SINTESIS DAN KARAKTERISASI KOMPOSIT
HIDROKSIAPATIT DARI TULANG SOTONG (Sepia sp.)-KITOSAN
UNTUK KANDIDAT APLIKASI BONE FILLER
SKRIPSI
ISTIFARAH
PROGRAM STUDI S1 TEKNOBIOMEDIK DEPARTEMEN FISIKA
FAKULTAS SAINS DAN TEKNOLOGI UNIVERSITAS AIRLANGGA
SINTESIS DAN KARAKTERISASI KOMPOSIT
HIDROKSIAPATIT DARI TULANG SOTONG (Sepia sp.)-KITOSAN
UNTUK KANDIDAT APLIKASI BONE FILLER
SKRIPSI
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Teknik Bidang Teknobiomedik Pada Fakultas Sains Dan Teknologi
Universitas Airlangga
Oleh : ISTIFARAH NIM.080810023
Tanggal Lulus : 6 Agustus 2012
Disetujui oleh :
Pembimbing I Pembimbing II
Ir. Aminatun, M.Si
LEMBAR PENGESAHAN SKRIPSI
Judul : Sintesis dan Karakterisasi Komposit Hidroksiapatit dari Tulang Sotong (Sepia Sp.) – Kitosan Untuk
Kandidat Aplikasi Bone Filler
Penyusun : Istifarah
NIM : 080810023
Pembimbing I : Ir. Aminatun, M.Si.
Pembimbing II : Dr. Prihartini Widiyanti, drg., M.Kes. Tanggal seminar : 6 Agustus 2012
PEDOMAN PENGGUNAAN SKRIPSI
Skripsi ini tidak dipublikasikan, namun tersedia di perpustakaan dalam
lingkungan Universitas Airlangga, diperkenankan untuk dipakai sebagai referensi
kepustakaan, tetapi pengutipan harus seijin penyusun dan harus menyebutkan
sumbernya sesuai dengan kebiasaan ilmiah.
Istifarah, 2012, Sintesis dan Karakterisasi Komposit Hidroksiapatit dari Tulang Sotong (Sepia Sp.)-Kitosan Untuk Kandidat Aplikasi Bone Filler, SKRIPSI, dibawah bimbingan Ir. Aminatun, M.Si dan Dr. Prihartini Widiyanti, drg, M.Kes. Program Studi Teknobiomedik, Departemen Fisika, Fakultas Sains dan Teknologi, Universitas Airlangga.
ABSTRAK
Penelitian ini bertujuan untuk mengetahui potensi hidroksiapatit (HA) dari tulang sotong (Sepia sp.) dan komposit HA-kitosan untuk aplikasi bone filler. Hidroksiapatit diperoleh dengan reaksi hidrotermal antara 1M aragonit (CaCO3)
dari lamellae tulang sotong dan 0,6M NH4H2PO4 dengan suhu 200oC dan variasi
durasi 12, 24 dan 36 jam. Kemudian dilakukan sintering dengan suhu 1000°C selama 1 jam. Sampel dengan kandungan HA tertinggi dijadikan matriks untuk mensintesis komposit, dengan kitosan sebagai serat/filler. Sintesis komposit HA-kitosan dilakukan dengan metode pencampuran sederhana dengan variasi HA-kitosan dari 20 hingga 35%. Uji XRD, kekuatan tekan, kekerasan dan MTT assay
dilakukan untuk menentukan sampel terbaik. Hasil penelitian menunjukkan bahwa diperoleh 100% CaCO3 dari tulang sotong dan berhasil diproses menjadi
100% HA amorf. Proses sintering mengakibatkan perubahan prosentase HA dengan derajat kristalinitas yang jauh lebih baik. Kandungan HA tertinggi diperoleh pada durasi hidrotermal 36 jam setelah disintering, yaitu 94%. Sampel terbaik diperoleh pada komposit dengan kitosan 20% yang mengindikasikan terjadinya penyatuan secara sempurna antara HA dan kitosan, dengan kekuatan tekan sebesar (5,241 ± 0,063) MPa dan kekerasan sebesar (8,800 ±0,200) VHN. Penambahan kitosan meningkatkan viabilitas sel dari 87,00% menjadi 97,11%. Komposit HA dari tulang sotong-kitosan berpotensi untuk aplikasi bone filler
pada tulang cancellous.
Istifarah, 2012, Synthesis and Characterization of Hydroxyapatite from Cuttlefish Bone (Sepia Sp.)-Chitosan Composite as Bone Filler Application
Candidate, Thesis, under guidance of Ir. Aminatun, M.Si and Dr. Prihartini Widiyanti, drg, M.Kes. Biomedical Engineering, Physics Department, Faculty of Science and Technology, Airlangga University.
ABSTRACT
This study aimed to find out the potential of hydroxyapatite (HA) that was synthesized from cuttlefish (Sepia sp.) bone as well as HA-chitosan composite for bone filler applications. Hydroxyapatite was obtained by hydrothermal reaction between 1M aragonite (CaCO3) from cuttlefish bone lamellae and 0.6 M
NH4H2PO4 at 200oC and variations in the duration of 12, 24 and 36 hours.
Followed by a sintering process with a temperature of 1000°C for 1 hour. Sample with the highest content of HA was used as the matrix to synthesize the composite with chitosan as the fiber/filler. Synthesis of HA-chitosan composite was conducted by a simple mixing method with variations of chitosan from 20 to 35%. XRD, compressive strength and hardness test as well as MTT assay were performed to determine the best sample of all. The results showed that 100% CaCO3 was obtained from cuttlefish bone and was successfully processed into 100% amorphous HA. Sintering process resulted in changes in the percentage of HA with much better degree of crystallinity. The highest HA content was obtained in the hydrothermal duration of 36 hours after sintering, of which was 94%. The best sample was obtained from the composite containing 20% chitosan which indicates perfect mixing between HA and chitosan, with a compressive strength of (5.241 ± 0.063) MPa and hardness of (8.800 ± 0.200) VHN. The addition of chitosan was found to increase the cell viability from 87.00% to 97.11%. HA-chitosan composite from cuttlefish bone has a potential for bone filler applications to cancellous bone.
KATA PENGANTAR
Puji syukur kehadirat Allah SWT atas segala limpahan rahmat, karunia,
dan hidayah-Nya, sehingga penulis dapat menyelesaikan penulisan skripsi yang
berjudul “Sintesis dan Karakterisasi Komposit Hidroksiapatit dari Tulang Sotong (Sepia Sp.)-Kitosan Untuk Kandidat Aplikasi Bone Filler”. Skripsi ini ditulis sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknik (S.T.)
bidang Teknobiomedik pada Fakultas Sains dan Teknologi, Universitas
Airlangga.
Pada kesempatan ini penulis mengucapkan terima kasih atas segala
bantuan yang diberikan oleh berbagai pihak sehingga penulisan skripsi ini dapat
terselesaikan dengan baik.
Penulis menyadari bahwa dalam penulisan skripsi ini masih jauh dari
sempurna. Oleh karena itu, kritik dan saran yang bersifat membangun sangat
penulis harapkan. Penulis berharap semoga skripsi ini dapat memberikan manfaat
bagi semua pihak yang membaca.
Surabaya, Agustus 2012 Penulis,
UCAPAN TERIMA KASIH
Alhamdulillah, puji syukur kehadirat Allah SWT atas segala limpahan
rahmat, karunia, dan hidayah-Nya, sehingga penulis dapat menyelesaikan
penulisan skripsi ini dengan baik.
Penulis menyadari bahwa dalam penyusunan skripsi ini tak lepas dari
bantuan dan dukungan dari banyak pihak. Penulis menyampaikan terimakasih
kepada :
1. Kedua orang tua tercinta, Papa Moh. Munir dan Mama Yuniawati Candra;
adik-adik tercinta, Sayyidul Kurniadi, Azizah, Syafira Maulina, dan Chairin
Nashir; seluruh keluarga besarku; serta Ardian Mas Suhendra yang selalu
mendoakan, memberi kasih sayang, motivasi, semangat dan perhatian setiap
saat.
2. Ibu Ir. Aminatun, M.Si. dan Ibu Dr. Prihartini Widiyanti, drg., M.Kes. selaku
dosen pembimbing I dan II yang senantiasa mencurahkan segenap ilmu,
waktu, dan tenaga untuk memberikan bimbingan, arahan, masukan yang
sangat berharga.
3. Bapak Drs. Siswanto, M.Si., dan Ibu Ir. Puspa Erawati selaku dosen penguji I
dan II atas segala saran dan masukan untuk perbaikan penulisan skripsi ini.
4. Ibu Retna Apsari, M.Si. selaku Ketua Program Studi S1 Teknobiomedik,
Bapak Adri Supardi, M.Sc. selaku dosen wali, serta dosen-dosen Program
Studi S1 Teknobiomedik yang telah memberikan dukungan dan semangat
5. Teman-teman Teknobiomedik 2008, khususnya biomaterial lovers, Windi Aprilyanti Putri, Aditya Iman Rizky, Miranda Zawazi Ichsan, Ary Andini,
Agnes Krisanti Widyaning, Gilang Daril Umami, Arindha Reni Pramesti,
Perwitasari Fitrah Lazzari Ramadhan, Nurul Istiqomah, Tri Wahyuni Bintarti,
Wida Dinar Tri Meylani yang selalu memberikan dukungan dan semangat
selama perkuliahan.
2.7 Analisis Sifat Mekanik ……….. 22
2.7.1 Kekuatan Tekan (Compressive Strength) ……… 22
2.7.2 Kekerasan (Vickers Hardness) ……… 23
3.3.3 Sintesis Hidroksiapatit dengan Metode Hidrotermal …….. 30
3.3.4 Sintesis Komposit HA-Kitosan ………..………. 31
3.4 Karakterisasi Sampel ……….. 33
3.4.1 Uji XRD ……….. 33
3.4.2 Uji Sifat Mekanik ……… 33
3.4.2.1 Uji Kekuatan Tekan (Compressive Strength) …….. 33
3.4.2.2 Uji Kekerasan (Vickers Hardness) ………..… 34
3.4.3 Uji Viabilitas Sel ………. 34
3.5Analisis Data ………. . 35
BAB IV HASIL DAN PEMBAHASAN ……….. 36
4.1 Uji X-Ray Diffraction (XRD) ……… . 36
4.1.1 Kandungan CaCO3 pada Tulang Sotong ……… 36
4.1.2 Hidroksiapatit dari Proses Hidrotermal ………..…… 37
4.1.3 Hidroksiapatit Setelah Disintering ………..…… 39
4.1.4 Komposit HA-Kitosan ……… 43
4.2 Uji Sifat Mekanik Komposit HA-Kitosan ……….. 44
4.2.2 Uji Kekerasan (Hardness) ……… 47
4.3 Uji MTT Assay……… 48
BAB V KESIMPULAN DAN SARAN ……….. 53
DAFTAR PUSTAKA ……….. 55
DAFTAR TABEL
No. Judul Tabel Halaman
2.1 Karakteristik Biomekanik Tulang Sehat (Ficai et al., 2011)...10
2.2 Kandungan Tulang Sotong ….….….….….….….….….….….... 12
2.3 Sifat Mekanik Polikristal Hidroksiapatit (Park et al., 2007) .….. 13
3.1 Variasi Komposisi Komposit ….….…….….…….….….….…... 32
4.1 Kandungan Sampel Setelah Disintering ….….…….….…….…. 42
4.2 Hasil Uji Sifat Mekanik ….….…….….…….….….….…….….. 45
DAFTAR GAMBAR
No. Judul Gambar Halaman
2.1 Tulang kortikal dan trabekular….….….….….….….….….…. 9
2.2 Sotong (cuttlefish) ….….….….….….….….….….….….….…. 11
2.3 Tulang sotong ….….….….….….….….….….….….….….…... 11
2.4 Struktur kitosan (Zilberman, 2011) ….….….….….….….….… 17
2.5 Spektrum XRD kitosan (Dewi, 2009) …...….….….….….….... 17
2.6 Difraksi sinar-X ….….….….….….….….….….….….….….… 21
2.7 Skema uji compressive strength ….….….….….….….….…... 23
2.8 Skema uji vickers hardness ….….….….….….….….….….….. 24
3.1 Skema pelaksanaan penelitian ….….….….….….….….….…... 29
4.1 Spektrum XRD bubuk lamellae tulang sotong (Sepia sp.) ….… 37
4.10 Spektrum XRD komposit (Sampel F1) .…….…….…….……... 43
4.11 Grafik kekuatan tekan sampel ….…….…….…….…….……... 45
4.12 Grafik kekerasan sampel ….…….…….…….……….…….…... 47
4.13 Grafik viabilitas sel ….…….…….…….……….…….…….….. 49
DAFTAR LAMPIRAN
No. Judul Lampiran Halaman
1 Hasil Uji XRD Kandungan Tulang Sotong (Sepia sp.) 2 Hasil Uji XRD Hidroksiapatit dari Proses Hidrotermal
3 Hasil Uji XRD Hidroksiapatit Setelah Disintering
4 Hasil Uji XRD Komposit F1
5 Kekuatan Tekan (Compressive Strength) 6 Kekerasan (Hardness)
Ku persembahkan
Tinta dan kertas ini untuk Papa dan Mama tercinta
Yang darahnya mengalir dalam tubuh ini
Untuk bisikan do’a dalam setiap sujudmu
Untuk hadirmu dalam setiap bangkit dan jatuhku
Tugas kita bukanlah untuk berhasil Tugas kita adalah untuk mencoba
Karena di dalam mencoba itulah kita menemukan dan belajar membangun kesempatan untuk berhasil
BAB I PENDAHULUAN
1.1 Latar Belakang
Terganggunya kesehatan dan fungsi organ dapat mengakibatkan
penurunan kualitas hidup manusia. Penanganan kerusakan fungsi pada beberapa
organ dilakukan dengan implantasi biomaterial. Biomaterial yang paling banyak
digunakan adalah untuk keperluan substitusi tulang, yaitu sebesar 46% dari total
keseluruhan aplikasi di bidang medis (Dewi, 2009). Berdasarkan data di Asia,
Indonesia adalah negara dengan jumlah penderita patah tulang tertinggi.
Diantaranya, ada sebanyak 300 – 400 kasus operasi bedah tulang per bulan di RS.
Dr. Soetomo Surabaya (Gunawarman dkk, 2010). Setiap tahun kebutuhan
substitusi tulang terus bertambah. Hal tersebut disebabkan meningkatnya
kecelakaan yang mengakibatkan patah tulang, penyakit bawaan dan non-bawaan
(Ficai et al., 2011).
Kerusakan tulang merupakan masalah kesehatan yang serius karena tulang
merupakan penyokong fungsi tubuh. Dengan demikian, penggunaan material yang
tepat untuk penanganan kerusakan tulang merupakan faktor keberhasilkan
implantasi tulang. Material substitusi tulang yang ideal harus non-toksik,
biokompatibel dengan semua jaringan di sekitarnya, osteokonduktif,
mempertahankan sifat mekanik (Yildirim, 2004).
(penggantian tulang manusia dengan tulang yang berasal dari manusia lain),
xenograft (penggantian tulang manusia dengan tulang yang berasal dari hewan). Setiap material tersebut memiliki kekurangan dan kelebihan sebagai material
untuk memperbaiki tulang. Kelemahan autograft adalah sering menyebabkan komplikasi dalam penyembuhan luka, operasi tambahan, nyeri pada donor dan
pasokan tulang tidak memadai untuk mengisi gap. Sedangkan allograft dan
xenograft terkait dengan reaksi infeksi, inflamasi, dan penolakan. Teknik allograft
yang menggunakan tulang mayat, memiliki masalah dalam reaksi imunogenik dan
resiko penyakit menular (AIDS dan hepatitis). Xenograft juga membawa resiko penyakit menular antar spesies (Wahl dan Czernuszka, 2006 dan Venkatesan et al., 2010). Keterbatasan tersebut memicu perkembangan riset di bidang biomaterial, yaitu dengan melakukan berbagai modifikasi pembuatan biomaterial
sintetik. Dengan biomaterial sintetik diharapkan karakter bahan diketahui secara
pasti dan terkontrol.
Hidroksiapatit (HA) telah dipelajari selama bertahun-tahun dan digunakan
secara luas untuk pembuatan implan karena kesamaannya dengan fase mineral
tulang dan terbukti biokompatibel dengan tulang dan gigi manusia (Ivankovic,
2010 dan Earl, 2006). Hidroksiapatit dengan rumus kimia Ca10(PO4)6(OH)2 adalah
komponen anorganik utama dari jaringan keras tulang dan menyumbang 60-70%
dari fase mineral dalam tulang manusia. Hidroksiapatit mampu menjalani ikatan
osteogenesis dan relatif tidak larut in vivo. Banyak penelitian telah menunjukkan bahwa HA tidak menunjukkan toksisitas, respon peradangan, respon pirogenetik
dan tulang sangat baik, dan memiliki kemampuan menjalin ikatan langsung
dengan tulang host. Hidroksiapatit menunjukkan sifat bioaktif dan osteokonduktif yang sangat bermanfaat dalam proses mineralisasi tulang.
Hidroksiapatit yang disintesis dari bahan alam memiliki
osteokonduktivitas yang lebih baik dibandingkan dengan dari bahan sintetik
(Saraswathy, dalam Dewi, 2008). Bahan alam yang dapat digunakan untuk
sintesis HA adalah tulang sotong. Tulang sotong (Sepia sp.) merupakan residu budidaya perikanan yang biasanya dimanfaatkan sebagai pakan burung dan
kura-kura sebagai asupan kalsium. Dengan harganya yang terjangkau, 85% kalsium
karbonat (CaCO3) yang terkandung dalam tulang sotong dapat dimanfaatkan
sebagai sumber kalsium dalam sintesis HA yang ekonomis dan dapat dijangkau
oleh masyarakat luas.
Scaffolds HA dari tulang sotong pertama kali disintesis pada tahun 2005 oleh Rocha et al. dengan metode hidrotermal pada suhu 200ºC. Hasil uji scaffolds
tersebut menunjukkan stabilitas termal yang tinggi. Selain itu, hasil uji in vitro
bioaktivitas pada SBF dan biokompatibilitas dengan osteoblas, menunjukkan
scaffolds HA dari tulang sotong cocok untuk aplikasi implan atau rekayasa jaringan.
Dalam pengaplikasiannya, biokeramik seperti HA dan trikalsium fosfat
(TKF) bersifat rapuh. Oleh karena itu, kalsium fosfat digunakan pada area dengan
tensile stress yang relatif rendah, seperti pengisi tulang dan gigi, atau pelapis pada perangkat implan (Wahl dan Czernuszka, 2006). Padahal, tulang yang sering
menopang berat tubuh ketika seseorang berdiri. Dengan demikian, kekuatan
mekanik juga turut memegang peran penting. Untuk menyempurnakan sifat
mekanik HA dapat dilakukan modifikasi dengan menambahkan polimer sebagai
serat/filler.
Kitosan adalah salah satu polimer alami yang berpotensi untuk digunakan
sebagai serat/filler dalam pembuatan komposit. Kitosan memiliki karakter bioresorbabel, biokompatibel, non-toksik, non-antigenik, biofungsional dan
osteokonduktif. Karakter osteokonduktif yang dimiliki kitosan dapat mempercepat
pertumbuhan osteoblas pada komposit HA-kitosan sehingga dapat mempercepat
pembentukan mineral tulang.
Pramanik et al. (2009) mensintesis nano-komposit HA-kitosan dengan cara pelarutan sederhana berdasarkan metode kimia. Variasi HA yang dilakukan
dari 10% hingga 60%. Hasil penelitian menunjukkan sifat mekanik komposit
meningkat secara signifikan seiring dengan pertambahan jumlah HA.
Nano-komposit yang dihasilkan juga bersifat sitokompatibel, osteokompatibel, dan
osteogenik, sehingga dapat digunakan untuk aplikasi bone tissue engineering. Namun, sekitar 70% penyusun tulang manusia merupakan senyawa kalsium
fosfat, sehingga pada penelitian ini akan dilakukan sintesis komposit HA dari
tulang sotong (Sepia sp.)-kitosan dengan variasi HA : kitosan = (80 : 20), (75 : 25), (70 : 30), (65 : 35). Komposit diharapkan memiliki sifat mekanik yang baik
untuk tujuan aplikasi bone filler. Selain itu, diharapkan penambahan kitosan dapat meningkatkan osteokonduktifitas HA, sehingga dapat mempercepat pembentukan
1.2 Rumusan Masalah
1. Bagaimana sifat mikro HA yang disintesis dari tulang sotong dan komposit
HA-kitosan?
2. Pada komposisi komposit berapakah diperoleh sifat mekanik terbaik untuk
tujuan aplikasi bone filler?
3. Bagaimana pengaruh penambahan kitosan terhadap viabilitas sel?
1.3 Batasan Masalah
Dalam penelitian ini, HA disintesis dari tulang sotong dengan metode
hidrotermal pada suhu 200ºC selama 12, 24, dan 36 jam. HA yang dihasilkan,
kemudian digunakan untuk sintesis komposit HA-kitosan dengan variasi HA :
kitosan = (80 : 20), (75 : 25), (70 : 30), (65 : 35). Sifat mikro HA dan komposit
HA-kitosan dapat diketahui dengan melakukan karakterisasi XRD. Untuk
mengetahui komposisi komposit terbaik, dilakukan uji kekuatan tekan dan
kekerasan. Sedangkan untuk mengetahui pengaruh penambahan kitosan terhadap
viabilitas sel dilakukan uji MTT assay.
1.4 Tujuan Penelitian
1. Mengetahui sifat mikro HA yang disintesis dari tulang sotong dan komposit
HA-kitosan dari hasil uji XRD.
2. Mengetahui komposisi komposit HA-kitosan dengan sifat mekanik terbaik
untuk aplikasi bone filler.
1.5 Manfaat Penelitian
1. Memberikan dasar teori tentang sifat mikro, mekanik dan biologis dari
komposit HA-kitosan.
BAB II
TINJAUAN PUSTAKA
2.1 Tulang
Tulang merupakan jaringan kuat pembentuk kerangka tubuh manusia.
Tulang memiliki empat fungsi utama yaitu fungsi mekanik, protektif, metabolik
dan hemopetik. Fungsi mekanik yaitu sebagai penyokong tubuh dan tempat
melekatnya jaringan otot untuk pergerakan. Fungsi protektif yaitu sebagai
pelindung berbagai alat vital dalam tubuh dan sumsum tulang. Fungsi metabolik
yaitu sebagai cadangan dan tempat metabolisme berbagai mineral yang penting
seperti kalsium dan fosfat. Fungsi hematopoietik yaitu sebagai tempat berlangsungnya proses pembentukan dan perkembangan sel darah (Leeson et al., dalam Dewi, 2009). Dengan demikian, penggunaan material yang tepat
merupakan faktor keberhasilan implantasi tulang.
2.1.1 Komposisi Tulang
Tulang manusia tersusun dari komponen organik dan inorganik.
Komponen organik pada tulang sekitar 30% yang sebagian besarnya adalah
kolagen (protein). Bahan organik lain seperti polisakarida dan lemak terdapat
dalam jumlah yang kecil. Komponen anorganik yaitu mineral tulang yang
sebagian besar terdiri dari senyawa kalsium fosfat sekitar 70% (Prabakan, dalam
Zulti 2008). Kalsium fosfat yang utama dikenal sebagai hidroksiapatit (HA)
karbon ditemukan di antara mineral tulang. Karbonat juga terdapat pada tulang.
Kombinasi yang demikian memberikan fungsi mekanik yang dibutuhkan oleh
tulang untuk penyangga tubuh dan pendukung gerakan, karena HA yang tumbuh
berada di dekat setiap segmen serat kolagen yang terikat kuat untuk menjaga
kekuatan tulang (Guyton et al., dalam Prasetyanti, 2008).
2.1.2 Sel Tulang
Sel dalam tulang yang terutama berhubungan dengan pembentukan dan
resorpsi tulang :
1. Osteoblas adalah sel yang menyintesis unsur organik tulang. Sel ini
bertanggung jawab untuk pembentukan tulang-tulang baru selama
pertumbuhan, perbaikan dan membentuk kembali tulang.
2. Osteosit adalah sel matang yang mengisi lakuna dalam matriks.
3. Osteoklas adalah sel yang bertanggung jawab untuk menghancurkan dan
membentuk kembali tulang.
2.1.3 Sifat Fisis dan Mekanik Tulang
Porositas dan kerapatan tulang bervariasi bergantung pada lokasi dalam
tubuh dan pembebanan di daerah tersebut. Kerapatan menentukan kekuatan dan
kekakuan tulang yang tumbuh berkembang untuk menahan beban yang ada
(Smallman, dalam Rismawati, 2008).
Berdasarkan porositasnya, tulang dapat diklasifikasikan menjadi tulang
tersebut memiliki komposisi yang sama. Jumlah tulang kortikal dan tulang
cancellous relatif bervariasi bergantung pada jenis tulang dan bagian yang berbeda dari tulang yang sama.
1. Tulang kortikal (kompak) adalah jaringan yang tersusun rapat dan terutama
ditemukan sebagai lapisan di atas jaringan tulang cancellous. Tulang kortikal terletak di bagian eksternal tulang panjang. Porositasnya bergantung pada
saluran mikroskopik (kanalikuli) yang mengandung pembuluh darah, yang
berhubungan dengan saluran havers.
2. Tulang cancellous disebut juga tulang bersepon, atau tulang trabekular. Struktur tulang cancellous menyerupai kisi yang terdiri dari batang tulang tipis atau trabekular yang menutupi ruang sumsum. Tulang cancellous
terletak di bagian internal tulang kortikal.
Pada dasarnya, keseluruhan tulang dan sebagian besar tubuh terdiri dari
bagian eksternal tulang kortikal sebesar 80% dari total kerangka dan bagian
internal tulang cancellous yang seperti spons, sebesar 20% dari total kerangka (Kofron, dalam Zilberman, 2011).
Gambar 2.1 Tulang kortikal dan trabekular
Tulang kortikal memiliki porositas ≤ 30%. Sebagai contoh, porositas
tulang kortikal pada femur orang dewasa dapat bervariasi, yaitu sekitar 5% untuk
usia 20 tahun ke atas, dan 30% pada usia 80 tahun. Sedangkan porositas tulang
cancellous dapat bervariasi dari 70% pada femoral neck dan sekitar 95% pada tulang belakang (Keaveny et al., 2004).
Umumnya, densitas rata-rata tulang kortikal sekitar 1,85 g/cm3, dan tidak
jauh berbeda di berbagai lokasi anatomi dan spesies. Sebaliknya, densitas rata-rata
tulang cancellous sangat bergantung pada lokasi anatomi. Sekitar 0,10 g/cm3
untuk tulang belakang, sekitar 0,30 g/cm3 untuk tibia, dan sekitar 0,60 g/cm3
untuk bagian yang menahan beban dari femur proksimal. Setelah kematangan
kerangka (sekitar usia 25 sampai 30 tahun), densitas tulang cancellous menurun mengikuti penuaan dengan tingkat sekitar 6% per dekade (Keaveny et al., 2004). Sedangkan tensile strength tulang kortikal sebesar 45-175 MPa, dan tulang
cancellous sebesar 7,4 MPa (Oktay, dalam Rismawati, 2008).
Kekerasan (vickers hardness) rata-rata tulang kortikal adalah 0,396 GPa atau 40,4kgf/mm2, sedangkan tulang cancellous adalah 0,345 GPa atau 35,2
kgf/mm2 (Pramanik et al., 2005).
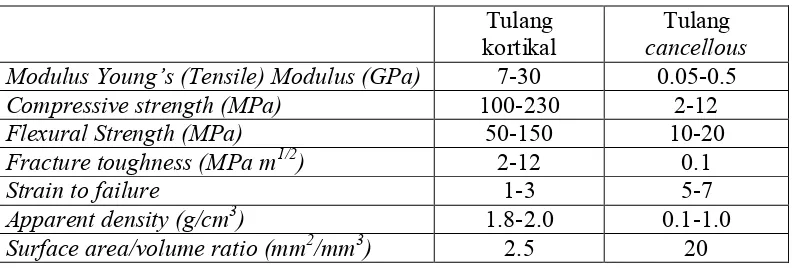
Tabel 2.1 Karakteristik Biomekanik Tulang Sehat (Ficai et al., 2011) Tulang
kortikal cancellousTulang Modulus Young’s (Tensile) Modulus (GPa) 7-30 0.05-0.5
2.2 Kandungan Tulang Sotong
Sotong atau cuttlefish adalah binatang yang hidup di perairan dangkal, kurang dari 200 meter. Berikut klasifikasi ilmiah sotong menurut Linnaeus, 1758
(http://data.gbif.org/species/browse/taxon/109543829/).
Kingdom : Animalia
Phylum : Mollusca
Class : Cephalopoda Subclass : Coleoidea Order : Sepiida Family : Sepiidae Genus : Sepia Species : Sepia sp.
Gambar 2.2 Sotong (cuttlefish)
Gambar 2.3 Tulang sotong
Komponen utama dari tulang sotong adalah kalsium karbonat (CaCO3)
kemungkinan besar adalah karbohidrat. Isi nitrogen dari 8.300 mg/kg
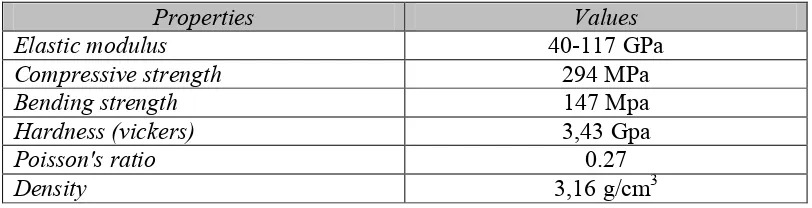
Hidroksiapatit (HA) adalah komponen anorganik utama dari jaringan keras
tulang dan menyumbang 60-70% dari fase mineral dalam tulang manusia. Rumus
kimia HA adalah Ca10(PO4)6(OH)2 yang memiliki rasio Ca : P adalah 1,67.
Struktur HA adalah heksagonal. Dimensi parameter kisi HA pada tulang adalah
nilai a = b = 9,419 Å dan c = 6,880 Å dan sudut α = β = 90o dan γ =120o (Shi,
Tabel 2.3. Sifat Mekanik Polikristal Hidroksiapatit (Park et al., 2007)
Hidroksiapatit telah dipelajari selama bertahun-tahun dan digunakan
secara luas untuk pembuatan implan karena kesamaannya dengan fase mineral
tulang dan terbukti bersifat biokompatibel dengan tulang dan gigi manusia
(Ivankovic et al., 2010 dan Earl et al., 2006). Hidroksiapatit mampu menjalani ikatan osteogenesis dan relatif tidak larut in vivo. Banyak penelitian telah menunjukkan bahwa HA tidak menunjukkan toksisitas, respon peradangan,
respon pirogenetik. Selain itu, pembentukan jaringan fibrosa antara implan dan
tulang sangat baik, memiliki kemampuan menjalin ikatan langsung dengan tulang
host, serta bioaktif dan osteokonduktif (Hui et al., 2010). Sifat bioaktif dan osteokonduktif dapat merangsang sel tulang di sekitar material implan untuk
berinfiltrasi sehingga dapat mempercepat proses mineralisasi tulang baru (Hin,
dalam Dewi, 2009).
Sintesis HA telah banyak dilakukan oleh para peneliti. Berbagai metode
dan prekursor sudah ditemukan untuk menghasilkan HA. Metode yang dapat
dilakukan yaitu metode hidrotermal, metode basah melalui presipitasi, dan metode
kering dengan perlakuan temperatur tinggi.
Earl et al. (2006) melakukan sintesis HA dari Ca(NO3)2.4H2O dan
memberikan perlakuan panas dan tekanan pada proses sintesis HA. Temperatur
yang digunakan yaitu 200°C dengan variasi waktu pada 24, 48, dan 72 jam. Hasil
eksperimen dianalisis dengan XRD. Spektrum XRD menunjukkan pada waktu
perlakuan 48 dan 72 jam terbentuk fase HA namun terdapat monetit (CaHPO4).
Fase tunggal HA terbentuk pada waktu perlakuan 24 jam.
Sumber prekursor untuk menghasilkan HA juga dapat diperoleh dari
bahan alam. Bahan alam yang mulai dikembangkan yaitu koral, kerang, cangkang
telur dan tulang sotong. Penggunaan bahan tersebut sebagai sumber kalsium.
Sebagian besar kandungan yang terdapat pada bahan tersebut adalah kalsium
karbonat (CaCO3). Penelitian in vivo menunjukkan HA dari bahan alam memiliki
osteokonduktif yang lebih baik dibandingkan dengan dari bahan sintetik
(Saraswathy, dalam Dewi, 2008).
Scaffolds HA dari tulang sotong pertama kali disintesis pada tahun 2005 oleh Rocha et al. CaCO3 dari tulang sotong (Sepia officinalis) dan (NH4)2HPO4
direaksikan dengan metode hidrotermal menggunakan autoklaf (teflon lined stainless steel) yang kemudian dimasukkan ke dalam furnace elektrik. Temperatur hidrotermal sebesar 200ºC (tingkat pemanasan dan pendinginan 5°C/menit)
dengan variasi waktu 1-24 jam. Hasil uji XRD menunjukkan scaffolds HA terbaik diperoleh pada waktu 24 jam, sedangkan pada waktu perlakuan 9 jam masih
ditemukan CaCO3. Scaffolds HA yang dihasilkan juga menunjukkan stabilitas
termal yang tinggi pada sintering hingga 1350°C. Selain itu, hasil uji in vitro
scaffolds HA dari tulang sotong cocok untuk aplikasi implan atau rekayasa jaringan.
Paljar et al. (2009) memisahkan terlebih dahulu bagian dorsal dan
lamellae tulang sotong (Sepia officinalis), kemudian diberi perlakuan panas pada 350°C selama 3 jam. Hasil karakterisasi XRD menunjukkan setelah perlakuan
panas, sebagian kandungan aragonit pada bagian dorsal berubah menjadi kalsit, sehingga untuk mensintesis HA digunakan tulang sotong bagian lamellae dan NH4H2PO4. Aragonit berubah cepat dan bertransformasi menjadi HA dengan
metode hidrotermal pada 200°C selama 24 jam.
Elisa et al. (2010) melakukan sintesis HA dari tulang sotong (Sepia officinalis) dengan transformasi hidrotermal pada 200oC dengan tekanan sekitar
15 atm selama 4 jam. Uji proliferasi sel dan diferensiasi osteogenic dengan sel osteoblas MC3T3-E1 menunjukkan kinerja yang baik.
Ivankovic et al. (2010) mensintesis HA dari tulang sotong (Sepia officinalis) dan NH4H2PO4 dengan transformasi hidrotermal dengan variasi suhu
antara 140–220oC dan variasi waktu antara 20 menit-48 jam dengan menggunakan
bejana tekan dan tertutup (teflon lined stainless steel) pada furnace elektrik. Spektrum difraksi sinar-X sampel setelah pelakuan hidrotermal 140°C, 160°C,
dan 180°C selama 20 menit menunjukkan bahwa terbentuk HA dengan
kekristalan yang buruk dan brushite (CaHPO4.2H2O). Sedangkan pada sampel
yang diberi perlakuan 200ºC brushite tidak terdeteksi. Selain itu, peneliti mengungkapkan bahwa pada sampel yang diberi perlakuan hidrotermal pada
(CaCO3), sedangkan sampel pada 200°C selama 24 jam keseluruhan aragonit
berubah menjadi HA. Di sisi lain, sampel dengan 220°C selama 24 jam
mengandung 97,9% berat HA dan 2,1% berat aragonit, sedangkan perlakuan
selama 48 jam, jumlah HA menurun karena terbentuk monetite (CaHPO4)
sebanyak 3,2% berat.
Dalam pengaplikasiannya, biokeramik seperti HA dan trikalsium fosfat
(TKF) bersifat rapuh. Oleh karena itu, kalsium fosfat digunakan pada area dengan
tensile stress yang relatif rendah, seperti pengisi tulang dan gigi, atau pelapis pada perangkat implan (Wahl dan Czernuszka, 2006). Padahal, tulang yang sering
mengalami patah di antaranya adalah tibia dan fibula (Ficai et al., 2011) yang menopang berat tubuh ketika seseorang berdiri. Dengan demikian, kekuatan
mekanik juga turut memegang peran penting. Untuk menyempurnakan sifat
mekanik HA dapat dilakukan modifikasi dengan menambahkan polimer sebagai
serat/filler.
2.4 Kitosan
Kitosan (C6H11NO4)n merupakan polimer alami yang berpotensi
digunakan sebagai serat/filler dalam pembuatan komposit. Kitosan banyak terdapat di alam dan dapat diperoleh dari eliminasi asetil kitin. Kitosan dapat
diekstrak dari kepiting atau udang.
Kitosan merupakan aminopolysaccharide dengan struktur mirip dengan selulosa (Kalinnikov, dalam Barinov, 2010). Kitosan memiliki karakter
dalam air, alkali dan pelarut organik, tetapi larut dalam larutan asam organik dan
dapat terdegradasi oleh enzim dalam tubuh (Dewi, 2008). Selain itu, kitosan
memiliki karakter biokompatibel, biodegradabel, dan osteokonduktif (Liu et al., 2006). Karakter osteokonduktif yang dimiliki kitosan dapat mempercepat
pertumbuhan osteoblas sehingga dapat mempercepat pembentukan mineral tulang.
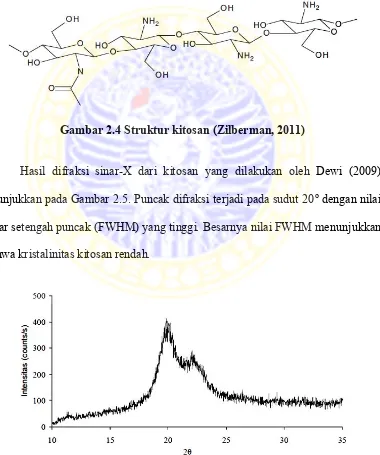
Gambar 2.4 Struktur kitosan (Zilberman, 2011)
Hasil difraksi sinar-X dari kitosan yang dilakukan oleh Dewi (2009)
ditunjukkan pada Gambar 2.5. Puncak difraksi terjadi pada sudut 20o dengan nilai
lebar setengah puncak (FWHM) yang tinggi. Besarnya nilai FWHM menunjukkan
bahwa kristalinitas kitosan rendah.
Khan et al. (2000) membuat film kitosan dengan melarutkan kitosan (1,4%b/v) dalam larutan asam asetat (2%b/v). Derajat deasetilasi kitosan yang
digunakan yaitu (84,05±0,17)%. Hasil uji sifat mekanik sampel menunjukkan
tensile strength sebesar (67,11±1,27) N/mm2 dan elongasi sebesar (21,35±2,12)%.
2.5 Komposit Hidroksiapatit-Kitosan
Modifikasi untuk menyempurnakan sifat mekanik HA dapat dilakukan
dengan menambahkan kitosan untuk membentuk komposit. Penambahan kitosan
sebagai filler diharapkan dapat mengurangi sifat rapuh dari senyawa apatit sehingga menghasilkan komposit yang ulet, tahan terhadap tekanan,
biodegradabel, serta mempercepat pertumbuhan osteoblas dan pembentukan
mineral tulang.
Li et al. (2005) mensintesis komposit kitosan-nanoHA (n-HA) dengan metode co-presipitasi menggunakan Ca(OH)2, H3PO4 dan kitosan. Variasi
perbandingan berat kitosan yang dilakukan yaitu antara 20-80%. Hasil penelitian
menunjukkan bahwa HA yang disintesis adalah kristal berkarbonat, berskala
nanometer dengan kristalinitas yang rendah dan tersebar merata dalam fase
kitosan dan tanpa ada pemisahan. Nilai kekuatan tekan maksimum yang diperoleh
dari sampel komposit dengan perbandingan berat kitosan : n-HA = 30 : 70, yaitu
sekitar 120 MPa, jauh berbeda dengan HA murni yaitu 6,5 MPa. Sampel tersebut
menunjukkan biodegradabilitas dan bioaktivitas yang tinggi ketika direndam
Lestari (2009) mensintesis komposit apatit-kitosan dengan metode in-situ
dan ex-situ. Perbedaan kedua metode ini terletak pada proses penambahan kitosan saat presipitasi sampel berlangsung. Pada metode in-situ proses pembentukan mineral apatit dilakukan dalam matriks kitosan. Sedangkan metode ex-situ, penambahan larutan kitosan dilakukan setelah proses presipitasi selesai dilakukan.
Hasil karakterisasi XRD pada sampel in-situ dan ex-situ memperlihatkan puncak HA, Apatit Karbonat tipe A (AKA), Apatit Karbonat tipe B (AKB), Okta Kalsium
Fosfat (OKF) dan kitosan. Hal tersebut menandakan bahwa komposit
apatit-kitosan berhasil terbentuk. Hasil XRD juga menunjukkan penurunan derajat
kristanilitas pada sampel komposit apatit-kitosan dibandingkan dengan sampel
apatit yang dikarenakan kitosan bersifat lebih amorf dibandingkan apatit. Namun,
derajat kristanilitas sampel ex-situ lebih besar dibandingkan in-situ. Hal tersebut dikarenakan proses pembentukan apatit tidak dihalangi oleh kitosan.
Pramanik et al. (2009) mensintesis nano-komposit HA-kitosan fosfat dengan cara pelarutan sederhana berdasarkan metode kimia. Variasi HA yang
dilakukan dari 10% hingga 60%. Hasil penelitian menunjukkan sifat mekanik
komposit meningkat secara signifikan seiring dengan pertambahan jumlah HA.
Uji sitotoksisitas dengan sel fibroblast mencit L929 menegaskan bahwa
nanokomposit bersifat sitokompatibel. Penelitian dengan kultur sel osteoblas
primer mencit membuktikan nanokomposit bersifat osteokompatibel dan
osteogenik. Penggunaan kitosan fosfat meningkatkan homogenitas distribusi
Dewi (2009) mensintesis komposit kalsium fosfat-kitosan dengan
menggunakan metode sonikasi. Pembuatan komposit dilakukan variasi
perbandingan kalsium fosfat (HA dan campuran HA-Apatit Karbonat(AK))
dengan kitosan yaitu (80 : 20)% dan (70 : 30)%. Kalsium fosfat yang digunakan
juga dilakukan variasi perbandingan HA dan campuran HA-AK yaitu (80 : 20)%
dan (70 : 30)%. Hasil pengujian menunjukkan bahwa penggunaan kitosan 30%
mengindikasikan adanya kitosan yang tidak berinteraksi dengan kristal apatit,
sehingga komposit yang optimal diperoleh dengan komposisi HA (64%),
campuran HA-AK (16%) dan kitosan (20%).
Ketika komposit HA-kitosan digunakan sebagai scaffold dan diimplankan ke tubuh, maka kitosan akan terdegradasi membentuk pori dan memberi ruang
untuk pertumbuhan tulang baru dan kemudian digantikan dengan tulang baru.
Selain itu, kitosan juga bersifat hidrofilik, sehingga dapat memfasilitasi adesi,
proliferasi dan diferensiasi sel. Dengan demikian, penggunaan komposit
HA-kitosan untuk substitusi tulang dapat mengaktifkan regenerasi dan remodelling
tulang (Li et al., 2005).
2.6 X-Ray Diffraction (XRD)
Metode XRD berdasarkan sifat difraksi sinar-X, yaitu hamburan cahaya
dengan panjang gelombang λ saat melewati kisi kristal dengan sudut datang θ dan
jarak antar bidang kristal sebesar d (Gambar 2.6). Data yang diperoleh dari metode karakterisasi XRD adalah sudut hamburan (sudut Bragg) dan intensitas.
sehingga mempengaruhi spektrum difraksi, sedangkan intensitas cahaya difraksi
bergantung dari berapa banyak kisi kristal yang memiliki orientasi yang sama.
Metode XRD dapat digunakan untuk menentukan sistem kristal, parameter kisi,
derajat kristalinitas dan fase yang terdapat dalam suatu sampel.
Puncak spektrum difraksi sinar-X berhubungan dengan jarak antar bidang.
Terlihat pada Gambar 2.6 jalannya sinar-X yang melalui kisi kristal. Syarat
terjadinya difraksi harus memenuhi hukum Bragg yang ditunjukkan pada
Persamaan (2.1).
2𝑑𝑠𝑖𝑛𝜃= 𝑛𝜆 (2.1)
dengan d, θ, dan λ berturut-turut adalah jarak antar bidang kristal, panjang gelombang dan sudut datang cahaya. Jika atom tersusun periodik dalam kristal,
gelombang terdifraksi akan terdiri dari interferensi maksimum tajam (peak).
Gambar 2.6 Difraksi sinar-X
XRD dapat memberi informasi secara umum baik secara kuantitatif
maupun secara kualitatif tentang komposisi fasa (misal dalam campuran). Hal
intensitas puncak, dan distribusi intensitas sebagai fungsi dari sudut difraksi. Tiga
informasi tersebut dapat digunakan untuk mengidentifikasi fasa yang terdapat
dalam suatu bahan. Setiap bahan memiliki spektrum difraksi yang khas seperti
sidik jari manusia. Spektrum difraksi sinar-X berbagai bahan telah dikumpulkan
dalam data ICDD (International Centre of Diffraction Data). Salah satu analisis komposisi fasa dalam suatu bahan adalah dengan membandingkan spektrum XRD
terukur dengan data tersebut.
Untuk menentukan prosentase komposisi senyawa dalam suatu sampel
digunakan persamaan sebagai berikut.
% 𝑆𝑒𝑛𝑦𝑎𝑤𝑎 = 𝛴𝐼 (𝑆𝑒𝑛𝑦𝑎𝑤𝑎 )
𝐼 (𝐾𝑒𝑠𝑒𝑙𝑢𝑟𝑢 ℎ𝑎𝑛) × 100% (2.2)
dengan ΣI (Senyawa) adalah jumlah intensitas yang puncak difraksinya sesuai
dengan data ICDD senyawa tertentu dan I (Keseluruhan) adalah jumlah intensitas
dari semua puncak difraksi suatu sampel.
2.7 Analisis Sifat Mekanik
Beberapa parameter material yang dibutuhkan agar dapat digunakan
sebagai bahan implan antara lain sifat mekanik yang meliputi kekuatan tekan
(compressive strength) dan kekerasan (hardness).
2.7.1 Kekuatan Tekan (Compressive Strength)
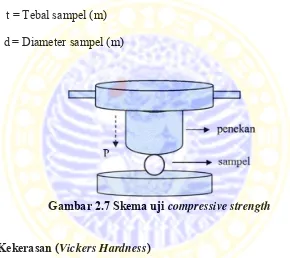
Kekuatan tekan (compressive strength) merupakan gaya maksimum yang diberikan untuk merusak atau mematahkan bahan. Salah satu cara untuk
dengan memberi beban tekanan secara diametral pada sampel yang berbentuk
silinder atau disk. Skema diametral compression test ditunjukkan oleh Gambar 2.7. Besarnya kekuatan tekan dapat dihitung dengan Persamaan (2.3).
𝜎 = 2𝑃
𝜋𝑡𝑑 (2.3)
Dengan = Kekuatan tekan (Pa)
P = Beban untuk mematahkan/memecah sampel (N)
t = Tebal sampel (m)
d = Diameter sampel (m)
Gambar 2.7 Skema uji compressive strength
2.7.2 Kekerasan (Vickers Hardness)
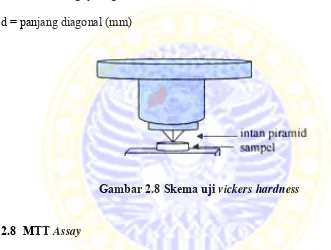
Kekerasan (hardness) merupakan ukuran ketahanan bahan terhadap deformasi tekan atau penetrasi yang bersifat tetap (permanen). Prinsip pengukuran
Vickers Hardness adalah aplikasi dari pembebanan dengan penekanan pada permukaan sampel menggunakan intan berbentuk piramid dengan posisi sudut
kemiringan 136. Skema pengukuran kekerasan (Vickers Hardness Test)
ditunjukkan oleh Gambar 2.8. Pengukuran tingkat kekerasan dilakukan pada
paramid 1), D2 (panjang diagonal paramid 2), P (Beban) dan VHN (Vickers Hardness Numbers) dengan menggunakan Persamaan (2.4).
VHN = 1,854 𝑃
𝑑2 (2.4)
Keterangan :
VHN = bilangan kekerasan vickers
P = beban atau gaya (kgf)
d = panjang diagonal (mm)
Gambar 2.8 Skema uji vickers hardness
2.8 MTT Assay
Kultur sel adalah suatu proses dimana sel prokariotik, eukariotik atau sel
tanaman yang dikembangkan dalam kondisi yang terkontrol. Sel kultur merujuk
kepada sebuah kultur yang berasal dari sel yang dipisahkan dari jaringan asal, dari
kultur primer atau dari cell line atau cell strain dengan cara enzimatik, mekanikal atau penguraian kimia (Aprilia, 2008).
Secara teori, sel apapun dapat dikultur, namun tidak semua sel mampu
bertahan di dalam lingkungan buatan yang dikenal sebagai media kultur. Media
kultur sangat bervariasi dalam kandungan konsentrasi glukosa, faktor
pertumbuhan, pH dan komponen nutrisi lainnya. Selain itu untuk menjaga
pertumbuhan sel juga diperlukan temperatur dan pencampuran gas yang tepat
(Aprilia, 2008).
Viabilitas adalah kemampuan untuk hidup setelah lahir. Berbagai macam
assay telah dikembangkan untuk mempelajari viabilitas dan proliferasi dalam populasi sel. Assay yang modern yang paling tepat adalah assay dengan format
microplate (96-well plates). Parameter yang paling penting dalam assay microplate ini adalah aktivitas metabolik. Kerusakan selular pasti akan menghasilkan hilangnya kemampuan sel untuk mengatur dan menyediakan energi
untuk fungsi metabolik dan perkembangan sel. Berdasarkan alasan tersebut maka
assay aktivitas metabolik dikembangkan. Salah satu metode dari assay aktivitas metabolik adalah dengan menggunakan substrat colorimetric MTT (Harsas, 2008).
MTT (3-(4, 5-dimethylthiazol-2-yl) 2, 5-diphenyl tetrazolium bromide)
assay adalah tes laboratorium dan assay colorimetric standard (sebuah assay yang mengukur perubahan warna) untuk mengukur pertumbuhan selular. Tes ini juga
digunakan untuk menentukan sitotoksisitas dari agen medikal dan material toksik
lainnya. Assay ini pertama kali diperkenalkan oleh Mosmann pada tahun 1983 dan didasarkan oleh enzim dehidrogenase mitokondrial sel viable (hidup) yang mengubah cincin tetrazolium MTT kuning dan membentuk kristal formazan biru
gelap yang tidak dapat menembus membran sel, sehingga akan terakumulasi di
dengan tingkat pembentukan formazan. Perubahan warna yang terjadi dapat
dihitung dengan menggunakan assay colorimetric sederhana, dibaca dengan menggunakan microplate reader. Hasil pembacaan microplate reader yang berupa nilai absorbansi (OD) dinyatakan dalam persentase terhadap kelompok
kontrol sebagai viabilitas cell line dengan menggunakan persamaan dari In vitro Technologies sebagai berikut (Harsas, 2008) :
𝑉𝑖𝑎𝑏𝑖𝑙𝑖𝑡𝑎𝑠𝑆𝑒𝑙
(% 𝑑𝑎𝑟𝑖𝑘𝑜𝑛𝑡𝑟𝑜𝑙)=
𝑁𝑖𝑙𝑎𝑖 𝑎𝑏𝑠𝑜𝑟𝑏𝑎𝑛𝑠𝑖 𝑘𝑒𝑙𝑜𝑚𝑝𝑜𝑘 𝑝𝑒𝑟𝑙𝑎𝑘𝑢𝑎𝑛
𝑁𝑖𝑙𝑎𝑖 𝑎𝑏𝑠𝑜𝑟𝑏𝑎𝑛𝑠𝑖 𝑘𝑒𝑙𝑜𝑚𝑝𝑜𝑘 𝑘𝑜𝑛𝑡𝑟𝑜𝑙 (2.5)
Jika persentase viabilitas sel masih di atas 60%, maka material yang dipaparkan
pada sel tersebut dikatakan tidak toksik, kerana OD dari perlakuan masih
BAB III
METODE PENELITIAN
3.1 Waktu dan Tempat Penelitian
Penelitian ini dilakukan selama 6 bulan pada tahun 2012. Pembuatan
sampel hidroksiapatit (HA) dan komposit HA-kitosan dilakukan di Laboratorium
Fisika Material FSAINTEK UNAIR dan Laboratorium Studi Energi dan
Rekayasa ITS. Uji XRD dilakukan di Jurusan Teknik Material dan Metalurgi FTI
ITS. Kompaksi sampel dilakukan di Laboratorium Farmasi UNAIR. Uji kekuatan
tekan dilakukan di Laboratorium Dasar Bersama (LDB) UNAIR. Uji kekerasan
dilakukan di Laboratorium Fisika Zat Padat FMIPA ITS. Uji MTT Assay
dilakukan di Pusat Veterinaria Farma (PUSVETMA) Surabaya.
3.2 Bahan dan Alat Penelitian 3.2.1 Bahan Penelitian
Bahan yang digunakan dalam pembuatan sampel pada penelitian ini yaitu
tulang sotong (Sepia sp.), amonium dihidrogen fosfat (NH4H2PO4), aquades,
kitosan (Teknologi Hasil Perikanan, Fakultas Perikanan IPB), asam asetat
(CH3COOH) 3%, Orthophosphoric acid (H3PO4) 85%, metanol P.A.
Bahan yang digunakan untuk MTT assay yaitu media Eagle’s, fibroblast cell line Baby Hamster Kidney-21 (BHK-21), Fetal Bofine Serum (FBS),
fungizone, larutan MTT (3-(4,5 dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide), Dimethyl Sufoxide (DMSO).
3.2.2 Alat Penelitian
Alat yang digunakan untuk pembuatan sampel pada penelitian ini yaitu
High Energy Milling HEM-E3D, cawan porselen, neraca analitik, hot plate,
magnetic stirrer, beaker glass, gelas ukur, pipette, reaktor (bejana tekan tertutup terbuat dari stainless steel), oven elektrik, pH meter, centrifuge, furnace, mortar.
Alat yang digunakan untuk karakterisasi sampel yaitu difraktometer
sinar-X PANalytical X'Pert PRO untuk uji XRD, Autograph untuk uji kekuatan tekan,
Microvickers Hardness untuk uji kekerasan. Sedangkan alat yang digunakan untuk MTT Assay yaitu laminar flow, botol kultur roux, mikropipet, 96-microwell plate, inkubator, Elisa reader.
3.3 Prosedur Penelitian
Tahap pelaksanaan penelitian ini yaitu ekstraksi CaCO3 dari tulang sotong,
persiapan bahan, sintesis hidroksiapatit, sintesis komposit hidroksiapatit-kitosan,
Gambar 3.1 Skema pelaksanaan penelitian
3.3.1 Ekstraksi CaCO3 dari Tulang Sotong (Sepia sp.)
Untuk mendapatkan CaCO3, bagian lamela tulang sotong (Sepia sp.)
dijadikan bubuk dengan HEM-E3D, kemudian dipanaskan pada suhu 350°C Karakterisasi XRD
Persiapan Bahan
(CaCO3 1M dan NH4H2PO4 0,6M)
Sintesis HA dengan Variasi Durasi Hidrotermal
Karakterisasi XRD
Sintering, 1000 °C, 1 jam
Karakterisasi XRD
Sintesis Komposit HA-Kitosan dengan Variasi Komposisi
Karakterisasi :
- Uji kekuatan tekan - XRD
- Uji kekerasan - MTT Assay
Analisis Data Ya
Tidak
selama 3 jam untuk menghilangkan komponen organik. Kemudian dilakukan
karakterisasi XRD untuk memastikan kandungan CaCO3.
3.3.2 Persiapan Bahan
CaCO3 (Mr = 100) 1M diperoleh dengan menambahkan 100 gram CaCO3
ke dalam 1 liter aquades. Sedangkan larutan NH4H2PO4 (Mr = 115) 0,6 M dibuat
dengan melarutkan 69 gram ke dalam 1 liter aquades.
3.3.3 Sintesis Hidroksiapatit dengan Metode Hidrotermal
Senyawa hidroksiapatit (HA) diperoleh dengan mereaksikan prekursor
kalsium (Ca) dan prekursor fosfat (P) dengan Ca : P = 10 : 6. Prekursor Ca
diperoleh dari CaCO3 dari tulang sotong 1M, sedangkan prekursor P diperoleh
dari senyawa NH4H2PO4 0,6 M. Reaksi yang akan terjadi adalah sebagai berikut.
10 CaCO3 + 6 NH4H2PO4 + 2H2O Ca10(PO4)6(OH)2 + 3 (NH4)2CO3 + 7 H2CO3
Berikut tahapan sintesis dengan metode hidrotermal.
1. CaCO3 1M dan larutan NH4H2PO4 0,6M dicampur dengan magnetic stirrer
selama 30 menit.
2. Campuran larutan dipindahkan ke reaktor.
3. Reaktor dimasukkan ke dalam oven elektrik untuk dipanaskan hingga suhu
200oC dengan variasi durasi, yaitu 12 jam, 24 jam, dan 36 jam, dengan nama
sampel berurutan yaitu sampel A, B, dan C.
5. Sampel dicuci dengan aquades menggunakan magnetic stirrer. Pencucian dilakukan berulang kali hingga hasil reaksi terpisah dengan aquades,
ditunjukkan oleh pH yang kembali menjadi 7. Hal tersebut dilakukan untuk
menghilangkan hasil sampingan yang bersifat asam.
6. Pencucian yang terakhir dilakukan dengan metanol untuk membatasi
aglomerasi partikel HA selama pengeringan.
7. Sampel dikeringkan dalam oven elektrik pada suhu 50oC selama 4 jam.
8. Sampel A, B, dan C dikarakterisasi XRD untuk memastikan terbentuknya HA
pada masing-masing sampel.
9. Sintering sampel dengan suhu 1000 °C selama 1 jam untuk menghilangkan
pengotor dan meningkatkan kristalinitas sampel. Nama sampel A, B, dan C
yang telah disintering berurutan adalah D, E, dan F.
10. Sampel D, E, dan F dikarakterisasi XRD untuk mengetahui kandungan
masing-masing sampel.
3.3.4 Sintesis Komposit HA-Kitosan
Hasil uji XRD terhadap sampel D, E, dan F menunjukkan sampel F
merupakan sampel terbaik dari tahap sebelumnya. Sehingga, sampel F yang
digunakan untuk mensintesis komposit HA-kitosan.
Preparasi terhadap kitosan dilakukan sebelum dilakukan sintesis komposit
1. Kitosan sebanyak 2 gram dicampurkan dengan 100 ml asam asetat 3% dan
6 gram asam fosfat 85%, kemudian dipanaskan dengan suhu 70°C selama
1 jam dengan pengadukan konstan.
2. Larutan didinginkan, kemudian diendapkan dalam metanol berlebih untuk
menghilangkan asam asetat dan asam fosfat yang tidak bereaksi. Gel yang
diperoleh, dilarutkan dalam aquades, kemudian dalam metanol berlebih.
3. Gel yang terbentuk dikumpulkan dan dikeringkan dengan suhu 70oC.
Sintesis komposit HA-kitosan dilakukan dengan metode pencampuran
sederhana. Kitosan dilarutkan dalam 10 ml aquades bersuhu 70oC, kemudian
ditambahkan bubuk HA secara perlahan. Massa kitosan dan HA disesuaikan
dengan komposisi pada Tabel 3.1. Campuran tersebut diaduk dengan magnetic stirrer selama 1 jam. Setelah semua bahan tercampur sempurna, bubur didiamkan selama semalam untuk gelembung udara. Bubur yang dihasilkan dari proses
tersebut kemudian dikeringkan dengan suhu 70oC selama lebih dari semalam.
Komposit yang dihasilkan kemudian dihaluskan dengan cara digerus dengan
mortar.
Tabel 3.1 Variasi Komposisi Komposit
Sampel % HA Massa (g) % Kitosan Massa (g)
F 100 2,5 0 0
F1 80 2 20 0,5
F2 75 1,875 25 0,625
F3 70 1,75 30 0,75
3.4 Karakterisasi Sampel 3.4.1 Uji XRD
Untuk melakukan uji XRD sampel diletakkan pada tempat berbentuk
balok, setelah itu sampel diletakkan pada alat uji. Hasil uji XRD tersaji dalam
bentuk grafik spektrum dan tabel. Pola difraksi berupa spektrum hasil uji XRD
memberikan informasi mengenai sudut terjadinya difraksi pada atom bahan (2)
pada sumbu horizontal dan besar intensitas yang dihasilkan pada sumbu vertikal.
3.4.2 Uji Sifat Mekanik
Sebelum dilakukan uji sifat mekanik, seluruh sampel ditimbang dengan
massa yang sama, yaitu 0,6 gram, kemudian dicetak menjadi pellet dengan cara dikompaksi dengan beban 2 ton. Cetakan yang digunakan berdiameter 13 mm.
Penambahan aseton dilakukan untuk mengatasi kesulitan dalam pencetakan
sampel menjadi pellet. Sampel yang telah dicetak kemudian dipanaskan dengan suhu 40°C menggunakan hotplate selama 1 jam.
3.4.2.1 Uji Kekuatan Tekan (Compressive Strength)
Pengukuran kekuatan tekan sampel dilakukan menggunakan Autograph. Sampel yang permukaannya telah dihaluskan, ditempatkan pada bagian penekan
mesin uji tekan, kemudian mesin dinyalakan dan mengatur kecepatan serta
otomatis gaya maksimal yang dapat ditahan oleh sampel ditampilkan oleh mesin
uji tekan. Kekuatan tekan dapat dihitung dengan persamaan (2.3).
3.4.2.2 Uji Kekerasan (Vickers Hardness)
Pengukuran tingkat kekerasan dilakukan dengan penekanan pada
permukaan sampel yang telah dengan menggunakan intan berbentuk piramid
dengan sudut kemiringan 136º. Akibat penetrasi pada permukaan sampel dengan
waktu penetrasi (t) yang telah ditentukan akan diperoleh berkas diagonal. Secara
otomatis nilai kekerasan vickers ditampilkan oleh mesin uji microvickers hardness.
3.4.3 Uji Viabilitas Sel
Uji viabilitas sel dilakukan dengan pengujian MTT assay. Tahapan yang dilaksanakan sebagai berikut.
1. Persiapan kultur sel fibroblas dilakukan dalam laminar flow. Kultur sel BHK-21 dalam bentuk monolayer dengan media Eagle’s dan FBS 5% ditanam
dalam botol kultur roux kemudian diinkubasi pada suhu 37° C selama 48 jam. 2. Kultur sel lalu dicuci dengan PBS sebanyak 5 kali yang bertujuan untuk
membuang sisa serum yang tersisa. Kemudian ditambahkan tripsin versene
untuk melepaskan sel dari dinding botol dan memisahkan ikatan antar sel
agar tidak menggerombol.
3. Sel dengan kepadatan 2 x 105 dimasukkan dalam 100 µL media (media
dipindahkan ke dalam 96-microwell plate sesuai dengan jumlah sampel dan
control.
4. Masing-masing sampel disterilisasi dengan sinar UV selama lebih dari
semalam, kemudian 0,05 gram sampel dilarutkan dalam 1 ml etanol. Larutan
sampel kemudian dalam 96-microwell plate sebanyak 50 µL. Lalu diinkubasi 24 jam pada suhu 37° C.
5. Pereaksi MTT 5 mg/mL yang telah dilarutkan dalam PBS ditambahkan ke
media sebanyak 10 µL untuk setiap well kemudian diinkubasi selama 4 jam dalam suhu 37° C.
6. Pelarut DMSO ditambahkan ke setiap well sebanyak 50 µL lalu disentrifuse 30 rpm selama 5 menit.
7. Nilai densitas optik (OD) formazan dihitung dengan Elisa reader pada panjang gelombang 630 nm. Penghitungan persentase viabilitas sel dapat
dihitung sesuai dengan Persamaan 2.5.
3.5 Analisis Data
Pengujian XRD dilakukan untuk menganalisis sifat mikro HA dan
komposit HA-kitosan. Data pengukuran yang diperoleh dari pengujian kekuatan
tekan (compressive strength) dan kekerasan (vickers hardness), akan dilakukan analisis keterkaitan antara sifat mekanik dengan variasi komposisi kitosan dalam
BAB IV
HASIL DAN PEMBAHASAN
Pada penelitian ini, dilakukan sintesis komposit hidroksiapatit
(HA)-kitosan, dimana HA disintesis dengan memanfaatkan kandungan aragonit
(CaCO3) pada tulang sotong (Sepia sp.). Hidoksiapatit yang diperoleh kemudian
digunakan sebagai matriks untuk membuat komposit, dengan kitosan sebagai
serat/filler. Variasi komposisi HA : kitosan yang dilakukan adalah 80 : 20, 75 : 25, 70 : 30, dan 65 : 35. Karakterisasi terhadap komposit meliputi sifat mikro dengan
uji X-Ray Diffraction (XRD), sifat mekanik meliputi kekuatan tekan dan kekerasan, serta MTT Assay.
4.1 Uji X-Ray Diffraction (XRD)
4.1.1 Kandungan CaCO3 pada Tulang Sotong
Hasil uji XRD terhadap bubuk lamellae tulang sotong yang telah diberi perlakuan panas 350°C selama 3 jam menunjukkan kandungan 100% kalsium
karbonat (aragonit, CaCO3) (Gambar 4.1). Spektrum XRD sampel menunjukkan
kesesuaian dengan ICDD 01-71-4891. Hal tersebut seiring dengan hasil penelitian
Paljar et al. (2009) yang menunjukkan bahwa perlakuan panas pada bagian dorsal
tulang sotong dapat mengubah kandungan aragonit menjadi kalsit. Namun, tidak
demikian halnya untuk bagian lamellae. Aragonit lebih mudah bertransformasi menjadi HA dibandingkan kalsit, sehingga pada penelitian ini digunakan aragonit
Gambar 4.1 Spektrum XRD bubuk lamellae tulang sotong (Sepia sp.)
4.1.2 Hidroksiapatit dari Proses Hidrotermal
Hasil uji XRD terhadap sampel A, B, dan C dengan durasi hidrotermal
berturut-turut 12, 24, dan 36 jam menunjukkan bahwa kandungan dari ketiga
sampel tersebut adalah 100% hidroksiapatit [HA, Ca10(PO4)6(OH)2]. Spektrum
XRD ketiga sampel tersebut bersesuaian dengan ICDD 01-72-1243. Puncak
tertinggi sampel A pada 2Ɵ = 31,72° dengan intensitas 110 (Gambar 4.2), sampel
B pada 2Ɵ = 31,69° dengan intensitas 104 (Gambar 4.3), dan sampel C pada
Gambar 4.2 Spektrum XRD sampel A
Gambar 4.3 Spektrum XRD sampel B
Rendahnya intensitas difraksi puncak tertinggi pada sampel A, B dan C
menunjukkan bahwa kristalinitas HA yang dihasilkan masih rendah (amorf). Selain itu, dimungkinkan sampel A, B dan C masih mengandung pengotor. Hal
tersebut didukung oleh warna bubuk dari ketiga sampel yang kecoklatan (Gambar
4.5). Diperkirakan pengotor merupakan ion karbonat (CO32-). Ion karbonat dapat
hilang pada pemanasan dengan suhu di atas 600°C (Septiarini, 2009). Dengan
demikian, perlu ditambahkan proses sintering untuk menghilangkan pengotor dan
meningkatkan kristalinitas HA yang telah diperoleh dari proses hidrotermal.
Gambar 4.5 Hidroksiapatit sebelum sintering
4.1.3 Hidroksiapatit Setelah Disintering
Sampel A, B, dan C yang telah disintering dengan suhu 1000 °C selama
1 jam berturut-turut disebut sebagai sampel D, E, dan F. Hasil uji XRD
menunjukkan bahwa ketiga sampel tersebut mengandung hidroksiapatit [HA,
Ca10(PO4)6(OH)2] dan trikalsium fosfat [TKF, Ca3(PO4)2] sesuai dengan ICDD
berturut-turut 01-72-1243 dan 01-073-4869. Selain itu, terdapat pula puncak yang
Puncak tertinggi sampel D pada 2Ɵ = 31,7152° dengan intensitas 1658,43
(Gambar 4.6), sampel E pada 2Ɵ = 31,7470° dengan intensitas 1472,35 (Gambar
4.7), dan sampel F pada 2Ɵ = 31,77576° dengan intensitas 1938,59 (Gambar 4.8).
Hasil uji XRD menunjukkan peningkatan intensitas yang sangat drastis
dibandingkan sampel sebelum disintering yang berkisar dari 104 – 115 saja.
Selain itu, sintering menyebabkan perubahan warna dari yang semula kecoklatan
menjadi putih (Gambar 4.9). Hal tersebut menunjukkan bahwa pengotor dalam
sampel telah hilang.
Gambar 4.7 Spektrum XRD sampel E
Gambar 4.9 Sampel setelah disintering
Berdasarkan analisis kuantitatif dengan metode rietveld terhadap hasil uji XRD, diperoleh kandungan masing-masing sampel.
Tabel 4.1 Kandungan Sampel Setelah Disintering
Nama Sampel HA (%) TKF (%)
D 94 6
E 89 11
F 94 6
Terbentuknya senyawa TKF pada sampel diakibatkan hilangnya OH
akibat perlakuan temperatur tinggi. Namun, kehadiran TKF dalam sampel
sebenarnya bukanlah hal yang fatal. Hal tersebut dikarenakan TKF juga
digunakan sebagai material implan tulang. Trikalsium fosfat (TKF) memiliki sifat
biodegradabel, bioaktif dan memiliki kelarutan yang tinggi (Dewi, 2009).
Berdasarkan Tabel 4.1 diketahui bahwa sampel D dan F yang kandungan
HA tertinggi dengan jumah yang sama, yaitu 94%. Namun, dengan
mempertimbangkan adanya 2 puncak yang tidak terindentifikasi sebagai HA atau
TKF pada spektrum XRD sampel D, yaitu pada posisi 2Ɵ 38,4365 dan 44,6553,
maka untuk tahapan penelitian selanjutnya sampel F yang digunakan sebagai
4.1.4 Komposit HA-Kitosan
Telah dilakukan sintesis komposit antara sampel F dengan kandungan HA
94% sebagai matriks dan kitosan sebagai serat/filler. Berdasarkan hasil uji sifat mekanik yang akan dibahas pada sub bab selanjutnya, dipilih sampel F1 sebagai
sampel komposit yang terbaik.
Gambar 4.10 Spektrum XRD komposit (sampel F1)
Hasil uji XRD terhadap sampel F1 ditunjukkan oleh Gambar 4.10. Apabila
dibandingkan dengan hasil uji XRD sampel F, dapat diketahui bahwa terjadi
penurunan intensitas dan pergeseran posisi puncak pada komposit. Di antaranya
pada puncak difraksi bidang (002), (211), dan (300). Pada bidang (002) terjadi
penurunan intensitas dari 737,25 menjadi 702,44 dan pergeseran posisi puncak
1938,59 menjadi 1830,03 dan pergeseran posisi puncak dari 31,7576 menjadi
31,7554. Pada bidang (300) terjadi penurunan intensitas dari 1248,14 menjadi
1082,17 dan pergeseran posisi puncak dari 32,8924 menjadi 32,8873. Penurunan
intensitas dan pergeseran puncak mengindikasikan terjadinya ikatan antara
matriksdan filler, yaitu HA dan kitosan dari proses pembentukan komposit. Analisis kuantitatif terhadap hasil uji XRD menunjukkan bahwa sampel
F1 mengandung 95% HA dan 5% brushite [CaHPO4(H2O)2]. Hal tersebut seiring
dengan penelitian Sari (2012) yang menyatakan terbentuknya CaHPO4 pada
komposit kemungkinan diakibatkan ketidakstabilan stoikiometri pada HA
sehingga rasio molar Ca/P > 1,67 yang membentuk CaO. Dimana, kandungan
CaO diatas 55 % akan membentuk CaHPO4. Ketidakstabilan stoikiometri tersebut
juga dimungkinkan karena sampel F yang digunakan untuk mensintesis komposit
F1 mengandung TKF sebesar 6%. Selain itu, afinitas yang tinggi akibat
penambahan asam fosfat pada kitosan juga dapat menyebabkan ketidakstabilan
stoikiometri, karena ion fosfat pada kitosan dapat bertukar dengan ion fosfat pada
HA (Pramanik et al., 2009).
4.2 Uji Sifat Mekanik Komposit HA-Kitosan
Pada penelitian ini sifat mekanik yang diuji adalah kekuatan tekan
Tabel 4.2 Hasil Uji Sifat Mekanik
4.2.1.Uji Kekuatan Tekan (Compresive Strength)
Uji kekuatan tekan (compresive strength) dilakukan untuk mengetahui tingkat kekuatan sampel terhadap tekanan dari pembebanan dari luar hingga
sampel rusak atau patah. Pengujian dilakukan dengan menggunakan alat
autograph. Data hasil uji kekuatan tekan dihitung dengan Persamaan (2.3). Dari perhitungan yang disajikan di Lampiran 5, diperoleh nilai kekuatan tekan dari
masing-masing sampel yang ditampilkan pada Gambar 4.11.
Hasil uji kekuatan tekan menunjukkan penambahan kitosan sebagai filler
dalam komposit HA-kitosan meningkatkan kekuatan tekan HA. Hal tersebut
menegaskan bahwa elastisitas kitosan mampu memperbaiki sifat HA yang rapuh
(brittle). Kekuatan tekan tertinggi diperoleh pada sampel F1, dengan perbandingan HA : kitosan sebesar 80 : 20, yaitu (5,241 ± 0,063) MPa.
Hasil uji kuat tekan menunjukkan pertambahan jumlah kitosan justru
mengakibatkan penurunan kekuatan tekan pada sampel F2, F3, dan F4. Hal tersebut
bisa saja terjadi karena sifat mekanik dipengaruhi banyak faktor. Di antaranya
adalah bentuk partikel, ukuran partikel, serta distribusi ukuran partikel (Cai et al., 2009). Mengingat sampel komposit F1-F4 digerus secara manual sebelum dicetak,
sehingga besar kemungkinan bentuk dan ukuran partikel tidak sama antara sampel
yang satu dengan yang lainnya. Distribusi ukuran partikel komposit pun
kemungkinan besar tidak homogen.
Kekuatan tekan juga dipengaruhi oleh interaksi antarmuka antara matriks
dan filler, yaitu HA dan kitosan (Cai et al., 2009). Penurunan kekuatan tekan akibat peningkatan jumlah kitosan, kemungkinan diakibatkan adanya kitosan yang
tidak berinteraksi dengan HA. Hal tersebut seiring dengan penelitian Dewi (2009)
dimana komposit kalsium fosfat-kitosan terbaik diperoleh pada komposisi 80 : 20,
dan komposisi 70 : 30 mengindikasikan adanya kitosan yang tidak berinteraksi
dengan kristal apatit.
Berdasarkan analisis hasil uji kekuatan, sampel F1 dengan perbandingan
HA : kitosan sebesar 80 : 20 dipilih sebagai sampel terbaik. Kekuatan tekan