ANALISIS MOLEKULER DAN FENOTIPIK PADI
NIPPONBARE-
OsPPCK
GENERASI T1 UNTUK
TOLERANSI KEKERINGAN
SARI WAHONO ROMY NUR SENO
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2015
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Analisis Molekuler dan Fenotipik Padi Nipponbare-OsPPCK Generasi T1 Untuk Toleransi Kekeringan adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juni 2015 Sari Wahono Romy Nur Seno
ABSTRAK
SARI WAHONO ROMY NUR SENO. Analisis Molekuler dan Fenotipik Padi Nipponbare-OsPPCK Generasi T1 Untuk Toleransi Kekeringan. Dibimbing oleh DJAROT SASONGKO HAMI SENO dan A DINAR AMBARWATI.
Penggunaan tanaman padi transgenik yang toleran kekeringan menjadi salah satu alternatif untuk mengatasi penurunan produksi selama cekaman kekeringan. Keberhasilan transformasi gen OsPPCK pada tanaman padi Nipponbare perlu dibuktikan secara molekuler untuk melihat integrasi gen OsPPCK dan ekspresi gen OsPPCK melalui uji toleransi kekeringan. Penelitian ini bertujuan mendapatkan padi Nipponbare transgenik generasi T1 yang positif mengandung gen OsPPCK dan toleran kekeringan serta mengamati karakter agronominya di rumah kaca. Metode seleksi dilakukan dengan uji toleransi tanaman terhadap kekeringan, mendeteksi keberadaan gen OsPPCK, dan mengamati karakter agronominya. Hasil evaluasi dari 115 tanaman sampel didapatkan 68 tanaman yang toleran kekeringan dan hanya 22 tanaman yang mengandung gen OsPPCK. Secara umum, tanaman padi Nipponbare-OsPPCK generasi T1 mempunyai tinggi tanaman yang berkisar dari 72-99 cm yang masih berada dalam kisaran tinggi tanaman Nipponbare nontransgenik (70-100 cm). Sebanyak 15 tanaman Padi Nipponbare-OsPPCK memiliki persentase biji hampa yang lebih rendah daripada tanaman padi Nipponbare nontransgenik dengan pengairan normal.
Kata kunci: amplifikasi PCR, gen OsPPCK , kekeringan, padi transgenik
ABSTRACT
SARI WAHONO ROMY NUR SENO. Molecular and Phenotypic Analysis of T1 Generation Rice Nipponbare-OsPPCK For Drought Tolerance. Supervised by DJAROT SASONGKO HAMI SENO and A DINAR AMBARWATI.
The use of transgenic rice plants that are tolerant to drought became one of the alternatives to overcome the decline in production during drought stress. The success of the transformation of OsPPCK genes in rice Nipponbare need attested molecularly to look at the integration of OsPPCK genes and gene expression through drought tolerance test. This study aims to obtain a T1 generation transgenic rice Nipponbare that were positive for OsPPCK genes and drought tolerant and observing the agronomy character in the greenhouse. Method of selection is done by testing the tolerance of plants to drought, to detect the presence of OsPPCK genes, and observe agronomy character. Results of the evaluation of 115 plant samples showed that 68 plants are tolerant to drought and only 22 plants that contain genes OsPPCK. In general, the rice plants Nipponbare-OsPPCK T1 generation has a height ranging from 72-99 cm are still in the high range Nipponbare nontransgenic plant (70-100 cm). A total of 15 plants rice Nipponbare-OsPPCK percentage of empty seeds were lower than the nontransgenic rice plants Nipponbare with normal irrigation.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
ANALISIS MOLEKULER DAN FENOTIPIK PADI
NIPPONBARE-
OsPPCK
GENERASI T1 UNTUK
TOLERANSI KEKERINGAN
SARI WAHONO ROMY NUR SENO
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2015
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas rahmat dan karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Karya ilmiah yang berjudul “Analisis Molekuler dan Fenotipik Padi Nipponbare-OsPPCK Generasi T1 Untuk Toleransi Kekeringan” ini ditujukan sebagai salah satu syarat untuk memperoleh gelar sarjana sains di Departemen Biokimia FMIPA Institut Pertanian Bogor. Penelitian ini dilaksanakan dari bulan Desember 2014 sampai dengan Maret 2015 di Laboratorium Biologi Molekuler dan Rumah kaca, Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya Genetik Pertanian, Cimanggu-Bogor.
Penulis mengucapkan terima kasih kepada Dr Djarot Sasongko Hami Seno, MS selaku pembimbing I dan Dr A Dinar Ambarwati, MSc selaku pembimbing II atas bimbingan dan arahan yang telah diberikan. Terima kasih penulis juga sampaikan kepada Dr Tri Joko Santoso SP.M.Si, Bapak Iman, dan Mira Br Sitepu yang senantiasa memberikan bimbingan, ilmu, dorongan, inspirasi, motivasi, dan arahan.
Ungkapan terimakasih juga disampaikan kepada Ayahanda Setya Suseno, Ibunda Endang Srimiwiti, segenap keluarga dan sahabat Biokimia 48 yang telah memberikan semangat, doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juni 2015
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
BAHAN DAN METODE 2
Alat dan Bahan 2
Prosedur Penelitian 2
HASIL 4
PEMBAHASAN 8
SIMPULAN DAN SARAN 11
Simpulan 11
Saran 11
DAFTAR PUSTAKA 11
LAMPIRAN 14
DAFTAR TABEL
1 Klasifikasi tanggap tanaman terhadap kekeringan (daun menggulung) 2 2 Klasifikasi tanggap tanaman terhadap kekeringan (daun mengering) 3 3 Klasifikasi tanggap kesembuhan tanaman setelah perlakuan pemulihan 3 4 Skor daun menggulung, daun mengering, dan kesembuhan tanaman
padi Nipponbare-OsPPCK (generasi T1) dan tanaman kontrol setelah
perlakuan keekringan 5
5 Karakter agronomi tanaman padi Nipponbare-OsPPCK dan Nipponbare
kontrol setelah perlakuan kekeringan 8
DAFTAR GAMBAR
1 Tanaman padi Nipponbare-OsPPCK generasi T1 dan tanaman kontrol
setelah perlakuan kekeringan 5
2 Elektroforegram hasil amplifikasi PCR padi Nipponbare-OsPPCK
menggunakan primer hptII 6
3 Elektroforegram hasil amplifikasi PCR padi Nipponbare-OsPPCK
menggunakan primer OsPPCK 7
DAFTAR LAMPIRAN
1 Bagan alir penelitian 14
2 Konsentrasi dan kemurnian DNA daun padi 15
3 Elektroforegram hasil amplifikasi PCR padi Nipponbare-OsPPCK
menggunakan primer hptII 16
4 Elektroforegram hasil amplifikasi PCR padi Nipponbare-OsPPCK
menggunakan primer OsPPCK 16
PENDAHULUAN
Tanaman padi telah banyak digunakan sebagai model penelitian untuk mendapatkan padi yang memiliki sifat unggul (Mulyaningsih et al. 2010). Salah satu sifat unggul yang diinginkan pada tanaman padi yaitu toleransi terhadap cekaman abiotik, diantaranya kekeringan. Kekeringan merupakan salah satu faktor yang berdampak terhadap produksi tanaman. Akibat kekeringan tanaman dapat kehilangan hasil sampai 50% (Jongdee et al. 2006). Hasil penelitian di rumah kaca menunjukkan terjadi penurunan produksi pada tanaman padi dengan rata-rata penurunan sebesar 52.3% pada lingkungan tercekam kekeringan dibandingkan dengan padi yang tumbuh pada lingkungan normal (Sammaullah dan Darajat 2001).
Usaha untuk meningkatkan produktivitas tanaman padi toleran kekeringan dapat dilakukan melalui rekayasa genetik. Teknologi molekuler memiliki peranan penting dalam menghasilkan kultivar dengan sifat unggul baru. Hal yang penting dalam pengembangan padi toleran kekeringan adalah memahami mekanisme toleransi kekeringan karena karakter kekeringan pada tanaman padi dikendalikan oleh banyak gen. Salah satunya adalah gen fosfoenolpiruvat karboksilase kinase (PPCK) (Fukuyama et al. 2006).
Dalam tanaman dengan metabolisme asam crassulacean (CAM) dan C4, fiksasi karbon fotosintesis saat kondisi panas dan kering dimediasi oleh fosfoenolpiruvat karboksilase (PEPC). Enzim PEPC tersedia dalam berbagai jenis tanaman, tetapi dalam kondisi inaktif. Untuk mengaktifasi enzim tersebut perlu adanya suatu reaksi fosforilasi. Fosforilasi reversibel PEPC dikatalisis oleh PEPC kinase (PPCK). Reaksi fosforilasi yang dikatalisis PPCK pada tanaman C3 dapat terjadi apabila dipicu oleh lingkungan luar yang panas dan kering. Fosforilasi PEPC akan mengurangi sensitifitas terhadap inhibitor dan meningkatkan sinsitivitas terhadap aktifator sehingga mencapai aktifitas yang lebih tinggi (Taybi et al. 2004). Dalam spesies fakultatif Mesembryanthemum crystallinum dan Kalanchoë blossfeldiana, tanaman CAM dapat disebabkan oleh salinitas atau dehidrasi, transkrip PEPC dapat terakumulasi dalam waktu 2 sampai 3 jam setelah stres (Brulfert J et al. 1993).
Gen PPCK dari tanaman padi (Oryza sativa-PPCK yang kemudian disingkat OsPPCK) sebelumnya telah berhasil diklon ke dalam vektor kloning pGEM-T easy oleh Peneliti di Laboratorium Biologi Molekuler, BB-BIOGEN. Selain itu, gen OsPPCK juga telah berhasil disisipkan pada pCAMBIA 1301 yang kemudian ditransformasi ke dalam kalus padi Nipponbare dengan menggunakan bantuan vektor Agrobacterium tumefaciens dan promoter Ubiquitin sehingga terbentuk tanaman padi Nipponbare-OsPPCK generasi T0. Oleh karena itu, perlu dilakukan penelitian lanjutan untuk melihat kestabilan gen OsPPCK pada generasi T1 dan melihat ekspresi gen OsPPCK pada generasi tersebut dengan melakukan uji toleransi kekeringan.
Penelitian ini bertujuan mendapatkan padi Nipponbare transgenik generasi T1 yang positif mengandung gen OsPPCK dan toleran kekeringan serta mengamati karakter agronominya di rumah kaca. Manfaat penelitian adalah padi Nipponbare transgenik OsPPCK yang toleran kekeringan dapat digunakan sebagai sumber plasma nutfah padi dan dapat digunakan sebagai tetua persilangan untuk merakit varietas unggul padi.
2
BAHAN DAN METODE
Alat dan Bahan
Alat yang digunakan dalam penelitian meliputi, mikropipet, tabung Eppendorf , mortar, spin, coolbox, waterbath, inkubator, stirer, autoklaf, vorteks, sentrifus Beckman Coulter, neraca analitik Kern 770, nanodrop Thermo Fisher Scientific 2009, PCR DNA Engine Tetrad Peltier Thermal Cycler 225, chemidoc gel system EQ Biorad, microwave, dan tangki elektroforesis. Bahan-bahan yang digunakan dalam penelitian meliputi benih padi Nipponbare-OsPPCK generasi T1, Nipponbare tipe liar, kontrol peka (IR20), kontrol tahan (Cabaccu dan Gajah Mungkur), pupuk NPK, pupuk cair yoshida, pupuk kandang, tanah, pasir, nitrogen cair, bufer ekstraksi CTAB, merkapto etanol, bufer TE-RNase, kalium asetat, natrium asetat, isopropanol, EtOH, primer hpt forward, primer hpt reverse, 10x bufer PCR, larutan MgCl2, dNTPs, enzim Taq DNA polimerase, ddH2O, agarosa,
GelRed (BIOTIUM), 1x bufer TAE, marker 1 kb plus DNA ladder, plasmid OsPPCK, 5x GCRich, 10 μM primer Ubiquitinforward, 10 μM OsPPCK-reverse, ready mix KAPA 2G, dan ddH2O.
Prosedur Penelitian
Analisis Respon Fenotipik Padi Transgenik Terhadap Kekeringan di Rumah Kaca (Santoso et al. 2013)
Benih padi Nipponbare-OsPPCK generasi T1 dari 20 galur tanaman, Nipponbare nontransgenik, kontrol peka (IR20) dan kontrol tahan (Cabaccu dan Gajah Mungkur) masing-masing sebanyak 10 biji dikecambahkan pada cawan petri yang telah dilapisi kertas saring dan diberi air secukupnya. Padi dipindahkan ke bak berukuran 50x40 cm yang berisi media tanah, pasir, dan pupuk (1:1:1) dengan berat kurang lebih 15 kg. Dalam setiap bak berisi tanaman sampel dan kontrol masing-masing lima tanaman. Tanaman padi ditumbuhkan selama 3 minggu dengan disiram air sebanyak 1 liter pada pagi dan sore hari, kemudian diberikan perlakuan kekeringan selama 10 hari (tanaman kontrol Nipponbare nontransgenik layu permanen). Setelah perlakuan kekeringan, tanaman padi disiram air sebanyak 1 liter setiap pagi dan sore seperti semula. Sampel tanaman padi yang mengalami recovery ditumbuhkan dan dipelihara di rumah kaca.
Pengamatan respon tanaman dilakukan dengan pemberian skoring berdasarkan gejala daun menggulung dan gejala daun mengering pada tahap akhir waktu pengeringan. Setelah perlakuan kekeringan dirasa cukup, dilakukan pemulihan tanaman. Tanaman yang masih tumbuh kemudian dilakukan penilaian kesembuhan. Skoring dilakukan mengikuti metode Standard Evaluation System for Rice (IRRI 2010, Silitonga et al. 2003) seperti tertera pada Tabel 1-3:
Tabel 1 Klasifikasi tanggap tanaman terhadap kekeringan (daun menggulung)
Skor/Skala Keterangan
0 Daun-daun sehat
3 Daun-daun melipat (berbentuk huruf V)
5 Daun betul-betul kuncup (membentuk huruf U)
7 Ujung-ujung daun bersentuhan (bentuk O)
3 Tabel 2 Klasifikasi tanggap tanaman terhadap kekeringan (daun mengering)
Skor/Skala Keterangan
0 Tidak ada gejala
1 Ujung daun sedikit mengering
3 Ujung-ujung daun mengering sampai ¼ panjang pada hampir
semua daun
5 ¼ sampai ½ dari semua daun betul-betul kering
7 Lebih dari 2/3 dari semua daun betul-betul kering
9 Tanaman mati
Tabel 3 Klasifikasi tanggap kesembuhan tanaman setelah perlakuan pemulihan
Skor/Skala Keterangan 1 90-100% tanaman sembuh 3 70-89% tanaman sembuh 5 40-69% tanaman sembuh 7 20-39% tanaman sembuh 9 0-19% tanaman sembuh
Isolasi DNA (Doyle & Doyle 1987)
Isolasi DNA dilakukan melalui tiga tahap yaitu ekstraksi DNA, pemurnian DNA, dan pemekatan DNA. Preparasi ekstrak sel dimulai dengan daun padi digerus menggunakanliquid nitrogen (LN) sampai halus, kemudian dimasukkan ke dalam tabung 2 mL, dan ditambahkan larutan CTAB, 3M Na-asetat dan larutan Chisam. Pemurnian dan pemekatan DNA dilakukan dengan penambahan natrium asetat 3M, dan isopropanol dingin. Pelet DNA dilarutkan dengan bufer TE(Tris EDTA)- RNAse sebanyak 50 μL. Selanjutnya kemurnian dan konsentrasi DNA diukur dengan nonodrop (Thermo Fisher Scientific 2000).
Amplifikasi DNA Menggunakan PCR (Sambrook et al. 2001)
Amplifikasi gen tanaman padi Nipponbare-OsPPCK yang toleran terhadap kekeringan dilakukan dengan menggunakan primer hptII dan OsPPCK. Kontrol positif dan negatif juga disertakan dalam proses PCR. Kontrol positif yang digunakan yaitu plasmid pCAMBIA-OsPPCK dan kontrol negatif DNA padi Nipponbare nontransgenik. Amplifikasi PCR dengan primer hptII dilakukan pada volume total reaksi 10 µL yang mengandung 1 µL DNA genomik cetakan 5 µL ready mix KAPA 2G, 1 µL sepasang primer hptII (forward sequence: 5’GAT TCC TTG CGG TCC GAA TG3’, dan reverse sequence: 5’TCC GAC CTG ATG CAG CTC TC3’) dengan konsentrasi 5 µM, dan 3 µL ddH2O. Reaksi amplifikasi dilakukan dengan program sebagai berikut: predenaturasi pada suhu 94 ºC selama 3 menit, dilanjutkan dengan 35 siklus yang terdiri atas denaturasi pada suhu 94 ºC selama 1 menit, penempelan primer pada suhu 60 ºC selama 1 menit, pemanjangan primer pada suhu 72 oC selama 30 detik. Pemanjangan primer terakhir selama 15 menit pada suhu 72 oC. Sementara amplifikasi PCR dengan primer OsPPCK dilakukan pada volume total reaksi 20 µL yang mengandung 2 µL DNA genomik cetakan, 2 µL GC rich, 0.2 µL dNTPs dengan konsentrasi 25 µM, 1 µL primer OsPPCK reverse dengan konsentrasi 5 µM, 1 µL primer Ubiquitin forward dengan konsentrasi 5 µM, 2 µL bufer MgCl2 dengan konsentrasi 1.5 mM, 0.16 µL Taq DNA polimerase dan 11.64 µL ddH2O. Reaksi amplifikasi dilakukan dengan program sebagai berikut: siklus pradenaturasi pada
4
95 oC selama 3 menit, dilanjutkan dengan 35 siklus yang terdiri dari denaturasi pada 94 oC selama 1 menit , penempelan primer pada 60 oC selama 1 menit, dan pemanjangan primer pada 72oC selama 1 menit. Pemanjangan primer terakhir 72 oC selama 10 menit.
Elektroforesis DNA (Sambrook et al. 2001)
Produk hasil PCR diseparasi menggunakan gel agarosa 1% di dalam 1x bufer TAE (Tris HCl-asam asetat-EDTA). Sebanyak 5µL produk PCR diinjeksikan kedalam sumur elektroforesis (80 volt, 45 menit). Pewarnaan gel dilakukan dengan menambahkan GelRed (BIOTIUM) pada loading dye yang akan dimasukkan ke dalam sumur bersama produk hasil PCR. Kemudian pita-pita DNA divisualisasi menggunakan chemidoc gel system.
Pengamatan Karakter Agronomi Tanaman Padi Nipponbare-OsPPCK Generasi T1 Hasil Uji Kekeringan (Sisharmini et al. 2013)
Analisis karakter agronomi dilakukan dengan mengamati tanaman padi Nipponbare-OsPPCK setelah uji kekeringan, Nipponbare kontrol dengan perlakuan kekeringan dan Nipponbare kontrol dengan pengairan normal. Karakter yang diamati meliputi tinggi tanaman, jumlah anakan produktif, jumlah biji isi, dan jumlah biji hampa.
HASIL
Respon Tanaman Padi Nipponbare-OsPPCK terhadap Kekeringan
Sebanyak 115 tanaman padi Nipponbare-OsPPCK yang berasal dari 20 galur telah diuji terhadap cekaman kekeringan selama 10 hari. Kadar air pada saat dilakukan cekaman kekeringan menunjukkan semua tanaman berada dalam kondisi tercekam karena didapatkan kadar air tanah rata-rata sebesar 18.52% (Lampiran 5) yang nilainya lebih rendah dari pF (kemampuan partikel tanah mengikat air) yaitu sebesar 18.84% (titik layu permanen) (Kartika 2014). Tanaman padi Nipponbare-OsPPCK memiliki skor daun menggulung, daun mengering dan kesembuhan yang bervariasi (Tabel 4). Tanaman kontrol Nipponbare nontransgenik, IR20 (kontrol peka), Gajah Mungkur (kontrol tahan) dengan perlakuan kekeringan memiliki skor daun menggulung, daun mengering dan kesembuhan sebesar 9. Tanaman Cabaccu (kontrol tahan) dengan perlakuan kekeringan memiliki skor daun menggulung sebesar 9, skor daun mengering 7 dan skor kesembuhan 7. Data ini mengindikasikan bahwa beberapa sampel tanaman padi transgenik Nipponbare generasi T1 lebih toleran terhadap cekaman kekeringan jika dibandingkan dengan tanaman kontrol. Kontrol tanaman padi yang digunakan sebagai pembanding seperti Nipponbare tipe liar, Gajah Mungkur, dan IR20 tidak mengalami pemulihan, sedangkan untuk kontrol Cabaccu masih dapat pulih setelah dilakukan penyiraman. Dari 115 tanaman padi Nipponbare-OsPPCK yang diuji, diperoleh 68 tanaman yang berhasil pulih setelah perlakuan kekeringan. Tanaman padi Nipponbare-OsPPCK generasi T1 dan tanaman kontrol setelah perlakuan kekeringan ditunjukkan pada Gambar 1. Batang tanaman Nipponbare-OsPPCK generasi T1 tumbuh tegak yang disertai dengan pertumbuhan daun yang segar sedangkan tanaman kontrol dengan perlakuan kekeringan menunjukkan batang tanaman rebah, daun mengering dan mati.
5 Tabel 4 Skor daun menggulung, daun mengering, dan kesembuhan tanaman padi Nipponbare-OsPPCK (generasi T1) dan tanaman kontrol setelah perlakuan kekeringan. Galur/ Varietas Jumlah Tanaman Kondisi Daun Kesembuhan Menggulung Mengering Nipponbare 5 9 9 9 Cabaccu 5 9 7 7 Gajah Mungkur 5 9 9 9 IR20 5 9 9 9 Nip-OsPPCK1 5 9 7 9 Nip-OsPPCK 2 5 9 7 9 Nip-OsPPCK 3 5 7 3 1 Nip-OsPPCK 4 10 9 7 9 Nip-OsPPCK 5 5 9 5 5 Nip-OsPPCK 6 5 7 3 1 Nip-OsPPCK 7 5 7 3 1 Nip-OsPPCK 8 5 7 3 1 Nip-OsPPCK 9 5 7 3 3 Nip-OsPPCK 10 10 7 3 1 Nip-OsPPCK 11 5 7 3 1 Nip-OsPPCK 12 5 9 3 1 Nip-OsPPCK 13 5 9 7 3 Nip-OsPPCK 14 10 7 3 5 Nip-OsPPCK 15 5 7 3 1 Nip-OsPPCK 16 5 9 5 5 Nip-OsPPCK 17 5 9 7 7 Nip-OsPPCK 18 5 9 7 7 Nip-OsPPCK 19 5 9 7 7 Nip-OsPPCK 20 10 7 5 7
Gambar 1 Tanaman padi Nipponbare-OsPPCK generasi T1 dan tanaman kontrol setelah perlakuan kekeringan.
6
Keberadaan gen hptII dan OsPPCK
Kualitas DNA hasil isolasi diuji secara kuantitatif. Uji kuantitatif dilakukan menggunakan spektrofotometer yang meliputi konsentrasi dan kemurnian DNA (Lampiran 2). Hasil pengukuran kuantitatif DNA dengan spektrofotometer nanodrop menunjukkan keberhasilan isolasi DNA dengan diperolehnya konsentrasi DNA yang cukup tinggi yaitu berkisar antara 507.6 ng/μL sampai 6117.5 ng/μL dengan nilai kemurnian sekitar 1.68-2.06. Menurut Sambrook et al. (2001), nilai kemurnian DNA yang baik sekitar 1.8-2.0. Nilai kemurnian DNA kurang dari 1.80 menunjukkan adanya kontaminasi protein, sedangkan nilai kemurnian DNA lebih dari 2.0 menunjukkan adanya kontaminasi RNA.
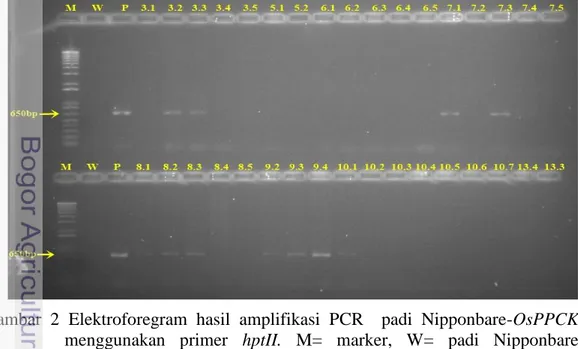
Analisis integrasi pertama menggunakan primer spesifik hptII (hygromycin phospho transferase) yang mengamplifikasi bagian gen higromisin. Gen higromisin merupakan marka seleksi yang terdapat pada plasmid pCAMBIA1301 yang disisipkan. Hasil visualisasi menunjukkan bahwa proses PCR 68 sampel menghasilkan 22 tanaman Nipponbare trangenik positif mengandung gen hptII. Tanaman padi yang positif PCR hptII ditandai dengan terbentuknya pita tunggal berukuran 650 bp (Gambar 2, lampiran 3). Tanaman yang terdeteksi positif PCR hptII diharapkan juga positif PCR gen target OsPPCK. Analisis integrasi lanjutan digunakan primer spesifik gen OsPPCK yang dikombinasikan dengan primer untuk promoter Ubiquitin (primer Ubi-F/OsPPCK-R) telah dilakukan terhadap 22 tanaman Nipponbare transgenik yang positif PCR hptII. Primer yang digunakan adalah primer spesifik terhadap gen OsPPCK sehingga hanya genom tanaman yang tersisipi gen target yang dapat teramplifikasi. Tanaman Nipponbare transgenik yang tidak mengandung gen OsPPCK tidak akan teramplifikasi karena tidak adanya sekuen spesifik terhadap primer yang digunakan. Hasil visualisasi menunjukkan adanya produk PCR berupa pita DNA tunggal yang berukuran sekitar 1400 bp (Gambar 3, Lampiran 4).
Gambar 2 Elektroforegram hasil amplifikasi PCR padi Nipponbare-OsPPCK menggunakan primer hptII. M= marker, W= padi Nipponbare nontransgenik (kontrol negatif), P=kontrol positif. 3.1-13.3 =kode lapang tanaman padi Nipponbare-OsPPCK generasi T1.
7
Gambar 3 Elektroforegram hasil amplifikasi PCR padi Nipponbare-OsPPCK menggunakan primer OsPPCK. M=marker, W= padi Nipponbare nontransgenik (kontrol negatif), P=kontrol positif. 3.2-14.3 =kode lapang tanaman padi Nipponbare-OsPPCK generasi T1.
Karakter Agronomi Tanaman Padi Nipponbare-OsPPCK Generasi T1
Karakter agronomi diamati dengan membandingkan tanaman padi Nipponbare-OsPPCK dengan padi Nipponbare nontransgenik. Jumlah anakan produktif tanaman padi Nipponbare-OsPPCK generasi T1 bervariasi mulai dari 3 sampai 21 anakan. Galur Nip-OsPPCK 3.3 memiliki anakan produktif sebanyak 21 yang lebih tinggi dari anakan produktif tanaman kontrol Nipponbare dengan perlakuan kekeringan (11 anakan) dan Nipponbare dengan pengariran normal (20 anakan). Tanaman padi Nipponbare-OsPPCK generasi T1 mempunyai tinggi tanaman yang berkisar 72-99 cm sedangkan Nipponbare nontransgenik dengan perlakuan kekeringan memikili tinggi tanaman 87 cm dan Nipponbare nontransgenik dengan pengairan normal memiliki tinggi tanaman 89 cm. Menurut Suprihatno et al. (2009), tinggi tanaman padi Nipponbare berkisar antara 70-100 cm. Hasil pengamatan tinggi tanaman menunjukkan bahwa tinggi tanaman sampel berada pada rentang tinggi normal padi Nipponbare (70-100 cm) (Tabel 5). Jumlah biji isi tanaman padi Nipponbare-OsPPCK 3.3 menunjukkan nilai yang lebih tinggi dari Nipponbare kontrol dengan perlakuan kekeringan, yaitu 1097 biji (Tabel 5). Tanaman Nipponbare kontrol dengan perlakuan kekeringan memiliki jumlah biji isi sebanyak 322 biji. Genotip tanaman padi Nipponbare-OsPPCK yang lain juga menunjukkan jumlah biji isi lebih tinggi dari Nipponbare kontrol dengan perlakuan kekeringan dengan jumlah biji sebanyak 322 biji (Tabel 5). Tanaman padi Nipponbare transgenik juga menunjukkan persentase biji hampa lebih rendah dari Nipponbare kontrol dengan perlakuan kekeringan. Sebanyak 15 tanaman Padi Nipponbare-OsPPCK memiliki persentase biji hampa yang lebih rendah dibandingkan dengan tanaman padi Nipponbare nontransgenik dengan pengairan normal.
8
Tabel 5 Karakter agronomi tanaman padi Nipponbare-OsPPCK dan Nipponbare kontrol setelah perlakuan kekeringan
Galur/Varietas Tinggi (cm) Ʃ Biji Isi ƩBiji Hampa Ʃ Anakan Produktif % Biji Hampa
Nipponbare pengairan normal 89 1004 477 20 32.21
Nipponbare kekeringan 87 322 397 11 55.21 Nip-OsPPCK 3.2 83 382 82 8 17.67 Nip-OsPPCK 3.3 99 1097 369 21 25.17 Nip-OsPPCK 6.3 97 679 398 16 36.95 Nip-OsPPCK 7.1 99 768 235 18 23.43 Nip-OsPPCK 7.3 86 97 45 5 31.69 Nip-OsPPCK 8.1 92 450 139 9 23.59 Nip-OsPPCK 8.2 95 357 87 8 19.59 Nip-OsPPCK 8.3 88 123 98 5 44.34 Nip-OsPPCK 9.2 82 250 47 5 15.82 Nip-OsPPCK 9.3 93 710 253 17 26.27 Nip-OsPPCK 9.4 89 486 131 11 21.23 Nip-OsPPCK 10.1 81 281 146 9 34.19 Nip-OsPPCK 10.8 87 86 82 6 48.81 Nip-OsPPCK 10.9 76 31 34 13 50.22 Nip-OsPPCK 10.10 82 850 179 19 17.39 Nip-OsPPCK 11.1 79 67 22 6 24.72 Nip-OsPPCK 11.3 90 137 87 11 38.84 Nip-OsPPCK 11.4 88 249 70 14 21.94 Nip-OsPPCK 12.2 85 74 66 6 47.14 Nip-OsPPCK 14.3 84 445 94 8 17.44 Nip-OsPPCK 14.4 85 774 252 17 24.56 Nip-OsPPCK 15.1 72 56 47 3 45.63
PEMBAHASAN
Respon Tanaman Padi Nipponbare-OsPPCK Generasi T1 terhadap Kekeringan
Tanaman yang mampu pulih dan bertahan hidup ketika mendapat cekaman kekeringan dikatakan sebagai tanaman toleran kekeringan (Santoso et al. 2013). Menurut Widyasari et al. (2004), ciri tanaman yang mengalami cekaman kekeringan dapat dilihat dari perubahan pada organ daun yang mengering ataupun layu. Selama proses perlakuan, dilakukan penilaian terhadap perubahan pada organ daun tanaman padi. Hal ini dilakukan untuk melihat ketahanan tanaman terhadap cekaman kekeringan. Klasifikasi penilaian tanaman yang tanggap terhadap kekeringan dapat dilihat pada Tabel 1 ,2 dan 3. Hasil pengamatan daun mengering menunjukkan bahwa skor daun menggulung, daun mengering dan kesembuhan pada tanaman padi Nipponbare-OsPPCK sangat bervariasi (Tabel 4). Variasi skor yang terjadi pada masing-masing genotip tanaman padi
Nipponbare-9 OsPPCK dapat disebabkan adanya segregasi gen OsPPCK dan kemungkinan menyisipkan gen pada tempat yang berbeda (Kartika 2014). Pada tanaman padi Nipponbare-OsPPCK memiliki skor kesembuhan yang lebih baik dari pada tanaman kontrol, hal ini menunjukkan bahwa gen OsPPCK yang disisipkan ke dalam tanaman dapat bekerja dengan baik sehingga tanaman toleran terhadap kekeringan.
Harahap et al. (1995) menjelaskan bahwa gajah mungkur dan cabaccu merupakan varietas yang termasuk padi toleran kekeringan dan sering digunakan sebagai pembanding untuk daya tembus akar padi. Menurut Yakushiji et al. (1998), cekaman kekeringan akan berpengaruh terhadap aspek pertumbuhan tanaman yang mencakup aspek morfologis, fisiologi, dan biokimia tanaman. Adanya cekaman kekeringan dalam setiap pertumbuhan dan perkembangan tanaman dapat menurunkan hasil yang disebabkan adanya hambatan pertumbuhan dan produktivitas tanaman.
Gen OsPPCK yang diintroduksikan ke dalam genom tanaman padi Nipponbare berperan dalam mengekpresikan PEPC kinase yang merupakan enzim kunci dalam tanaman dengan metabolisme asam crassulacean (CAM) dan C4. Dengan disisipkannya gen tersebut kedalam genom tanaman padi Nipponbare diharapkan tanaman tersebut memiliki sifat toleran kekeringan seperti sifat tanaman CAM dan C4 pada umumnya (Taybi et al. 2004). Dalam kondisi kekeringan, konsentrasi CO2 atmosfer relatif rendah dan O2 relatif tinggi. Pada kondisi tersebut kerja enzim Rubisco dalam fiksasi karbon tanaman padi (C3) tidak optimal karena adanya kompetisi pengikatan CO2 dan O2 dalam situs pengikatannya yang pada akhirnya akan mengakibatkan reaksi fotorespirasi. Untuk menghindari hal tersebut, gen OsPPCK yang diintroduksikan ke dalam genom tanaman padi akan mengekspresikan PEPC kinase yang akan memfosforilasi PEP karboksilase. Enzim PEP karboksilase berperan dalam proses fiksasi karbon menggantikan kerja enzim Rubisco. Enzim ini tidak memiliki situs pengikatan oksigen sehingga reaksi fotorespirasi dapat terhindari.
Keberadaan gen hptII dan OsPPCK
Kestabilan integrasi transgen dalam tanaman transgenik dapat diketahui dengan melakukan uji kestabilan gen. Uji stabilitas gen dilakukan dengan mendeteksi transgen pada turunan tanaman transgenik menggunakan teknik PCR. Individu-individu transgenik dari genotip-genotip Nipponbare-OsPPCK generasi T1 yang toleran kekeringan kemudian dianalisis secara molekuler untuk mengetahui keberadaan transgen OsPPCK. Peningkatan toleransi terhadap kekeringan berkaitan dengan adanya ekspresi gen OsPPCK yang telah terintegrasi ke dalam genom tanaman. Oleh karena itu, tanaman transgenik masih perlu diidentifikasi secara molekuler untuk mengkonfirmasi keberadaan dan integrasi gen yang diintroduksikan di dalam genom tanaman (Siska 2014).
Analisis integrasi pertama dilakukan menggunakan primer spesifik hptII (hygromycin phospho transferase) yang mengamplifikasi bagian gen higromisin. Tanaman padi yang positif PCR hptII ditandai dengan terbentuknya pita produk PCR berukuran 650 bp (Gambar 2, lampiran 3). Hasil ini tidak sesuai dengan penelitian sebelumnya. Menurut Nanda (2015), tanaman yang positif mengandung gen hpt ditunjukkan dengan amplikon DNA berukuran 500 bp. Ketidaksesuaian ini dapat terjadi karena reaksi PCR yang digunakan mengandung Ready Mix
10
KAPPA 2G yang didalamnya terdapat dye yang dapat menempel pada dNTPs sehingga memberatkan amplikon DNA saat dilakukan elektroforesis.
Tanaman yang terdeteksi positif PCR hptII diharapkan juga positif PCR gen target OsPPCK. Hasil visualisasi menunjukkan adanya produk PCR berupa pita tunggal yang berukuran sekitar 1400 bp (Gambar 3, Lampiran 4). Hal ini menunjukkan bahwa semua tanaman Nipponbare transgenik yang positif mengandung gen hptII juga positif mengandung gen OsPPCK karena ukuran fragmen DNA tersebut sesuai dengan ukuran fragmen gen OsPPCK yaitu sekitar 1400 pb yang terbentuk pada hasil pemotongan dari vektor rekombinan pCambia-OsPPCK yang telah dilakukan dalam penelitian sebelumnya di Laboratorium Biologi Molekuler, BB-BIOGEN.
Terdapat 68 tanaman Nipponbare-OsPPCK yang berhasil recovery setelah dilakukan penyiraman dan hanya 22 tanaman diantaranya yang mendandung gen hptII dan OsPPCK. Hal tersebut dapat terjadi karena tanaman mengalami segregasi (Kartika 2014). Selain itu, tanaman Nipponbare transgenik yang terdeteksi positif PCR hptII dan OsPPCK pada 22 sampel menunjukkan adanya hubungan dengan analisis terhadap kekeringan. Tanaman Nipponbare transgenik tersebut memiliki skor daun menggulung, daun mengering dan kesembuhan yang lebih baik dari tanaman sampel lainnya (Tabel 4). Hal ini menunjukkan bahwa tanaman Nipponbare transgenik memiliki gen OsPPCK yang telah berhasil disisipkan ke dalam genom tanaman dan gen tersebut dapat berfungsi dengan baik karena toleran terhadap kekeringan sehingga tanaman Nipponbare transgenik dapat tumbuh dan melangsungkan siklus hidupnya.
Karakter Agronomi Tanaman Padi Nipponbare-OsPPCK Generasi T1
Teknik transformasi genetik dapat dikatakan berhasil jika ditandai dengan keberhasilan menyisipkan rangkaian gen yang diintroduksikan ke dalam genom tanaman sehingga dapat diekspresikan dan tetap terpelihara dalam seluruh pembelahan sel berikutnya. Oleh karena itu, salah satu upaya untuk menentukan gen tersebut dapat berfungsi dengan benar adalah dengan melihat fenotip tanaman padi tersebut (Santoso 2008). Keberhasilan teknik transformasi genetik dapat dilihat dari fenotip tanaman transgenik yang dibandingkan dengan fenotip tanaman kontrol.
Perlakuan cekaman kekeringan dilakukan pada umur tanaman 20 hari. Kekurangan air pada fase vegetatif menyebabkan pertumbuhan tanaman terhambat, sedangkan fase generatif merupakan fase pertumbuhan yang peka bagi tanaman padi terhadap kekeringan. Kekeringan pada fase tersebut dapat menyebabkan tanaman tidak berkembang atau tidak menghasilkan gabah. Penurunan hasil akibat defisit air setelah fase berbunga terjadi karena penurunan jumlah gabah isi dan meningkatnya kehampaan (Samaullah et al. 1996).
Pengamatan karakter agronomi dilakukan dengan membandingkan padi Nipponbare-OsPPCK dengan padi Nipponbare nontransgenik. Menurut Suprihatno et al. (2009), tinggi tanaman padi Nipponbare berkisar antara 70-100 cm. Hasil pengamatan tinggi tanaman menunjukkan bahwa tinggi tanaman padi Nipponbare-OsPPCK generasi T1 sekitar 72-99 cm yang masih dalam rentang tinggi normal padi Nipponbare (70-100 cm) (Tabel 5). Dari data tersebut dapat dikatakan bahwa perlakuan kekeringan tidak memberikan penaruh signifikan terhadap pertumbuhan tinggi tanaman padi Nipponbare-OsPPCK generasi T1.
11 Sebanyak 15 tanaman Padi Nipponbare-OsPPCK memiliki presentasi biji hampa yang lebih rendah daripada tanaman padi Nipponbare nontransgenik dengan pengairan normal. Kekurangan air pada genotip tersebut tidak terlalu berpengaruh terhadap jumlah biji yang dihasilkan.
Hasil pengamatan menunjukkan gabah hampa tidak hanya dihasilkan pada tanaman dengan perlakuan kekeringan, namun juga pada perlakuan pengairan normal. Menurut Yoshida (1981) kondisi kekeringan pada periode 0-2 minggu menjelang pembungaan dapat menyebabkan kehampaan malai. Nipponbare kontrol dengan perlakuan kekeringan menunjukkan persentase biji hampa paling tinggi (55.21%) dibandingkan dengan tanaman padi Nipponbare-OsPPCK (Tabel 5). Biji hampa yang dihasilkan oleh tanaman padi Nipponbare-OsPPCK dan Nipponbare kontrol dapat disebabkan perlakuan cekaman kekeringan terjadi pada fase reproduktif (Yoshida 1981) .
SIMPULAN DAN SARAN
Simpulan
Sebanyak 115 tanaman padi Nipponbare-OsPPCK generasi T1 telah dievaluasi kekeringan dan didapatkan 68 tanaman yang toleran kekeringan. Analisis PCR 68 tanaman yang toleran kekeringan diperoleh sebanyak 22 tanaman mengandung gen hptII (650bp) dan OsPPCK (1400bp). Tanaman tersebut memiliki skor daun menggulung, daun mengering dan kesembuhan yang lebih baik dari tanaman sampel lainnya yang tidak mengandung gen target. Hasil pengamatan tinggi tanaman menunjukkan bahwa tinggi tanaman sampel berada pada rentang tinggi normal padi Nipponbare (70-100 cm). Sebanyak 15 tanaman Padi Nipponbare-OsPPCK memiliki presentasi biji hampa yang lebih rendah dibandingkan dengan tanaman padi Nipponbare nontransgenik.
Saran
Perlu dilakukan penelitian lebih lanjut untuk mengetahui jumlah salinan gen, dan pola segregasi agar kestabilan gen dapat dipelajari. Selain itu perlu dilakukan optimasi metode perlakuan kekeringan agar antara fase vegetatif, fase pembungaan, dan fase generatif dapat terkontrol dengan baik.
DAFTAR PUSTAKA
Brulfert J, Güclü S, Taybi T, Pierre JN. 1993. Enzymatic responses to water stress in detached leaves of the CAM plant Kalanchoë blossfeldiana Poelln., cv Tom Thumb. J.Plant. Physiol. Biochem. 31:491–497.
Doyle J.J and Doyle J.L. 1987. A rapid DNA isolation procedure for small quantities of fresh leaf tissue. Phytochem. Bull. 19:11-15.
Fukuyama H, Tesshu Tamai, Yojiro T, Stuart Sullivan, mitsue Miyao, Hugh G. 2006. Characterization and functional analysis of phospoenalpyruvate carboxilase kinase genes in rice. TPJ. 47:258-268.
12
Harahap Z, Suwarno, Lubis E, Susanto TW. 1995. Padi unggul Toleran Kekeringan dan Naungan. Bogor (ID): Pusat Penelitian dan Pengembangan Tanaman Pangan, Badan Litbang Pertanian.
[IRRI] International Rice Research Institute. 2010. Morfologi dan pertumbuhan padi [Internet]. [Waktu dan tempat pertemuan tidak diketahui]. Jakarta (ID): IRRI. Hlm 1-10; [diunduh 2015 Maret 12]. Tersedia pada: http:// www. Knowledgebank. Irri. org/ morph/ morphology.htm
Jongdee B, Pantuwan G, Fukai S, Fischer K. 2006. Improving drought tolerance in rainfed lowland rice: AN example from Thailand. Agr Water Manage. 80: 225-240.
Kartika S. 2014. Karakterisasi molekuler tanaman padi nipponbare transgenik 35S::OsERA1 yang toleran kekeringan [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Mulyaningsih ES, H Aswidinnoor, D Soepandi, PBF Ourwerkerk, S Nugroho, IH Slamet Loedin. 2010. Perbandingan tiga metode transformasi Agrobacteriumuntuk pencarian gen-gen terkait toleransi kekeringan menggunakan transposon Ac/Ds pada padi cv. Batutegi. J Biologi Indonesia. 6(3): 367-381.
Nanda H. 2015. Analisis molekuler dan fenotipe galur padi transgenik IR64 generasi T3 yang mengandung penanda aktivasi untuk toleransi kekeringan [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Samaullah MY, Sutaryo B, Taryat T. 1996. Peluang pemanfaatan genotip padi toleran kekeringan pada daerah terbatas sumber air. Seminar Nasional Masyarakat Konservasi Tanah dan Air. Malang (ID): Universitas Brawijaya. Sambrook J, DW Russell. 2001. Molecular Cloning: A Laboratory Manual. Ed-3.
New York (US): Coldspring Harbor Laboratory Press.
Santosa TJ. 2008. Identifikasi begomovirus Indonesia pada tomat dan analisis diversitas genetik gen AV1 serta pemanfaatannya untuk pengembangan tanaman tahab virus [disertasi]. Bogor (ID): Institut Pertanian Bogor.
Santoso TJ, A Apriana, A Sisharmini, KR Trijatmiko. 2013. Identifikasi Galur dan Gen-gen Terkait Toleran Kekeringan pada Padi Transgenik cv. T309 yang Mengandung Vektor Penanda Aktivasi. J Agro Biogen. 9(3): 97106.
Silitongga TS, Somantri IH, Daradjat AA, Kurniawan H. 2003. Panduan Sistem Karakterisasi dan Evaluasi Tanaman Padi. Departemen Pertanian. Badan Penelitian dan Pengembangan Pertanian. Jakarta (ID): Komisi Nasional Plasma Nutfah.
Sisharmini A, A Apriana, Diah N, TJ Santoso, KR Trijatmiko. 2013. Identifikasi perubahan karakter agronomis padi transgenik penanda aktivasi cv. asemandi generasi T1. J Agro Biogen. 9(3):107-116.
Suprihatno B, Daradjat A, Satoso, Baehaki, Widiarta, Setyono A, Indrasari DS, Lesmana. 2009. Deskripsi Varietas Padi. Subang (ID): Balai Besar Penelitian Tanaman Padi, Departemen Pertanian.
13 Taybi T, Hugh G. Nimmo, dan Anne M. Borland. 2004. Expression of phosphoenolpyruvate carboxylase and phosphoenolpyruvate carboxylase kinase genes. J Plant Physiol. 135(1): 587–598.
Taybi T, Sotta B, Gehrig HH, Güclü S, Kluge M, Brulfert J. 1995. Differential effects of abscisic acid on phosphoenolpyruvate carboxylase and CAM operation in Kalanchoë blossfeldiana. Bot Acta. 198: 240–246.
Widyasari WB, Bambang S, Cahya I, Kabul W, Untung M. 2004. Isolasi dan analisis gen yang responsif terhadap cekaman kekeringan pada tebu. Berk. Penel. Hayati. 9:69-73.
Yakushiji H, K Morinaga, H Nonami. 1998. Sugar accumulation and partitioning in satsuma mandarin tree tissue and fruit in responsse to drought stress. J. Amer. Soc. Hort. Sci. 123(4):719-726.
Yakushiji H, K Morinaga, H Nonami. 1998. Sugar accumulation and partitioning in satsuma mandarin tree tissue and fruit in responsse to drought stress. J. Amer. Soc. Hort. Sci. 123(4):719-726.
14
LAMPIRAN
Lampiran 1 Bagan alir penelitian
Penumbuhan benih padi
Perlakuan kekeringan
Isolasi DNA
Amplifikasi DNA
Elektroforesis gel agarose
15 Lampiran 2 Konsentrasi dan kemurnian DNA daun padi
Sampel Konsentra
si (ng/μL) A260/280 Sampel
Konsentrasi
(ng/μL) A260/280
Nip-kontrol 3017.2 2.00 Nip-OsPPCK 10.9 4239,8 2,06
Nip-OsPPCK 3.1 1600.2 1.94 Nip-OsPPCK 10.10 5390,9 1,98
Nip-OsPPCK 3.2 2727 1.93 Nip-OsPPCK11.1 1943.3 1.91
Nip-OsPPCK 3.3 4078.6 2.00 Nip-OsPPCK 11.2 1227.1 1.93
Nip-OsPPCK 3.4 4791.5 1.92 Nip-OsPPCK 11.3 452.9 1.91
Nip-OsPPCK 3.5 2076.7 1.92 Nip-OsPPCK 11.4 3279.0 1.91
Nip-OsPPCK 5.1 2688.5 1.91 Nip-OsPPCK 11.5 3289.5 1.92
Nip-OsPPCK 5.2 3780.1 1.93 Nip-OsPPCK 12.1 578.3 1.89
Nip-OsPPCK 6.1 1563.6 1.94 Nip-OsPPCK 12.2 3356 1,96
Nip-OsPPCK 6.2 1001.5 1.91 Nip-OsPPCK 12.3 1221.7 1.89
Nip-OsPPCK 6.3 3019,2 2,02 Nip-OsPPCK 12.4 889.6 1,87
Nip-OsPPCK 6.4 1110.6 1.92 Nip-OsPPCK 12.5 1002.0 1.95
Nip-OsPPCK 6.5 2388.6 1.90 Nip-OsPPCK 13.1 2560.7 1.98
Nip-OsPPCK 7.1 3035,3 1,92 Nip-OsPPCK 13.2 1289.7 1.97
Nip-OsPPCK 7.2 1334.0 1.90 Nip-OsPPCK 13.3 1901.5 1,87
Nip-OsPPCK 7.3 2258,7 2.00 Nip-OsPPCK 13.4 993.9 2.00
Nip-OsPPCK 7.4 1446.7 1.90 Nip-OsPPCK 14.1 1479.0 1.98
Nip-OsPPCK 7.5 1719.3 1.92 Nip-OsPPCK 14.2 2001.3 1.94
Nip-OsPPCK 8.1 2815,7 1,95 Nip-OsPPCK 14.3 4430,4 2.00
Nip-OsPPCK8.2 2787,1 1,93 Nip-OsPPCK 14.4 2600,6 1,97
Nip-OsPPCK 8.3 4123,5 1,97 Nip-OsPPCK 15.1 3613,8 1,97
Nip-OsPPCK 8.4 1509.8 1.94 Nip-OsPPCK 15.2 2977.0 1.97
Nip-OsPPCK 8.5 1516.0 1.94 Nip-OsPPCK 15.3 1753.3 2.00
Nip-OsPPCK 9.1 1412.8 1.94 Nip-OsPPCK 15.4 1964.5 1.87
Nip-OsPPCK 9.2 2779,4 1,99 Nip-OsPPCK 15.5 1286.5 1.94
Nip-OsPPCK 9.3 6117,5 1,88 Nip-OsPPCK 16.1 1358.3 1.97
Nip-OsPPCK 9.4 6094,4 1.90 Nip-OsPPCK 16.2 985.0 2.00
Nip-OsPPCK 10.1 3054,7 2,06 Nip-OsPPCK 16.3 1263.9 1.89
Nip-OsPPCK 10.2 362.5 1.92 Nip-OsPPCK 17.1 3790.5 1.83
Nip-OsPPCK 10.3 1088.8 1.93 Nip-OsPPCK 18.1 2797.4 1.98
Nip-OsPPCK 10.4 1585.9 1.93 Nip-OsPPCK 19.1 507.6 2.00
Nip-OsPPCK10.5 1180.4 1.91 Nip-OsPPCK 20.1 4297.9 1.87
Nip-OsPPCK 10.6 932.2 1.94 Nip-OsPPCK 20.2 2066.7 2.00
Nip-OsPPCK 10.7 990.7 1.93 Nip-OsPPCK 20.3 3249.6 1.68
16
Lampiran 3 Elektroforegram hasil amplifikasi PCR padi Nipponbare-OsPPCK menggunakan primer hptII
Keterangan: M=marker, P=kontrol positif, W=Nipponbare nontransgenik (kontrol negatif), 13.2-20.1= kode lapang tanaman padi Nipponbare-OsPPCK generasi T1.
Lampiran 4 Elektroforegram hasil amplifikasi PCR padi Nipponbare-OsPPCK menggunakan primer OsPPCK
Keterangan: M=marker, P=kontrol positif , W=Nipponbare nontransgenik (kontrol negatif), 14.4-15.1= kode lapang tanaman padi Nipponbare-OsPPCK generasi T1.
17
Lampiran 5 Data kadar air tanah
Sampel Bobot tanah Kadar air
(g) (%) Basah Kering Bak 1 349.8 284.8 18.5 Bak 2 340.2 279.6 17.8 Bak 3 331.0 268.2 18.9 Bak4 341.3 276.6 18.9 Rata-rata 18.52 Contoh perhitungan: Kadar air (%) = 𝐵𝑜𝑏𝑜𝑡 𝑡𝑎𝑛𝑎ℎ 𝑏𝑎𝑠𝑎ℎ−𝐵𝑜𝑏𝑜𝑡 𝑡𝑎𝑛𝑎ℎ 𝑘𝑒𝑟𝑖𝑛𝑔 𝑡𝑒𝑟𝑘𝑜𝑟𝑒𝑘𝑠𝑖 𝐵𝑜𝑏𝑜𝑡 𝑡𝑎𝑛𝑎ℎ 𝑏𝑎𝑠𝑎ℎ × 100 % = 349.8 𝑔−284.8 𝑔 349.8 𝑔 × 100 % = 18.5 %
18
RIWAYAT HIDUP
Penulis dilahirkan di Klaten pada tanggal 7 April 1994 dari ayah bernama Setyo Suseno dan ibu bernama Endang Srimiwiti. Penulis merupakan anak pertama dari tiga bersaudara. Tahun 2011 penulis menyelesaikan pendidikan Sekolah Menengah Atas di SMA Muhammadiyah 1 Klaten, Jawa Tengah dan pada tahun yang sama penulis melanjutkan studi di Institut Pertanian Bogor (IPB ). Di IPB penulis menempuh pendidikan mayor Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam dan minor Pengolahan Pangan. Pada tahun 2014, penulis melaksanakan praktik lapangan di Laboratorium Biologi Molekuler, BB Biogen, dengan judul “Deteksi Integrasi Gen HPT Pada Tanaman Padi Putatif Transgenik Menggunakan PCR”. Selama masa perkuliahan penulis menjadi anggota divisi Comunication and Information Center (CIC) dalam organisasi Community of Research and Education in Biochemistry (CREBs) periode 2013-2014.