BAB III
METODOLOGI PENELITIAN
3.1 LOKASI DAN WAKTU PENELITIAN
Penelitian ini akan dilaksanakan di Laboratorium Kimia Fisika, Departemen Teknik Kimia, Fakultas Teknik, Universitas Sumatera Utara, Medan. Penelitian ini dilakukan selama lebih kurang 6 bulan, yaitu dari bulan Oktober 2015 hingga April 2016.
3.2 BAHAN DAN PERALATAN 3.2.1 Bahan
Pada penelitian ini bahan yang digunakan antara lain:
1. Biji buah durian (Durio zibethinus), diperoleh dari pedagang durian di Jl. KH Wahid Hasyim, Medan.
2. Aquadest (H2O), diperoleh dari toko bahan kimia Rudang, Medan.
3. Sorbitol (C6H14O6), diperoleh dari toko bahan kimia Rudang, Medan. 4. Kitosan ((C6H11NO4)n), diperoleh dari toko bahan kimia Rudang, Medan. 5. Asam Klorida (HCl), diperoleh dari toko bahan kimia Rudang, Medan.
6. Air Kapur, diperoleh dari pedagang di Pasar Pringgan Jl. Iskandar Muda, Medan. 3.2.2 Alat 1. Saringan 2. Pipet tetes 3. Gelas ukur 4. Beaker glass 5. Magnetic stirrer 6. Desikator 7. Cawan porselin 8. Oven listrik 9. Furnace 10. Ember 11. Neraca Digital
12. Jangka sorong 13. Termometer 14. Ayakan 100 mesh 15. Blender 16. Pisau 17. Talenan
18. Cetakan plexiglass ukuran 20x20 cm
3.3 PROSEDUR PENELITIAN
Penelitian ini diawali dengan pengambilan sampel biji durian di Jl. KH Wahid Hasyim sebanyak 5 kg. Dilakukan proses ekstraksi pati biji durian, dimana selanjutnya pati tersebut diolah menjadi bioplastik. Prosedur penelitian dapat dijelaskan sebagai berikut:
3.3.1 Ekstraksi Pati
Pati yang digunakan pada penelitian ini yaitu pati yang diekstrak langsung dari biji durian melalui beberapa proses. Pengambilan kandungan pati dari biji durian dilakukan dengan :
1. Biji durian dikupas bagian selubung luar dan kulit arinya sampai bersih.
2. Setiap 5 kg Biji durian dipotong tipis-tipis dengan ketebalan ± 2 mm. Potongan biji durian direndam dalam air kapur (CaCO3) selama 15 menit dengan konsentrasi 1%, dimana air kapur tersebut merupakan campuran 15 gram kapur (CaCO3) di dalam 2 liter air bersih. Air kapur digunakan untuk menghilangkan lendir/getah pada biji durian.
3. Setelah 20 menit, biji durian dibilas berulang-ulang dengan air sampai bersih. 4. Biji durian yang sudah bersih dijemur di bawah matahari selama 6 jam untuk
mengurangi lendir/getah yang masih ada pada biji.
5. Setelah kering biji durian dihancurkan menggunakan blender dengan menambahkan air, dimana perbandingan biji durian dengan air adalah 1 : 5 (w/v).
6. Biji durian yang telah halus dikeluarkan dari blender dan disaring menggunakan saringan, diperoleh ampas dan cairan filtrat (suspensi pati).
7. Suspensi yang dihasilkan kemudian dimasukkan dalam kulkas dan diendapkan selama 24-48 jam hingga pati mengendap sempurna.
8. Cairan bening pada bagian atas dibuang hingga menyisakan endapan putih yang kaya pati.
9. Pati basah yang dihasilkan diuji dengan lakmus merah apakah pH pati sudah netral atau masih bersifat basa akibat penggunaan air kapur .
10. Jika pati masih bersifat basa maka pati dicuci dengan aquades dan diendapkan lagi hingga diperoleh endapan pati dengan pH netral.
11. Pati basah kemudian dikeringkan menggunakan oven pada suhu 50oC selama ±24 jam hingga kering.
12. Pati kering yang berbentuk gumpalan rapuh dihancurkan dengan menggunakan tumbukan hingga menghasilkan serbuk pati yang halus.
13. Serbuk pati selanjutnya diayak dengan ayakan 100 mesh.
14. Dihitung berapa persen pati yang diperoleh dari berat 5 kg biji durian.
3.3.2 Pembuatan Bioplastik
Pati yang telah diperoleh melalui proses ektraksi pati selanjutnya dijadikan sebagai bahan baku dalam pembuatan bioplastik. Bioplastik dibuat dengan mengguanakan metode casting. Berikut proses pembuatan film bioplastik dari pati biji durian berpengisi kitosan dan plasticizer gliserol :
1. Pati ditimbang sebanyak 0,2 w/v dari 100 ml aquadest dan kitosan ditimbang sebanyak 0,04 w/v dari larutan pati.
2. Dicampurkan pati dengan aquades pada beaker glass 500 ml.
3. Dibuat larutan kitosan dengan melarutkan kitosan yang telah ditimbang ke dalam larutan asam klorida dengan variasi konsentrasi 0,8%; 0,9% ; 1,0% ; 1,1% ; 1,2% ; dan 1,3% (v) .
4. Ditimbang massa sorbitol dengan konsentrasi 20% (w) dari massa total pati-kitosan.
5. Beaker glass 500 ml yang berisi larutan pati diletakkan di atas magnetic stirrer
hot plate sambil mulai dipanaskan.
7. Setelah 20 menit ditambahkan sorbitol ke dalam larutan, lalu diaduk hingga temperatur larutan mencapai variasi temperatur yang telah ditentukan (T = 70 oC , 72,5 oC , 75 oC , 77,5 oC dan 80 oC).
8. Setelah temperatur tercapai dimana larutan sudah mengental dan berwarna kecoklatan, magneticstirrer dimatikan.
9. Beaker glass berisi larutan kemudian didinginkan sebelum dicetak.
10. Larutan dituangkan merata ke dalam cetakan akrilik dengan volume cetakan adalah (20 x 20 x 0,3) cm3, kemudian dikeringkan dalam oven pada temperatur T = 45 oC selama 24 jam.
11. Setelah dikeringkan, diangkat dan dimasukkan ke dalam desikator selama 24 jam.
12. Kemudian plastik dilepas dari cetakannya. Plastik siap untuk dianalisa.
3.4 PROSEDUR ANALISA 3.4.1 Prosedur Analisa Pati
3.4.1.1 Analisa Kadar Pati (SNI-01-3194-1992)
Tujuan dilakukan analisa ini adalah untuk mengetahui kandungan pati yang terdapat pada pati biji durian. Analisa kadar pati (amilum) dari pati biji durian dilakukan di Laboratorium Uji Teknologi Pangan dan Hasil Pertanian, Universitas Gadjah Mada.
1. Timbang 2-5 gram sampel berupa bahan padat yang telah dihaluskan atau bahan cair dalam gelas piala 250 ml, tambahkan 50 ml aquades dan diaduk selama 1 jam. Suspensi disaring dengan kertas saring whatman 42 dan dicuci dengan aquades sampai volume filtrat 250 ml. Filtrat mengandung karbohidrat yang terlarut dan dibuang.
2. Bahan yang mengandung lemak, maka pati yang terdapat sebagai residu pada kertas saring dicuci 5 kali dengan 10 ml ether, biarkan ether menguap dari residu, kemudian cuci lagi dengan 150 ml alkohol 10% untuk membebaskan lebih lanjut karbohidrat yang terlarut.
3. Residu dipindahkan secara kualitatif dari kertas saring ke dalam erlenmeyer dengan pencucian 200 ml aquades dan tambahkan 20 ml HCl 25% (BJ 1,125),
tutup dengan pendingin balik dan panaskna di atas penangas air mendidih selama 2,5 jam.
4. Setelah dingin netralkan dengan larutan NaOH 45% dan encerkan sampai volume 500 ml, kemudian saring dengan kertas saring whatman 42, tentukan kadar gula yang dinyatakan sebagai glukosa dari filtrat yang diperoleh. Penentuan glukosa seperti pada penentuan gula reduksi. berat glukosa dikalikan 0,9 merupakan berat pati.
3.4.1.2 Analisa Kadar Amilosa (SNI-01-3194-1992)
Tujuan dilakukan analisa ini adalah untuk mengetahui kandungan amilosa yang terdapat pada pati biji durian yang umumnya memberikan sifat kekuatan pada suatu film. Analisa kadar amilosa dari pati biji durian dilakukan di Laboratorium Uji Teknologi Pangan dan Hasil Pertanian, Universitas Gadjah Mada.
I. Pembuatan Kurva Standar
1. Timbang 40 mg amilosa murni, masukkan ke dalam tabung reaksi. Tambahkan 1 ml etanol 95% dan 9 ml NaOH 1 N.
2. Panaskan dalam air mendidih selama kurang lebih 10 menit sampai semua bahan membentuk gel. Setelah itu dinginkan.
3. Pindahkan seluruh campuran ke dalam labu takar 100 ml. Tepatkan sampai tanda tera dengan air.
4. Pipet masing 1, 2, 3, 4 dan 5 ml larutan diatas masukkan masing-masing ke dalam labu takar 100 ml.
5. Ke dalam masing-masing labu takar tersebut, tambahkan asam asetat 1 Nmasing-masing 0,2; 0,4; 0,6; 0,8 dan 1 ml, lalu tambahkan masing-masing 2 ml larutan iod.
6. Tepatkan masing-masing campuran dalam labu takar sampai tanda tera dengan air. Biarkan selama 20 menit.
7. Intensitas warna biru yang terbentuk diukur dengan spektrofotometer pada panjang gelombang 625 nm.
II. Pengukuran Sampel
1. Tiimbang 100 mg sampel dalam bentuk tepung (sampel sebagian besar terdiri dari pati, jika banyak mengandung komponen lainnya, ekstrak dulu patinya baru analisa kadar amilosanya), masukkan ke dalam tabung reaksi. Tambahkan 1 ml etanol 95% dan 9 ml NaOH 1 N.
2. Panaskan dalam air mendidih selama kurang lebih 10 menit sampai terbentuk gel.
3. pindahkan seluruh gel ke dalam labu takar 100 ml. Tepatkan sampai tanda tera dengan air.
4. pipet 5 ml larutan tersebut, masukkan ke dalam labu takar 100 ml. Tambahkan 1 ml asam asetat 1 N dan 2 ml larutan Iod.
5. Tepatkan sampai tanda tera dengan air, kocok, diamkan selama 20 menit. 6. Ukur intensitas warna yang terbentuk dengan spektrofotometer pada panjang
gelombang 625 nm.
7. Hitung kadar amilosa dalam sampel.
3.4.1.3 Analisa Kadar Amilopektin (SNI-01-3194-1992)
Tujuan dilakukan analisa ini adalah untuk mengetahui kandungan amilopektin yang terdapat pada pati biji durian yang umumnya memberikan sifat mekanik yang rendah pada suatu film. Analisa kadar amilopektin dari pati biji durian dilakukan di Laboratorium Uji Teknologi Pangan dan Hasil Pertanian, Universitas Gadjah Mada.
1. Dihitung kadar pati sampel pati biji durian berdasarkan prosedur. 2. Dihitung kadar amilosa sampel pati biji durian berdasarkan prosedur.
3. Ditentukan kadar amilopektin berdasarkan nilai kadar pati dan kadar amilosa sampel pati biji durian yang telah dihitung.
Kadar amilopektin ditentukan dengan perhitungan: % amilopektin = % pati - % amilosa
3.4.1.4 Prosedur Analisa Kadar Air (SNI-01-2891-1992)
Analisa kadar air dari pati biji durian dilakukan di Laboratorium Jasa Uji Fakultas Teknologi Industri Pertanian, Universitas Padjadjaran.
1. Timbang dengan seksama 1-2 gram sampel pada sebuah botol timbang bertutup yang sudah diketahui bobotnya. untuk contoh berupa cairan, botol timbang dilengkapi dengan pengaduk dan pasir kwarsa/kertas saring berlipat. 2. Keringkan pada oven suhu 105 0C selama 3 jam.
3. Dinginkan dalam desikator.
4. Timbang, ulangi pekerjaan ini hingga diperoleh bobot tetap. 5. Catat data pengamatan dalam loogbook analisis
6. Perhitungan :
Kadar air = ( W1 / W ) x 100% Dimana :
W = berat sampel sebelum dikeringkan ( g) W1 = kehilangan berat setelah dikeringkan ( g)
3.4.1.5 Prosedur Analisa Kadar Abu dengan Standar AOAC ( Widyaningsih, dkk., 2012)
Analisa kadar abu dari pati biji durian dilakukan di Laboratorium Proses Industri Kimia, Departemen Teknik Kimia, Universitas Sumatera Utara.
1. Sampel ditimbang sebanyak 2 gram dimasukkan ke dalam cawan porselin . 2. Cawan yang berisi sampel dipijarkan diatas nyala api pembakar bunsen hingga
tidak berasap lagi .
3. Kemudian dimasukkan kedalam furnace dengan suhu 650 oC selama ± 12 jam. 4. Cawan yang berisi sampel didinginkan dalam desikator selama 30 menit lalu
ditimbang hingga beratnya tetap.
Perhitungan : 𝐾𝑎𝑑𝑎𝑟 𝑎𝑏𝑢 =𝑏𝑒𝑟𝑎𝑡 𝑎𝑤𝑎𝑙−𝑏𝑒𝑟𝑎𝑡 𝑎𝑘ℎ𝑖𝑟
𝑏𝑒𝑟𝑎𝑡 𝑎𝑤𝑎𝑙 𝑥 100%
3.4.1.6 Prosedur Analisa Kadar Lemak (SNI-01-2891-1992)
Analisa kadar lemak dari pati biji durian dilakukan di Laboratorium Jasa Uji Fakultas Teknologi Industri Pertanian, Universitas Padjadjaran.
1. Timbang dengan teliti 1 - 2 gram sampel dalam selongsong kertas yang dialasi dengan kapas, kemudian sumbat selongsong yang berisi sampel dengan kapas. 2. Keringkan dalam oven pada suhu tidak lebih 80oC selama kurang lebih satu
3. Masukkan selongsong dalam alat soxhlet yang telah dihubungkan dengan labu lemak berisi batu didih yang telah dikeringkan dan telah diketahui bobotnya. 4. Ekstrak dengan heksana atau pelarut lemak lainnya selama kurang lebih 6 jam. 5. Sulingkan heksana dan keringkan ekstrak lemak dalam oven pada suhu 105 oC 6. Dinginkan dan timbang
7. Ulangi pengeringan hingga tercapai bobot tetap 8. Catat data pengamatan dalam logbook
9. Perhitungan :
% Lemak = ( 𝑊−𝑊1
𝑊2 ) x 100%
Dimana :
W = berat sampel
W1 = berat lemak sebelum ekstraksi W2 = berat labu lemak sesudah ekstraksi
3.4.1.7 Prosedur Analisa Kadar Protein (SNI-01-2891-1992)
Analisa kadar protein dari pati biji durian dilakukan di Laboratorium Jasa Uji Fakultas Teknologi Industri Pertanian, Universitas Padjadjaran.
1. Timbang dengan teliti 0.51 gram sampel dalam labu kjeldahl 100 ml. 2. Tambahkan 2 gram selenium 5 dan 25 ml H2SO4 pekat
3. Panaskan diatas kompor listrik atau api pembakar sampai mendidih dan larutan berubah menjadi warna jernih kehijauan ( sekitar 2 jam)
4. Biarkan dingin, kemudian encerkan dan masukan ke dalam labu ukur 100 ml, tepatkan sampai tanda batas.
5. Untuk menampung destilat, pipet 10 ml asam borat 2 % masukkan kedalam Erlenmeyer 250 ml, tambahkan 5 tetes indicator campuran.
6. Pipet 5 ml larutan hasil dekstruksi ke dalam alat destilasi protein tambahkan 5 ml NaOH 42.8% dan akuades untuk membilas.
7. Destilasi selama kurang lebih 15 menit sampai destilat yang tertampung tidak bersifat basa. ( uji dengan menggunakan kertas lakmus)
8. Bilas ujung kondensor dengan air akuades. 9. Titrasi destilat dengan HCl 0.01 N
11. Catat data pengamatan dalam logbook 12. Perhitungan : Kadar protein : (( 𝑉1 – 𝑉2 ) 𝑋 𝑁 𝑋 0.0014 𝑋 𝑓𝑘 𝑋 𝑓𝑝) 𝑊 Dimana : W = berat sampel
V1 = volume HCl 0.01 N yang dipergunakan titrasi sampel V2 = volume HCl 0.01 N yang dipergunakan titrasi blanko N = Normalitas HCl
Fk = factor konversi protein
3.4.1.8 Prosedur Uji Pasting Time Larutan Pati Menggunakan Rapid Visco Analyzer (RVA)
Analisa profil gelatinisasi dari pati biji duriandengan RVA dilakukan di Laboratorium Jasa Uji Fakultas Teknologi Industri Pertanian, Universitas Padjadjaran.
1. Isi bak pendingin dengan akuades sampai tanda pada display muncul tanda bahwa air sudah cukup terisi.
2. Pasang kabel pada stop kontak, nyalakan alat dengan menekan tombol yang berada di bagian belakang alat, nyalakan juga air pendingin.
3. Atur temperature, time, pump, refrigerate.
4. Jika semua parameter pengaturan sudah sesuai, tekan tombol ON sampai semua pengaturan posisi on ( perhatikan tanda di display)
5. Pilih menu STD 1 pada menu utama 6. Pasang flashdisk pada alat RVA.
7. Timbang sampel sebanyak 3,5-4 gram (sesuaikan dengan kandungan air sampel) dan masukan ke canister
8. Tambahkan akuades atau buffer sebanyak 25 gram ( sesuaikan dengan penimbangan sampel.
9. Simpan canister pada alat dan mulai pengukuran dengan menekan tombol √, lalu tower sampel pada alat.
10. Alat akan memutar sampel dengan pemanasan pada 50 – 95 0C selama ±23 menit.
11. Jika sudah selesai, grafik pengukuran bisa di lihat pada display, lalu pilih option save.
12. Saving data pada flashdisk.
3.4.2 Prosedur Analisa Bioplastik
3.4.2.1 Prosedur Pengujian Sifat Kuat Tarik (ASTM D638-02a, 2002)
Analisa densitas dari bioplastik dilakukan di Laboratorium Polimer, Departemen Teknik Kimia, Universitas Sumatera Utara.
1. Sampel dipotong dengan ukuran 13 mm x 57 mm dengan tebal ≤ 7 mm. 2. Pengujian dilakukan dengan cara menempatkan spesimen pada genggaman
mesin uji.
3. Indikator ekstensi (extensomer) dipasang. 4. Alat pengukur regangan melintang dipasang. 5. Dilakukan pengukuran beban dan tegangan.
6. Kecepatan pengujian diatur sesuai dengan laju yang diperlukan. 7. Kurva tegangan-beban dicatat.
8. Selain itu dicatat pula nilai tegangan dan beban serta nilai tegangan dan beban pada saat putus.
9. Kuat tarik dihitung dengan menggunakan rumus berikut : Perhitungan : Kuat Tarik (kg/cm2) = 𝑏𝑒𝑏𝑎𝑛 𝑚𝑎𝑘𝑠𝑖𝑚𝑢𝑚
𝑙𝑢𝑎𝑠 𝑝𝑒𝑟𝑚𝑢𝑘𝑎𝑎𝑛 (𝐴)
3.4.2.2 Prosedur Pengujian Perpanjangan pada saat putus (ASTM D638-02a, 2002)
Analisa densitas dari bioplastik dilakukan di Laboratorium Polimer, Departemen Teknik Kimia, Universitas Sumatera Utara.
1. Sampel dipotong dengan ukuran 13 mm x 57 mm dengan tebal ≤ 7 mm. 2. Pengujian dilakukan dengan cara menempatkan spesimen pada genggaman
mesin uji.
5. Dilakukan pengukuran beban dan tegangan.
6. Kecepatan pengujian diatur sesuai dengan laju yang diperlukan. 7. Kurva tegangan-beban dicatat.
8. Dicatat persen perpanjangan pada saat putus pada grafik dikali dengan 100.
3.4.2.3 Prosedur Analisa Ketahanan terhadap Air (ASTM D570-98, 2005)
Analisa ketahanan terhadap air dari bioplastik dilakukan di Laboratorium Operasi Teknik Kimia, Departemen Teknik Kimia, Universitas Sumatera Utara. 1. Dipotong plastik dengan diameter 50,8 mm dan tebal ± 0,18 mm dan
ditimbang berat sampel.
2. Masukkan sampel plastik ke dalam wadah berisi air distilat denngan temperatur 23±1 oC selama 24 jam.
3. Setelah 24 jam, sampel diambil dan dibersihkan dengan menggunakan kain kering. Penyerapan air dihitung dengan rumus :
Perhitungan : Penyerapan air=𝑏𝑒𝑟𝑎𝑡 𝑠𝑎𝑚𝑝𝑒𝑙 𝑎𝑤𝑎𝑙−𝑏𝑒𝑟𝑎𝑡 𝑠𝑎𝑚𝑝𝑒𝑙 𝑎𝑘ℎ𝑟
𝑏𝑒𝑟𝑎𝑡 𝑠𝑎𝑚𝑝𝑒𝑙 𝑎𝑘ℎ𝑖𝑟 𝑥 100%
3.4.2.4 Prosedur Analisa Densitas (ASTM D792-91, 1991)
Analisa densitas dari bioplastik dilakukan di Laboratorium Operasi Teknik Kimia, Departemen Teknik Kimia, Universitas Sumatera Utara.
1. Film dipotong dengan ukuran 5 cm x 5 cm dengan tebal tertentu, kemudian dihitung volumenya.
2. Potongan film ditimbang dan rapat massa film ditentukan dengan membagi massa dengan volumenya (g/cm3).
Perhitungan : 𝜌 = 𝑚
𝑣
3.4.2.5 Prosedur Analisa Morfologi Permukaan Bioplastik dengan Scanning Electron Microscope (SEM) (Setiani, dkk., 2013)
Analisa dengan SEM ini dilakukan di Laboratorium Terpadu USU.
1. Sampel yang diambil dari patahan bioplastik setelah uji kuat tarik ditempelkan pada set holder dengan perekat ganda.
3. Sampel dimasukkan pada tempatnya di dalam Scanning Electron Microscope (SEM).
4. Gambar topografi diamati dan dilakukan perbesaran 5000 kali dan 10000 kali.
3.4.2.6 Prosedur Analisa Gugus Fungsi Bioplastik dengan FT-IR (Fourier Transform Infrared) (Darni dan Utami, 2010)
Analisa gugus fungsi dengan FT-IR dilakukan di Laboratorium Fakultas Farmasi, Universitas Sumatera Utara.
1. Sampel film bioplastik ditempatkan ke dalam set holder, kemudian dicari spektrum yang sesuai.
2. Hasil yang di dapat berupa difraktogram hubungan antara bilangan gelombang dengan intensitas.
3.5 FLOWCHART PENELITIAN 3.5.1 Flowchart Ekstraksi Pati
Gambar 3.1 Flowchart Ekstraksi Pati Mulai
Biji durian dikupas bagian selubung luar dan kulit arinya kemudian dicuci Biji durian dipotong tipis-tipis dan direndam air kapur (larutan
CaCO3 1%) selama 15 menit Biji durian dibilas dengan air sampai bersih
Biji durian yang sudah bersih dijemur di bawah matahari selama 6 jam Biji durian dihancurkan dengan blender dengan bantuan air Biji durian yang telah halus dikeluarkan dari blender dan disaring
menggunakan saringan plastik
Selesai
Filtrat (suspensi pati) yang dihasilkan kemudian dimasukkan dalam kulkas dan diendapkan selama 24-48 jam Cairan bening pada bagian atas dibuang hingga menyisakan
endapan putih yang kaya pati
Pati basah yang dihasilkan diuji dengan lakmus merah, jika pati masih bersifat basa maka pati dicuci dengan aquades dan diendapkan lagi
hingga diperoleh endapan pati dengan pH netral
Pati basah kemudian dikeringkan menggunakan oven pada suhu 45 oC selama ±24 jam hingga kering
Pati kering yang berbentuk gumpalan rapuh dihancurkan dengan menggunakan tumbukan hingga halus kemudian di ayak
3.5.2 Flowchart Pembuatan Bioplastik
Mulai
Dicampurkan pati dengan aquades pada beaker glass 500 ml
Beaker glass 500 ml yang berisi larutan pati diletakkan di atas magnetic stirrer hot plate
dan diatur kecepatan putar dan temperatur alat
Massa Pati ditimbang sebanyak 0,2 w/v dari 100 ml aquadest dan kitosan ditimbang sebanyak 0,03 (w/v) dari larutan pati
Ditambahkan larutan kitosan kemudian diaduk selama 20
menit
Ditambahkan sorbitol ke dalam larutan
Ditimbang massa sorbitol dengan konsentrasi 20% (w) dari massa total pati-kitosan
A
Dibuat larutan kitosan dengan melarutkan kitosan yang telah ditimbang ke dalam larutan asam klorida
dengan variasi konsentrasi 1,0%, 1,1%, 1,2%, 1,3%, dan 1,4% .
Setelah temperatur tercapai dimana larutan sudah mengental dan berwarna kecoklatan, magneticstirrer dimatikan
Larutan didinginkan dan dituangkan merata ke dalam cetakan akrilik dengan volume cetakan adalah (20 x 20 x 0,3) cm3
Gambar 3.2 Flowchart Pembuatan Bioplastik
3.5.3 Flowchart Uji Kadar Air
Gambar 3.3 Flowchart Uji Kadar Air Larutan dalam cetakan dikeringkan dalam oven
pada temperatur T = 45 oC selama 24 jam
Selesai
Setelah dikeringkan, diangkat dan dimasukkan ke dalam desikator selama 24 jam.
Kemudian plastik dilepas dari cetakannya. Plastik siap untuk dianalisa
Sampel ditimbang seberat 2 gram dan dimasukkan ke dalam cawan porselin yang telah dikeringkan
Dimasukkan ke dalam oven pada suhu 100 – 105 oC selama 5 jam atau berat konstan Mulai
Setelah dingin dimasukkan ke dalam desikator selama 30 menit dan ditimbang kemudian dihitung dengan rumus perhitungan kadar air.
Selesai A
3.5.4 Flowchart Uji Kadar Abu
Gambar 3.4 Flowchart Uji Kadar Abu
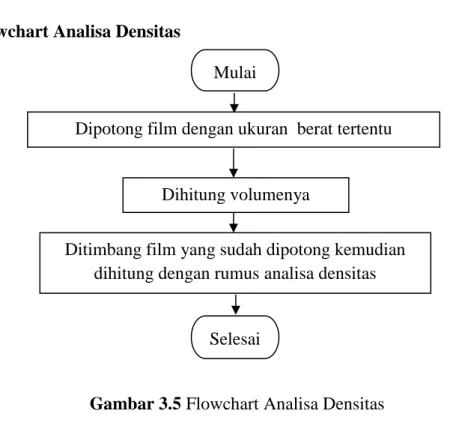
3.5.5 Flowchart Analisa Densitas
Gambar 3.5 Flowchart Analisa Densitas
Sampel ditimbang seberat 2 gram dan dimasukkan ke dalam cawan porselin yang telah dikeringkan
Lalu diabukan dalam furnace pada suhu 650 oC ± 12 jam
Selesai Mulai
Mulai
Ditimbang film yang sudah dipotong kemudian dihitung dengan rumus analisa densitas Dipotong film dengan ukuran berat tertentu
Dihitung volumenya
Selesai
Setelah dingin dimasukkan ke dalam desikator selama 30 menit dan ditimbang kemudian dihitung dengan rumus perhitungan kadar air.
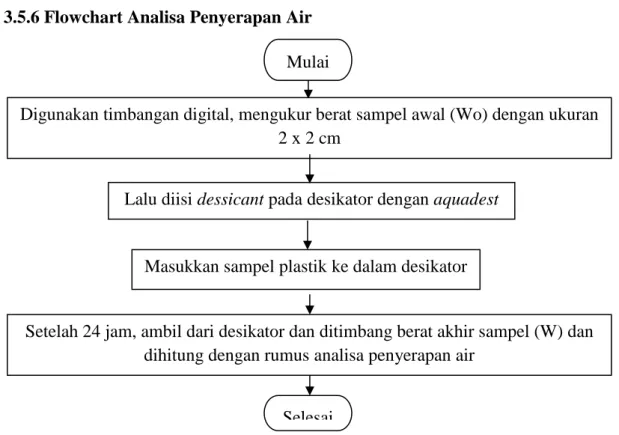
3.5.6 Flowchart Analisa Penyerapan Air
Gambar 3.6 Flowchart Uji Kadar Air
Digunakan timbangan digital, mengukur berat sampel awal (Wo) dengan ukuran 2 x 2 cm
Lalu diisi dessicant pada desikator dengan aquadest
Mulai
Masukkan sampel plastik ke dalam desikator
Selesai
Setelah 24 jam, ambil dari desikator dan ditimbang berat akhir sampel (W) dan dihitung dengan rumus analisa penyerapan air
BAB IV
HASIL DAN PEMBAHASAN
4..1 HASIL KARAKTERISTIK PATI BIJI DURIAN
Pati yang digunakan pada penelitian pembuatan bioplastik ini adalah pati yang diekstrak dari biji durian. Biji durian yang telah dikumpulkan kemudian diolah menjadi pati kering. Pati kering dihaluskan kemudian diayak dengan ayakan 100 mesh. Dari hasil penelitian ini, rendemen pati diperoleh sebesar 20,58%, dimana 100 gram biji durian menghasilkan pati sebanyak 20,58 gram. Gambar pati biji durian ditunjukkan oleh gambar 4.1 dibawah ini.
Gambar 4.1 Pati Biji Durian (Durio Zibethinus)
Karakteristik pati biji durian bertujuan untuk mengetahui presentase komponen yang terkandung di dalam pati yang dihasilkan, meliputi kadar pati (amilum), kadar air, kadar abu, kadar lemak, kadar protein, kadar amilosa dan kadar amilopektin sehingga diketahui kualitas pati yang dihasilkan. Hasil karakteristik pati biji durian disajikan dalam Tabel 4.1 berikut ini.
Tabel 4.1 Hasil Karakteristik Pati Biji Durian
Komponen Pati Biji Durian Kadar (%) Standar Industri Indonesia (%)[52]
Air 15,7 14 Pati 76,6530 75 - Amilosa 22,3365 - - Amilopektin 54,3165 - Abu 0,13 15 Lemak 0,07 - Protein 0,81 - Karbohidrat 81,1 -
4.1.1 Kadar Air Pati Biji Durian
Tujuan dari analisa kadar air adalah untuk menetapkan persentase kandungan air yang terdapat per satuan massa serbuk pati yang diperoleh dari hasil ekstraksi dari biji durian. Kadar air merupakan pemegang peranan penting dalam proses pembusukan dan ketengikan. Kadar air perlu diukur untuk menentukan umur simpan suatu bahan pangan [74]. Pengujian kadar air menggunakan sampel pati biji durian sebanyak 2 gram dan hasil analisa kadar air pati durian diperoleh sebesar 15,7%. Berdasarkan standar mutu pati menurut Standar Industri Indonesia, kadar air yang diizinkan adalah maksimal 14% [75]. Jika dibandingkan dengan kadar air pati menurut Standar Industri Indonesia, kadar air pati biji durian telah mendekati standar.
4.1.2 Kadar Abu Pati Biji Durian
Tujuan dari analisa kadar abu untuk menunjukan kandungan mineral suatu bahan pangan Penentuan kadar abu didasarkan dengan menimbang sisa mineral sebagai hasil pembakaran bahan organik pada suhu sekitar 550o C, lalu didinginkan selama 30 menit didalam desikator dan ditimbang hingga didapatkan berat tetap [76]. Total abu merupakan parameter yang bermanfaat bagi nilai nutrisi dari banyak produk makanan. Kadar abu menunjukan kandungan mineral suatu bahan pangan. Abu didefinisikan sebagai residu yang tertinggal setelah suatu bahan pangan dibakar hingga bebas karbon. Kadar abu suatu bahan pangan menggambarkan banyaknya mineral yang tidak terbakar menjadi zat yang dapat menguap. Komponen yang umum terdapat pada senyawa organik alami adalah kalium, natrium, kalsium, magnesium, mangan, dan besi. Secara kuantitatif nilai kadar abu dalam pati yang dihasilkan berasal dari mineral-mineral dalam biji, pemakaiaan pupuk, dan dapat juga berasal dari kontaminasi tanah dan udara selama pengolahan [56]. Adapun kadar abu yang diperoleh dari pati biji durian adalah sebesar 0,13%. Berdasarkan standar mutu pati menurut standar industri Indonesia, kadar abu yang diizinkan adalah maksimal 15% [77]. Jika dibandingkan dengan kadar abu pati menurut standar industri Indonesia, kadar abu pati biji durian telah memenuhi.
4.1.3 Kadar Lemak Pati Biji Durian
Tujuan analisis kadar lemak adalah untuk mengetahui jumlah kandungan lemak yang terdapat per satuan massa serbuk pati yang diperoleh dari hasil ekstraksi biji durian. Karakterisasi kadar lemak menggunakan 2 gram sampel pati biji durian dan hasil analisapati biji durian diperoleh kadar lemak sebesar 0,07%. Nilai ini lebih rendah dari nilai kadar lemak pati biji durian hasil penelitian sebelumnya oleh Cornelia, dkk., 2013 yaitu sebesar 0,38%. Pada pati, biasanya kadar amilosa berhubungan dengan kadar lemak. Suatu senyawa kompleks bisa terbentuk antara lemak pati dengan amilosa pada granula selama proses swelling, hal ini akan menghambat proses swelling pada semua temperatur [79]. Selain itu keberadaan lemak endogen pada pati memiliki dampak yang merugikan terhadap proses swelling
granula dengan cara menyingkirkan air [80].
4.1.4 Kadar Protein Pati Biji Durian
Tujuan analasi kadar protein untuk menunjukkan analisis kadar nitrogen yang terdapat pada pati [56]. Protein merupakan heteropolimer yang mengandung lebih dari 20 asam amino yang bisa membentuk berbagai macam ikatan intermolekul dan mengalami interaksi yang berbeda-beda [81]. Asam amino yang banyak terdapat pada protein pati biji durian yaitu leusin (30,9-37,3%), penilalanin (3,11-9,04%), lisin (6,04-8,36%), Glisin (6,07-7,42%), dan asam aspartik (6,10-7,19%) [82]. Adapun kadar protein yang diperoleh dari 0,51 gram sampel pati biji durian adalah sebesar 0,81 %. Berdasarkan penelitian sebelumnya, kadar protein pati biji durian adalah sebesar 4,76 %, dimana adanya protein dalam pati biji durian dapat menyebabkan terjadinya reaksi pencoklatan sehingga bioplastik yang terbuat dari pati biji durian berwarna tidak jernih [78]. Kadar protein yang diperoleh lebih rendah dari penelitian sebelumnya.
4.1.5 Kadar Pati Biji Durian
Tujuan dari analisa kadar pati adalah untuk menetapkan persentase kandungan pati (amilum) yang terdapat per satuan massa serbuk pati yang diperoleh dari hasil ekstraksi dari biji durian. Dari hasil penelitian ini, rendemen pati adalah sebesar
20,58%, dimana dari 100 gram biji durian dihasilkan pati kering sebanyak 20,58 gram. Karakterisasi kadar pati menggunakan 5 gram sampel pati biji durian dan hasil analisapati biji durian diperolehkadar pati 86,82 %. Dengan metode yang sama, kadar pati yang diperoleh dari penelitian ini lebih tinggi dari kadar pati pada penelitian Jufri dkk., (2006) yaitu sebesar 68,22% dan penelitian Cornelia dkk., (2013), yaitu sebesar 83,92%. Berdasarkan standar mutu pati menurut Standar Industri Indonesia (SII) tahun 1997, kadar pati yang diizinkan adalah minimum 75%. Jika dibandingkan dengan kadar pati menurut standar industri Indonesia, kadar pati biji durian yang diperoleh telah memenuhi standar.
4.1.6 Kadar Amilosa dan Amilopektin Pati Biji Durian
Pati memiliki komponen penyusun utama, yaitu amilosa dan amilopektin. Tujuan analisa kadar amilosa dan amilopektian bertujuan untuk mengetahui banyaknya fraksi terlarut dan tidak terlarut pati biji durian. Fraksi yang terlarut disebut amilosa dan fraksi yang tidak terlarut disebut amilopektin. Karakterisasi kadar amilosa dan amilopektin menggunakan 100 miligram sampel pati biji durian dan hasil analisa pati biji durian diperoleh kadar amilosa 36,32 % dan kadar amilopektin 50,50 %. Rasio antara amilosa dan amilopektin berdampak pada sifat-sifat fisika-kimia pati, seperti gelatinisasi dan retrodegradasi [83]. Kadar amilosa yang rendah menyebabkan viskositas tinggi dan temperatur pasting yang rendah, sedangkan kadar amilosa yang tinggi menyebabkan viskositas rendah dan temperatur pasting tinggi [84].
4..2 Hasil Fourier Transform Infra Red (FTIR)
4.2.1 Hasil Analisis FTIR Pati Biji Durian, Kitosan, Bioplastik Tanpa Pengisi Kitosan dan Plastisizer Sorbitol, Dan Bioplastik Dengan Pengisi Kitosan Dan Plastisizer Sorbitol
Hasil analisa FTIR (Fourier Transform Infra Red) dilakukan bertujuan mengidentifikasi gugus fungsi dari komponen-komponen penyusun bioplastik dan bioplastik yang dihasilkan. Berikut ini merupakan hasil FTIR yang terdiri dari hasil analisa FTIR pati, kitosan, bioplastik tanpa pengisi kitosan dan plastisizer sorbitol,
dan bioplastik dengan pengisi kitosan dan plastisizer sorbitol yang disajikan pada Gambar 4.2 berikut ini.
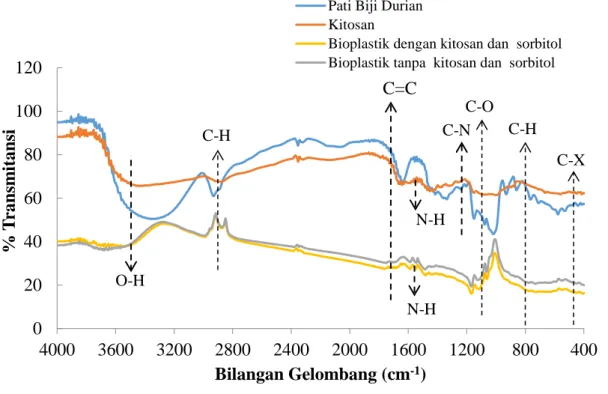
Gambar 4.2 Hasil Analisa Fourier Transform Infra Red (FTIR)
Dari hasil FTIR senyawa pati biji durian dapat dilihat munculnya puncak serapan pada bilangan gelombang 578,64 cm-1 menunjukkan keberadaan gugus C-X klorida. Selanjutnya muncul gelombang-gelombang 759,95 cm-1 dan 856,39 cm-1 yang menunjukkan keberadaan gugus C-H aromatik. Selanjutnya, munculnya puncak serapan pada bilangan gelombang 929,69 cm-1 menunjukkan keberadaan gugus C-H alkena. Kemudian, terdapat munculnya puncak serapan pada bilangan gelombang 1014,56 cm-1, 1149,57 cm-1,dan 1246,02 cm-1 yang merupakan keberadaan gugus C– O eter dan C–O ester. Adanya puncak serapan pada bilangan gelombang 1346,31 cm -1 menunjukkan keberadaan gugus C-N amina. Adanya puncak serapan pada bilangan gelombang 1639,49 cm-1 menunjukkan adanya keberadaan gugus C=C alkena. Adanya puncak serapan pada bilangan gelombang 2931,80 cm-1 menunjukkan adanya keberadaan gugus C-H alkana. Adanya puncak serapan pada bilangan gelombang 3340,71 cm-1 menunjukkan adanya keberadaan gugus ikatan hidrogen
O-0 20 40 60 80 100 120 400 800 1200 1600 2000 2400 2800 3200 3600 4000 % T ran sm itan si Bilangan Gelombang (cm-1)
Pati Biji Durian Kitosan
Bioplastik dengan kitosan dan sorbitol Bioplastik tanpa kitosan dan sorbitol
O-H C-H C=C N-H C-N C-O C-H C-X N-H
Analisis FT-IR dilakukan untuk mengidentifikasi gugus fungsi utama yang terdapat pada pati. Pati memilik struktur utama yaitu amilosa dan amilopektin dan dapat dilihat adanya keberadaan gugus O-H, gugus C-H, dan gugus C-O [85], [86]. Hasil FTIR pati biji durian yang diperoleh telah menunjukkan bilangan gelombang yang menyatakan gugus O-H pada bilangan gelombang 3340,71 cm-1. Gugus C-O eter pada bilangan gelombang 1014,56 cm-1, 1149,57 cm-1,dan 1246,02 cm-1. Gugus C-H ditunjukkan pada bilangan gelombang 759,95 cm-1, 856,39 cm-1, 929,69 cm-1, dan 2931,80 cm-1. Pada gambar 4.3 di bawah ini disajikan struktur sederhana dari pati yang menunjukkan gugus-gugus tersebut.
Gambar 4.3 Struktur Molekul Pati
Selain struktur utama pati yaitu amilosa dan amilopektin, pati memiliki kandungan lainnya yaitu protein dan lemak [87]. Adanya puncak serapan pada bilangan gelombang FTIR pati biji durian menunjukkan keberadaan gugus C-N amina pada bilangan gelombang 1346,31 cm-1. Gugus C-N amina ini diduga berasal dari protein yang terkandung di dalam pati. Protein merupakan polimer dari monomer asam amino. Gambar 4.4 merupakan rumus struktur dari asam amino, dimana pada struktur asam amino tersebut dapat dilihat terdapat gugus amina C-N.
Gambar 4.4 Struktur Molekul Asam Amino
Adanya puncak serapan pada bilangan gelombang FTIR pati biji durian menunjukkan keberadaan gugus C-O ester terdapat pada bilangan gelombang
H H N C R H C O OH
1014,56 cm-1, 1149,57 cm-1,dan 1246,02 cm-1. Pati memiliki kandungan lemak, gugus C-O ester ini diduga berasal dari lemak yang terkandung di dalam pati. Berikut gambar struktur lemak yang menunjukkan adanya gugus ester yang dapat dilihat pada gambar 4.5 di bawah ini.
Gambar 4.5 Struktur Molekul Lemak
Dari hasil analisa FTIR terlihat bahwa kitosan memiliki gugus N-H yang simetris dengan terlihat adanya puncak serapan bilangan gelombang 1589,34 cm-1. Kemudian kitosan juga memiliki gugus C-H alkana dengan terlihat adanya puncak serapan bilangan gelombang 894,97 cm-1 dan 999,13 cm-1. Adanya puncak serapan pada bilangan gelombang 1076,28 cm-1 dan 1149,57 cm-1 menunjukkan adanya keberadaan gugus alkohol, eter, asam karboksilat, dan ester C–O. Adanya puncak serapan pada bilangan gelombang 1315,45 cm-1 menunjukkan adanya keberadaan gugus ikatan amina C-N. Adanya puncak serapan pada bilangan gelombang 1651,07 cm-1 menunjukkan adanya keberadaan gugus ikatan anhidrida C=O. Selanjutnya, terdapat puncak serapan pada bilangan gelombang 2881,65 cm-1 yang menunjukkan keberadaan C-H alkana. Adanya puncak serapan pada bilangan gelombang 3437,15 cm-1 yang menunjukkan keberadaan gugus O–H [88]. Kitosan merupakan suatu senyawa poli (N-amino-2 deoksi β-D-glukopiranosa) atau glukosaamin yang menunjukkan adanya gugus OH, gugus NH2, gugus C=O amida, dan gugus CH3 [89]. Kitosan diperoleh dari proses deasetilasi kitin, pada proses tersebut gugus asetil pada molekul kitin dihilangkan untuk membentuk gugus amino pada kitosan [90].
Dari hasil FTIR bioplatik tanpa kitosan dapat dilihat munculnya puncak serapan pada bilangan gelombang 547,78 cm-1 dan 640,37 cm-1 menunjukkan keberadaan gugus C-X klorida. Selanjutnya, munculnya puncak serapan pada bilangan gelombang 690,52 cm-1, 729,09 cm-1 dan 779,24 cm-1 yang menunjukkan
cm-1 dan 1172,72 cm-1 yang merupakan keberadaan gugus alkohol, eter, asam karboksilat, ester C–O. Adanya puncak serapan pada bilangan gelombang 1485,19 cm-1 dan 1593,20 cm-1 menunjukkan gugus aromatik C=C. Adanya puncak serapan pada bilangan gelombang 2877,79 cm-1dan 2997,38 cm-1 menunjukkan gugus alkana C-H. Adanya puncak serapan pada bilangan gelombang 3691,75 cm-1 menunjukkan gugus ikat hidrogen O-H. Adanya gugus-gugus di atas menunjukkan struktur yang terdapat pada bioplastik tanpa kitosan. Gugus-gugus yang terlihat dari hasil bioplastik tanpa kitosan ini masih memiliki gugus-gugus penyusunnya yaitu gugus dari pati biji durian dan tidak adanya pengisi kitosan juga ditandai dengan tidak adanya gugus amino N-H dari hasil FTIR bioplastik tanpa kitosan ini.
Dari hasil analisa FTIR bioplastik dengan pengisi kitosan dan plasticizer dapat dilihat munculnya puncak serapan pada bilangan gelombang 3541,31 cm-1 dan 3649,32 cm-1 yang merupakan keberadaan gugus O–H alkohol. Adanya puncak serapan pada bilangan gelombang 2877,79 cm-1 dan 2997,38 cm-1 yang merupakan keberadaan gugus C–H alkana. Munculnya puncak serapan pada bilangan gelombang 547,78 cm-1 dan 640,37 cm-1 menunjukkan keberadaan gugus C-X klorida. Munculnya puncak serapan pada bilangan gelombang 725,23 cm-1 yang menunjukkan keberadaan gugusalkena C-H. Adanya puncak serapan pada bilangan gelombang 1118,71 cm-1 dan 1172,72 cm-1 menunjukkan keberadaan gugus alkohol, eter, asam karboksilat, ester C–O. Adanya puncak serapan pada bilangan gelombang 1485,19 cm-1 dan 1546,91 cm-1 menunjukkan gugus aromatic C=C. Adanya puncak serapan pada bilangan gelombang 1546,91 cm-1 menunjukkan gugus primer dan sekunder amina N-H. Adanya puncak serapan pada bilangan gelombang 1693,50 cm -1 menunjukkan keberadaan gugus alkena C=C. Terdapat puncak serapan pada bilangan gelombang 1546,91 cm-1 pada produk bioplastik dengan pengisi kitosan dan
plasticizer gliserol. Bilangan gelombang ini menunjukkan keberadaan gugus NH
[91]. Hal ini menunjukkan bahwa pengisi kitosan telah terdispersi dalam produk bioplastik.
4..3 HASIL SCANNING ELECTRON MICROSCOPE (SEM)
4.3.1 Hasil Analisis Morfologi Permukaan Pati Biji Durian dan Kitosan
Karakteristik morfologi permukaan pati yang telah diekstrask dari biji durian diuji dengan SEM (Scanning Electron Microscope). Hasil SEM yang diperoleh ditunjukkan pada Gambar 4.6 berikut ini.
.
Gambar 4.6 Hasil Analisis SEM dengan Perbesaran 10000 kali (a) Pati biji durian (b) Kitosan
Tujuan analisa SEM ini adalah untuk mengetahui morfologi dan struktur dari permukaan bahan. Dengan mengetahui morfologinya, ini akan membantu dalam menganalisa pengaruhn penambahan pengisi kitosan dan plasticizer sorbitol terhadap karakteristik sifat-sifat mekanik dari bioplastik
Gambar 4.6 (a) menunjukkan hasil analisa SEM partikel pati biji durian yang berukuran 100 mesh dengan perbesaran 10000 kali. Hasil analisa SEM menunjukkan bahwa morfologi pati biji durian memiliki ukuran partikel yang belum cukup seragam. Ini disebabkan pengayakan pati dilakukan dengan ayakan 100 mesh, yang berarti ukuran partikel yang lebih kecil 100 mesh juga berhasil lolos sehingga menyebabkan ukuran partikel belum seragam. Ukuran partikel pada pati biji durian adalah 5,2 µm.
Gambar 4.6 (b) menunjukkan hasil analisa SEM partikel kitosan yang perbesaran 10000 kali. Hasil analisa SEM menunjukkan bahwa morfologi kitosan juga memiliki ukuran partikel yang kurang seragam. Ini disebabkan penghaluskan kitosan dengan blender yang kurang sempurna sehingga menyebabkan ukuran partikel kurang seragam. Ukuran partikel pada kitosan adalah 2,8 µm.
a
b
5,20 µm
Morfologi permukaan pati berbeda-beda tergantung jenis sumber pati tersebut. Hasil analisa SEM pati biji durian yang diperoleh memiliki granula berbentuk semi bulat. Bentuk granula pati ini tidak jauh berbeda dengan hasil penelitian sebelumnya oleh Jufri, dkk., (2006), dengan pengamatan menggunakan mikrograf elektron perbesaran 2000 kali menunjukkan partikel pati biji durian berbentuk granula bulat dengan bagian ujung yang membulat seperti topi baja.
Hasil analisa SEM pati biji durian yang diperoleh pada penelitian ini memiliki ukuran granula pati sebesar 5,20 µm. Dalam penggolongan pati, terdapat dua tipe ukuran granula pati, yaitu ukuran granula kecil (5-10 µm) dan ukuran granula besar (25-40 µm) (Hoseney, 2011). Berdasarkan penggolongan di atas, pati biji durian yang diekstrak termasuk dalam pati ukuran kecil. Granula pati yang berukuran kecil ini diduga dipengaruhi oleh proses penggilingan dan pengayakan yang dilakukan terhadap pati biji durian dalam penelitian ini.
Larutan pati adalah campuran antara pati dengan air. Dan larutan kitosan adalah campuran kitosan, air, dan HCl. Dari gambar 4.6 terlihat bahwa ukuran partikel pada pati memiliki ukuran yg jauh lebih besar dibanding ukuran partikel pada kitosan. Dan juga kerapatan partikel pada pati lebih tinggi dibandingkan pada kitosan. Kerapatan partikel yang tinggi menyebabkan pati memiliki densitas lebih tinggi dibanding kitosan. Oleh karena itu penambahan kitosan dalam pembuatan bioplastik cenderung akan menurunkan nilai densitas dari bioplastik tersebut. Kerapatan partikel pati yang lebih tinggi dibanding kitosan juga mengindikasikan bahwa bioplastik dengan penambahan kitosan memiliki densitas yang lebih rendah atau kerapatan partikel yang lebih rendah. Sehingga bioplastik dengan penambahan kitosan akan semakin mudah menyerap air. Hal ini akan di bahas lebih lanjut pada bab berikutnya.
4.3.2 Hasil Analisis Morfologi Permukaan Patahan Bioplastik dari Pati Biji Durian Tanpa Kitosan dan Sorbitol Serta Patahan Bioplastik dari Pati Biji Durian Dengan Kitosan Dan Sorbitol
Karakteristik morfologi permukaan dari bioplastik yang dihasilkan diuji dengan SEM (Scanning Electron Microscope). Hasil SEM bioplastik disajikan pada Gambar 4.7 dibawah ini.
Gambar 4.7 Hasil Analisis SEM Patahan Bioplastik dari Pati Biji Durian dengan Perbesaran 1000 kali (a) Tanpa Penambahan Kitosan dan Sorbitol (b) Dengan Penambahan Kitosan dan Sorbitol
Pada Gambar 4.7 (a) terlihat adanya titik-titik putih pada bioplastik pati biji durian tanpa kitosan dan sorbitol yang menunjukkan bahwa pati biji durian belum tercampur secara merata di dalam bioplastik yang dihasilkan, namun pada gambar 4.7 (b) tidak ditemukan adanya gelembung udara (void). Adanya permukaan yang tidak rata yang tampak pada gambar merupakan akibat dari tarikan yang dialami bioplastik saat pengujian pengujian tarik. Tarikan yang diberikan pada bioplastik tersebut menyebabkan ikatan dari bioplastik terganggu yang ditandai dengan
Pati tergelatinisasi
a
b.2
b
Gambar 4.7 (a) menunjukkan hasil analisa SEM produk bioplastik dengan tanpa penambahan kitosan. Terlihat adanya titik-titik putih pada bioplastik pati biji durian tanpa kitosan dan sorbitol yang menunjukkan bahwa pati biji durian belum tercampur secara merata di dalam bioplastik yang dihasilkan. Pada gambar (a) patahan dengan perbesaran 1000 kali dapat dilihat bahwa patahan bioplastik tanpa kitosan memiliki morfologi yang tidak rata dan berongga, hal ini diakibatkan adanya tarikan yang dialami bioplastik saat pengujian pengujian tarik. Tarikan yang diberikan pada bioplastik tersebut menyebabkan ikatan dari bioplastik terganggu yang ditandai dengan terbentuknya kerenggangan atau permukaan yang tidak rata. Selain itu, tanpa adanya penambahan kitosan bioplastik yang dihasilkan memiliki kekuatan yang lemah, sehingga kurang tahan terhadap tarikan.
Pada gambar 4.7 (b) terlihat bahwa bioplastik terlihat patahan bioplastik dengan penambahan kitosan dan sorbitol memiliki morfologi yang tidak rata, hal ini diakibatkan adanya tarikan yang dialami bioplastik saat pengujian pengujian tarik. Tarikan yang diberikan pada bioplastik tersebut menyebabkan ikatan dari bioplastik terganggu yang ditandai dengan terbentuknya kerenggangan atau permukaan yang tidak rata.
4.4 KARAKTERISTIK HASIL ANALISA PROFIL GELATINASI DENGAN RAPID VISCO ANALYZER (RVA)
Tujuan analisa Rapid Visco Analyzer (RVA) adalah untuk mengetahui profil gelatinasi dari pati biji durian dan bioplastik. Karakterisasi ini berkaitan dengan pengukuran viskositas pati dengan konsentrasi tertentu selama pemanasan dan pengadukan. Hasil RVA yang diperoleh disajikan pada gambar berikut :
0 1000 2000 3000 4000 5000 6000 7000 0 20 40 60 80 100 120 0 200 400 600 800 1000 1200 1400 1600 T em perat ur ( oC) Waktu (detik) Temperatur Viskositas V iskosit as (cP )
(a)
(b)
(c)
Gambar 4.8 Profil Gelatinisasi yang Diukur dengan RVA a) Pati Biji Durian
b) Bioplastik tanpa Pengisi Kitosan dan Plastisizer
Sorbitol
c) Bioplastik dengan Pengisi Kitosan dan Plastisizer
Sorbitol
Dari gambar 4.8 terlihat hubungan temperatur, waktu dan viskositas pada 3 perlakuan yang berbeda, yaitu gambar (a) pati biji durian, gambar (b) bioplastik tanpa pengisi kitosan dan plastisizer sorbitol, dan gambar (c) bioplastik dengan pengisi kitosan dan plastisizer sorbitol.
Data-data hasil analisa profil gelatinasi pati biji durian disajikan dalam tabel 4.2 dibawah ini, yaitu mencakup nilai Temperatur Gelatinasi, Peak Viscosity, Final
Viscosity, Breakdown, dan Setback 1.
0 1000 2000 3000 4000 5000 6000 7000 8000 0 20 40 60 80 100 120 0 200 400 600 800 1000 1200 1400 1600 T em perat ur ( oC) Waktu (detik) Temperatur Viskositas V iskosi tas (cP) 0 1000 2000 3000 4000 5000 6000 7000 0 20 40 60 80 100 120 0 200 400 600 800 1000 1200 1400 1600 T em perat ur ( oC) Waktu (detik) Temperatur Viskositas V iskosi tas (cP )
Tabel 4.2 Data Profil Gelatinasi Bioplastik tanpa Pengisi Kitosan, dan Bioplastik dengan Pengisi Kitosan dan Plasticizer Sorbitol
Parameter Pati Biji Durian Bioplastik tanpa Pengisi Kitosan Bioplastik dengan Pengisi Kitosan dan Plasticizer Sorbitol Temperatur Gelatinisasi 69,5 °C 69,2 °C 69,6 °C Peak Viscosity 5783 cP 7136 cP 6115 cP Hold Viscosity 3238 cP 967 cP 1598 cP Final Viscosity 5646 cP 3737 cP 3240 cP Breakdown 2545 cP 6169 cP 4517 cP Setback 1 2468 cP 2770 cP 1642 cP
Pada tabel di atas dapat dilihat ada beberapa parameter yang dapat diukur oleh RVA adalah pasting temperature, peak viscosity, hold viscosity, final viscosity,
breakdown viscosity dan setback viscosity [93]. Proses gelatinasi yaitu suatu keadaan
memanaskan pati pada suhu tertentu dengan jumlah air yang berlebih dapat membuat pati menjadi mudah berasosiasi dengan air dimana menyebabkan terjadinya peningkatan swelling power dan viskositas pati. Temperatur pada saat viskositas mengalami kenaikan sebagai tanda mulainya gelatinisasi disebut pasting temperatur
[94], [95]. Viskositas optimum atau Peak Viscosity (PV) adalah parameter yang menunjukkan kemampuan granula pati untuk mengikat air dan mempertahankan pembengkakan selama pemanasan. Selama periode holding sampel masih dipengaruhi oleh sifat mekanis teganan-regangan yang dapat menyebabkan gangguan lebih lanjut terhadap granula pati dan proses leaching amilosa. Viskositas selama periode holding disebut Hold Viscosity (HV). Pada saat sampel didinginkan secara berkala maka viskositas meningkat menjadi Final Viscosity (FV) yang mana terkait dengan proses retrogradasi dan reasosiasi molekul amilosa [95]. Breakdown viscosity
adalah viskositas selisih antara PV dan HV yang menyatakan kestabilan pasta terhadap pemanasan. Breakdown disebabkan oleh perbedaan antara viskositas ketika membengkak, keberadaan granula pati yang telah tergelatinisasi dan viskositas ketika granula pati yang tergelatinisasi terganggu baik sebagian atau seluruhnya. Setback 1 yaitu selisih antara HV dengan FV yang menunjukkan kemampuan pasta pati mengalami retrogradasi yaitu proses pembentukan kembali matriks pati yang telah
mengalami gelatinisasi. Viskositas Setback mengisyaratkan derajat retrodegradasi [96].
Pada Tabel 4. terlihat bahwa pati biji durian mulai mengalami gelatinisasi pada temperatur 69,65 oC. Terdapat beberapa tahapan pada proses gelatinisasi. Tahap pertama, pati dalam air dingin akan menyerap air sampai sekitar 5-30%, proses ini bersifat reversible. Tahap kedua, akibat pemanasan yang diberikan ikatan hidrogen antara amilosa dan amilopektin dalam granula pati mulai putus, sementara energi kinetik molekul air meningkat dan lebih kuat daripada daya tarik menarik antara molekul amilosa dan amilopektin, sehingga air dapat masuk ke dalam granula pati dan granula mulai mengembang. Proses penyerapan air ke dalam granula pati ini bersifat irreversible [97]. Pada proses gelatinisasi tahap kedua ini dimana granula pati membengkak menyebabkan peningkatan yang cepat pada viskositas akan menghasilkan viskositas maksimum yaitu Peak Viscosity (PV) [98]. Makin besar kemampuan mengembang granula pati maka viskositas pasta makin tinggi. Hasil pengukuran RVA pada penelitian ini, PV pati biji durian adalah 5783 cP.
Tahap ketiga gelatinisasi terjadi pengembangan granula lebih besar lagi dan mencapai pengembangan maksimum hingga granula pecah dan menyebabkan bagian amilosa dan sedikit amilopektin berdifusi keluar granula dan terdispersi ke dalam larutan. Pecahnya struktur granula pati menyebabkan penurunan viskositas pasta serta stabilitas viskositas pasta menjadi rendah. Hal ini terjadi ketika pada proses pengukuran dengan RVA, dimana ketika temperatur di pertahankan pada 69,65 oC selama 1,5 menit setelah sebelumnya mencapai viskositas puncak terjadi penurunan viskositas menjadi 3238 cP. Viskositas ini disebut hold viscosity (HV). Perubahan viskositas selama pemanasan pada temperatur konstan ini menunjukkan kestabilan viskositas terhadap pemanasan. Selisih nilai antara PV dan HV adalah nilai viskositas
breakdown 2545 cP. Semakin rendah nilai breakdown menunjukkan pasta yang
terbentuk semakin stabil terhadap panas [99]. Pada saat penurunan suhu, viskositas pasta pati kembali meningkat akibat terbentuknya kembali ikatan hidrogen antara amilosa dan amilopektin [100]. Viskositas hasil pengukuran dengan RVA meningkat menjadi 5646 cP. Viskositas ini disebut viskositas pasta dingin atau Final Viscosity
(FV). Final viscosity atau viskositas akhir menunjukkan kemampuan pati untuk membentuk pasta kental atau gel setelah proses pemanasan dan pendinginan [101].
Perubahan viskositas selama pendinginan ini disebut setback 1 yaitu selisih antara HV dengan FV, yaitu sebesar 2468 cP. Adanya nilai setback ini menunjukkan kemampuan pasta pati mengalami retrogradasi yaitu proses pembentukan kembali matriks pati yang telah mengalami gelatinisasi amilopektin [100]. Molekul-molekul amilosa akan berikatan kembali satu sama lain dengan percabangan amilopektin di luar granula setelah pasta didinginkan [101].
Schoch dan Maywald (1968) menggolongkan pati dalam beberapa tipe berdasarkan sifat amilografi. Pati tipe A memiliki pembengkakan yang besar dengan viskositas puncak yang tinggi diikuti oleh pengenceran yang cepat selama pemanasan, viskositas breakdown yang tinggi, serta viskositas pasta dingin yang lebih rendah dari viskositas puncak. Pati tipe B memiliki pembengkakan yang sedang dengan viskositas pastayang lebih rendah dan lebih tidak encer. Pati tipe C memiliki pembengkakan terbatas dan cenderung tidak memiliki puncak viskositas, tetapi viskositasnya yang tinggi tetap dipertahankan atau meningkat selama pemanasan [50]. Berdasarkan penggolongan di atas, pati biji durian yang diekstrak dalam penelitian ini termasuk ke dalam pasta pati golongan pati A karena memiliki viskositas puncak yang besar 5783 cP, viskositas breakdown yang cukup tinggi 2545 cP, dan viskositas dingin yang lebih rendah 5646 cP.
Pada tabel 4.2 di atas juga disajikan nilai-nilai hasil RVA yang diperoleh dari RVA bioplastik dari pati biji durian dengan penambahan kitosan dan plastisizer
sorbitol dan penambahan kitosan dan plastisizer sorbitol . Temperatur awal gelatinasi bioplastik dengan penambahan kitosan dan plastisizer sorbitol dan penambahan kitosan dan plastisizer sorbitol berturut-turut terjadi pada suhu yang tidak berbeda jauh terhadap suhu gelatinasi pati biji durian yaitu 69,2 oC dan 69,6 oC. Viskositas optimum atau Peak Viscosity (PV) dari bioplastik pati biji durian yang menunjukkan kemampuan granula pati dalam bioplastik untuk mengikat air dan mempertahankan pembengkakan selama pemanasan adalah 7136 cP dan 6115 cP. Nilai ini sangat besar dibanding pati biji durian yang berarti larutan bioplastik cukup kental. Komponen air yang digunakan pada penelitian pembuatan bioplastik ini memang tidak terlalu banyak. Hal ini yang diduga menyebabkan larutan bioplastik cukup kental. Hold Viscosity (HV) dari bioplastik pati biji durian yang menunjukkan penurunan viskositas akibat pembengkakan granula pati yang mencapai maksimum
di dalam larutan bioplastik tanpa kitosan dan dengan kitosan adalah 967 cP dan 1598 cP. Ini berarti terjadi penurunan viskositas yang sangat signifikan. Final Viscosity
(FV) dari bioplastik pati biji durian yang menunjukkan viskositas akhirnya saat kembali membentuk pasta kental setelah proses pemanasan adalah 3737 cP dan 3240 cP. Ini menunjukkan bahwa larutan telah sedikit turun kekentalannya dari awal proses gelatinasi. Breakdown viscosity bioplastik dari pati biji durian yang menyatakan kestabilan pasta terhadap pemanasan adalah 6169 cP dan 4517 cP. Semakin rendah nilai breakdown menunjukkan pasta yang terbentuk semakin stabil terhadap panas [99]. Namun pada nilai di atas terlihat nilai breakdown yang lebih tinggi dari pati biji durin, terlihat bahwa pati biji durian lebih stabil. Setback 1 bioplastik dari pati biji durian yang menunjukkan kemampuan pasta mengalami retrogradasi yaitu proses pembentukan kembali matriks pati yang telah mengalami gelatinisasi saat dalam proses pembuatan bioplastik adalah sebesar 2770 cP dan 1642 cP.
4.5 PENGARUH VARIASI KONSENTRASI HCl SEBAGAI PELARUT
KITOSAN DAN TEMPERATUR PEMANASAN LARUTAN
BIOPLASTIK TERHADAP DENSITAS BIOPLASTIK
Berikut gambar 4.9 yang menunjukkan pengaruh variasi konsentrasi HCl sebagai Pelarut Kitosan dan Temperatur Pemanasan Pati terhadap densitas bioplastik.
Gambar 4.9 Pengaruh Variasi Konsentrasi HCl dan Temperatur Pemanasan sebagai Pelarut Kitosan dan Temperatur Pemanasan Larutan Bioplastik terhadap Densitas Bioplastik
0 ,6 5 1 ,3 6 3 1 ,3 2 2 1 ,1 9 9 0 ,8 7 4 0 ,7 4 1 2 ,3 1 9 2 ,2 2 5 2 ,1 6 3 1 ,4 8 7 1 ,2 8 2 2 ,1 7 0 1 ,6 0 9 1 ,5 2 5 1 ,2 5 0 1 ,1 7 8 1 ,5 4 8 1 ,4 4 3 1 ,3 8 3 1 ,1 9 6 1 ,1 1 6 1 ,3 5 3 1 ,3 2 2 1 ,2 3 3 1 ,0 9 2 0 ,9 8 7 1 ,1 0 9 1 ,0 8 9 1 ,0 0 3 0 ,9 5 9 0 ,6 6 1 0 0,5 1 1,5 2 2,5 70 72,5 75 77,5 80 Densi ta s (g r/m l) Temperatur Pemanasan (ºC) Tanpa Pengisi 0,8% HCl 0,9% HCl 1,0% HCl 1,1% HCl 1,2% HCl 1,3% HCl
Tujuan analisa densitas adalah untuk mengetahui nilai kerapatan partikel pada bioplastik dari pati biji durian.
Gambar 4.9 menunjukkan hubungan variasi konsentrasi HCl sebagai pelarut kitosan dan temperatur pemanasan terhadap densitas bioplastik. Dari gambar 4.9 diatas dapat dilihat nilai densitas bioplastik tertinggi pada masing-masing temperatur pemanasan pada konsentrasi HCl 0,9 %v sebagai pelarut kitosan. Sedangkan densitas terendah pada masing-masing temperatur pemanasan adalah pada konsentrasi HCl 1,3 %v. Dari hasil percobaan yang dilakukan di laboratorium, kelarutan kitosan dalam larutan HCl pada konsentrasi < 0,9 % atau konsentrasi > 0,9 %v dan konsentrasi < 1,3 %v menunjukkan kelarutan yang kurang baik dengan masih adanya serpihan kitosan yang belum terlarut setelah proses pengadukan yang cukup lama.
Dari gambar 4.9 tersebut dapat dilihat adanya pengaruh konsentrasi HCl sebagai pelarut kitosan terhadap densitas bioplastik. Dengan semakin bertambahnya konsentrasi HCl sebagai pelarut kitosan dapat menyebabkan nilai densitas dari bioplastik menjadi menurun. Hal ini disebabkan oleh kelarutan kitosan yang berkurang seiring bertambahnya konsentrasi HCl dari 0,9 %v sampai 1,3 %v. Pada konsentrasi HCl 0,9 %v bioplastik memiliki nilai densitas tertinggi karena kelarutan kitosan paling baik, sehingga dengan adanya penambahan kitosan dapat mengisi dan meningkatkan kerapatan struktur bioplastik. Penentuan rapat massa (densitas) film dilakukan dengan cara film dipotong dengan ukuran dan tebal tertentu, kemudian dihitung volumenya. Potongan film ditimbang dan rapat massa film ditentukan dengan membagi rapat potongan uji dengan volumenya (g/cm3) [14]. Kerapatan merupakan sifat fisik suatu polimer. Kerapatan suatu bahan berpengaruh terhadap sifat mekanik bahan tersebut, semakin rapat suatu bahan maka semakin meningkatkan sifat mekaniknya. Sehingga film bioplastik yang dihasilkan mempunyai kekuatan tarik yang baik. Kerapatan atau densitas ini dapat didefinisikan sebagai berat per satuan volume bahan [62]. Peningkatan sifat mekanik disebabkan oleh meningkatnya kerapatan ikatan sambung silang. Agen ikatan sambung silang akan bereaksi dengan gugus –OH pada pati dan membuat ikatan eter dengan gugus hidroksil yang memungkinkan [102]
Penambahan pengisi dan plasticizer menghasilkan nilai densitas yang lebih besar. Densitas berbanding lurus dengan massa suatu bahan, sehingga semakin besar
massa suatu bahan maka nilai densitas semakin besar [14]. Pengaruh penambahan
plasticizer sorbitol jika dibandingkan dengan plasticizer gliserol adalah semakin
banyak plasticizer yang ditambahkan maka nilai kuat tarik cenderung menurun sedangkan persentase elongation of break cenderung naik dan sorbitol memberikan nilai kuat tarik yang lebih tinggi daripada gliserol, namun memberikan nilai
elongation of break yang lebih rendah daripada gliserol karenasorbitol lebih bersifat
rapuh [15]. Jadi, kitosan dan sorbitol memiliki fungsi penting masing-masing, kitosan meningkatkan kekuatan tarik sehingga densitas juga ikut meningkat, sedangkan sorbitol meningkatkan nilai elastisitas sehingga nilai elongation of break juga ikut meningkat.
Dari gambar 4.9 juga dapat dilihat adanya pengaruh temperatur pemanasan terhadap densitas bioplastik. Densitas meningkat dari suhu 70 oC ke 75 oC lalu terus mengalami penurunan hingga suhu 80 oC pada masing-masing variasi konsentrasi HCl. Proses gelatinasi terbaik terjadi pada suhu 69,6 oC sesuai hasil analisa RVA bioplastik pati biji durian dengan penambahan kitosan dan sorbitol. Keadaan pembuatan bioplastik pada suhu pemanasan yang semakin melewati suhu gelatinasi bioplastik menghasilkan larutan bioplastik yang semakin lama semakin berwarna kecoklatan, semakin jenuh, dan terlalu masak seiring temperatur yang semakin meningkat. Ini mempengaruhi bioplastik yang dihasilkan dimana bioplastik tersebut memiliki densitas yang semakin menurun. Hal ini terlihat ketika pemanasan sudah jauh dari suhu gelatinasi, yaitu pada suhu 75 °C sampai 80 °C densitas semakin menurun.
4.6 PENGARUH VARIASI KONSENTRASI HCL SEBAGAI PELARUT
KITOSAN DAN TEMPERATUR PEMANASAN TERHADAP
PENYERAPAN AIR BIOPLASTIK
Berikut grafik yang menunjukkan pengaruh variasi konsentrasi HCl sebagai Pelarut Kitosan dan Temperatur Pemanasan Pati terhadap Penyerapan Air bioplastik.
Gambar 4.10 Pengaruh variasi Konsentrasi HCl dan Temperatur Pemanasan sebagai Pelarut Kitosan dan Temperatur Pemanasan terhadap Penyerapan Air Bioplastik
Gambar 4.10 menunjukkan hubungan konsentrasi HCl sebagai pelarut kitosan dan temperatur pemanasan bioplastik terhadap penyerapan air bioplastik pati biji durian berpengisi kitosan dan plasticizer sorbitol. Dari gambar 4.10 diatas dapat dilihat nilai penyerapan air tertinggi pada masing-masing temperatur pemanasan adalah pada konsentrasi HCl 1,3 %v, sedangkan pemanjangan saat putus terendah pada masing-masing temperatur pemanasan adalah pada konsentrasi HCl 0,9 %v.
Dari gambar 4.10 tersebut dapat dilihat adanya pengaruh konsentrasi HCl sebagai pelarut kitosan terhadap penyerapan air bioplastik. Uji penyerapan air adalah uji yang dilakukan untuk mengetahui seberapa besar daya serap bahan tersebut terhadap air. Pada bioplastik diharapkan air yang terserap pada bahan sangat sedikit atau dengan kata lain daya serap bahan tersebut terhadap air harus rendah. Secara singkat dapat dikatakan bahwa semakin kecil ukuran partikel pati, semakin rendah tingkat penyerapan air dari film bioplastik yang dihasilkan, namun jika dibandingkan dengan ukuran partikel pati, faktor kecepatan pengadukan sangat mempengaruhi
2 9 ,2 5 12, 033 12, 328 12, 743 13, 557 16, 426 10, 017 10, 819 11, 667 13,055 15, 278 11, 765 13,106 14, 638 15, 231 16, 349 12, 778 13, 262 17, 647 18, 382 19, 583 16, 111 17,429 18, 750 20, 536 21, 528 17, 582 19, 463 22, 708 23, 889 28, 750 0 5 10 15 20 25 30 70 72,5 75 77,5 80 P eny er a pa n Air ( %) Temperatur Pemanasan (ºC) Tanpa Pengisi 0,8% HCl 0,9% HCl 1,0% HCl 1,1% HCl 1,2% HCl 1,3% HCl
tingkat penyerapan air. Hal ini dapat dilihat jika salah satu variabel dibuat konstan antara satu sama lain [62]. Hal ini juga mengindikasikan bahwa semakin tinggi kerapatan partikel, maka semakin menurunkan tingkat penyerapan air. Kerapatan merupakan sifat fisik suatu polimer. Kerapatan suatu bahan berpengaruh terhadap sifat mekanik bahan tersebut, semakin rapat suatu bahan maka semakin meningkatkan sifat mekaniknya. Sehingga film bioplastik yang dihasilkan mempunyai kekuatan tarik yang baik. Kerapatan atau densitas ini dapat didefinisi- kan sebagai berat per satuan volume bahan [62]. Pada gambar terlihat bahwa semakin tinggi konsentrasi HCl maka semakin tinggi pula densitas (kerapatan) nya. Sehingga semakin tinggi konsentrasi HCl juga akan menurunkan tingkat penyerapan air pada bioplastik, karena densitas berbanding terbalik dengan tingkat penyerapan air.
Dari gambar 4.10 diatas dapat dilihat nilai penyerapan air tertinggi pada masing-masing konsenrasi HCl adalah pada temperatur pemanasan 80 oC, sedangkan penyerapan air terendah pada masing-masing konsenrasi HCl adalah pada temperatur pemanasan 70 oC.
Dari gambar 4.10 diatas dapat dilihat adanya pengaruh peningkatan temperatur pemanasan bioplastik terhadap penyerapan air bioplastik. Dengan semakin meningkatnya temperatur dapat menyebabkan nilai penyerapan air dari bioplastik menjadi meningkat. Hal tersebut akibat pengaruh temperatur yang semakin tinggi yang dapat menyebabkan ikatan antar intermolekuler antar pati semakin lemah sehingga mengurangi ikatan hidrogen internal antara rantai polimer sambil meningkatkan ruang molekul. Hal ini didukung oleh penelitian Pamilia, dkk. (2014) yang mengemukakan peningkatan suhu pemanasan akan menurunkan persentase pemanjangan dari edible film [103]. Teori ini mengindikasikan bahwa semakin tinggi suhu pemanasan akan menurunkan densitas dari bioplastik, sehingga kerapatan antar molekul semakin kecil, akibatnya tingkat penyerapan air semakin meningkat.
Jenis dan konsentrasi dari plasticizer yang digunakan akan memberikan pengaruh terhadap kelarutan dari film berbahan dasar pati. Semakin banyak air yang masuk ke dalam struktur pati akan meningkatkan kelarutan dalam air dan asam. Kelarutan dalam air yaitu untuk memprediksi kestabilan bioplastik terhadap pengaruh air. Penambahan sorbitol pada film meningkatkan kelarutan dalam air. Hal
ini karena sorbitol memiliki sifat hidrofil. Pengaruh penambahan plasticizer sorbitol jika dibandingkan dengan plasticizer gliserol adalah semakin banyak plasticizer yang ditambahkan maka nilai kuat tarik cenderung menurun sedangkan persentase
elongation of break cenderung naik dan sorbitol memberikan nilai kuat tarik yang
lebih tinggi daripada gliserol, namun memberikan nilai elongation of break yang lebih rendah daripada gliserol karena sorbitol lebih bersifat rapuh [15]. Jadi, kitosan dan sorbitol memiliki fungsi penting masing-masing, kitosan meningkatkan kekuatan tarik, sedangkan sorbitol meningkatkan nilai elastisitas dan kelarutan terhadap air sehingga penyerapan air juga ikut meningkat.
4.7 PENGARUH VARIASI KONSENTRASI HCL SEBAGAI PELARUT KITOSAN DAN TEMPERATUR PEMANASAN TERHADAP SIFAT MEKANIK BIOPLASTIK
4.7.1 Pengaruh Variasi Konsentrasi HCl sebagai Pelarut Kitosan dan Temperatur Pemanasan terhadap Sifat Kekuatan Tarik Bioplastik
Tujuan analisa kekuatan tarik adalah untuk mengetahui kemampuan maksimum bioplastik dalam menahan gaya atau beban yang diterima.
Berikut grafik yang menunjukkan pengaruh variasi konsentrasi HCl sebagai Pelarut Kitosan dan Temperatur Pemanasan Pati terhadap sifat kekuatan tarik bioplastik.
Gambar 4.11 Pengaruh variasi Konsentrasi HCl dan Temperatur Pemansan sebagai Pelarut Kitosan dan Temperatur Pemanasan terhadap Sifat Kekuatan Tarik Bioplastik
1 ,8 7 2,8 4 2 2 ,6 7 6 2 ,4 3 3 2 ,1 0 6 1 ,7 2 9 1 0 ,6 3 0 9 ,8 1 6 8 ,6 1 3 7 ,5 1 2 5 ,7 8 8 8 ,6 3 2 5 ,9 8 2 4 ,6 5 5 4 ,4 1 0 4 ,2 1 4 4 ,0 1 8 3 ,8 2 2 3 ,7 0 4 3 ,5 0 4 2 ,9 8 9 2 ,8 7 5 2 ,6 4 6 2 ,4 8 3 2 ,4 5 0 2 ,3 5 2 2 ,6 4 6 2 ,2 5 4 2 ,2 3 4 2 ,1 0 7 1 ,4 9 0 0 2 4 6 8 10 12 70 72,5 75 77,5 80 K ek ua ta n T a rik (M P a ) Temperatur Pemanasan(ºC) Tanpa Pengisi 0,8% HCl 0,9% HCl 1,0% HCl 1,1% HCl 1,2% HCl 1,3% HCl
Gambar 4.11 menunjukkan hubungan variasi konsentrasi HCl sebagai pelarut kitosan dan temperatur pemanasan terhadap kekuatan tarik bioplastik. Dari gambar 4.11 diatas dapat dilihat nilai kekuatan tarik bioplastik tertinggi pada masing-masing temperatur pemanasan adalah pada konsentrasi HCl 0,9 %v. Sedangkan kekuatan tarik terendah pada masing-masing temperatur pemanasan adalah pada konsentrasi HCl 1,3 %v. Dari hasil percobaan yang dilakukan di laboratorium, kelarutan kitosan dalam larutan HCl pada konsentrasi > 0,9 %v dan konsentrasi < 1,3 %v menunjukkan kelarutan yang kurang baik dengan masih adanya serpihan kitosan yang belum terlarut setelah proses pengadukan yang cukup lama.
Dari gambar 4.11 kekuatan tarik mengalami penurunan seiring meningkatnya temperatur pemanasan larutan bioplastik dari suhu 70 oC ke 80 oC. Dari hasil RVA bioplastik diketahui bahwa temperatur gelatinasi dari bioplastik dari pati biji durian dengan pengisi kitosan dan plastisizer sorbitol adalah 69,6 oC. Hasil analisa kekuatan tarik menunjukkan bahwa kekuatan tarik mengalami peningkatan seiring suhu pemanasan yang semakin mendekati temperatur gelatinasi bioplastik, sedangkan kekuatan tarik mengalami penurunan seiring suhu pemanasan yang semakin menjauhi temperatur gelatinasi bioplastik.
Dari penelitian yang dilakukan ini, larutan bioplastik yang dihasilkan semakin tinggi temperatur pemanasannya maka larutannya semakin kental. Ini didukung oleh hasil RVA gelatinasi pati pada gambar 4.8 bahwa seiring meningkatnya temperatur dari pasting temperature 69,6 oC terlihat bahwa viskositas terus meningkat yang berarti menunjukkan larutan semakin kental. Pada suhu pemanasan 75 oC, 77,5 oC, dan 80 oC, granula pati diduga seluruhnya telah mengalami gelatinasi sehingga granula pati sudah seluruhnya membengkak dan pecah membentuk larutan dispersi koloid dalam air yang menyebabkan larutan lebih kental. Dengan adanya penambahan sejumlah air dan dipanaskan pada suhu yang tinggi maka akan terjadi gelatinasi. Gelatinasi mengakibatkan ikatan amilosa akan cenderung saling berdekatan karena adanya ikatan hidrogen [104]. Suhu gelatinasi hanya diperlukan dalam pengaktifan awal pemutusan ikatan pada rantai tepung biji durian akibat energi termal dari suhu pemanasan. Proses gelatinasi terjadi ketika granula pati dipanaskan di dalam air, sehingga energi panas yang dihasilkan akan menyebabkan ikatan hidrogen terputus, dan air dapat masuk ke dalam granula pati. Air yang masuk