BAB 3
METODE PENELITIAN
3.1. Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Februari 2016 sampai dengan Maret 2017di Laboratorium Kultur Jaringan dan Laboratorium Genetika, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara, Medan.
3.2. Bahan dan Alat
Bahan tanaman yang digunakan dalam penelitian ini adalah pucuk apikal tanaman kelapa sawit berumur 8-10 bulan yang diperoleh dari Pusat Penelitian Kelapa Sawit (PPKS) Marihat, Pematang Siantar sebagai sumber eksplan. Bahan kimia yang digunakan adalah bahan penyusun media Y3 (Eeuwens, 1976) (Lampiran 2 halaman 33.), α-Naphthaleneacetic acid (NAA), kinetin, HCl 0,1 N, NaOH 0,1N, sukrosa, agar, arang aktif, larutan pemutih (NaOCl 5,25%), deterjen, alkohol 70%, akuades, spiritus, HgCl2, primer SSR,ddH2O steril, agarosa, loading dye,
Bayclin®, Tween® 80, aluminium foil, kertas saring.
Alat yang digunakan pada penelitian ini adalah erlenmeyer, gelas ukur, pipet serologi, propipet, pH meter, autoklaf, Laminar Air Flow Cabinet (LAFC), rak kultur, plastik, karet, botol kultur, shaker, botol selai, alat diseksi, beaker glass, neraca digital, mikroskop, bunsen, cawan petri, kain hitam, mancis, handsprayer, mikropipet, vorteks, alu dan lumpang, freezer, water bath, lemari pendingin, PCR, elektroforesis, mikropipet, sentrifugasi.
3.3. Cara Kerja
3.3.1. Sterilisasi Eksplan
selama 5 menit dan dibilas dengan akuades steril. Tunas direndam dalam HgCl2
0,1% selama 30 menit dan dibilas dengan akuades steril sebanyak tiga kali. Eksplan tunas diletakkan dalam cawan petri dan dikeringkan dengan kertas saring steril. Eksplan diiris ± 0,5 cm secara aseptik dan diinokulasikan ke media kultur.
Gambar 3.1. (a) Bibit Kelapa Sawit, (b) Tunas Apikal Kelapa sawit; TA: Tunas Apikal
3.3.2. Induksi Kalus
Eksplan diinokulasikan ke media Y3 (Euwens, 1976) (Lampiran 2 halaman 33) dengan penambahan 130 mg/L 2,4-D. Kultur diletakkan pada suhu 27 ± 1ºC dalam keadaan gelap dan disubkultur satu bulan sekali pada media yang sama hingga kalus terbentuk (Bayzura, 2014; Astuti, 2014).
3.3.3. Induksi Embrio
Kalus yang telah terbentuk dipindahkan ke media Y3 dengan kombinasi Kinetin 0,5 mg/L dan NAA 0,1 mg/L. Kultur diletakkan di bawah kondisi bercahaya selama 16 jam fotoperiodisme pada suhu 27 ± 1ºC dan disubkultur dua minggu sekali pada media yang sama hingga embrio terbentuk (Thuzar et al., 2011).
3.3.4. Induksi Planlet
Planlet diinduksikan pada media Y3 dengan kombinasi Kinetin sebesar 0; 0,01; dan 0,2 mg/L dan NAA sebesar 0; 0,05; dan 0,1 mg/L. Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) dengan 2 faktorial, yaitu:
a b
TA
Faktor 1 (K) : Perlakuan media Y3 dengan penambahan ZPT Kinetin dengan konsentrasi
K0 : 0 mg/L
K1: 0,1 mg/L
K2 : 0,2 mg/L
Faktor 2 (N) : Perlakuan media Y3 dengan penambahan ZPT NAA dengan konsentrasi
N0 : 0 mg/L
N1 : 0,05 mg/L
N2 : 0,1 mg/L
Sehingga diperoleh kombinasi 9 perlakuan untuk masing-masing kelompok percobaan dengan masing-masing ulangan sebanyak 5 kali. Rincian kombinasi perlakuan sebagai berikut:
K0N0 K1N0 K2N0
K0N1 K1N1 K2N1
K0N2 K1N2 K2N2
Kultur diletakkan dibawah kondisi bercahaya selama 16 jam fotoperiodisme pada suhu 27 ± 1ºC dan disubkultur 2 minggu sekali pada media yang sama (Eeuwens et al, 2002).
3.3.5. Parameter Pengamatan
Perubah yang diamati pada penelitian ini adalah: 1. Waktu Inisiasi Organ
Waktu induksi organ dihitung secara manual mulai dari hari setelah tanam (HST) hingga terbentuknya planlet.
2. Persentase Jumlah Akar
Persentase Jumlah Akar = x 100% 3. Persentase Jumlah Tunas
Persentase Jumlah Tunas = x 100% Jumlah botol yang tumbuh tunas
suatu perlakuan Jumlah total botol percobaan Jumlah botol yang tumbuh akar
3.3.6. VerifikasiVariasi Somaklonal
3.3.6.1. Isolasi DNA
Planlet yang tumbuh dan telah diamati diisolasi DNAnya. Isolasi DNA berdasarkan metode Cetyltrimethylamonium bromida (CTAB) (Doyle & Doyle, 1990) yang dimodifikasi. Planlet 0,4 g digerus dalam lumpang porselen dengan bantuan nitrogen cair. Planlet yang telah halus seperti tepung berwarna putih dimasukkan ke dalam tabung mikro ukuran 2 mL yang berisi 1 mL buffer ekstraksi (100 mM Tris-HCl pH 8, 1,4 M NaCl, 20 mM EDTA, 2% CTAB, 3%
PVP dan 0,2% β-mercaptoetanol) yang telah dipanaskan pada suhu 65ºC. Larutan
bolak-balik sampai terbentuk suspensi dan dipanaskan di dalam water bath suhu 65ºC selama 30 menit dengan catatan setiap 10 menit sampel dikeluarkan dan dikocok manual.
Sampel dibiarkan dingin pada suhu ruang dan dilanjutkan dengan proses pemurnian. Proses pemurnian diawali dengan penambahan Tris-Phenol : Kloroform : Isoamilalkohol (25:24:1) dengan volume yang sama dan disentrifus dengan kecepatan 10.000 rpm selama 15 menit pada suhu 4ºC. Supernatan dipindahkan ke tabung mikro baru dan dimurnikan lagi dengan larutan kloroform : isoamilalkohol (24:1) dengan volume yang sama dan dibiarkan selama 45 menit serta dibolak-balik secara teratur. Larutan disentrifus dengan kecepatan 10.000 rpm selama 15 menit pada suhu 4ºC. Supernatan diambil dengan pipet dan dipindahkan ke tabung mikro yang baru. DNA diendapkan dengan penambahan 1/10 kali volume sodium asetat (pH 5,2) dan 3 kali volume etanol absolut dingin, dibolak-balik beberapa kali. DNA tersebut diinkubasi pada suhu -20ºC selama 3 jam dan disentrifugasi dengan kecepatan 10.000 rpm selama 15 menit pada suhu 4ºC. Supernatan dibuang sedangkan pelet diambil dan dibersihkan dengan 500 µL alkohol 70%. Tahap selanjutnya DNA dikeringanginkan atau divakum pada suhu 37ºC selama 10 menit. DNA yang telah kering dilarutkan dengan 50 µ L akuabides (ddH2O) steril.
3.3.6.2. Uji Kualitas dan Kuantitas DNA
DNA hasil ekstraksi kemudian diukur konsentrasinya dengan menggunakan alat Nanophotometer (IMPLEN P-360 NanoPhotometer P-Class). Larutan blanko yang digunakan adalah ddH2O. Pengukuran konsentrasi DNA
pada panjang gelombang 260 nm. Konsentrasi DNA dihitung dengan rumus A260
x 50 x faktor pengenceran. Pengukuran kemurnian DNA dilakukan dengan membandingkan absorben 260/280 (A260/280). DNA yang murni mempunyai
A260/280 = 1,8 hingga 2. Uji kualitas dan kuantitas juga dilakukan dengan
elektroforesis pada 1% gel Agarosa.
3.3.6.3. Amplifikasi DNA dengan Teknik SSR
Amplifikasi pita DNA menggunakan GoTaq® Green Master Mix (Promega, USA) dan mengikuti protokol yang disarankan oleh perusahaan tersebut (Lampiran 3 Halaman 34) serta menggunakan 3 primer SSR yang terdapat pada Tabel 3.1 (Singh et al., 2007). Hasil PCR dielektroforesis pada 1,8% gel agarosa, tegangan listrik 70 V, kuat arus 500 mA selama 90 menit. Hasil elektroforesis diwarnai dengan ethidium bromida (1 µg/mL) dan divisualisasikan dengan Gel Documentation (UVItec, Cambridge).
Tabel 3.1. Nama Lokus, Motif Ulangan, Urutan Primer dan Suhu Annealing Nama
P4T12a (GA)8 F: GTTATTTGAGAGAGAGAGAGAG 52°C
R: TGCCACTACGTGAAGAAGATAAAG
3.4. Analisis Data
Data yang diperoleh selanjutnya dianalisis dengan uji F pada taraf 5%. Jika perlakuan berpengaruh nyata maka dilanjutkan dengan uji Duncan dengan bantuan software SPSS versi 22.Data biner pita DNA diproses dengan bantuan software NTSYS (Rohlf, 2000) sehingga dihasilkan pohon dendogram kesamaan
BAB 4
HASIL DAN PEMBAHASAN
Penelitian ini menggunakan parameter pengamatan waktu inisiasi planlet, rata-rata jumlah akar dan rata-rata jumlah tunas dan dilanjutkan dengan melihat perubahan genetik planlet dengan teknik SSR.
4.1. Induksi Kalus dari Eksplan Tunas Apikal Kelapa Sawit (Tahap 1)
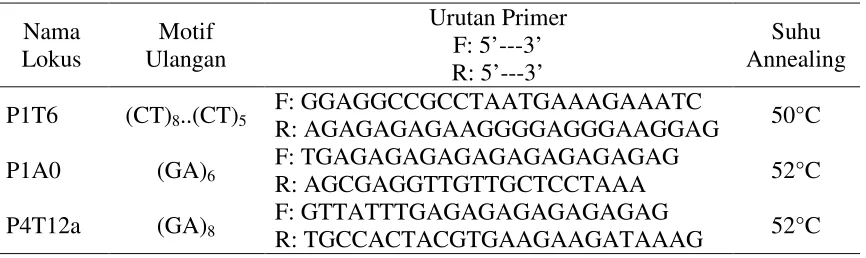
Eksplan tunas apikal kelapa sawit yang ditanam pada media Y3 dengan penambahan 2,4-D 130 mg/L dapat menginduksi pertumbuhan kalus selama 90 HST (Gambar 4.1.). Hal ini menunjukkan bahwa 2,4-Dmampu menginduksi pertumbuhan kalus pada kelapa sawit (Eeuwens et al., 2002; Abdullah et al., 2005).Feher et al., (2003) menambahkan bahwa 2,4-D memiliki dua faktor yang bekerja langsung sebagai auksin dan pada jenis tanamandalam konsentrasi tertentu dapat menyebabkan stres. Menurut Gaj (2004) dibandingkan dengan jenis auksin lainnya, 2,4-D paling banyak digunakan pada induksi embrio somatik. Hal ini disebabkan 2,4-D memiliki daya aktivitas kuat dan dalam konsentrasi rendah mampu menginduksi kalus endosperm (Thomas & Chaturvedi, 2008).
Gambar 4.1. Kultur tunas apikal kelapa sawit (a) Eksplan tunas apikal pada media Y3 + 2,4-D 130 ppm (b) Kalus embrionik tunas.
Kalus yang tumbuh berwarnaputih kekuningan, bentuk nodular dan memiliki struktur kompak. Kalus yang memiliki ciri-ciri seperti ini merupakan kalus embrionik.Menurut Peterson & Smith (1991), Thuzar et al., (2012) dan
Pereira et al., (2013) kalus embrionik yang berasal dari meristem apikal kelapa sawit berwarna putih kekuningan dan mengkilat. Kasi & Sumaryono (2006) dan Bayzura (2014) mendapatkan warna kalus embrionik dari famili Arecaceae pada umumnya berwarna kekuningan.
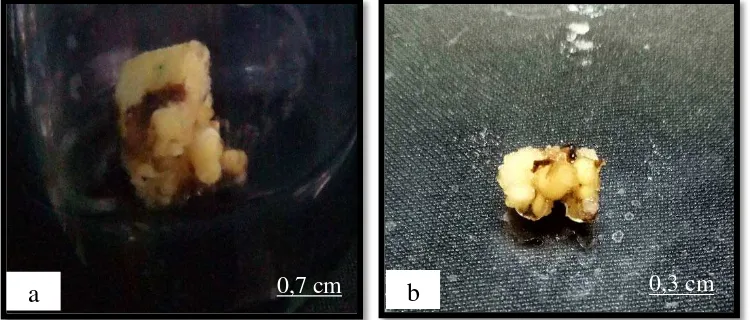
4.2. Induksi Embrio dari Eksplan Tunas Apikal Kelapa Sawit (Tahap 2)
Kalus embrionik yang diperoleh dilakukan induksi embrio somatik pada media Y3 dengan penambahan kinetin 0,1 mg/L dan NAA 0,05 mg/L. Embrio somatik terbentuk 90 HST(Gambar 4.2.). Hal ini menunjukkan bahwa kombinasitersebut mampu merangsang pertumbuhan kalus embrionik. Menurut Sahrawat dan Chand (2009) perubahan keseimbangan hormon dalam sel terhadap zat pengatur tumbuh (ZPT) auksin dan sitokinin menentukan proses diferensiasi. Kombinasi perlakuan perbandingan antara auksin dan sitokinin sangat mempengaruhi dalam menentukan tipe morfogenesis (Decruse et al., 2003).
Gambar 4.2. Morfologi embrio somatik (a) kalus dan embrio somatik selama 90 hari setelah tanam (b) embrio somatik fase globular selama 90 hari setelah tanam.
Karunaratne & Periyapperuma (1990) mendapatkan embrio somatik pada kultur dalam media yang mengandung auksin rendah (2,4-D 0,001 mg/L) dan sitokinin yang tinggi (kinetin 0,002 mg/L) yang berbentukglobular, bertekstur kompak, bulat, bipolar, permukaan rata dan berwarnah putih. Gaj (2001) melaporkan bahwa embrio somatik yang dapat dicirikan dengan struktur bipolar, yaitu mempunyai dua calon meristem, yaitu meristem akar dan meristem tunas. Struktur tersebut lebih menguntungkan dari pada pembentukan tunas adventif.
4.3. Waktu Organogenesis dari Eksplan Tunas Apikal Kelapa Sawit (Tahap
Perlakuan)
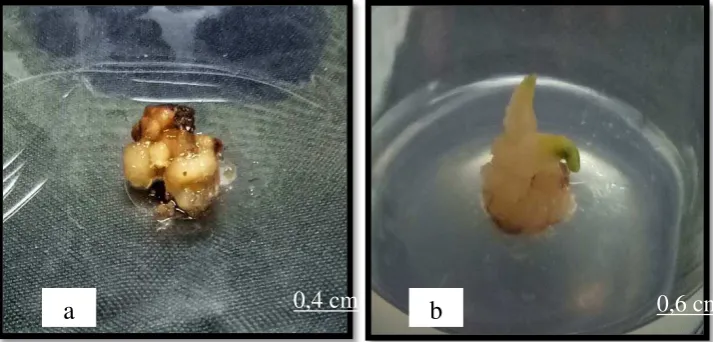
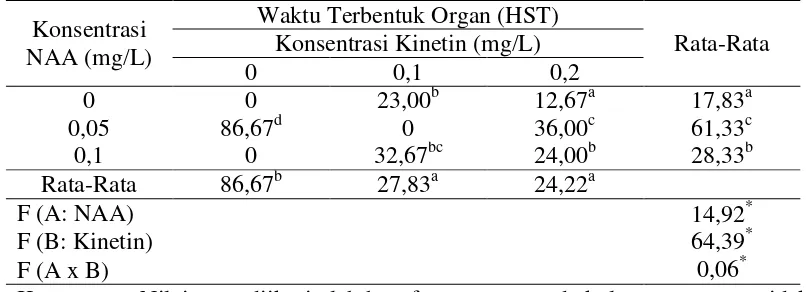
Waktu organogenesis dihitung secara manual dari awal penanaman embrio somatik pada media Y3 dengan penambahan kombinasi NAA dan kinetin yang berbeda pada tiap perlakuan hingga mulai terbentuk organ selama 100 hari pengamatan (Gambar 4.3.). Organ mulai terbentuk pada 12–86 hari setelah tanam (Tabel 4.1.).
Gambar 4.3. Respon in vitro dari tunas apikal kelapa sawit (a) akar dari eksplan tunas apikal kelapa sawit (b) tunas dari eksplan tunas apikal kelapa sawit; R=Akar, S=tunas.
Tabel 4.1 Rata-rata tumbuh planlet dari eksplan tunas apikal kelapa sawit dengan konsentrasi NAA dan kinetin yang berbeda.
Konsentrasi NAA (mg/L)
Waktu Terbentuk Organ (HST)
Rata-Rata
Keterangan: Nilai yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji Duncan.
Perlakuan dengan konsentrasi kinetin 0,2 mg/L tanpa NAA dapat menginduksi pertumbuhan planlet tercepat yaitu 12,67 HST. Hal ini menunjukkan bahwa NAA memperlambat pertumbuhan planlet. Demikian pula pada perlakuan NAA 0,05 mg/L tanpa kinetin dapat menginduksi pertumbuhan planlet. Namun
a 0,4 cm b 0,5 cm
R
pertumbuhan pada perlakuan NAA tanpa kinetin terjadi begitu lambat yaitu 86.67 HST. Hasil yang sama dilaporkan oleh Karjadi dan Buchory (2007) bahwa induksi planlet dengan zat pengatur tumbuh BAP 2,5 dan 7,5 mg/L tanpa penambahan NAA mengalami pertumbuhan tinggi dibandingkan dengan penambahan NAA tinggi planlet cenderung menurun. Kumari et al., (2013) menambahkan bahwa konsentrasi kinetin 2,0 mg/L dan NAA 0,1 mg/L mampu menginduksi pertumbuhan planlet tercepat pada tanaman Dendrobium sonia.
Hal serupa juga terjadi pada perlakuan kombinasi antara NAA dan kinetin. Interaksi antara NAA dan kinetin juga berpengaruh nyata terhadap waktu tumbuh planlet selama 24,00 HST, namun masih lebih rendah dibandingkan dengan perlakuan yang diperkaya kinetin. Hal ini menunjukkan bahwa zat pengatur tumbuh kinetin berperan dalam proses morfogenesis planlet dari tunas apikal kelapa sawit. Sitokinin berfungsi untukmerangsang pembelahan sel tanaman dan berinteraksi dengan auksin dalam menentukan arah diferensiasi sel. Selain itu, sitokinin berperan dalam induksi dan perkembangan dari jaringan meristematik yang membantu formasi organ dan berperan dalam mengatur dan berhubungan luas dengan aktivitas-aktivitas dan pola morfogenesis (Wareing & Phillips, 1970; Gardner et al., 2008; Zulkarnain, 2009 dan Seyyedyousefi et al., 2013)
4.4. Rata-rata Jumlah Akar
Rata-rata jumlah akardiamati selama 100 HST. Akar yang terbentuk dari embrio somatik asal tunas apikal kelapa sawit tumbuh pada beberapa perlakuan saja. Pada perlakuan kinetin tunggal dan kombinasinya dengan NAA terbentuk akar paling banyak dibandingkan dengan perlakuan NAA tunggal yang tidak ada pertumbuhan akar (Tabel 4.2.).
Tabel 4.2 Rata-rata jumlah akar yang muncul pada tingkat konsentrasi NAA dan kinetin yang berbeda.
Perlakuan dengan konsentrasi kinetin0,2 mg/L tunggal menginduksi pembentukan akar paling banyak dibandingkan dengan perlakuan lainnya dengan rata-rata jumlah akar sebanyak 4,00.Widiastoety (2014) menyatakan bahwa pembentukan akar berhubungan dengan kandungan auksin dan sitokinin endogen dalam jaringan tanaman yang diikuti dengan pemanjangan dan perbesaran sel. Pembentukan akar juga dipengaruhi oleh intensitas cahaya. Intensitas cahaya rendah dapat merangsang zat pengatur tumbuh endogen untuk bekerja lebih aktif dalam merangsang pertumbuhan dan perkembangan akar. Kondisi terang berpengaruh nyata terhadap perbaikan kemampuan regenerasi planlet. Auksin dalam jaringan tanaman dapat bekerja aktif walaupun dalam keadaan gelap, tetapi sintesis auksin berlangsung dalam keadaan terang (Urdiroz et al., 2004).
Namun hasil dari perlakuan kinetin lebih banyak mengalami pertumbuhan akar dibandingkan pada konsentrasi auksin. Hal ini dapat disebabkan oleh zat pengatur tumbuh eksogen yang terdapat pada embrio somatik asal tunas apikal kelapa sawit. Menurut Hartati (2010) bahwa setiap tanaman mempunyai kemampuan yang berbeda-beda dalam menyerap zat pengatur tumbuh untuk merangsang pertumbuhannya. Akar tanaman tumbuh dan berkembang mengikuti respon dan ketersediaan unsur hara dan status zat pengatur tumbuh khususnya auksin (Angestiwi, 2007).
4.5. Rata-rata Jumlah Tunas
Tabel 4.3 Rata-rata jumlah tunas yang muncul pada beberapa tingkat konsentrasi NAA dan kinetin
Konsentrasi NAA (mg/L)
Jumlah Tunas
Rata-Rata Konsentrasi Kinetin (mg/L)
0 0,1 0,2
0 0 1,00 0 1,00
0,05 0 0 1,67 1,67
0,1 0 1,00 0 1,00
Rata-Rata 0 1,00 1,67
Huetterman dan Prece (1993) melaporkan bahwa sitokinin berpotensi dalam memacu frekuensi regenerasi dan memacu pembentukkan tunas adventif pada beberapa jenis tumbuhan. Selain itu, mampu menginduksi proses pembelahan sel secara cepat pada kumpulan sel meristem sehingga terbentuk primordia tunas (George & Sherington, 1984). Fereol et al., (2002) menambahkan bahwa auksin umumnya menghambat pertumbuhan tunas, sedangkan kombinasi konsentrasi sitokinin tinggi dengan auksin rendah penting dalam pembentukan tunasdan daun. Dalam kultur jaringan kedua zat pengatur tumbuh ini terbukti berperan dalam menunjang pertumbuhan jaringan apabila digunakan dengan konsentrasi yang tepat.
Konsentrasi antara sitokinin dan auksin yang berbeda akan mengakibatkan modus pertumbuhan yang berbeda, meskipun memiliki rasio yang sama (Zulkarnain, 2007). Khalegi et al., (2008) menambahkan bahwa konsentrasi sitokinin yang semakin tinggi mengakibatkan penurunan jumlah tunas yang berdampak pada dominansi apikal, serta penambahan NAA dalam konsentrasi rendah diperlukan untuk primordia tunas.
4.6. Analisis Perubahan Genetik Planlet dari Eksplan Tunas Apikal Kelapa
Sawit
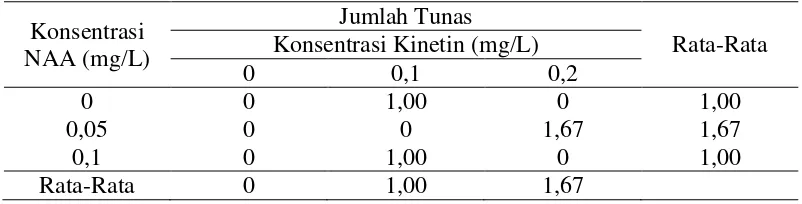
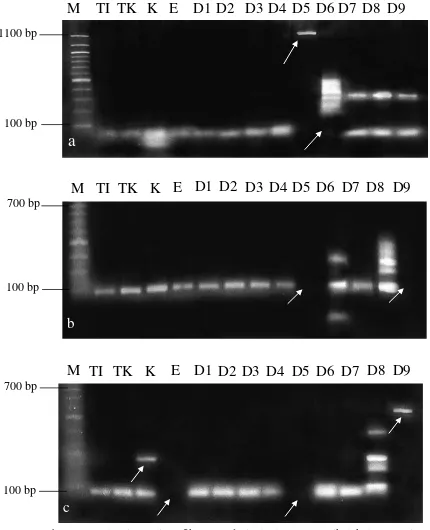
Gambar 4.4. Pola pita polimorfik DNA dari planlet tunas apikal kelapa sawit dengan primer SSR: (a) Primer P1A0, (b) Primer P4T12a dan (c) Primer P1T6, (M=Marker 100 bp, (TI)=Tanaman Induk, (TK)=Tanaman Abnormal hasil Kultur Jaringan, K=Kalus, E=Embrio, D1=K0N0 (Kinetin dan NAA 0 mg/L), D2=K0N1 (NAA 0,05 mg/L), D3=K0N2 (NAA 0,1 mg/L), D4=K1N0 (kinetin 0,1 mg/L), D5=K1N1 (kinetin 0,1 mg/L dan NAA 0,05 mg/L), D6=K1N2 (kinetin 0,1 mg/L dan NAA 0, 1 mg/L), D7=K2N0 (kinetin 0,2 mg/L), D8=K2N1 (kinetin 0,2 mg/L dan NAA 0,05 mg/L), D9=K2N2 (kinetin 0,2 mg/L dan NAA 0,1 mg/L) dan tanda = perubahan pita DNA)
a
TI
TK
K
E
D1
D2 D3 D4 D5 D6
D7 D8 D9
TI
TK
K
E
D1
D2
D3
D4
D5
D6
D7
D8
D9
700 bp
100 bp 1100 bp
100 bp
TI
TK
K
E
D1
D2
D3
D4
D5
D6
D7
D8
D9
700 bp
100 bp
M
M
M
b
Hasil amplifikasi menggunakan primer P1A0, P4T12a dan P1T6 menunjukkan bahwa primer dapat mendeteksi perubahan genetik pada tanaman hasil klon kelapa Sawit. Hal ini ditunjukkan pada primer P1A0 pada perlakuan K1N1 (kinetin 0,1 mg/L dan NAA 0,05 mg/L) mengalami perubahan pita DNA pada ukuran 1100 bp, K1N2 (kinetin 0,1 mg/L dan NAA 0,1 mg/L) mengalami perubahan pita DNA pada ukuran 100 bp, K2N0 (kinetin 0,2 mg/L), K2N1 (kinetin 0,1 mg/L dan NAA 0,05 mg/L), dan K2N2 (kinetin 0,2 mg/L dan NAA 0,1 mg/L) mengalami perubahan pita DNA yaitu muncul pita baru pada ukuran 300 bp. Menurut Singh et al. (2007) bahwa primer P1A0, P4T12a dan P1T6 mampu mendeteksi perubahan genetik antara ortet (tanaman induk yang digunakan sebagai sumber eksplan untuk perbanyakan tanaman pada teknik kultur jaringan) dengan organ yang telah terbentuk dari hasil klon tanaman kelapa sawit. Pada primer P4T12a mengalami perubahan pada perlakuan K1N1 (kinetin 0,1 mg/L dan NAA 0,05 mg/L) tidak terdapat pita, K1N2 (kinetin 0,1 mg/L dan NAA 0,1 mg/L) dan K2N1 (kinetin 0,2 mg/L dan NAA 0,05 mg/L) mengalami penambahan pita DNA pada ukuran 200 bp dan pada perlakuan K2N2 (kinetin 0,2 mg/L dan NAA 0,1 mg/L) tidak terdapat pita DNA. sedangkan pada primer P1T6 pada perlakuan K (kalus) mengalami penambahan pita DNA pada ukuran 300 bp. Perlakuan E (embrio) dan K1N1 (kinetin 0,1 mg/L dan NAA 0,05 mg/L) tidak terdapat pita DNA. Pada perlakuan K2N1 (kinetin 0,2 mg/L dan NAA 0,05 mg/L) mengalami penambahan pita pada ukuran 300 bp dan 400 bp dan pada perlakuan K2N2 (kinetin 0,2 mg/L dan NAA 0,1 mg/L) mengalami perubahan pita DNA pada ukuran 500 bp.
Berbeda dengan tanaman abnormal hasil kultur jaringan (TK) yang tidak mengalami perubahan pita pada hasil amplifikasi. Hal ini menujukkan ketiga primer tersebut tidak efektif dalam melihat perubahan genetik pada tanaman induk dan tanaman abnormal hasil kultur jaringan. Berbeda dengan hasil perlakuan dengan kombinasi kinetin dan NAA yang mengalami perubahan genetik dari pola pita yang terbentuk.
sekuens DNA. Menurut Bayzura (2014) perubahan genetik dapat disebabkan karena penambahan 2,4-D dalam konsentrasi yang tinggi dan juga lamanya interval subkultur. Euwens et al., (2002) menambahkan bahwa lamanya subkultur yang dilakukan selama tahap pengkulturan klon kelapa sawit mempunyai kecenderugan meningkatkan abnormalitas pembungaan kelapa sawit.
Banyak faktor yang mempengaruhi perubahan genetik hasil klon dari kultur jaringan, yaitu sumber eksplan, pemilihan konsentrasi zat pengatur tumbuh yang digunakan dan banyaknya dilakukan subkultur selama masa kultur (Karp, 1995). Jones (1991) dan Paranjothy et al., (1993) menyatakan bahwa abnormalitas yang terjadi pada klon kelapa sawit disebabkan oleh gangguan pada ekspresi gen yang dipengaruhi fitohormon. Menurut Griffth et al., (1993) dan Kumar (1995) keragaman genetik pada kultur jaringan disebabkan oleh penggandaan jumlah kromosom (fusi dan endomitosis), perubahan struktur kromosom, perubahan gen dan sitoplasma.
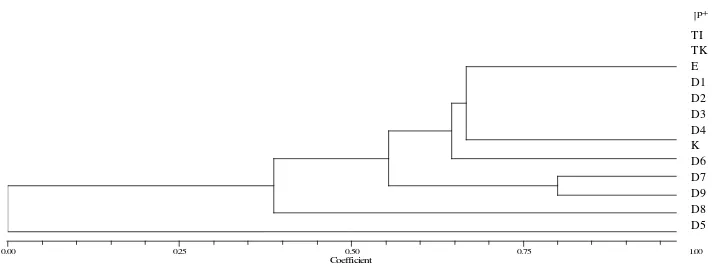
Perubahan genetik yang terjadi pada planlet dari eksplan tunas apikal kelapa sawit juga dapat dilihat dari pohon dendogram (Gambar 4.5.)
Gambar 4.5. Pohon dendogram kemiripan genetik planlet dari tunas apikal kelapa sawit.
Hasil dari pohon dendogram memperlihatkan seluruh planlet mengelompok pada nilai koefisien kemiripan 0,39. Hal ini menunjukkan bahwa seluruh organ hasil kultur jaringan dari eksplan tunas apikal kelapa sawit mengalami perubahan genetik sebesar 61%. Sanputawong & Te-Chato (2011) melaporkan bahwa tanaman hasil klon kelapa sawit mengalami perubahan genetik yang disebabkan oleh penambahan auksin dicamba sebesar 1 mg/L yang diamplifikasi dengan delapan primersimple sequence repeat(SSR) yaitu EgCIR008, EgCIR0243, EgCIR0337, EgCIR0409, EgCIR0446, EgCIR0465, EgCIR0781 dan EgCir00905.
Coefficient
0.00 0.25 0.50 0.75 1.00
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
a. Konsentrasi kinetin 0,2 mg/L tunggal mampu menginduksi pertumbuhan planlet tercepat yaitu 12,67 HST.
b. Semua primer dapat mendeteksi perubahan genetik planlet dari tunas apikal kelapa sawit. Primer P1A0 paling banyak mendeteksi perubahan genetik planlet dari eksplan tunas apikal kelapa sawit.
c. Pada perlakuan K1N1 (kinetin 0,1 mg/L dan NAA 0,05 mg/L) mengalami perubahan genetik yang paling banyak diantara perlakuan yang lain.
5.2 Saran
a. Sebaiknya dilakukan penelitian lebih lanjut mengenai konsentrasi zat pengatur tumbuh yang lebih bervariasi dan frekuensi subkultur dalam mendeteksi perubahan genetik planlet dari eksplan tunas apikal kelapa sawit.