BAB III
METODE PENELITIAN
3.1 Jenis Penelitian
Penelitian ini merupakan jenis penelitian dasar dengan menggunakan metode deskriptif, yaitu untuk menganalisis hubungan kekerabatan antar anggota familia Solanaceae dengan cara merekonstruksi pohon filogenetik berdasarkan siuken DNA daerah ITS.
3.2 Sampel Penelitian
Sampel pada penelitian ini adalah sebanyak dua puluh spesies tumbuhan dari sebelas genus anggota familia Solanaceae. Familia Convolvulaceae, Apocynaceae, dan Plantaginaceae digunakan sebagai outgroup. Pemilihan familia Convolvulaceae sebagai outgroup didasarkan pada penelitian Stefanovic et al., (2002, hlm. 1510) yang menyatakan bahwa Convolvulaceae merupakan sister group dari familia Solanaceae. Sedangkan Plantaginaceae, dan Apocynaceae dipilih sebagai outgroup karena memiliki kekerabatan yang dekat dengan familia Solanaceae (Melotto-Passarin et al., 2008, hlm. 91; Haston et al., 2009, hlm. 161). Sikuen DNA daerah ITS untuk genus
Capsicum dan Withania diperoleh dari genbank dengan alamat http://www.ncbi.nlm.nih.gov/. Daftar tumbuhan yang digunakan pada penelitian ini tercantum dalam Tabel 3.1.
Tabel 3.1 Tumbuhan yang Digunakan dalam Penelitian
No
1 Physalis angulata Ciplukan Ingroup Ujung Berung
2 Solanum nigrum Leunca Ingroup UPI
3 Solanum wrightii Karundung Ingroup UPI dan Dago
4 Solanum lycopersicum Tomat Ingroup UPI & Ujung
(1) (2) (3) (4) (5)
6 Solanum melongena Terong ungu Ingroup Ujung Berung
7 Nicotiana tabacum Tembakau Ingroup Ujung Berung
8 Brugmansia suaveolens Kecubung orange Ingroup UPI
9 Brugmansia candida Kecubung putih Ingroup UPI
10 Brunfelsia uniflora Manacá Ingroup UPI
11 Cestrum nocturnum Kembang dayang Ingroup UPI
12 Solanum pseudocapsicum Leunca kuning Ingroup UPI
13 Capsicum annum Cabai merah Ingroup Genbank
14 Withania somnifera Ashwagandha Ingroup Genbank
15 Datura metel Kecubung ungu Ingroup Cihideung
16 Petunia grandiflora Petunia Ingroup Cihideung
17 Nicandra physalodes Ciplukan keras Ingroup UPI
18 Cestrum cultum Kembang dayang Ingroup Dago
19 Physalis peruviana Ciplukan Ingroup Dago
20 Solanum tuberosum Kentang Ingroup Cimahi
21 Plantago major Ki sendok Outgroup UPI & Dago
22 Allamanda cathartica Alamanda Outgroup UPI
23 Ipomoea cairica Bunga terompet Outgroup UPI
3.3 Lokasi Penelitian
Penelitian ini dilakukan di Laboratorium Mikrobiologi Departemen Pendidikan Biologi Fakultas Pendidikan Matematika dan Ilmu Pengetahuan Alam Universitas Pendidikan Indonesia, Bandung. Sikuensing hasil amplifikasi DNA daerah ITS dari sampel-sampel tumbuhan dilakukan di Macrogen Inc., Seoul-Korea.
3.4 Alat dan Bahan
Tabel 3.2 Alat-alat yang Digunakan dalam Penelitian
No Alat Fungsi
1 Autoclave Sterilisasi
2 Mikropipet Mengambil larutan
3 Tabung mikro Tempat isolasi DNA dan penyimpanan DNA genom
4 Tabung PCR Tempat penyimpanan amplikon
5 Lumpang dan alu Menghaluskan sampel
6 Vorteks Menghomogenkan larutan
7 Timbangan digital Mengukur masa bahan
8 Spatula Mengambil bahan
9 Penangas air dan shaker Shocking saat isolasi DNA
10 Shaker Mencampurkan larutan
11 Mesin sentrifugasi Memisahkan fasa larutan
12 Freezer Menyimpan sampel
13 Spektrofotometer Mengukur konsentrasi DNA
14 Microwave Memanaskan bahan
15 Mesin elektroforesis Memisahkan sampel DNA 16 UV transluminator Melihat hasil elektroforesis
17 Mesin PCR Amplifikasi
18 Magnetic Stirrer with Hot Plate Menghomogenkan larutan
Bahan-bahan yang digunakan dalam penelitian beserta fungsinya terdapat pada Tabel 3.3.
Tabel 3.3 Bahan-bahan yang Digunakan dalam Penelitian
No Bahan Fungsi
1 Kit isolasi DNA tumbuhan Isolasi DNA
2 Nitrogen cair Menghaluskan sampel
3 Buffer TAE Penyangga untuk elektroforesis DNA
4 ddH2O Melarutkan bahan
5 RNAse Mendegradasi molekul RNA
6 Agarose Media untuk mengelektroforesis DNA
7 DNA ledder Penanda ukuran pita DNA
8 Loading dye Pemberat dan pewarna molekul DNA 9 EtBr Pewarna DNA pada proses elektroforesis
10 Larutan TE Melarutkan bahan
11 PCR master mix Campuran bahan-bahan untuk amplifikasi 12 Primer ITS-5 dan ITS-4 Pembatas fragmen DNA target saat
amplifikasi
terdapat dalam lampiran III.
3.5 Prosedur Kerja
3.5.1. Sampling
Sampel tumbuhan didapatkan dari beberapa daerah di Bandung, diantaranya Ujung Berung, Dago, Cihideung, dan Setiabudhi, serta Kota Cimahi. Secara garis besar morfologi tumbuhan diamati dan didokumentasikan. Sampel yang diambil dari tiap-tiap tumbuhan yaitu daun muda, disimpan di dalam kantung plastik, diberi label, dan disimpan di dalam box berisi es. Selanjutnya di laboratorium, sampel tumbuhan disimpan di dalam freezer pada suhu -20°C. Penyimpanan sampel tumbuhan pada suhu dibawah 0°C ini dimaksudkan untuk menjaga DNA sampel agar tidak rusak.
3.5.2. Isolasi DNA Genom
DNA tumbuhan anggota suku Solanaceae diisolasi menggunakan kit dari Thermo Scientific. Tahapan isolasi DNA menggunakan protokol dari kit tersebut dengan sedikit modifikasi (Gambar 3.1). Sebanyak 100 mg daun muda dihaluskan di dalam lumpang dan alu yang berisi nitrogen cair hingga daun muda tersebut berbentuk serbuk. Selanjutnya, serbuk daun muda dimasukkan ke dalam tabung mikro berisi 350 µl lysis buffer A, kemudian sampel dihomogenkan menggunakan vorteks selama lima belas detik. Sampel yang telah homogen ditambahkan lysis buffer B dan RNAse, masing-masing sebanyak 50 µl dan 5 µl. Sampel diinkubasi di dalam penangas air bersuhu 65°C selama sepuluh menit. Selama inkubasi, sampel dihomogenkan menggunakan shaker dalam penangas.
Setelah diinkubasi, sampel diangkat, kemudian ditambahkan
kecepatan 14.000 rpm. Supernatan yang diperoleh dari hasil sentrifugasi dipindahkan kedalam tabung mikro baru kemudian diberi larutan plant
gDNA binding solution dan etanol 96%, masing-masing sebanyak 400 µl, selanjutnya dihomogenkan dengan cara membolak-balikkan tabung mikro.
Sebanyak setengah volume sampel (600-700 µl) dimasukkan ke dalam spin column with collection tube dan disentrifugasi selama satu menit dengan kecepatan 8.000 rpm. Cairan yang terdapat pada bagain bawah dari collection tube dibuang. Hal yang sama dilakukan untuk sisa volume sampel lainnya. Setelah semua sampel disaring pada spin column, ditambahkan wash buffer I sebanyak 500 µl dan disentrifugasi selama satu menit dengan kecepatan 8.000 rpm. Setelah disentrifugasi, cairan yang berada dibawah
collection tube dibuang. Ditambahkan wash buffer II sebanyak 500 µl kedalam spin column, kemudian disentrifugasi selama tiga menit dengan kecepatan 14.000 rpm. Setelah itu, tabung dikosongkan dan dispin kembali selama satu menit dengan kecepatan 14.000 rpm.
dihaluskan
(13) Supernatan dipindahkan ke microtube baru
(14) 400µl Plant gDNA Binding Solution (15) 400µl Etanol 96%
(16) Dihomogenkan dengan cara membolak-balik tabung (17, 20) 600-700µl larutan dipindahkan
ke dalam spin column
(31) Inkubasi di suhu ruangan
sela a ’
(32) Disentrifugasi kec. 10.000rpm
(33) 50µl Elution Buffer
3.5.3 Pengukuran Konsentrasi dan Kemurnian DNA
Sebanyak 1 µl DNA hasil isolasi ditambahkan 499 µl ddH2O,
kemudian dihomogenkan. Konsentrasi dan kemurnian DNA genom diukur dengan menggunakan spektrofotometer pada panjang gelombang 260 dan 280Å. Konsentrasi dan kemurnian DNA yang diperoleh dihitung menggunakan rumus :
[DNA] = A x 50 x faktor pengenceran Kemurnian DNA = A260 x A280
Keterangan :
A = Nilai absorbansi pada panjang gelombang tertentu
3.5.4 Elektroforesis
Gel agarose dibuat dengan konsentrasi 1% dalam buffer TAE, dididihkan dalam microwave hingga campuran terlihat bening. Gel agarose dituangkan ke dalam cetakan gel lengkap dengan sisir yang dipasang dengan posisi tegak dan berjarak 0,5-1 mm dari dasar cetakan. Selanjutnya, gel dibiarkan mengeras pada suhu ruang.
Sampel DNA disiapkan dan ditambahkan loading dye dengan perbandingan 3:2, kemudian dimasukkan kedalam sumur gel yang berada di dalam alat elektroforesis berisi buffer TAE 1x. Proses elektroforesis dilakukan selama 120 menit dengan daya 100 volt. Gel agarose kemudian direndam dalam EtBr selama 5 menit dan H2O selama 2 menit. Hasil
elektroforesis diamati dibawah lampu UV dan didokumentasikan (Hidayat, 2014, hlm. 5).
3.5.5 Amplifikasi DNA daerah ITS
Amplifikasi DNA daerah ITS mengacu pada Hidayat & Pancoro (2001 dalam Muchtar, 2008, hlm. 27) dengan beberapa modifikasi. Komposisi larutan untuk amplifikasi DNA daerah ITS yaitu 25µl PCR master mix dengan konsentrasi akhir 1x, primer ITS-5 dan ITS-4 masing-masing sebanyak 1,25 µl dengan konsentrasi akhir 0,25 µM, DNA genom sebanyak 5 µl, dan ditambahkan ddH2O hingga volume akhir larutan PCR
mengacu pada Hidayat et al. (2008, hlm. 17). Amplifikasi dimulai dengan denaturasi awal pada suhu 95°C selama 2 menit (1 siklus), selanjutnya 35 siklus yang terdiri dari denaturasi pada suhu 95°C selama 30 detik,
annealing pada suhu 57°C selama 2 menit, dan ekstensi pada suhu 71°C selama 2 menit. Tahapan amplifikasi diakhiri oleh 1 siklus final extension pada suhu 71°C selama 10 menit. Hasil amplifikasi dielektroforesis pada gel agarosa 1% yang dilarutkan dalam buffer TAE 1x (Muchtar, 2008, hlm. 27).
3.5.6 Sikuensing DNA
Sebanyak 21 produk amplifikasi disikuensing di Macrogen Inc., Korea Selatan menggunakan primer ITS-4 (5’
-CCCGCCTGACCTGGGGTCGC-3’) dan ITS-5 (5’-TAGAGGAAGGAGAAGTCGTAACAA-3’) dengan
menggunakan mesin ABI377A dan pewarnaan dengan kit ABI PRISMTM Dye Terminator.
3.5.7 Analisis Data
3.5.7.1 Contig
Terdapat dua set data urutan basa nukleotida yang diperoleh dari hasil sikuensing untuk setiap sampel hasil isolasi DNA daerah ITS. Satu set data berasal dari sikuensing menggunakan primer ITS-5 dan satu set data lainnya berasal dari hasil sikuensing menggunakan primer ITS-4. Dilakukan contig menggunakan software CodonCode Aligner untuk kedua data tersebut. Pada saat proses contig, terdapat daerah overlap dari masing-masing data. Hasil yang diperoleh adalah urutan DNA daerah ITS secara lengkap. Penggunaan kedua primer tersebut adalah untuk meminimalisir kesalahan baca yang dilakukan mesin sequencer.
3.5.7.2 Verifikasi Data Hasil Sikuensing
genus diambil satu sikuen DNA daerah ITS dari genbank untuk dijadikan sebagai sikuen DNA pembanding.
3.5.7.3 Pencarian Daerah ITS
Pencarian daerah ITS yang terdiri dari ITS-1; 5,8S; dan ITS-2 dilakukan menggunakan program BLAST dengan alamat http://blast.ncbi.nlm.nih.gov/Blast.cgi. Pencarian dilakukan dengan penjajaran DNA sampel yang telah dicontig dengan DNA pembanding dari genbank. Hasil yang didapatkan adalah letak urutan basa dimana daerah ITS-1; 5,8S; dan ITS-2 sampel berada. Selanjutnya, urutan tersebut dicatat rangenya dan dihitung jumlahnya sehingga didapatkan urutan basa beserta jumlah dari daerah ITS sampel.
3.5.7.4 Editing Data
Dilakukan pembentukan pohon filogeni terhadap data yang telah melalui proses editing. Pembentukan pohon filogeni menggunakan software Mega versi 4, dengan memilih menu bootstrap test of phylogeny dan maximum parsimony untuk mengetahui nilai bootstrap dari pohon filogeni yang terbentuk.
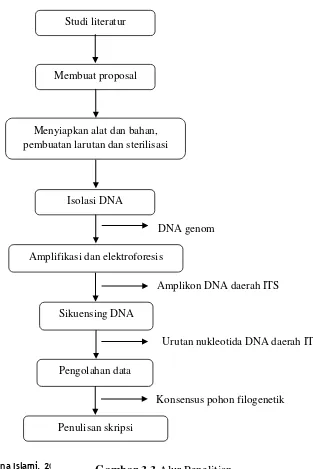
3.6 Alur Penelitian
Gambar 3.3 menunjukkan tahapan-tahapan serta hasil yang didapatkan dari masing-masing langkah pada penelitian ini.
Studi literatur
Membuat proposal
Menyiapkan alat dan bahan, pembuatan larutan dan sterilisasi
Isolasi DNA
Amplifikasi dan elektroforesis
Sikuensing DNA
Pengolahan data
Penulisan skripsi
DNA genom
Amplikon DNA daerah ITS
Konsensus pohon filogenetik