BAB I PENDAHULUAN
Acinetobacter selama tiga dekade terakhir telah berkembang dari organisme yang
dipertanyakan patogenitasnya menjadi penyebab infeksi yang penting di rumah sakit.1
Acinetobacter mulai dikenal sebagai patogen di rumah sakit pada akhir tahun 1970an,
namun jarang terjadi dan masih sensitif terhadap antimikroba secara umum sehingga mudah diobati.2 Tahun 1991 menjadi perhatian awal di mana terjadi wabah yang
disebabkan multidrug resistant (MDR) Acinetobacter dalam rumah sakit di New York. Sekarang, MDR Acinetobacter telah dilaporkan di seluruh dunia.3 Rumah sakit di
berbagai tempat seperti Amerika Utara, Eropa, Argentina, Brazil, China, Taiwan, Hong Kong, Jepang, Korea, dan bahkan area terpencil seperti Tahiti di Pasifik Selatan melaporkan kasus MDR Acinetobacter baumannii.4 Infeksi nosokomial di ICU,
khususnya pneumonia, berhubungan dengan Acinetobacter pada 10-30% kasus, dibandingkan hanya 2-4% pada 15 tahun yang lalu.3
Di antara semua species dalam genus Acinetobacter, Acinetobacter baumannii merupakan species yang paling penting. Tahun 2004, Centers for Disease Control and
Prevention (CDC) melaporkan bahwa A.baumannii berperan pada sekitar 80% dari
seluruh infeksi Acinetobacter.2 A.baumannii biasanya lebih resisten terhadap berbagai
antibiotik dan infeksinya sering lebih berat dibanding species Acinetobacter yang lain. Selain itu, kemampuannya untuk bertahan lama dalam lingkungan rumah sakit menjadikannya potensial untuk penyebaran nosokomial.5
Resistensi A.baumannii terhadap antibiotik terjadi dengan cepat. Awal tahun 1990an ditemukan strain pertama yang resisten carbapenem, kemudian diikuti munculnya
strain yang resisten terhadap semua antibiotik kecuali colistin pada tahun 1998. A.baumannii bahkan sekarang berhasil mengembangkan resistensi terhadap semua
antibiotik termasuk colistin, obat yang sebelumnya aktif secara global melawan patogen ini.6 Hal ini menyebabkan A.baumannii menjadi perhatian besar. Infectious Diseases
Society of America (IDSA) menyebutkan A.baumannii sebagai salah satu dari patogen
Pemilihan terapi inisial melawan infeksi A.baumannii menjadi hal yang sulit mengingat berbagai jenis resistensi antibiotik terhadap patogen ini. Data pola sensitivitas institusi lokal yang ada dapat membantu untuk pemilihan antibiotik empirik. Kemudian, terapi definitif diberikan dengan interpretasi yang cermat dari hasil kultur dan sensitivitas.5 Karena langkanya antibiotik baru, perhatian juga ditujukan untuk
mengoptimalkan obat yang tersedia. Strategi ini termasuk kombinasi antibiotik, antibiotik yang diberikan pada lokasi sumber infeksi (contoh intrathecal, intraventricular, inhalasi), maupun infus antibiotik yang diperpanjang lama pemberiannya.7
BAB II
ASPEK MIKROBIOLOGI
Acinetobacter merupakan bakteri cocobacillus gram negatif dengan bentuk antara batang
(bacillus) dan bulat (coccus) pada pengecatan gram.8 Karena bentuknya batang pendek
dan gemuk, Acinetobacter bisa salah diidentifikasi sebagai coccus gram negatif.5 Selain
itu, bakteri ini juga cenderung dapat mempertahankan kristal ungu sehingga bisa salah diidentifikasi sebagai coccus gram positif.9 Acinetobacter bersifat nonmotil, berkapsul,
dan aerob. Koloninya berdiameter 1-2 mm, berbentuk kubah dengan permukaan halus dan tidak berpigmen.3
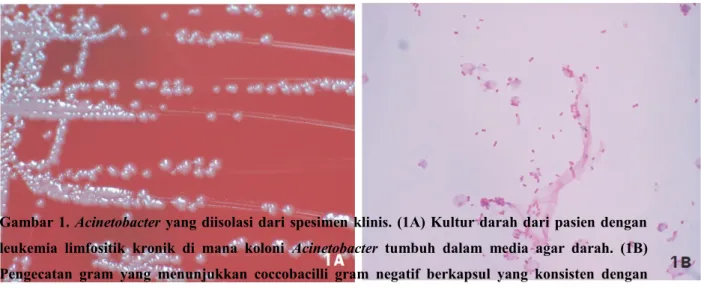
Gambar 1. Acinetobacter yang diisolasi dari spesimen klinis. (1A) Kultur darah dari pasien dengan leukemia limfositik kronik di mana koloni Acinetobacter tumbuh dalam media agar darah. (1B) Pengecatan gram yang menunjukkan coccobacilli gram negatif berkapsul yang konsisten dengan
Acinetobacter.3
Acinetobacter dapat menyerupai bakteri lain seperti Neisseria atau Moraxella
pada pengecatan gram. Reaksi oksidase negatif berguna untuk membedakannya, ditambah pemeriksaan lain yang dapat dilihat pada tabel 1.9
Sejarah Acinetobacter dimulai pada tahun 1911 ketika Martinus Willem Beigerinck, seorang mikrobiologis dari Belanda, menemukan bakteri gram negatif aerob tidak beragi yang diisolasi dari tanah yang mengandung kalsium asetat. Organisme ini dinamakan Micrococcus calcoaceticus.2,5 Penamaan genus sekarang, Acinetobacter (dari
bahasa Yunani, akinetos, yang berarti nonmotil) diusulkan oleh Brisou dan Prevot pada tahun 1954 untuk membedakannya dengan genus Achromobacter yang motil. Baumann et al kemudian mempublikasikan survei komprehensif dan menyimpulkan bahwa ada beberapa species yang dapat digolongkan dalam satu genus Acinetobacter.5
Pada tahun 1986, pasangan peneliti Bouvet dan Grimont membagi 12 grup DNA dari Acinetobacter menggunakan DNA-DNA hybridization sehingga mendapatkan berbagai species termasuk A.baumannii.2 Genus Acinetobacter saat ini terdiri dari 40
lebih species, di mana A.baumannii (Acinetobacter species 2), Acinetobacter species 3 dan Acinetobacter species 13TU merupakan yang terpenting secara klinis karena menjadi penyebab mayoritas infeksi Acinetobacter. Ketiganya dikelompokkan sebagai
A.baumannii complex karena tidak bisa dibedakan dengan tes laboratorium rutin dan
secara klinis sering disebut sebagai A.baumannii kecuali disebutkan terpisah.10,11
DNA-DNA hybridization dianggap sebagai gold standard untuk mengidentifikasi A.baumannii complex dengan tepat, sementara metode lain berusaha dikembangkan dan divalidasi.10
Metode yang paling sering digunakan termasuk pulse-field gel electrophoresis dan PCR dengan spektrometri.11 A.baumannii merupakan species yang paling sering didapatkan
pada kebanyakan area (Tabel 2). Sama seperti A.baumannii, Acinetobacter species 3 dan
13TU juga menjadi patogen nosokomial penting sesuai laporan adanya sejumlah wabah
di ICU yang disebabkan kedua species ini.10 Akhir-akhir ini, Acinetobacter species 3
disebut sebagai A.pittii dan 13 TU disebut sebagai A.nosocomialis.11
Habitat alami Acinetobacter berada di tanah, air, binatang, maupun manusia.1,8
Acinetobacter memiliki ketahanan hidup yang lama di lingkungan, serupa dengan Staphylococcus aureus dan lebih baik dibanding bakteri gram negatif lain.6 Sebagai
contoh, kemampuan A.baumannii hidup pada permukaan kering di lingkungan ICU bisa mencapai 13 hari (10 hari lebih lama dibanding bakteri gram negatif lain).2 Oleh karena
itu, patogen ini berpotensi menyebabkan kontaminasi intensif di lingkungan rumah sakit, yang umum terjadi saat terjadi wabah.Kebutuhan nutrisi yang sederhana, bervariasinya sumber karbohidrat yang bisa digunakan dan kemampuannya tumbuh dalam suhu dan pH yang berbeda-beda menjelaskan ketahanan hidup yang lama dari bakteri ini.6
Pada manusia, Acinetobacter dapat mengkolonisasi kulit, konjungtiva, faring, traktus gastrointestinal, uretra, dan vagina.9 Area yang lembab seperti axilla, paha, atau
perineum menjadi tempat yang baik untuk kolonisasi bakteri ini.6 Oleh karena
Acinetobacter merupakan flora komensal gram negatif yang paling umum ditemukan di
kulit pasien dan petugas rumah sakit, bakteri ini berpotensi menjadi reservoar infeksi di rumah sakit pada situasi epidemik dan endemik.6,9
BAB III
ASPEK EPIDEMIOLOGI
Infeksi Acinetobacter telah dikenal sejak lama di negara tropis, menjadi problem selama perang dan bencana alam, serta menyebabkan wabah di banyak rumah sakit.1 Oleh karena
itu, banyak studi epidemiologi yang berusaha menjelaskan infeksi akibat patogen ini. Di daerah tropis dan subtropis seperti Australia dan Hong Kong, Acinetobacter diketahui sebagai penyebab infeksi terutama di ICU.3 CDC juga melaporkan bahwa
infeksi nosokomial akibat Acinetobacter meningkat pada musim panas dibanding musim lainnya. Penjelasan yang mungkin adalah udara lebih hangat dan lembab mendukung pertumbuhan Acinetobacter pada habitat alaminya, serta adanya kontaminan lingkungan, seperti condensate unit AC, yang telah dilaporkan menjadi suatu penyebab infeksi
Acinetobacter epidemik.1 Acinetobacter juga diketahui merupakan organisme gram
negatif yang paling umum mengkolonisasi kulit petugas rumah sakit, termasuk perawat ICU, sehingga meningkatkan kejadian infeksi nosokomial.3 Selain infeksi nosokomial,
Acinetobacter juga telah dilaporkan di Australia dan Asia sebagai penyebab infeksi yang
didapat di komunitas. Infeksi ini ditandai adanya carrier di faring, pneumonia agresif, berhubungan dengan alkohol dan kanker, dan mortalitas yang tinggi.1
Beberapa bencana menunjukkan Acinetobacter harus dimasukkan sebagai diagnosis banding etiologi infeksi jaringan lunak setelah paparan lingkungan tropis. Setelah tsunami di Asia Tenggara pada 24 Desember 2004, 17 orang dengan trauma berat dievakuasi ke Jerman. MDR Acinetobacter diisolasi dari 20% luka, darah, dan sekret saluran nafas pasien-pasien tersebut. Setelah pengeboman di Bali tahun 2002, pasien yang terinfeksi A.baumannii dengan luka bakar ditransfer ke Swiss dan dianggap menjadi sumber kontaminasi dan wabah di ICU.1
Peran infeksi Acinetobacter selama perang mulai diketahui tahun 1955 dari laporan bloodstream infection (BSI) pada militer perang Korea. Selama perang Vietnam, dilaporkan 63 tentara dengan infeksi jaringan lunak akibat Acinetobacter. Terakhir, infeksi A.baumannii dilaporkan pada personel militer Amerika Serikat yang terluka di Timur Tengah. Hasil evaluasi menunjukkan bahwa banyak yang menjadi sumber infeksi
Acinetobacter, termasuk makanan lokal, kontaminasi luka di medan perang, penyebaran
lingkungan, dan infeksi silang antar rumah sakit.1
Permasalahan infeksi Acinetobacter semakin besar dengan timbulnya resistensi antibiotik di banyak negara. Di Amerika Serikat, data dari National Nosocomial Infection
Surveillance System dari 1986 sampai 2003 menunjukkan peningkatan strain Acinetobacter yang resisten terhadap amikacin (5% ke 20%), ceftazidime (25% ke 68%),
dan imipenem (0% ke 20%).5 Infeksi MDR Acinetobacter juga telah menjadi masalah
serius di ICU beberapa negara Asia. Insidennya meningkat di Thailand, China, Hong Kong, Taiwan, dan Malaysia.3 Rumah sakit di berbagai tempat seperti Amerika Utara,
Eropa, Argentina, Brazil, China, Taiwan, Hong Kong, Jepang, Korea, dan bahkan area terpencil seperti Tahiti di Pasifik Selatan semuanya telah melaporkan kasus MDR
A.baumannii.4 Bahkan, di rumah sakit di Asia dan Timur Tengah, sejumlah wabah
pandrug-resistant A.baumannii telah didokumentasikan.5 Dari penelitian di unit neonatal
RS Dr.Cipto Mangunkusumo Jakarta tahun 2010-2011, kultur darah yang melaporkan adanya isolat A.baumanni semuanya termasuk strain MDR. Sensitivitas terhadap berbagai antibiotik sangat rendah dengan kisaran 0-21%, termasuk ampicillin-sulbactam (16%), meropenem (16%), dan amikacin (21%).12 A.baumannii ditemukan berupa strain MDR
pada 72% kasus di rumah sakit tersier di Terengganu tahun 2011 dengan resistensi carbapenem sekitar 75% dan polymyxin B sebesar 25,9%.13 Gambaran luasnya masalah
resistensi antibiotik dapat dilihat pada gambar 2 yang menunjukkan sejumlah negara yang telah melaporkan wabah akibat A.baumannii resisten carbapenem.5 The Meropenem
Yearly Susceptibility Test Information Collection (MYSTIC) merupakan studi surveilans
yang melibatkan 100 lebih pusat medis di Eropa, Amerika, dan Asia untuk memonitor aktivitas in vitro meropenem dan antibiotik spektrum luas lainnya. Acinetobacter termasuk patogen yang sensitivitasnya rendah terhadap meropenem, yaitu 45,7%, dibandingkan P.aeruginosa (85,4%) dan Enterobactericeae (97,3%).14
Gambar 2. Negara-negara yang melaporkan wabah A.baumannii resisten carbapenem. Warna merah menandakan wabah dilaporkan sebelum tahun 2006, warna kuning menandakan wabah dilaporkan setelah tahun 20065
A.baumannii mempunyai sejumlah faktor virulen. Faktor-faktor ini termasuk
perlekatan yang menetap pada permukaan padat dan kering, kemampuan mendapat nutrisi esensial seperti besi, kemampuan adhesi pada sel epitel, serta kemampuan dari beberapa strain untuk menghasilkan gelatinase dan proteinase yang merusak jaringan pejamu.
A.baumannii juga mempunyai kemampuan untuk membentuk biofilm yang berperan
dalam proses kolonisasi. Biofilm merupakan agregasi mikroorganisme di mana sel melekat satu sama lain atau pada permukaan berupa matriks yang dibentuk sendiri. Biofilm membuat bakteri resisten terhadap desinfeksi sekaligus juga mengijinkan sel untuk saling bertukar gen resistensi.2 Meskipun begitu, faktor-faktor virulensi ini lebih
jarang dibanding bakteri gram negatif lain. Akibatnya, A.baumannii lebih dianggap sebagai patogen oportunis.6 Tanpa adanya gangguan pada mekanisme pertahanan tubuh,
peran patogen ini pada infeksi manusia tetap terbatas.9
Faktor-faktor risiko untuk infeksi dan atau kolonisasi A.baumannii yang berhubungan dengan fasilitas kesehatan diidentifikasi oleh Fournier dan Richet, meliputi : skor Acute Physiology and Chronic Health Evaluation (APACHE) II tinggi, durasi perawatan, perawatan di bangsal dengan endemisitas Acinetobacter tinggi, nutrisi enteral, larutan parenteral yang terkontaminasi, pemberian produk darah, terapi antibiotik sebelumnya (carbapenem, fluoroquinolone, cephalosporin generasi ketiga,
aminoglycoside) dan prosedur seperti bedah, ventilasi mekanik, dan penggunaan kateter.8
Selain itu, infeksi A.baumannii juga bisa didapatkan dari komunitas. Faktor-faktor risikonya termasuk alkohol, merokok, penyakit paru kronik, diabetes mellitus, dan tinggal di daerah tropis.9
Infeksi Acinetobacter mempengaruhi baik morbiditas maupun mortalitas. Peningkatan mortalitas secara signifikan terjadi pada bakteremia A.baumannii bila dibandingkan dengan bakteri gram negatif lain. Hasil yang lebih buruk juga terjadi pada pasien yang terinfeksi A.baumannii di komunitas daripada yang terinfeksi di rumah sakit, termasuk insiden tinggi bakteremia, ARDS, DIC, dan kematian.5 Mortalitas pada infeksi
MDR Acinetobacter termasuk tinggi, dengan rentang 26-68%. Namun sulit dibuktikan bahwa kontribusi infeksi ini independen terhadap mortalitas karena biasanya pasien mengalami penyakit dasar yang berat dan dirawat di ICU. Ada studi lain yang tidak mendapatkan bahwa infeksi Acinetobacter independen terhadap peningkatan mortalitas. Kemungkinan penjelasan untuk hal ini adalah infeksi Acinetobacter merupakan petanda mortalitas yang meningkat pada pasien dengan penyakit dasar yang berat, namun bukan prediktor independen. Infeksi Acinetobacter juga dihubungkan juga dengan meningkatnya morbiditas dan hari perawatan di rumah sakit. Infeksi MDR Acinetobacter ditemukan secara signifikan memperpanjang masa perawatan di ICU (6 hari) maupun rata-rata perawatan di rumah sakit (18 hari).15
BAB IV
MANIFESTASI KLINIS
Manifestasi klinis infeksi Acinetobacter memiliki spektrum yang luas, termasuk pneumonia, bakteremia, infeksi saluran kemih, endocarditis, peritonitis, meningitis, infeksi kulit dan jaringan lunak (Gambar 3).3 Dari semuanya, manifestasi yang paling
sering adalah pneumonia dan blood stream infection (BSI). Acinetobacter menyebabkan 1% dari semua episode bakteremia dan 3% dari semua episode pneumonia dalam rumah sakit di Amerika Serikat menurut CDC dan National Nosocomial Infection Surveillance (NNIS).6 Di hampir semua sistem organ, Acinetobacter dapat menyebabkan infeksi yang
bersifat supuratif.9
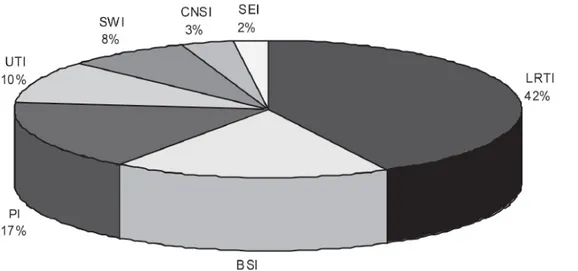
Gambar 3. Lokasi utama infeksi Acinetobacter di ICU (dari Larson E). LRTI: lower respiratory tract
infection; BSI: bloodstream infection; PI: peritoneal infection; UTI: urinary tract infection; SWI: surgical wound infection; CNSI: central nervous system infection; SEI: skin and eye infection3
Tiga species yang paling penting secara klinis (A.baumannii, Acinetobacter
genospecies 3, dan Acinetobacter genospecies 13TU) memiliki perbedaan dalam
manifestasi penyakit. A.baumannii lebih cenderung menginfeksi traktus respiratorius dan mengenai pasien yang lemah, terutama di ICU. Sebagai perbandingan, Acinetobacter
genospecies 3 lebih sering terlibat dalam infeksi kulit dan jaringan lunak serta biasanya
terjadi di bangsal umum, bukan di ICU. Studi lain menemukan bahwa pada pasien dengan pneumonia akibat A.baumannii, lebih sering didapatkan pneumonia lobaris, temuan
hematologi abnormal, dan skor APACHE II yang lebih tinggi secara signifikan dibandingkan dengan Acinetobacter genospecies 13TU.10
Pada kasus bakteremia, mortalitas pasien lebih tinggi pada yang terinfeksi
A.baumannii dibandingkan dengan Acinetobacter genospecies 3 atau 13TU. Pasien
dengan bakteremia dari A.baumannii lebih sering mengalami pneumonia, sementara bakteremia akibat Acinetobacter genospecies 13TU lebih sering merupakan bakteremia primer. Selain itu, jarak antara waktu admisi sampai awitan bakteremia rata-rata 10 hari lebih lama pada pasien dengan A.baumannii dibandingkan bakteremia akibat
Acinetobacter genospecies 3 dan 13TU.10
Pneumonia
Sistem pernafasan merupakan lokasi infeksi yang paling sering dari Acinetobacter.9
Pneumonia juga merupakan manifestasi klinis yang paling berat dengan mortalitas lebih tinggi dibandingkan lokasi lain. Acinetobacter dapat menyebabkan community acquired pneumonia (CAP) atau hospital acquired pneumonia (HAP). Manifestasi terbanyak
berupa HAP yang late-onset (setelah 4 hari perawatan), walaupun early-onset dapat juga terjadi terutama kalau pasien telah menerima terapi antimikroba sebelumnya atau perawatan dalam 90 hari sebelum awitan pneumonia.3
Ada beberapa faktor risiko yang berkontribusi terhadap kejadian pneumonia nosokomial Acinetobacter di ICU, yaitu : pasien imunokompromis (termasuk pasien dengan neutropenia atau HIV, terutama CD4 rendah), pasien dengan penyakit dasar yang berat (skor APACHE II yang sangat tinggi), dan penggunaan antibiotik sebelumnya (khususnya cephalosporin generasi ketiga, aminoglycoside, quinolone, aatu carbapenem dalam 15 hari sebelum episode pneumonia). Durasi perawatan di ICU atau rumah sakit 5 hari atau lebih juga merupakan faktor risiko yang penting. Ini dapat dijelaskan dengan peningkatan kolonisasi dan translokasi bakteri ataupun akibat penggunaan alat invasif yang lebih sering di ICU, termasuk selang endotrakeal, kateter vena sentral, dan trakeostomi.3
Umumnya, gambaran radiologis pneumonia Acinetobacter berupa multilobaris. Beberapa pasien dapat terjadi kavitas, efusi pleura, dan empiema. Bakteremia sekunder dan syok sepsis bisa terjadi, di mana keduanya berhubungan dengan prognosis buruk.3
Dampak terbesar dari Acinetobacter adalah menjadi penyebab ventilator
associated pneumonia (VAP).9 Acinetobacter termasuk diagnosis banding etiologi VAP
yang tergolong patogen MDR (Tabel 4).16 Mortalitas pasien dengan VAP akibat
A.baumannii tinggi, berkisar 33-70%. VAP akibat A.baumannii biasanya late-onset,
mengenai pasien setelah 10-14 hari dengan ventilasi mekanik. Sampel dari saluran nafas harus diambil menggunakan teknik invasif dan kultur kuantitatif dilakukan untuk mencapai diagnosis definitif, membedakan infeksi yang sebenarnya dari kolonisasi yang umum terjadi.6
Dari sebuah penelitian yang dipublikasi pada tahun 2013 untuk melihat karakteristik VAP akibat A.baumannii, didapatkan dari analisis multivariat bahwa faktor prediktif akan hasil yang buruk adalah hipertensi sebelumnya (OR 5,8, 95% CI 1,4-24,9, p = 0,018) dan syok septik (OR 8,5, 95% CI 3-23,7, p < 0,001). Pada penelitian ini ditemukan hanya 14,2% strain yang sensitif imipenem, sementara tidak ada yang resisten terhadap colistin. Mortalitas ICU mencapai 60,9%.17
Tabel 4. Patogen penyebab VAP16
CAP akibat Acinetobacter juga bisa terjadi bila daya tahan tubuh menurun, seperti pada pasien diabetes mellitus, alkohol, merokok, dan ada penyakit paru yang mendasari.9
Penyakit ini ditandai dengan perjalanan penyakit fulminan, bakteremia, dan angka mortalitas mencapai 40-60%.5
Bloodstream infection (BSI)
Infeksi Acinetobacter dari berbagai tempat di tubuh dapat berlanjut pada bakteremia.3
Sumber BSI biasanya berhubungan dengan jalur kateter, pneumonia, infeksi saluran kemih, atau luka yang terinfeksi.5 Setelah bakteremia terjadi, syok sepsis dapat ditemukan
pada 1/3 kasus dan angka mortalitasnya mencapai 15-46%. Mortalitas yang lebih rendah dibandingkan pneumonia kemungkinan disebabkan bakteremia lebih banyak pada infeksi yang berhubungan kateter, di mana perbaikan dapat dilihat ketika kateter dicabut, sementara pasien dengan pneumonia lebih sering septik dan mempunyai penyakit dasar yang lebih berat.3 Bakteremia Acinetobacter yang sebenarnya juga harus dibedakan dari
pseudobakteremia akibat teknik pengambilan kultur darah yang tidak tepat.9
Infeksi saluran kemih
A.baumannii kadang menjadi penyebab infeksi saluran kemih di ICU dengan persentase
1,6% pada satu studi.5 Terjadinya sistitis dan pielonefritis telah dilaporkan pada kasus
dengan nefrolitiasis atau kateter urin.9
Meningitis
A.baumannii dapat menyebabkan meningitis, biasanya terjadi nosokomial setelah
prosedur bedah saraf atau trauma kepala, walaupun pernah juga dilaporkan pada pejamu yang sehat sebelumnya. Ruam petekie ditemukan pada 30% pasien dengan meningitis akibat Acinetobacter.9 Mortalitas meningitis akibat A.baumannii dapat mencapai 70%.5
Jaringan lunak
Pada satu studi, Acinetobacter menyebabkan 2,1% dari infeksi kulit dan jaringan lunak yang didapat di ICU.5 Acinetobacter menjadi salah satu patogen utama pada luka
traumatik (luka akibat perang), insisi pasca operasi, dan luka bakar sebagai hasil dari kemampuan organisme tumbuh dalam jaringan yang rusak dan adanya benda asing.9
Kasus osteomielitis pernah dilaporkan akibat infeksi luka dalam yang dialami tentara di medan perang.2 Pada kasus selulitis yang berhubungan dengan pemasangan kateter vena,
resolusi bisa dicapai hanya dengan pencabutan kateter saja.9
Infeksi lain
Infeksi Acinetobacter dapat terjadi pada semua lokasi tubuh. Infeksi pada mata bisa berupa konjungtivitis, ulkus kornea akibat kontaminasi lensa kontak, perforasi kornea, sampai endoftalmitis. Pada katup jantung, baik prostetik atau tidak, bisa terjadi endokarditis. Osteomielitis, artritis septik, dan abses hati serta pankreas juga telah dilaporkan.9
BAB V
RESISTENSI ANTIBIOTIK
Acinetobacter (khususnya A.baumannii) dapat resisten terhadap banyak kelas antibiotik.
Kemampuannya mengakumulasi berbagai macam mekanisme resistensi sampai timbulnya strain yang resisten terhadap semua antibiotik menjadi peringatan akan bahaya dari patogen ini.1
A.baumannii mempunyai mekanisme resistensi intrinsiknya sendiri, di mana
membran luar organisme ini relatif kurang permeabel dibanding bakteri gram negatif lain. Selain itu, patogen ini bisa mendapatkan berbagai mekanisme resistensi baru yang impresif melebihi kemampuan resistensi intrinsiknya sendiri. Hal ini dimungkinkan karena A.baumannii bisa bertukar gen resistensi melalui plasmid, integron, dan transposon dengan bakteri lain. Seperti dijelaskan pada gambar 4, plasmid (elemen ekstra kromosom yang ada secara alami dalam bakteri) yang mendapat gen resistensi dari transposon yang berasal dari kromosom, bisa ditransfer antar bakteri sehingga memfasilitasi resistensi antibiotik.2 Sebuahstudi genomik pada strain MDR Acinetobacter
epidemik di Perancis menemukan adanya “resistance island” yang mengandung 45 gen resistensi yang tampaknya didapatkan dari genus Pseudomonas, Salmonella, atau
Eschericia.15
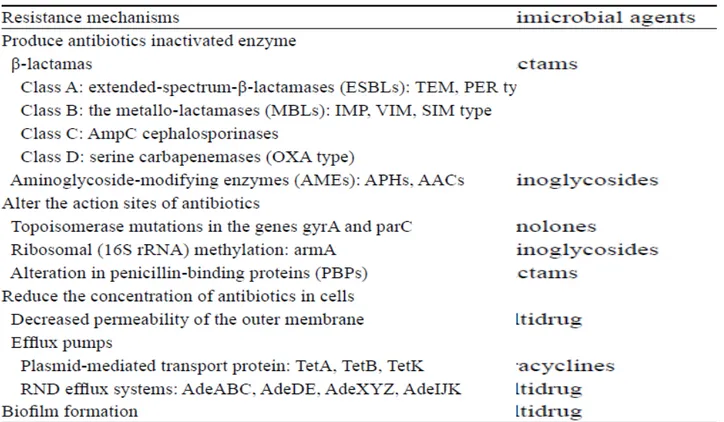
Mekanisme resistensi Acinetobacter diilustrasikan dalam gambar 5 dan dijabarkan dalam tabel 5. Mekanisme ini umumnya terdiri dari 3 kategori: 15
1. Enzim yang menginaktivasi antibiotik
Acinetobacter memiliki berbagai enzim -lactamase yang menimbulkan resistensi terhadap penicillin, cephalosporin, dan carbapenem. Contoh : AmpC cephalosporinase menghasilkan resistensi terhadap cephalosporin spektrum luas, enzim tipe OXA dan metallo--lactamase (MBL) menimbulkan resistensi terhadap carbapenem.15
2. Menurunnya akses ke dalam bakteri
Kanal porin penting sebagai jalur masuknya antibiotik ke dalam sel bakteri. Penurunan ekspresi protein porin pada Acinetobacter dapat menghalangi masuknya antibiotik -lactam ke dalam ruang periplasma (ruang antara membran luar dan membran sitoplasma).Selain itu, Acinetobacter memiliki pompa efflux yang mampu mengeluarkan secara aktif berbagai jenis antibiotik dari dalam sel, seperti -lactam, quinolone, tetracycline, chloramphenicol, dan tigecycline.1,15
3. Mutasi yang mengubah bakteri atau fungsi seluler
Mekanisme ini mencakup mutasi yang mengubah bakteri atau fungsinya, menurunkan afinitas terhadap antibiotik, dan upregulating fungsi seluler, seperti produksi protein. Contoh: resistensi terhadap quinolone terjadi melalui modifikasi DNA gyrase akibat mutasi gen gyrA dan parC. Perubahan ini menyebabkan afinitas quinolone lebih rendah pada kompleks DNA-enzim.4 Resistensi terhadap colistin diduga melalui
perubahan membran sel Acinetobacter sehingga mengganggu ikatan antibiotik dengan patogen ini.15 Mekanisme utamanya berupa modifikasi atau gangguan sintesis
Gambar 5. Gambaran potensi mekanisme dari resistensi antibiotik pada Acinetobacter1
Tabel 5. Mekanisme resistensi antibiotik dari A.baumannii10
Kelompok ahli internasional dengan inisiatif dari European Centre for Disease
Prevention and Control (ECDC) dan CDC membuat terminologi standar resistensi
dengan rumah sakit dan cenderung resisten obat, termasuk Acinetobacter. Berikut definisi umum yang diajukan:18
MDR (multidrug resistant) : resisten terhadap minimal satu antibiotik pada tiga atau lebih kategori antibiotik.
XDR (extended drug resistant) : resisten terhadap minimal satu antibiotik pada semua kategori antibiotik, kecuali satu atau dua golongan (dengan kata lain, hanya sensitif terhadap satu atau dua kategori).
PDR (pandrug resistant) : resisten terhadap semua kategori antibiotik. Kategori antibiotik yang dinilai relevan untuk Acinetobacter adalah:18
Aminoglycoside (gentamicin, tobramycin, amikacin, netilmicin)
Carbapenem antipseudomonas (imipenem, meropenem, doripenem)
Fluoroquinolon antipseudomonas (ciprofloxacin, levofloxacin)
Penicillin antipseudomonas + -lactam inhibitor (piperacillin-tazobactam, ticarcilin-clavulanic acid)
Extended-spectrum cephalosporin (cefotaxim, ceftriaxon, ceftazidim, cefepim)
Inhibitor jalur folat (trimethoprim-sulphamethoxazole)
Penicillin + -lactam inhibitor (ampicillin-sulbactam)
Polymyxin (colistin, polymyxin B)
Tetracycline (tetracycline, doxycycline, minocycline).
Penentuan minimal inhibitory concentration (MIC) dengan broth microdilution dan agar dilution yang kemudian dibandingkan dengan resistance breakpoint dianggap sebagai gold standard untuk penilaian sensitivitas/resistensi antibiotik.4 Perlu
diperhatikan bahwa organisasi yang menentukan breakpoint, yaitu Clinical and
Laboratory Standards Institute (CLSI), European Committee on Antimicrobial Susceptibility Testing (EUCAST), dan British Society for Antimicrobial Chemotherapy
(BSAC) mempunyai breakpoint yang berbeda untuk antibiotik yang digunakan terhadap
A.baumannii (Tabel 6).5
Tabel 6. Perbandingan EUCAST, CLSI, dan BSAC dalam breakpoint berbagai antibiotik terhadap
Peningkatan resistensi terhadap hampir semua antibiotik terjadi pada A.baumannii
group secara global, namun ada perbedaan antara species A.baumannii dengan Acinetobacter genospecies 3 dan Acinetobacter genospecies 13TU. Ditemukan bahwa
strain MDR A.baumannii yang resisten carbapenem lebih tinggi secara signifikan daripada Acinetobacter genospecies 3 dan 13TU. Sebaliknya, Acinetobacter genospecies
3 dan 13 TU biasanya sensitif terhadap berbagai agen antimikroba. Oleh karena itu,
pasien dengan infeksi A.baumannii cenderung lebih jarang mendapat terapi empiris yang sesuai. Resistensi antibiotik terhadap A.baumannii membuat pilihan terapi yang ada sangat terbatas bagi dokter untuk mengobati pasien dengan carbapenem resistant, MDR, bahkan PDR.10
BAB VI
PEMILIHAN TERAPI ANTIBIOTIK
Pemilihan antibiotik empirik terhadap A.baumannii merupakan hal yang menantang. Waktu untuk memulai terapi yang efektif akan berdampak pada hasil akhir pasien yang
menderita infeksi akibat patogen ini. Sementara, dengan adanya berbagai mekanisme resistensi antibiotik pada A.baumannii, diperlukan tes sensitivitas untuk memastikan terapi definitif.5 Oleh karena itu, laboratorium mikrobiologi termasuk lini depan dalam
melawan infeksi ini dengan menyediakan surveilans data sensitivitas antibiotik yang cepat dan akurat. Masukan dari mikrobiologi klinis membuat klinisi dapat selangkah lebih maju dalam menghadapi infeksi akibat A.baumannii.11
Interpretasi hasil kultur mikrobiologi juga harus mempertimbangkan kolonisasi dan potensi kontaminasi dari lingkungan.9 Sebuah studi di rumah sakit tersier di India
bertujuan membedakan antara infeksi dan kolonisasi dari A.baumannii. Dari pasien-pasien di ICU yang didapatkan 119 isolat A.baumannii dan diberikan antibiotik, hanya 65 isolat (54,6%) yang patogenik berdasarkan berbagai parameter klinis dan laboratorium. Terapi antibiotik yang berlebihan ini menggambarkan kecenderungan untuk mengobati infeksi A.baumannii berdasarkan laporan bakteriologis saja dan bukan klinis. Studi ini menunjukkan bahwa penggunaan antibiotik harus bijaksana di mana terapi diberikan untuk infeksi A.baumannii yang dikonfirmasi klinis dan bukan hanya kolonisasi.19
Sampai saat ini, belum ada panduan yang jelas dalam terapi infeksi A.baumannii. Terapi empiris dapat berbeda-beda tergantung lokasi geografis dan kasus per kasus.11
Namun demikian, ada beberapa referensi yang bisa menjadi rujukan dalam pertimbangan terapi. Panduan American Thoracic Society tahun 2005 untuk manajemen pasien dewasa dengan HAP, VAP, dan HCAP merekomendasikan antibiotik yang paling aktif untuk
Acinetobacter sebagai patogen MDR adalah carbapenem, sulbactam, dan polymyxin.
Namun belum ada data yang menunjukkan perbaikan hasil akhir dengan terapi regimen kombinasi (level of evidence II).20 Pilihan antibiotik serupa direkomendasikan dari buku
Nosocomial Pneumonia, Strategies for Management tahun 2007 (tabel 7).6
Tabel 8. Antibiotik untuk terapi infeksi Acinetobacter7
Sebuah tinjauan pilihan terapi antibiotik untuk infeksi Acinetobacter dilakukan tahun 2010 yang diringkas dalam tabel 8.7 Penjelasan spesifik mengenai masing-masing
antibiotik akan dijabarkan.
Carbapenem
Carbapenem (imipenem, meropenem, doripenem) menjadi salah satu pilihan terapi yang paling penting untuk infeksi A.baumannii. Obat ini mempunyai aktivitas bakterisidal yang
sangat baik dan stabil terhadap -lactamase.7 Oleh karena spektrumnya yang luas,
carbapenem direkomendasikan sebagai terapi empirik lini pertama untuk pasien yang dicurigai mengalami pneumonia akibat A.baumannii. Hal ini didukung oleh data in vitro, penelitian, dan pengalaman klinis yang ekstensif.6
Resistensi A.baumannii terhadap carbapenem sayangnya meningkat dan biasanya disertai resistensi terhadap obat lain juga (kecuali polymyxin atau tigecycline). Sensitivitas terhadap carbapenem berkisar dari >90% sampai rendah sekitar 32% tergantung lokasi geografis dan jenis carbapenem. Oleh karena itu, pemahaman pola sensitivitas antibiotik lokal diperlukan untuk menentukan terapi dan perbedaan sensitivitas antar carbapenem perlu dipertimbangkan.7 Tes sensitivitas terhadap imipenem
tidak memprediksi sensitivitas terhadap meropenem dan demikian juga sebaliknya. Data yang diperoleh dari program MYSTIC menunjukkan imipenem lebih poten dibandingkan meropenem untuk infeksi MDR Acinetobacter. Pompa efflux bisa mempengaruhi meropenem lebih besar, sementara -lactamase spesifik menghidrolisis imipenem lebih efisien.15 Doripenem merupakan carbapenem baru yang mempunyai aktivitas in vitro
terhadap A.baumannii setara dengan imipenem dan meropenem, namun tampaknya tidak mempunyai kelebihan khusus. Walaupun ertapenem memberikan kemudahan daripada carbapenem sebelumnya karena diberikan sekali sehari, obat ini tidak mempunyai aktivitas terhadap A.baumannii sehingga tidak direkomendasikan.3
Sulbactam
Sulbactam adalah satu dari tiga -lactamase inhibitor yang ada. Tidak seperti asam klavulanat dan tazobactam, sulbactam mempunyai aktivitas bakterisidal intrinsik melawan Acinetobacter. Studi menunjukkan dengan jelas bahwa aktivitas intrinsik dari obat ini terhadap Acinetobacter lebih berperan daripada kemampuannya menghambat -lactamase.5,7
Hasil investigasi klinis menunjukkan sulbactam (tersedia di Amerika Serikat dalam bentuk kombinasi dengan ampicillin) efektif pada infeksi A.baumannii dari ringan sampai berat. Urban et al melaporkan salah satu pengalaman awal menggunakan ampicillin-sulbactam dan mendapatkan bahwa 9 dari 10 pasien yang sakit berat dan menggunakan ventilasi mekanik menunjukkan perbaikan klinis dengan menggunakan
ampicillin-sulbactam (dosis ampisillin 3 gram dan sulbactam 1,5 gram IV tiap 6-8 jam). Efektivitas antibiotik yang mengandung sulbactam serupa dengan regimen lain pada kasus pneumonia dan BSI yang masih sensitif terhadap obat ini.7
Sulbactam dipertimbangkan sebagai alternatif yang menarik karena aktivitas antibakterinya lebih spesifik daripada imipenem dan penggunaannya dapat berkontribusi pada menurunnya terapi carbapenem, yang menjadi faktor risiko utama terjadinya strain
A.baumannii resisten imipenem.6 Namun pada meningitis akibat A.baumannii, hasil terapi
dengan sulbactam meragukan. Hal ini kemungkinan berhubungan dengan penetrasi obat yang terganggu. Dosis optimal sulbactam untuk mengobati infeksi A.baumannii yang serius belum diketahui, tapi kebanyakan peneliti merekomendasikan minimal 6 gram/hari dalam dosis terbagi pada pasien dengan fungsi ginjal yang normal. Masih perlu ditentukan apakah dosis yang lebih tinggi akan efektif atau menurunkan risiko resistensi atau apakah ampicillin sulbactam harus dikombinasikan dengan obat lain.7 Sayangnya,
resistensi sulbactam umum terjadi dan dapat meningkat di beberapa area geografis.5
Polymyxin
Munculnya strain A.baumannii yang resisten terhadap semua antimikroba yang rutin dites telah menyebabkan dipergunakannya kembali polymyxin (colistin atau polymyxin E dan polymyxin B).5 Obat ini merupakan antibiotik yang paling aktif secara in vitro terhadap
MDR Acinetobacter.1 Polymyxin adalah antibiotik peptida kationik yang berinteraksi
dengan bagian lipid A dari lipopolisakarida. Hal ini mengganggu keutuhan membran bakteri yang mengakibatkan keluarnya isi sitoplasma.13,21 Colistin bersifat bakterisidal
melawan Acinetobacter, dan efeknya tergolong concentration dependent.15
Efektivitas colistin pada pasien sakit berat dengan infeksi MDR Acinetobacter, termasuk pneumonia, bakteremia, sepsis, infeksi intraabdomen, dan infeksi sistem saraf pusat sudah dilaporkan dalam studi-studi observasional.15 Satu laporan
mendokumentasikan efektivitas dan keamanan colistin pada pasien dengan VAP akibat
Acinetobacter yang resisten carbapenem. Terapi colistin menghasilkan kesembuhan klinis
pada 57% pasien dan tidak ada yang mengalami kelemahan neuromuskular berkepanjangan sebagai efek samping terapi. Oleh karena itu, colistin harus dipertimbangkan sebagai terapi VAP akibat Acinetobacter yang resisten carbapenem.20
Secara keseluruhan, efektivitas colistin terhadap A.baumannii menunjukkan respon kuratif dari 57% sampai >80%. Namun perlu diperhatikan bahwa angka resistensi polymyxin telah dilaporkan setinggi 3,2% untuk strain MDR A.baumannii, dan angka yang lebih tinggi lagi dilaporkan di Korea.5
Colistin merupakan polymyxin yang paling umum digunakan di Amerika Serikat. Ada dua jenis colistin, colistin sulfat untuk oral/topikal dan CMS (sodium colistin methanosulfonate atau colistin sulfomethate sodium) untuk parenteral.5 Dosis yang
direkomendasikan untuk parenteral adalah 2,5-5,0 mg/kg/hari terbagi dalam 2-4 dosis untuk colistin base (setara dengan 6,67-13,3 mg/kg/hari CMS).7
Hasil terapi colistin pada pneumonia akibat A.baumannii kurang baik dibandingkan dengan lokasi yang lain. Hal ini bisa dijelaskan karena penetrasinya yang buruk pada jaringan paru.6 Oleh karena itu, colistin inhalasi meningkat penggunaannya
sebagai usaha untuk meningkatkan deposisi obat pada lokasi infeksi sekaligus meminimalisir toksisitas sistemik.5 Colistin inhalasi bahkan ditemukan lebih efisien pada
pneumonia akibat A.baumannii jika diberikan tunggal dalam bentuk nebulisasi atau kombinasi dengan colistin IV dibanding hanya IV saja.11 Menurut FDA, colistin inhalasi
harus digunakan segera setelah disiapkan untuk mencegah bentuk aktif yang toksik terhadap paru-paru.7 Efek samping utama dari colistin inhalasi adalah bronkokonstriksi.1
Bronkodilator sebelum pemberian mungkin bermanfaat untuk mencegah bronkospasme yang berkaitan dengan colistin inhalasi.5
Walaupun meningitis akibat A.baumannii jarang, insidennya meningkat dan sering disebabkan strain MDR. Polymyxin IV (colistin atau polymyxin B) ditambah polymyxin atau aminoglikosida intrathecal/intraventricular dengan atau tanpa rifampin IV direkomendasikan.7 Pemberian IV menghasilkan penetrasi cukup baik pada meningen
yang mengalami inflamasi, dengan kadar dalam cairan cerebrospinal sekitar 25% dari kadar dalam darah.1 Sebuah tinjuan terhadap 64 episode meningitis bakteri gram negatif
menemukan angka kesembuhan 80%, termasuk kesembuhan pada 10 dari 11 (91%) pasien dengan meningitis akibat Acinetobacter. Mayoritas pasien mendapat terapi antimikroba sistemik dengan tambahan pemberian lokal polymyxin.15
Nefrotoksisitas menjadi perhatian dari penggunaan colistin, khususnya pada pasien lansia, yang mengalami gangguan ginjal, atau yang mendapat obat nefrotoksik lainnya.7 Mekanisme polymyxin menyebabkan nefrotoksik adalah dengan meningkatkan
permeabilitas membran sehingga menghasilkan influx kation, anion, dan air yang menyebabkan pembengkakan sel dan lisis.6 Namun, toksisitas yang ditemukan pada studi
awal colistin disebabkan kurangnya pemahaman terhadap farmakokinetik, farmakodinamik, toksikodinamik, dan penggunaan dengan dosis yang tidak sesuai. Falagas et al menyimpulkan insiden nefrotoksik dengan polymyxin sekarang ini lebih jarang dan ringan dibanding studi tahun 1970an. Insiden toksisitas renal dalam studi-studi terakhir berkisar 0-37%.22 Secara umum, angka nefrotoksisitas lebih rendah secara
signifikan dibanding sebelumnya dan reversibel dengan penghentian obat.5 Klinisi tetap
perlu memperhatikan potensi nefrotoksisitas, menyesuaikan dosis sesuai fungsi ginjal, menghindari pemberian obat nefrotoksik lain jika memungkinkan, dan memonitor pasien untuk deteksi ada tidaknya penurunan fungsi ginjal.22
Efek neurotoksik polymyxin lebih jarang daripada nefrotoksik, lebih ringan dan pulih setelah penghentian terapi. Neurotoksisitas juga jarang terjadi pada studi-studi terbaru dibanding yang lama. Dizziness, kelemahan otot, parestesia perifer dan fasial, tuli parsial, gangguan visual, vertigo, konfusio, halusinasi, kejang, dan ataxia telah dihubungkan dengan penggunaan polymyxin, walaupun kebanyakan studi melaporkan efek tersebut dengan colistin.Tidak ada toksisitas berat seperti blok neuromuskular atau apneu yang diinduksi polymyxin dilaporkan dalam 15 tahun terakhir. Polymyxin B dihubungkan dengan efek samping lain termasuk ruam, pruritus, dermatitis dan demam akibat obat, yang mungkin dihasilkan dari aksi pengeluaran histamin.22
Polymyxin B hanya berbeda satu asam amino dengan colistin. Perbedaan lain adalah polymyxin B diberikan parenteral dalam bentuk garam sulfat, sedangkan colistin dalam bentuk garam natrium CMS, prodrug yang kemudian mengalami hidrolisis menjadi bentuk aktif. Dosis polymyxin B IV yang direkomendasikan saat ini untuk pasien dengan fungsi ginjal normal adalah 1,5-2,5 mg/kg/hari dalam dua dosis terbagi, diberikan dalam infus 1 jam.22 Berdasarkan literatur lama, polymyxin B tampaknya dieliminasi
terutama melalui ginjal. Namun, studi farmakokinetik baru-baru ini menolak teori tersebut dan membuktikan bahwa eliminasi renal bukanlah yang utama. Pengubahan atau penyesuaian dosis polymyxin B dapat berpotensi untuk kegagalan terapi. Dari laporan kasus di Singapura tahun 2014, didemonstrasikan efektivitas polymyxin B yang tidak diubah dosisnya untuk terapi XDR A.baumannii pada dua pasien dengan end stage renal
mana kultur darah dan sputum menjadi negatif. Dari pengamatan, nefrotoksisitas dan neurotoksisitas tidak terbukti.23
Aminoglikosida
Amikacin dan tobramycin adalah 2 agen aminoglikosida yang memiliki aktivitas melawan kebanyakan isolat A.baumannii. Namun sama seperti semua anibiotik lain, resistensinya meningkat dan tes sensitivitas diperlukan. Tobramycin memiliki angka sensitivitas keseluruhan yang paling tinggi. Aminoglikosida sering tidak digunakan sebagai agen tunggal dan profil toksisitasnya sering membuat penggunaannya dihindari (terutama untuk pengobatan jangka panjang). Efektivitas antibiotik inhalasi, termasuk aminoglikosida, mendapat perhatian yang meningkat. Namun, sangat sedikit data klinis untuk hal ini (di luar kasus fibrosis kistik).7
Tigecycline
Tigecycline termasuk kelas antibiotik baru glycylcycline yang memiliki aktivitas bakteriostatik melawan MDR Acinetobacter.15 Tigecycline merupakan turunan
semisintetik dari minocycline. Keuntungan obat ini dibanding golongan tetracycline adalah kemampuannya untuk mengatasi mekanisme resistensi yang spesifik terhadap tetracycline sehingga mempunyai spektrum yang lebih luas.7
Tigecycline dapat berguna pada infeksi VAP akibat A.baumannii karena mencapai penetrasi yang sangat baik di jaringan (termasuk paru namun tidak termasuk traktus urinarius).4 Namun, perpindahan cepat dari obat ini ke dalam jaringan setelah pemberian
IV membuatnya tidak direkomendasikan sebagai terapi tunggal untuk BSI akibat
A.baumannii.7 Resistensi tingkat tinggi terhadap tigecycline telah dideteksi pada beberapa
isolat MDR Acinetobacter, dan didapatkan bahwa patogen ini mampu menyingkirkan obat ini dengan upregulating pompa efflux. Berdasarkan temuan ini dan kekuatiran apakah konsentrasi serum puncak yang adekuat dapat dicapai, tigecycline sebaiknya dicadangkan untuk salvage therapy, di mana pemberiannya ditentukan dari konsultasi dengan spesialis penyakit infeksi.15
Tetracycline
Tes sensitivitas diperlukan untuk setiap obat dari golongan tetracycline karena banyak isolat yang resisten tetracycline terbukti masih sensitif terhadap minocycline. Data klinis golongan obat ini sangat terbatas. Satu studi menunjukkan keberhasilan pada 7 dari 8 pasien yang diterapi minocycline untuk luka terinfeksi dan studi lain menunjukkan 6 dari 7 pasien yang mengalami VAP berhasil diterapi dengan minocycline atau doxycycline.7
Terapi kombinasi
Kombinasi antibiotik merupakan strategi yang sering digunakan untuk terapi MDR
A.baumannii. Pendekatan ini bertujuan untuk mencapai sinergi melawan strain MDR.
Ditemukan bahwa kombinasi sulbactam dengan aminoglikosida, rifampin, dan azithromycin telah menunjukkan sinergi melawan strain yang sensitif terhadap imipenem. Sebaliknya, manfaat kombinasi sulbactam dengan cephalosporin kecil. Colistin yang dikombinasi dengan rifampin (atau meropenem dan azithromycin) juga mencapai sinergi melawan isolat yang sensitif terhadap imipenem. Dispekulasi bahwa peran polymyxin dalam kombinasi dengan antibiotik lain adalah menyebabkan permeabilitas cepat pada membran luar, sehingga mengijinkan masuknya antibiotik lain ke dalam sel bakteri.4
Sebuah studi retrospektif melaporkan hasil yang baik dari kombinasi polymyxin dengan ampicillin-sulbactam ketika didapatkan resistensi carbapenem.9
Risiko timbulnya strain A.baumannii resisten colistin terjadi saat colistin diberikan secara monoterapi. Oleh karena itu, kombinasi colistin dengan antibiotik lain menjadi rasional. Sebuah penelitian menunjukkan efek sinergistik kombinasi colistin dengan sulbactam, netilmicin, maupun vancomycin. Vancomycin, yang tidak umum digunakan melawan bakteri gram negatif, ternyata menunjukkan aktivitas sinergistik terhadap colistin yang paling tinggi pada strain A.baumannii dengan efek bakterisidal cepat.21
Rifampin tetap mempertahankan aktivitas tinggi secara in vitro dan in vivo melawan A.baumannii bahkan pada strain yang resisten carbapenem. Namun, rifampin jangan digunakan sebagai monoterapi karena menginduksi timbulnya A.baumannii yang resisten terhadap obat ini baik in vitro dan in vivo.6
Kurangnya uji klinis terkontrol membuat sulit untuk mengevaluasi peran terapi kombinasi untuk infeksi MDR Acinetobacter. Kebanyakan data yang ada berasal dari seri kasus tidak terkontrol, model binatang, atau studi in vitro.15 Tidak ada rekomendasi kuat
yang bisa dibuat untuk setiap kombinasi terapi. Studi terkontrol untuk evaluasi efektivitas terapi kombinasi diperlukan sebelum rekomendasi formal bisa diberikan.9
Extended-infusion -lactam
Oleh karena munculnya MDR Acinetobacter dan kelangkaan antimikroba baru, perhatian ditujukan pada optimalisasi penggunaan obat yang tersedia. Literatur klinis mulai memunculkan penggunaan infus -lactam yang diperpanjang (extended-infusion) untuk mengobati bakteri gram negatif, terutama cefepime, piperacillin-tazobactam, dan carbapenem. Keuntungan dari hal ini adalah kemampuan untuk mencapai konsentrasi obat di atas MIC untuk waktu yang lebih lama. Sebagai contoh, Li et al menunjukkan kemungkinan meropenem mencapai target bakterisidal meningkat dari 64% ke 90% ketika lama infus diubah dari 0,5 ke 3 jam. Imipenem dan meropenem mempunyai waktu paruh yang singkat 4 jam sehingga membatasi manfaat bila diberikan infus di atas 3 jam. Hal yang berbeda pada doripenem di mana obat ini mempunyai waktu paruh yang lebih panjang. Walaupun data retrospektif menunjukkan manfaat dari extended-infusion, belum ada uji klinis prospektif untuk hal ini. Perlu diperhatikan juga bahwa manfaat
extended-infusion juga terpengaruh pada pasien dengan gangguan ginjal yang merupakan
BAB VII
PENGENDALIAN INFEKSI
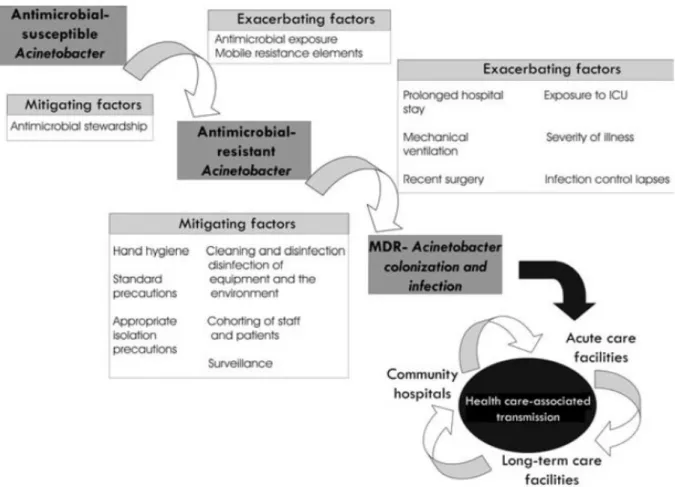
Berkembangnya Acinetobacter yang sensitif terhadap antibiotik menjadi MDR dapat dilihat pada gambar 6, di mana beberapa faktor bekerja sama di fasilitas kesehatan, termasuk adanya pasien yang rentan, adanya pasien yang sudah terinfeksi atau mengalami kolonisasi bakteri, tekanan selektif dari penggunaan antimikroba, dan kurangnya kepatuhan pada prosedur pengendalian infeksi.15 Tiga hal utama yang mendorong
timbulnya resistensi antibiotik adalah kegagalan mempertahankan higiene rumah sakit, tekanan selektif akibat penggunaan antibiotik irrasional, dan perpindahan elemen genetik yang mengkode resistensi.11
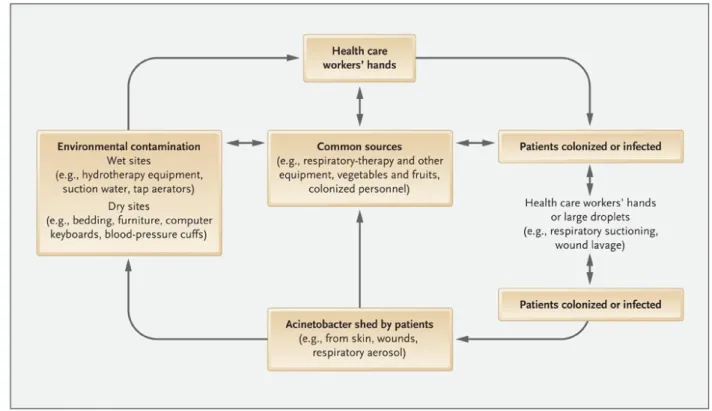
Tujuan utama dari pengendalian infeksi MDR Acinetobacter adalah mendeteksi keberadaannya dalam rumah sakit sejak awal, mengontrol penyebaran secara agresif, dan mencegah endemisitas. Pengendalian ini didasarkan hampir semuanya pada pengalaman wabah infeksi Acinetobacter, umumnya mengenai modus transmisi patogen (gambar 7) dan penggunaan antibiotik spektrum luas yang berlebihan. Pengendalian paling berhasil bila penyebab umum diidentifikasi dan dieliminasi. Tinjauan terhadap wabah pada 51 rumah sakit menemukan 25 penyebab umum berupa 13 dari infeksi saluran nafas dan 12 dari BSI atau infeksi lain yang kemudian dapat dikontrol dengan pelepasan atau desinfektan dan sterilisasi ventilator yang terkontaminasi atau alat-alat yang berhubungan lainnya.1
Gambar 7. Reservoar, sumber, dan pola transmisi Acinetobacter pada fasilitas kesehatan1
Acinetobacter merupakan flora komensal normal pada kulit pasien dan petugas
kesehatan yang menjadikan mereka sebagai reservoar di rumah sakit. Bentuk utama transmisi A.baumannii adalah melalui kontak langsung. Telah diketahui juga bahwa
A.baumannii bisa menyebar melalui transmisi udara berdasarkan laporan yang
kolonisasi dari saluran nafas.6 Kontaminasi lingkungan ICU juga tampaknya menjadi
sumber yang penting. Reservoar lingkungan yang signifikan di ICU termasuk ventilator, selang ventilator, resuscitation bag, matras, jubah, dan sarung tangan.3 Wilks et al juga
melaporkan wabah infeksi MDR Acinetobacter di mana kontaminasi lingkungan ditemukan di gorden, laringoskop, peralatan untuk mengangkat pasien, dan pegangan pintu.15
Prosedur untuk memotong rute transmisi tetap berupa cuci tangan dan higiene personal (baik pasien maupun petugas kesehatan), menurunkan beban biofilm pasien di kulit, dan penggunaan antibiotik yang hati-hati.11 MDR Acinetobacter umumnya tetap
sensitif terhadap desinfektan dan antiseptik. Laporan kegagalan desinfektan lebih menunjukkan kegagalan petugas untuk mengikuti prosedur pembersihan dibandingkan resisten desinfektan.1 Pengendalian ketat harus diimplementasikan termasuk penggunaan
jubah, sarung tangan, dan masker. Sebagai tambahan, pasien yang mengalami kolonisasi atau infeksi A.baumannii harus diisolasi dari pasien lain dalam kamar tersendiri.6
Desinfeksi periodik bangsal, unit, dan sterilisasi peralatan medis menggunakan metode yang sesuai sangat direkomendasikan. Survei sampel lingkungan rumah sakit secara periodik untuk kontaminasi mikrobiologis juga dianjurkan. Dekontaminasi kulit selektif dengan chlorhexidine menurunkan jumlah A.baumannii signifikan dan diajukan sebagai cara pengendalian infeksi untuk menurunkan jumlah wabah endemik. Selain itu, dekontaminasi pasien pada saluran cerna juga telah dilaporkan. Antibiotik dapat digunakan untuk menghambat kolonisasi usus dari A.baumannii, namun manfaatnya dibatasi risiko menimbulkan fenotip yang resisten.11
Pengendalian antibiotik merupakan salah satu fokus pengendalian infeksi, yang terdiri dari pembatasan penggunaan cephalosporin generasi ketiga dan carbapenem, jadwal perputaran antibiotik, dan implementasi panduan antimikroba.3 Beberapa laporan
menunjukkan keberhasilan pengendalian wabah dengan menurunkan penggunaan antibiotik spektrum luas, seperti fluoroquinolone atau carbapenem. Temuan ini masuk akal oleh karena paparan antibiotik sering merupakan faktor risiko terjadinya wabah, namun penggunaan intervensi multipel menyulitkan interpretasi dari studi-studi ini.1
BAB VIII RINGKASAN
Acinetobacter merupakan patogen yang menjadi isu penting dalam tiga dekade terakhir,
khususnya A.baumannii yang berperan pada sekitar 80% kasus dan menyebabkan infeksi yang lebih berat dibanding species lainnya. A.baumannii berkembang dari patogen di rumah sakit yang jarang dan mudah diterapi menjadi patogen di komunitas dan rumah sakit yang meningkat, baik insiden maupun resistensinya terhadap berbagai antibiotik di seluruh dunia. Kemampuan A.baumannii untuk resisten terhadap antibiotik didukung oleh mekanisme intrinsik dari patogen itu sendiri maupun mekanisme resistensi yang bisa didapatkan dari bakteri lain. Resistensi terhadap antibiotik ini terus berkembang dari
multidrug resistant, extended drug resistant, sampai pandrug resistant.
A.baumannii mempunyai spektrum manifestasi klinis yang luas pada hampir
semua sistem organ, di mana pneumonia dan blood stream infection menjadi yang paling sering ditemukan. Secara umum, dampak terbesar dari A.baumannii adalah menyebabkan
ventilator associated pneumonia yang biasanya berupa late-onset. Hasil spesimen yang
menunjukkan adanya A.baumannii harus diinterpretasi hati-hati secara mikrobiologis dan klinis untuk membedakan kontaminasi, kolonisasi, dan infeksi yang sesungguhnya, mengingat patogen ini merupakan salah satu flora komensal tubuh dan bisa hidup lama di benda mati.
Terapi antibiotik terhadap A.baumannii harus diberikan segera, baik secara empirik karena mempengaruhi hasil akhir pada pasien, maupun secara definitif setelah hasil kultur dan resistensi dianalisa dengan cermat. Secara umum, antibiotik yang paling aktif melawan A.baumannii adalah carbapenem, sulbactam, dan polymyxin. Carbapenem umumnya menjadi lini pertama terapi empirik karena masih bisa mengatasi A.baumannii yang masih sensitif, walaupun resistensinya di seluruh dunia meningkat, dan memiliki spektrum luas. Alternatifnya adalah sulbactam yang memiliki aktivitas spesifik melawan
A.baumannii dan memiliki efektivitas serupa, namun kurang baik untuk kasus meningitis.
Polymyxin menjadi obat yang paling aktif dari semuanya terhadap A.baumannii sampai saat ini. Adanya kekuatiran tentang nefrotoksisitas dan neurotoksisitas telah menurun dengan data-data terbaru yang menunjukkan kemungkinannya kecil, disertai
efektivitasnya terbukti dalam mengobati A.baumannii yang resisten terhadap antibiotik lain, termasuk carbapenem. Dengan makin berkembangnya resistensi A.baumannii termasuk terhadap polymyxin, terapi kombinasi diajukan sebagai strategi untuk mencapai sinergi dan mencegah resistensi, yang harus diuji melalui lebih banyak lagi penelitian. Berbagai modifikasi juga dilakukan selain pemilihan jenis antibiotik, seperti pemberian polymyxin inhalasi atau intrathecal sesuai lokasi infeksi dan pemberian infus antibiotik yang diperpanjang.
Pengendalian infeksi juga memegang peranan penting untuk mencegah merebaknya wabah dan A.baumannii yang resisten antibiotik. Prosedur yang penting untuk memotong jalur transmisi ini termasuk mencuci tangan, higiene personal (pasien dan petugas kesehatan), dan penggunaan antibiotik yang hati-hati.
DAFTAR PUSTAKA
1. Munoz-Price LS, Weinstein RA. Acinetobacter Infection. New England Journal of Medicine. 2008; 358:1271-1281.
2. Camp C, Tatum OL. A Review of Acinetobacter baumannii as a Highly Successful Pathogen in Times of War. Labmedicine. 2010; 41(11):650-657.
3. Rungruanghiranya S, Somboonwit C, Kanchanapoom T. Acinetobacter Infection in the Intensive Care Unit. Journal of Infectious Disease and Antimicrobial Agents. 2005; 22:77-92.
4. Perez F, Hujer AM, Hujer KM, Decker BK, Rather PN, Bonomo RA. Global Challenge of Multidrug-Resistant Acinetobacter baumannii. Antimicrobial Agents and Chemotherapy. 2007; 51(10):3471-3484.
5. Peleg AY, Seifert H, Paterson DL. Acinetobacter baumannii: Emergence of a Successful Pathogen. Clinical Microbiology Reviews. 2008; 21(3):538-582.
6. Garnacho-Montero J, Pachon-Ibanez ME, Cisneros-Herreros JM. Nosocomial Pneumonia by Acinetobacter baumannii. In: Rello J (ed.) Nosocomial Pneumonia, Strategies for Management. West Sussex: John Wiley & Sons; 2007.p131-145.
7. Fishbain J, Peleg AY. Treatment of Acinetobacter Infections. Clinical Infectious Disease. 2010; 51(1):79-84.
8. APIC. Guide to the Elimination of Multidrug-resistant Acinetobacter baumannii Transmission in Healthcare Settings. 2010.
9. Allen DM, Hartman BJ. Acinetobacter Species. In : Mandell GL, Bennett JE, Dolin R. Principles and Practice of Infectious Diseases, 7th ed. 2010. Churchill Livingstone:
Philadelphia. p 2881-2884.
10. Zhang H, Zhang J, Qiao L. The Acinetobacter baumannii group: a systemic review. World Journal of Emergency Medicine. 2013; 4(3):169-174.
11. Joshi SG, Litake GM. Acinetobacter baumannii: An emerging pathogenic threat to public health. World Journal of Clinical Infectious Diseases. 2013; 3(3):25-36.
12. Tjoa E, Moehario LH, Rukmana A, Rohsiswanto R. Acinetobacter baumannii: Role in Blood Stream Infection in Neonatal Unit, Dr.Cipto Mangunkusumo Hospital, Jakarta, Indonesia. International Journal of Microbiology. 2013; 1-6.
13. Lean S, Suhaili Z, Ismail S, Rahman NIA, Othman N, Abdullah FH, et al. Prevalence and Genetic Characterization of Carbapenem and Polymyxin-Resistant Acinetobacter baumannii Isolated from a Tertiary Hospital in Terengganu, Malaysia. ISRN Microbiology. 2014; 1-9.
14. Rhomberg PR, Jones RN. Summary Trends for the Meropenem Yearly Susceptibility Test Information Collection Program: a 10-year experience in United States (1999-2008). Diagnostic Microbiology and Infectious Disease. 2009; 65:414-426.
15. Maragakis LL, Perl TM. Acinetobacter baumannii: Epidemiology, Antimicrobial Resistance, and Treatment Options. Clinical Infectious Disease. 2008; 46:1254-1263. 16. Mandell LA, Wunderink RG. Pneumonia. In: Loscalzo J (ed.) Harrison’s Pulmonary
and Critical Care Medicine. New York: McGraw-Hill; 2010.p100-108.
17. Chaari A, Mnif B, Bahloul M, Mahjoubi F, Chtara K, Turki O, et al. Acinetobacter baumannii ventilator-associated pneumonia: epidemiology, clinical characteristics, and prognostic factor. International Journal of Infectious Diseases. 2013; 17:e1225-1228.
18. Magiorakos AP, Srinivasan A, Carey RB, Carmeli Y, Falagas ME, Giske CG, et al. Multidrug-resistant, extensively drug-resistant and pandrug-resistant bacteria: an international expert proposal for interim standard definitions for acquired resistance. Clinical Microbiology Infection. 2012; 18:268-281.
19. Jaggi N, Sissodia P, Sharma L. Acinetobacter baumannii isolates in a tertiary care hospital: Antimicrobial resistance and clinical significance. Journal of Microbiology and Infectious Diseases. 2012; 2:57-63.
20. American Thoracic Society. Guidelines for the Management of Adults with Hospital-acquired, Ventilator-associated, and Healthcare-associated Pneumonia. American Journal of Respiratory and Critical Care Medicine. 2005; 171:388-416.
21. Percin D, Akyol S, Kalin G. In vitro synergism of combination of colistin with selected antibiotics against colistin-resistant Acinetobacter baumannii. GMS Hygiene and Infection Control. 2014; 9(2):1-5.
22. Zavascki AP, Goldani LZ, Li J, Nation RL. Polymyxin B for the treatment of multidrug-resistant pathogens : a critical review. Journal of Antimicrobial Chemotherapy. 2007; 60:1206-1215.
23.Zhou YP, Chua NGS, Chlebicki MP, Ling Lee WH, Kwa ALH. Nonattenuated Polymyxin B Used for the Treatment of Extreme-Drug Resistant Acinetobacter baumannii-related Infections in Patients with Preexisting End Stage Renal Failure. Case Reports in Infectious Diseases. 2014; 1-3.