PENGARUH KATALIS PADA LAJU REAKSI
I. TUJUAN
Setelah melakukan percobaan ini, diharapkan kita mampu :
Menjelaskan bagaimana pengaruh katalis pada reaksi
II. PERINCIAN KERJA
Mencampurkan larutan KI dan K2S2O8 dengan Na2S2O3 berbeda konsentrasi dengan menggunakan larutan Kanji sebagai indicator.
Mencampurkan larutan KI dan K2S2O8 dengan Na2S2O3 berbeda konsentrasi dengan menggunakan Kupri Sulfat (CuSO4) sebagai katalis. III.
ALAT DAN BAHAN
a. Alat
Gelas Kimia 500 ml 1 Buah
Gelas Kimia 250 ml 1 Buah
Tabung Reaksi Besar 12 Buah
Termometer 100 ºC 2 Buah
Pipet Ukur 20 ml 1 Buah
Pipet Ukur 10 ml 1 Buah
Pipet Tetes 1 Buah
Bulp 2 Buah
Neraca Analitik 1 Buah
Labu Semprot 1 Buah b. Bahan Larutan KI Larutan K2S2O8 Larutan Na2S2O3 Indikator Kanji Kristal CuSO4.5H2O Aquadest
IV.DASAR TEORI
Laju menyatakan seberapa cepat atau seberapa lambat suatu proses berlangsung. Laju juga menyatakan besarnya perubahan yang terjadi dalam satu satua waktu.
Reaksi kimia adalah proses perubahan zat pereaksi menjadi produk. Seiring dengan bertambahnya waktu reaksi, maka jumlah zat peraksi semakin sedikit, sedangkan produk semakin banyak. Laju reaksi dinyatakan sebagai laju berkurangnya pereaksi atau laju terbentuknya produk. Laju reaksi dipengaruhi oleh beberapa faktor, antara lain adalah konsentrasi, luas permukaan, temperatur, dan katalis.
Pada praktikum ini yang akan dibahas adalah katalis yang mempengaruhi laju reaksi. Katalis adalah suatu zat yang mempercepat laju reaksi kimia pada suhu tertentu, tanpa mengalami perubahan atau terpakai oleh reaksi itu sendiri. Suatu katalis berperan dalam reaksi tapi bukan sebagai pereaksi ataupun produk. Katalis memungkinkan reaksi berlangsung lebih cepat atau memungkinkan reaksi pada suhu lebih rendah akibat perubahan yang dipicunya terhadap pereaksi. Katalis menyediakan suatu jalur pilihan dengan energi aktivasi yang lebih rendah. Katalis mengurangi energi yang dibutuhkan
untuk berlangsungnya reaksi.
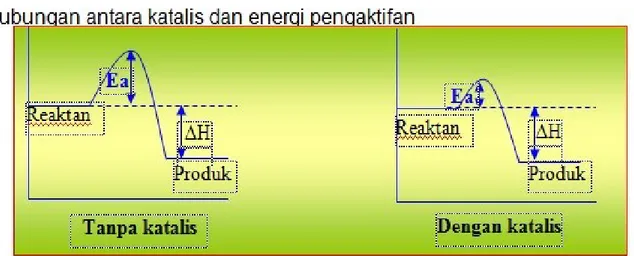
Gambar 2.4 Energi pengaktifan reaksi dengan katalis dan tanpa katalis Berdasrkan Penggunaannya, katalis dapat dibedakan ke dalam dua golongan utama, yaitu:
Katalis heterogen (Adsorpsi) adalah katalis yang ada dalam fase berbeda dengan pereaksi dalam reaksi yang dikatalisisnya. Penggunaan katalis heterogen biasanya pada suhu dan tekanan tinggi. Umumnya katalis heterogen berupa zat padat yang terdiri dari logam atau oksida logam. Keuntungan penggunaan katalis heterogen adalah katalisnya dapat
dipisahkan dengan penyaringan dari produk bila reaksi telah selesai. Banyak proses industri yang menggunakan katalis heterogen, sehingga proses dapat berlangsung lebih cepat dan biaya produksi dapat dikurangi. Beberapa logam ada yang dapat mengikat cukup banyak molekul-molekul gas pada permukannya, misalnya Ni, Pt, Pd dan V. Gaya tarik menarik antara atom logam dengan molekul gas dapat memperlemah ikatan kovalen pada molekul gas, dan bahkan dapat memutuskan ikatan itu. Satu contoh sederhana untuk katalisis heterogen yaitu bahwa katalis menyediakan suatu permukaan di mana pereaksipereaksi (atau substrat ) untuk sementara terjerap. Ikatan dalam substrat-substrat menjadi sedemikian lemah sehingga memadai terbentuknya produk baru. Ikatan atara produk dan katalis lebih lemah, sehingga akhirnya terlepas.
Katalis homogen (Pembentukan senyawa antara) adalah katalis yang berada dalam fase yang sama. Umumnya bereaksi dengan satu atau lebih pereaksi untuk membentuk suatu perantara kimia yang selanjutnya bereaksi membentuk produk akhir reaksi, dalam suatu proses yang memulihkan katalisnya.
Berikut ini merupakan skema umum reaksi katalitik, di mana C melambangkan katalisnya:
A + C → AC ………. (1)
B + AC → AB + C ………. (2)
Meskipun katalis (C) termakan oleh reaksi 1, namun selanjutnya dihasilkan kembali oleh reaksi 2, sehingga untuk reaksi keseluruhannya menjadi :
A + B + C → AB + C
Salah satu contoh katalis homogen adalah reaksi fase gas antara berelang dioksida (SO2) dan oksigen (O2) untuk menghasilkan belerang trioksida (SO3), yaitu :
2SO2(g) + O2(g) → SO3(g) ……….. (1) Lambat dan mempunyai energi pengaktifan tinggi.
Laju reksi tersebut dapat ditingkatkan dengan menambahkan katalis, katalis yang digunakan adalah nitrogen oksida (NO). Reaksi hadirnya NO sebagai katalis adalah sebagai berikut :
2NO (g) + O2(g) → 2NO2(g) ……… (2) NO2 (g) + SO2(g) → SO3 (g) + NO (g) ………. (3)
Dua reaksi yang lebih cepat menggantikan reaksi yang lebih lambat. NO2 yang terbentuk dalam reaksi (2) merupakan senyawa antara darimana NO dihasilkan kembali dalam reaksi (3).
Katalis dapat bekerja dengan membentuk senyawa antara atau mengabsorpsi zat yang direaksikan. Sehingga katalis dapat meningkatkan laju reaksi, sementara katalis itu sendiri tidak mengalami perubahan kimia secara permanen. Cara kerjanya yaitu dengan menempel pada bagian substrat tertentu dan pada akhirnya dapat menurunkan energi pengaktifan dari reaksi, sehingga reaksi berlangsung dengan cepat.
Ada jenis katalis yang lain yaitu katalis enzim. Katalis enzim ini disebut sebagain katalis biologis. Banyak reaksi- reaksi penting yang dikatalisis oleh enzim, misalnya pengubahan karbohidrat atau amilum menjadi glukosa dalam mulut yang dikatalisis oleh enzim ptyalin. Enzim merupakan molekul protein dengan bentuk yang karakteristik yang hanya akan mengijinkan molekul-molekul Pereaksi tertentu berikatan. Reaksi enzimatik ada yang berlangsung secara homogen, Namun ada pula yang berlangsung secara heterogen. Karakteristik enzim adalah pada Kespesifikan dan efisiensinya. Dikatakan spesifik karena reaksi hanya berlangsung pada substrat yang spesifik. misalnya enzim urease spesifik untuk reaksi hidrolisis urea. Efisiensi enzim berkaitan dengan kemampuan enzim meningkatkan laju reaksi berlipat ganda dibandingkan tanpa enzim.
Berdasarkan fungsinya, katalis dibedakan menjadi 2, yaitu :
Katalis positif (katalisator) yang berfungsi mempercepat reaksi.
katalis negatif (inhibitor) yang berfungsi memperlambat laju reaksi. Berdasarkan cara bereaksinya, katalis dibedakan menjadi 2, yaitu :
Katalis aktif yaitu katalis yang ikut terlibat reaksi dan pada akhir rekasi terbentuk kembali.
Katalis pasif yaitu katalis yang tidak ikut bereaksi, hanya sebagai media reaksi saja.
Katalis dapat mempengaruhi terjadinya reaksi, tetapi pada akhir reaksi dapat diperoleh kembali. Fungsi katalis adalah menurunkan energi aktivasi, sehingga jika ke dalam suatu reaksi ditambahkan katalis, maka reaksi akan lebih mudah terjadi. Hal ini disebabkan karena zat- zat yang bereaksi akan lebih mudah melampaui energi aktivasi.
Katalis adalah zat yang mempercepat laju reaksi, tetapi tidak mengalami perubahan kimia secara permanen, sehingga pada akhir reaksi zat tersebut dapat diperoleh kembali. Katalis mempercepat reaksi dengan cara
menurunkan harga energi aktivasi (Ea). Sedangkan zat yang dapat memperlambat laju reaksi disebut inhibitor. Meskipun katalis menurunkan energi aktivasi reaksi, tetapi ia tidak mempengaruhi perbedaan energi antara produk dan pereaksi. Dengan kata lain, penggunaan katalis tidak akan mengubah entalpi reaksi.
Pengaruh katalis dalam mempengaruhi laju reaksi terkait dengan energi pengaktifan reaksi (Ea). Katalis yang digunakan untuk mempercepat reaksi memberikan suatu mekanisme reaksi alternatif dengan nilai Ea yang lebih rendah dibandingkan dengan nilai Ea reaksi tanpa katalis. Semakin rendah nilai Ea maka lebih banyak partikel yang memiliki energi kinetik yang cukup untuk mengatasi halangan Ea yang rendah ini.
Gambar 4. grafik pengaruh katalis terhadap energi pengaktifan (Ea) Dengan memperhatikan gambar.4 diatas dapat dilihat bahwa tanpa katalis, energi pengaktifan (Ea) suatu reaksi lebih banyak, sedangkan dengan menggunakan katalis, Ea menjadi lebih sedikit, sehingga laju reaksi menjadi lebih cepat. Ini berarti bahwa katalis dapat meningkatkan energi pengaktifan suatu reaksi, sehingga laju reaksi menjadi semakin besar.
V. PROSEDUR KERJA
a. Penggunaan Larutan Kanji sebagai indicator
Menyiapkan 2 tabung reaksi besar dan diberi label tabung I dan tabung II
Untuk tabung I, ditambahkan 20 ml larutan KI dan kemudian ditambahkan lagi 10 ml larutan Na2S2O3 0.04 M.
Sedangkan untuk tabung II, ditambahkan larutan 20 ml K2S2O8 0.01 M dan kemudian ditambahkan 3-5 tetes larutan kanji sebagai indicator
Langkah selanjutnya adalah mencampurkan larutan yang ada pada tabung reaksi besar II ke tabung reaksi besar I
Tepat pada saat pencampuran dimulai, stopwatch juga ikut dijalankan
Stopwatch kemudian dihentikan ketika warna campuran larutan berubah dari bening ke biru gelap
Dicatat waktu yang ditunjukkan oleh stopwatch
Mengulangi percobaan 1-8 dengan mengubah konsentrasi K2S2O8 menjadi 0.004 M dan 0.007 M
b. Penggunaan Kupri Sulfat sebagai katalis
Menyiapkan 2 tabung reaksi besar dan diberi label tabung I dan tabung II
Untuk tabung I, ditambahkan 20 ml larutan KI dan kemudian ditambahkan lagi 10 ml larutan Na2S2O3 0.04 M
Sedangkan untuk tabung II, ditambahkan larutan 20 ml K2S2O8 0.01 M dan kemudian ditambahkan 0.0049 g Kristal kupri sulfat (CuSO4)
Langkah selanjutnya adalah mencampurkan larutan yang ada pada tabung reaksi besar II ke tabung reaksi besar I
Tepat pada saat pencampuran dimulai, stopwatch juga ikut dijalankan
Stopwatch kemudian dihentikan ketika warna campuran larutan berubah dari bening ke biru gelap
Dicatat waktu yang ditunjukkan oleh stopwatch
Mengulangi percobaan 1-8 dengan mengubah konsentrasi K2S2O8 menjadi 0.004 M dan 0.007 M
VI.
DATA PENGAMATAN
Volume : Kalium Iodida : 10 ml
Kalium Persulfat : 20 ml
Kalium tiosulfat : 10 ml Berat CuSO4 : 0,0049 gram 1. Tanpa Katalis
Tabung I : KI + Tiosulfat
Tabung II : Kalium persulfat + Kanji Konsentrasi K2S2O8 Waktu 0.07 00:02:56 0.004 00:11:35 0.007 00:05:06 2. Dengan Katalis Tabung I : KI + Tiosulfat
Konsentrasi K2S2O8 Waktu
0.01 00:00:52
0.004 00:05:14
VII. PENGOLAHAN DATA & PEMBAHASAN
a. Pengolahan DataPenentuan massa kupri sulfat (CuSO4.5H2O BM = 249.55 g⁄mol) 0.0001 M M =
liter
mol
M =g /BM
L
g =M × l× BM
g = 0.0001 mol ⁄ l ×0.2 l× 249.55 g ⁄ mol g =0.0049 g
b. PembahasanBanyak faktor yang mempengaruhi laju suatu reaksi. Pengetahuan tentang faktor-faktor ini akan berguna dalam mengatur laju suatu reaksi. Hal ini sangat penting terutama untuk mengontrol proses-proses kimia dalam industri. Tentunya proses kimia yang berlangsung sangat lambat sangat tidak ekonomis. Pengontrolan terhadap factor-faktor yang mempengaruhi laju reaksi kimia akan dapat meningkatakan nilai ekonomis. Faktor- faktor yang mempengaruhi laju reaksi yang meliputi konsentrasi pereaksi, luas permukaan pereaksi, temperatur reaksi dan penggunaan katalisator dalam reaksik kimia.
Perobaan ini bertujuan untuk mengetahui pengaruh katalis terhadap laju reaksi. Oleh karena itu, pada percobaan ini dilakukan dua percobaan yaitu mencampurkan larutan KI dan Na2S2O3 dengan larutan K2S2O8 yang ditambahkan 3-5 tetes indikator kanji serta mencampurkan larutan KI dan Na2S2O3 dengan larutan K2S2O8 yang ditambahkan dengan 0.0049 g katalis kupri sulfat. Kedua larutan ini selanjutnya di campurkan dan diukur bwaktu hingga campuran berubah menjadi warna biru gelap. Setelah melakukan percobaan ini, terlihat hasil bahwa waktu yang dibutuhkan untuk melakukan reaksi yang melibatkan katalis berjalan lebih cepat dibandingkan dengan yang hanya menggunakan indikator. Dari hal tersebut dapat diketahu bahwa katalis mempengaruhi laju reaksi yang terjadi. Katalis adalah suatu zat yang mempercepat laju reaksi kimia pada suhu tertentu, tanpa mengalami perubahan atau terpakai oleh reaksi itu sendiri. Suatu katalis berperan dalam reaksi tapi bukan sebagai pereaksi ataupun produk. Katalis memungkinkan reaksi berlangsung lebih cepat atau memungkinkan reaksi pada suhu lebih rendah akibat perubahan yang dipicunya terhadap pereaksi. Katalis menyediakan suatu jalur pilihan dengan energi aktivasi yang lebih rendah. Katalis mengurangi energi yang dibutuhkan untuk berlangsungnya reaksi. Dengan penambahan katalis
juga dapat meningkatkan energi pengaktifan suatu reaksi, sehingga laju reaksi menjadi semakin cepat.
Reaksi yang terjadi:
VIII. KESIMPULAN
Dari hasil percobaan yang telah dilakukan dapat disimpulkan bahwa reaksi yang melibatkan katalis (dalam hal ini kupri sulfat) dapat mempercepat jalannya laju reaksi suatu campuran di bandingkan suatu reaksi tanpa adanya katalis.
IX.
DAFTAR PUSTAKA
Levit.B.P. ; Findlay’s Practical Physical Chemistry, 9th edition, Longman group ltd, London. http://batalyonchamistr.blogspot.com/p/pertemuan-ke-3.html