TERKADANG HIDUP SEPERTI
KATALIS
JUSMALARA AISYAHNUR
14035026
JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS NEGERI PADANG
TERKADANG HIDUP SEPERTI
KATALIS
Hiii bro and sist welcome to my site...
Semoga artikel ini bermanfaat ya buat kamu-kamu yang baca, disini kita akan bahas tentang katalis. Katalis adalah sebuah istilah di pelajaran Kimia. Bagi anak IPA pasti tidak asing dengan istilah ini. Katalis, secara gampangnya adalah suatu zat yang memepercepat laju reaksi kimia, dengan suhu tertentu, tanpa mengurangi atau merubah zat katalis tersebut. Katalis juga mengurangi energi yang yang dibutuhkan saat reaksi.
Masih linglung dengan pernyataan tersebut??? Baiklah gue akan mempermudah menjelaskannya yaitu dengan mengaitkan dengan kehidupan gue. Anggap aja gue punya temen, sebut saja namanya Reta dan Robert. Gue dan Reta sudah berteman dari SMP, SMA sampai sekarang kuliah pun sama, gue sering main dirumahnya Reta karna kami tetanggaan.
Suatu saat gue melihat cowok yang saya kagumi, namanya Robert orangnya pintar, tinggi, manis, cute lah pokoknya. Gue mengagumi Robert sejak awal masuk kuliah. Baru-baru ini gue suka lihat Robert lewat didepan rumah dan ternyata do`i tinggal dekat komplek rumah kita-kita yeee.
Semenjak gue tau kalau do`i tinggal dekat komplek, kita bertiga sering jalan-jalan bareng, ngampus bareng, explore tempat-tempat wisata di Kota. Soo gue seneng bangeet dong karena jalan-jalan dengan do`i dan sahabat gue.
Tibalah di hari H, gue ngajak Reta main kayak biasanya gue masih bersikap kalo gue lupa kalo Reta ultah dihari itu, biar Retanya ngambek, badmood dan gue juga kadang-kadang ngebully dia biar marah. Sampai lah dipuncak kemarahan si Reta barulah kita akhiri penderitaan Reta dengan keluarnya Robert dengan membawa kue, Reta saat itu cuma bisa diam dan terharu sampai nangis gitu lah, tapi gue malah ngakak smapi-sampai susah buat gue berhenti ngakak karena lihat ekspresi si Reta waktu Robert keluar bawa kue.
Setelah gue siap gue ngakak, gue lihat Robert lagi kasih bunga sama Reta dan mengungkapkan perasaan dan sejenisnyalah pokoknya. Gue saat itu cuma bisa diam aja liat pertunjukan itu. Ternyata ini emeng rencana Robert yang gue gak ketahui, pantesan pas gue ajakin buat kejutan untuk Reta dia semangaat bangeet coba.
Nah, kalian pahamkan sekarang katalis itu apa?
A.Pengertian Katalis
Katalis adalah suatu zat yang mempercepat laju reaksi reaksi kimia pada suhu tertentu, tanpa mengalami perubahan atau terpakai oleh reaksi itu sendiri (lihat pula katalisis). Suatu katalis berperan dalam reaksi tapi bukan sebagai pereaksi ataupun produk.
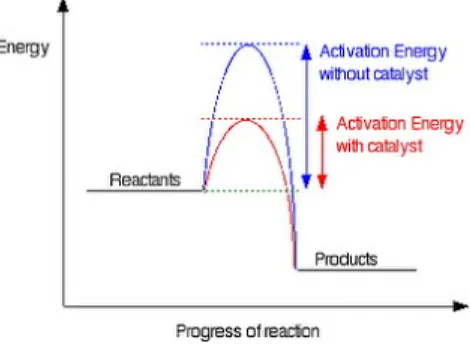
Katalis memungkinkan reaksi berlangsung lebih cepat atau memungkinkan reaksi pada suhu lebih rendah akibat perubahan yang dipicunya terhadap pereaksi. Katalis menyediakan suatu jalur pilihan dengan energi aktivasi yang lebih rendah. Katalis mengurangi energi yang dibutuhkan untuk berlangsungnya reaksi.
Menurut Ostwald (1902), katalisator didefenisikan sebagai substansi yang dapat mengubah laju suatu reaksi tanpa terapat sebagai produk pada akhir reaksi. Katalisator hanya menurunkan tenaga pengaaktifan reaksi kekanan maupun kekiri, sehiingga katalisator tidak mengganggu letak kesetimbangan tetapi hanya mempercepat dicapainya keadaan kesetimbangan.
Sejalan dengan perkembangan pengetahuan terhadap katalisator semakin jelas bahwa katalisator dapat mengawali penggabungan senyawa kimia. Sebagai contoh pada dekomposisi asetaldehid dengan katalisator iodium. Keefektifan iodium sebagai katalisator berhubungan dengan kemudahan molekuul terdisosiasi menjadi atom-atomnya yang akan menyerang molekul organik.
Energi aktivasi untuk reaksi terkatalisis adalah sekitar 32,5 kkal, yang secara signifikan lebih rendah dari pada reaksi tak terkatalisis, yaitu sekitar 48 kkal. Beberapa macam reaksi yang menggunakan katalis, yaitu:
a. Reaksi dalam fasa gas, contoh: 2SO2(g) + O2(g) NO→ 2SO3(g)
CH3COH(g) I→2 CH4(g) + CO(g)
b. Reaksi dalam larutan, contoh reaksi hidrolisa
CH3COOC2H5 + H2O H+→¿¿ CH3COOH + C2H5OH
Glukosa Fruktosa
C12H12O11(aq) + H2O(l) + H+(aq) → C6H12O6 + C6H12O6
c. Reaksi dalam Padatan
KClO3 MnO→ 2 KCl + 1
1 2 O2
B.Cara Kerja Katalis
Pada reaksi katalisis paling sederhana yang melibatkan hanya satu substrat dan katalisator dan katalisator membentuk kompleks dimana setelah itu terdekomposisi dengan pembentukan produk dan katalisator. Mekanisme sederhana yang dapat didekati oleh sebagian besar katalisator yang hanya melibatkan satu substrat dan tidak melibatkan reaksi berantai.
Jika energi aktifasi dari suatu reaksi tinggi, maka pada temperatur normal hanya sebagian kecil tumbukan antar molekul yang menghasilkan reaksi. Agar reaksi dapat berjalan dengan baik dibutuhkan suatu katalis. Katalis dapat menghantarkan reaktan melalui jalan baru yang lebih mudah untuk berubah menjadi produk, yaitu melalui jalan dengan energi aktivasi yang lebih rendah.
Dari gambar diatass terlihat bahwa katalis mempercepat reaksi dengan cara menurunkan energi aktivasi melalui pembentukan zat antara (intermediate) dengan pereaksi dan setelah reaksi selesai dia kembali seperti semula.
C.Macam-Macam Katalis
Katalis juga ada macam-macamnya, dan dapat diklasifikasikan menjadi beberapa jenis yaitu:
1. Katalis Homogen
Adalah katalis yang wujudnya sama dengan wujud reaktannya. Dalam reaksi kimia, katalis homogen berfungsi sebagai zat perantara ( fasilitator ).
a. Katalis Asam-Basa
Mekanisme umumnya melibatkan transfer proton: Contoh:
a) Katalis Asam Bronsted Lowry
Melibatkan transfer proton dari katalis ke substrat.
S + HA → HS+ + A- (HS+ kemudian bereaksi)
Contoh: Solvolisis Ester, Inversi Sukrosa.
b) Katalis Basa Bronsted Lowry
Melibatkan transfer proton dari substrat ke katalis.
SH + B´ → S- + HB+ (HB+ kemudian bereaksi)
b. Katalis Enzim
Enzim sebagai katalis dalam reaksi organik ( pada makhluk hidup ) Karakteristik reaksi enzim:
1. Merupakan katalis yang efisien, karena dapat meningkatkan laju reaksi berlipat ganda walaupun digunakan dalam konsentrasi kecil Contoh:
Urease: digunakan untuk hidrolisis urea, tapi tidak bisa untuk hidrolisis metil urea.
Invertase: digunakan untuk inversi gula.
Zymase: digunakan untuk konversi glukosa.
3. Laju reaksi enzimatik maksimum pada temperatur dan PH optimum Laju reaksi enzimatik meningkat dengan naiknya temperatur tetapi pada batas tertentu, karena suhu yang terlalu tinggi akan merusak enzim sehingga aktivitas enzim berkurang dan laju reaksi turun.
4. Aktivitas enzim dapat diturunkan dengan peracunan, racun tersebut akan bereaksi dengan gugus fungsi aktif pada permukaan enzim.
Contoh: Ion Ag+, Hg2+ akan bereaksi dengan gugus-SH dari enzim
5. Aktivitas katalis dapat ditingkatkan dengan menambahkan zat lain (promotor) / aktivator / koenzim.
Contoh: Ion logam Na+, Mn2+, Co2+, Cu2+, dll yang akan berikatan
dengan enzim dan mempercepat aksi katalitik.
Enzim meerupakan katalis untuk reaktan (substrat) tertentu. Enzim bekerja pada PH dan suhu optimumnya, seperti contoh berikut ini:
Glukosa isomerase untuk isomerisasi glukosa menjadi fruktosa
Protease untuk menguraikan protein
Amilase untuk menguraikan amilum (starch)
Urease untuk menguraikan urea.
2. Katalis Heterogen
Dalam katalis heterogen, reaktan dan katalis berbeda fasa. Biasanya katalis berupa padatan dan reaktan berwujud gas atau cairan. Katalis heterogen sejauh ini adalah jenis katalis yang paling penting dalam industri kimia, terutama dalam sintesis merbagai bahan kimia penting. Disini dijelaskan dua contoh katalis heterogen yang spesifik.
Asam Nitrat adalah salah satu asam anorganik yang paling penting. Asam ini digunakan dalam produksi pupuk, zat warna, obat-obatan, dan bahan peledak. Metode industri yang utama dalam memproduksi asam nitrat adalah proses Ostwald. Bahan awalnya, yaitu ammonia dan molekul oksigen, dipanaskan dengan tambahan adanya katalis platina-rodium sampai sekitar 800oC:
4NH3(g) + 5O2(g) → 4NO(g) + 6H2O(g)
Nitrogen oksida yang terbentuk mudah teroksidasi (tanpa katalis) menjadi nitrogen dioksida:
2NO(g) + O2(g) → 2NO2(g)
Ketika dilarutkan di dalam air, NO2 membentuk asam nitrit dan
asam nitrat:
2NO2(g) + H2O(l) → HNO2(aq) + HNO3(aq)
Jika dipanaskan, asam nitrit berubah menjadi asam nitrat sebagai berikut:
3HNO2(aq) → HNO3(aq) + H2O(l) + 2NO(g)
NO yang dihasilkan dapat didaur-ulang untuk menghasilkan NO2
pada tahap kedua.
Konverter Analitik
Pada suhu tinggi di dalam mesin mobil yang sedang berjalan, gas nitrogen dan oksigen bereaksi menjadi nitrogen oksida.
Ketika lepas ke atmosfer, NO segera bergabung dengan O2
membentuk NO2. Nitrogen dioksida dan gas lain yang diemisikan oleh
mobil, seperti karbon monoksida (CO) dan berbagai hidrokarbon yang tidak terbakar, menjadikan mobil sebagai sumber pencemar udara yang utama.
Sebagian besar mobil baru dilengkapi dengan koverter katalitik. Konverter katalitik yang efisien memiliki dua tujuan; Mengoksidasi CO dan hidrokarbon-hidrokarbon yang tidak terbakar menjadi CO2
dan H2O, dan mereduksi NO dan NO2 menjadi N2 dan O2. Gas buang
panas yang telah diinjeksi dengan udara dilewatkan ke bilik pertama dari salah satu converter untuk mempercepat pembakaran hidrokarbon yang sempurna dan untuk menuurunkan emisi CO. (Gambar di bawah menunjukan penampang melintang dari converter katalitik, mengandung Pt atau Pd atau oksida logam transisi seperti CuO atau Cr2O3). Namun, karena suhu tinggi meningkatkan produksi NO,
diperlukan satu lagi bilik kedua yang berisi katalis berbeda (logam transisi atau oksida logam transisi) dan bekerja pada suhu yang lebih rendah untuk menguraikan NO menjadi N2 dan O2 sebelum dibuang
lewat knalpot.
Perbedaan Katalis Homogen dengan Katalis Heterogen
1. Katalis Homogen
Fasa cair atau gas.
Setiap molekul katalis aktif sebagai katalis.
Aktivitas dan selektivitas rendah-tinggi.
Tidak mudah teracuni oleh adanya sedikit kotoran.
Sukar dipisahkan dari campuran reaksi.
Mudah terurai pada temperatur tinggi.
2. Katalis Heterogen
Fasa padat.
Memiliki pusat aktif yang tidak seragam.
Aktivitas dan selektivitas rendah-tinggi.
Mudah dipisahkan dari campuran reaksi.
Stabil pada temperatur tinggi.
D.Fungsi Katalis
Pada temperatur tetap, fungsi katalis dalam reaksi kimia adalah sebagai berikut:
1.
Katalis dapat digunakan dalam pengaktifan reaksi yang akan mempercepat laju reaksi dengan menurunkan energi aktifasi.2.
Katalis menyediakan reaksi alternatif dalam suatu reaksi kimia.3.
Katalis mempercepat tercapainya keadaan kesetimbangan reaksi.4.
Katalis mempercepat reaksi maju dan reaksi balik sama besar.E. Sifat-sifat Katalis
Katalis memiliki memiliki beberapa sifat-sifat tertentu:
1. Katalis tidak mengubah kesetimbangan dan katalis hanya berpengaruh dan katalis hanya berpengaruh pada sifat kinetik seperti mekanisme reaksi.
2. Katalis juga bersifat spesifik, satu katalis hanya sesuai untuk satu jenis reaksi saja seperti halnya katalis enzim.
3. Komposisi kimia dari katalis tidak berubah pada akhir reaksi.
4. Katalis yang diperlukan suatu reaksi sangat sedikit.
5. Katalis tidak mempengaruhi keadaan akhir suatu reaksi kesetimbangan.
6. Katalis tidak memulai suatu reaksi tetapi mempengaruhi laju reaksi.
7. Katalis mempunyai kondisi optimum.
8. Katalis dapat diracuni oleh suatu zat dalam jumlah yang sangat sedikit yang disebut racun katalis.
9. Kereaktifan katalis dapat diperbesar oleh suatu zat yang disebut pemercepat katalis (promotor).
10. Salah satu hasil reaksi dapat berfungsi sebagai katalis untuk reaksi. Zat ini disebut sebagai oktokatalis.
12. Zat yang dapat memperlambat laju reaksi disebut inibitor.