TEORI LAJU REAKSI
A. Pengertian
Secara etimologis laju reaksi dapat diartikan sebagai perubahan konsentrasi pereaksi (reaktan) atau hasil reaksi (produk) dalam satuan waktu. Laju reaksi dapat dinyatakan sebagai laju berkurangnya konsentrasi reaktan atau laju bertambahnya konsentrasi produk.
Pengetahuan tentang laju reaksi sangat penting dalam penetuan kondisi yang diperlukan untuk membuat suatu produk secara cepat dan ekonomis. Agar suatu reaksi kimia berlangsung, partikel-partikel dari zat yang bereaksi harus bertumbukan satu dengan yang lainnya. Energi kinetik minimum yang harus dimiliki atau yang harus diberikan kepada partikel agar tumbukan mereka menghasilkan reaksi disebut energi pengaktifan (energi aktivasi) dengan lambang Ea. Makin rendah atau kecil Ea, makin mudah suatu reaksi terjadi sehingga makin cepat reaksi itu berlangsung.
B. Teori Tumbukan
Jumlah tumbukan antara molekul-molekul per satuan waktu disebut frekuensi tumbukan. Besar frekuensi tumbukan ini dipengaruhi oleh berbagai faktor antara lain:
1. konsentrasi; 2. suhu
3. luas permukaan bidang sentuh.
Semakin besar konsentrasi suatu larutan, semakin banyak molekul yang terkandung di dalamnya. Dengan demikian, semakin sering terjadi tumbukan di antara molekul-molekul tersebut. Hal itu berarti hanya sebagian dari tumbukan molekul yang menghasilkan reaksi. Keadaan itu didasarkan pada 2 faktor, yaitu:
1. hanya molekul-molekul yang lebih energik yang akan menghasilkan reaksi sebagai hasil tumbukan;
2. kemungkinan suatu tumbukan tertentu untuk menghasilkan reaksi kimia tergantung dari orientasi molekul yang bertumbukan.
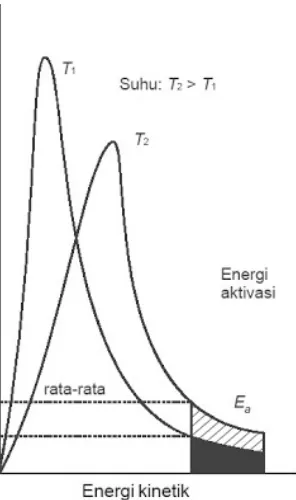
Gambar 1. Distribusi energi molekul-molekul gas.
Pada suhu yang lebih tinggi (T2), fraksi molekul yang mencapai energi pengaktifan sebesar x2, distribusi energi melebar. Energi kinetik molekul rata-rata meningkat dengan kenaikkan suhu sehingga lebih banyak molekul yang memiliki energi lebih besar dari energi pengaktifan. Akibatnya, reaksi makin sering terjadi dan laju reaksi juga semakin meningkat.
Laju reaksi kimia tergantung pada hasil kali frekuensi tumbukan dengan fraksi molekul yang memiliki energi sama atau melebihi energi pengaktifan. Karena fraksi molekul yang teraktifkan biasanya sangat kecil, maka laju reaksi jauh lebih kecil daripada frekuensi tumbukannya sendiri. Semakin tinggi nilai energi pengaktifan, semakin kecil fraksi molekul yang teraktifkan dan semakin lambat reaksi berlangsung. Perhatikan contoh reaksi berikut. A2(g) + B2(g) → 2AB(g)
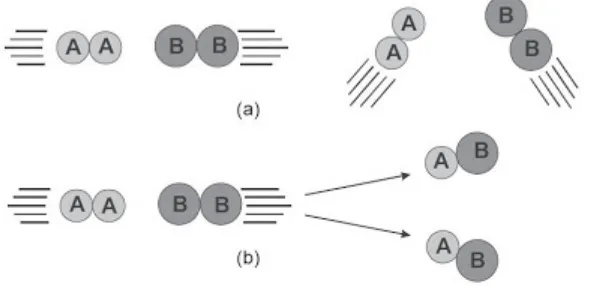
Gambar 2. Tumbukan molekul dan reaksi kimia (a) Tumbukan yang tidak memungkinkan terjadinya reaksi. (b) Tumbukan yang memungkinkan terjadinya reaksi.
Molekul-molekul harus mempunyai orientasi tertentu agar tumbukan efektif untuk menghasilkan reaksi kimia. Pada gambar 2. ditunjukkan bahwa jumlah tumbukan yang orientasinya tidak memungkinkan terjadi reaksi umumnya lebih banyak daripada jumlah tumbukan yang memungkinkan terjadinya reaksi. Hal itu berarti peluang suatu tumbukan tertentu untuk menghasilkan reaksi umumnya kecil.
C. Teori Kompleks Teraktivasi (ACT) atau Teori Keadaan Transisi
Pada gambar di atas, sewaktu partikel NO dan O3 bergerak mendekat, electron terluar dari kedua partikel menimbulkan gaya tolak-menolak dan menyebabkan kedua partikel mengalami perlambatan. Dengan kata lain, energy kinetic partikel (Ek) akan berkurang,
sedangkan energy potensial (Ep) bertambah. (Menurut hokum kekekalan energy, E = Ek +Ep.
Jika Ek berkurang, maka Ep bertambah, begitu pula sebaliknya). Apabila Ek kedua partikel
Sebaliknya, jika kedua partikel memiliki Ek yang cukup dan orientasi yang tepat, maka
keduanya akan dapat mengatasi gaya tolak-menolak dan terjadi tumbukan. Pada saat terjadi tumbukan, partikel NO dan O3 akan bergabung melalui ikatan N --- O membentuk gugus atom yang tidak stabil yang disebut kompleks teraktivasi. Selama proses berlangsung, ikatan O - O pada O3 yang tidak sekuat ikatan N = O pada NO, akan melemah dan ditulis sebagai ikatan O --- O. (Klik gambar untuk memperjelas tulisan)
(NO dan O3 mempunyai struktur resonansi)
Pada saat bersamaan, energy kinetic tumbukan diserap oleh kompleks teraktivasi menjadi energy vibrasi atom-atomnya (energy potensial). Energy ini akan terkonsentrasi pada ikatan N --- O dan O --- O dan dapat bergerak antara kedua ikatan tersebut. akibat adanya pergerakan energi, ada dua kemungkinan yang dapat terjadi:
1. Apabila energi yang cukup terkonsentrasi pada ikatan N --- O, maka ikatan N --- O akan putus dan kompleks teraktivasi akan berubah kembali menjadi pereaksi NO dan O3. Dengan kata lain, terjadi tumbukan gagal.
2. Apabila energi yang cukup terkonsentrasi pada ikatan O --- O, maka ikatan O --- O akan putus dan kompleks teraktivasi akan membentuk produk reaksi NO2 dan O2. Dengan kata lain, terjadi tumbukan efektif. Tumbukan gagal, dan tumbukan efektif ini ditunjukkan oleh diagram energy potensialnya. (klik gambar untuk memperjelas)
Pada gambar di atas:
1. Tumbukan gagal; kompleks teraktivasi berubah kembali menjadi partikel-partikel pereaksi
LATIHAN
1. Hitung laju reaksi, factor frekuensi, dan konstanta laju pada 700 K dan 1 atm (1,02325x105 Nm-2) untuk pengeuraian hydrogen iodide jika garis tengah kolisinya sianggap sampai 0,35 nm. Energy pengaktivasi ialah 184 kJmol-1
. kJmol-1. Berapakah temperature dimana 0,15%, 0,25% dan 0,40% kolisi bola-bola keras antara molekul-molekul reaktan terjadi dengan energy kinetic yang relative cukup sepanjang garis pusat?
3. Hitunglah konstanta laju untuk reaksi berikut pada 300 K dan 1 atm (1,103x105 Nm-2) untuk reaksi-reaksi berikut :
a. ClO + ClO Cl2 + O2 b. 2NO2 2NO + O2 c. NO + Cl2 NOCl + Cl
Jawab: temperature (A∞Tn). Hitung harga eksponen ‘n’ untuk reaksi berikut.
n (T ½)3-1 A = k - T 1/2 n = T ½ n = ½
b. A = kt x qAB n qAqB = kt x ft3 x fv3 x fr2 n ft3 x ft3 x fv0 x fr2 = kt x fv2
n ft3x fv2 = kt x ( T0)2 n (T ½)3 A = kT - 1 n (T 1/2)3 = kT/ n (T 1/2)3 = T 3/2 n = 3/2
5. Jika dianggap bahwa harga fungsi partisi transisi, rotasi, dan vibrasi untuk sistem-sistem berbeda adalah sama, hitung harga factor pra-eksponensial untuk masing-masing reaksi pada soal no 4 di atas, jika harga kT/h=1013detik-1. Hitung factor ruang (P) jika teori kolisi memberikan harga untuk A sebagai 1012 dm3 mol-3detik-1. Jika diketahui qtrans≈ 108, qrot≈rot, qvib≈1.