HAND OUT
KIMIA XI IPA
BAB III
LAJU REAKSI
I. Standarkompetensi
Memahami Kinetika reaksi, kesetimbangan kimia dan factor-faktor yang mempengaruhinya serta penerapannya dalam kehidupan sehari-hari dan industri.
II.Kompetensidasar
Mendeskripsikan pengertian laju reaksidengan melakukan percobaan tentang factor-faktor yang mempengaruhi.
III.Tujuan pembelajaran
1. Siswa dapat menjelaskan pengertian kemolaran. 2. Siswa dapat menetukan molaritas larutan.
3. Siswa dapat membuat larutan dengan molaritas tertentu. 4. Siswa dapat mengecerkan larutan dengan kosentrasi tertentu. 5. Siswa dapat menjelaskan pengertian laju reaksi.
6. Siswa dapat menentukan factor-faktor yang mempangaruhi laju reaksi.
7. Menafsirkan grafik dari data percobaan tentang factor-faktor yang mempengaruhi laju reaksi.
8. Menjelaskan pengaruh konsentrasi, luas permukaan bidang sentuh, dan suhu terhadap laju reaksi berdasarkan teori tumbukan.
9. Membedakan diagram energi potensial dari reaksi kimia dengan menggunakan katalisator dan yang tidak menggunakan katalisator
10.Menjelaskan pengertian, peranan katalisator dan energi pengaktifan dengan menggunakan diagram energy aktivasi.
11.Menentukan orde reaksi.tetapan laju.
III.1 Kemolaran
Kemolaran atau molaritas biasa juga disebut dengan molar merupakan salah satu satuan dari konsentrasi.Kemolaran didefinisikan sebagai jumlah mol zat terlarut dalam tiap liter larutan. Oleh karena itu, satuan kemolaran adalah mol/liter dan dilambangkan dengan M. Secara matematis dirumuskan sebagai berikut:
𝑀 = 𝑉 𝑎𝑡𝑎𝑢 𝑀 = 𝑛 𝑚𝑔
𝑚 ×
Keterangan:
M = kemolaran (mol/L atau mmol/mL) n = mol zat terlarut (mol atau mmol) V = volume larutan (L atau mL) g = massa zat terlarut (gram)
Lambang konsentrasi dapat ditulis dalam bentuk kurung siku, [].Misalnya, konsentrasi HCl dapat ditulis dengan [HCl].
Pengenceran Larutan
Pengenceran merupakan proses memperkecil konsentrasi larutan dengan menambahkan sejumlah tertentu pelarut. Pengenceran menyebabkan volume dan kemolaran larutan berubah tanpa mengubah mol zat terlarut. Sehingga, mol larutan sebelum diencerkan sama dengan mol larutan setelah diencerkan.
Untuk larutan pekat, kemolaran dapat ditentukan jika kadar dan massa jenisnya diketahui, yaitu dengan menggunakan rumus berikut:
Keterangan:
M = kemolaran (mol/L)
𝜌 = massa jenis (kg/L)
mm = massa molar
n1 = n2 V1 M1 =V2 M2
𝑀 = 𝜌 × 10 × 𝑘𝑎𝑑𝑎𝑟𝑚
III.2 Konsep Laju Reaksi
1. Pengertian Laju Reaksi
Reaksi kimia merupakan proses perubahan zat pereaksi menjadi produk. Dengan bertambahnya waktu reaksi, maka jumlah zat pereaksi akan semakin sedikit, sedangkan produk semakin banyak. Oleh karena itu laju reaksi dapat dinyatakan sebagai laju berkurangnya pereaksi atau laju terbentuknya produk. Dengan kata lain, laju reaksi merupakan besaran yang menyatakan perubahan konsentrasi zat-zat dalam reaksi kimia, yakni berkurangnya pereaksi atau bertambahnya produk per satuan waktu.
Contoh 1:
Sebanyak 5 gram NaOH dilarutkan dalam 200 mL air. Tentukan kemolaran larutan tersebut jika mm NaOH = 40 g/mol!
Diketahui kadar HCl sebanyak 36,5% dengan massa jenis 1,19 g/L. tentukan: a. MolaritasHCl!
b. Volume asamklorida yang diperlukan untuk membuat 500 mL HCl 1 M!
Penyelesaian:
a. 𝑀 = 𝜌 ×10 ×𝑘𝑎𝑑𝑎𝑟 𝑚𝑚
[HCl] = 1,19 𝑔/𝐿 × 10 × 36,5
36,5 𝑔/𝑚𝑜𝑙 = 11,9 mol/L = 11,9 M
b. Volume HCl yang diperlukan dapat dihitung menggunakan rumus pengenceran:
V1 M1 = V2 M2
V1 . 11,9 M = 500 mL . 1 M
Latihan2.1 :
2. PenentuanLajuReaksi
Laju reaksi ditentukan melalui percobaan, yaitu dengan mengukur banyaknya pereaksi yang habis bereaksi atau banyaknya produk yang dihasilkan pada selang waktu tertentu. Cara yang umum digunakan untuk menyatakan laju reaksi adalah laju pengurangan konsentrasi molar pereaksi atau laju pertambahan konsentrasi molar produk dalam satu satuan waktu.
Reaksi:
Padaawalreaksi, reaktan ada dalam keadaan maksimum sedangkan produk ada dalam keadaan minimal. Setelah reaksi berlangsung, maka produk akan mulai terbentuk.Semakin lama produk akan semakin banyak terbentuk, sedangkan reaktan semakin lama semakin berkurang.
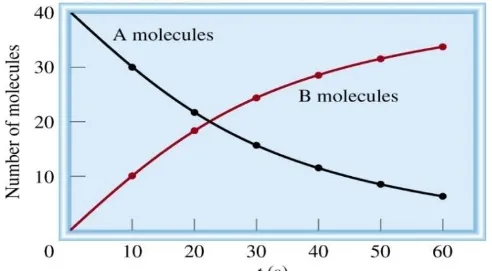
Gambar 3.1 Grafiklajureaksiperubahankonsentrasiprodukdankonsentrasireaktan.
Dari gambar 3.1 terlihat bahwa konsentrasi reaktan semakin berkurang, sehingga laju reaksinya (v) adalah berkurangnya konsentrasi A setiap satuan waktu, sedangkan produk semakin bertambah, sehingga laju reaksinya dapat juga dilihat dari bertambahnya konsentrasi B setiap satuan waktu, yang dirumuskan sebagai berikut:
atau
Keterangan:
A = pereaksi (reaktan)
B = produk
v = laju reaksi (M s-1)
t = waktu reaksi (s)
∆[𝐴] = perubahan konsentrasi reaktan (M)
∆[𝐵] = perubahan konsentrasi produk (M)
Tanda (−) artinya pengurangan konsentrasi salah satu pereaksi Tanda (+) artinya pertambahan konsentrasi salah satu produk
Contoh :
Berdasarkanreaksi:
2N2O5(g) → 4NO2(g) + O2(g)
diketahuibahwa N2O5berkurangdari 2 mol/liter menjadi 0,5 mol/liter dalamwaktu10
detik. Berapakahlajureaksiberkurangnya N2O5?
Penyelesaian:
𝑣 = −∆[𝑅]∆𝑡
𝑣𝑁2𝑂5= −
∆[𝑁2𝑂5]
∆𝑡
𝑣𝑁2𝑂5= −
(2 − 0,5)𝑀
10 𝑠 = −1,5 𝑀/𝑠
Maka, laju berkurangnya N2O5= 1,5 𝑀/𝑠
Menurut reaksi diatas, berdasarkan koefisien reaksinya laju pembentukan O2 sama
dengan setengah dari laju peruraian N2O5 atau ¼ dari pembentukan NO2. Sehingga, laju
reaksi dinyatakan sebagai 1/koefisien dari laju masing-masing komponen. Jadi laju reaksinya dinyatakan sebagai berikut:
III.3 Faktor-faktor yang Mempengaruhi Reaksi
Berdasarkan hasil percobaan, laju reaksi dipengaruhi oleh konsentrasi, luas permukaan sentuhan, suhu dan katalis.
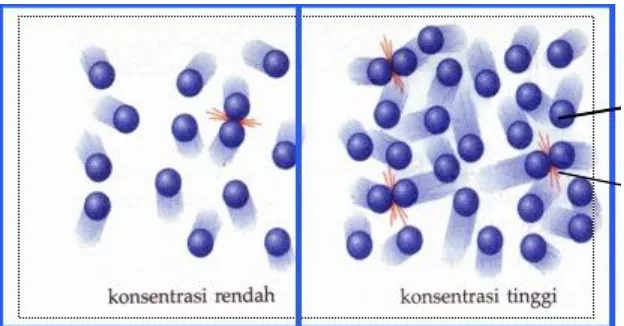
1. Konsentrasi
Gambar 3.2Reaksilogam
Zn denganHCl 3 M (kiri)danHCl 1 M (kanan)
2. Luas Permukaan Sentuhan
Salah satu syarat agar reaksi dapat berlangsung adalah zat-zat pereaksi harus bercampur atau bersentuhan. Pada campuran pereaksi yang heterogen, reaksihanya terjadi pada bidang batas campuran. Bidang batas campuran inilah yang dimaksud dengan bidang sentuh. Dengan memperbesar luas bidang sentuh, reaksi akan berlangsung lebih cepat Pada umumnya, reaksi akan berlangsung lebih cepat jika konsentrasi pereaksi diperbesar. Zat yang konsentrasinya besar mengandung jumlah partikel yang lebih banyak, sehingga partikel-partikelnya tersusun lebih rapat dibanding zat yang konsentrasinya rendah. Partikel yang susunannya lebih rapat, akan lebih sering bertumbukan dibanding dengan partikel yang susunannya renggang, sehingga kemungkinan terjadinya reaksi semakincepat.
karena semakin luas permukaan sentuh, semakin banyak tempa tterjadinya tumbukan antar molekul yang bereaksi.
Misalnya, gula yang berbentuk butiran halus akan lebih cepat larut dalam air dari pada gula yang berbentuk butiran kasar. Kayu balok yang telah dibelah lebih mudah terbakar dibandingkan dengan kayu balok yang masih utuh.
3. Suhu
Laju reaksi dapatdipercepatataudiperlambatdengancaramengubahsuhunya.Ada
kecenderunganbahwapadasuhu yang lebihtinggi,
reaksikimiaberlangunglebihcepat.Denganmenaikkansuhureaksi,
4. Tekanan
Lajureaksijugadipengaruhiolehtekanan, penambahantekanandenganmemperkecil volume akanmemperbesarkonsentrasi, sehinggadapatmempercepatlajureaksi.
5. Katalis
Katalisadalahzat yang
dapatmengubahlajureaksitanpamengalamipeubahansecarakimiawai di akhirreaksi.katalis yang mempercepatlajureaksidisebutkatalispositifataukatalissaja.Sedangkankatalis yang memperlambatlajureaksidisebutkatalisnegatifatauinhibitor.
Katalisdibedakanmenjadidua,
yaitukatalishomogendankatalisheterogen.Katalishomogenadalahkatalis yang sefasedenganzat yang dikatalisis.Misalnya, larutan FeCl3padareaksipenguraianlarutan
H2O2:
2H2O2(aq)
𝑘𝑎𝑡𝑎𝑙𝑖𝑠 𝐹𝑒𝐶𝑙3
Katalisheterogenadalahkatalis yang fasenyaberbedadenganzat yang dikatalisis.Misalnya, katalislogambesidalamreaksipembuatanamoniadari gas nitrogen dan gas hidrogen.
Berikut grafik reaksi tidak menggunakan katalis dan menggunakan katalis:
N2(g) + 3H2(g) 𝐹𝑒
III.4 Persamaan Laju Reaksi 1. Persamaan Laju Reaksi
Persamaan laju reaksi menggambarkan hubungan kuantitatif antara laju reaksi dengan konsentrasi reaktan. Untukreaksi:
Persamaan laju:
Keterangan: k =tetapanlajureaksi
v =lajureaksi (mol L-1s-1)
[A], [B] =konsentrasipereaksi A, B
x =ordereaksiterhadappereaksi A
y =ordereaksiterhadappereaksi B
Pangkat konsentrasi pereaksi pada persamaan laju reaksi disebut orde atau tingkat reaksi.
mA +nB → pC + qD
2. Pengertian Orde Reaksi
Orde reaksi adalah besarnya pengaruh konsentrasi reaktan terhadap laju reaksi. Orde reaksi dapat berupa:
a. OrdeNol
b. OrdeSatu
Reaksi berorde satu artinya laju reaksi berbanding lurus terhadap perubahan konsentrasi reaktan. Jika konsentrasi reaktan diperbesar tiga kali, menyebabkan laju reaksi menjadi tiga kali lebih besar.
c. OrdeDua
Reaksi berorde dua artinya
laju reaksi berbanding lurus dengan kuadrat perubahan konsentrasi reaktan. Jika konsentrasi reaktan diperbesar tiga kali, menyebabkan laju reaksi berubah menjadi 32
atau 9 kali lebih besar.
3. Menentukan Persamaan Laju
Salah satu cara menentukan persamaan laju adalah metode laju awal. Berdasarkan metode laju awal, laju diukur pada awal reaksi dengan konsentrasi yang berbeda-beda. Untuk memahami metode ini perhatikan contoh berikut:
2NO(g) + Br2(g) → 2NOBr(g)
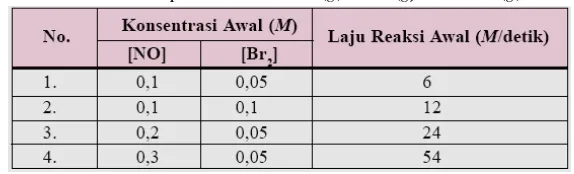
Berdasarkan hasil percobaan diperoleh data sebagai berikut:
Tabel 3.1 Data percobaanreaksi2NO(g) + Br2(g) → 2NOBr(g)
Tentukan:
a) Orde reaksi terhadap NO b) Orde reaksi terhadap Br2
c) Orde reaksi total d) Persamaan laju reaksi e) Harga tetapan reaksi k
Penyelesaian:
Persamaanlajureaksinyaadalah: v = k[NO]x[Br 2]y
a) Ordereaksiterhadap NO adalahx, dapatditentukandenganmembandingkan data dariduapercobaandengankonsentrasi Br2 yang sama. Misalnya, percobaan 1 dan 3. 𝑣1
ditentukandenganmembandingkanduapercobaandengankonsentrasi NO yang sama. Yaitu, percobaan 1 dan 2.
𝑣1
III.5 Teori Tumbukan
Teori tumbukan menggambarkan pertemuan partikel-patikel pereaksi sebagai suatu tumbukan, sedangkan tumbukan yang dapat menghasilkan partikel-partikel produk reaksi disebut tumbukan efektif.
reaksi, maka reaksi berlangsung secara eksoterm. Sebaliknya, jika energi produk lebih tinggi dari pada energi yang dimiliki kedua pereaksi pada awal reaksi, maka reaksi berlangsung secara endoterm.
SOAL-SOAL
1. Natrium hidroksida merupakan satu diantara beberapa zat kimia yang digunakan untuk membuat sabun, deterjen, dan kertas. Jika 2 g NaOH (Mr = 40) dilarutkan dalam air hingga 250 mL, tentukan komolaran larutan tersebut!
2. Lahan pertanian yang bersifat asam dapat dinetralkan dengan kalsium hidroksida Ca(OH)2 (Mr = 74).Jika diperlukan 0,3 M Ca(OH)2 400 mL, berapa gram Ca(OH)2 yang harus dilarutkan?
3. Di sebuah meja praktikum di laboratorium kimia terdapat botol pereaksi dengan label yang tulisannyaNaOH 4% (m/v), volume 100 mL, dan massa jenis, ρ = 1,1 g/mL.Tentukan kemolaran NaOH tersebut jika diketahui Mr NaOH = 40!
4. Dalam suatu percobaan penentuan laju reaksi P + Q → R, diperoleh data sebagai berikut:
5. a. Jelaskan pengaruh penambahan katalisator terhadap laju suatu reaksi!
b. Berikan contoh reaksi yang menggunakan katalis, sebutkan juga katalisator yang digunakan!
a. Ordereaksiterhadap A, B, C danorde total b. Hargadansatuan k
a. Ordereaksiterhadap A, B, danorde total b. Hargadansatuan k
a. Ordereaksiterhadap A, B, danorde total b. Hargadansatuan k
c. Persamaanlajureaksinya