TATA NAMA SENYAWA DAN PERSAMAAN REAKSI
A.Kompetensi Inti
KI 1 : Menghayati dan mengamalkan ajaran agama yang dianutnya
KI 2 : Menghayati dan mengamalkan perilaku jujur, disiplin, tanggungjawab, peduli (gotong royong, kerjasama, toleran, damai), santun, responsif dan pro-aktif dan menunjukkan sikap sebagai bagian dari solusi atas berbagai permasalahan dalam berinteraksi secara efektif dengan lingkungan sosial dan alam serta dalam menempatkan diri sebagai cerminan bangsa dalam pergaulan dunia.
KI 3: Memahami, menerapkan, menganalisis pengetahuan faktual, konseptual, prosedural berdasarkan rasa ingintahunya tentang ilmu pengetahuan, teknologi, seni, budaya, dan humaniora dengan wawasan kemanusiaan, kebangsaan, kenegaraan, dan peradaban terkait penyebab fenomena dan kejadian, serta menerapkan pengetahuan prosedural pada bidang kajian yang spesifik sesuai dengan bakat dan minatnya untuk memecahkan masalah.
KI 4 : Mengolah, menalar, dan menyaji dalam ranah konkret dan ranah abstrak terkait dengan pengembangan dari yang dipelajarinya di sekolah secara mandiri, dan mampu menggunakan metoda sesuai kaidah keilmuan.
B. Kompetensi Dasar dan Indikator
1.1 Menyadari adanya keteraturan struktur partikel materi sebagai wujud kebesaran Tuhan YME
dan pengetahuan tentang struktur partikel materi sebagai hasil pemikiran kreatif manusia yang
kebenarannya bersifat tentatif.
2.1 Menunjukkan perilaku ilmiah (memiliki rasa ingin tahu, disiplin, jujur, objektif, terbuka,
mampu membedakan fakta dan opini, ulet, teliti, bertanggung jawab, kritis, kreatif, inovatif,
demokratis, komunikatif ) dalam merancang dan melakukan percobaan serta berdiskusi yang
diwujudkan dalam sikap sehari-hari.
2.2 Menunjukkan perilaku kerjasama, santun, toleran, cinta damai dan peduli lingkungan serta
hemat dalam memanfaatkan sumber daya alam.
3.9 Menerapkan aturan IUPAC untuk penamaan senyawa anorganik dan organik sederhana. Indikator:
1. Menentukan nama senyawa kimia biner logam – nonlogam 2. Menentukan nama senyawa kimia biner nonlogam – nonlogam 3. Menentukan nama senyawa kimia poliatomik sederhana
4.9 Menalar aturan IUPAC dalam penamaan senyawa anorganik dan organik sederhana. Indikator:
A. Tata Nama Senyawa Sederhana
Setiap rumus kimia mempunyai nama dengan aturan-aturan yang telah ditentukan dan disebut tata nama senyawa. Dengan mengetahui rumus kimia, kita dapat menuliskan zat-zat yang bereaksi dan hasil reaksinya dalam suatu persamaan reaksi.
Tata nama sistematik dari senyawa kimia disusun dan diatur oleh IUPAC (International Union of Pure and Applied Chemistry atau organisasi Internasional Kimia Murni dan Terapan). Penerapan tata nama senyawa kimia meliputi senyawa – senyawa biner, poliatomik, dan ionik.
1. Tata Nama Senyawa Biner yang Terdiri dari Atom Logam dan Nonlogam
Suatu senyawa dapat tersusun atas dua atau lebih unsur kimia. Senyawa yang tersusun atas dua unsur kimia disebut senyawa biner. Berikut tata nama senyawa biner yang tersusun atas unsur logam dan nonlogam.
a. Nama senyawa kimia yang terdiri dari dua unsur (senyawa biner) menggunakan akhiran –ida. b. Unsur logam (kation) disebutkan terlebih dahulu diikuti unsur nonlogam (anion).
c. Jumlah unsur yang menyusun senyawa tidak berpengaruh terhadap penamaan senyawa. Contoh:
KCl = kalium klorida
NaCl = natrium klorida
MgI2 = magnesium iodida
MgO = magnesium oksida
Na2S = natrium sulfida
d. Jika kation berasal dari logam yang memiliki jumlah muatan lebih dari satu, maka Di belakang nama logam (dalam bahasa Indonesia) dituliskan muatan ion dalam kurung dengan tulisan Romawi dilanjutkan dengan nama nonlogam diberi akhiran –ida.
Contoh:
FeCl2 = besi (II) klorida
FeCl3 = besi (III) klorida
CuO = Tembaga (II) oksida
2. Tata Nama Senyawa Biner yang Terdiri dari Atom Nonlogam dan Nonlogam
Senyawa biner dari nonlogam dan nonlogam disebut dengan senyawa kovalen biner. Cara penamaan senyawa kovalen biner adalah sama seperti senyawa ion, yaitu diberi akhiran "ida". Jika pasangan unsur hanya membentuk satu jenis senyawa, angka indeks (jumlah atom) tidak perlu disebutkan.
Contoh:
HCl = hidrogen klorida
Beberapa pasang unsur dapat pula membentuk lebih dari satu senyawa biner. Penamaan senyawa harus disebutkan jumlah atomnya dalam angka latin dengan indeks dalam bahasa Yunani, sebagai berikut:
Indeks angka satu untuk unsur pertama umumnya tidak pernah disebutkan. Contoh:
CO = karbon monoksida CO2 = karbon dioksida N2O3 = dinitrogen trioksida N2O5 = dinitrogen pentoksida HBr = hidrogen bromida HF = hidrogen fluorida CS2 = karbon disulfida
1. Tuliskan nama senyawa-senyawa berikut! a. LiCl
b. RbI c. CaCl2 d. SrO e. Al2O3 f. NaF g. Fe2O3 h. SnCl2 i. MnO j. CaS
2. Tuliskan rumus senyawa ion yang mempunyai nama berikut! a. Natrium sulfida
b. Magnesium oksida c. Aluminium sulfida d. Stronsium klorida e. Magnesium nitrida f. Tembaga (II) klorida g. Tembaga (I) oksida h. Seng (II) iodida i. Kromium (II) oksida j. Timah (II) oksida
3. Tuliskan nama senyawa-senyawa berikut. a. CO
b. PCl5 c. CO2 d. SCl6 e. SiCl4 f. SO2 g. Cl2O h. CBr4 i. Cl2O5 j. ClF3
4. Tuliskan rumus molekul senyawa yang mempunyai nama berikut. a. Fosforus triklorida
b. Karbon disulfida c. Karbon tetraklorida d. Difosforus trioksida e. Dinitrogen trioksida f. Diklorin heptaoksida g. Silikon dioksida h. Sulfur trioksida i. Diklorin trioksida j. Diarsen trioksida
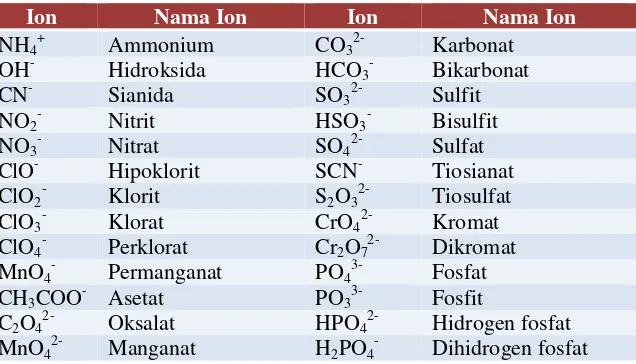
3. Tata Nama Senyawa Poliatomik
Senyawa poliatom dibentuk oleh lebih dari dua atom yang berbeda. Pada umumnya senyawa ini dibentuk oleh ion-ion poliatomik. Ion-ion poliatomik itu sendiri adalah ion-ion yang terdiri atas dua atom atau lebih yang terikat bersama, umumnya dijumpai tersusun atas unsur-unsur nonlogam.
Tabel 4.1 Rumus dan Nama Ion – ion Poliatomik
Ion Nama Ion Ion Nama Ion
NH4+ Ammonium CO32- Karbonat
OH- Hidroksida HCO3- Bikarbonat
CN- Sianida SO32- Sulfit
NO2- Nitrit HSO3- Bisulfit
NO3- Nitrat SO42- Sulfat
ClO- Hipoklorit SCN- Tiosianat
ClO2- Klorit S2O32- Tiosulfat
ClO3- Klorat CrO42- Kromat
ClO4- Perklorat Cr2O72- Dikromat MnO4- Permanganat PO43- Fosfat
CH3COO- Asetat PO33- Fosfit
C2O42- Oksalat HPO42- Hidrogen fosfat MnO42- Manganat H2PO4- Dihidrogen fosfat
Nama senyawa ion poliatomik adalah gabungan nama kation, nama anion dan angka indeks tidak disebutkan. Senyawa ion bersifat netral, jumlah muatan positif sama dengan jumlah muatan negatif.
Contoh:
NaClO = natrium hipoklorit
KMnO4 = kalium permanganat
CaCO3 = kalsium karbonat
KNO3 = kalium nitrat
4. Tata Nama Senyawa Asam
Asam adalah senyawa kovalen yang terdiri atas ion H+ (sebagai kation)
dan suatu anion. Penamaan asam didahului dengan kata asam yang diikuti nama anion. Contoh:
HBr = asam bromida H2SO4 = asam sulfat HNO3 = asam nitrat
5. Tata Nama Senyawa Basa
Pada umumnya basa adalah senyawa ion dari logam dengan ion OH–. Penamaannya diawali dengan menyebutkan ion logam dan diikuti dengan hidroksida.
Contoh:
KOH = kalium hidroksida Mg(OH)2 = magnesium hidroksida Fe(OH)2 = besi (II) hidroksida
1. Tuliskan nama asam dengan rumus kimia sebagai berikut. a. H2CO3
b. H2SO3 c. H2S d. HCl e. H3PO3 f. CH3COOH
2. Tuliskan rumus kimia asam-asam berikut. a. Asam sulfat
b. Asam klorat c. Asam oksalat d. Asam fosfat e. Asam perklorat f. Asam nitrit
3. Tuliskan nama dari basa berikut ini. a. Fe(OH)2
b. Zn(OH)2 c. Cr(OH)3 d. KOH e. Au(OH)3 f. Sn(OH)2
4. Tuliskan rumus kimia dari basa berikut ini. a. Natrium hidroksida
b. Tembaga (II) hidroksida c. Aluminium hidroksida d. Nikel (II) hidroksida e. Kalsium hidroksida f. Raksa (I) hidroksida
5. Tentukan massa molekul relatif dari senyawa berikut. a. CaCO3
b. Na2HPO4 c. NaHCO3 d. KNO3 e. MgSO4 f. K2MnO4
6. Tuliskan rumus kimia dan bentuk ion-ion yang terdapat dalam senyawa berikut: a. Amonium fosfat
b. Natrium sulfida
c. Natrium dihidrogen fosfat d. Barium sulfat
e. Besi (II) nitrat f. Tembaga (I) asetat
7. Tuliskan rumus kimia yang terbentuk dari kation dan anion berikut, serta beri nama senyawa yang terbentuk!
Kation Anion
Cl- NO2- SO42- Cr2O72- PO43-
K+ Ca2+
Zn2+
Ag+ Al3+
B. Persamaan Reaksi
Kita mengenal perubahan fisika dan perubahan kimia. Perubahan fisika yaitu perubahan yang tidak menghasilkan zat baru sedangkan perubahan kimia menghasilkan zat baru. Perubahan kimia disebut juga reaksi kimia. Contoh perubahan kimia yang dapat diamati di lingkungan kita yaitu kayu dibakar menjadi arang dan besi berkarat.
Reaksi kimia dapat diamati karena adanya perubahan dari warna zat
Persamaan reaksi didefinisikan sebagai persamaan yang menyatakan kesetaraan jumlah zat-zat yang terlibat dalam reaksi kimia dengan menggunakan rumus kimia. Dalam reaksi kimia terdapat zat-zat pereaksi dan zat-zat hasil reaksi. Dalam menuliskan persamaan reaksi, rumus kimia pereaksidituliskan di ruas kiri dan rumus kimia hasil reaksi dituliskan di ruas
kanan. Antara kedua ruas itu dihubungkan dengan tanda panah ( → ) yang menyatakan arah reaksi kimia. Contoh:
Logam magnesium bereaksi dengan gas klorin membentuk magnesium klorida. Persamaan reaksinya adalah:
Magnesium + klorin → magnesium klorida, atau dapat dituliskan dengan rumus kimia menjadi: Mg + Cl2→ MgCl2
Hal-hal yang digambarkan dalam persamaan reaksi adalah rumus kimia zat-zat pereaksi (reaktan) di sebelah kiri tanda panah dan zat-zat hasil reaksi (produk) di sebelah kanan tanda panah. Anak panah dibaca yang artinya “membentuk” atau “bereaksi menjadi”. Wujud atau keadaan zat-zat pereaksi dan hasil reaksi ada empat macam, yaitu gas (g), cairan (liquid atau l), zat padat (solid atau s) dan larutan (aqueous
atau aq).
Bilangan yang mendahului rumus kimia zat-zat dalam persamaan reaksi disebut koefisien reaksi. Koefisien reaksi diberikan untuk menyetarakan atom-atom sebelum dan sesudah reaksi. Selain untuk menyetarakan persamaan reaksi, koefisien reaksi menyatakan perbandingan paling sederhana dari partikel zat yang terlibat dalam reaksi.
Misalnya, reaksi antara gas hidrogen dengan gas oksigen membentuk air sebagai berikut.
Pereaksi atau reaktan Hasil reaksi/produk
2H2(g) + O2(g) → 2H2O(l) ↓ ↓ ↓
koefisien H2 = 2 koefisien O2 = 1 koefisien H2O = 2
Berdasarkan persamaan reaksi di atas, berarti 2 molekul hidrogen bereaksi
dengan 1 molekul oksigen membentuk 2 molekul H2O. Oleh karena itu sebaiknya dihindari koefisien pecahan karena dapat memberi pengertian seolah – olah partikel materi (atom atau molekul) dapat dipecah.
Penulisan persamaan reaksi dapat dilakukan dalam dua langkah sebagai berikut:
1. Menuliskan rumus kimia zat-zat pereaksi dan produk, lengkap dengan keterangan tentang wujudnya. 2. Penyetaraan, yaitu memberi koefisien yang sesuai, sehingga jumlah atom ruas kiri sama dengan
jumlah atom ruas kanan.
C. Penyetaraan Reaksi
Suatu persamaan reaksi dikatakan benar jika memenuhi hukum kimia, yaitu zat-zat yang terlibat dalam reaksi harus setara, baik jumlah zat maupun
muatannya.
Banyak reaksi dapat disetarakan dengan jalan mencoba/menebak, akan tetapi sebagai permulaan dapat mengikuti langkah berikut:
1. Pilihlah satu rumus kimia yang paling rumit, tetapkan koefisiennya sama dengan 1. 2. Zat-zat yang lain tetapkan koefisien sementara dengan huruf.
3. Setarakan dahulu unsur yang terkait langsung dengan zat yang tadi diberi koefisien 1. 4. Setarakan unsur lainnya. Biasanya akan membantu jika atom O disetarakan paling akhir.
Suatu persamaan reaksi harus disetarakan agar sesuai dengan hukum kekekalan massa yang menyatakan bahwa: “dalam setiap reaksi kimia, jumlah massa zat – zat sebelum dan sesudah reaksi adalah sama”. Maka, tidak ada atom unsur yang terhilang atau tercipta setelah reaksi kimia berlangsung.
1. Tuliskan dan setarakan persamaan reaksi antara gas metana (CH4) dengan gas oksigen membentuk gas karbon dioksida dan uap air.
Penyelesaian:
Langkah 1: Menuliskan rumus kimia dan persamaan reaksi CH4(g) + O2(g) → CO2(g) + H2O(l)
Langkah 2: Penyetaraan
Tetapkan koefisien CH4 = 1, sedangkan koefisien zat-zat lainnya dimisalkan dengan huruf.
1CH4(g) + aO2(g) → bCO2(g) + cH2O(l)
Setarakan jumlah atom ruas kiri dan kanan
Jumlah Atom
Koefisien 1 tidak perlu ditulis, sehingga persamaan reaksi menjadi: CH4(g) + 2O2(g) → CO2(g) + 2H2O(l)
2. Tuliskan dan setarakan persamaan reaksi antara logam aluminium dengan klorida membentuk larutan aluminium klorida dan gas hidrogen.
Penyelesaian:
Langkah 1: Menuliskan rumus kimia dan persamaan reaksi Al(s) + HCl(aq) → AlCl3(aq) + H2(g)
Langkah 2: Penyetaraan
Tetapkan koefisien AlCl3 = 1, sedangkan koefisien zat-zat lainnya dimisalkan dengan huruf.
aAl(s) + bHCl(aq) → 1AlCl3(aq) + cH2(g) Setarakan jumlah atom ruas kiri dan kanan
Jumlah Atom
Karena koefisien tidak boleh pecahan, untuk membulatkan pecahan, maka semua koefisien dikalikan dua, sehingga persamaan reaksi menjadi:
2Al(s) + 6HCl(aq) → 2AlCl3(aq) + 3H2(g)
9. H3PO4 + Ca(OH)2 → Ca3(PO4)2 + H2O 10. Al + HCl → AlCl3 + H2
11. Fe2O3+ HBr → FeBr3 + H2O 12. Pb(NO3)2+ NaCl → PbCl2 + NaNO3 13. K3PO3 + MgI2→ KI + Mg3(PO3)2 14. C2H4 + O2 → CO2 + H2O
15. C3H4 + O2→ CO2 + H2O 16. C2H5OH + O2→ CO2 + H2O 17. Ag2O + NH3→ Ag + N2 + H2O 18. Cu + HNO3→ Cu(NO3)2 + NO + H2O 19. I2 + NaOH → NaI + NaIO3 + H2O 20. NaOH + H2SO4 → Na2SO4 + H2O
b. Tuliskan persamaan reaksi berikut, kemudian setarakan!
1. Gas nitrogen bereaksi dengan gas hidrogen membentuk amonia. 2. Gas hidrogen bereaksi dengan gas oksigen membentuk air.
3. Logam aluminium bereaksi dengan gas oksigen membentuk aluminium oksida padat. 4. Kalsium oksida padat bereaksi dengan air membentuk larutan kalsium hidroksida.
5. Larutan natrium hidroksida bereaksi dengan larutan asam sulfat membentuk larutan natrium sulfat dan air.
6. Larutan asam klorida bereaksi dengan larutan magnesium hidroksida membentuk larutan magnesium klorida dan air.
7. Butana terbakar sempurna membentuk gas karbon dioksida dan air.
8. Larutan magnesium nitrat bereaksi dengan larutan natrium fosfat membentuk larutan magnesium fosfat dan larutan natrium nitrat.
9. Logam besi bereaksi dengan larutan asam klorida membentuk larutan besi (III) klorida dan gas hidrogen.
10. Karbon dioksida dan amonia bereaksi membentuk urea dan air
1. Nama untuk senyawa dengan rumus CaC2 adalah . . . . a. kalsium karbonat
b. kalsium karbida c. kalsium dikarbon d. kalsium karbohidrat e. kalsium dikarbonat
2. Nama yang tepat untuk NaClO adalah . . . . a. natrium hipoklorit
b. natrium klorat c. natrium klorit d. natrium perklorat e. natrium klorida
3. Nama yang tepat untuk senyawa KCN adalah . . . . a. kalium nitrat
b. kalium nitrida c. kalium karbon d. kalium sianida e. kalium karbonat
4. Rumus kimia untuk kalsium karbonat adalah . . . .
a. CaC2 d.Ca2CO3
b. Ca(OH)2 e.CaCO3 c. CaH2
5. Rumus kimia yang benar untuk natrium dihidrogen fosfat adalah . . . . a. Na3PO4
b. Na(PO4)3 c. Na2HPO4 d. Na3PO3 e. NaH2PO4
6. Massa molekul relatif (Mr) dari C2H4O2 adalah . . . . Diketahui Ar C = 12, H = 1, O = 16 a. 29
b. 60 c. 32 d. 75 e. 44
7. Massa satuan rumus (Mr) dari Na2S2O3 adalah . . . . Diketahui Ar Na = 23, S = 32, O = 16 a. 71
b. 103 c. 94 d. 158 e. 106
8. Perhatikan persamaan reaksi setara berikut.
X + Pb(NO3)2(aq) → PbCl2(s) + NaNO3(aq) Senyawa X adalah . . . . a. HNO3
b. HCl c. NaNO3 d. NaCl2 e. NaCl
9. Gas metana terbakar sempurna menghasilkan gas CO2 dan H2O. Persamaan yang tepat untuk menyatakan reaksi tersebut adalah . . . .
a. CH4(g) + O2(g)→ CO2(g) + 4H2O(g) b. CH4(g) + O2(g)→ CO2(g) + 2H2O(g) c. CH4(g) + 2O2(g)→ CO2(g) + 2H2O(g) d. CH4(g) + H2(g)→ CH2(g) + 2H2(g) e. CH4(g) + N2(g)→ CN2(g) + 2H2(g) 10. Perhatikan persamaan reaksi setara berikut.
X + 2HCl(aq) → 2NaCl(aq) + H2O(l) + CO2(g) Senyawa X adalah . . . . a. NaNO3
b. NaOH c. Na2CO3 d. Na2S2O3 e. Na2SO4
11. Pembakaran sempurna gas etana menghasilkan CO2 dan H2O seperti ditunjukkan pada persamaan reaksi berikut.
C2H6(g) + O2(g)→ CO2(g) + H2O(l) Pada persamaan ini, perbandingan koefisien reaksi CO2 terhadap H2O adalah . . . .
a. 1 : 1 d. 3 : 1 b. 1 : 3 e. 3 : 2 c. 2 : 3
12. Ca(OH)2(aq) + H3PO4(aq) → Ca3(PO4)2(s) + H2O(l) Koefisien reaksi pada persamaan di atas adalah . . . . a. 1-2-3-6 d. 3-2-1-6
13. Di antara persamaan molekuler berikut, reaksi yang sudah setara adalah . . . a. 2CuO(s) + 2C(s) → Cu(s) + 4CO2(g)
b. SO2(g) + 2O2(g) → SO3(g)
c. H2S(g) + O2(g)→ H2O(l) + SO2(g) d. P4O10(g) + 10C(s)→ P4(g) + 10CO(g) e. 2NO(g) + O2(g)→ 2NO2(g)
14. Jumlah atom nitrogen terbanyak dalam senyawa . . . . a. KNO3
b. Fe(NO3)3
c. CO(NH2)2
d. Ca(NO2)2
e. N2O5
15. Koefisien reaksi yang tepat untuk reaksi:
K(s) + H2O(l) → KOH(aq) + H2(g) berturut-turut adalah . . . .
a. 2, 1, 1, 1 b. 1, 2, 2, 1 c. 2, 2, 2, 1 d. 2, 1, 2, 1
16. 1, 2, 1, 2 Reaksi yang sudah setara adalah . . . . a. CH4(g) + O2(g) → CO2(g) + 2H2O(l)
b. CaO(s) + 2HCl(aq) → CaCl2(aq) + 2 H2O(l)
c. Fe2O3(s) + C(s) → 2Fe(s) + 3CO(g)
d. C2H6(g) + 3O2(g) → 2CO2(g) + H2O(l)
e. 2 H2(g) + 3SO2(g) → 2H2O(l) + 2SO2(g)
17. Pada reaksi: xC2H6(g) + yO2(g) → zCO2(g) + H2O(g) x, y, dan z berturut-turut yang benar adalah . . . .
a. 1, 7, 2 b. 4, 7, 2 c. 2, 7, 4 d. 4, 7, 4 e. 2, 7, 2
18. Nama senyawa K2O adalah . . . . a. dikalium oksida
b. kalium dioksida c. kalium oksida d. kalsium oksida e. dikalsium oksida
19. Rumus senyawa aluminium klorida adalah . . . . a. AlCl d.Al2Cl
b. Al3Cl e.AlCl3 c. AlCl2
20. Nama senyawa CuS adalah . . . . a. tembaga sulfur
b. tembaga(I) sulfida c. tembaga(II) sulfida d. tembaga sulfat e. tembaga sulfit
22. Senyawa dinitrogen tetraoksida memiliki rumus . . . .
a. NO4 d. Ni2O
b. Ni2O4 e. N4O2 c. N2O4
23. Rumus garam yang benar apabila ion kalsium bergabung dengan anion sulfat . . . . a. CaSO4 d.Ca2(SO3)2
b. Ca2(SO4)2 e.CaSO3 c. Ca2SO4
24. Rumus senyawa yang mungkin berdasarkan tabel kation dan anion berikut:
kation Anion K+
Mg2+ Al3+
NO3 -CO32- PO43- a. KCO3 b. K2NO3 c. MgNO3 d. Mg2(PO4)3 e. AlPO4
25. Rumus asam fosfat yang tepat adalah . . . . a. H2PO4
b. H3PO3 c. H2PO3 d. H3PO4 e. HPO4
26. Jika ion-ion Zn2+, Ba2+, dan Al3+ membentuk basa bergabung dengan ion hidroksida (OH–), rumus basa yang benar adalah . . . .
a. ZnOH b. Ba2OH c. BaOH d. Zn2OH e. Al(OH)3
27. Persamaan reaksi berikut yang setara adalah . . . . a. Fe(s) + HCl(aq)→ FeCl2(aq) + H2(g)
b. SO2(g) + O2(g)→ SO3(g)
c. CuO(s) + 2H2(g)→ Cu(s) + H2O(g) d. Na(s) + H2O(l)→ NaOH(aq) + H2(g) e. Zn(s) + H2SO4(aq)→ ZnSO4(aq) + H2(g)
28. Reaksi pembakaran pirit adalah sebagai berikut.
2FeS2 + aO2 → 2FeO + bSO2 Koefisien untuk a dan b adalah . . . . a. a = 3; b = 2
b. a = 3; b = 3 c. a = 4; b = 3 d. a = 4; b = 5 e. a = 5; b = 4
29. Reaksi pembakaran gas asetilen adalah 2C2H2 + aO2 → bCO2 + cH2O. Koefisien untuk a, b, dan c adalah . . . .
30. aCu + bHNO3 → cCu(NO3)2 + dH2
Koefisien a, b, c, dan d agar reaksi tersebut setara adalah . . . . a. 2, 1, 1, 1
b. 1, 2, 1, 1 c. 1, 1, 1, 2 d. 1, 2, 1, 2 e. 2, 1, 2, 1
31. Reaksi amonium fosfat dengan kalium hidroksida membentuk kalium fosfat dan amonium hidroksida. Reaksi yang benar adalah . . . .
a. (NH3)4(aq) + PO4(aq) + KOH(aq) → K4(PO4)3(aq) + NH4OH(aq) b. (NH4)3PO4(aq) + 3KOH(aq) → 3NH4OH(aq) + 3 KPO4(aq) c. (NH4)3PO4(aq) + 3KOH(aq) → 3NH4OH(aq) + K3PO4(aq) d. K3PO4(aq) + 3 KOH(aq) → K3PO4(aq) + 3 NH4OH(aq) e. K3PO4(aq) + KOH(aq) → K4(PO4)3(aq) + NH4OH(aq)
32. Berikut ini tata nama yang benar, kecuali . . . . a. NaClO = natrium hipoklorit