A. RUMUS KIMIA
B. TATA NAMA SENYAWA ANORGANIK
C. PERSAMAAN REAKSI
T A T A N A M A S E N Y A W A D A N P E
R-S A M A A N R E A K R-S I
3
Materi tersusun oleh atom-atom, misalnya tembaga, jika tembaga kita potong menjadi dua bagian masing-masing tetap merupakan tembaga sebab sifat-sifat tembaga masih dimiliki oleh kedua bagian tersebut. Andaikan tembaga terus-menerus dipotong-potong, semakin lama semakin kecil, akhirnya akan menjadi butiran (partikel) terkecil yang masih mempunyai sifat tembaga. Contoh lain materi yang terdiri atas atom adalah besi, timah, timbal dan lain-lain.
Atom yang saling mengikat akan membentuk molekul. Menurut teori molekul, semua senyawa tersusun atas partikel-partikel sangat kecil yang disebut molekul. Molekul adalah gabungan beberapa atom unsur-unsur yang membentuk senyawa. Misalnya molekul air, terbentuk dari unsur oksigen dan unsur hidrogen. Setiap molekul air terbentuk dari 1 atom oksigen dan 2 atom hidrogen. Molekul-molekul bergabung membentuk senyawa, yang disebut molekul senyawa. Contoh molekul senyawa antara lain karbondioksida, alkohol, dan gula.
Di samping molekul senyawa, terdapat pula molekul unsur. Molekul unsur merupakan gabungan beberapa atom yang sejenis. Misalnya fosfor, terdapat dalam bentuk molekul tiap molekul tersusun dari 4 buah atom (P4). Unsur belerang terdapat dalam bentuk molekul yang tersusun atas 8 atom belerang (S8). Sedangkan unsur-unsur oksigen, hidrogen, nitrogen, klor, brom, dan yod terdiri atas molekul-molekul dua atom yang biasa dikenal dengan molekul diatomik. Partikel terkecil dari suatu unsur disebut atom. Partikel terkecil suatu senyawa disebut molekul. Selain atom dan molekul, partikel, yang lain adalah ion. Ion adalah atom atau gabungan (gugus) atom yang bermuatan listrik. Ion yang bermuatan negatif disebut anion, sedangkan ion yang bermuatan positif disebut kation. Ion yang berupa gabungan atom bermuatan listrik disebut ion poliatom.
Setelah mempelajari Bab 3 Anda dapat menuliskan nama senyawa, menulis rumus kimia, dan menyetarakan persamaan reaksi. Hubungan antara konsep yang satu dengan yang lain dapat Anda perhatikan pada peta konsep di bawah ini.
Peta Konsep Tata Nama rumus
molekul empirisrumus
TATA NAMA
SENYAWA
kation anion rumus kimia persamaan reaksi pembentuk dapat berupa dituliskan pada dapat berupa dituliskan dariA. RUMUS KIMIA
Rumus kimia suatu zat dinyatakan dengan lambang unsur dan angka indeks. Lambang unsur menunjukkan jenis unsur, sedangkan angka indeks menunjukkan perbandingan atom-atom unsur. Angka indeks ditulis sebagai subskrip setelah lambang unsur.
Senyawa adalah zat tunggal yang terbentuk dari dua jenis unsur atau lebih dengan perbandingan massa tertentu dan memiliki sifat-sifat berbeda dengan unsur pembentuknya.
Berdasarkan tempat terbentuknya senyawa dibagi menjadi dua macam, yaitu senyawa organik dan senyawa anorganik.
• Senyawa organik adalah senyawa yang terbentuk di dalam tubuh makhluk hidup. Contoh: gula, selulosa, protein, lemak/minyak. • Senyawa anorganik ialah senyawa yang terbentuk di alam (di luar
tubuh makhluk hidup). Contoh: batuan, mineral-mineral, garam, dan lain-lain.
Dalam mempelajarinya maka diberi cara penamaan senyawa-senyawa tersebut. Namun sebelumnya kita pelajari bagaimana cara menuliskan rumus senyawa (rumus molekul) pada senyawa kovalen dan rumus empiris pada senyawa ion.
1. Cara Penulisan Rumus Molekul
Rumus molekul adalah rumus yang menyatakan jenis dan jumlah atom-atom unsur dalam molekul unsur atau molekul senyawa. Rumus molekul hanya ada pada senyawa kovalen.
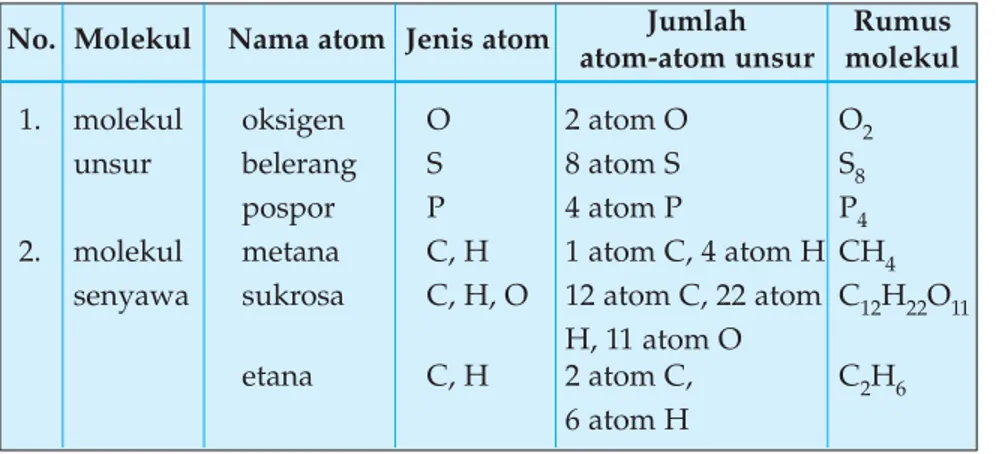
Tabel penulisan rumus molekul
No. Molekul Nama atom Jenis atom atom-atom unsur molekulJumlah Rumus
1. molekul oksigen O 2 atom O O2
unsur belerang S 8 atom S S8
pospor P 4 atom P P4
2. molekul metana C, H 1 atom C, 4 atom H CH4
senyawa sukrosa C, H, O 12 atom C, 22 atom C12H22O11 H, 11 atom O
etana C, H 2 atom C, C2H6
Gambar Atom, molekul senyawa, ion
2. Cara Menuliskan Rumus Senyawa Ion
Rumus senyawa ion dapat dituliskan dengan cara memperhatikan kation dan anion beserta muatannya.
Hal ini dapat ditentukan:
Anda dapat memperhatikan tabel berikut sekaligus melengkapinya.
Senyawa ion bukan merupakan molekul, sehingga rumus tersebut hanya merupakan perbandingan paling sederhana yang disebut rumus empiris. A Cl– S2- SO 42- CO3 2-K K+ K 2CO3 Na+ NaCl Pb2+ PbS NH4+ (NH 4)2SO4 Kx++ Ay–⎯→ K yAx Fosfor belerang oksigen
Konsep Sajian Gambar
atom molekul unsur molekul Senyawa ion Na+ dan Cl -Cl- Na+
3. Rumus Empiris
Rumus empiris adalah rumus yang menyatakan jenis dan per-bandingan paling sederhana dari atom-atom unsur dalam senyawa. Tabel rumus empiris senyawa molekul
Tabel rumus empiris senyawa ion
Latihan
1
1. Dua molekul senyawa organik terdiri atas 12 atom C, 24 atom H dan 12 atom O. Tentukan rumus molekul senyawa tersebut!
2. Apakah senyawa MgCl2mempunyai rumus molekul? Jelaskan!
B. TATA NAMA SENYAWA
1. Tata Nama Senyawa Anorganik
a. Senyawa yang terbentuk dari kation dan anion
Disebutkan nama kationnnya (ion positif), diikuti nama anionnnya (ion negatif)
Contoh: NaCl (Natrium Klorida) MgCl2 (Magnesium Klorida) MgO (Magnesium Oksida)
Senyawa Jenis Jenis Perbandingan Rumus No. ion kation anion terkecil kation empiris
dan anion
1. kalium klorida K+ Cl– 1 ion K+dan 1 ion Cl– KCl
2. magnesium oksida Mg2+ O2– 1 ion Mg2+dan 1 ion O2– MgO
3. besi (III) oksida Fe3+ O2– 2 ion Fe3+dan 3 ion O2– Fe 2O3 Senyawa Rumus Perbandingan Perbandingan Rumus No. molekul molekul atom-atom terkecil atom- empiris
unsur atom unsur
1. etana C2H6 C : H = 2 : 6 C : H = 1 : 3 CH3 2. glukosa C6H12O6 C:H:O = 6:12:6 C:H:O = 1:2:1 CH2O 3. sukrosa C12H22O11 C:H:O = 12:22:11 C:H:O = 12:22:11 C12H22O11
Tabel beberapa kation (ion positif) dan anion (ion negatif)
Contoh:
HF = asam fluorida/hidrogen fluorida HClO3 = asam klorat/hidrogen klorat Pb(NO3)2 = timbal (II) nitrat
Cu(OH)2 = tembaga (II) hidroksida NH4NO3 = amonium nitrat
No. Kation Nama Anion Nama
1. H+ asam/Hidrogen F- fluorida 2. Na+ natrium Cl- klorida 3. K+ kalium Br- bromida 4. NH4+ amonium I- iodida 5. Cu+ tembaga (l) CN- sianida 6. Ag+ perak (l) NO 3- nitrat 7. Mg2+ magnesium NO 2- nitrit 8. Ca2+ kalsium MnO 4- permanganat 9. Sr2+ stronsium ClO- hipoklorit
10. Ba2+ barium ClO
2- klorit
11. Fe2+ besi (II) ClO
3- klorat
12. Zn2+ seng ClO
4- perklorat 13. Cu2+ tembaga (II) OH- hidroksida 14. Hg2+ raksa (II) CNS- tiosianat 15. Pb2+ timbal (II) CH 3COO- asetat 16. Mn2+ mangan (II) SO 42- sulfat 17. Ni2+ nikel (II) SO 32- sulfit 18. Sn2+ timah (II) CO 32- karbonat 19. Co2+ kobal (II) C 2O42- oksalat 20. Al3+ aluminium Cr 2O42- kromat 21. Cr3+ krom (III) S 2O32- tiosulfat 22. Co3+ kobal (III) AsO
43- arsenat 23. Ni3+ nikel (III) AsO
33- arsenit 24. Pb4+ timbal (IV) PO
43- pospat 25. Sn4+ timah (IV) PO
b. Senyawa nonlogam dan nonlogam (senyawa kovalen)
Senyawa nonlogam yang mempunyai jenis atom sama, tetapi jum-lahnya berbeda, namanya disebutkan, dengan menyatakan jumlah atom menggunakan awalan mono (satu), di (dua), tri (tiga), tetra (empat), penta (lima). Awalan mono tidak digunakan untuk unsur yang pertama Contoh:
CO = karbon monoksida N2O5= dinitrogen pentaoksida CO2 = karbon dioksida P2O3 = difosfor trioksida NO2 = nitrogen monoksida P
2O5 = difosfor pentaoksida
d. Senyawa hidrat
Pemberian nama senyawa hidrat dimulai dari nama senyawanya diikuti jumlah molekul air kristal, lalu kata hidrat.
Contoh: CaCl2. 6H2O : kalsium klorida heksahidrat MgSO4. 7H2O : magnesium sulfat heptahidrat Na2CO3. 10H2O : natrium karbonat dekahidrat CaSO4. 2H2O : kalsium sulfat dihidrat
CuSO4. 5H2O : tembaga (II) sulfat pentahidrat
2. Tata Nama Senyawa Organik
Pemberian nama senyawa organik lebih kompleks dibandingkan tata nama senyawa anorganik, karena sebagian besar senyawa organik tidak dapat ditentukan dari rumus kimianya saja melainkan dapat di-lihat dari rumus strukturnya. Di samping itu, jumlah senyawa organik jauh lebih banyak dibandingkan senyawa anorganik. Berikut diberikan contoh nama senyawa organik sederhana.
Rumus kimia Nama Rumus kimia Nama
CH4 metana C2H5OH etanol C2H6 etana CH3Cl klorometana C3H8 propana CH2Cl2 diklorometana C4H10 butana CHCl3 triklorometana C5H12 pentana CCl4 tetraklorometana/ karbon tetraklorida C6H14 hexana CH3COOH asam asetat/asam cuka C7H16 heptana C6H12O6 glukosa
Latihan
2
1. Tuliskanlah nama senyawa dengan rumus kimia sebagai berikut: a. AlCl3 c. Ba(OH)2 e. Ca3(PO4)2
b. SO3 d. H2SO4 f. N2O3 2. Tuliskanlah rumus kimia senyawa-senyawa berikut:
a. natrium oksida d. asam fosfat b. besi (III) karbonat e. glukosa c. amonium sulfat
C. PERSAMAAN REAKSI
Persamaan reaksi menggambarkan semuazat yang bereaksi (pereaksi), hasil reaksi (produk) dan wujud masing-masing zat. Arah reaksi berlang-sung dilambangkan dengan tanda panah. Perbandingan jumlah partikel pereaksi dan hasil reaksi ditunjukkan dengan bilangan bulat.
Contoh: Besi di udara terbuka bereaksi dengan oksigen membentuk karat besi. Reaksi di atas dapat dituliskan dengan lambang atom dan rumus molekul. Fe(s)+ O2(g)⎯→ Fe2O3(s) (Persamaan reaksi)
pereaksi zat hasil reaksi
Pada reaksi di atas, Fe diberi simbol (s = solid) artinya padat, O2(g)artinya gas. Zat-zat yang mempunyai wujud cair diberi simbol (l = liquid)) dan yang berupa larutan diberi simbol (aq = aqua).
Reaksi di atas jumlah atom Fe dan O antara ruas kiri dan ruas kanan belum sama jumlahnya (setara). Persamaan reaksi menjadi benar jika jumlah atom dari setiap unsur di ruas kiri sama dengan jumlah atom dari setiap unsur di ruas kanan. Untuk menyamakan perlu ditambahkan Koefisien reaksi. 4Fe(s)+ 3O2(g) ⎯→ 2Fe2O3(s)
Koefisisen reaksi
Langkah-langkah penulisan persamaan reaksi adalah sebagai berikut. 1. Menuliskan rumus kimia zat yang direaksikan di sebelah kiri tanda panah
dan rumus kimia zat-zat hasil reaksi di sebelah kanan tanda panah. 2. Menuliskan semua fase zat yang terlibat dalam reaksi.
3. Melengkapi persamaan reaksi dengan memberikan koefisien.
4. Memeriksa lagi persamaan reaksi yang sudah diberi koefisien, apakah jumlah atom di sebelah kiri tanda panah sudah sama dengan sebelah kanan tanda panah atau belum.
Contoh: C2H6+ O2⎯→ CO2+ H2O
a. Menyamakan dahulu banyaknya atom C di sebelah kiri dan kanan C2H6+ O2⎯→ 2CO2+ H2O
b. Menyamakan jumlah atom H di sebelah kiri dan kanan C2H6+ O2⎯→ 2CO2+ 3H2O
c. Menambahkan koefisien O2 di sebelah kiri berdasarkan jumlah atom O di sebelah kanan. Di sebelah kanan terdapat (2 x 2) + (3 x 1) = 7 atom O atau 31⁄
2molekul O2 C2H6+ 31⁄
2O2⎯→ 2CO2+ 3H2O
d. Karena koefisien-koefisien persamaan reaksi harus bilangan yang bulat, hasil dari (c) harus dikalikan 2, menjadi:
2C2H6+ 7O2⎯→ 4CO2+ 6H2O
Latihan
3
1. Setarakan persamaan reaksi berikut: a. N2(g)+ H2(g)⎯→ NH3(g)
b. Al2O3(s)+ HCl(aq)⎯→ AlCl3(aq)+ H2O(l) c. C4H10(g)+ O2(g)⎯→ CO2(g)+ H2O(g) d. MnO2(s)+ CO(g)⎯→ Fe(s)+ CO2(g) e. Fe2(s)+ CO(g)⎯→ Fe(s)+ CO2(g)
f. CuCl2(aq)+ NaOH(aq)⎯→ Cu(OH)2(s)+ NaCl(aq) g. Mg(s)+ HCl(aq)⎯→ MgCl2(aq)+ H2(g)
h. Al(s)+ H2SO4(aq)⎯→ Al2(SO4)3(aq)+ H2(q)
2. Tuliskan persamaan reaksi setara untuk reaksi berikut:
a. Logam seng direaksikan dengan larutan asam klorida menghasilkan larutan seng klorida dan gas hidrogen
b. Larutan asam klorida direaksikan dengan larutan natrium hidroksida menghasilkan larutan natrium klorida dan air
c. Gas amoniak direaksikan dengan gas oksigen menghasilkan gas nitrogen oksida dan air
d. Padatan besi (III) oksida direaksikan dengan larutan asam klorida menghasilkan larutan besi (III) klorida dan air
e. Padatan kalsium karbonat direaksikan dengan larutan asam klorida menghasilkan larutan kalsium klorida, air, dan gas karbondioksida.
anion atom ion poliatom ion kation koefisien reaksi molekul senyawa molekul unsur molekul persamaan reaksi rumus empiris rumus kimia rumus molekul senyawa hidrat
• Molekul: gabungan beberapa atom Molekul dibedakan menjadi molekul unsur (terdiri dari atom-atom sejenis) dan molekul senyawa (terdiri dari atom-atom tak sejenis)
• Ion : atom/kumpulan atom yang bermu-atan listrik
• Rumus kimia: menyatakan jenis unsur dan perbandingan atom-atom penyusun zat tersebut
• Rumus kimia terdiri dari rumus molekul dan rumus empiris
• Rumus molekul: rumus yang meny-atakan jenis dan jumlah atom-atom unsur dalam senyawa
• Rumus empiris: rumus yang menyatakan jenis dan perbandingan paling sederhana dari atom-atom unsur dalam senyawa • Tata nama senyawa anorganik
a. senyawa yang terbentuk dari kation dan anion
penamaan: kation + anion
b. senyawa nonlogam dan nonlogam penamaan disebutkan jumlah atom yang dimiliki menggunakan awalan mono (satu), di (dua), tri (tiga), tetra (empat), penta (lima)
c. senyawa hidrat
penamaan: disebutkan nama senyawa-nya diikuti jumlah molekul air kristal lalu kata hidrat.
• Tatanama senyawa organik
Untuk senyawa organik sederhana yang mengandung C dan H nama senyawa dimulai dengan awalan yang sesuai den-gan jumlah C.
RANGKUMAN
KK
1. Lambang unsur emas, tembaga, seng dan timbal secara beruru-tan adalah .... a. Zn, Cu, Au, Pb b. Au, Cu, Zn, Pb c. Pb, Au, Zn, Cu d. Zn, Pb, Cu, Au e. Au, Zn, Cu, Pb
2. Molekul batu kapur terdiri dari 1 atom kalsium, 1 atom karbon dan 3 atom oksigen. Rumus kimia batu kapur adalah .... a. CaO d. CaCO3 b. CaCO e. Ca3CO3 c. Ca3CO CH4 - metana C2H6 - etana C3H8 - propana C4H10 - butana • Cara menuliskan rumus kimia
Kx++ Ay-⎯→ K xAy
• Persaman reaksi menyatakan: 1) Rumus kimia zat-zat
a. pereaksi (reaktan) zat yang berada di ruas kiri
b. hasil reaksi (produk): zat yang berada di ruas kanan
2) Koefisien reaksi: menyatakan jumlah partikel dari pereaksi dan hasil reaksi 3) Wujud/keadaan zat-zat: dapat berupa
padat (s), cair (l), gas (g), dan larut dalam air (aq)
• Suatu persamaan reaksi dikatakan setara jika jumlah atom dari setiap unsur di ruas kiri sama dengan jumlah atom setiap unsur di ruas kanan.
ELATIHAN SOAL
P
P
3. Partikel terkecil dari suatu logam adalah .... a. atom b. unsur c. ion d. molekul unsur e. molekul-molekul
4. Di antara pernyataan di bawah ini yang benar adalah ....
a. unsur merupakan penyusun dari atom
b. molekul penyusun utama dari senyawa
c. atom partikel terkecil dari suatu senyawa
d. molekul unsur terdiri dari unsur-unsur yang berbeda e. molekul senyawa tersusun
dari unsur-unsur yang sejenis 5. Dari zat-zat berikut:
1) air 3) arang 2) gula 4) garam Yang tegolong unsur adalah nomor ....
a. 1) dan 3) d. 1) dan 3) b. 2) dan 4) e. 3)
c. 1), 2) dan 4)
6. Di antara rumus kimia berikut: 1) O2 3) CO2
2) H2 4) H2O
Maka yang tergolong molekul senyawa adalah ....
a. 1) dan 2) d. 1) dan 3) b. 2) dan 4) e. 1) dan 4) c. 3) dan 4)
7. Semua zat-zat berikut tergolong senyawa, kecuali .... a. asam cuka b. alkohol c. garam dapur d. gula e. air raksa
8. Lambang unsur yang benar dari atom besi adalah ....
a. B d. Bi
b. Be e. Fe
c. Br
9. Dari senyawa berikut yang menunjukkan rumus empiris adalah ....
a. C6H6 d. C6H12O6 b. C4H10 e. H2O2 c. CH2O
10. Dari ion Ca2+dan ion NO 3-bila bersenyawa maka membentuk .... a. CaNO3 d. Ca2(NO3)3 b. Ca(NO3)2 e. Ca3(NO3)2 c. Ca2NO3
11. Dalam satu molekul Al2(SO4)3 terdapat ....
a. 6 atom Al, 3 atom S, dan 12 atom O
b. 2 atom Al, 3 atom S, dan 12 atom O
c. 2 atom Al, 3 atom S, dan 4 atom O
d. 2 atom Al, 1 atom S, dan 4 atom O
e. 1 atom Al, 1 atom S, dan 4 atom O
12. Satu molekul trimetanol alinin dengan rumus NH2(CH3OH)2 mengandung atom sebanyak ....
a. 16 d. 8
b. 15 e. 6
c. 11
13. Dalam senyawa CuSO4 5H2O maka jumlah atom O sebanyak ....
a. 4 d. 10
b. 5 e. 15
c. 9
14. Nama senyawa N2O5adalah .... a. nitrogen oksida
b. nitrogen monoksida c. nitrogen trioksida d. dinitrogen trioksida e. Dinitrogen Pentaoksida
15. Rumus kimia dari senyawa timah (IV) oksida adalah .... a. Tio d. SnO4 b. TiO2 e. SnO2 c. SnO
16. Dari ion-ion berikut K+, Pb2+, NH4+, Cl-, CO
32- maka rumus kimia yang benar dari ion-ion tersebut adalah ....
a. KS2 d. NH4(CO3)2 b. NH4Cl e. Pb(CO3)2 c. Pb2Cl
17. Dari persamaan reaksi:
aMg(s) + bHCl(aq) → cMgCl2(aq) + dH2(g)
Koefisien reaksi a, b, c, dan d berturut-turut adalah .... a. 1, 1, 1, dan 2 b. 1, 2, 1, dan 2 c. 1, 2, 1, dan 1 d. 2, 1, 2, dan 1 e. 1, 1, 2, dan 2
18. Pembakaran sempurna gas metana menghasilkan gas karbondioksida dan uap air, dapat ditulis dengan persama-an reaksi .... a. CH4(g) + O2(g) → CO2(g) + H2O(g) b. CH4(g) + O2(g) → CO2(g) + H2O(l) c. CH4(g) + O2(g) → CO2(g) + H2O(l) d. CH4(g) + 2O2(g) → CO2(g) + H2O(g) e. CH4(g) + 2O2(g) → CO2(g) + H2O(g)
19. Dari persamaan reaksi berikut yang sudah setara adalah .... a. 2Ca(s)+ HCl(aq)→ 2CaCl2(aq)
+ H2(g)
b. C2H6g) + O2(g) → 2CO2(g) + 6H2O(g)
c. 2NH3(g)→ N2(g)+ 3H2(g) d. 2KOH(aq)+ H2S(aq)→ K2S(aq)
+ H2O(l)
e. AgNO3(aq) + CaCl2(aq) → 2AgCl(aq)+ Ca(NO3)2(aq) 20. Agar persamaan reaksi berikut
setara, maka nilai a dan b bertu-rut-turut adalah ....
MnCl4+ aH2O → MnO2+ bHCl a. 1 dan 2 d. 2 dan 3 b. 2 dan 4 e. 3 dan 4 c. 1 dan 1
II. Kerjakan soal-soal di bawah ini dengan benar!
1. Jelaskan pengertian:
a. materi c. molekul b. atom d. ion
2. Sebutkan perbedaan molekul unsur dan molekul senyawa, beri ma-sing-masing 2 contoh!
3. Sebutkan nama dari unsur-unsur berikut:
a. K d. Zn g. Mg j. Cl
b. C e. Cu h. N k. Mn
4. Tuliskan tanda atom dari unsur-unsur berikut: a. besi f. brom b. aluminium g. yodium c. timbal h. arsen d. timah i. helium e. emas j. silikon
5. Dari zat-zat berikut tentukan mana yang tergolong unsur dan senyawa:
a. air f. kapur
b. air raksa g. karbon
c. gula h. belerang
d. garam dapur i. alkohol e. asam cuka j. perak
6. Tuliskan rumus empiris dan rumus molekul senyawa yang tersusun oleh:
a. 1 atom Ca dan 2 atom C b. 2 atom H dan 2 atom O
c. 2 atom Cu, 1 atom S dan 4 atom O d. 6 atom C, 12 atom H, dan 6 atom O 7. Beri nama senyawa berikut:
a. Al2O3 d. CuO
b. P2O5 e. NO2
c. H2S f. MgSO47H2O 8. Tuliskan rumus kimia dari zat berikut:
a. besi (II) sulfida f. magnesium nitrida b. karbon tetraklorida g. aluminum sulfat c. asam asetat h. barium hidroksida d. kalsium karbida i. kalium yodida e. natrium nitrat j. timah (IV) klorida 9. Setarakan persamaan reaksi berikut:
a. C2H5OH(g)+ O2(g)→ CO2(g)+ H2O(g) b. C2H2(g) + O2(g)→ CO2(g)+ H2O(g) c. HNO3(s)→ N2O5(g)+ H2O(l)
d. Ba(OH)2(aq) + HCl(aq)→ BaCl2(aq)+ H2O(l)
e. NaNO2(aq) + Al2(CO3)3(aq)→ Na2CO3(aq)+ Al(NO2)3(aq)
10. Tuliskan persamaan reaksi dan setarakan dari reaksi antara larutan Kalsium Karbonat dengan larutan Asam Klorida yang menghasilkan larutan Kalsium Klorida, gas Karbondioksida dan Air!