LAPORAN AKHIR
INSENTIF RISET SINAS
IDENTIFIKASI PENYEBAB PENYAKIT BUSUK UMBI PORANG
(Amorphophallus mueleri Blume) DAN ISOLASI SERTA SKREENING AGENS HAYATI UNTUK PENGENDALIAN RAMAH LINGKUNGAN
RD-2015-0019
Bidang Prioritas Iptek:
10. Teknologi Pangan
10.03 Riset Pengembangan Perkebunan
Jenis Insentif Riset:
Riset Dasar
NON KONSORSIUM
Lembaga Penelitian Dan Pengabdian Masyarakat
Universitas Merdeka Madiun
Jln. Serayu No 79 Madiun 63133
Phone (0351) 495551/Fax (0351) 495551/E-mail: lppm@unmer-madiun.ac.id
Tahun 2015
iii
RINGKASAN/ABSTRAK
Identifikasi penyebab penyakit busuk umbi porang (Amorphophallus mueleri Blume) dan isolasi serta skreening agens hayati untuk pengendalian ramah lingkungan. Indonesia mengexport porang ke Jepang dan China. Salah satu faktor pembatas produksi porang disebabkan serangan penyakit busuk di pertanaman dan pasca panen. Identifikasi yang akurat dari penyebab penyakit dan isolasi serta skreening agens hayati sangat diperlukan untuk keberhasilan pengendalian terhadap penyakit tersebut. Penelitian bertujuan: 1) mendeteksi dan mengidentifikasi patogen busuk umbi porang; 2) memperoleh dan menguji daya antagonisme agens hayati terhadap patogen busuk umbi porang. Penelitian dilakukan dengan cara: 1) pendekatan Postulat Koch yaitu isolasi, inokulasi, dan reisolasi yang dilanjutkan dengan analisis molekular untuk menentukan spesies dari penyebab penyakit; 2) isolasi dan skreening agens hayati serta uji kemampuan daya hambat bakteri antagonis terhadap penyakit busuk umbi porang secara in vitro.Hasil penelitian menunjukkan penyebab busuk umbi porang terdiri atas dua isolat jamur yaitu:
Sclerotium delphinii isolate CBS221 dengan patogenisitas tertinggi yaitu 88,23%, diikuti : Fusarium oxysporum strain Ppf15 sebesar 30,65 % dan dua isolat bakteri yaitu Serratia nematodiphila strain DZ0503SBS1 sebesar 14,01 % dan Cedecea neteri NBRC 105707
sebesar 10,46 %. Aplikasi Pseudomonas fluorescens (Pf 11, Pf 15, dan Pf 25) mampu menghambat patogen busuk umbi porang secara in vitro. Pseudomonas fluorescens Pf 11 mempunyai daya hambat yang lebih efektif dibandingkan Pseudomonas fluorescens Pf 15, dan Pf 25. P. fluorescens Pf 11 memiliki prospek untuk dikembangkan sebagai alternative pengendalian ramah lingkungan terhadap umbi katak di tempat penyimpanan.
iv DAFTAR ISI
Halaman
Lembar Identitas dan Pengesahan ... ii
Ringkasan/Abstrak ... iii Daftar Isi ... iv Daftar Tabel ... v Daftar Gambar ... vi BAB 1. PENDAHULUAN ... 1 1.1. Latar Belakang ... 1
1.2. Tujuan dan Sasaran ... 2
BAB 2. TINJAUAN PUSTAKA ... 4
1.1. Tanaman Porang (Amorphophallus muelleri Blume) ... 4
1.2. Penyakit Busuk Umbi Porang ... 5
BAB 3 TUJUAN DAN MANFAAT ... 7
BAB 4. METODE ... 8
1.1. Laporan Tahap I ... 7
1.2. Laporan Tahap II ... 13
1.3. Laporan Tahap III ... 18
BAB 5. RENCANA CAPAIAN, HASIL DAN PEMBAHASAN ... 19
1.1. Rencana Capaian ... 19
1.2. Hasil ... 21
1.3. Hambatan ... 30
1.4. Pembahasan ... 30
BAB 6. KESIMPULAN DAN SARAN ... 36
1.1. Kesimpulan ... 36
1.2. Saran ... 36
v DAFTAR TABEL
Halaman Tabel 1. Persentase penyakit busuk umbi di permukaan kulit dan
daging umbi porang berdasarkan periode tumbuh ketiga ... 21
Tabel 2. Jenis isolat jamur penyebab busuk umbi porang hasil inokulasi ... 24
Tabel 3. Jenis isolat bakteri penyebab busuk umbi porang hasil inokulasi ... 27
Tabel 4. Sifat fenotipik Pseudomonas fluorescens isolate Saradan ... 29
Tabel 5. Hasil pengujian Pseudomonas fluorescens isolat Saradan terhadap pertumbuhan koloni penyebab penyakit busuk umbi porang ... 29
Tabel 6. Pengaruh P.fluorescens PF 11 terhadap penekanan jumlah organ sklerosia dari S. delphinii dan persentase perkecambahan sklerosia pada umbi katak di penyimpanan ... 30
vi DAFTAR GAMBAR
Halaman Gambar 1. Tanaman porang (Amorphophallus muelleri Blume) ... 4 Gambar 2. Pembusukan pada umbi porang ... 8 Gambar 3. Pengambilan sampel umbi dari tanaman porang ... 9 Gambar 4. Cara peletakan inokulum bakteri antagonis dan penyebab penyakit 17 Gambar 5. Penyebab penyakit busuk umbi porang pada 4 hari setelah inokulasi 20 Gambar 6. Gejala busuk pada umbi porang yang muncul setelah diinokulasi
dengan isolat jamur ... 22 Gambar 7. Biakan murni dari bagian jaringan umbi porang ... 22 Gambar 8. Morfologi koloni jamur penyebab busuk umbi porang (200 X) ... 23 Gambar 9. Hasil amplifikasi DNA pada isolat jamur penyebab penyakit busuk
umbi porang dalam PAGE 6% ... 23 Gambar 10. Pohon filogenetik dari isolat penyebab penyakit busuk
umbi porang ... 24 Gambar 11. Gejala pada umbi porang dari hasil reisolasi isolat bakteri ... 25 Gambar 12. Koloni bakteri penyebab penyakit busuk umbi porang
di bawah sinar UV ... 25 Gambar 13. Reaksi hipersensitif pada daun tembakau ... 26 Gambar 14. Hasil uji degradasi pektat isolat bakteri pendarfluor pada
umbi kentang ... 26 Gambar 15. Pohon filogenetik yang memperlihatkan posisi isolat bakteri
nomor 5 dan 7 berdasarkan sekuen gen 6 S rRNA ... 27 Gambar 16. Pengamatan koloni bakteri pada medium King B di bawah
Sinar UV (λ = 366 nm) ... 28 Gambar 17. Bentuk bakteri pada pengamatan di bawah mikroskop
cahaya dengan perbesaran 1000 x ... 28 Gambar 18. Pengujian reaksi hipersensitif dari Pseudomonas fluorescens
pada daun tembakau ... 29 Gambar 19. Gejala penyakit busuk umbi porang ... 31 Gambar 20. Daya hambat Pseudomonas fluorescens Pf 11 terhadap
Sclerotium delphinii pada 7 hari setelah inokulasi di media
King B agar ... 34 Gambar 21. Penyimpanan umbi katak selama dua bulan yang ditumbuhi oleh
1
BAB 1.
PENDAHULUAN
1.1. LATAR BELAKANGIndonesia mengexport porang (Amorphophallus mueleri Blume) ke Jepang dan Tiongkok. Bahan makanan yang berasal dari porang atau iles-iles ini mengandung glukomanan dan disukai oleh masyarakat Jepang sebagai bahan baku mie atau konyaku dan industri lain, seperti obat-obatan. Tanaman porang dapat dipanen setelah berumur 3 tahun (3 kali pertumbuhan). Harga umbi saat ini diperkirakan sekitar Rp. 4.000,-/Kg dalam keadaan basah. Umbi dalam bentuk irisan keripik yang kering dijual sekitar Rp. 9.000,-/Kg. Apabila menjualnya langsung ke pihak investor dari Jepang harga sekitar USD 18/Kg. Oleh karena itu budidaya tanaman porang mempunyai prospek yang baik dan bernilai ekonomis tinggi bagi masyarakat. Sehingga dapat membantu masyarakat dalam membuka lapangan kerja dan usaha serta memberikan nilai tambah bagi masyarakat itu sendiri.
Salah satu faktor pembatas produksi porang disebabkan serangan penyakit
busuk umbi porang di pertanaman dan pasca panen. Jamur Sclerotium rolfsii Sacc,
Fusarium oxysporum, Pseudomonas sp, Rhizoctonia, Cercospora menyebabkan
penyakit busuk pada pangkal batang dan umbi busuk lunak (foot root). Selain itu
Batryodiplodia theobromae terjadi pada kondisi panas dan lembab. Penyebab
penyakit yang disebabkan oleh jamur terutama berkembang pada musim hujan dan kondisi lingkungan yang lembab dengan intensitas sinar matahari rendah. Agihan penyakit busuk pangkal batang di lahan mengelompok dengan batas tegas. Hal ini menunjukkan penyebab penyakit terbawa melalui tanah (Setiasih, 2008; Andayanie, 2014). Pengamatan berdasarkan gejala secara visual terhadap penyakit tersebut sebagai langkah awal identifikasi, namun tidak dapat dijadikan jaminan. Penyakit busuk pada pangkal batang yang menyerang melalui akar menimbulkan tantangan dalam pengelolaan penyakit yang efektif. Oleh karena sumber inokulum awal sudah ada di dalam tanah sebelum awal pertumbuhan atau diintroduksi oleh tanaman inang. Identifikasi yang akurat dari penyebab penyakit sangat diperlukan untuk keberhasilan pengendalian terhadap penyakit tersebut.
Pengendalian hayati menggunakan mikroorganisme yang berasosiasi dengan rizosfer perakaran tanaman yang sehat lebih aman,ramah lingkungan dan berkesinambungan serta dapat diintegrasikan dengan pengendalian hama terpadu. Saat ini bakteri Pseudomonas fluorescens banyak dimanfaatkan sebagai agens hayati.
2 Rizobakteri dari genus Pseudomonas, Bacillus dapat meningkatkan pertumbuhan tanaman, menguraikan dinding sel patogen dan menghambat pertumbuhan patogen dengan menghasilkan senyawa antimikroba seperti siderofor ( Weller et al., 2002; Joseph et al., 2007; Chandrashekhara, 2007; Diniyah, 2010). Tahapan pengembangan agens hayati dilakukan melalui isolasi, skreening in vitro, uji kemampuan antagonisme, skreening in vivo, dan pengembangan formulasi (Ahmed et al., 2007).
Eksplorasi keragaman bakteri rizozfer di perakaran tanaman porang yang sehat diperlukan untuk mengetahui potensi ketersediaan agens hayati pada pengendalian penyakit busuk umbi porang.
Pengendalian penyakit busuk umbi pada tanaman porang akan meningkatkan kandungan glukomanan. Kemampuan agens hayati dalam meningkatkan pertumbuhan dan pengendalian penyakit pada berbagai komoditas telah banyak dilaporkan peneliti, tetapi informasi tentang penggunaan agens hayati untuk pengendalian busuk umbi porang di sentra penanaman porang belum pernah dilaporkan, khususnya di Indonesia. Upaya identifikasi penyebab penyakit busuk umbi dan isolasi serta skreening agens hayati yang akurat akan digunakan sebagai strategi pengendalian busuk umbi porang. Selain itu membantu penyelamatan umbi porang dan pengembangan sumber pangan alternatif serta meningkatkan devisa negara melalui export porang dalam bentuk chip melalui program pengelolaan hutan bersama masyarakat, sehingga dapat memperkuat Sistim Inovasi Nasional (SINas).
1.2. TUJUAN DAN SASARAN
a. Tujuan
Tujuan Umum: Tujuan umum penelitian sebagai upaya untuk peningkatan produksi porang dan ketahanan pangan nasional yang akan teragregasi ke dalam SINas melalui:
i) Isolasi dan identifikasi penyebab penyakit busuk umbi yang akurat sebagai langkah awal pengendalian penyakit busuk umbi porang (laporan kemajuan I).
ii) Isolasi dan potensi bakteri rizozfer pada tanaman porang sehat sebagai agens hayati penyakit busuk umbi porang (laporan kemajuan II).
iii) Mendapatkan umbi katak yang sehat di penyimpanan (laporan kemajuan III). Tujuan Khusus: Tujuan khusus penelitian terdiri atas:
i) Mengetahui dan mengkaji intensitas penyakit busuk umbi porang yang disebabkan oleh organisme patogenik di sentra penanaman porang di Kabupaten Madiun (laporan kemajuan I).
3 ii) Mengkaji dan mempelajari derajad (tingkat) virulensi isolat organisme patogenik dominan yang berasal dari daerah sentra penanaman porang di Kabupaten Madiun (laporan kemajuan I).
iii) Melakukan karakterisasi dan identifikasi isolat dari organisme patogenik yang berasosiasi dengan umbi porang berdasarkan analisis fenotipik (konvensional) dan genotipik (molekular) (laporan kemajuan I).
iv) Mendapatkan dan melakukan identifikasi isolat rizobakteri dari rizosfer tanaman porang sehat di daerah endemis penyakit busuk umbi porang (laporan kemajuan II). v) Mengevaluasi daya hambat dan efektivitas isolat-isolat rizobakteri untuk menekan
penyakit busuk umbi porang (laporan kemajuan II).
vi) Memperoleh bulbil atau umbi katak yang sehat dengan penggunaan isolat yang tertinggi daya hambatnya terhadap penyebab penyakit busuk umbi (laporan kemajuan III).
b. Sasaran
Diperoleh identifikasi penyebab penyakit busuk umbi porang (laporan kemajuan I) dan identifikasi bakteri rizozfer serta potensi bakteri tersebut sebagai agens hayati (laporan kemajuan II) untuk strategi pengendalian penyebab penyakit busuk umbi porang yang ramah lingkungan melalui penggunaan umbi katak yang sehat, sehingga kualitas dan kuantitas umbi porang dapat ditingkatkan (laporan kemajuan III).
4
BAB 2.
TINJAUAN PUSTAKA
1.1. TANAMAN PORANG (Amorphophallus muelleri Blume)Amorphophallus muelleri dikenal dengan nama lokal porang. Tanaman porang
menyebar dari Kepulauan Andaman melewati Myanmar, Thailand bagian utara sampai ke Sumatera, Jawa terus ke Flores dan Timor (Yuzammi, 2000). Tanaman ini memiliki bulbil atau umbi katak yang terdapat pada tengah dan pada percabangan rakhisnya, sehingga berbeda dengan jenis Amorphophallus lainnya yang ada di Pulau Jawa. Umbi katak dapat digunakan untuk bahan perbanyakan tanaman secara generative. Umbi katak yang dipilih harus sehat, sehingga persentase tumbuh dapat mencapai di atas 90 %. Daun biasanya hanya satu per umbi akan tetapi terkadang dijumpai juga adanya daun tumbuh lebih dari satu. Tangkai daun halus, hijau atau hijau kecoklatan atau hampir hitam pada bagian latar dengan totol-totol kecil atau berbentuk jajaran genjang (rhomboid) atau berbentuk seperti garis-garis, berjumlah banyak, berwarna hijau pucat atau hijau muda (Gambar 1). Tanaman porang yang cukup besar dapat menghasilkan umbi katak ± 40 /pohon. Umbinya berwarna coklat tua pada bagian luar, kuning atau orange pada bagian dalam dan tidak mempunyai umbi samping.
Gambar 1. Tanaman porang (Amorphophallus muelleri Blume)
Pangsa pasar umbi porang mencakup pasar dalam negeri dan luar negeri. budidaya tanaman porang mempunyai prospek yang baik dan bernilai ekonomis tinggi bagi masyarakat ( Rachmawati dan Daroini, 2014). Satu gelondong porang memiliki berat sekitar 1 – 3 kg. Harga chips mencapai Rp 28.000/kg. Lahan seluas kurang lebih 1 hektar dapat menghasilkan 12 ton porang gelondongan dan 4 kuintal katak. Harga katak pada tahun 2014 mencapai Rp 50.000/kg.
5 1.2. PENYAKIT BUSUK UMBI PORANG
Salah satu faktor pembatas produksi porang disebabkan serangan penyakit busuk umbi di pertanaman dan pasca panen. Pengamatan berdasarkan gejala secara visual terhadap penyakit tersebut sebagai langkah awal identifikasi, namun tidak dapat dijadikan jaminan. Identifikasi yang akurat secara biologi, dan fisiologi serta molekular dari penyebab penyakit sangat diperlukan untuk keberhasilan pengendalian terhadap penyakit tersebut. Agihan penyakit busuk pangkal batang di lahan mengelompok dengan batas tegas. Hal ini menunjukkan penyebab penyakit terbawa melalui tanah dan sulit dikendalikan secara kimiawi karena penyebarannya sangat cepat (Setiasih, 2008; Andayanie, 2014). Kondisi tersebut memberikan gagasan untuk melakukan pengendalian penyakit busuk umbi porang yang ramah lingkungan dan berkelanjutan dengan pemanfaatan agens hayati.
1.3. PENGENDALIAN PENYAKIT BUSUK UMBI PORANG
Rizobakteri dapat digunakan untuk mengendalikan penyakit melalui beberapa cara yaitu produksi senyawa antibiosis, persaingan ruang dan nutrisi, penguraian faktor kepatogenan seperti enzim kitinase (1-3 glukanase) sebagai pendegradasi dinding sel serta menghasilkan fitohormon (Van Loon, 2007; Wiyono et al., 2008). Salah satu rizobakteri yang mempunyai potensi sebagai agens hayati yaitu
Pseudomonas fluorescens. Bakteri ini diisolasi dari perakaran tanaman gandum
bersifat sebagai antifungi dan antibakteri dari penyebab penyakit. Kemampuan rizobakteri dalam menginduksi ketahanan tanaman bervariasi. Isolat yang efektif mengendalikan penyakit tanaman adalah yang berasal dari rizoplan tanaman yang bersangkutan (indigenus). Bakteri kelompok ini menghasilkan pigmen berwarna hijau kuning yang dapat digunakan untuk identifikasi serta klasifikasi dari senyawa fluorescence atau pyoverdin yang berpendar di bawah cahaya ultraviolet (panjang gelombang 266 nm (Nawangsih et.al., 2014). Pengendalian penyakit dengan menggunakan P. fluorescens merupakan salah satu alternatif pengendalian yang ramah lingkungan, berkesinambungan dan dapat diintegrasikan dalam program pengendalian hama terpadu ( Soesanto et al., 2011; Yanti et al., 2013).
Kemampuan Rizobakteria mengendalikan penyakit pada berbagai komoditas telah banyak dilaporkan, tetapi penggunaan rizobakteria dari lingkungan habitat tanaman porang belum pernah dilaporkan. Oleh karena itu identifikasi dan potensi
6 rizobakteri tersebut perlu dievaluasi dan dipertimbangkan untuk pengendalian penyakit busuk umbi porang di pertanaman dan pasca panen.
Keberhasilan pengendalian hayati sangat dipengaruhi oleh daya antagonis atau daya hambat yang dimiliki isolat atau jumlah inokulum yang digunakan dan cara aplikasinya (Cook & Baker, 1996). Leeman et al. (l995) mengatakan bahwa aplikasi
Pseudomonas fluorescens melalui penyelaputan benih (seed coating) sangat sesuai
dan praktis untuk pengendalian patogen tular tanah. Oleh karena umbi katak yang terinfeksi penyakit busuk umbi akan menjadi sumber inokulum di lapangan. Masalah yang perlu mendapat perhatian dalam penggunaan Pseudomonas fluorescens yaitu daya hambat harus tinggi dan konsentrasinya aplikasi efektif, terutama pada benih umbi katak saat penyimpanan.
7
BAB 3.
TUJUAN DAN MANFAAT
Tujuan dan manfaat penelitian ini adalah:1. Diharapkan dapat berguna sebagai bahan informasi dasar tentang keberadaan mikroorganisme patogenik pada umbi porang terutama tentang intensitas penyakit, virulensi patogen, karakteristik mikroorganisme patogenik berdasarkan fenotipik dan genotipik. Informasi ini dipergunakan sebagai salah satu dasar untuk membantu pengendalian busuk umbi porang yang tepat Selain itu hasilnya dapat berguna sebagai data base penelitian porang di Indonesia (laporan kemajuan I).
2. Mendapatkan dan melakukan identifikasi isolat rizobakteri dari rizoplan tanaman porang (indigenus). Manfaat penelitian untuk mengetahui senyawa yang berpendar dari kelompok Pseudomonas spp dan morfologi serta sifat fenotipik dari sel bakteri tersebut (laporan kemajuan II).
3. Mendapatkan daya hambat isolat Pseudomonas fluorescens terhadap patogen penyebab busuk umbi porang secara in vitro. Manfaat penelitian ini untuk melihat keefektifan daya hambat rizobakteri terhadap penyebab penyakit busuk umbi porang (laporan kemajuan II).
4. Mempelajari konsentrasi yang efektif Pseudomonas fluorescens terhadap penularan penyebab penyakit busuk umbi porang melalui umbi katak saat penyimpanan (laporan kemajuan III).
8
BAB 4.
METODE
1.1. Laporan Tahap ISampel umbi diperoleh dari pertanaman porang yang bergejala busuk umbi di bawah tegakan hutan jati Kecamatan Saradan Kabupaten Madiun. Analisis sampel dilakukan di laboratorium Agroteknologi Universitas Merdeka Madiun dan di laboratorium LPPT Universitas Gadjah Mada Yogyakarta. Penelitian isolasi dan identifikasi penyebab penyakit busuk umbi porang dilakukan mulai bulan April 2015 sampai bulan Agustus 2015. Metode penelitian dilakukan dengan pengamatan intensitas penyakit, pendekatan Posulath Koch yaitu: isolasi, inokulasi, reisolasi,dan pengamatan secara visual di bawah mikroskop serta analisis molekular.
a. Pengamatan Intensitas Penyakit
Gejala busuk umbi porang diamati pada periode tumbuh ketiga yaitu 2 minggu sebelum tanaman rebah (MSBTR), saat tanaman rebah (TR), dua minggu setelah tanaman rebah (MSTR). Pengambilan umbi dilakukan, masing-masing sebanyak 10 tanaman. Masa pengamatan ini merupakan panen ketiga dari umbi porang dengan kandungan glukomanan yang tinggi, jika umbi tersebut sehat (Chairiyah, 2014). Persentase umbi yang terserang dibedakan menjadi persentase umbi bergejala busuk di bagian luar dan persentase umbi bergejala busuk di bagian dalam (Gambar 2).
Gambar 2. Pembusukan pada umbi porang: A) miselium jamur nampak di bagian luar umbi; B) pembusukan nampak di bagian dalam umbi
Intensitas busuk umbi di bagian kulit umbi dihitung menggunakan rumus: ∑ (n x v)
I = x 100%
N x Z I = intensitas serangan
n = jumlah umbi yang terserang dengan nilai skor tertentu v = harga numerik tiap tingkat kerusakan (skor)
9 N = jumlah semua sampel yang diamati
Z = nilai tingkat kerusakan (skor) tertinggi
Skor tingkat kerusakan yang digunakan yaitu:
1 = umbi porang nampak sehat, kulit umbi mulus tanpa ada cacat 2 = bagian kulit umbi porang sedikit sekali membusuk
3 = bagian batang dan kulit umbi porang sedikit membusuk dan tidak lepas secara alami
4 = bagian batang dan kulit umbi porang membusuk dan tidak lepas secara alami 5 = bagian batang dan kulit umbi porang membusuk dengan miselium nampak di
bagian batang dan kulit luar umbi porang
Persentase busuk umbi porang di bagian dalam dihitung dengan rumus: P = A/B x 100%
P = persentase serangan
A = jumlah contoh umbi porang yang daging buahnya mengalami pembusukan B = jumlah contoh umbiporang yang diamati
b. Pengambilan Sampel Umbi Porang Bergejala Busuk dan Isolasi Penyebab Penyakit
Umbi porang diambil dari tanaman yang menunjukkan gejala pangkal batang dan umbi yang mengalami pembusukan sebanyak 10 tanaman porang (Gambar 2).
Gambar 3. Pengambilan sampel umbi dari tanaman porang: A) pembusukan dan miselium nampak pada pangkal batang; B) pembusukan pada umbi
Sampel umbi yang mengalami pembusukan di pertanaman diamati di laboratorium. Tanah pada bagian umbi dibersihkan dengan air mengalir dan dikeringanginkan. Umbi diseka dengan alkohol 70% sebanyak tiga kali. Bagian jaringan umbi diambil secara aseptik dan direndam di dalam larutan natrium hipoklorit 2% selama 3 menit. Selanjutnya dibilas sebanyak tiga kali dengan aquadest steril serta dikeringkan dengan tissue steril. Jaringan ditumbuhkan dalam media PDA
10 (Potato Dextrose Agar) kloramfenikol untuk mendapatkan isolat jamur. Isolat bakteri diperoleh dengan cara perendaman bagian jaringan bergejala di dalam 5 ml air steril. Setelah jaringan mengeluarkan oose bakteri, kemudian diambil satu oose serta ditumbuhkan pada media CPG (Cassamino Pepton Glucose Agar). Jaringan dan oose pada masing-masing media tersebut diinkubasikan selama tiga hari. Isolat jamur dan atau bakteri yang tumbuh di subkultur pada media yang baru sampai didapatkan biakan murni.
c. Inokulasi Isolat Jamur Penyebab Penyakit Busuk Umbi Porang
Umbi porang sehat dan telah steril umur satu bulan disiapkan untuk inokulasi isolat patogen. Biakan murni dari isolat jamur diinokulasikan satu persatu pada umbi porang yang sehat di laboratorium. Umbi porang dibelah dan dilubangi bagian tengahnya. Bagian yang lubang pada umbi disentuhkan masing-masing isolat dengan jarum ose. Sedangkan perlakuan kontrol tidak disentuhkan dengan isolat. Masing-masing isolat jamur dilakukan dengan 10 kali ulangan dan diletakkan pada gelas plastik transparan yang telah disterilkan dengan alkohol. Gejala busuk umbi yang muncul di laboratorium diamati secara visual.
d. Reisolasi Isolat Jamur Penyebab Penyakit Busuk Umbi Porang
Umbi hasil inokulasi dengan isolat jamur penyebab penyakit yang menunjukkan gejala pada hari ketiga diisolasi mikroorganismenya. Isolasi dilakukan dengan pengambilan jaringan (± 2 mm2) antara yang sakit dan sehat. Jaringan diambil secara aseptik kemudian direndam dalam larutan hipoklorit selama 3 menit. Selanjutnya dibilas sebanyak tiga kali dengan aquadest steril serta dikeringkan dengan tissue steril. Bagian jaringan tersebut diinkubasikan selama 3 hari. Selanjutnya dibilas sebanyak tiga kali dengan aquadest steril serta dikeringkan dengan tissue steril. Jaringan ditumbuhkan dalam media PDA (Potato Dextrose Agar) kloramfenikol untuk memastikan jamur yang sama dengan yang diinokulasi sebelumnya.
e. Identifikasi Isolat Jamur Penyebab Penyakit Busuk Umbi Porang
Isolat jamur hasil reisolasi yang menimbulkan gejala busuk umbi diidentifikasi di bawah mikroskop dengan mencocokkan ciri-ciri jamur yang teramati ( Barnet & Hunter, 1998; CMI, 1981). Analisis secara molekular dilakukan sebagai berikut:
1) Ekstraksi DNA
Isolat jamur ditumbuhkan pada medium PDA. Jamur yang tumbuh disubkultur ke dalam 50 ml medium Potato Dextrose Broth, digoyang di atas shaker dengan
11 kecepatan 125 rpm selama 7-10 hari pada suhu ruang. Ekstraksi DNA jamur dilakukan dengan menggunakan bahan-bahan ekstraksi. Kultur jamur disaring dan miselium ditimbang 0,5 gram dan dihaluskan dengan mortar dengan cara menambah 700 µl CTAB 2% dan 500-700 µg pasir kwarsa. Sebanyak miselium dimasukkan dalam tube 1,5 ml diinkubasikan pada suhu 60°C selama 30 menit dalam waterbath, selanjutnya disentrifuse 5.000 rpm selama 5 menit. Supernatan diambil dan dimasukkan dalam tube baru dan ditambahkan dengan CIAA dengan volume yang sama dan divortex selama 1-3 menit. Selanjutnya disentrifuse 12.000 rpm selama 10 menit. Supernatan dipindahkan lagi dalam tube baru dan ditambahkan ethanol 96 % (1 M) sebanyak 1-2 kali volume supernatan yang didapatkan. Selanjutnya disimpan semalam pada suhu -20 °C dan disentrifuse 12.000 rpm selama 10 menit. Supernatan dipindah kedalam tube baru dan ditambah ethanol 70% sampai penuh dan digojog selama1-3 menit, kemudian disentrifuse 12.000 rpm selama 10 menit dan ethanol dibuang. Pelet yang didapatkan dikeringanginkan dan ditambah TE buffer 20 µL dan disimpan pada suhu -20 °C.
2) Amplifikasi gen 16S rRNA
DNA genom hasil ekstraksi digunakan untuk amplifikasi gen 18S-rRNA. Selanjutnya, sampel DNA tersebut diamplifikasi dengan menggunakan pasangan primer universal untuk berbagai spesies jamur yaitu 18S FWEU (5’-AGG ATC CAT TGG AGG GCA AGT -3’) dan 18SRVEU (5’-TCC ACC TAC GAG CTT TTT ACC TGC A -39). Komponen reaksi PCR (25 µl) mengandung PCR kit KAPA (10 µl), primer 27F dan 1509R (masing-masing 2 µl), DNA cetakan (2 µl) dan dH2O (9 µl). Tahapan PCR terdiri atas pre-denaturasi pada suhu 94 ºC selama 1 menit, denaturasi pada suhu 94 OC selama 30 detik, annealing (pelekatan primer) pada suhu 55 OC selama 30 detik,
extension pada suhu 72 OC selama 45 detik dan final extension pada suhu 72 OC selama 5 menit dan PCR dijalankan selama 30 siklus. Tahap akhir suhu diturunkan dan dipertahankan pada 4OC, kemudian siap untuk divisualisasi. Hasil amplifikasi DNA kemudian divisualisasi menggunakan elektroforesis gel agarose dengan konsentrasi 1%. Setelah amplifikasi, DNA marker dan larutan DNA produk amplifikasi gen 18S rRNA, masing-masing sebanyak 5 µl dimasukkan ke dalam sumur gel agarose dalam 1 x TBE dan alat elektroforesis di running dengan 110 V selama 30 menit .
Pita DNA hasil elektroforesis dideteksi dengan pengecatan ethidium bromida selama 15 menit dan gel diletakkan di atas permukaan UV transilluminator, kemudian divisualisasi dengan fotografi cahaya UV. Selanjutnya didokumentasikan dengan kamera digital.
12 3) Analisis filogenetik
Hasil amplifikasi DNA dengan teknik PCR, selanjutnya disekuensing pada perusahaan jasa sekuensing PT Genetika Science Indonesia (1st BASE Pte Ltd Malaysia). Hasil sekuen berupa data perunutan DNA kemudian dianalisis tingkat kesamaan atau kekerabatan genetik dari isolat yang diperoleh dengan data sekuen GenBank menggunakan program BLAST-N (Basic Local Alignment Search Tool) . Dengan program BLAST metode neighbour joining dibuat pohon filogenetik.
f. Identifikasi Isolat Bakteri Penyebab Penyakit Busuk Umbi Porang
Identifikasi isolat bakteri dilakukan setelah reisolasi biakan murni dari isolat bakteri ke umbi porang dengan cara sebagai berikut:
1) Karakterisasi koloni bakteri
Karakterisasi bakteri yang diamati berdasarkan fisiologi bakteri yaitu: produksi pigmen fluorescens, uji busuk lunak, reaksi gram, dan reaksi hipersensitif.
i. Produksi pigmen fluorescens dan warna koloni bakteri
Biakan murni isolat bakteri ditumbuhkan pada media King agar pada satu cawan. Isolat bakteri yang tumbuh diamati di bawah sinar UV dengan panjang gelombang 365 nm untuk pengamatan koloni bakteri dan pendarfluor yang dihasilkan. Koloni bakteri yang tumbuh dan berpendar digoreskan kembali pada media King B hingga diperoleh koloni tunggal. Koloni bakteri diamati di bawah sinar UV untuk melihat koloni yang berpendar.
ii. Uji degradasi pektat
Uji degradasi pektat menggunakan umbi kentang sehat berbobot 30 g. Umbi dicuci dengan air mengalir selanjutnya diusap dengan alkohol 96% dan dibilas dengan air steril. Umbi kentang dibelah dan dibuat lubang (sumuran) ditengahnya. Isolat bakteri umur 48 jam dituangkan pada sumuran tersebut. Umbi kentang diinkubasikan pada suhu kamar selama 48 jam dengan kondisi anaerob. Pengamatan dilakukan pada 24 jam dan dilanjutkan pada 48 jam. Untuk kontrol air steril dituangkan pada sumuran umbi kentang.
iii. Reaksi gram
Uji reaksi gram menggunakan KOH 3%. Apabila saat pengujian dijumpai benang hifa berarti gram negatif. Bakteri gram negatif mempunyai sifat patogenik. iv. Uji hipersensitif
Pengujian hipersensitif dilakukan pada bakteri yang telah dipastikan berpendar di bawah sinar UV. Pengujian ini menggunakan kerapatan bakteri 106 cfu/ml dan
13 diinfiltrasi pada daun tembakau. Hasil infiltrasi pada daun tersebut diiinkubasikan selama 24 jam. Gejala nekrosis yang berwarna coklat muda hingga coklat tua dan daun nampak tipis akan dihasilkan pada permukaan daun bagian atas, jika bakteri yang diinfiltrasikan patogenik.
2) Analisis molekular i. Ekstraksi DNA
Isolat bakteri yang berasal dari koloni tunggal ditumbuhkan pada medium NA miring dalam tabung reaksi dan diinkubasikan dalam inkubator pada suhu 30OC selama 48 jam. Isolat bakteri dipindahkan dan ditumbuhkan kembali ke dalam 5 ml medium Nutrien Broth, digoyang di atas shaker dengan kecepatan 125 rpm selama 16 – 24 jam pada suhu ruang. Ekstraksi DNA bakteri dilakukan dengan menggunakan bahan-bahan ekstraksi. Kultur bakteri dimasukkan dalam tube 1,5 ml disentrifuse dengan kecepatan 12.000 rpm untuk mendapatkan sel bakteri dan selanjutnya ditambah dengan 540 µL buffer TE dan 30 µL SDS 10% dan diinkubasikan selama 1 jam pada suhu 37°C dalam oven. Suspensi tersebut ditambah dengan 100 µL NaCl 5 M dan 80 µL CTAB/NaCl dan digojog, selanjutnya diinkubasikan pada suhu 65 °C selama 10 menit dalam waterbath. Kemudian sebanyak 750 µL CIAA ditambahkan dan digojog, selanjutnya disentrifuse 12.000 rpm selama 5 menit. Supernatan dipindahkan kedalam tube baru dan ditambahkan dengan PCIAA sebanyak 600 µL untuk kemudian disentrifuse 12.000 rpm selama 5 menit. Supernatan dipindahkan lagi dalam tube baru dan ditambahkan ethanol 96 % (1 M). Selanjutnya disentrifuse 12.000 rpm selama 5 menit dan pelet dicuci dengan ethanol 70% dingin sebanyak 300 µL, kemudian disentrifuse 12.000 rpm selama 5 menit. Pelet yang didapatkan dikeringanginkan dan ditambah TE buffer 20 µL dan disimpan pada suhu -20 °C.
ii. Amplifikasi gen 16S rRNA
DNA genom hasil ekstraksi digunakan untuk amplifikasi gen 16S-rRNA. Selanjutnya, sampel DNA tersebut diamplifikasi dengan menggunakan pasangan primer universal untuk berbagai spesies bakteri yaitu 27F (5’-AGAGTTTGATCCTGGCTCAG-3’) dan 1509R (5’-GGTTACCTTGTTACGACTT-3’). Komponen reaksi PCR (25 µl) mengandung PCR kit KAPA (10 µl), primer 27F dan 1509R (masing-masing 2 µl), DNA cetakan (2 µl) dan dH2O (9 µl). Tahapan PCR terdiri atas pre-denaturasi pada suhu 94 ºC selama 2 menit, denaturasi pada suhu 95 OC selama 15 detik, annealing (pelekatan primer) pada suhu 57 OC selama 30 detik,
extension pada suhu 68 OC selama 30 detik dan final extension pada suhu 72 OC selama 5 menit dan PCR dijalankan selama 30 siklus. Tahap akhir suhu diturunkan
14 dan dipertahankan pada 4OC, kemudian divisualisasi dengan elektroforesis gel agarose konsentrasi 1%. Setelah amplifikasi, DNA marker dan larutan DNA dari produk amplifikasi gen 16S rRNA, masing-masing sebanyak 5 µl dimasukkan kedalam sumur gel agarose dalam 1 x TBE dan alat elektroforesis di running dengan 90 V/80 menit .
Pita DNA hasil elektroforesis dideteksi dengan pengecatan ethidium bromida selama 15 menit dan gel diletakkan di atas permukaan UV transilluminator, kemudian divisualisasi dengan fotografi cahaya UV. Selanjutnya didokumentasikan dengan kamera digital.
iii. Sekuensing gen 16S rRNA dan Analisis filogenetik
Hasil amplifikasi DNA dengan teknik PCR, selanjutnya disekuensing pada perusahaan jasa sekuensing PT Genetika Science Indonesia (1st BASE Pte Ltd Malaysia). Hasil sekuen berupa data perunutan DNA kemudian dianalisis tingkat kesamaan atau kekerabatan genetik dari isolat yang diperoleh dengan data sekuen GenBank menggunakan program BLAST-N (Basic Local Alignment Search Tool) . Pohon filogenetik sibuat dengan program BLAST metode neighbour joining .
1.2. Laporan Tahap II
Sampel tanah diperoleh dari tanaman porang yang sehat di sekitar pertanaman yang terserang penyakit busuk umbi (bulbs rot) dan busuk pangkal batang (collar rot) di bawah tegakan hutan jati Kecamatan Saradan Kabupaten Madiun. Analisis sampel tanah dilakukan di laboratorium Agroteknologi Universitas Merdeka Madiun dan LPPT Universitas Gadjah Mada Yogyakarta. Penelitian dilakukan mulai bulan September 2015 sampai bulan November 2015.
Pemahaman sifat-sifat dari agens hayati, seperti sifat fenotipik bakteriologis dan sifat patogenisitas terhadap tanaman porang diperlukan untuk keefektifan pengendalian hayati. Metode penelitian dilakukan dengan cara: isolasi, skreening in vitro, uji kemampuan antagonisme.
a. Isolasi dan Identifikasi Agens Hayati
Isolasi agens hayati dilakukan dengan cara pengambilan tanah yang melekat disekitar perakaran tanaman porang sehat. Selanjutnya tanah dimasukkan dan disimpan dalam kantung plastik untuk dianalisa. Sampel tanah dengan berat 1 g dimasukkan dalam erlenmeyer yang berisi 10 ml larutan bufer fosfat 0,1 M dengan pH 7,0. Larutan divortex dan supernatan dibuat pengenceran 6 kali (10-6). Supernatan sebanyak 1 ml dibiakkan dalam media King B agar dan diinkubasikan pada suhu kamar
15 selama 48 jam. Selanjutnya dilakukan isolasi kembali bakteri pada media King B hingga diperoleh isolat murni.
Identifikasi bakteri antagonis diamati berdasarkan:1) pengamatan morfologi koloni dan sel; 2) sifat fisiologi dan biokimia.
1) Pengamatan morfologi koloni dan sel bakteri antagonis
Bentuk dan warna koloni bakteri diamati di bawah mikroskop dengan sinar ultra violet panjang gelombang 365 nm (UV tipe Gamac). Pengecatan negatif dilakukan untuk melihat morfologi individu sel dengan metode Yutono et al., 1973.
2) Sifat fisiologi dan biokimia bakteri antagonis
Pengujian sifat fisiologi dan biokimia bakteri dilakukan dengan cara sebagai berikut:
a) Pengujian gram
Isolat murni dari bakteri yang berumur 24 jam diambil sebanyak satu ose dan diletakkan pada gelas obyek steril yang telah ditetesi dengan KOH 3% serta diaduk, sehingga tercampur rata. Selanjutnya jarum ose diangkat perlahan-lahan, jika lengket di jarum ose digolongkan gram negatif dan tidak lengket digolongkan gram positif (Lelliot & Stead, 1987).
b) Reduksi Hidrogen Peroksidase (H2O2)
Isolat murni dari bakteri yang berumur 24 jam diambil sebanyak satu ose dan digoreskan pada gelas obyek steril yang telah ditetesi dengan H2O2 3%, jika terjadi gelembung udara menunjukkan bakteri tersebut mereduksi H2O2 (Lelliot & Stead, 1987).
c) Hidrolisis pati
Isolat murni dari bakteri yang berumur 24 jam ditumbuhkan pada medium pati dan diinkubasikan selama 5 hari. Selanjutnya isolat ditetesi dengan reagen Iodium pati, jika disekitar koloni menjadi bening menunjukkan reaksi positif. Reaksi negatif akan nampak di sekitar koloni berwarna biru tua atau gelap (Lelliot & Stead, 1987). d) Enzim gelatin
Isolat murni dari bakteri yang berumur 24 jam diinokulasikan pada medium gelatin di dalam tabung reaksi dan diinkubasikan pada temperatur ruang selama 3 hari. Selanjutnya diinkubasikan di dalam kulkas (suhu 4oC) selama 2 jam. Jika medium tetap cair menunjukkan reaksi positif atau bakteri dapat menghidrolisis gelatin (Klement, 1990).
16 e) Produksi Indol
Isolat murni dari bakteri yang berumur 24 jam ditumbuhkan pada medium Indol dan diinkubasikan selama 3 −5 hari. Pengamatan dilakukan dengan meneteskan larutan Iodin. Jika pada permukaan medium tersebut terdapat cincin merah menunjukkan reaksi positif (Klement, 1990).
f) Reduksi nitrat
Isolat murni dari bakteri yang berumur 24 jam ditumbuhkan pada medium Nitrat dalam tabung reaksi dan diinkubasikan selama 4 hari. Selanjutnya ditambahkan 1 ml reagen Nitrat dan diinkubasikan selama 24 jam pada temperatur ruangan. Jika pada permukaan medium tersebut berwarna merah menunjukkan bakteri tersebut mereduksi Nitrat (Klement, 1990).
g) Hidrolisis arginin
Isolat murni dari bakteri yang berumur 24 jam ditumbuhkan pada medium dengan kandungan L-arginin di dalam dua tabung reaksi, masing-masing ditutup dengan minyak parafilm dan tanpa ditutup minyak parafilm. Selanjutnya diinkubasikan pada suhu 27oC selama 5 hari. Reaksi positif ditunjukkan dengan perubahan media berwana merah pada tabung yang ditutup parafilm dan berwarna merah jambu pada tabung yang tanpa ditutup parafilm (Lelliot & Stead, 1987).
h) Pembentukan Levan
Bakteri ditumbuhkan pada medium Nutrien Agar dengan penambahan sukrosa 5%. Selanjutnya diinkubasikan pada temperatur ruangan selama 2 hari. Pembentukan levan sukrosa ditunjukkan dengan koloni bakteri yang transparan sampai gelap, berlendir (mukoid) dan berbentuk cembung (Fahy & Hayward, 1983).
3) Pengujian koloni bakteri antagonis menghambat pertumbuhan koloni patogen busuk umbi porang
Sclerotium delpinii isolate CBS221 dan Fusarium oxysporum strain Ppf15
sebagai kelompok jamur penyebab penyakit busuk umbi porang dan Cedecea lapagei strain DSM 4597 dan Serratia marcecens subsp. Sakuensis strain KRED (laporan kemajuan I) akan digunakan untuk uji daya hambat dari bakteri antagonis. Pengujian dilaksanakan pada media King B agar dalam cawan petri.
Pengujian pada kelompok patogen jamur, bagian bawah cawan petri masing-masing diberi garis tengah dengan spidol marker. Inokulum koloni bakteri antagonis berumur 48 jam dengan cork borer ukuran diameter 5 mm diletakkan dengan jarak 3 cm dari tepi cawan petri. Sedangkan inokulum koloni penyebab penyakit busuk umbi porang dengan cara yang sama, tetapi arahnya berlawanan dengan koloni bakteri
17 antagonis. Masing-masing inokulum koloni penyebab penyakit tersebut diletakan pada cawan petri yang berbeda (Gambar 5). Selanjutnya inokulum tersebut diinkubasikan selama 7 hari. Pengamatan dilakukan setiap hari dengan mengukur jari-jari koloni
Sclerotium delpinii isolate CBS221 dan Fusarium oxysporum strain Ppf15.
Gambar 4. Cara peletakan inokulum bakteri antagonis dan penyebab penyakit
Keterangan : Pf = Pseudomonas fluorescens; P = Sclerotium delpinii;
Fusarium oxysporum
Daerah penghambatan diukur dengan rumus: r1 – r2
I = x 100% r1
I = daya hambat (%).
r1 = jari-jari koloni Sclerotium delpinii isolate CBS221 dan Fusarium oxysporum strain Ppf15 yang arahnya berlawanan dengan koloni bakteri antagonis.
r2 = jari-jari koloni Sclerotium delpinii isolate CBS221 dan Fusarium oxysporum strain Ppf15 yang arahnya menuju koloni bakteri antagonis.
Pengujian pada kelompok patogen bakteri Cedecea lapagei strain DSM 4597 dan Serratia marcecens subsp. Sakuensis strain KRED dilakukan dengan penambahan 6 ml air steril pada biakan patogen bakteri. Selanjutnya suspensi bakteri diambil sebanyak 100 µl (107cfu/ml), dituangkan dalam cawan petri yang berisi media
King B agar, kemudian kertas saring steril diletakkan ditengah petri dan ditetesi bakteri antagonis sebanyak 20 µl ( Navitasari et al., 2013).
Masing-masing isolat agens hayati dilakukan pengujian dengan tiga kali ulangan. Nilai diameter daya hambat yang diperoleh dianalisis ragamnya dan diuji dengan Jarak Berganda Duncan.
18 1.3. Laporan Tahap III
Umbi katak diperoleh dari lahan endemis penyakit busuk umbi porang. umbi katak tersebut berasal dari tanaman yang terinfeksi penyakit busuk umbi porang dan jika jatuh ke tanah akan banyak sklerosia berlimpah di tanah, sehingga umbi katak akan berfungsi sebagai agen penyebab penyakit saat disimpan dan di tanam di lapangan.
Umbi katak dimasukkan dalam plastik diameter 30 cm dengan jumlah 1 kg umbi
katak/plastik untuk setiap perlakuan. Isolat yang tertinggi daya hambatnya (P. fluorescens Pf 11) terhadap penyebab penyakit busuk umbi porang diuji pada umbi
katak saat penyimpanan. Isolat P. fluorescens hasil seleksi sebelumnya dikultur pada media cair King B 5% dengan konsentrasi sesuai yang ditentukan dalam perlakuan. Inokulum tersebut diinkubasikan selama 2 x 2 jam, selanjutnya diaplikasikan pada umbi katak dengan dua cara aplikasi. Perlakuan terdiri atas dua faktor:
1) Cara aplikasi P. fluorescens: (A) umbi katak saat penyimpanan diperlakukan dengan penyelaputan P. fluorescens. Umbi katak sebanyak 1 kg dicampurkan dengan 10 ml suspensi P. fluorescens dan ditambah talk serta diaduk supaya merekat, selanjutnya dimasukkan plastik; (B) penyemprotan umbi katak sebanyak 1 kg disemprot secara merata dengan 10 ml suspensi Pseudomonas fluorescens,
selanjutnya dimasukkan plastik; (C) sebagai kontrol tanpa upaya pengendalian.
2) Konsentrasi P. fluorescens: 105 cfu/ml; (B) 107 cfu/ml; (C) 109 cfu/ml. Hasil akhir
adalah benih umbi katak yang dilapisi pasta dan cairan bakteri antagonis
P fluorescens.
Percobaan ini disusun dalam Rancangan Acak Lengkap (RAL) terdiri dari 7 perlakuan dengan masing-masing perlakuan lima kali ulangan. Data diolah dengan analisis ragam (ANOVA) dan dilanjutkan denganuji selang berganda Duncan (DMRT) pada taraf nyata α = 5% menggunakan SAS versi 6.12
19
BAB 5.
RENCANA CAPAIAN, HASIL DAN PEMBAHASAN
1.1. Rencana Capaiana. Laporan Tahap I
1) Pengamatan intensitas penyakit
Rencana capaian pada laporan kemajuan tahap pertama ini adalah mengetahui persentase pembusukan di bagian luar dan bagian dalam umbi porang berdasarkan periode tumbuh ketiga yaitu 2 minggu sebelum tanaman rebah (MSBTR), saat tanaman rebah (TR), dua minggu setelah tanaman rebah (MSTR).
2) Pengambilan sampel umbi porang bergejala busuk dan isolasi penyebab penyakit
Rencana capaian pada laporan kemajuan tahap pertama ini adalah menentukan persentase busuk umbi di bagian kulit dan daging umbi porang serta mendapatkan biakan murni dari isolat jamur dan bakteri. Biakan murni digunakan untuk inokulasi penyebab penyakit.
3) Inokulasi isolat penyebab penyakit
Inokulasi isolat penyebab penyakit dilakukan pada umbi porang sehat di laboratorium. Kegiatan inokulasi direncanakan akan mendapatkan gejala busuk di laboratorium dan isolat murni yang akan diidentifikasi secara akurat. Sampai dengan laporan kemajuan tahap pertama, direncanakan sudah terkumpul data hasil skoring gejala busuk umbi di laboratorium.
4) Reinokulasi isolat jamur penyebab penyakit
Pada kegiatan reinokulasi penyebab penyakit direncanakan akan mendapatkan mikroba yang tumbuh pada masing-masing media sampai diperoleh biakan murni yang siap diidentifikasi.
5) Identifikasi isolat jamur penyebab penyakit
Pada kegiatan identifikasi isolat penyebab penyakit akan teramati ciri-ciri penyebab penyakit dari isolat jamur berdasarkan pengamatan di bawah mikroskop, dan hasil amplifikasi DNA isolat jamur serta analisis filogenetik.
20 6) Identifikasi isolat bakteri penyebab penyakit
Pada kegiatan identifikasi isolat penyebab penyakit akan teramati ciri-ciri penyebab penyakit dari isolat bakteri berdasarkan pengamatan uji gram, pengujian hipersensitif, sekuensing gen 16S rRNA serta analisis filogenetik.
b. Laporan Tahap II
1) Pengamatan morfologi koloni dan sel bakteri antagonis
Kegiatan ini dilakukan untuk mengetahui pigmen yang dikeluarkan oleh bakteri tersebut pada medium King B di bawah sinar UV, sehingga dapat dibedakan dengan kelompok bakteri lain. Selain itu pengecatan negatif terhadap bakteri untuk mengetahui bentuk dan ukuran bakteri dengan pengamatan di bawah mikroskop. 2) Pengamatan sifat fisiologi dan biokimia bakteri antagonis
Pengujian berbagai sifat fisiologi dan biokimia bakteri dilakukan untuk mengetahui sifat fenotipik bakteriologis agar efektif sebagai agens hayati. Pengujian ini dilakukan dengan cara: pengujian gram, reduksi hidrogen peroksida, hidrolisis pati, enzim gelatin, produksi indol, reduksi nitrat, hidrolisis arginin, pembentukan levans. 3) Pengujian koloni bakteri antagonis menghambat pertumbuhan koloni patogen
busuk umbi porang
Uji daya hambat terhadap patogen penyebab busuk umbi porang (S. delpinii CBS221 dan F. oxysporum strain Ppf 15 , Cedecea lapagei strain DSM 4597, dan
Serratia marcecens subsp. Sakuensis strain KRED.) secara in vitro akan dilakukan
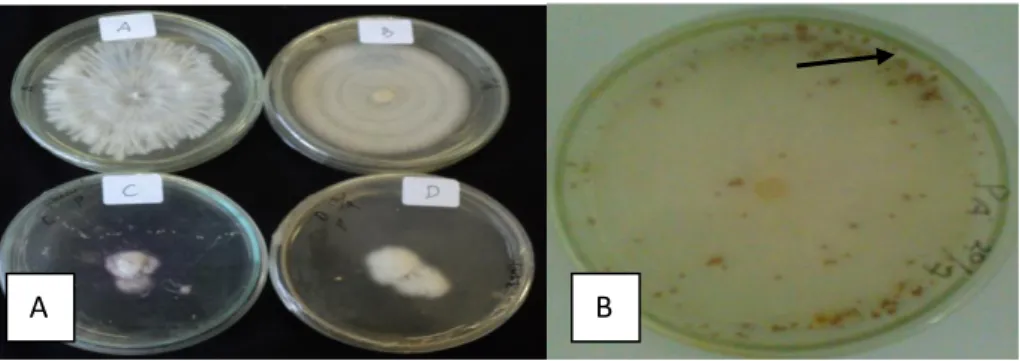
untuk memilih bakteri antagonis yang berpotensi sebagai agens hayati. Koloni patogen penyebab penyakit busuk umbi porang disajikan pada Gambar 5.
Gambar 5. Penyebab penyakit busuk umbi porang pada 4 hari setelah inokulasi: A) Fusarium
oxysporum strain Ppf 15; B) Sclerotium delpinii CBS221; C)Cedecea lapagei strain
DSM 4597;D)Serratia marcecens subsp. Sakuensis strain KRED.
21 c. Laporan tahap III
Jumlah sklerosia dan perkecambahan sklerosia dilakukan pengamatan setelah umbi katak disimpan selama dua bulan. Jumlah sklerosia dihitung menggunakan Wt Sieving Technique (Punja, 1988) yang telah dimodifikasi.
Skerosia setiap perlakuan diambil dengan pinset dan dimasukkan ke dalam cawan petri. Selanjutnya organ pembiakan tersebut dikecambahkan. Setiap perlakuan diambil 25 butir untuk diisolasikan pada media PDA dalam cawan. Perkecambahan ditandai oleh munculnya hifa berwarna putih. Perkecambahan dihitung dengan rumus:
a
P = x 100% a + b
P : persentase perkecambahan a : sklerosia yang berkecambah b : sklerosia yang tidak berkecambah 1.2. Hasil
a. Laporan Tahap I
1) Persentase penyakit busuk umbi porang
Gejala penyakit busuk umbi porang di batang nampak kumpulan miselium seperti bulu. Miselium tersebut akan berubah menjadi butir-butir bulat dan lonjong yang nampak disekitar tanah dari tanaman yang terinfeksi. Infeksi penyebab penyakit tersebut menyebabkan permukaan kulit umbi terlapisi oleh miselium, jika ditekan umbi menjadi lunak. Infeksi pada bagian daging umbi menampakkan gejala nekrose yang berwarna coklat sampai hitam. Persentase penyakit busuk umbi porang tergolong cukup rendah seperti yang ditunjukkan pada Tabel 1.
Tabel 1. Persentase penyakit busuk umbi di permukaan kulit dan daging umbi porang berdasarkan periode tumbuh ketiga
Masa periode tumbuh ketiga Gejala pada bagian umbi porang
Permukaan kulit umbi (X ± SE%) Daging umbi (X±SE%)
2 MSBTR 7.25± 2.01 9.48 ± 2,39
TR 11.61± 1.84 14.01± 3.12
2 MSTR 13.83 ± 0.97 16.25 ± 1.70
Keterangan: MSBTR = minggu sebelum tanaman rebah; TR = tanaman rebah; MSTR = minggu setelah tanaman rebah; SE = Standard Error pengukuran
Penyakit busuk umbi porang terbanyak terjadi pada daging umbi saat 2 MSTR. Daging umbi menampakan gejala nekrosa yang berwarna coklat muda sampai coklat
22 tua. Tingginya persentase busuk umbi ini disebabkan infeksi organisme lain saat tanaman.
2) Inokulasi isolat jamur penyebab penyakit
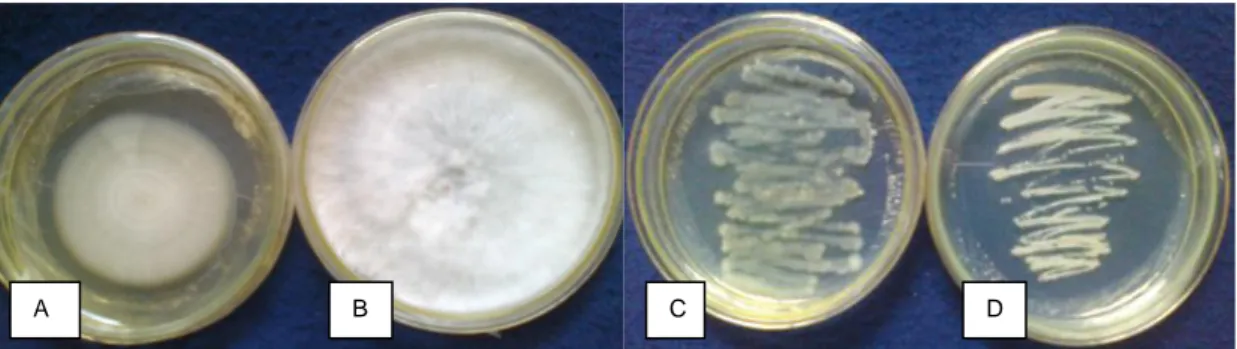
Hasil inokulasi isolat patogen pada umbi porang menghasilkan gejala yang terdiri atas: 1) umbi mengalami nekrose dengan miselium berwarna putih seperti kapas dan berbulu dengan pertumbuhannya sangat cepat. Hari kelima setelah inokulasi menampakan gumpalan berwarna putih, selanjutnya gumpalan tersebut berwarna coklat ;2) umbi mengalami nekrose dengan miselium seperti kapas dengan pertumbuhannya lambat. Sampai hari kelima tidak nampak terbentuknya gumpalan. Hasil inokulasi isolat penyebab penyakit disajikan pada Gambar 6.
Gambar 6. Gejala busuk pada umbi porang yang muncul setelah diinokulasi dengan isolat jamur (A,B,C,D) pemacu pembusukan pada umbi porang di laboratorium, K: kontrol
3) Identifikasi isolat jamur penyebab penyakit
Potongan jaringan dari umbi bergejala busuk dengan miselium yang tumbuh di daging umbi disubkultur hingga diperoleh biakan murni jamur. Morfologi jamur penyebab busuk umbi porang pada media PDA disajikan pada Gambar 7.
Gambar 7. Biakan murni dari bagian jaringan umbi porang: A) koloni penyebab penyakit; B) koloni penyebab penyakit dengan sklerotia berwarna coklat
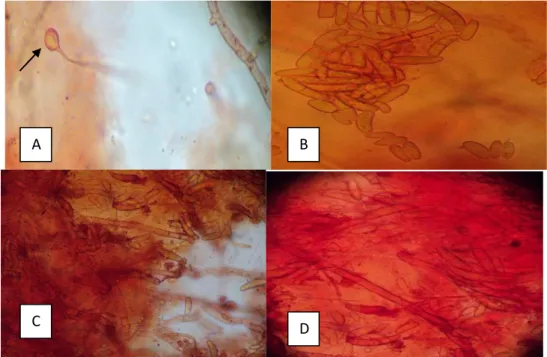
23 a) Pengamatan mikroskopi
Hasil pengamatan di bawah mikroskop menampakan hasil sebagai berikut: 1) miselium dengan sklerotia; 2) miselium dengan spora yang terdiri atas mikrokonidia dan makrokonidia yang berbentuk bulan sabit dan bersekat. Morfologi koloni jamur penyebab busuk umbi porang disajikan pada Gambar 8.
Gambar 8. Morfologi koloni jamur penyebab busuk umbi porang (200 X):A) miselium dengan klamidospora (terminal); B,C,D) miselium dengan mikro dan makrokonidia
b) Analisis secara molekular
Masing-masing DNA isolat jamur seperti pada Gambar 4 diisolasi, kemudian di PCR. Hasil amplifikasi DNA dengan teknik PCR disajikan pada Gambar 9.
M 1 2 3
Gambar 9. Hasil amplifikasi DNA pada isolat jamur penyebab penyakit busuk umbi porang dalam PAGE 6%. Lajur (1) DNA miselium jamur dengan spora (makrokonidia dan mikrokonidia); Lajur (2) DNA miselium jamur dengan sklerotia; Lajur (3) DNA miselium jamur dengan spora (makrokonidia dan mikrokonidia); Lajur (M) marker DNA 1 kb
3000 bp
1000 bp
A B
24 Isolat nomor 1 dan 3 berhasil teramplifikasi pada daerah sekitar 600 bp. Isolat nomor 2 teramplifikasi pada daerahsekitar 700 bp. Hasil amplifikasi DNA isolat jamur disekuensing. Hasil sekuen berupa data perunutan DNA kemudian dianalisis tingkat kesamaan atau kekerabatan genetik dari isolat yang diperoleh dengan data sekuen GenBank menggunakan program BLAST-N (Basic Local Alignment Search Tool) . Program BLAST metode neighbour joining digunakan untuk membuat pohon filogenetik, sehingga diperoleh nama spesies jamur dengan kecocokan tertinggi (Gambar 10).
Isolat1 Isolat3
Fusarium oxysporum strain Ppf15
Fusarium oxysporum f. sp. radicis-lycopersici strain ATCC 52429 Fusarium oxysporum isolate 2-X
Sclerotium delphinii isolate CBS221 Isolat2
Athelia rolfsii strain bai2 69 100 64 87 42 0.05
Gambar 10. Pohon filogenetik dari isolat penyebab penyakit busuk umbi porang 4) Jenis isolat jamur penyebab busuk umbi porang hasil inokulasi
Jenis isolat jamur penyebab busuk umbi porang hasil inokulasi disajikan pada Tabel 2.
Tabel 2. Jenis isolat jamur penyebab busuk umbi porang hasil inokulasi Nomor
isolat
Jenis mikroba Hasil inokulasi pada umbi Rerata kemunculan gejala Karakteristik pertumbuhan koloni di media PDA 1 dan 3 Fusarium oxysporum Strain Ppf15 Menghasilkan gejala pada 5 hsi
30,65% Koloni tumbuh agak lama; pada biakan umur 3 hari mencapai 0.8 cm 2 Sclerotium delphinii isolate CBS221 Menghasilkan gejala pada 3 hsi
88,23% Koloni tumbuh sangat cepat; pada biakan Umur 3 hari mencapai 3,6 cm
5) Reisolasi dan karakterisasi isolat bakteri penyebab penyakit busuk umbi porang a) Reisolasi isolat bakteri penyebab penyakit
Reisolasi isolat bakteri penyebab penyakit dilakukan pada umbi porang yang berumur satu bulan. Isolat bakteri yang tumbuh pada jaringan disubkultur beberapa kali sampai diperoleh biakan murni. Reisolasi isolat bakteri disajikan pada Gambar 11.
25 Gambar 11. Gejala pada umbi porang dari hasil reisolasi isolat bakteri
b) Pengamatan koloni bakteri penyebab penyakit
Hasil isolasi pada media King B penyebab penyakit ditemukan 10 jenis bakteri berpendar dan isolat nomor 3 berwarna merah. Hasil pengamatan koloni bakteri tersebut pada media King B disajikan pada Gambar 12.
Gambar 12. Koloni bakteri penyebab penyakit busuk umbi porang c) Pengujian gram
Hasil uji gram menunjukkan bahwa isolat bakteri nomor 1, 2, 3, 5, 7, 8 bersifat gram negatif dan nomor 4, 6 dan 10 bersifat gram positif.
d) Pengujian hipersensitif
Pengujian hipersensitif menggunakan 10 isolat bakteri yang berpendar. Isolat bakteri nomor 7 dan 5 masing-masing setelah masa inkubasi 2 hari, dan 3 hari menunjukkan gejala nekrosis dan daun nampak tipis transparan (Gambar 13).
26 Gambar 13. Reaksi hipersensitif pada daun tembakau: A) gejala nekrosis pada isolat bakteri
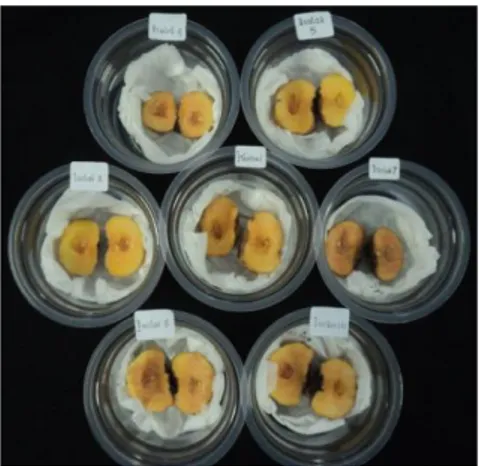
nomor 7; B) gejala nekrosis pada isolat bakteri nomor 5 e) Pengujian degradasi pektat pada umbi kentang
Uji degradasi pektat pada isolat bakteri pendar fluor nomor 5 dan 7 menunjukkan gejala yang berbeda. Isolat bakteri pendarfluor nomor 5 jaringan umbi yang rusak dan mati berwarna hitam pekat dan tidak meluas dibandingkan isolat nomor 9. Hasil pengujian degradasi pektat pada umbi kentang disajikan pada Gambar 14.
Gambar 14. Hasil uji degradasi pektat isolat bakteri pendar fluor pada umbi kentang: Konrrol dengan penuangan air steril; isolat 5 dan 7 dengan penuangan masing-masing isolat bakteri pendar fluor
f) Analisis secara molekular
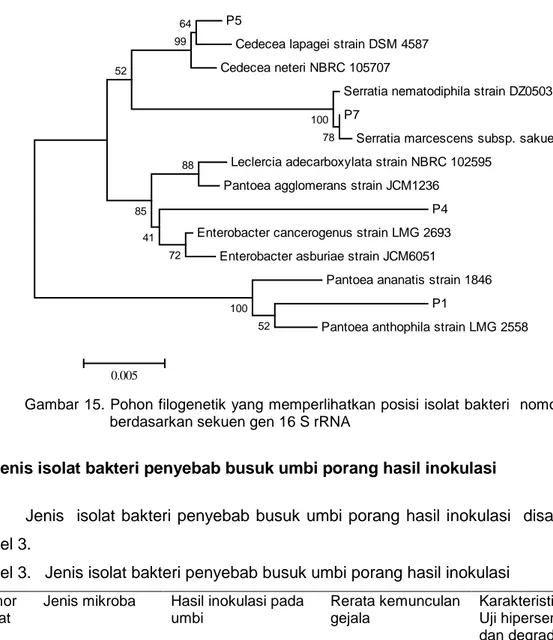
Pohon filogenetik menunjukkan bahwa isolat bakteri nomor 5 termasuk dalam kelompok Cedecea lapagei strain DSM 4597. Berdasarkan hasil BLAST diketahui isolat mempunyai kemiripan 99% dengan Cedecea neteri NBRC 105707. Isolat nomor 7 termasuk dalam kelompok Serratia marcecens subsp. Sakuensis strain KRED. Isolat mempunyai kemiripan 100% dengan Serratia nematodiphila strain DZ0503SBS1. Pohon filogenetik yang memperlihatkan posisi isolat bakteri nomor 5 dan 7 berdasarkan sekuen gen 16S rRNA (Gambar 15).
27 P5
Cedecea lapagei strain DSM 4587 Cedecea neteri NBRC 105707
Serratia nematodiphila strain DZ0503SBS1 P7
Serratia marcescens subsp. sakuensis strain KRED Leclercia adecarboxylata strain NBRC 102595
Pantoea agglomerans strain JCM1236 P4 Enterobacter cancerogenus strain LMG 2693
Enterobacter asburiae strain JCM6051
Pantoea ananatis strain 1846 P1
Pantoea anthophila strain LMG 2558 52 100 78 100 88 64 99 52 72 85 41 0.005
Gambar 15. Pohon filogenetik yang memperlihatkan posisi isolat bakteri nomor 5 dan 7 berdasarkan sekuen gen 16 S rRNA
6) Jenis isolat bakteri penyebab busuk umbi porang hasil inokulasi
Jenis isolat bakteri penyebab busuk umbi porang hasil inokulasi disajikan pada Tabel 3.
Tabel 3. Jenis isolat bakteri penyebab busuk umbi porang hasil inokulasi Nomor
isolat
Jenis mikroba Hasil inokulasi pada umbi
Rerata kemunculan gejala
Karakteristik
Uji hipersensitif, gram, dan degradasi pektat
5 Cedecea neteri NBRC 105707 Menghsilkan gejala pada 8 hsi 10,46% Gejala nekrosis, gram negatif, mendegradasi pektat pada hari 4, tetapi tidak menyebar
7 Serratia
namatodiphila strain
DZ0503SBS1
Menghasilkan gejala pada 4 hsi
14,01% Gejala nekrosis, gram negatif, mendegradasi pektat pada hari 4, tetapi menyebar
28 b. Laporan Tahap II
1) Morfologi koloni bakteri
Berdasarkan pengamatan di bawah sinar UV ( λ = 366 nm) menunjukkan tiga dari 37 koloni bakteri pada medium King B agar berpendar dengan warna hijau kebiruan. Koloni bakter tersebut dengan kode 11,15,25. Pendaran dan warna dari koloni bakteri tersebut disajikan pada Gambar 16
Gambar 16. Pengamatan koloni bakteri pada medium King B di bawah sinar UV (λ = 366 nm) A) koloni bakteri yang berpendar; B) koloni bakteri yang berpendar dan yang tidak berpendar.
Individu bakteri dengan pengecatan negatif mempunyai bentuk batang dengan ukuran 0,5−0,9 x 1,6−3,7 µm. Bakteri dapat ditemukan dalam keadaan tunggal dan bergerombol (Gambar 17).
Gambar 17. Bentuk bakteri pada pengamatan di bawah mikroskop cahaya dengan perbesaran 1000x
2) Pengujian reaksi hipersensitif pada daun tembakau
Pengujian hipersensitif menggunakan tiga koloni bakteri (Pf 11, Pf 15, Pf 25) yang berpendar di bawah sinar UV masing-masing setelah masa inkubasi sampai hari ke 7 tidak menunjukkan gejala nekrosis (Gambar 18).
29 Gambar 18. Pengujian reaksi hipersensitif dari Pseudomonas fluorescens pada daun tembakau 3) Pengamatan sifat fisiologi dan biokimia bakteri
Tabel 4. Sifat fenotipik Pseudomonas fluorescens isolat Saradan
Sifat fenotip Pf 11 Pf 15 Pf 25
Gram − − −
Reduksi Hidrogen Peroksidase + + +
Hidrolisis Pati − + − Enzim Gelatin + + − Reduksi Nitrat + + + Produki Indol 2 hari 5 hari − + + − + − Hidrolisis Arginin + + + Pembentuk Levan + − −
4) Pengujian daya hambat
Tabel 5. Hasil pengujian Pseudomonas fluorescens isolat Saradan terhadap pertumbuhan koloni penyebab penyakit busuk umbi porang
Kode isolat
P. fluorescens
Daya hambat terhadap jamur penyebab busuk umbi porang (%)
Diameter hambatan terhadap bakteri penyebab busuk umbi porang (mm)
F.oxysporum S. delpinii C. neteri S. namatodiphila
Pf 11 85,12 a 78,84 a 11,25 a 14.09 a
Pf 15 54,93 c 51.06 b 9.37 b 12,14 b
Pf 25 61,40 b 49,93 b 9,29 b 8,70 b
Kontrol 1,37 d 1,80 c 2,01 c 2,28 d
Keterangan: Angka yang diikuti huruf yang sama dalam kolom yang sama menunjukkan tidak
berbeda nyata pada P= 0.05
Kontrol = tanpa menggunakan isolat P. fluorescens c. Laporan Tahap III
Perlakuan yang paling menekan jumlah dan perkecambahan sklerosia adalah aplikasi dengan penyelaputan umbi katak P. fluorescens dengan konsentrasi tinggi 107 -109cfu/ml. Viabilitas organ pembiakan Sclerotium delphinii pada umbi katak yang disimpan selama dua bulan dari peubah jumlah dan perkecambahan sklerosia hanya dipengaruhi oleh cara aplikasi P. fluorescens Pf 11. P fluorescens yang diaplikasikan dengan penyelaputan benih dan penyemprotan umbi katak dengan agens hayati tersebut, masing-masing mampu menekan jumlah sklerosia yang
30 terbentuk pada umbi katak rata-rata 22,50 butir (90 %) dan 12,34 butir (49,36 %) sklerosia dari 25 sklerosia yang dikembangkan pada media PDA (Tabel 6).
Tabel 6. Pengaruh P.fluorescens PF 11 terhadap penekanan jumlah organ sklerosia dari S. delphinii dan persentase perkecambahan sklerosia pada umbi katak di penyimpanan Cara aplikasi P.fluorescens Pf 11 Konsentrasi P.fluorescens Pf 11 (cfu/ml).
Organ sklerosia (butir/1 kg umbi katak) Perkecambahan (%) A1 105 20,45 b 18,20 e 107 23,26 ab 6,96 g 109 23,79 a 4,84 fg A2 105 10,46 d 58,80 b 107 11,80 d 52,81 c 109 14,75 c 41,00 d Kontrol 3,89 e 84,44 a Keterangan:
A1 : Aplikasi melalui penyelaputan umbi katak A2 : Aplikasi melalui penyemprotan
Angka selajur yang diikuti oleh huruf yang sama tidak berbeda nyata pada P= 0,05 1.3. HAMBATAN
Kendala dan hambatan pada kegiatan penelitian “Identifikasi Penyebab Penyakit Busuk Umbi Porang (Amorphophallus mueleri Blume) “ yaitu ketersediaan tanaman porang di lapangan. Ketersediaan tanaman porang di lapangan yang digunakan untuk isolasi penyebab penyakit busuk umbi porang merupakan hambatan yang paling utama. Tanaman porang pada musim kemarau yaitu bulan Juni sampai bulan September dalam kondisi dorman. Oleh karena itu peneliti melakukan penelitian sebelum bulan Juni untuk mendapatkan isolat penyebab penyakit busuk umbi porang di pertanaman,sehingga tidak berpengaruh terhadap target-target penelitian. Meskipun masalah keterlambatan pendanaan merupakan masalah klasik yang selalu terjadi untuk peneliti di Indonesia.
Tahap ke II dan III secara teknis tidak mengalami hambatan dalam penelitian. Hal ini karena penelitian dilakukan lebih awal dan penelitian di laboratorium serta umbi katak di lapangan tersedia pada akhir musim kemarau. Meskipun tenggang waktu pelaporan kemajuan II dan III sangat dekat.
1.4. PEMBAHASAN
a. Laporan Kemajuan I
Gejala penyakit busuk umbi menampakan tumbuhnya miselium pada pangkal batang dan kulit serta bagian daging umbi porang. Kumpulan miselium berwarna
31 putih seperti kapas dan sklerotia berwarna coklat yang tumbuh pada kulit umbi porang mengotori tanah dan melekat pada umbi tersebut serta menjadi sumber inokulum. Jika tanah di permukaan umbi dibersihkan nampak permukaan umbi berwarna coklat terang dan ditekan nampak lunak. Gejala pada pangkal batang ini menyebabkan tanaman porang rebah sebelum saatnya (Gambar 19). Kondisi ini akan memudahkan infeksi jasad pengganggu lain yang memperparah gejala pada umbi tersebut.
Gambar 19. Gejala penyakit busuk umbi porang: A) gejala pada pangkal batang; B) gejala pada permukaan tanah ; C) gejala pada permukaan kulit umbi porang
Jamur tular tanah dengan struktur berupa skletotia dapat bertahan hingga 10 tahun. Jika terdapat tanaman inang akan berkembang kembali. Permukaan sklerotium dapat mengeluarkan exudat antara lain asam oksalat yang bersifat racun pada tanaman. Asam oksalat meningkat karena senyawa dari akar yang menguap (Yaqub dan Shahzad, 2005; Okereke dan Wokocha,2007; Sumartini,2011).
Hasil identifikasi berdasarkan pengamatan di bawah mikroskop miselium dengan skerotia dan miselium dengan spora yang terdiri atas: makrokonidia dan mikrokonidia, masing-masing adalah kelompok jamur Sklerotium sp dan Fusarium sp. Amplifikasi DNA menunjukkan isolat 1 mempunyai ukuran pita yang sama Berdasarkan diagram filogenetik, miselium jamur dengan sklerotia 100 % dianggap teridentifikasi pada tingkat spesies dan memiliki kemiripan basa dengan Sclerotium
delphinii isolate CBS221. Miselium jamur dengan spora yang terdiri atas makrokonidia
dan mikrokonidia 87% dianggap teridentifikasi pada tingkat genus atau famili dan memiliki kemiripan basa dengan Fusarium oxysporum strain Ppf15.
Karakter isolat bakteri nomor 1, 2, 3 ,5 , 7 dan 8 menunjukkan bersifat gram negatif dan produksi pigmen pendarfluor. Meskipun pada uji hipersensitif menunjukkan isolat bakteri nomer 5 dan 7 bergejala nekrosis, yang berarti penyebab penyakit pada umbi porang. Hasil pengujian ini didukung dengan uji pektat. Isolat nomor 5 dan 7 mampu menghasilkan dan mensekresikan ensim pektinase atau isoensim serta mendegradasikan dinding sel untuk merombak pektat. Hal ini menyebabkan umbi porang membusuk dan berwarna hitam. Menurut Barras et al. (l994) menyatakan
32 enzim pektinase dari bakteri pendar fluor mampu memecah pektin didalam lamela tengah dan dinding sel tanaman, sehingga jaringan mati, rusak dan sel pecah.
Berdasarkan hasil isolasi dan uji busuk umbi serta produksi pigmen pendarfluor didapatkan 10 koloni bakteri. Koloni bakteri dari isolat nomor 5 dan 7 setelah uji gram menunjukan kelompok bakteri gram negatif dan uji hipersensitif menghasilkan gejala nekrosis pada daun tembakau.Isolat nomor 5 dan 7 mengindikasikan patogenik terhadap umbi porang. Ignjatov et al., (2007) uji patogenisitas positif, jika daun tembakau menunjukkan gejala nekrosis pada bagian daun 24 jam setelah terinfiltrasi dengan isolat bakteri.
Berdasarkan uji gram isolat bakteri nomor 1 bersifat gram negatif, tetapi bereaksi negatif pada uji hipersensitif, reisolasi pada umbi porang, dan degradasi pektat, sehingga tbakteri tersebut tidak patogenik. Meskipun analisis pohon filogenetik teridentifikasi Pantoea ananatis strain 1846. Bakteri patogenik yang menyebabkan busuk umbi porang adalah dari kelompok Cedecea neteri NBRC 105707 dan Serratia
namatodiphila strain DZ0503SBS1 termasuk famili Enterobacteriaceae. Menurut
Kowalska et al. (2011) Serratia plymuthica menyebabkan busuk umbi pada bawang. Sedangkan Serratia marcecens strain PPM4 16 S termasuk bakteri endofit yang mampu menekan serangan penyakit hawar daun bakteri.
b. Laporan Kemajuan II
1) Morfologi koloni bakteri dan uji reaksi hipersensitif
Tiga koloni bakteri tersebut (Pf 11, Pf 15, Pf 25) merupakan kelompok
Pseudomonas fluorescens. Hal ini karena memancarkan sinar hijau kebiruan, jika
diamati di bawah sinar UV dengan panjang gelombang 365 nm. Menurut Sands (2001) dan Schaad (l988) pendaran sinar tersebut mencirikan keberadaan dari siderofor karena medium King B mengandung ion Fe. Terbentuknya pigmen fluorescens pada bakteri di media King B menunjukkan bakteri termasuk golongan Pseudomonas
fluorescens.
Sampel dari tiga koloni bakteri Pseudomonas fluorescens tersebut mempunyai bentuk batang dengan ukuran 0,5−0,9 x 1,6−3,7 µm. Menurut Palleroni (l993) koloni bakteri tersebut merupakan famili dari Pseudomonasaceae.
Gejala nekrotik sampai hari ke 7 tidak dihasilkan oleh tiga koloni bakteri
Pseudomonas fluorescens pada uji HR. Reaksi ini menunjukkan koloni bakteri tersebut