PENGUJIAN SIFAT ANTIOKSIDAN GALAKTOMANAN YANG DIEKSTRAKSI DARI AMPAS KELAPA
TESIS
Oleh
RISLIMA SIHOMBING 117006029/KIM
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2013
PENGUJIAN SIFAT ANTIOKSIDAN GALAKTOMANAN YANG DIEKSTRAKSI DARI AMPAS KELAPA
TESIS
Diajukan Sebagai Salah Satu Syarat Untuk Memperoleh Gelar Magister Sains Dalam Program Studi Ilmu Kimia Pada Fakultas Matematika Dan Ilmu
Pengetahuan Alam Universitas Sumatera Utara
Oleh
RISLIMA SIHOMBING 117006029/KIM
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN
Judul Tesis : PENGUJIAN SIFAT ANTIOKSIDAN GALAKTOMANAN YANG DIEKSTRAKSI DARI AMPAS KELAPA
Nama Mahasiswa : RISLIMA SIHOMBING Nomor Pokok : 117006029
Program Studi : Magister Ilmu Kimia
Menyetujui, Komisi Pembimbing
Prof. Dr. Jamaran Kaban, MSc
Ketua Anggota
Dr. Mimpin Ginting, MS
Ketua Program Studi, Dekan,
Prof.Dr. Basuki Wirjosentono, MS,Ph.D Dr. Sutarman, MSc
Tanggal Lulus : 04 Juli 2013
Telah diuji pada
Tanggal : 04 Juli 2013
PANITIA PENGUJI TESIS
Ketua : Prof. Dr. Jamaran Kaban, MSc Anggota : 1. Dr. Mimpin Ginting, MS
2. Prof Dr. Seri Bima Sembiring, MSc 3. Dr. Hamonangan Nainggolan, MSc 4. Dr. Lamek Marpaung, MPhil 5. Prof.Dr. Yunazar Manjang
PERNYATAAN ORISINALITAS
PENGUJIAN SIFAT ANTIOKSIDAN GALAKTOMANAN YANG DIEKSTRAKSI DARI AMPAS KELAPA
TESIS
Dengan ini saya menyatakan bahwa saya mengakui semua karya Tesis ini adalah hasil kerja saya sendiri kecuali kutipan dan ringkasan yang tiap satuannya telah dijelaskan sumbernya dengan benar.
Medan, Juli 2013
Rislima Sihombing NIM. 117006029
PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Sebagai Sivitas Akademika Universitas Sumatera Utara, saya yang bertanda tangan di bawah ini:
Nama : Rislima Sihombing Nomor Pokok : 117006029
Program Studi : Magister Ilmu Kimia Jenis Karya Ilmiah : Tesis
Demi pengembangan ilmu pengetahuan, menyetujui untuk memberikan kepada Universitas Sumatera Utara Hak Bebas Royalti Non-Eksklusif (Non-Exclusif Royalty Free Right) atas Tesis saya yang berjudul:
PENGUJIAN SIFAT ANTIOKSIDAN GALAKTOMANAN YANG DIEKSTRAKSI DARI AMPAS KELAPA
beserta perangkat yang ada (jika diperlukan). Dengan Hak Bebas Royalti Non- Eksklusif ini, Universitas Sumatera Utara berhak menyimpan, mengalih media, memformat, mengelola dalam bentuk data-base, merawat dan mempublikasikan Tesis saya tanpa meminta izin dari saya selama tetap mencantumkan nama saya sebagai penulis dan sebagai pemegang dan atau sebagai pemilik hak cipta.
Demikian pernyataan ini dibuat dengan sebenarnya.
Medan, Juli 2013
Rislima Sihombing NIM. 117006029
RIWAYAT HIDUP
DATA PRIBADI
Nama Lengkap : Rislima Sihombing
Tempat / Tgl lahir : Buluduri, Kab. Dairi, 27 Oktober 1969 Alamat Rumah : JL. Bersama Km 13- Muliorejo Kec Sunggal
HP : 085261679821
Email : sihombingrislima@yahoo.com.au Instansi Tempat Kerja : SMA Negeri 4 Binjai
Alamat Kantor : Jl. Cut Nyak Dien No 134 Binjai
DATA PENDIDIKAN
SD Negeri. 1 Buluduri Tahun 1976 - 1982
SMP Negeri Laeparira Tahun 1982- 1985
SMA Negeri Parongil Tahun 1985 - 1988
D-3 Kependidikan Kimia USU Tahun 1988 - 1991 S-1 Universitas Terbuka Jakarta Tamat 1995 – 1996
PENGUJIAN SIFAT ANTIOKSIDAN GALAKTOMANAN YANG DIEKSTRAKSI DARI AMPAS KELAPA
ABSTRAK
Galaktomanan merupakan senyawa karbohidrat golongan polisakarida telah diisolasi dari ampas kelapa melalui metode ekstraksi dengan menggunakan pelarut etanol dan selanjutnya dilakukan uji aktivitasnya sebagai antioksidan. Sebanyak 130 g ampas kelapa kering diekstraksi dengan menggunakan metode refluks dalam pelarut etanol sebanyak 780 ml pada suhu 500C selama 5 jam. Masing-masing ekstrak galaktomanan yang diperoleh, dimurnikan dengan menggunakan pereaksi Fehling dan diikuti dengan penambahan HCl dan etanol, sentrifugasi dan pengeringan yang kemudian diperoleh galaktomanan murni rata- rata sebanyak 0,33 g (0,0254%). Hasil analisa spektrum FT-IR memberikan spektrum yang menggambarkan pola spektrum senyawa bahwa hasil ekstraksi adalah galaktomanan. Selanjutnya galaktomanan yang diperoleh melalui pengujian aktivitas antioksidan dengan metode DPPH diperoleh nilai IC50 sebesar 8,18 mg/mL
Kata kunci: Galaktomanan, Ekstraksi, Spektroskopi FT-IR, Antioksidan.
THE OF ANTIOXIDANT PROPERTIES GALACTOMANNANS WHICH EXTRACTED FROM DREGS COCONUT
ABSTRACT
Galactomannan is a carbohydrate compound of polysaccharide class that has been isolated from coconut pulp through extraction method using ethanol solvent and furthermore its activity test is carried out as antioxidant. As much as 130 g of dried coconut pulp is extracted by using reflux method in 780 ml ethanol solvent at a temperature of 500C for 5 hours. Each extract galactomannan obtained is purified by using Fehling reagent and followed by the addition of HCl and ethanol, centrifugation and drying of thus pure galactomannan obtained an average of 0.33 g (0.0254%).
Results of FT-IR spectrum analysis provides a spectrum that describes the pattern of compound spectrum that the extraction is galactomannan. Furthermore galactomannan obtained through antioxidant activity testing with DPPH method, IC50 values is obtained at 8.18 mg / mL
Keyword: Galactomannan, Extraction, Spectroscopy FT-IR, Antioxidant.
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Tuhan Yesus Kristus, sang Juruselamat yang telah memberi rahmat dan karuniaNya sehingga penulis dapat menyelesaikan penulisan tesis ini dengan judul “PENGUJIAN SIFAT ANTIOKSIDAN GALAKTOMANAN YANG DIEKSTRAKSI DARI AMPAS KELAPA”.Tesis ini merupakan tugas akhir penulis pada Sekolah Pascasarjana Universitas Sumatera Utara.
Pada kesempatan ini perkenankan penulis mengucapkan terima kasih dan penghargaan yang setinggi-tingginya kepada :
1. Bapak Prof. Dr. dr. Syahril Pasaribu DTMH, Sp.A(K), MSc selaku Rektor Universitas Sumatera Utara.
2. Bapak Dr. Sutarman, MSc selaku Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara
3. Bapak Prof. Basuki Wirjosentono, MS, Ph.D selaku Ketua Program Studi Pascasarjana Kimia Universitas Sumatera Utara.
4. Bapak Prof. Dr. Jamaran Kaban MSc selaku pembimbing utama dan Bapak Dr.
Mimpin Ginting MS selaku anggota komisi pembimbing sekaligus selaku Kepala Laboratorium Kimia Organik FMIPA USU yang dengan penuh perhatian telah memberikan bimbingan, dorongan, pengetahuan dan saran hingga tesis ini dapat diselesaikan.
5. Seluruh staf dosen Pascasarjana Kimia Universitas Sumatera Utara atas ilmu yang diberikan kepada penulis selama mengikuti perkuliahan maupun dalam menyusun tesis ini.
6. Seluruh para asisten Laboratorium Kimia Organik FMIPA- USU atas fasilitas dan bantuannya selama pengerjaan tesis ini.
7. Bapak Drs. Agus Erwin Siregar selaku Kepala Sekolah SMA Negeri 4 Binjai yang telah memberikan izin untuk mengikuti studi Pascasarjana.
8. Kepada orang tuaku dan seluruh keluargaku yang telah memberikan doa restu serta dorongan moril selama ini
Akhirnya penulis mengucapkan terima kasih kepada suami tercinta Pantas Manurung dan anak - anakku tersayang, Daniel Franklin Manurung, Debora Patricia Br Manurung dan David Fanrich Natanael Manurung dengan penuh kesabaran dan kasih yang tulus memberikan doa restu, dukungan dan bantuan selama penulis menyelesaikan pendidikan ini.
Penulis menyadari bahwa tesis ini masih jauh dari sempurna karena itu penulis sangat mengharapkan kritik dan saran yang membangun untuk kesempurnaan tesis ini.
Hormat penulis,
RISLIMA SIHOMBING
RIWAYAT HIDUP
DATA PRIBADI
Nama Lengkap : Rislima Sihombing
Tempat / Tgl lahir : Buluduri, Kab. Dairi, 27 Oktober 1969 Alamat Rumah : JL. Bersama Km 13- Muliorejo Kec Sunggal
HP : 085261679821
Email : sihombingrislima@yahoo.com.au Instansi Tempat Kerja : SMA Negeri 4 Binjai
Alamat Kantor : Jl. Cut Nyak Dien No 134 Binjai
DATA PENDIDIKAN
SD Negeri. 1 Buluduri Tahun 1976 - 1982
SMP Negeri Laeparira Tahun 1982- 1985
SMA Negeri Parongil Tahun 1985 - 1988
D-3 Kependidikan Kimia USU Tahun 1988 - 1991 S-1 Universitas Terbuka Jakarta Tamat 1995 - 1996
DAFTAR ISI
Halaman
ABSTRAK i
ABSTRACT ii
KATA PENGANTAR iii
DAFTAR ISI v
DAFTAR TABEL viii
DAFTAR GAMBAR ix
DAFTAR LAMPIRAN x
BAB 1. PENDAHULUAN 1
1.1. Latar Belakang 1
1.2. Permasalahan 3
1.3. Tujuan Penelitian 4
1.4. Manfaat Penelitian 4
1.5. Metodologi Penelitian 4
1.6. Lokasi Penelitian 5
BAB 2. TINJAUAN PUSTAKA 6
2.1. Morfologi Kelapa (Cococ nucifera) 6
2.2. Karbohidrat 7
2.2.1. Monosakarida 9
2.2.2. Oligosakarida 11
2.2.2.1. Maltosa 11
2.2.2.2. Sukrosa 12
2.2.2.3. Laktosa 13
2.2.3. Polisakarida 15
2.2.3.1. Selulosa 15
2.2.3.2. Pati 16
2.3. Galaktomanan dan Kegunaannya 18
2.4. Antioksidan 20
2.4.1. Antioksidan Sintetis 22
2.4.2. Antioksidan Alami 24
2.5. Pengujian Antioksidan 29
2.6. Spektroskopi Inframerah 33
BAB 3 BAHAN DAN METODE 37
3.1. Alat- alat 31
3.2. Bahan- bahan 38
3.3. Prosedur Penelitian 38
3.3.1. Tahap Persiapan Sampel 38
3.3.2. Ekstraksi Galaktomanan dari Ampas Kelapa 38
3.3.3. Pemurnian Galaktomanan 38
3.3.4. Uji Aktivitas Antioksidan Senyawa 38 galaktomanan dengan metode DPPH
3.3.4.1. Pembuatan Larutan DPPH 0,3 mM 38
3.3.4.2. Pembuatan Variasi Larutan 39
Galaktomanan
3.3.4.3. Uji Aktivitas Antioksidan 39
3.3.4.3.1. Pembuatan Larutan Blanko 39 3.3.4.3.2. Uji Aktivitas Antioksidan Sampel 39
3.4. Bagan Penelitian 40
3.4.1. Ekstraksi Galaktomanan dari Ampas Kelapa 40
3.4.2. Pemurnian Galaktomanan 41
3.4.3. Uji Sifat Antioksidan Galaktomanan
Dengan metode DPPH 42
3.4.3.1. Pembuatan Larutan DPPH 0,3 mM 42 3.4.3.2.Pembuatan Variasi Larutan Galaktomanan 42
3.4.3.3. Uji Blanko 43
3.4.3.4. Uji Sampel (Senyawa galaktomanan) 43
BAB 4 HASIL DAN PEMBAHASAN 44
4.1. Hasil Penelitian 44
4.1.1. Hasil Ekstraksi Galaktomanan
dari ampas kelapa 44
4.1.2. Hasil Uji Aktivitas Antioksidan Galaktomanan 44 diekstraksi dari ampas kelapa
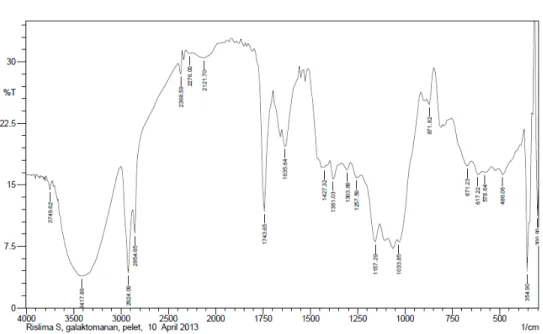
4.1.3. Hasil Uji Spektroskopi FT-IR Galaktomanan 45
4.2. Pembahasan 46
4.2.1. Ekstraksi Galaktomanan dari Ampas Kelapa 46 4.2.2. Uji Aktivitas Antioksidan Galaktomanan
Hasil Ekstraksi Ampas Kelapa 47
BAB 5 KESIMPULAN DAN SARAN 52
5.1. Kesimpulan 52
5.2. Saran 52
DAFTAR PUSTAKA 53
LAMPIRAN 60
DAFTAR TABEL
Nomor Judul Halaman Tabel 2.1. Keuntungan dan kerugian Antioksidan Sintesis dan Alami 26 Tabel 2.2. Aktivitas Antioksidan Polisakarida dari beberapa tumbuh-tumbuhan 30
Tabel 2.3. Serapan Khas beberapa gugus fungsi 35
Tabel 4.1. Hasil Ekstraksi Galaktomanan dari Ampas Kelapa 44 Tabel 4.2. Hasil pengukuran Absorbansi Galaktomanan dari Ampas Kelapa 45 Tabel 4.3. Hasil Analisis Galaktomanan dari Ampas Kelapa dengan
Spektrofotometer FT-IR 47
DAFTAR GAMBAR
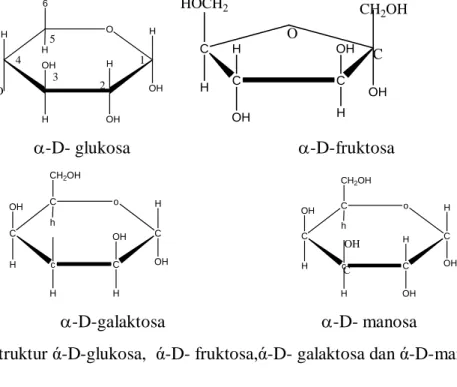
Nomor Judul Halaman Gambar 2.1. Struktur α-D- glukosa, α-D- fruktosa α-D- galaktosa
α- D- manosa 10
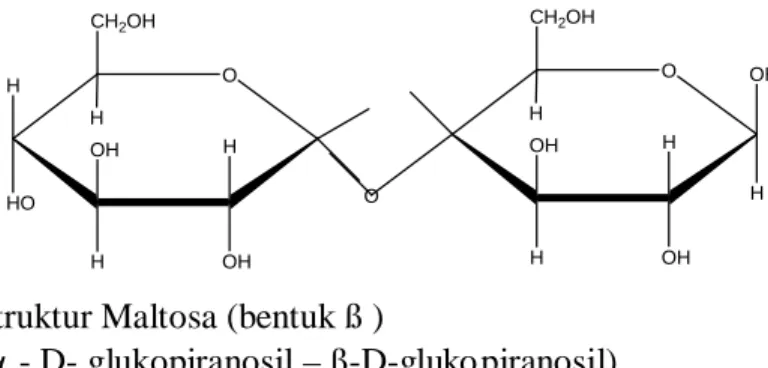
Gambar 2.2. Struktur Maltosa ( bentuk ß )
(α- D- glukopiranosil- ß – D- glukopiranosil) 12 Gambar 2.3. Struktur Sukrosa (α-D- glukopiranosil, ß – D- fruktofuranosida 12 Gambar 2.4 Struktur Laktosa (ß-D- galaktopiranosil-α-D-glukopiranosil) 14
Gambar 2.5. Struktur molekul Selulosa 16
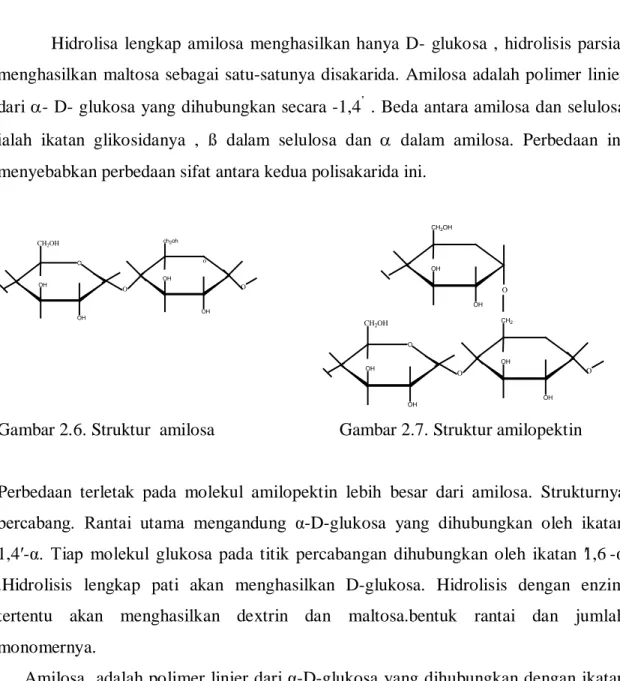
Gambar 2.6. Struktur amilosa 17
Gambar 2.7. Struktur amilopektin 17
Gambar 2.8. Struktur Galaktomanan 18
Gambar 2.9. Beberapa senyawa Antioksidan Sintesis 23 Gambar 2.10. Beberapa senyawa Antioksidan derivat Asam Benzoat 25 Gambar 2.11. Senyawa Antioksidan derivat asam Sinamat 25 Gambar 2.12 Struktur DPPH* sebelum dan sesudah bereaksi dengan
Antioksidan 32
Gambar 2.13. Spektrofotometer Inframerah 34
Gambar 4.1. Spektrum FT-IR Galaktomanan yang diekstraksi dari
Ampas Kelapa 45
Gambar 4.2. Resonansi radikal bebas DPPH 49
Gambar 4.3. Reaksi DPPH* dengan Galaktomanan 51
DAFTAR LAMPIRAN
Nomor Judul Halaman Lampiran 1. Gambar Proses Ekstraksi Galaktomanan dari Ampas Kelapa 60 Lampiran 2. Gambar Uji Aktivitas Antioksidan Galaktomanan dari
Ampas Kelapa 62
Lampiran 3. Spektrum FT-IR Galaktomanan 64
Lampiran 4. Hasil Uji Aktivitas Antioksidan Galaktomanan 65 Lampiran 5. Perhitungan nilai IC50 Galaktomanan 67 Lampiran 6. Grafik % Peredaman Vs Konsentrasi (mg/ mL) 69
PENGUJIAN SIFAT ANTIOKSIDAN GALAKTOMANAN YANG DIEKSTRAKSI DARI AMPAS KELAPA
ABSTRAK
Galaktomanan merupakan senyawa karbohidrat golongan polisakarida telah diisolasi dari ampas kelapa melalui metode ekstraksi dengan menggunakan pelarut etanol dan selanjutnya dilakukan uji aktivitasnya sebagai antioksidan. Sebanyak 130 g ampas kelapa kering diekstraksi dengan menggunakan metode refluks dalam pelarut etanol sebanyak 780 ml pada suhu 500C selama 5 jam. Masing-masing ekstrak galaktomanan yang diperoleh, dimurnikan dengan menggunakan pereaksi Fehling dan diikuti dengan penambahan HCl dan etanol, sentrifugasi dan pengeringan yang kemudian diperoleh galaktomanan murni rata- rata sebanyak 0,33 g (0,0254%). Hasil analisa spektrum FT-IR memberikan spektrum yang menggambarkan pola spektrum senyawa bahwa hasil ekstraksi adalah galaktomanan. Selanjutnya galaktomanan yang diperoleh melalui pengujian aktivitas antioksidan dengan metode DPPH diperoleh nilai IC50 sebesar 8,18 mg/mL
Kata kunci: Galaktomanan, Ekstraksi, Spektroskopi FT-IR, Antioksidan.
THE OF ANTIOXIDANT PROPERTIES GALACTOMANNANS WHICH EXTRACTED FROM DREGS COCONUT
ABSTRACT
Galactomannan is a carbohydrate compound of polysaccharide class that has been isolated from coconut pulp through extraction method using ethanol solvent and furthermore its activity test is carried out as antioxidant. As much as 130 g of dried coconut pulp is extracted by using reflux method in 780 ml ethanol solvent at a temperature of 500C for 5 hours. Each extract galactomannan obtained is purified by using Fehling reagent and followed by the addition of HCl and ethanol, centrifugation and drying of thus pure galactomannan obtained an average of 0.33 g (0.0254%).
Results of FT-IR spectrum analysis provides a spectrum that describes the pattern of compound spectrum that the extraction is galactomannan. Furthermore galactomannan obtained through antioxidant activity testing with DPPH method, IC50 values is obtained at 8.18 mg / mL
Keyword: Galactomannan, Extraction, Spectroscopy FT-IR, Antioxidant.
BAB 1 PENDAHULUAN
1.1. Latar Belakang
Indonesia merupakan negara produsen kelapa utama di dunia. Hampir semua daerah di Indonesia dapat dijumpai tanaman kelapa. Kelapa merupakan salah satu tanaman yang sangat luas penggunaannya, selain untuk memenuhi kebutuhan pangan masyarakat, seperti santan,minyak goreng, gula dan air kelapa segar, kelapa juga dapat digunakan sebagai bahan baku industri. Salah satu contohnya adalah minyak kelapa yang digunakan sebagai bahan industri sabun, obat-obatan, mentega dan lain sebagainya.
Hampir semua bagian dari tanaman kelapa dapat dimanfaatkan. Saat ini banyak sekali industri-industri pengolahan minyak kelapa seperti VCO (Virgin Coconut Oil) yang terbuat dari daging kelapa segar yang diolah pada suhu rendah atau tanpa pemanasan.
Kegiatan industri ini menghasilkan limbah padat, salah satunya adalah ampas kelapa.
Ampas kelapa dapat dimanfaatkan sebagai pakan ternak. Selain dapat digunakan sebagai pakan ternak ampas kelapa juga dapat digunakan sebagai bahan baku untuk memproduksi galaktomannan (Sahfitri, 2006).
Galaktomanan ada dalam endosperm dari sejumlah tumbuhan yang diperoleh dari hasil ekstraksi biji Fenugreek Trigonellafoenum graecum yang merupakan anggota famili Leguminoceae, dan memiliki beberapa fungsi termasuk cadangan karbohidrat (Reid dan Edwards, 1995) Tanaman ini tumbuh di Timur Tengah, Afrika Utara, dan Eropa Selatan. Sementara itu, di India tanaman ini dikenal dengan sebutan Methi.
Methi merupakan tanaman setinggi 30 – 60 cm. Biji tanaman ini sudah dapat dipanen pada umur 3 - 4 bulan dengan produktivitas 600 – 800 kg per hektar. Masyarakat India sudah mengenal tanaman ini sebagai obat sejak 25 abad silam.
Galaktomanan dapat diisolasi dari ampas kelapa limbah pengolahan minyak kelapa murni (VCO) dengan cara ekstraksi menggunakan metanol . Ampas kelapa dicampur metanol di dalam tangki reaktor dengan perbandingan 1:3. Campuran tersebut diaduk selama 2 - 3 jam. Setelah ampas kelapa larut, didiamkan hingga terbentuk endapan
galaktomannan. Kemudian endapan itu dipisahkan dari metanol. Agar menjadi serbuk, endapan dikeringkan dengan freeze dryer (Purawisastra, 2005).
Galaktomannan dapat diisolasi dari ampas kelapa dengan cara ekstraksi menggunakan pelarut metanol . Ampas kelapa dicampur dengan metanol dengan perbandingan 1 : 6. Campuran tersebut diekstraksi selama 5 jam , keadaan pada suhu 500C. Setelah ampas kelapa larut, kemudian disaring dan dimasukkan kedalam labu pisah. didiamkan hingga terbentuk endapan. Endapan dipisahkan dari larutan Kemudian endapan itu dimasukkan kedalam gelas piala dan dibiarkan sampai metanol menguap dan didapatkan hasil sebesar 0,45% (Zultiniar dkk., 2009).
Seperti dikutip Duodecim Medical Publication, Finlandia, galaktomannan direkomendasikan sebagai salah satu obat untuk mengatasi hiperlipidemia atau lebih dikenal dengan kadar lemak darah tinggi. Galaktomannan efektif menangkap lemak dan mengubahnya menjadi gumpalan-gumpalan dan keluar bersama feses.
Galaktomannan mampu menurunkan serum total kolesterol dan Low Density Lipoprotein (LDL) kolesterol 10 – 15%. Sedangkan kadar high density lipoprotein (HDL) dan trigliserida tidak berubah (Syah., 2005)
Dalam bidang medis, galaktomanan juga banyak memiliki manfaat yang sangat baik. Galaktomanan berperan sebagai sumber serat makanan dan memicu pertumbuhan bakteri usus yang membantu pencernaan.
Galaktomanan merupakan senyawa yang berfungsi sebagai salah satu obat bagi penderita diabetes dan dapat mencegah kenaikan kadar kolesterol , LDL dan HDL Kenaikan kadar kolesterol dapat dicegah dengan mengkomsumsi bahan makanan yang mengandung senyawa galaktomanan baik secara langsung maupun tidak langsung.
Hasil penelitian membuktikan bahwa galaktomanan dapat mengurangi 54% kadar gula pada urine penderita diabetes dengan menghidrolisis enzim amilase untuk memperlambat penyerapan gula. Selain itu, galaktomannan juga menurunkan respon insulin terhadap makanan dan memperlambat penyerapan karbohidrat, sehingga kadar glukosa darah tetap dalam keadaan normal. Oleh karena itu , galaktomanan juga sangat berkhasiat bagi penderita diabetes (http://www.indonesia.com, 2009).
Galaktomanan adalah heteropolisakarida yang terdiri dari rantai mannosa dan galaktosa. Galaktomanan adalah polisakarida heterogen yang terbentuk dari rantai utama β-(14)-D-manopiranosa dengan satu unit cabang α - D-galaktopiranosa yang terikat pada posisi ά-(16), meskipun ada beberapa deviasi dari struktur dasar ini. Rasio manosa dan galaktosa (M/G) antara galaktokmanan yang satu dengan yang lainnya berbeda menurut spesies (Kok, et al., 1999). Variasi distribusi galaktosa pada rantai utama menyebabkan variasi kelarutan, sifat alir dan sifat-sifat lainnya.
Menyangkut sifat- sifat fisikokimia yang berbeda , galaktomanan adalah sejenis material yang serba guna yang digunakan untuk banyak aplikasi yaitu sebagai pengental dan stabilizer yang sangat baik dari emulsi, dan karena tidak bersifat toksik memungkinkan pemakaiannya sangat luas dalam industri- industri tekstil, farmasi, biomedis, kosmetik dan makanan (Srivastava dan Kapoor, 2005; Vierra, et al, 2007).
Sebagian besar galaktomanan yang digunakan dalam teknologi farmasi dan kosmetik biasanya merupakan gum yang tidak dimurnikan (Uner dan Altinkurt, 2004).
Dalam industri makanan, galaktomannan biasa digunakan sebagai penggumpal.
Galaktomannnan telah banyak digunakan sebagai pengental, stabilizer emulsi dan zat aditif pada berbagai industri makanan dan obat- obatan (Reid and Edward, 1995;
Mikkonen et al ., 2009). Galaktomannan juga diketahui memiliki sifat antioksidan (Sun et al., 2010.)
Akhir-akhir ini ada peningkatan ketertarikan pada identifikasi sifat-sifat antioksidan produk-produk dari sumber alami untuk dimakan, misalnya pada pengawetan makanan atau makanan kesehatan (Lin and Zhao, 2007; Vargas et al., 2008; Ponce et al., 2008).
Berdasarkan latar belakang diatas, maka peneliti tertarik meneliti galaktomanan yang diekstraksi dari ampas kelapa dengan menggunakan pelarut etanol dan selanjutnya melakukan uji aktivitas sifat antioksidan dari galaktomanan tersebut .
1.2. Permasalahan
Galaktomanan yang telah banyak digunakan sebagai pengental, stabilizer emulsi dan zat aditif pada berbagai industri makanan dan obat- obatan ( Reid and Edwards, 1995;
Mikkonen et al., 2009). Galaktomanan juga diketahui memiliki sifat antioksidan (Sun et al., 2010). Salah satu sumber polisakarida galaktomanan adalah ampas kelapa, dimana pemanfaatan ampas kelapa saat ini masih kurang optimal .
Berdasarkan hal tersebut diatas ingin dilakukan penelitian tentang:
1. Bagaimanakah proses ekstraksi galaktomanan dari ampas kelapa?
2. Bagaimanakah aktivitas sifat antioksidan dari galaktomanan yang diekstraksi dari ampas kelapa?
1.3. Tujuan Penelitian
Penelitian ini bertujuan untuk :
1. Mengisolasi senyawa galaktomanan dari ampas kelapa secara ekstraksi dengan menggunakan pelarut etanol.
2. Menguji aktivitas sifat antioksidan dari senyawa galaktomanan yang diekstraksi dari ampas kelapa dengan metode DPPH (2,2 – diphenyl -1- picryl hydrazyl ).
1.4. Manfaat Penelitian
Manfaat dari penelitian ini adalah :
1. Memberi informasi bahwa ampas kelapa mengandung senyawa galaktomanan yang memiliki manfaat yang sangat berguna bagi kehidupan kita.
2. Memberi informasi mengenai sifat anti oksidan senyawa galaktomanan yang diekstraksi dari ampas kelapa.
1.5. Metodologi Penelitian
Ampas kelapa yang diambil dari Pasar Kampung Lalang dikeringkan dengan cara dijemur tanpa sinar matahari langsung atau dengan cara diangin-anginkan . Kemudian ditumbuk atau dihaluskan dan diayak sesuai ukuran yang diharapkan lalu diekstraksi dengan menggunakan pelarut etanol dan disaring. Filtratnya diuapkan dan kemudian
dilakukan proses pemurnian dengan melarutkannya dengan aquadest dan menambahkan larutan Fehling. Endapannya disentrifugasi dan dipisahkan. Endapan yang terbentuk dicampurkan dengan HCl 5% dalam etanol dan etanol 96% dan disentrifugasi kembali. Setelah dipisahkan , endapan yang terbentuk dikeringkan dengan menambahkan etanol absolut lalu divakum dan dimasukkan ke dalam desikator. Galaktomanan murni yang diperoleh dianalisa dengan FT-IR serta dilakukan pengujian aktivitas antioksidan dengan metode DPPH.
1.6. Lokasi Penelitian
Penelitian ini dilakukan di laboratorium Kimia Organik FMIPA USU Medan, Uji Aktivitas Antioksidan dilakukan di Laboratorium BARISTAND - Medan dan analisa FT-IR produk dilakukan di Laboratorium Kimia Organik FMIPA- UGM Yokyakarta.
BAB 2
TINJAUAN PUSTAKA
2.1. Morfologi Tumbuhan Kelapa (Cocos Nucifera)
Berdasarkan taksonominya, tumbuhan kelapa termasuk dalam ; Divisio : Spermathopyta
Kelas : Monocotyledoneae Ordo : Palmales
Famili : Arecales Genus : Arecaceae Species : Cocos nucifera Nama binominal : Cocos nucifera L Nama : Kelapa.
Nama daerah : Kelopo,kerambil,cikal
Kelapa (Cocos nucifera) adalah satu jenis tumbuhan dari suku aren-arenan atau Arecaceae dan adalah anggota tunggal dalam marga Cocos. Tumbuhan ini dimanfaatkan hampir semua bagiannya oleh manusia sehingga dianggap sebagai tumbuhan serba guna, khususnya bagi masyarakat pesisir. Kelapa juga adalah sebutan untuk buah yang dihasilkan tumbuhan ini . Pohon dengan batang tunggal atau kadang- kadang bercabang. akar serabut, tebal dan berkayu, berkerumun membentuk bonggol, adaptif pada lahan berpasir pantai. Batang beruas-ruas namun bila sudah tua tidak terlalu tampak, khas tipe monokotil dengan pembuluh menyebar (tidak konsentrik), berkayu. Daun tersusun secara majemuk, menyirip sejajar tunggal, pelepah pada ibu tangkai daun pendek, duduk pada batang, warna daun hijau kekuningan. Buah besar, diameter 10 cm sampai 20 cm atau bahkan lebih, berwarna kuning, hijau, atau coklat.
Endospermium berupa cairan yang mengandung banyak enzim, dan fase padatannya mengendap pada dinding endokarp ketika buah menua; embrio kecil dan baru membesar ketika buah siap untuk berkecambah (disebut kentos) . Kelapa secara alami
tumbuh di pantai dan pohonnya mencapai ketinggian 30 m. Ia berasal dari pesisir Samudera Hindia, namun kini telah tersebar di seluruh daerah tropika. Tumbuhan ini dapat tumbuh hingga ketinggian 1000 m dari permukaan laut, namun akan mengalami perlambatan pertumbuhan.
Endosperma buah kelapa yang berupa cairan serta endapannya yang melekat di dinding dalam batok ("daging buah kelapa") adalah sumber penyegar populer. Daging buah muda berwarna putih dan lunak serta biasa disajikan sebagai es kelapa muda atau es degan. Cairan ini mengandung beraneka enzim dan memiliki khasiat penetral racun dan efek penyegar/penenang. Beberapa kelapa bermutasi sehingga endapannya tidak melekat pada dinding batok melainkan tercampur dengan cairan endosperma. Mutasi ini disebut (kelapa) kopyor. Daging buah tua kelapa berwarna putih dan mengeras.
Sarinya diperas dan cairannya dinamakan santan. Daging buah tua ini juga dapat diambil dan dikeringkan serta menjadi komoditi perdagangan bernilai, disebut kopra.
Kopra adalah bahan baku pembuatan minyak kelapa dan turunannya. Cairan buah tua kelapa biasanya tidak menjadi bahan minuman penyegarp dan merupakan limbah industri kopra. Namun demikian dapat dimanfaatkan lagi untuk dibuat menjadi bahan semacam jelly yang disebut nata de coco dan merupakan bahan campuran minuman penyegar. Daging kelapa juga dapat dimanfaatkan sebagai penambah aroma pada daging serta dapat dimanfaatkan sebagai obat rambut yang rontok dan mudah patah.
Keluarga palmae (palem) umumnya tidak bercabang dan mempunyai berkas daun yang berbentuk cincin ( Suhardiman, 1996).
2.2 Karbohidrat
Karbohidrat merupakan senyawa polisakarida yang paling banyak terdapat di alam.
Hampir seluruh tanaman dan hewan mensintesis dan memetabolisme karbohidrat.
Karbohidrat di sintesis dalam tanaman selama fotosintesis. Melalui proses yang kompleks, sinar matahari mengubah CO2 dari udara dan H2O dari dalam tanah (dengan tekanan osmosis diangkut ke hijau daun) menjadi glukosa. Proses ini dinyatakan dalam persamaan reaksi seperti dibawah ini (Riswiyanto, 2009).
6CO2 + 6H2O sinar ultra violet C6H12O6 + 6 O2
klorofil (selulosa, starch)
Di dalam tubuh karbohidrat berguna untuk mencegah pemecahan protein tubuh yang berlebihan, kehilangan mineral dan berguna untuk membantu metabolisme lemak dan protein (Misra, 1997). Sedangkan di dalam tumbuhan, karbohidrat juga mempunyai peranan penting dalam menentukan karakteristik bahan makanan misalnya rasa, warna, tekstur dan lain-lain. Karbohidrat di dalam biji palma pada umumnya adalah polisakarida dalam bentuk galaktomanan ataupun mannan (Haris, 1996).
Pada hewan dan manusia energi tersimpan dalam glikogen dan pada tanaman sebagai pati. Manusia dan binatang menyusui (mamalia) dapat mengubah sukrosa, laktosa (gula susu), maltosa dan pati menjadi glukosa yang kemudian dapat digunakan sebagi energi oleh organisma itu, atau disimpan sebagai glikogen (suatu polisakarida).
Bila organisme itu memerlukan energi , glikogen diubah lagi menjadi glukosa.
Karbohidrat yang berlebihan dapat diubah menjadi lemak (Winarno, 1982).
Kata karbohoidrat timbul karena rumus molekul senyawa ini dapat dinyatakan sebagai hidrat dari karbon. Contohnya glukosa memiliki rumus molekul C6H12O6 yang dapat ditulis sebagai C6(H2O)6 .
Secara biokimia, karbohidrat adalah polihidroksil-aldehida atau polihidroksil-keton, Karbohidrat mengandung gugus fungsi karbonil (sebagai aldehida atau keton) dan banyak gugus hidroksil. Pada awalnya, istilah karbohidrat digunakan untuk golongan senyawa yang mempunyai rumus (CH2O)n, yaitu senyawa-senyawa yang n atom karbonnya tampak terhidrasi oleh n molekul air. Namun demikian, terdapat pula karbohidrat yang tidak memiliki rumus demikian dan ada pula yang mengandung nitrogen, fosforus, atau sulfur. Kimiawi dari karbohidrat pada dasarnya merupakan kimia gabungan dari dua buah gugus fungsi yaitu gugus hidroksil dan gugus karbonil (Hart, 2003).
Karbohidrat dapat digolongkan menurut strukturnya sebagai monosakarida, oligosakarida dan polisakarida (Anna dan Titin, 2006). Istilah sakarida berasal dari
kata Latin (Sakarum = gula) dan merujuk pada rasa manis dari beberapa karbohidrat sederhana. Ketiga golongan karbohidrat itu berkaitan satu dengan lainnya melalui proses hidrolisis.
H2O H2O
Polisakarida Oligosakarida Monosakarida H+ H+ ( Hart, 2003)
2.2.1. Monosakarida
Monosakarida adalah senyawa karbohidrat dalam bentuk gula yang paling sederhana.
Beberapa monosakarida mempunyai rasa manis. Sifat umum dari monosakarida adalah larut air, tidak berwarna, dan berbentuk padat kristal. Contoh dari monosakarida adalah glukosa (dextrosa), fruktosa (levulosa), galactosa, xylosa dan ribosa. Monosakarida merupakan senyawa pembentuk disakarida (seperti sukrosa) dan polisakarida (seperti selulosa dan amilum).
Monosakarida digolongkan berdasarkan jumlah atom karbon yang dikandungnya (triosa, tetrosa, pentosa, heksosa, dan heptosa) dan gugus aktifnya, yang bisa berupa aldehida atau keton. Ini kemudian bergabung, menjadi misalnya aldoheksosa dan ketotriosa. Selanjutnya, tiap atom karbon yang mengikat gugus hidroksil (kecuali pada kedua ujungnya) bersifat optik aktif, sehingga menghasilkan beberapa karbohidrat yang berlainan meskipun struktur dasarnya sama. Sebagai contoh, galaktosa adalah aldoheksosa, namun memiliki sifat yang berbeda dari glukosa karena atom-atomnya disusun berlainan.
Monosakarida merupakan sakarida sederhana yang tidak dapat dihidrolisis menjadi satuan terkecil walaupun dalam suasana yang lunak sekalipun. Monosakarida paling sederhana adalah gliseraldehid atau aldotriosa dan isomerinya adalah dihidroksiaseton atau ketotriosa Kedua senyawa tersebut merupakan suatu triosa karena mengandung tiga atom karbon. Jadi suatu monosakarida, tidak hanya dapat dibedakan berdasarkan gugus-gugus fungsionalnya melainkan juga dari jumlah atom karbonnya.
Monosakarida yang paling banyak ditemukan dalam tubuh organisme adalah monosakarida yang dibangun dengan 6 (enam) atom C yang dikenal sebagai glukosa.
Pada molekul ini terdapat lima gugus hidroksil dan satu gugus aldehid yang terikat pada atom karbon. Glukosa memiliki dua isomer yaitu manosa dan galaktosa, perbedaan antara glukosa dengan manosa terletak pada gugus hidroksi pada atom C nomor 2.
H O H
OH H
OH H
OH 6
H CH2OH
HO
1 3 2
4 5
C OH
H
OH H
H C
C OH
CH2OH HOCH2
C O
α-D- glukosa α-D-fruktosa
C
C
c C
C OH o
H
H
OH OH
H H
CH2OH
h
C C
c C
C OH o
H
H
OH H
OH H
CH2OH
h OH C
α-D-galaktosa α-D- manosa
Gambar 2.1 Struktur ά-D-glukosa, ά-D- fruktosa,ά-D- galaktosa dan ά-D-manosa
Glukosa dengan rumus molekul C6H12O6, adalah monosakarida yang mengandung enam atom karbon. Glukosa merupakan polihidroksi aldehida. Lima karbon dan satu oksigennya membentuk siklik yang disebut cincin piranosa, bentuk siklik ini paling stabil untuk aldosa beratom karbon enam. Dalam cincin piranosa, atom karbon mengikat gugus samping hidroksil dan hidrogen kecuali untuk atom C no.5, yang terikat pada gugus −CH2OH sebagai atom karbon nomor 6. Struktur cincin ini berada dalam kesetimbangan pada pH 7, struktur D-glukosa dalam bentuk cincin piranosa . Selain memiliki isomer, glukosa juga memiliki enansiomer yaitu isomer cermin terhadap dirinya yaitu D-glukosa dan L-glukosa. Namun kenyataannya yang ditemukan pada organisme, hanya yang dalam bentuk D-isomer. Dalam bentuk rantai
lurus kita dapat dengan mudah membedakan Bentuk D atau L konformasi isomer pada karbon nomor 5 atau pada atom C asimetris. Notasi D berasal dari kata Dextro berarti kanan, dan notasi L berarti levo atau kiri, sebagai penanda digunakan gugus hidroksilnya.
Sedangkan pada cincin piranosa juga memiliki dua bentuk yang khas, yaitu posisi dari gugus hidroksil pada atom karbon pertama. Jika gugus hidroksil berposisi di bawah hidrogennya, maka disebut dengan bentuk α (alfa). Demikian pula sebaliknya jika gugus hidroksilnya berposisi di atas hidrogennya, disebut dengan bentuk β (beta).
Glukosa di dalam air akan membentuk keseimbangan dalam dua bentuk, yaitu bentuk α -D–glukosa dan β -D–glukosa, dengan komposisi 36 : 64. Proses perubahan dari α - D–glukosa ke β -D–glukosa atau sebaliknya disebut dengan mutarotasi ( Sastrohamidjojo, 2005)
.
2.2.2. Oligosakarida
Oligosakarida merupakan gabungan dari molekul- molekul monosakarida yang mempunyai 2 – 10 satuan monosakarida meskipun yang penting dan menarik biasanya adalah di- atau tri sakarida.
Disakarida adalah karbohidrat yang tersusun dari 2 molekul monosakarida, yang dihubungkan oleh ikatan glikosida. Ikatan glikosida terbentuk antara atom C 1 suatu monosakarida dengan atom O dari OH monosakarida lain. Hidrolisis 1 mol disakarida akan menghasilkan 2 mol monosakarida. Berikut ini beberapa disakarida yang banyak terdapat di alam.
2.2.2.1. Maltosa
Maltosa adalah suatu disakarida dan merupakan hasil dari hidrolisis parsial tepung (amilum). Maltosa tersusun dari molekul α-D-glukosa dan β-D-glukosa.
H O
HO
H
OH H
OH CH2OH
H
O OH
H H
OH H
OH CH2OH
H
O
Gambar 2.2 Struktur Maltosa (bentuk ß )
(α - D- glukopiranosil – ß-D-glukopiranosil)
Dari struktur maltosa, terlihat bahwa gugus -O- sebagai penghubung antar unit yaitu menghubungkan C 1 dari α-D-glukosa dengan C 4 dari β-D-glukosa. Konfigurasi ikatan glikosida pada maltosa selalu α karena maltosa terhidrolisis oleh α-glukosidase.
Satu molekul maltosa terhidrolisis menjadi dua molekul glukosa (Stanley, 1998).
2.2.2.2. Sukrosa
Sukrosa terdapat dalam gula tebu dan gula bit. Dalam kehidupan sehari-hari sukrosa dikenal dengan gula pasir. Sukrosa tersusun oleh molekul glukosa dan fruktosa yang dihubungkan oleh ikatan 1,2–α. Sukrosa terhidrolisis oleh enzim invertase menghasilkan α-D-glukosa dan β-D-fruktosa. Campuran gula ini disebut gula inversi, lebih manis daripada sukrosa.
O
OH CH2OH
HO
O
CH2OH HO O
HOCH2
HO
HO
Gambar 2.3.Struktur Sukrosa ( α-D-glukopiranosil-ß-D- fruktofuranosida)
Jika kita perhatikan strukturnya, karbon anomerik (karbon karbonil dalam monosakarida) dari glukosa maupun fruktosa di dalam air tidak digunakan untuk berikatan sehingga keduanya tidak memiliki gugus hemiasetal. Akibatnya, sukrosa dalam air tidak berada dalam kesetimbangan dengan bentuk aldehid atau keton sehingga sukrosa tidak dapat dioksidasi. Sukrosa bukan merupakan gula pereduksi (Fessenden, 1986).
2.2.2.3. Laktosa
Laktosa adalah komponen utama yang terdapat pada air susu ibu dan susu sapi.
Laktosa tersusun dari molekul β-D-galaktosa dan α-D-glukosa yang dihubungkan oleh ikatan 1,4′-β. Hidrolisis dari laktosa dengan bantuan enzim galaktase yang dihasilkan dari pencernaan, akan memberikan jumlah ekivalen yang sama dari α-D-glukosa dan β-D-galaktosa. Apabila enzim ini kurang atau terganggu, bayi tidak dapat mencernakan susu. Keadaan ini dikenal dengan penyakit galaktosemia yang biasa menyerang bayi ( Anna dan Titin, 2006).
Oligosakarida merupakan gabungan dari molekul-molekul monosakarida yang jumlahnya antara 2 (dua) sampai dengan 10 (sepuluh) molekul monosakarida.
Sehingga oligosakarida dapat berupa disakarida, trisakarida dan lainnya. Oligosakarida secara eksperimen banyak dihasilkan dari proses hidrolisa polisakarida dan hanya beberapa oligosakarida yang secara alami terdapat di alam. Oligosakarida yang paling banyak digunakan dan terdapat di alam adalah bentuk disakarida seperti maltosa, laktosa dan sukrosa. Molekul disakarida yang disusun oleh dua molekul monosakarida yang dihubungkan oleh ikatan glikosida.
HO O
H
O
H
OH H
OH CH2OH
H
O
OH OH
CH2 OH
OH
Gambar 2.4. Struktur Laktosa (ß- D-galaktopiranosil -α-D- glukopiranosa)
Ikatan glikosida terjadi dari kondensasi gugus hidroksil dua molekul monosakarida, yaitu berasal dari gugus hidroksil dari atom karbon yang pertama dengan salah satu gugus hidroksil pada atom karbon nomor 2, 4, atau 6, yang berasal dari monosakarida yang kedua.Kita ambil contoh bagaimana sebuah α–D–Glukosa dan β–D–Glukosa membentuk disakarida. Pada struktur laktosa terdapat ikatan glikosida antara atom karbon nomor 1 dari α- D-glukosa dan atom karbon nomor 4 dari β-D-glukosa lain.
Disakarida yang banyak terdapat di alam seperti maltosa yang terbentuk dari 2 molekul glukosa melalui ikatan glikosida. Pada maltosa, jembatan oksigen terbentuk antara atom karbon nomor 1 dari D-glukosa dan atom karbon nomor 4 dari D-glukosa lain. Ikatan yang terbentuk dinamakan ikatan α (1→4) glikosida, secara lengkap
dinyatakan dengan β-D-glukopiranosil (1→4) -D-glukopiranosa. Dalam bentuk sederhana Glc(α1↔4β)Glc, m altosa diperoleh dari hasil hidrolisa pati dan banyak dimanfaatkan sebagai pemanis.
Sukrosa (gula pasir) terbentuk dari satu molekul α-D-glukosa dan β-D-fruktosa, yaitu β-D-fruktofuranosil (2→1) α -D-glukopiranosa atau fru(α2↔1β)Glc. Sukrosa biasa diperoleh di alam sebagai gula tebu dan gula bit. Khususnya pada ekstrak gula dari bit, sukrosa tidak murni melainkan bercampur dengan oligosakarida yang lain seperti rafinosa dan stakiosa.
Monosakarida dan oligosakarida serta poli alkohol lainnya umumnya memiliki rasa manis. Sukrosa memiliki rasa manis dan terasa nyaman di lidah kita, walaupun
memiliki rasa manis dan pahit. Sedangkan gentiobiosa memiliki rasa pahit. Bahan untuk pemanis yang sering digunakan oleh industri adalah sukrosa, starch syrup (campuran glukosa, maltosa dan malto oligosakarida), glukosa, gula invert, fruktosa, laktosa dan gula alkohol (sorbitol, mannitol, xylitol) (Anna dan Titin, 2006)
2.2.3. Polisakarida
Polisakarida merupakan polimer monosakarida, mengandung banyak satuan monosakarida yang dihubungkan oleh ikatan glikosida. Polisakarida atau karbohidrat kompleks merupakan karbohidrat yang terbentuk oleh hampir lebih dari 20.000 unit molekul monosakarida terutama glukosa (Riswiyanto, 2009). Di dalam ilmu gizi jenis karbohidrat kompleks merupakan sumber utama bahan makanan yang umum dikomsumsi oleh manusia adalah pati (starch). Hidrolisis lengkap dari polisakarida akan menghasilkan monosakarida. Glikogen dan amilum merupakan polimer glukosa.
Berikut beberapa polisakarida terpenting.
2.2.3.1. Selulosa
Selulosa merupakan polisakarida yang banyak dijumpai dalam dinding sel pelindung seperti batang, dahan, daun dari tumbuh-tumbuhan. Selulosa merupakan polimer yang berantai panjang dan tidak bercabang. Suatu molekul tunggal selulosa merupakan polimer rantai lurus dari 1,4 -β-D-glukosa. Hidrolisis selulosa dalam HCl 4% dalam air menghasilkan D-glukosa.
O
O
O
OH OH
CH2OH
O O
OH OH
H2COH
O
OH OH
H2COH
Gambar 2.5. Struktur molekul Selulosa
Dalam sistem pencernaan manusia terdapat enzim yang dapat memecahkan ikatan α- glikosida, tetapi tidak terdapat enzim untuk memecahkan ikatan β-glikosida yang terdapat dalam selulosa sehingga manusia tidak dapat mencerna selulosa. Dalam sistem pencernaan hewan herbivora terdapat beberapa bakteri yang memiliki enzim β- glikosida sehingga hewan jenis ini dapat menghidrolisis selulosa. Contoh hewan yang memiliki bakteri tersebut adalah rayap, sehingga dapat menjadikan kayu sebagai makanan utamanya. Selulosa sering digunakan dalam pembuatan plastik. Selulosa nitrat digunakan sebagai bahan peledak, campurannya dengan kamper menghasilkan lapisan film (seluloid).
2.2.3.2 Pati
Pati terbentuk lebih dari 500 molekul monosakarida. Merupakan polimer dari glukosa.
Pati terdapat dalam umbi-umbian sebagai cadangan makanan pada tumbuhan. Pati merupakan polisakarida paling melimpah kedua. Pati dapat dipisahkan menjadi dua fraksi utama berdasarkan kelarutan bila dibubur (triturasi) dengan air panas: sekitar 20% pati adalah amilosa (larut) dan 80% sisanya ialah
amilopektin (tidak larut).
Hidrolisa lengkap amilosa menghasilkan hanya D- glukosa , hidrolisis parsial menghasilkan maltosa sebagai satu-satunya disakarida. Amilosa adalah polimer linier dari α- D- glukosa yang dihubungkan secara -1,4’ . Beda antara amilosa dan selulosa ialah ikatan glikosidanya , ß dalam selulosa dan α dalam amilosa. Perbedaan ini menyebabkan perbedaan sifat antara kedua polisakarida ini.
O
OH OH CH2OH
OH OH ch2oh
O O
o
O
OH OH CH2OH
OH OH CH2
O O
O OH OH CH2OH
Gambar 2.6. Struktur amilosa Gambar 2.7. Struktur amilopektin
Perbedaan terletak pada molekul amilopektin lebih besar dari amilosa. Strukturnya bercabang. Rantai utama mengandung α-D-glukosa yang dihubungkan oleh ikatan 1,4′-α. Tiap molekul glukosa pada titik percabangan dihubungkan oleh ikatan 1,6′ -α .Hidrolisis lengkap pati akan menghasilkan D-glukosa. Hidrolisis dengan enzim tertentu akan menghasilkan dextrin dan maltosa.bentuk rantai dan jumlah monomernya.
Amilosa adalah polimer linier dari α-D-glukosa yang dihubungkan dengan ikatan 1,4-α. Dalam satu molekul amilosa terdapat 250 satuan glukosa atau lebih. Amilosa membentuk senyawa kompleks berwarna biru dengan iodium. Warna ini merupakan uji untuk mengidentifikasi adanya pati. Komposisi kandungan amilosa dan amilopektin akan bervariasi dalam produk pangan yang memiliki kandungan amilopektin tinggi akan semakin mudah dicerna ( Almatsier, 2003).
2.3 Galaktomanan dan Kegunaannya
O H
HO
H HO
H
O H OH OH
O O
OH
H H H
H2C
O HO
H
OH O HO
O HO
H
O
CH2OH OH
OHO
H H HOH2C
HO
O O
Galaktosa
Manosa
Manosa
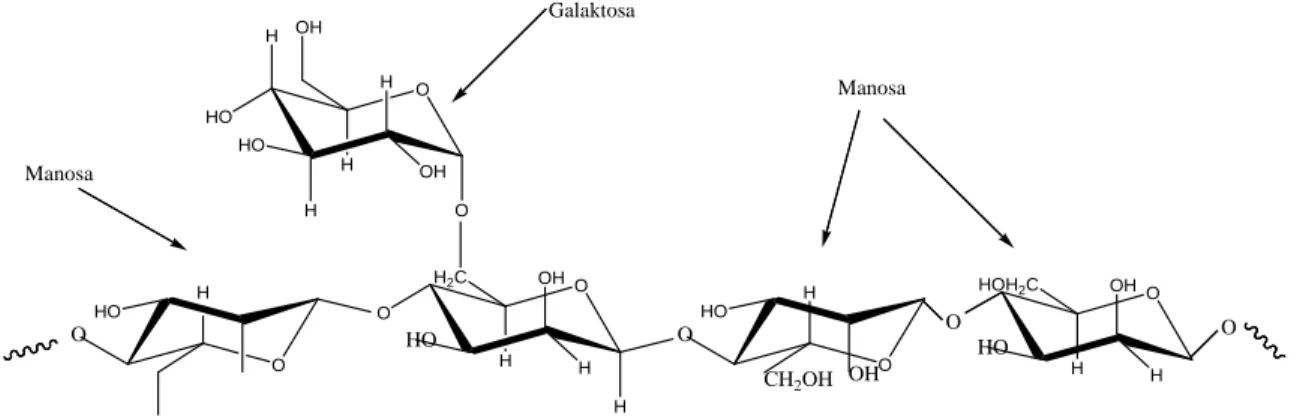
Gambar 2.8. Struktur Galaktomanan
Kebanyakan tumbuh-tumbuhan memiliki cadangan polisakarida yang secara biologis tidak memiliki fungsi apapun terkecuali sebagai sumber karbon untuk bertumbuh.
Tumbuhan dari famili Poaceae seperti misalnya gandum, padi, maize dan lainnya memiliki cadangan polisakarida. Galaktomanan merupakan cadangan karbohidrat serta mengatur banyaknya air didalam biji selama proses perkecambahan. Didalam biji yang terbungkus lapisan tipis endosperma, galaktomanan juga memiliki fungsi mekanis yakni untuk melindungi kecambah (Scherbukhin and Anulov, 1999).
Tumbuhan lainnya dari keluarga legume memiliki cadangan polisakarida dalam bentuk galaktomanan. Hasil penelitian sebelumnya menunjukkan dari 163 spesies tumbuhan dari keluarga legume ini, 119 diantaranya menyimpan sebagai cadangan polisakaridanya dalam bentuk galaktomanan (Mathur, 2012). Galaktomanan ini memiliki selain sebagai cadangan makanan juga berfungsi menyimpan air untuk mencegah kekeringan pada tumbuhan (Srivastava and Kapoor, 2005).
Senyawa galaktomanan dalam ilmu gizi merupakan serat makanan (dietary fiber) yang mampu menurunkan kadar glukosa dan kolestrol darah. Galaktomanan ini secara alami terkandung dalam beberapa jenis tanaman untuk bisa dimanfaatkan ,
galaktomanan perlu dilakukan suatu proses pemisahan dari senyawa lain yang terkandung dalam tanaman tersebut.
Galaktomanan adalah suatu heteropolisakarida yang memiliki berat molekul 1660 kDa (Egorov et al , 2003). Galaktomanan merupakan polisakarida heterogen yang terdiri dari rantai utama ß-(14)-D-manopiranosa dengan satu unit cabang α-D- galaktopiranosa yang terikat pada posisi α-(1-6). Galaktomanan dari masing-masing tanaman berbeda-beda pada rasio manosa dan galaktosa, distribusi galaktosa pada rantai manosa dan berat molekulnya.
Rasio manosa dan galaktosa bergantung pada sumber galaktomanan tersebut dan umumnya berkisar pada 1,1 – 5,0 . Galaktomanan dengan kandungan galaktosa yang besar umumnya mudah larut dalam air dan kecenderungannya untuk membentuk gel sangat rendah dibandingkan galaktomanan dengan rasio galaktosa yang rendah.
Kelarutan yang sangat tinggi tersebut disebabkan oleh banyaknya rantai cabang sehingga rantai manosa menjadi sukar untuk berinteraksi secara intermolekuler (Srivastava and Kapoor, 2005).
Tingkat kekentalan galaktomanan bila dilarutkan dalam air sangat tergantung pada ukuran molekulnya dan bila ditambahkan polisakarida lainnya seperti xantan maka akan terbentuk gel (Morris et al, 1977). Kelebihan utama dari galaktoman ini bila dibandingkan dengan polisakarida lainnya adalah kemampuannya untuk membentuk larutan yang sangat kental dalam konsentrasi yang rendah dan hanya sedikit dipengaruhi oleh pH, kekuatan ionik dan pemanasan. Viskositas galaktomanan sangat konstan sekali pada kisaran pH 1 – 10,5 yang kemungkinan disebabkan oleh karakter molekulnya yang bersifat netral. Namun demikian apabila galaktoman akan mengalami degradasi pada kondisis yang sangat asam atau basa pada suhu tinggi.
Sifat fisikokimia galaktomanan dapat dikarakterisasi dengan menggunakan beberapa peralatan dan teknik yang berbeda. Parameter- parameter yang penting dalam karakterisasi galaktomanan adalah perbandingan manosa dan galaktosa, rata-rata berat molekul, bentuk struktur dan viskositas intrinsiknya. Rasio manosa dan galaktosa dapat ditentukan dengan menggunakan kromatografi gas atau dengan kromatografi
pertukaran anion tekanan tinggi setelah terlebih dahulu dihidolisis dengan menggunakan asam. Berat molekulnya dapat ditentukan dengan menggunakan size exclusion chromatography sedangkan distribusi galaktosa pada rantai manan-nya dapat dikarakterisasi dengan menggunakan 13C-NMR atau dengan menggunakan metode enzimatis dengan enzim ß-D-mannanase yang akan mendegradasi galaktomanan secara spesifik. Viskositas intrinsik dapat ditentukan dengan menggunakn viskometer kapiler dan persamaan Huggins & Kramer’s untuk menentukan viskositasnya (Cerqueira et al., 2009).
2.4. Antioksidan
Senyawa antioksidan saat ini bermanfaat untuk berbagai bidang, seperti dalam bidang pangan, industri tekstil, minyak bumi, bahan pewarna dan lain-lain. Riset tentang perkembangan senyawa berkhasiat antioksidan telah banyak dikembangkan baik senyawa alam maupun senyawa sintesis. Senyawa antioksidan adalah senyawa yang berperan untuk menghambat proses autooksidasi dalam minyak atau lemak (Ketaren, 1986).
Defenisi antioksidan secara umum adalah senyawa atau molekul yang dapat memperlambat atau mencegah terjadinya proses oksidasi yang disebabkan oleh radikal bebas. Selain itu antioksidan juga dapat menetralisir radikal bebas sehingga atom dengan elektron yang tidak berpasangan mendapat pasangan elektron sehingga tidak reaktif lagi (Kosasih et al, 2004).
Radikal bebas merupakan atom atau molekul yang sangat reaktif yang mempunyai satu atau lebih elektron yang tidak berpasangan di orbit luarnya. Radikal bebas dapat timbul dari proses metabolisme dalam tubuh dan dapat juga berasal dari lingkungannya seperti pencemaran udara , bahan kimia dari makanan dan air, alkohol, rokok, radiasi UV dan sebagainya (Dalimartha dan Soedibyo, 1998).
Radikal bebas ini bersifat reaktif dan tidak stabil sehingga untuk mencapai kestabilan atom atau molekul radikal bebas akan bereaksi dengan molekul sel tubuh dengan cara mengikat elektron molekul tersebut. Proses ini pada akhirnya akan menimbulkan radikal bebas baru terhadap molekul elektronnya diambil sehingga
jumlahnya terus bertambah. Oleh karena itu, reaksi radikal bebas cenderung berupa reaksi berantai. Reaksi ini akan terus menerus berlangsung dalam tubuh dan bila tidak segera dicegah dapat menimbulkan berbagai penyakit seperti kanker, jantung, katarak, penuaan dini serta penyakit degeneratif lainnya. Untuk mengantisipasi kerusakan akibat radikal bebas tersebut maka tubuh suatu substansi penting yaitu antioksidan yang mampu menangkap radikal bebas .
Ketika radikal bebas menempel pada molekul yang berpasangan, yang dilakukannya hanyalah merusak DNA sel- sel molekul tersebut untuk membentuk keseimbangan elektron agar proses metabolisme tubuh berjalan normal. Tetapi ketika dua radikal bebas yang mencari pasangan bertemu, mereka akan menciptakan hubungan yang stabil (Siagian, 2012).
Tubuh manusia sebenarnya dapat menghasilkan antioksidan termasuk superoksid dismutase, katalase, dan glutation tetapi jika terjadi paparan oksidan yang berlebihan , antioksidan tubuh ini tidak akan mampu mengatasinya serta jumlahnya tidak mencukupi untuk menetralkan radikal bebas yang jumlahnya semakin menumpuk di dalam tubuh. Oleh karena itu, tubuh memerlukan antioksidan dari luar berupa makanan atau suplemen (Sibuea, 1971; Nordmann, 1993).
Antioksidan tubuh dikelompokkan menjadi tiga, yaitu : 1. Antioksidan primer
Berfungsi untuk mencegah pembentukan senyawa radikal bebas baru. Antioksidan primer mengubah radikal bebas yang ada menjadi molekul yang berkurang dampak negatifnya sebelum radikal bebas ini sempat bereaksi, contoh : enzim SOD yang berfungsi sebagai pelindung hancurnya sel- sel dalam tubuh serta mencegah proses peradangan karena radikal bebas. Enzim SOD sebenarnya sudah ada dalam tubuh kita.
Namun bekerjanya membutuhkan bantuan zat- zat gizi mineral seperti mangan, seng dan tembaga. Selenium juga berperan sebagai antioksidan. Jadi jika ingin menghambat gejala dan penyakit degeneratif, mineral- mineral tersebut hendaknya tersedia cukup dalam makanan yang dikomsumsi tiap hari.
2. Antioksidan sekunder
Berfungsi menangkap senyawa serta mencegah terjadinya reaksi berantai, contoh Vitamin E, Vitamin C, beta karoten, asam urat, bilirubin dan albumin.
3. Antioksidan tersier
Berfungsi memperbaiki kerusakan sel – sel dan jaringan yang disebabkan radikal bebas. Contoh : enzim yang memperbaiki DNA pada inti sel adalah metionin sulfoksidan reduktase. Adanya enzim- enzim perbaikan DNA ini berguna untuk mencegah penyakit kanker. Untuk mencegah atau memperlambat kerusakan oksidatif makanan, antioksidan banyak digunakan sebagai aditif dalam lemak dan minyak dan dalam pengolahan makanan.
Jenis antioksidan yang dapat digunakan antara lain : antioksidan sintetis dan antioksidan alami (Ensofas, 2010).
2.4.1. Antioksidan Sintesis
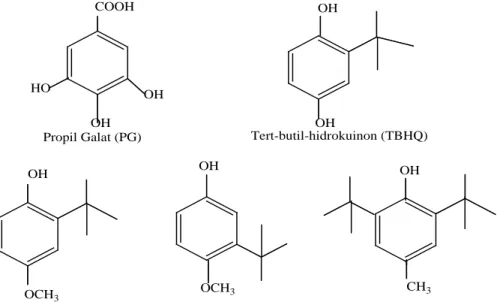
Beberapa antioksidan sintesis lebih populer digunakan adalah senyawa fenolik seperti butylated hydroxyanisol, (BHA) butylatead hidroksi-toluen (BHT), tersier Butylhydroquinon (TBHQ), dan ester dari asam galat, misalnya propil galat (PG).
Antioksidan fenolik sintesis selalu diganti dengan alkil untuk meningkatkan kelarutannya dalam lemak dan minyak. Keempat antioksidan sintesis pada prakteknya digunakan pada batas 0,02% kandungan lemak atau minyak dari makanan.
OH HO OH
COOH OH
OH
Propil Galat (PG) Tert-butil-hidrokuinon (TBHQ)
OH
OCH3
OH
OCH3
OH
4-metoksi-2-tert butil- fenol (2-BHA)
4-metoksi-3-tert butil fenol
(3-BHA) 2,6-di-tert-butil-p-hidroksi toluena (BHT)
CH3
Gambar 2.9. Beberapa Senyawa Antioksidan Sintesis
Antioksidan yang paling cocok untuk minyak nabati adalah TBHQ, BHA dan BHT cukup stabil terhadap panas dan sering digunakan untuyk stabilisasi lemak dalam produk gorengan dan panggang. Kelemahan galat terletak pada kecenderungan untuk membentuk endapan gelap dengan ion besi dan sensitivitas panas. Beberapa antioksidan seperti BHA dan BHT digunakan secara kombinasi akan dapat bersinergi demikian juga BHA sinergis dengan PG.
Antioksidan sintesis sudah sangat benar diuji untuk perilaku toksikologinya, tetapi beberapa dari perilakunya setelah lama penggunaan, dibawah tekanan berat sebagai data toksikologi baru yang memaksakan beberapa penggunaan yang hati- hati. Dalam konteks ini, produk antioksidan alami muncul sebagai antioksidan yang sehat dan lebih aman daripada sintesis. Sejak sekitar tahun 1980 antioksidan alami telah muncul sebagai alternatif antioksidan sintesis (Pokorny, 2001).
2.4.2. Antioksidan Alami
Penggunaan senyawa alami sebagai antioksidan sudah sangat lama. Hal ini meliputi pengasapan dan pembumbuan untuk pengawetan daging, ikan, dan makanan lain yang kaya lemak. Perlakuan tersebut diakui dapat memberi efek penghambat tengik.
Buah-buahan segar , beberapa jenis sayuran, tumbuhan biji-bijian dan rempah- rempah merupakan sumber anti oksidan alami yang telah diketahui berpotensi mengurangi resiko penyakit kronis termasuk penyakit hati dan beberapa jenis kanker (Dalimarta dan Soedibyo, 1998).
Hal ini tidak lazim untuk mencoba mendefenisikan antioksidan alami dapat mempengaruhi zat yang terbentuk sebagai konsekuensi dari memasak atau pengolahan bahan nabati atau hewania untuk makanan. Antioksidan alami hampir ditemukan pada semua mikroorganisme, jamur dan bahkan di jaringan hewan dan tumbuhan ini sebagian besar adalah senyawa fenolik dan yang merupakan beberapa dari kelompok antioksidan alami adalah flavonoid, asam fenolik dan minyak atsiri.
Flavonoid merupakan kelompok besar fenolat yang terdapat dalam tanaman yang dicirikan dengan rangka karbon C6-C5-C6. Dasar struktur dari senyawa ini terdiri dari dua cincin aromatik dihubungkan oleh tiga karbon rantai alifatik yang biasanya telah terkondensasi untuk membentuk piran atau cincin furan. Kemampuan flavonoid menghambat oksidasi lipida didokumentasikan dengan baik untuk produk lipida alami.
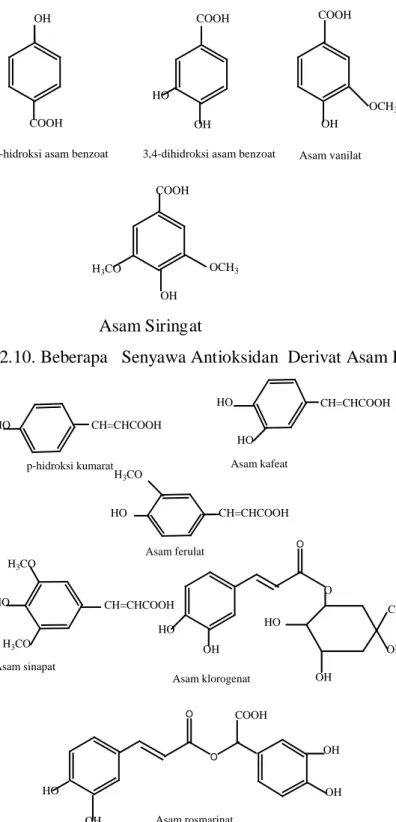
Flavonoid dapat bertindak sebagai antioksidan dengan peredaman radikal yang mencakup superoksida anion, radikal lipida peroksil dan radikal hidroksil. Mekanisme lain dari flavonoid yang dipilih meliputi pendinginan singlet oksigen, logam khelasi serta penghambatan lipoksigenase. Asam fenolik seperti p-hidroksibenzoat, 3,4- dihidroksibenzoat, vanilat, siringat, p-kumarat, kafeat, ferulat, sinapat, klorogenat dan asam rosmarinat tersebar luas di pabrik. Asam ini biasanya ada sebagai ester dari asam organik atau glikosida. Turunan- turunan asam sinamat merupakan antioksidan lebih aktif daripada turunana asam benzoat.
OH
COOH OH
COOH
HO
COOH
OH
OCH3
p-hidroksi asam benzoat 3,4-dihidroksi asam benzoat Asam vanilat
COOH
OH
OCH3 H3CO
Asam Siringat
Gambar 2.10. Beberapa Senyawa Antioksidan Derivat Asam Benzoat
HO CH=CHCOOH
HO H3CO
CH=CHCOOH HO
HO
CH=CHCOOH
Asam kafeat p-hidroksi kumarat
Asam ferulat
HO H3CO
H3CO
CH=CHCOOH
O
O
HO OH
COOH
OH HO
OH Asam sinapat
Asam klorogenat
O O
HO OH
COOH
OH
OH Asam rosmarinat
Gambar 2.11. Senyawa Antioksidan derivat Asam Sinamat
Efektivitas menghambat radikal dari monofenol meningkat secara substansial oleh satu atau dua substitusi metoksi. Kombinasi dari dua fenol asam akan meningkatkan efisiensi, misalnya asam rosmarinat adalah antioksidan yang lebih baik dari asam kafeat. Esterifikasi asam kafeat dengan bagian gula akan dapat menurunkan aktivitas molekulnya, misalnya asam klorogenat kurang efektif daripada asam kafeat (Pokorny, 2001).
Antioksidan alami pada umumnya lebih disukai oleh konsumen, dan dapat dengan mudah memperoleh persetujuan legislatif daripada bahan aditif sintetis. Namun fakta bahwa antioksidan alami ini umumnya jika terdapat dalam makanan adalah sepenuhnya nontoksik. Antioksidan sintesis diuji untuk karsinogenik atau efek mutagenik tetapi banyak senyawa bahan alami belum pernah diuji. Adapun keuntungan dan kerugian dari antioksidan sintetik dan alami dirangkum dalam tabel .
Tabel 2.1. Keuntungan dan Kerugian dari Antioksidan Sintetis dan Alami
Antioksidan Sintesis Antioksidan Alami
Banyak diterapkan Kegunaan terbatas pada beberapa produk Mencegah aktivitas antioksidan tinggi Aktivitas antioksidan dengan rentang
yang luas
Dianggap sebagai zat yang berbahaya Meningkatkan soal keselamatan Penggunaan dilarang untuk beberapa
jenis
Meningkatkan dan memperluas penggunaan aplikasi
Kelarutan rendah dalam air Jangkauan kelarutan luas Menurunkan keuntungan Menaikkan keuntungan
Tidak ada argumen ilmiah atau teknis rasional dapat diberikan untuk antioksidan alami. Antioksidan alami lebih diterima oleh konsumen terutama berdasarkan alasan emosional. Kebanyakan antioksidan yang umumnya ditambahkan pada makanan (misalnya propil galat, flavonoid, tokofenol-α, asam karnosat, karnosol, katekin, vitamin C) merupakan yang mampu menstimulasi radikal bebas, kerusakan pada klomponen non lipid, karbohidrat dan DNA dalam makanan. Namun manfaat menggunakan antioksidan lebih besar daripada resiko. Tanpa antioksidan dalam makanan yang terbentuk dapat menyebabkan resiko yang lebih besar untuk kesehatan (Pokorny, 2001). Bahan- bahan alami yang kaya akan antioksidan dapat diperoleh dengan ekstraksi. Antioksidan alami lainnya yang juga telah mulai banyak diteliti adalah polisakarida.
Beberapa peneliti telah menemukan bahwa ternyata polisakarida dari tumbuh- tumbuhan memiliki sifat antioksidan yang sangat kuat (Wang and Luo, 2007; Yang et al, 2006).
Tabel 2.2. Aktivitas Antioksidan Polisakarida dari Beberapa Tumbuh- tumbuhan
Nama Tumbuhan (Latin) Scavenging Activity (%)
Referensi
Grifola frondosa 79,6 Chen, et al., 2012
Agaricus bisporus 86,1` Tian, et al., 2012
Lentinus edodes 90,6 Chen, et al., 2012
Carica Papaya 78,5 Zhang, et al., 2012
Ssaussurea invoclurate 88,7 Yao, et al., 2012
Houttuynia cordata 87,2 Tian, et al., 2011
Medicago sdativa L 74,5 Liu, et al., 2010
Turbinaria ornata (Marine Brown Alga) 80,21 Ananthi, et al., 2010
Turbinaria cornoides 90 Chattopadhyay,et al.,2010
Brevibacterium otitidis BTS 44 91,5 Asker and Shawky, 2010
Hyriopsis cumingii 81,28 Qiao, et al., 2009
Salvya officinalis L 90 Capek, et al., 2009
Ecklonia cava 70,1 Athukorala, et al., 2006
Litchi chinensis sonn 54,1 Yang, et al., 2006
Polisakarida yang diekstraksi dari buah pepaya telah diteliti memiliki sifat antioksidan yang cukup baik dalam menghambat radikal superoksida, hidroksil dan DPPH*
polisakarida yang larut dalam air dari buah wolfberry (Lycium barbarum L), sweet cherry (Prunus avium L.), kiwi (Actinidia chinensis L.) dan cranberry (Vaccinium macrocarpon Aiton). Polisakarida dari keempat jenis buah- buahan tersebut diperoleh dari ekstraksi dengan menggunakan air panas yang kemudian difraksinasi dengan menggunakan kromatografi kolom penukar ion dan dikarakterisasi berat molekunya dengan High Performance Size Exclusion Chromatography (HPSEC). Dari keempat jenis buah- buahan tersebut masing- masing diperoleh 4 fraksi polisakarida yang berbeda berat molekulnya dimana fraksi polisakarida dari buah sweet cherries diketahui memiliki berat molekul yang lebih tinggi dibandingkan yang lainnya. Hasil uji aktivitas antioksidan memperlihatkan polisakarida dari keempat jenis buah- buahan ini memiliki sifat antioksida, dimana polisakarida dari buah sweet cherry yang paling tinggi sifat antioksidannya.Tumbuhan Magnolia officinalis yang banyak digunakan dalam ramuan herbal pengobatan tradisional China juga telah diteliti memiliki sifat antioksidan dan anti tumor.
Hasil penelitian memperlihatkan ternyata berat molekul dari polisakarida mempengaruhi kemampuan penghambatan pembentukan radikal bebas dimana fraksi menemukan bahwa polisakarida terasetilasi memperlihatkan aktivitas antioksidan yang lebih tinggi dibandingkan polisakarida yang mengandung gugus sulfat. Oleh karena itu beliau menyatakan bahwa aktivitas antioksidan polisakarida berasal dari kemampuannnya memberikan atom hidrogen. Gugus asetil yang tersubstitusi pada atom C2 atau C3 dapat mengaktivasi atom hidrogen yang terikat pada atom karbon anomer. Wang et al., (2010) meneliti pengaruh adanya gugus sulfat yang disubstitusi pada senyawa galaktomanan dari guar gum terhadap sifat antioksidannya. Peneliti tersebut memperlihatkan bahwa gugus –OSO3H yang banyak terikat pada atom C6 dan dapat mengaktivasi atom hidrogen pada anomer sehingga menjadi mudah lepas untuk kemudian dapat menetralkan tersulfasi memiliki aktivitas antioksidan yang jauh lebih baik dari galaktomanan.
2.5. Pengujian Antioksidan