1
SINTESIS DAN KARAKTERISASI SENYAWA KOMPLEKS DARI PERAK NITRAT DENGAN LIGAN CAMPURAN
TIOUREA DAN TRIFENILSTIBINA
M. Faqihuddin Zaky, Fariati, Effendy
Jurusan Kimia, FMIPA, Universitas Negeri Malang Jalan Semarang 5, Malang 65145
Email: mf.zaky@yahoo.com
ABSTRAK: Senyawa kompleks dari perak nitrat dengan ligan campuran tiourea (tu) dan trifenilstibina (SbPh3) telah disintesis. Senyawa kompleks diperoleh melalui pembentukan [Ag(µ-S-tu)](∞|∞)NO3, diikuti reaksinya dengan SbPh3. Pengukuran titik lebur menunjukkan bahwa senyawa hasil sintesis merupakan senyawa baru. Analisis EDX memberikan prediksi rumus empiris C55H49AgN3O3SSb3. Hasil uji daya hantar listrik dan uji kualitatif ion nitrat menunjukkan bahwa senyawa hasil sintesis adalah senyawa molekuler yang mengandung AgNO3, tu, and SbPh3. Senyawa yang diperoleh merupakan senyawa kompleks dengan rumus kimia [(Ph3Sb)3Ag(tu)(NO3)].
Perhitungan menggunakan HyperChem 8.0.3 menunjukkan bahwa senyawa kompleks memiliki energi bebas sebesar 136.367,58 kkal/mol. Geometri dari kompleks [(Ph3Sb)3Ag(tu)(NO3)] di sekitar atom pusatnya adalah trigonal bipiramidal ter- distorsi.
Kata kunci: sintesis, kompleks perak nitrat, tiourea, trifenilstibina, ligan campuran.
ABSTRACT: Adduct of silver nitrate with thiourea (tu) and triphenylstibine (SbPh3) mixed ligands has been synthesized. The adduct is obtained by forming of [Ag(µ-S- tu)](∞|∞)NO3, followed by its reaction with SbPh3. Measurement of melting point shows that the synthesized compound is a new one. The EDX analysis gives the empirical formula of C55H49AgN3O3SSb3. The result of electrical conductivity measurement and qualitative test of nitrate ion show that adduct is a molecular compound containing AgNO3, tu, and SbPh3. The adduct is a coordination compound with formula of [(Ph3Sb)3Ag(tu)(NO3)]. Calculation using HyperChem 8.0.3 shows that the coordination compound has 136.367,58 kkal/mol of free energy. Geometry of [(Ph3Sb)3Ag(tu)(NO3)] about its central atom is distorted trigonal bipyramidal.
Keywords: synthesis, silver nitrate complex, thiourea, triphenylstibine, mixed ligand.
Perak nitrat telah dilaporkan dapat membentuk senyawa kompleks dengan ligan tu (Ahmad dkk., 2002:782-785; Bowmaker dkk., 2009:3185-3197) dan ligan SbPh3 (Effendy dkk., 1997:587-604; Effendy dkk., 1997:671-674; Bowmaker dkk., 1997:539-552), namun senyawa kompleks dari perak nitrat dengan ligan campuran tu dan SbPh3 belum pernah disintesis. Senyawa kompleks yang telah disintesis adalah kompleks dari perak nitrat dengan ligan campuran tu dan PPh3 pada stoikiometri 1:1:1 (Isab dkk., 2010:1251-1256). Senyawa Kompleks yang dihasilkan adalah {[Ag(PPh3)(μ-tu)]2(NO3)2.[Ag(PPh3)(μ-tu)(NO3)]2} yang terdiri dari dua kompleks dimer, yaitu dimer molekuler [Ag(PPh3)(μ-tu)(ONO2)]2 yang memiliki geometri
2
tetrahedral terdistorsi di sekitar atom pusatnya dan dimer ionik [Ag(PPh3)(μ- tu)]2(NO3)2 dengan kation kompleks [Ag(PPh3)(μ-tu)]+ yang memiliki geometri trigonal planar terdistorsi di sekitar atom pusatnya. Kedua dimer memiliki tu sebagai ligan jembatan yang menghubungkan dua ion Ag(I).
SbPh3 merupakan ligan yang isostruktur dengan PPh3. SbPh3 memiliki atom donor Sb(sp3) dengan keelektronegatifan yang lebih rendah dari atom P(sp3),
sehingga diharapkan lebih mudah mendonorkan PEB pada atom pusat. Ditinjau dari teori HSAB oleh Pearson (1963:3533-3539), ligan PPh3 dan SbPh3 merupakan basa lunak sehingga kekuatan interaksinya dengan perak(I) yang merupakan asam lunak dapat dianggap tidak berbeda. Berdasarkan keelektronegatifan atom donor dan kelunakan sebagai basa, maka SbPh3 akan lebih mudah membentuk kompleks dengan perak(I) dibandingkan PPh3. Hal tersebut memungkinkan senyawa kompleks dari perak nitrat dengan ligan campuran SbPh3 dan tu untuk disintesis.
Senyawa kompleks {[Ag(PPh3)(μ-tu)]2(NO3)2.[Ag(PPh3)(μ-tu)(NO3)]2} disintesis melalui reaksi langsung antara perak nitrat dengan PPh3 dan tu pada perbandingan mol 1:1:1. Perbedaan kekuatan ligan SbPh3 dan PPh3 dapat menyebabkan penggunaan metode yang berbeda dalam mensintesis senyawa kompleks dari perak nitrat dengan ligan campuran SbPh3 dan tu. Penelitian ini bertujuan untuk menemukan metode sintesis senyawa kompleks dari perak nitrat dengan ligan campuran SbPh3 dan tu, serta memprediksikan struktur senyawa kompleks yang dihasilkan berdasarkan hasil analisis EDX, daya hantar listrik, dan komputasi dengan HyperChem 8.0.3.
METODOLOGI Alat dan Bahan
Alat-alat yang digunakan adalah tabung reaksi, gelas kimia, kaca arloji, corong kaca, pipet tetes, spatula, statif, klem, manice, kertas saring, aluminium foil, kertas lakmus, neraca analitik Sartorius Element ELT103, bak ultrasonik BRANSON 1510, alat ukur titik lebur Fisher Scientific, konduktometer Omega Engineering INC, dan alat SEM-EDX FEI Inspect S-50-AMETEK.
Bahan-bahan yang digunakan adalah AgNO3 (Merck; p.a.), tu (Merck; p.a.), SbPh3 (Merck; p.a.), MeCN (Merck; p.a.) MeOH (Merck; p.a.), DMSO (Merck;
p.a.), KOH teknis, dan aquades.
3
Eksperimen
Penelitian terdiri dari dua tahapan, yaitu sintesis dan karakterisasi. Tahap sintesis meliputi sintesis senyawa kompleks [Ag(tu)](∞|∞)NO3 dan sintesis senyawa kompleks dari [Ag(tu)](∞|∞)NO3 dan SbPh3. Tahap karakterisasi meliputi uji titik lebur, uji daya hantar listrik (DHL), uji kualitatif ion nitrat, analisis Energy Dispersive X-ray (XRD), dan komputasi dengan HyperChem 8.0.3.
Sintesis Senyawa Kompleks [Ag(tu)](∞|∞)NO3
Larutan tu (0,0095 g; 0,1250 mmol) dalam MeOH (3 mL) dicampurkan ke dalam larutan AgNO3 (0,0212 g; 0,1250 mmol) dalam MeCN (3 mL). Campuran didiamkan hingga seluruh kompleks mengendap.
Sintesis Senyawa Kompleks dari [Ag(tu)](∞|∞)NO3 dan SbPh3
Kompleks [Ag(tu)](∞|∞)NO3 yang telah disintesis, diambil pelarutnya dengan menggunakan pipet tetes hingga hampir habis, kemudian ditambah 2 mL pelarut DMSO dan dikocok perlahan hingga larut. Padatan SbPh3 (0,0441 g; 0,1250 mmol) ditambahkan ke dalam campuran dan digetarkan dalam bak ultrasonik selama 1 jam dengan temperatur 60C. Larutan jernih berwarna kekuningan yang dihasilkan kemudian dievaporasi secara perlahan dengan cara ditutup aluminium foil dan dilubangi sebesar jarum agar terjadi kristalisasi. Kristal tidak berwarna terbentuk setelah 6 hari.
Karakterisasi Senyawa Kompleks Hasil Sintesis
Analisis titik lebur dilakukan untuk mengetahui terbentuk atau tidaknya senyawa baru. Analisis EDX bertujuan untuk memperoleh rumus empiris senyawa hasil sintesis berdasarkan perbandingan terkecil persentase atom dan massa unsur penyusun. Struktur-struktur prediksi dibuat berdasarkan rumus empiris yang
diperoleh dan dihitung nilai energi bebasnya dengan software HyperChem 8.0.3. Uji DHL dan uji kualitatif ion nitrat dengan metode aliase devarda dilakukan untuk menentukan kompleks hasil sintesis merupakan kompleks ionik atau molekuler.
Struktur prediksi yang dipilih adalah yang paling sesuai dengan hasil karakterisasi.
4
HASIL DAN PEMBAHASAN
Sintesis Senyawa Kompleks [Ag(tu)](∞|∞)NO3
Senyawa kompleks [Ag(tu)](∞|∞)NO3 berupa endapan putih terbentuk secara langsung setelah pencampuran. Senyawa kompleks terdekomposisi di udara dengan cepat (± 1 menit) dan terdekomposisi pada temperatur 170C sesuai dengan hasil yang dilaporkan oleh Ahmad dkk. (2002:782-785) dan Bowmaker dkk. (2009:3185- 3197). Senyawa kompleks [Ag(tu)](∞|∞)NO3 memiliki kelarutan yang sangat rendah dalam sebagian besar pelarut. Senyawa kompleks dapat larut dalam DMSO
membentuk larutan berwarna putih, tetapi memberikan deposit berupa endapan hitam setelah beberapa hari yang merupakan efek pemutusan ikatan polimer senyawa kompleks [Ag(tu)](∞|∞)NO3 (Ahmad dkk., 2002:782-785).
Sintesis Senyawa Kompleks dari [Ag(tu)](∞|∞)NO3 dan SbPh3
Kristal-kristal tidak berwarna disertai endapan hitam diperoleh dari larutan hasil sintesis setelah enam hari. Kristal-kristal yang diperoleh berbentuk kubus dan berukuran kecil. Endapan hitam yang terbentuk merupakan hasil dekomposisi sebagian senyawa kompleks [Ag(tu)](∞|∞)NO3 yang mengalami pemutusan ikatan polimer (Ahmad dkk., 2002:782-785). Pembentukan endapan hitam menyebabkan stoikiometri reaksi tidak lagi sebesar 1:1:1. Endapan hitam dapat dipisahkan dari kristal dengan pencucian menggunakan MeCN.
Sintesis senyawa kompleks dari perak nitrat dengan ligan campuran tu dan SbPh3 tidak dapat dilakukan dengan mereaksikan ketiga reaktan secara langsung seperti pada sintesis senyawa kompleks {[Ag(PPh3)(μ-tu)]2(NO3)2.[Ag(PPh3)(μ- tu)(NO3)]2}. Reaksi secara langsung antara perak nitrat, SbPh3 dan tu menghasilkan endapan putih yang mengindikasikan ligan SbPh3 dan tu tidak dapat berkoordinasi secara bersamaan. Senyawa kompleks hanya dapat diperoleh melalui pembentukan kompleks [Ag(tu)](∞|∞)NO3 terlebih dulu, kemudian mereaksikannya dengan SbPh3
dalam pelarut DMSO.
Karakterisasi Senyawa Kompleks Hasil Sintesis
Hasil karakterisasi dari senyawa kompleks hasil sintesis dapat dilihat pada Tabel 1. Data titik lebur menunjukkan bahwa senyawa hasil sintesis adalah senyawa baru. Senyawa hasil sintesis memiliki kestabilan termal yang rendah karena
5
mengalami dekomposisi pada temperatur 157C. Data persentase atom dan massa dari analisis EDX memberikan prediksi rumus empiris C55H49AgN3O3SSb3. Rumus empiris tersebut menunjukkan ligan tu (CH4N2S) dan SbPh3 (C18H15Sb) yang berkoordinasi membentuk senyawa kompleks. Nilai perbandingan atom Ag:S:Sb adalah 1,28:1,34:3,80 atau dengan perbandingan terkecil 1,04:1,00:2,97 sehingga diprediksi senyawa kompleks hasil sintesis mengandung satu ligan tu dan tiga ligan SbPh3. Dengan demikian, ada dua kemungkinan struktur yang didapatkan yaitu [(Ph3Sb)3Ag(tu)]NO3 dan [(Ph3Sb)3Ag(tu)(NO3)]. Komputasi menggunakan software HyperChem 8.0.3 dengan metode semi-empiris memberikan nilai energi bebas yang sangat rendah untuk kedua struktur tersebut. Kemungkinan struktur
[(Ph3Sb)3Ag(tu)(NO3)] memiliki energi bebas yang lebih rendah sehingga lebih stabil secara termodinamika.
Tabel 1. Hasil Karakterisasi Senyawa Kompleks Hasil Sintesis
Karakterisasi Hasil
Titik lebur (C):
Kompleks hasil sintesis Kompleks [Ag(tu)](∞|∞)NO3
AgNO3 tu SbPh3
%At EDX:
C N O S Ag Sb
157 (terdekomposisi) 170 (terdekomposisi) 212 (terdekomposisi) (Merck) 174-179 (Merck)
52-54 (Merck)
84,0 4,56 5,02 1,34 1,28 3,80
%Wt EDX:
C N O S Ag Sb
Prediksi energi bebas HyperChem 8.0.3 (kkal/mol):
Struktur [(Ph3Sb)3Ag(tu)]NO3
Struktur [(Ph3Sb)3Ag(tu)(NO3)]
Uji DHL (μS):
Kompleks hasil sintesis (dalam DMSO) AgNO3 (dalam air)
AgNO3 (dalam DMSO) DMSO
Uji kualitatif ion nitrat
56,2 3,56 4,47 2,39 7,66 5,76
-124661,11 -136367,58
28,4 110 36,0 1,80 Negatif
6
Uji DHL yang dilakukan menginformasikan bahwa DHL larutan AgNO3 dalam air dan DMSO memberikan hasil yang berbeda. DHL AgNO3 dalam pelarut air jauh lebih tinggi dari DHL AgNO3 dalam pelarut DMSO. Hal tersebut disebabkan AgNO3 dalam air terdisosiasi sempurna menjadi ion-ionnya, sedangkan dalam
pelarut DMSO tidak mengalami disosiasi. Berdasarkan penelitian yang dilakukan oleh Ahrland & Bjork (1974:823-828), AgNO3 membentuk kompleks tersolvasi dalam DMSO. Senyawa kompleks yang terbentuk adalah AgNO3.DMSO yang merupakan kompleks molekuler dengan DMSO berkoordinasi pada atom O. DHL senyawa kompleks hasil sintesis memiliki nilai mendekati DHL AgNO3 dalam pelarut DMSO yang menunjukkan bahwa senyawa kompleks hasil sintesis juga tidak terdisosiasi. Dengan demikian, senyawa kompleks hasil sintesis merupakan senyawa kompleks molekuler. Uji kualiatif ion nitrat yang dilakukan memberikan hasil negatif sehingga dapat dipastikan bahwa anion NO3-
bertindak sebagai ligan dalam senyawa kompleks hasil sintesis.
Prediksi Struktur Senyawa Kompleks Hasil Sintesis
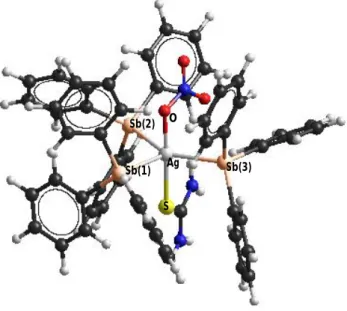
Hasil karakterisasi menunjukkan bahwa prediksi struktur senyawa kompleks yang paling sesuai adalah [(Ph3Sb)3Ag(tu)NO3]. Prediksi struktur senyawa kompleks hasil sintesis dengan model ball and stick ditunjukkan pada Gambar 1. Struktur dioptimasi dengan HyperChem 8.0.3 dengan metode mekanika molekuler (MM+), kemudian dilakukan pengukuran panjang dan sudut ikatan. Data panjang dan sudut ikatan diberikan pada Tabel 2.
Berdasarkan data panjang ikatan dari Tabel 2, ikatan Ag−Sb adalah lebih panjang daripada ikatan Ag−S dan Ag−O. Hal tersebut disebabkan oleh jari-jari kovalen atom Sb yang lebih besar dari atom S dan O. Ikatan Ag−Sb pada senyawa kompleks hasil sintesis sebesar 2,7418 Å juga lebih panjang dari ikatan Ag−P pada kompleks {[Ag(PPh3)(μ-tu)]2(NO3)2.[Ag(PPh3)(μ-tu)(NO3)]2} yaitu 2,4029 Å. Ikatan Ag−Sb lebih panjang karena atom Sb memiliki jari-jari kovalen yang lebih besar dari atom P. Sudut ikatan yang dihasilkan menunjukkan bahwa senyawa kompleks hasil sintesis memiliki geometri trigonal bipiramidal terdistorsi dengan ligan nitrato dan tu terletak pada bidang aksial, sedangkan tiga ligan SbPh3 terletak pada bidang
ekuatorial.
7 Gambar 1. Prediksi Struktur Senyawa Kompleks [(Ph3Sb)3Ag(tu)NO3]
Tabel 2. Prediksi Panjang dan Sudut Ikatan Senyawa Kompleks Hasil Sintesis
Panjang Ikatan (Å) Sudut Ikatan (°) Ag−Sb(1)
Ag−Sb(2) Ag−Sb(3) Ag−O Ag−S
2,7448 2,7418 2,7454 2,0057 2,4210
Sb(1)−Ag−Sb(2) Sb(1)−Ag−Sb(3) Sb(2)−Ag−Sb(3) Sb(1)−Ag−O Sb(2)−Ag−O Sb(3)−Ag−O Sb(1)−Ag−S Sb(2)−Ag−S Sb(3)−Ag−S O−Ag−S
117,43 115,49 125,48 86,181 86,482 85,703 91,531 93,430 95,455 177,94
KESIMPULAN
Senyawa kompleks dari perak nitrat dengan ligan campuran tu dan SbPh3 disintesis melalui pembentukan kompleks [Ag(tu)](∞|∞)NO3, diikuti reaksinya dengan SbPh3. Senyawa kompleks hasil sintesis diprediksi adalah [(Ph3Sb)3Ag(tu)NO3] yang merupakan kompleks molekuler dan memiliki geometri trigonal bipiramidal
terdistorsi di sekitar atom pusatnya.
DAFTAR RUJUKAN
Ahmad, S., Isab, A.A. & Perzanowski, H.P. 2002. Silver(I) Complexes of Thiourea.
Transition Metal Chemistry, 27: 782-785.
Ag
S Sb(1)
Sb(2)
Sb(3) O
8
Ahrland, S. & Bjork, N. 1974. Metal Halide and Pseudohalide Complexes in Dimethylsulfoxide Solution. I. Dimethyl Sulfoxide Solvates of Silver(I), Zinc(II), Cadmium(II) and Mercury(II). Acta Chemica Scandinavica A, 28:
823-828.
Bowmaker, G.A., Effendy, Hart, R.D., Kildea, J.D., de Silva, E.N., Skelton, B.W. &
White, A.H. 1997. Lewis-Base Adducts of Group 11 Metal(I) Compounds.
LXIV† Syntheses, Spectroscopy and Structures of Some 1 : 4 Adducts of Copper(I) and Silver(I) Perchlorates with Triphenylarsine and
Triphenylstibine. Australian Journal of Chemistry, 50: 539-552.
Bowmaker, G.A., Skelton, B.W. & White, A.H. 2009. Structural and Infrared
Spectroscopic Studies of Some Novel Mechanochemically Accessed Adducts of Silver(I) Oxoanion Salts with Thiourea. Inorganic Chemistry, 48: 3185- 3197.
Effendy, Kildea, J.D. & White, A.H. 1997. Lewis-Base Adducts of Group 11
Metal(I) Compounds. LXVIII† Synthesis and Structural Systematics of Some 1 : 3 Adducts of Silver(I) Compounds with Triphenylstibine, [(Ph3Sb)3AgX], X = Cl, I, SCN, NCS, CN, ONO2. Australian Journal of Chemistry, 50: 587- 604.
Effendy, Kildea, J.D. & White, A.H. 1997. Lewis-Base Adducts of Group 11
Metal(I) Compounds. LXXIV† Synthesis and Structure of the 1 : 1 Adduct of Silver(I) Nitrate with Triphenylstibine. Australian Journal of Chemistry, 50:
671-674.
Isab, A.A., Nawaz, S., Saleem, M., Altaf, M., Monim-ul-Mehboob, M., Ahmad, S. &
Evans, H.S. 2010. Synthesis, Characterization and Antimicrobial Studies of Mixed Ligand Silver(I) Complexes of Thioureas and Triphenylphosphine;
Crystal Structure of {[Ag(PPh3)(thiourea)(NO3)]2.[Ag(PPh3)(thiourea)]2- (NO3)2}, Polyhedron, 29: 1251-1256.
Pearson, R.G. 1963. Hard and Soft Acids and Bases. Journal of The American Chemical Society, 85 (22): 3533-3539.