i
UJI AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOLIK DAUN SAWO KECIK (Manilkara kauki (L.) Dubard) SECARA KUALITATIF DAN
KUANTITATIF DENGAN METODE DPPH
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Filbert Hita Kumaro
NIM : 098114017
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iii
iv HALAMAN PERSEMBAHAN
“Dari air kita belajar ketenangan,
D ari batu kita belajar ketegaran,
Dari api kita belajar keberanian,
Dari angin kita belajar arah tujuan,
Dari padi kita belajar rendah hati,
Dari Zhuge Liang kita belajar ‘menjadi yang terbaik’”
~dHanZ_Kiryu, 2011
“Everyone got their own priority, please
respect their choice and please don’t be
self-centred”
~Filbert Hita Kumaro, 2013
“There are only two paths you can choose. You can sit quietly and be selected out
of this world, or you can adapt and change!”
~Gai Tsutsugami (Guilty Crown)
“Till now I have been
running away. But, now I
will show my own self!”
~Ouma Shu (Guilty Crown)
Kupersembahkan untuk:
Kedua orangtuaku, keluarga, teman-teman,
vi PRAKATA
Anumodana kepada Tiratana dan para Bodhisattasehingga penulis dapat
menyelesaikan skripsi dengan judul “Uji Aktivitas Antioksidan Ekstrak
Etanolik Daun Sawo Kecik (Manilkara kauki (L.) Dubard) Secara Kualitatif dan Kuantitatif dengan Metode DPPH” sebagai salah satu syarat untuk
mencapai gelar Sarjana Farmasi Universitas Sanata Dharma Yogyakarta.
Dalam penelitian dan penulisan skripsi, berbagai pihak telah memberikan
dukungan dan bantuan sehingga penulis dapat menyelesaikan skripsi ini dengan
baik. Oleh karena hal tersebut, penulis ingin mengutarakan ucapan terima kasih
sebesar-besarnya kepada:
1. Yohanes Dwiatmaka, M.Si. sebagai Dosen Pembimbing yang telah
membimbing dan memberikan banyak masukan yang membangun dalam
penelitian maupun penulisan skripsi ini.
2. Agustina Setiawati, M.Sc., Apt. sebagai Dosen Penguji yang telah
memberikan banyak kritik dan saran serta kesediannya menguji skripsi ini.
3. Jeffry Julianus, M.Si. sebagai Dosen Penguji yang telah memberikan
banyak kritik dan saran serta kesediannya menguji skripsi ini.
4. Segenap dosen dan karyawan Fakultas Farmasi Universitas Sanata
Dharma.
5. Kedua orangtuaku, William Kwan dan Rosianawati, yang terus
mendukung dan memberikan semangat dalam menyelesaikan skripsi ini.
6. Indah Kertawati dan Martina Sipayung atas bantuan dan kontribusi dalam
vii
7. Jap Yulius Billy Soegianto dan Benny Ade Saputra atas banyak informasi
dan pertukaran pendapat akan penelitian.
8. Guild Valkyrian (Ragnarok Online 2 SEA – Jormungand Server) beserta
semua teman-teman RO2SEA atas bantuan dan hiburannya yang dapat
melepas lelah penulis.
9. Vincent Eddy Kuncoro, Yohanes Ivan Kristian Santoso, Yoseph Edo
Saputra, Gregorius Sebastian D.A., Rendy Xaverio, Meita Eryanti, dan
Mayke Prasastia, yang selalu menyemangati dan menemani penulis
berjalan-jalan baik untuk kebutuhan penelitian maupun hanya hiburan.
10. Berbagai pihak yang tidak dapat disebut satu per satu.
Penulis menyadari bahwa penelitian dan penulisan skripsi ini masih jauh
dari kata sempurna. Penulis juga meminta maaf sebesar-besarnya dan bertanggung
jawab atas kesalahan yang ada pada penulisan skripsi ini. Oleh karena itu, setiap
kritik dan saran akan diterima dengan baik oleh penulis. Akhir kata, semoga
skripsi ini dapat bermanfaat bagi perkembangan ilmu pengetahuan.
ix DAFTAR ISI
Halaman
HALAMAN JUDUL...i
HALAMAN PERSETUJUAN PEMBIMBING...ii
HALAMAN PENGESAHAN...iii
HALAMAN PERSEMBAHAN...iv
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI...v
PRAKATA...vi
PERNYATAAN KEASLIAN KARYA...viii
DAFTAR ISI...ix
DAFTAR TABEL...xiii
DAFTAR GAMBAR...xiv
DAFTAR LAMPIRAN...xv
INTISARI...xvi
ABSTRACT...xvii
BAB I PENGANTAR...1
A. Latar Belakang...1
x
2. Keaslian penelitian...2
3. Manfaat penelitian...3
B. Tujuan Penelitian...3
BAB II PENELAAHAN PUSTAKA...4
A. Sawo Kecik...4
1. Uraian tanaman...4
2. Morfologi...4
3. Kegunaan dan khasiat...5
4. Kandungan fitokimia...5
B. Antioksidan...5
1. Radikal bebas...5
2. Definisi antioksidan...8
3. Manfaat antioksidan...9
C. Metode Pengujian Aktivitas Antioksidan...9
1. Metode pengujian aktivitas antioksidan secara umum...9
2. Uji DPPH...10
D. Skrining Fitokimia dan Ekstraksi...12
E. Landasan Teori...14
xi
BAB III METODOLOGI PENELITIAN...16
A. Jenis dan Rancangan Penelitian...16
B. Variabel dan Definisi Operasional...16
1. Variabel...16
2. Definisi operasional...16
C. Bahan Penelitian...16
D. Alat Penelitian...17
E. Tata Cara Penelitian...17
1. Determinasi sawo kecik...17
2. Skrining fitokimia...17
3. Pembuatan Ekstrak Etanolik Daun Sawo Kecik...20
4. Uji kualitatif DPPH dengan kromatografi lapis tipis (KLT)...21
5. Penentuan operating time (OT) ekstrak etanolik daun sawo kecik...21
6. Penentuan operating time (OT) baku pembanding asam askorbat...22
7. Penentuan panjang gelombang absorbansi maksimum (λmaks)...23
8. Uji kuantitatif DPPH dengan spektrofotometri visibel...23
F. Analisis Hasil...24
1. Determinasi sawo kecik...24
xii
3. Uji kualitatif DPPH dengan kromatografi lapis tipis (KLT)...25
4. Uji kuantitatif DPPH dengan spektrofotometri visibel...25
BAB IV HASIL DAN PEMBAHASAN...26
A. Determinasi Sawo Kecik...26
B. Hasil Skrining Fitokimia...26
C. Hasil Uji Kualitatif DPPH dengan KLT...31
D. Hasil Uji Kuantitatif DPPH...35
BAB V KESIMPULAN DAN SARAN...41
A. Kesimpulan...41
B. Saran...41
DAFTAR PUSTAKA...42
xiii
DAFTAR TABEL
Halaman
Tabel I. Tingkat aktivitas antioksidan dengan metode DPPH...11
xiv
DAFTAR GAMBAR
Halaman
Gambar 1. DPPH radikal dan non-radikal...11
Gambar 2. Uji tanin...29
Gambar 3. Uji flavonoid dengan serbuk Zn, HCl 2N, dan HCl pekat...29
Gambar 4. Uji flavonoid dengan serbuk magnesium dan HCl pekat...29
Gambar 5. Uji triterpenoid/steroid...30
Gambar 6. Uji saponin...30
Gambar 7. Uji alkaloid dengan Mayer...31
Gambar 8. Uji alkaloid dengan Bouchardat...31
Gambar 9. Kromatogram KLT uji kualitatif antioksidan (EMW)...33
Gambar 10. Kromatogram KLT uji kualitatif antioksidan (CEF)...34
Gambar 11. Kromatogram KLT uji kualitatif antioksidan (BEA)...35
Gambar 12. Grafik optimasi OT asam askorbat...36
Gambar 13. Grafik optimasi OT ekstrak etanolik daun sawo kecik...37
Gambar 14. Optimasi λmaks DPPH pada 3 jenis konsentrasi...37
Gambar 15. Kurva regresi linier asam askorbat...38
xv
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Surat pengesahan determinasi tanaman sawo kecik...45
Lampiran 2. Gambar tanaman sawo kecik dari Gereja Katolik Hati Kudus Tuhan Yesus, Ganjuran, Bantul, Yogyakarta...46
Lampiran 3. Optimasi uji kuantitatif antioksidan...47
Lampiran 4. Scanning metanol p.a...49
Lampiran 5. Uji kuantitatif antioksidan...50
xvi INTISARI
Daun tanaman sawo kecik (Manilkara kauki (L.) Dubard) digunakan sebagai antitumor di India. Radikal bebas merupakan salah satu penyebab penyakit tumor. Oleh karena antioksidan dapat menetralkan radikal bebas, maka perlu adanya pengujian antioksidan daun sawo kecik untuk mengetahui aktivitasnya sebagai antioksidan. Metode pengujian yang dipilih adalah metode DPPH (1,1-difenil-2-pikril hidrazil) baik secara kualitatif (kromatografi lapis tipis) maupun secara kuantitatif (spektrofotometri). Selain itu juga dilakukan skrining fitokimia yang mendukung keberadaan kandungan yang kemungkinan dapat menimbulkan aktivitas antioksidan tersebut. Aktivitas antioksidan ditetapkan dengan nilai IC50. Dari hasil penelitian, ditemukan bahwa daun sawo
kecik mengandung tanin dan flavonoid. Nilai IC50 dari ekstrak etanolik daun sawo
kecik adalah 5,00±0,04 µg/mL yang artinya mempunyai aktivitas antioksidan sangat aktif (< 50 µg/mL).
xvii
ABSTRACT
Leaves of sau (Manilkara kauki (L.) Dubard) are used as antitumor in India. One of the causes that leads to the development of tumour is free radicals. Since antioxidants are capable to neutralise free radicals, hence there is a need to test the leaves of sau for their antioxidant properties. The method used is DPPH
(1,1-diphenyl-2-picrylhydrazyl) method both qualitatively (with Thin Layer
Chromatography) and quantitatively (with spectrophotometry). Moreover, phytochemical screening is also done to check the compounds which might be responsible for the antioxidant property. The antioxidant activity is measured as IC50. As a result, it was found out that the leaves of sau contain tannins and
flavonoids. The IC50 value of leaves of sau ethanolic extract is 5.00±0.04 µg/mL
which indicates for its very high antioxidant activity (< 50 µg/mL).
1 BAB I PENGANTAR A. Latar Belakang
Proses oksidasi dapat merusak molekul penting dalam tubuh dan dapat
membahayakan struktur penting dalam sel. Oksidasi merupakan proses alami
yang dapat terjadi ketika suatu zat berikatan dengan oksigen. Antioksidan adalah
zat yang dalam jumlah kecil dapat menginhibisi kecepatan proses oksidatif pada
molekul penting dalam tubuh, melindungi sel, dan mencegah kerusakan dalam
tubuh yang disebabkan oleh radikal bebas (Chawda, 2011). Beberapa jenis
penyakit yang dapat disebabkan oleh proses oksidasi adalah kanker, penyakit
kardiovaskuler, katarak, penurunan fungsi syaraf, serta penuaan dini (Mbata,
2010).
Secara alami, antioksidan akan menetralisir radikal bebas hasil dari
proses reaksi normal sel. Radikal bebas merupakan atom atau molekul dengan
electron shell yang tidak komplit, sehingga bersifat lebih reaktif dibandingkan
dengan atom atau molekul dengan electron shell yang komplit. Antioksidan dapat
menginhibisi proliferasi (perbanyakan) sel. Secara selektif, antioksidan dapat
menginhibisi pertumbuhan sel kanker tanpa berpengaruh pada sel normal.
Antioksidan juga menunjukkan adanya peningkatan respon sel tumor terhadap
kemoterapi dan radioterapi dengan dosis yang tinggi dan berulang (Chawda,
2011).
Penggunaan antioksidan dari tanaman cukup mendapat perhatian untuk
itu, konsumen juga lebih memilih menggunakan antioksidan alami dibandingkan
antioksidan sintetis karena terdapat kekhawatiran bahwa antioksidan sintetis dapat
menimbulkan toksisitas pada tubuh (Vareltzis, Koufidis, Gavriilidou, Papavergou,
and Vasiliadou, 1997; Timm, 2000).
Di India, daun sawo kecik (Manilkara kauki (L.) Dubard) merupakan
salah satu obat yang digunakan sebagai antitumor dalam bentuk pasta (Khare,
2007). Antioksidan merupakan salah satu cara untuk mengobati perkembangan sel
tumor (Carter, Madl, and Padula, 2006). Dengan demikian, maka terdapat
kemungkinan bahwa daun sawo kecik memiliki aktivitas antioksidan. Untuk
mengetahui aktivitas antioksidan daun sawo kecik, maka dapat dilakukan melalui
uji kemampuan menangkap radikal bebas. Metode yang dipilih adalah metode
DPPH (1,1-difenil-2-pikril hidrazil) karena metode tersebut sederhana, cepat,
sensitif, reprodusibel, dan paling sering digunakan pada pengujian antioksidan
ekstrak tanaman (Shivaprasad, Mohan, Kharya, Shiradkar, and Lakshman, 2005;
Savatovic, Cetkovic, Canadanovic-Brunet, and Djilas, 2012).
1. Permasalahan
a. Apakah daun sawo kecik mempunyai aktivitas antioksidan?
b. Berapa nilai IC50 aktivitas antioksidan ekstrak etanolik daun sawo kecik?
2. Keaslian penelitian
Sejauh penelusuran yang telah dilakukan peneliti, uji aktivitas
antioksidan ekstrak etanolik daun sawo kecik secara kualitatif dan kuantitatif
3. Manfaat penelitian
a. Manfaat teoretis. Memberikan informasi mengenai aktivitas
antioksidan daun sawo kecik.
b. Manfaat metodologi. Memberikan pengetahuan mengenai tata cara
pengujian aktivitas antioksidan ekstrak etanolik daun sawo kecik secara kualitatif
dan kuantitatif dengan metode DPPH.
c. Manfaat praktis. Memberikan informasi mengenai aktivitas
antioksidan daun sawo kecik dalam penangkapan radikal bebas.
B. Tujuan Penelitian
Penelitian ini dilakukan dengan tujuan :
1. Untuk mengetahui ada atau tidaknya aktivitas antioksidan pada daun sawo
kecik.
2. Untuk mengetahui nilai IC50 aktivitas antioksidan dari ekstrak etanolik daun
4 BAB II
PENELAAHAN PUSTAKA A. Sawo Kecik
1. Uraian tanaman
Sawo kecik (Manilkara kauki (L.) Dubard) merupakan tanaman dari
bangsa Ericales (Sawo), suku Sapotaceae (Sawo-sawoan). Nama ilmiah lainnya
adalah Mimusops kauki L. Nama lokal: sawo kecik (Jawa); sawo (Melayu);
peukula (Aceh); sawo kicik (Sunda); sabu (Madura); kayu sabua (Kangean); sabo
(Bali); sawo (Bima); nani (Makasar); nane (Bugis). Nama Inggris untuk sawo
kecik adalah sau (Yuzammi dkk., 2010).
Sawo kecik berasal dari Amerika tropis. Di Indonesia, sawo kecik
tumbuh pada ketinggian 1 – 350 meter di atas permukaan laut (Yuzammi dkk.,
2010). Di Kabupaten Bantul, Yogyakarta, sawo kecik dinyatakan sebagai flora
identitas Kabupaten Bantul (Anonim, 2011).
2. Morfologi
Sawo kecik berupa pohon dengan tinggi batang 15 – 30 m. Batang
berwarna coklat, diameter 30 – 70 cm, bercabang banyak. Kanopi rimbun
berbentuk payung. Daun tunggal berwarna hijau tua, berbentuk lonjong, berujung
meruncing, dan berukuran 5 x 13 cm. Bunga berwarna putih kusam, keluar dari
ketiak daun, terletak menggantung. Benang sari berjumlah 6 tangkai putik
bertangkai panjang yang menjulang keluar dari mulut bunga. Buah berbentuk
buah 5 – 7 cm dengan diameter 4 cm. Biji berjumlah 1 – 6, berwarna coklat muda,
berbentuk pipih, dan permukaannya mengkilap (Yuzammi dkk., 2010).
3. Kegunaan dan khasiat
Buah sawo kecik yang masak digunakan sebagai buah untuk disantap.
Kayu pohonnya dapat digunakan sebagai perkakas maupun alat tulis. Pohon sawo
kecik juga dapat digunakan sebagai pohon pelindung (Anonim, 2011b). Daun
sawo kecik dapat berfungsi sebagai antifungi, antidiare, antitumor (dalam bentuk
pasta), astringen, antipiretik, antihelmintik, pengobatan pada beri-beri, delirium,
dan lepra (Bhat, Shivaprakasan, and Jayarajan, 1994; Mathias-Mundy and
Murdiati, 1991; Khare, 2007; Duke, 2012).
4. Kandungan fitokimia
Seluruh bagian mengandung taraxerol, triterpene ketone, α- dan β
-amyrin, sinamat, α-sipnasterol, β-sitosterol, β-D-glukosida, kuersitol, kuersetin
dan dihidroderivat kuersetin, dan asam ursolat. Bagian batang diketahui
mengandung tanin 10% (Khare, 2007).
B. Antioksidan 1. Radikal bebas
Radikal bebas adalah atom atau molekul yang mempunyai elektron tanpa
pasangan (unpaired electron). Adanya elektron tanpa pasangan menyebabkan
senyawa sangat reaktif untuk mencari pasangan dengan menyerang dan mengikat
elektron senyawa lain yang ada di sekitarnya. Target utama radikal bebas
termasuk karbohidrat. Namun, yang paling rentan menjadi target utama radikal
bebas adalah asam lemak tak jenuh. Terjadinya kerusakan pada ikatan rangkapnya
di membran sel membuat dinding sel rapuh. Radikal bebas berpotensi merusak
bagian dalam pembuluh darah dan menyebabkan aterosklerosis, merusak basa
DNA dan membentuk sel kanker, serta merusak jaringan lipid dan terbentuk
peroksida yang memicu berbagai penyakit degeneratif. Radikal bebas dianggap
salah satu oksidan karena terjadi penarikan elektron senyawa lain (Winarsi, 2007).
Radikal bebas secara normal diproduksi terus-menerus dalam jumlah
banyak untuk metabolisme dalam tubuh. Radikal bebas dibutuhkan untuk
melawan agen infeksi seperti bakteri, fungi, dan parasit. Walaupun berguna bagi
tubuh, namun dapat menjadi masalah pada jumlah tertentu. Segera setelah radikal
bebas dilepaskan, tubuh akan mencari penetralnya yakni antioksidan, termasuk
enzim antioksidan (endogen) maupun nutrien antioksidan (eksogen). Ketika
jumlah radikal bebas lebih banyak dibanding antioksidan, maka terjadi kerusakan
membran sel yang menimbulkan arthritis sendi, emphysema dan bronkitis,
aterosklerosis dan penyakit jantung, ulkus peptikum, penuaan dini dan pengerutan
kulit, maupun mutasi nukleus penyebab kanker. Diabetes, gangguan ginjal,
gangguan hepar, dan hampir semua penyakit dapat dikaitkan dengan kerusakan
oleh radikal bebas (Hari, 1995).
Senyawa oksigen reaktif atau radikal bebas akan terbentuk dalam setiap
kegiatan termasuk saat bernafas, namun secara umum pembentukan radikal bebas
a. Pestisida atau karbon tetraklorida (CCl4). Setelah masuk dalam tubuh
zat ini akan bereaksi dengan sitokrom P450 monooksigenase dan membentuk
radikal triklorometil (CCl3●) dan triklorometilperoksil (CCl3O2●) (Winarsi,
2007).
b. Benzoapirene. Senyawa hasil pemanggangan daging berlemak ini jika
masuk dalam tubuh akan berubah menjadi senyawa radikal 7,8-diol-9-10 epoksida
(Winarsi, 2007).
Pada dasarnya radikal bebas dapat terbentuk secara endogen (sebagai
respons normal biokimia intrasel maupun ekstrasel) maupun eksogen (seperti
polusi, makanan, injeksi, dan absorpsi melalui kulit) (Supari, 1996).
Belleville-Nabet (1996) mengungkapkan beberapa reaksi pembentukan senyawa oksigen
reaktif. Oksigen yang teraktivasi dapat menyebabkan pembentukan radikal bebas
oksigen yang disebut anion superoksida (O2●). Secara in vitro, senyawa radikal
bebas tersebut akan membentuk kompleks dengan senyawa organik. Beberapa
faktor yang menyebabkan terjadinya pembentukan kompleks adalah adanya sifat
permukaan membrane, muatan listrik, sifat pengikatan makromolekul, dan bagian
enzim, substrat, maupun katalisator. Peristiwa pembentukan kompleks ini dapat
terjadi pada sel normal, sel tidak normal, maupun sel teraktivasi.
Radikal bebas juga dapat terbentuk melalui jalur enzimatis ataupun
metabolik. Proses cascade dari asam arakidonat menjadi prostaglandin dan
prostasiklin dipacu oleh enzim lipoksigenase dan siklooksigenase (menghasilkan
senyawa oksigen reaktif berupa epoksida atau aldehid oksidase), serta oksidase
membentuk radikal anion superoksida atau hidroperoksida. Enzim sitokrom P450
juga menghasilkan senyawa peroksida yang termasuk senyawa oksigen reaktif.
Secara normal peroksida tidak berbahaya, namun keberadaan logam transisi Cu
dan Fe dalam tubuh akan membentuk radikal hidroksil melalui reaksi
Haber-Weiss dan Fenton. Proses aktivasi makrofag dan netrofil, yang merupakan bentuk
mekanisme pertahanan tubuh, juga membentuk senyawa radikal bebas dan
senyawa oksigen reaktif termasuk asam hipoklorit (HOCl) yang berfungsi untuk
menghancurkan virus dan bakteri namun juga berpotensi menyerang sel tubuh jika
tidak terkontrol (Winarsi, 2007).
2. Definisi antioksidan
Antioksidan merupakan senyawa pemberi elektron (electron donor) atau
reduktan yang dapat memerangi aktivitas oksidan dalam tubuh (Winarsi, 2007).
Antioksidan dianggap sebagai dasar kesehatan dan digunakan selama
bertahun-tahun dalam menanggulangi efek berbahaya dari proses oksidatif (Sing, 2007).
Kerusakan oksidatif yang diakibatkan radikal bebas dalam tubuh
merupakan masalah yang tidak dapat diabaikan mengingat laporan dari Dr. Bruce
Ames, teman sejawat Packer dari University of California, Berkeley, mengenai
jumlah kerusakan oksidatif dalam tubuh, yang menunjukkan bahwa secara in vitro
dalam satu sel kira-kira terjadi 10.000 kali reaksi oksidasi dalam waktu 24 jam.
Namun demikian tubuh akan mencari penetral kerusakan yang disebabkan oleh
radikal bebas baik secara endogen maupun eksogen. Mekanisme tersebut
dinamakan antioxidant network, yang mana dapat berkoordinasi akan kebutuhan
Berdasarkan sumbernya, antioksidan dapat digolongkan menjadi dua
jenis, yakni antioksidan alami dan antioksidan sintetis. Antioksidan sintetis yakni
antioksidan yang dibuat dengan melakukan sintesis kimia seperti tBHQ, BHT, dan
propil galat (Gulcin, Uguz, Oktay, Beydemir, and Kufrevioglu, 2004).
Antioksidan alami terdiri atas berbagai senyawa fenolik atau nitrogen dan
karotenoid. Antioksidan alami terdapat pada tumbuhan level tinggi (seperti sayur,
buah, dan teh). Antioksidan alami dapat melindungi tubuh manusia dari radikal
bebas dan menurunkan terjadinya perkembangan penyakit kronis (Sing, 2007).
3. Manfaat antioksidan
Antioksidan bermanfaat dalam mencegah kerusakan oksidatif yang
disebabkan oleh radikal bebas. Antioksidan dapat digunakan dalam pencegahan
berbagai macam penyakit seperti penyakit kardiovaskuler, kanker, katarak,
penurunan fungsi syaraf, serta penuaan dini (Mbata, 2010).
C. Metode Pengujian Aktivitas Antioksidan 1. Metode pengujian aktivitas antioksidan secara umum
Pengujian aktivitas antioksidan dapat dilakukan dengan berbagai macam
cara, baik secara kualitatif maupun kuantitatif. Salah satu pengujian secara
kualitatif adalah dengan menggunakan metode DPPH pada kromatografi lapis
tipis (Masoko and Eloff, 2007).
Shivaprasad et al. (2005) melaporkan bahwa uji kuantitatif antioksidan
dapat dilakukan dengan menggunakan spektrofotometri secara in vitro. Salah satu
2. Uji DPPH
Metode DPPH (1,1-difenil-2-pikril hidrazil) merupakan metode yang
paling sering dilakukan sebagai metode pengujian antioksidan pada ekstrak
tanaman (Shivaprasad et al., 2005). Metode DPPH dapat digunakan baik pada
pengujian kualitatif maupun kuantitatif (Sarker, Latif, and Gray, 2005). Metode
DPPH merupakan metode yang sederhana, cepat, sensitif, dan reprodusibel untuk
pengujian aktivitas antioksidan (Savatovic et al., 2012).
Prinsip metode DPPH adalah reduksi larutan metanolik radikal bebas
berwarna (DPPH) dengan cara penangkapan radikal bebas (Shivaprasad et al.,
2005). DPPH merupakan senyawa radikal bebas stabil yang dapat berubah warna
dari ungu (Gambar 1a) ke kuning (Gambar 1b) dengan adanya reduksi melalui
proses pemberian (donor) hidrogen atau elektron. Oleh karena itu, senyawa yang
dapat mereduksi DPPH disebut sebagai antioksidan atau penangkap radikal bebas
(Dehpour, Ebrahimzadeh, Fazel, and Mohammad, 2009).
Untuk pengujian secara kualitatif, pengujian antioksidan dengan metode
DPPH dilakukan secara kromatografi lapis tipis. Zat yang telah terelusi disemprot
dengan reagen DPPH 0,2% dalam metanol (Masoko and Eloff, 2007).
Berdasarkan berbagai jurnal acuan, panjang gelombang yang dapat
digunakan sebagai working wavelength adalah 515-520 nm. Operating Time (OT)
yang optimal adalah 30 menit, namun dapat digunakan waktu yang lebih singkat
(5 atau 10 menit) pada jenis substrat yang berbeda. Sehingga pemilihan OT
(a) (b)
Gambar 1. (a) DPPH (radikal), berwarna ungu; (b) DPPH (non-radikal), berwarna kuning (Molyneux, 2004).
Aktivitas antioksidan ditetapkan berdasarkan kadar efektif senyawa
dalam menangkap radikal bebas yang dinyatakan dalam nilai “Effective
Concentration” EC50 (juga disebut “Inhibitory Concentration” IC50) yang
didefinisikan sebagai kadar penyebab hilangnya aktivitas DPPH sebanyak 50%
(Molyneux, 2004). Nilai itu dapat diketahui dengan memplotkan nilai serapan
terhadap kadar ekstrak pada kurva atau dengan menghitung kemiringan kurva
menggunakan regresi linier (Marxen et al., 2007). Nilai EC50 berbanding terbalik
dengan aktivitas antioksidan (Molyneux, 2004). Menurut Jun, Yu, Fong, Wan,
Yang, and Ho (2003), tingkat aktivitas antioksidan menggunakan metode DPPH
dapat digolongkan berdasarkan nilai IC50 (tabel I).
Tabel I. Tingkat aktivitas dengan metode DPPH (Jun et al., 2003).
Intensitas Sangat aktif
Aktif Sedang Lemah Tidak
aktif
Nilai IC50 < 50
µg/mL
50 – 100
µg/mL
101 – 250
µg/mL
250 – 500
µg/mL
> 500
D. Skrining Fitokimia dan Ekstraksi
Skrining fitokimia merupakan suatu tahap pemeriksaan awal yang
digunakan untuk mendeteksi kandungan kimia suatu bahan alam. Uji ini antara
lain dilakukan pada golongan alkaloid, flavonoid, saponin, tanin, steroid dan
triterpenoid. Pengujian tersebut dilakukan dengan metode pereaksi warna
(Mustikasari dan Ariyani, 2010; Susmiati, 2010).
Ekstrak merupakan sediaan pekat yang didapatkan dengan cara
mengekstraksi zat aktif dari simplisia nabati atau hewani menggunakan pelarut
yang sesuai dan diuapkan hingga seluruh atau hampir seluruh pelarut menguap
serta massa atau serbuk yang tersisa diperlakukan hingga memenuhi baku yang
telah ditetapkan (Anonim, 1995). Ekstraksi adalah proses penyarian zat-zat dari
suatu tubuh makhluk hidup (Yatim, 2007). Ekstraksi dilakukan berdasarkan
tekstur, kandungan air simplisia, dan jenis senyawa yang akan diisolasi. Alkohol
seperti etanol merupakan pelarut serba guna yang baik untuk ekstraksi
pendahuluan karena dapat menarik semua senyawa berbobot molekul rendah baik
polar maupun non-polar (Harborne, 1987).
Teknik-teknik ekstraksi yang dapat dilakukan digolongkan menjadi
ekstraksi panas dan ekstraksi dingin. Ekstraksi dingin termasuk:
1. Maserasi
Maserasi merupakan proses ekstraksi simplisia menggunakan pelarut
dengan beberapa kali pengocokan atau pengadukan pada suhu ruang. Maserasi
termasuk ekstraksi dengan prinsip pencapaian kesetimbangan konsentrasi
2. Perkolasi
Perkolasi merupakan proses ekstraksi dengan pelarut yang selalu baru
hingga ekstraksi sempurna pada suhu ruang. Proses perkolasi terdiri atas tahapan
pengembangan bahan, tahapan maserasi antara, tahapan perkolasi sebenarnya
(penetesan atau penampungan ekstrak), dan terus-menurus hingga terbentuk
perkolat (Anonim, 2000).
Teknik-teknik ekstraksi panas termasuk:
1. Refluks
Refluks adalah ekstraksi dengan pelarut pada suhu titik didih zat selama
waktu tertentu dan dalam jumlah pelarut terbatas yang relatif konstan dengan
adanya pendingin balik (Anonim, 2000).
2. Digesti
Digesti adalah maserasi dengan pengadukan kontinu pada suhu yang
lebih tinggi dari suhu ruang, yakni 40 – 50°C (Anonim, 2000).
3. Infundasi
Infundasi merupakan teknik ekstraksi menggunakan pelarut air pada
penangas air mendidih selama 15 menit (Anonim, 2000).
4. Dekoksi
Dekoksi merupakan teknik ekstraksi yang memiliki prinsip yang sama
5. Sokletasi
Sokletasi adalah ekstraksi dengan pelarut yang selalu baru yang
dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinu dengan jumlah
pelarut relatif konstan dengan adanya pendingin balik (Anonim, 2000).
E. Landasan Teori
Radikal bebas diproduksi secara terus-menerus dalam tubuh untuk
berbagai kebutuhan. Namun pada jumlah tertentu, radikal bebas dapat menjadi
masalah bagi tubuh. Untuk mencegah timbulnya kerusakan molekul penting
dalam tubuh dan bahaya pada struktur penting dalam sel, maka tubuh akan
mencari penetralnya yakni antioksidan. Antioksidan dapat menginhibisi
perkembangan sel tumor. Antioksidan alami diyakini lebih aman penggunaannya
dibandingkan antioksidan sintetik. Di India, secara tradisional daun sawo kecik
digunakan sebagai pengobatan antitumor. Oleh karena itu ada kemungkinan
bahwa sawo kecik memiliki aktivitas antioksidan. Dengan demikian, perlu adanya
pengujian kualitatif dan kuantitatif antioksidan. DPPH adalah metode yang
sederhana, cepat, sensitif, reprodusibel, dan paling sering digunakan untuk
pengujian antioksidan pada ekstrak tanaman. Aktivitas antioksidan kemudian
ditetapkan dengan nilai IC50 dan digolongkan sesuai dengan penggolongan
F. Hipotesis
1. Daun sawo kecik mempunyai aktivitas antioksidan.
2. Nilai IC50 ekstrak etanolik daun sawo kecik menunjukkan aktivitas antioksidan
16 BAB III
METODE PENELITIAN A. Jenis dan Rancangan Penelitian
Penelitian ini termasuk dalam penelitian eksperimental murni.
B. Variabel dan Definisi Operasional 1. Variabel
a. Variabel bebas: konsentrasi ekstrak etanolik daun sawo kecik.
b. Variabel tergantung: aktivitas antioksidan ekstrak etanolik sawo kecik.
c. Variabel pengacau terkendali: tempat tumbuh tanaman.
d. Variabel pengacau tidak terkendali: umur tanaman dan iklim tumbuh tanaman.
2. Definisi operasional
a. Ekstrak etanolik daun sawo kecik adalah sari hasil proses maserasi daun sawo
kecik dengan pelarut etanol.
b. %IC adalah besaran aktivitas antioksidan ekstrak etanolik daun sawo kecik.
C. Bahan Penelitian
Bahan yang digunakan adalah daun sawo kecik, akuades, DPPH
(Aldrich), asam klorida, metanol teknis, metanol p.a. (E. Merck), pereaksi Mayer,
pereaksi Bouchardat, natrium sulfat anhidrat, pereaksi asam fosfomolibdat,
pereaksi Hager, ammonia, ammonium hidroksida, eter, kloroform, eter minyak
tanah, etanol, serbuk magnesium, serbuk seng, serbuk halus asam borat, serbuk
sulfat, etil asetat, asam askorbat (Brataco), aseton, formic acid, benzena, silica gel
60 GF-254 (E. Merck), dan asam asetat anhidrat.
D. Alat Penelitian
Alat yang digunakan adalah alat-alat gelas, neraca analitik, oven, blender,
maserator, corong Buchner, vacuum rotary evaporator, waterbath, alat pendingin
balik, lemari pendingin, lemari asam, pelat dan chamber KLT, vortex, stopwatch,
lampu UV, dan spektrofotometer UV-visibel (UV mini-1240 UV-Vis
Spectrophotometers Shimadzu).
E. Tata Cara Penelitian 1. Determinasi sawo kecik
Daun sawo kecik yang diperoleh dari pohon sawo kecik pada kompleks
Gereja Katolik Hati Kudus Tuhan Yesus, Ganjuran, Bantul diidentifikasi di
Laboratorium Kebun Tanaman Obat Universitas Sanata Dharma Yogyakarta.
2. Skrining fitokimia
a. Pembuatan serbuk simplisia. Daun sawo kecik dicuci dengan air
mengalir, diangin-anginkan, dikeringkan dengan oven pada suhu 40°C hingga
kering (mudah dihancurkan), dan dihaluskan dengan blender.
b. Uji alkaloid (Anonim, 1989). Serbuk simplisia ditimbang sebanyak 0,5
g ditambah 1 mL HCl 2 N dan 9 mL akuades, dipanaskan di atas waterbath
selama 2 menit. Campuran didinginkan dan disaring. Filtrat kemudian dibagi
1) Filtrat sebanyak 3 tetes ditambah 2 tetes pereaksi Mayer, akan terbentuk
endapan menggumpal berwarna putih atau kuning yang larut dalam metanol.
2) Filtrat sebanyak 3 tetes ditambah pereaksi Bouchardat, akan terbentuk endapan
berwarna coklat hingga hitam.
3) Jika terjadi endapan pada kedua percobaan, maka simplisia kemungkinan
mengandung alkaloid. Sebaliknya, jika tidak terjadi endapan pada kedua
percobaan, maka simplisia tidak mengandung alkaloid. Filtrat ke-3 digunakan
untuk prosedur berikutnya.
Sisa filtrat dikocok dengan 3 mL amonia pekat dan 10 mL campuran
eter:kloroform (3:1). Fase organik diambil, ditambah natrium sulfat anhidrat, dan
disaring. Filtrat diuapkan di atas waterbath dan residu yang diperoleh dilarutkan
dengan sedikit HCl 2 N. Larutan diuji dengan:
1) asam fosfomolibdat atau asam foswolframat
2) Bouchardat atau Wagner
3) Mayer atau Dragendorff atau Marme
4) Hager
Jika pada pengujian terdapat paling sedikit 2 golongan yang bereaksi,
maka simplisia positif mengandung alkaloid.
c. Uji saponin (Anonim, 1989). Sebanyak 0,5 g serbuk simplisia
dimasukkan dalam tabung reaksi, ditambah 10 mL akuades panas. Campuran
didinginkan dan dikocok kuat-kuat selama 10 detik. Saponin positif jika terbentuk
buih 1 – 10 cm, tidak kurang dari 10 menit dan tidak hilang pada penambahan
d. Uji tanin (Sutrisno, 1986; Odebiyi and Sofowora, 1978). Larutan besi
(III) ammonium sulfat 0,5 N diencerkan dengan air 5 kali volume awal. Larutan
tersebut diteteskan pada cuplikan simplisia. Tanin positif ditandai dengan warna
hijau atau biru sampai hitam. Metode lainnya adalah dengan memasukkan 0,5 g
ekstrak ke dalam 10 mL kalium hidroksida 10% yang dibuat baru dan dikocok
untuk melarutkan. Tanin positif ditandai dengan keberadaan endapan kotor.
e. Uji triterpenoid dan steroid (Harborne, 1998; Shah and Seth, 2010).
Serbuk simplisia (0,5 g) diekstraksi dengan etanol (dimaserasi dan difiltrasi),
dievaporasi hingga kering (dalam oven), dan diekstraksi dengan kloroform
(dengan perbandingan ekstrak : penyari (1:5)). Hasilnya disaring dengan kapas,
kemudian ditambah asam asetat anhidrat dan dilanjutkan dengan H2SO4 pekat.
Terbentuknya cincin ungu hingga biru pada batas kedua cairan menandakan
adanya triterpenoid atau steroid.
f. Uji flavonoid (Anonim, 1989). Sebanyak 0,5 g serbuk diekstraksi
dengan 10 mL metanol, menggunakan alat pendingin balik selama 10 menit.
Cairan panas disaring menggunakan kertas saring berlipat, kemudian filtrat
diencerkan dengan 10 mL air. Setelah dingin, larutan ditambah 5 mL eter minyak
tanah, dikocok hati-hati, dan didiamkan. Lapisan metanol (lapisan bawah)
diambil, diuapkan pada suhu 40°C di bawah tekanan. Residu hasil evaporasi
dilarutkan dalam 5 mL etil asetat dan disaring untuk mendapatkan larutan
percobaan:
1) Sebanyak 1 mL larutan percobaan diuapkan hingga kering (di atas waterbath),
serbuk seng dan 2 mL asam klorida 2N, dan didiamkan selama 1 menit.
Kemudian ditambahkan 10 tetes asam klorida pekat, jika dalam waktu 2 sampai 5
menit terjadi warna merah intensif, menunjukkan adanya flavonoid.
2) Sebanyak 1 mL larutan percobaan diuapkan hingga kering (di atas waterbath),
residunya dilarutkan dalam 1 mL etanol 95%, kemudian ditambahkan 0,1 g
serbuk magnesium dan 10 tetes HCl pekat. Jika terjadi warna merah jingga
sampai merah ungu menunjukkan flavonoid positif. Jika terjadi warna kuning
jingga, menunjukkan adanya flavon, kalkon, dan auron.
3) Sebanyak 1 mL larutan percobaan diuapkan hingga kering (di atas waterbath),
residunya dibasahkan dengan aseton, ditambah serbuk halus asam borat dan
serbuk halus asam oksalat, dan dipanaskan secara hati-hati di atas waterbath. Sisa
yang diperoleh dicampur dengan 10 mL eter dan diamati di bawah sinar UV 366
nm; larutan berfluorosensi kuning intensif menunjukkan adanya flavonoid.
3. Pembuatan ekstrak etanolik daun sawo kecik
Serbuk simplisia yang telah diblender dimasukkan dalam bejana
maserasi, ditambah etanol 70% hingga terendam sempurna dengan perbandingan
serbuk : cairan penyari (1:5), dan diaduk homogen. Kemudian campuran
dimaserasi pada suhu ruang selama 48 jam dengan kecepatan 140 rpm. Setelah
itu, dilakukan penyaringan dengan corong Buchner. Filtratnya yang disimpan
dalam lemari pendingin, sedangkan residunya diremaserasi dengan etanol 70%
sejumlah penyari awal selama 48 jam dengan kecepatan 140 rpm. Kemudian,
dilakukan penyaringan dengan corong Buchner dan diambil filtratnya. Filtrat
Buchner. Filtrat hasil penyaringan dievaporasi dengan vacuum rotary evaporator
dan oven hingga didapatkan ekstrak kering etanolik daun sawo kecik.
4. Uji kualitatif DPPH dengan kromatografi lapis tipis (KLT)
Fase diam yang digunakan adalah silica gel 60 GF-254. Fase gerak
dibuat 3 macam, yakni:
a. Etil asetat : metanol : akuades (40:5,4:4) [EMW] (polar/netral)
b. Kloroform : etil asetat : formic acid (5:4:1) [CEF] (semi-polar/asam)
c. Benzena : etanol : amonium hidroksida (90:10:1) [BEA] (non-polar/basa)
Sebanyak 1% larutan uji dan asam askorbat (baku) dalam metanol p.a.
dibuat. Setelah 3 chamber dijenuhkan dengan fase gerak yang berbeda, dilakukan
penotolan larutan uji (dengan 3 replikasi) dan larutan baku pada 3 pelat KLT
menggunakan pipa kapiler. Kemudian ketiga pelat tersebut dimasukkan ke dalam
ketiga chamber yang telah dijenuhkan untuk dielusi setinggi 10 cm. Setelah elusi
selesai pelat-pelat tersebut diangkat, dibiarkan mengering, dan disemprot dengan
larutan DPPH 0,2% pada lemari asam. Latar belakang pelat akan berwarna ungu
dan warna kuning pada bercak mencerminkan adanya aktivititas antioksidan.
Intensitas warna diamati selama 10 menit yang menandakan besarnya aktivitas
antioksidan.
5. Penentuan operating time (OT) ekstrak etanolik daun sawo kecik
Sebanyak 25 mg ekstrak dimasukkan dalam labu ukur 50 mL dan
ditambah metanol p.a. hingga tanda batas sebagai larutan stok (500 µg/mL).
Kemudian sebanyak 10 mL larutan stok diambil, dimasukkan dalam labu ukur 50
(100 µg/mL). Kemudian sebanyak 4, 6, dan 8 mL diambil dari larutan intermediet,
dimasukkan dalam labu ukur 100 mL, dan ditambah metanol p.a. hingga tanda
batas (4, 6, dan 8 µg/mL). Selain itu, sebanyak 3,9 mg DPPH dimasukkan dalam
labu ukur 100 mL dan ditambah metanol p.a. hingga tanda batas (DPPH 0,1 mM).
Sebanyak 5 mL dari masing-masing konsentrasi (4, 6, dan 8 µg/mL)
dimasukkan dalam tabung reaksi berbeda, ditambah larutan DPPH 0,1 mM
sebanyak 5 mL, di-vortex selama 30 detik, didiamkan selama 5, 10, 15, 20, 25, 30,
35, 40, 45, 50, 55, dan 60 menit, dan diukur dengan spektrofotometer visibel
dengan panjang gelombang teoretis 517 nm.
6. Penentuan operating time (OT) baku pembanding asam askorbat
Sebanyak 25 mg asam askorbat dimasukkan dalam labu ukur 50 mL dan
ditambah metanol p.a. hingga tanda batas sebagai larutan stok (500 µg/mL).
Kemudian sebanyak 10 mL larutan stok diambil, dimasukkan dalam labu ukur 50
mL, dan ditambah metanol p.a. hingga tanda batas sebagai larutan intermediet
(100 µg/mL). Kemudian sebanyak 2, 4, dan 6 mL diambil dari larutan intermediet,
dimasukkan dalam labu ukur 100 mL, dan ditambah metanol p.a. hingga tanda
batas (2, 4, dan 6 µg/mL). Selain itu, sebanyak 3,9 mg DPPH dimasukkan dalam
labu ukur 100 mL dan ditambah metanol p.a. hingga tanda batas (DPPH 0,1 mM).
Sebanyak 5 mL dari masing-masing konsentrasi (2, 4, dan 6 µg/mL)
dimasukkan dalam tabung reaksi berbeda, ditambah larutan DPPH 0,1 mM
sebanyak 5 mL, di-vortex selama 30 detik, didiamkan selama 5, 10, 15, 20, 25, 30,
35, 40, 45, 50, 55, dan 60 menit, dan diukur dengan spektrofotometer visibel
7. Penentuan panjang gelombang absorbansi maksimum (λmaks)
Sebanyak 3,9 mg DPPH dimasukkan dalam labu ukur 100 mL dan
ditambah metanol p.a. hingga tanda batas (DPPH 0,1 mM). Sebanyak 2,5 mL, 5
mL, dan 7,5 mL diambil dari DPPH 0,1mM, dimasukkan dalam labu ukur 10 mL,
dan ditambah metanol p.a. hingga tanda batas. Larutan di-vortex selama 30 detik
dan didiamkan selama Operating Time (OT). Kemudian dilakukan scanning
panjang gelombang maksimum (λmaks) dari 400 – 600 nm.
8. Uji kuantitatif DPPH dengan spektrofotometri visibel
a. Pengukuran absorbansi kontrol. Sebanyak 3,9 mg DPPH dimasukkan
dalam labu ukur 100 mL dan ditambah metanol p.a. hingga tanda batas (DPPH 0,1
mM). Kemudian, sebanyak 10 mL DPPH 0,1 mM dimasukkan dalam tabung
reaksi., di-vortex selama 30 detik, dan dibaca absorbansinya pada OT dan λmaks.
Dilakukan replikasi sebanyak 3 kali. Pengukuran ini digunakan sebagai kontrol
terhadap pengukuran absorbansi larutan pembanding asam askorbat dan larutan
uji ekstrak etanolik daun sawo kecik.
b. Pengukuran larutan pembanding asam askorbat dan larutan uji ekstrak
etanolik daun sawo kecik. Sebanyak 25 mg ekstrak dimasukkan dalam labu ukur
50 mL dan ditambah metanol p.a. hingga tanda batas sebagai larutan stok (500
µg/mL). Kemudian sebanyak 10 mL larutan stok diambil, dimasukkan dalam labu
ukur 50 mL, dan ditambah metanol p.a. hingga tanda batas sebagai larutan
intermediet (100 µg/mL). Kemudian sebanyak 4, 5, 6, 7, dan 8 mL diambil dari
larutan intermediet, dimasukkan dalam labu ukur 100 mL, dan ditambah metanol
Sebanyak 25 mg asam askorbat dimasukkan dalam labu ukur 50 mL dan
ditambah metanol p.a. hingga tanda batas sebagai larutan stok (500 µg/mL).
Kemudian sebanyak 10 mL larutan stok diambil, dimasukkan dalam labu ukur 50
mL, dan ditambah metanol p.a. hingga tanda batas sebagai larutan intermediet
(100 µg/mL). Kemudian sebanyak 2, 3, 4, 5, dan 6 mL diambil dari larutan
intermediet, dimasukkan dalam labu ukur 100 mL, dan ditambah metanol p.a.
hingga tanda batas (2, 3, 4, 5, dan 6 µg/mL). Selain itu, sebanyak 3,9 mg DPPH
dimasukkan dalam labu ukur 100 mL dan ditambah metanol p.a. hingga tanda
batas (DPPH 0,1 mM).
Sebanyak 5 mL dari masing-masing konsentrasi ekstrak (4, 5, 6, 7, dan 8
µg/mL) maupun asam askorbat (2, 3, 4, 5, dan 6 µg/mL) dimasukkan dalam
tabung reaksi berbeda, ditambah larutan DPPH 0,1 mM sebanyak 5 mL, di-vortex
selama 30 detik, didiamkan selama OT, dan dibaca pada spektrofotometer visibel
pada λmaks. Replikasi dilakukan sebanyak 3 kali.
c. Estimasi aktivitas antioksidan. Hasil prosedur 8 a dan 8 b dihitung
aktivitas antioksidannya dalam IC50.
F. Analisis Hasil 1. Determinasi sawo kecik
Identifikasi dilakukan untuk meyakinkan bahwa bahan uji yang
digunakan benar-benar daun sawo kecik sehingga menghindari kesalahan dalam
identifikasi berupa surat keterangan hasil identifikasi daun sawo kecik dari
laboratorium tersebut.
2. Skrining fitokimia
Skrining fitokimia dilakukan untuk mengetahui kandungan fitokimia
yang ada dalam daun sawo kecik. Hasil uji berupa perubahan warna atau endapan
yang terbentuk sesuai dengan pustaka acuan.
3. Uji kualitatif DPPH dengan kromatografi lapis tipis (KLT)
Pengujian ini dilakukan untuk mengetahui apakah ekstrak etanolik daun
sawo kecik dapat berfungsi sebagai antioksidan atau tidak. Hasilnya dinyatakan
dengan warna pada bercak setelah disemprot dengan pereaksi DPPH. Warna
kuning menunjukkan adanya aktivitas antioksidan.
4. Uji kuantitatif DPPH dengan spektrofotometri visibel
Pengujian kuantitatif DPPH akan menentukan seberapa besar aktivitas
antioksidan ekstrak etanolik daun sawo kecik yang ditetapkan dengan nilai IC50.
Data nilai IC50 diuji normalitas distribusinya dengan metode Shapiro-Wilk dan
dilanjutkan dengan uji parametrik (untuk distribusi normal) atau uji
non-parametrik (untuk distribusi tidak normal) untuk perbandingan nilai rata-rata IC50
ekstrak etanolik daun sawo kecik dengan nilai IC50 asam askorbat. Pengujian
26 BAB IV
HASIL DAN PEMBAHASAN A. Determinasi Sawo Kecik
Langkah pertama dalam penelitian adalah melakukan determinasi pada
tanaman guna mengetahui ketepatan identitas tanaman yang akan dipergunakan.
Kebenaran identitas tanaman digunakan untuk menghindari adanya kemungkinan
kesalahan dalam pengambilan sampel pada analisis fitokimia (Harborne, 1987).
Daun sawo kecik diperoleh dari Gereja Katolik Hati Kudus Tuhan Yesus,
Ganjuran, Bantul pada tanggal 3 Januari 2013 pada jam 10.00 WIB dan
dipreparasi sesuai tata cara penelitian. Hasil determinasi tanaman (lampiran 1)
menyatakan kebenaran tanaman yang diteliti, yakni Manilkara kauki (L.) Dubard
atau sawo kecik.
B. Hasil Skrining Fitokimia
Skrining fitokimia dilakukan untuk mengetahui kandungan fitokimia
yang ada dalam daun sawo kecik. Menurut Khare (2007), seluruh bagian tanaman
sawo kecik mengandung taraxerol (triterpenoid), triterpene ketone (triterpenoid),
α- dan β-amyrin (triterpenoid), sinamat (fenilpropanoid), α-spinasterol (steroid),
β-sitosterol (steroid), β-D-glukosida (glikosida), kuersitol (inositol), kuersetin dan
dihidroderivat kuersetin (flavonoid), dan asam ursolat (triterpenoid). Penulis
melakukan skrining fitokimia meliputi golongan alkaloid, flavonoid, saponin,
tanin, steroid dan triterpenoid, yang mengacu pada penelitian Mustikasari dan
menunjukkan bahwa daun sawo kecik mengandung tanin (berwarna hijau
kehitaman dengan penambahan besi (III) ammonium sulfat 0,5 N [Gambar 2a];
terdapat endapan kotor setelah dikocok dengan kalium hidroksida [Gambar 2b])
dan flavonoid (hasil positif kuning jingga, yang menandakan keberadaan flavon,
kalkon, atau auron, pada pemberian serbuk magnesium dan asam klorida [Gambar
4], hasil negatif pada kedua metode lainnya (warna abu-abu pada pemberian
serbuk seng dan asam klorida [Gambar 3]; warna hijau dengan pemberian asam
borat dan asam oksalat di bawah sinar UV 366 nm)), tetapi tidak mengandung
saponin (tidak timbul busa setelah dikocok) [Gambar 6], alkaloid (tidak ada
endapan pada penambahan Mayer atau Bouchardat) [Gambar 7 dan 8], steroid dan
triterponoid (cincin berwarna coklat) [Gambar 5]. Hasil ini sedikit berbeda dengan
yang telah disampaikan oleh Khare (2007). Adanya hasil positif pada tanin
memungkinkan adanya senyawa baru pada tanaman ini untuk diteliti lebih lanjut.
Ketidakadaan steroid dan triterpenoid pada pengujian dapat dikarenakan oksidasi
dari kedua asam (asam asetat anhidrat dan asam sulfat pekat) juga mengoksidasi
zat lain pada ekstrak yang jumlahnya lebih banyak daripada triterpenoid dan
[image:44.595.102.518.294.744.2]steroid.
Tabel II. Hasil skrining fitokimia
Uji Reagen
Hasil Positif Menurut
Acuan
Hasil
Pengujian Gambar
Tanin (Metode Sutrisno) Besi (III) ammonium sulfat Hijau atau biru sampai hitam Hijau sampai
hitam 2 (a)
Tanin (Metode Odebiyi dan Sofowora) Kalium hidroksida Adanya endapan kotor Terdapat
Flavonoid Serbuk seng, asam klorida
Merah intensif dalam
2-5 menit
Abu-abu 3
Flavonoid
Serbuk magnesium, asam klorida
Kuning jingga Kuning jingga 4
Flavonoid Aseton, asam borat, asam oksalat, eter Fluoresensi kuning intensif Fluoresensi
hijau N/A
Triterpenoid/Steroid Asam asetat anhidrat, asam sulfat Terbentuk cincin ungu hingga biru pada batas kedua cairan Terbentuk
cincin coklat 5
Saponin Akuades panas
Terbentuk buih 1-10 cm
Tidak ditemukan
buih
6
Alkaloid Mayer
Terbentuk endapan putih atau kuning yang larut dalam metanol Tidak terbentuk endapan 7
Alkaloid Bouchardat
(a) (b)
Gambar 2. (a) Uji tanin dengan metode Sutrisno (1986); (b) Uji tanin dengan metode Odebiyi dan Sofowora (1978)
Gambar 3. Uji flavonoid dengan serbuk seng dan asam klorida
[image:46.595.98.496.103.657.2]Gambar 5. Uji triterpenoid/steroid
Gambar 7. Uji alkaloid dengan reagen Mayer
Gambar 8. Uji alkaloid dengan reagen Bouchardat
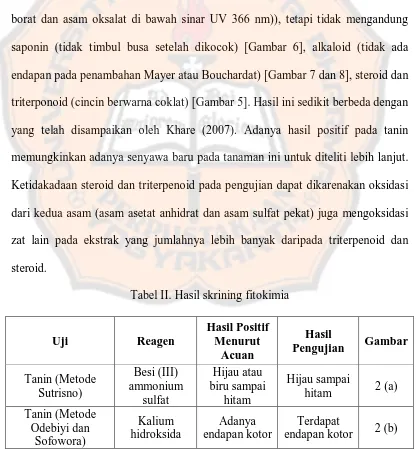
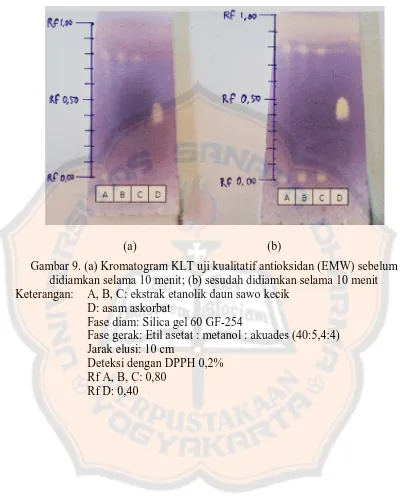
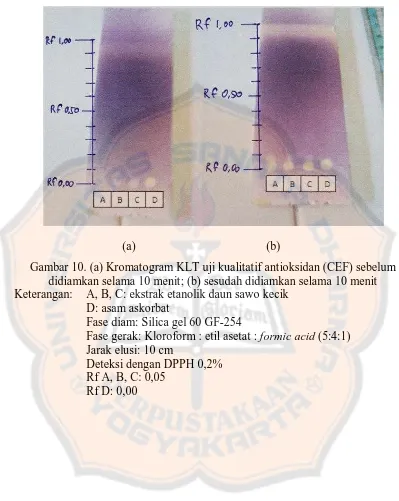
C. Hasil Uji Kualitatif DPPH dengan KLT
Pengujian kualitatif DPPH dilakukan untuk mengetahui apakah senyawa
dalam ekstrak etanolik daun sawo kecik memiliki aktivitas antioksidan atau tidak.
Untuk pengujian secara kualitatif, pengujian antioksidan dengan metode DPPH
dengan reagen DPPH 0,2% dalam metanol (Masoko and Eloff, 2007). Hasil
positif ditunjukkan apabila timbul bercak berwarna kuning dan jika intensitasnya
tidak memudar dalam waktu 10 menit menandakan aktivitas antioksidan yang
cukup tinggi. Hasil dari penelitian menunjukkan bahwa pemisahan terbaik ekstrak
daun sawo kecik ditunjukkan pada fase gerak polar/netral (EMW) dengan nilai Rf
0,80 (Gambar 9), pemisahan kurang baik pada fase gerak semi-polar/asam (CEF)
dengan nilai Rf 0,05 (Gambar 10), dan tidak terjadi pemisahan fase gerak
non-polar/basa (BEA) atau nilai Rf 0,00 (Gambar 11). Zat yang digunakan sebagai
pembanding (kontrol positif) adalah asam askorbat. Hasil dari penelitian
menunjukkan bahwa asam askorbat hanya menunjukkan pemisahan pada fase
gerak polar/netral (EMW) dengan Rf 0,40 (Gambar 9). Asam askorbat dapat
terelusi sempurna karena merupakan zat murni. Pada gambar, didapatkan hasil
bahwa senyawa uji ekstrak etanolik daun sawo kecik dan senyawa pembanding
asam askorbat mempunyai aktivitas antioksidan. Hal ini ditandai dengan adanya
perubahan warna dari ungu menjadi kuning pada bercak-bercak.
Baik ekstrak etanolik daun sawo kecik maupun asam askorbat mengalami
peningkatan intensitas setelah 2 menit dan tidak memudar selama 10 menit. Hal
ini menggambarkan kemungkinan bahwa ekstrak etanolik daun sawo kecik
maupun asam askorbat merupakan antioksidan dengan kekuatan yang cukup
(a) (b)
Gambar 9. (a) Kromatogram KLT uji kualitatif antioksidan (EMW) sebelum didiamkan selama 10 menit; (b) sesudah didiamkan selama 10 menit Keterangan: A, B, C: ekstrak etanolik daun sawo kecik
D: asam askorbat
Fase diam: Silica gel 60 GF-254
Fase gerak: Etil asetat : metanol : akuades (40:5,4:4) Jarak elusi: 10 cm
Deteksi dengan DPPH 0,2% Rf A, B, C: 0,80
[image:50.595.98.498.108.604.2](a) (b)
Gambar 10. (a) Kromatogram KLT uji kualitatif antioksidan (CEF) sebelum didiamkan selama 10 menit; (b) sesudah didiamkan selama 10 menit Keterangan: A, B, C: ekstrak etanolik daun sawo kecik
D: asam askorbat
Fase diam: Silica gel 60 GF-254
Fase gerak: Kloroform : etil asetat : formic acid (5:4:1) Jarak elusi: 10 cm
Deteksi dengan DPPH 0,2% Rf A, B, C: 0,05
[image:51.595.99.498.108.609.2]Gambar 11. Kromatogram KLT uji kualitatif antioksidan (BEA) sesudah didiamkan selama 10 menit
Keterangan: A, B, C: ekstrak etanolik daun sawo kecik D: asam askobat
Fase diam: Silica gel 60 GF-254
Fase gerak: Benzena : etanol : amonium hidroksida (90:10:1) Jarak elusi: 10 cm
Deteksi dengan DPPH 0,2% Rf A, B, C, D: 0,00
D. Hasil Uji Kuantitatif DPPH
Berdasarkan berbagai jurnal acuan, panjang gelombang yang dapat
digunakan sebagai working wavelength adalah 515-520 nm. Operating Time (OT)
yang optimal adalah 30 menit, namun dapat digunakan waktu yang lebih singkat
(5 atau 10 menit) pada jenis substrat yang berbeda. Sehingga pemilihan OT
tergantung pada hasil optimasi (Molyneux, 2004). Hasil optimasi OT dan λmaks
yang didapat pada penelitian adalah 30 menit dan 515 nm (Lampiran 3) yang
mana sesuai dengan pernyataan Molyneux (2004). Scanning terhadap metanol
bahwa penggunaan metanol tidak memberikan serapan supaya tidak mengganggu
hasil dari pembacaan absorbansi.
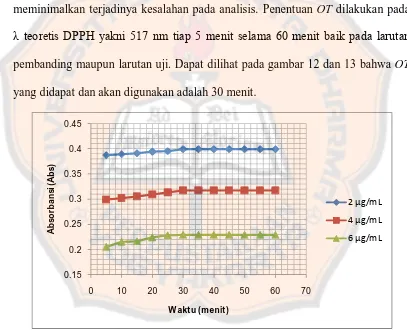
Optimasi OT (Operating Time) dilakukan untuk menetapkan waktu
ketika larutan pembanding maupun larutan uji telah mereduksi radikal DPPH
dengan sempurna (reaksi telah berjalan sempurna) sehingga dapat diperoleh
absorbansi yang stabil. Absorbansi yang stabil memastikan reprodusibilitas dan
meminimalkan terjadinya kesalahan pada analisis. Penentuan OT dilakukan pada
λ teoretis DPPH yakni 517 nm tiap 5 menit selama 60 menit baik pada larutan
pembanding maupun larutan uji. Dapat dilihat pada gambar 12 dan 13 bahwa OT
[image:53.595.100.507.277.607.2]yang didapat dan akan digunakan adalah 30 menit.
Gambar 12. Grafik optimasi OT asam askorbat
0.15 0.2 0.25 0.3 0.35 0.4 0.45
0 10 20 30 40 50 60 70
A b s o rb a n si ( A b s )
W aktu (menit)
Gambar 13. Grafik optimasi OT ekstrak etanolik daun sawo kecik
Optimasi λmaks dilakukan untuk mengetahui panjang gelombang yang
dapat memberikan serapan tertinggi dengan sensitivitas tertinggi (terdapat
perbedaan absorbansi dengan sedikit perbedaan konsentrasi). Dilakukan pada 3
jenis konsentrasi untuk memastikan bahwa pada konsentrasi manapun tetap akan
memberikan serapan tertinggi yang konstan. Optimasi λmaks dilakukan pada hasil
OT yang telah dilakukan sebelumnya (30 menit). Panjang gelombang yang
didapat adalah 515 nm (gambar 14).
Gambar 14. Optimasi λmaks DPPH pada 3 jenis konsentrasi
(A: 2,5 µg/mL, B: 5 µg/mL, dan 7,5 µg/mL)
0.3 0.35 0.4 0.45 0.5
0 10 20 30 40 50 60 70
A b s o rb a n si ( A b s )
W aktu (menit)
Hasil dari optimasi OT dan λmaks digunakan untuk pengukuran aktivitas
antioksidan. Sebelum melakukan pengukuran aktivitas antioksidan, perlu
dilakukan pengukuran pada pelarut yang digunakan sebagai kontol negatif. Dalam
hal ini pelarut yang digunakan adalah metanol. Hasil scanning pelarut metanol
menunjukkan tidak adanya serapan (Lampiran 4).
Untuk mendapatkan nilai IC50 yang menggambarkan aktivitas
antioksidan, dilakukan pengukuran dengan 5 konsentrasi uji yang berbeda yang
kemudian ditetapkan % IC dari tiap-tiap konsentrasi. Setelah dilakukan
perhitungan % IC, dilakukan perhitungan regresi linier antara konsentrasi larutan
uji/pembanding dengan % IC. Pada kurva persamaan regresi linier asam askorbat
didapatkan persamaan y = 6,584x + 30,846 (replikasi 1) dengan nilai r terbaik
yakni 0,9947. Sedangkan pada kurva persamaan regresi linier ekstrak etanolik
daun sawo kecik didapatkan persamaan y = 3,168x + 34,046 (replikasi 1) dengan
[image:55.595.100.511.189.727.2]nilai r terbaik yakni 0,9944.
Gambar 15. Kurva persamaan regresi linier asam askorbat
y = 6,584x + 30,846 r = 0,9947
30 35 40 45 50 55 60 65 70 75
0 2 4 6 8 10
%
I
C
Gambar 16. Kurva persamaan regresi linier ekstrak etanolik daun sawo kecik
Dari lampiran 5, sub-bagian 4 didapatkan bahwa IC50 asam askorbat
adalah 3,03±0,15 µg/mL, sedangkan IC50 ekstrak etanolik daun sawo kecik adalah
5,00±0,04 µg/mL. Dari data tersebut dapat disimpulkan bahwa keduanya
merupakan antioksidan sangat aktif (< 50 µg/mL) menurut penggolongan Jun et
al. (2003).
Guna memastikan ada atau tidaknya perbedaan yang bermakna antara
IC50 asam askorbat dengan IC50 ekstrak etanolik daun sawo kecik, maka
digunakanlah pengujian secara statistik. Oleh karena jumlah data yang kecil
(kurang dari 50 data), maka digunakan metode Shapiro-Wilk untuk pengujian
normalitas. Setelah itu dilanjutkan dengan uji parametrik (untuk data dengan
distribusi normal) atau non-parametrik (untuk data dengan distribusi tidak
normal). Hasil uji normalitas menunjukkan bahwa baik asam askorbat maupun
ekstrak etanolik daun sawo kecik mengikuti distribusi normal karena p-value dari
y = 3,168x + 34,046 r = 0,9944
40 45 50 55 60 65
0 2 4 6 8 10
%
IC
keduanya lebih dari 0,05 (p-value asam askorbat 0,1623; p-value ekstrak etanolik
daun sawo kecik 0,8428). Oleh karena hasil uji normalitas menunjukkan keduanya
mengikuti distribusi normal, maka digunakan uji parametrik yakni uji T tidak
berpasangan. Uji ini dilakukan karena kedua sampel berdiri secara individu dan
tidak saling bergantung satu sama lainnya. Pada uji ini nilai H0 (Hipotesis nol)
adalah IC50 asam askorbat yang tidak lebih kecil daripada IC50 ekstrak etanolik
daun sawo kecik, sedangkan nilai H1 (Hipotesis alternatif) adalah nilai IC50 asam
askorbat yang lebih kecil daripada IC50 ekstrak etanolik daun sawo kecik. Hasil
pengujian statistik menunjukkan p-value sebesar 4,58x10-5 yang lebih kecil
dibanding p-value yang ditentukan yakni 0,05. Oleh karena itu, H0 ditolak karena
nilai signifikansi yang didapat di bawah nilai signifikansi yang ditentukan,
sehingga dapat disimpulkan bahwa IC50 asam askorbat lebih rendah dibanding
41 BAB V
KESIMPULAN DAN SARAN A. Kesimpulan
1. Daun sawo kecik memiliki aktivitas antioksidan.
2. Nilai IC50 ekstrak etanolik daun sawo kecik sebesar 5,00±0,04 µg/mL (aktivitas
antioksidan sangat aktif) pada pengujian dengan menggunakan DPPH.
B. Saran
Perlu dilakukan isolasi lebih lanjut pada bercak kromatogram KLT pada
uji antioksidan kualitatif untuk mengetahui kandungan fitokimia yang paling
DAFTAR PUSTAKA
Anonim, 1989, Materia Medika Indonesia, Jilid V, Departemen Kesehatan, Jakarta, hal. 549, 552-553.
Anonim, 1995, Farmakope Indonesia, Edisi IV, Departemen Kesehatan, Jakarta, hal. 7.
Anonim, 2000, Parameter Standar Umum Ekstrak Tumbuhan Obat, Departemen Kesehatan, Jakarta, hal. 10-11.
Anonim, 2010, Australian Tropical Rainforest Plants, http://keys.trin.org.au/key-
server/data/0e0f0504-0103-430d-8004-060d07080d04/media/Html/taxon/Manilkara_kauki.htm, diakses tanggal 22 Maret 2013.
Anonim, 2011, Flora Identitas Kabupaten/Kota di Provinsi Daerah Istimewa
Yogyakarta, http://bk.menlh.go.id/florafauna/12diy/_12diy_flora.htm, diakses tanggal 19 Oktober 2012.
Belleville-Nabet, F., 1996, Zat Gizi Antioksidan Penangkal Senyawa Radikal Pangan dalam Sistem Biologis, Prosiding Seminar Senyawa Radikal dan
Sistem Pangan: Reaksi Biomolekuler, Dampak terhadap Kesehatan dan Penangkalan, CFNS, IPB dan Kedutaan Besar Perancis, Jakarta.
Bhat, N., Shivaprakasan, M.L., and Jayarajan, R., 1994, Antifungal activity of some plant extracts, Indian J For, 17, 10-14.
Carter, J.W., Madl, R., and Padula, F., 2006, Wheat antioxidants suppress intestinal tumor activity in Min mice, Nutrition Research, Volume 26, Issue 1, 33-38.
Chawda, H.S., 2011, Prospective Study of Antioxidants, Its Mechanism and Potential Role in Cancer, International Journal of Research in
Pharmaceutical and Biomedical Sciences, Vol 2 (3), 888-894.
Dehpour, A.A., Ebrahimzadeh, M.A., Fazel, N.S., and Mohammad, N.S., 2009, Antioxidant activity of the methanol extract of Ferula assafoetida and its essential oil composition, Grasas Y Aceites, 60 (4), 405-412.
Duke, J.A., 2012, Dr. Duke’s Phytochemical and Ethnobotanical Databases,
http://www.ars-grin.gov/cgi-bin/duke/ethnobot.pl?ethnobot.taxon=Manilkara%20kauki, diakses tanggal 19 Oktober 2012.
Gulcin, I., Uguz, M.T., Oktay, M., Beydemir, S., and Kufrevioglu, O.I., 2004, Evaluation of the Antioxidant and Antimicrobial Activities of Clary Sage (Salvia sclarea L.), Turk. J. Agric. For., 28, 25-33.
Harborne, J.B., 1987, Metode Fitokimia: Penuntun Cara Modern Menganalisis
Tumbuhan, Penerbit ITB, Bandung, hal. 6.
Harborne, J.B., 1998, Phytochemical Methods: A Guide to Modern Technique of
Plant Analysis, Chapman & Hall, London, pp. 129.
Jun, M.H.Y., Yu, J., Fong, X., Wan, C.S., Yang, C.T., and Ho, 2003, Comparison of antioxidant activities of isoflavones from kudzu roots (Pueraria labata Ohwl), J. Food Sci., Institute of Technologist, 68, 2117-2122.
Khare, C.P., 2007, Indian Medicinal Plants: An Illustrated Dictionary, Springer-Verlag, New Delhi, pp. 397-398.
Marxen, K., Vanselow, K.H., Lippemeier, S., Hintze, R., Ruser, A., and Hansen, U., 2007, Determination of DPPH Radical Oxidation Caused by Methanolic Extracts of Some Microalgal Species by Linear Regression Analysis of Spectrophotometric Measurements, Sensors, Vol. 7, 2080-2095.
Masoko, P., and Eloff, J.N., 2007, Screening of Twenty-Four South African
Combretum and Six Terminalia Species (Combretaceae) for Antioxidant
Activities, Afr J Trad CAM, 4 (2), 231-239.
Mathias-Mundy, E., and Murdiati, T.B., 1991, Traditional Veterinary Medicine
for Small Ruminants in Java, Indonesian Small Ruminant Network,
Bogor, pp. 4.
Mbata, T.I., 2010, Antioxidant Nutrients: Beneficial or Harmful, Internet Journal
of Food Safety V, 7, 29-33.
Molyneux, P., 2004, The use of the stable free radical diphenylpicrylhydrazyl (DPPH) for estimating antioxidant activity, Songklanakarin J. Sci.
Technol., 26 (2), 211-219.
Mulja, M., dan Suherman, 1995, Analisis Instrumental, Airlangga University Press, Surabaya, hal. 224-228.
Mustikasari, K., dan Ariyani, D., 2010, Skrining Fitokimia Ekstrak Metanol Biji Kalangkala (Litsea angulata), Sains dan Terapan Kimia, Vol. 4, No. 2, 131-136.
Odebiyi, O.O., and Sofowora, E.A., 1978, Phytochemical screening of Nigerian medicinal plants II, Lloydia, 41(3), 234-246.
Sarker, S.D., Latif, Z., and Grey, A.I., 2006, Natural Products Isolation, Second Edition, Humana Press, Inc., New Jersey, pp. 20.
Savatovic, S.M., Cetkovic, G.S., Canadanovic-Brunet, J.M., and Djilas, S.M., 2012, Kinetic behaviour of the DPPH radical-scavenging activity of tomato waste extracts, J. Serb. Chem. Soc., 77(0), 1-12.
Shah, B., and Seth, A., 2010, Textbook of Pharmacognosy and Phytochemistry, Elsevier, Chennai, pp. 239-240.
Shivaprasad, H.N., Mohan, S., Kharya, M.D., Shiradkar, M.R., and Lakshman, K., 2005, In-Vitro Models for Antioxidant Activity Evaluation: A Review,
Pharmainfo Net, 3 (4), 1-11.
Sing, Y.Y., 2007, Determination of Synthetic Phenolic Antioxidants in Food Items Using HPLC and Total Antioxidants Using Fia Approaches,
Thesis, 3-5, Universiti Sains Malaysia, Penang.
Supari, F., 1996, Radikal Bebas dan Patofisiologi Beberapa Penyakit, Prosiding
Seminar Senyawa Radikal Bebas dan Sistem Pangan: Reaksi Biomolekuler, Dampak terhadap Kesehatan dan Penangkalan, Pusat
Susmiati, W., 2010, Isolasi dan Penentuan Aktivitas Antidiabet Fraksi Diklorometan Daun Salam (Syzigium polyantum) Asal Nusa Tenggara Barat (NTB), Skripsi, 32, Universitas Pendidikan Indonesia, Bandung. Sutrisno, R.B., 1986, Analisis Jamu, Penerbit Fakultas Farmasi Universitas
Pancasila, Jakarta, hal. 113.
Timm, M., 2000, α-Tocopherol in Meat and Meat Products: Influence of Feeding
on α-Tocopherol Concentration, Quality Attributes and Storage Stability,
Dissertation, 83.
Vareltzis, K., Koufidis, D., Gavriilidou, E., Papavergou, E., and Vasiliadou, S., 1997, Effectiveness of a natural Rosemary (Rosmarinus officinalis) extract on the stability of filleted and minced fish during frozen storage,
Zeitschrift für Lebensmitteluntersuchung und -Forschung A, 205 (2),
93-96.
Winarsi, H., 2007, Antioksidan Alami dan Radikal Bebas, Penerbit Kanisius, Yogyakarta, hal. 12-17, 26-28, 77-78, 260.
Yatim, W., 2007, Kamus Biologi, Yayasan Obor Indonesia, Jakarta, hal. 369. Yuzammi, Witono, J.R., Hidayat, S., Handayani, T., Sugiarti, Mursidawati, S.,
LAMPIRAN
Lampiran 3. Optimasi uji kuantitatif antioksidan 1. Penentuan Operating Time (OT)
Waktu (menit)
Konsentrasi asam
askorbat (µg/mL) Konsentrasi ekstrak etanolik daun sawo kecik (µg/mL)
2 4 6 4 6 8
5 0,387 0,299 0,205 0,457 0,438 0,350
10 0,389 0,302 0,215 0,455 0,431 0,345
15 0,391 0,305 0,216 0,453 0,427 0,339
20 0,394 0,309 0,224 0,451 0,426 0,335
25 0,395 0,313 0,228 0,451 0,425 0,333
30 0,399 0,317 0,229 0,449 0,424 0,332
35 0,399 0,317 0,229 0,449 0,424 0,332
40 0,399 0,317 0,229 0,449 0,424 0,332
45 0,399 0,317 0,229 0,449 0,424 0,332
50 0,399 0,317 0,229 0,449 0,424 0,332
55 0,399 0,317 0,229 0,449 0,424 0,332
60 0,399 0,317 0,229 0,449 0,424 0,332
2. Penentuan λmaks
a. Spektra DPPH 0,1 mM (2,5 mL) dengan metanol (7,5 mL)
b. Spektra DPPH 0,1 mM (5 mL) dengan metanol (5 mL)
Keterangan: Diperoleh λmaks = 515 nm
c. Spektra DPPH 0,1 mM (7,5 mL) dengan metanol (2,5 mL)
Lampiran 4. Scann