(TSL 641)
Bakteri Penambat Nitrogen Bebas (
Azotobacter
) dan
Cendawan Penghasil Antibiotik (
Penicillium)
KELOMPOK III : Deni Pratama (A154130141) Herlina Puji Cahya Lestari (A154130081)
Ricky Trinanda (A154130021) Winda Ika Susanti (A154130091)
PROGRAM STUDI BIOTEKNOLOGI TANAH DAN LINGKUNGAN SEKOLAH PASCASARJANA
DAFTAR ISI
DAFTAR TABEL
Halaman 1. Jumlah kloni Azotobacter sp. pada masing – masing
sampel tanah dari rizosfer alang – alang ... 11
2. Uji Patogenitas Azotobacter pada tanaman tembakau ... 12
3. Pertumbuhan benih padi yang diinokulasikan Azotobacter sp.
dan yang tidak diinokulasikan Azotobacter sp. ... 13
DAFTAR GAMBAR
Halaman
1. Koloni Azotobacter sp. pada media NFM ... 11
2. Grafik Pertumbuhan Azotobacter sp. ... 12
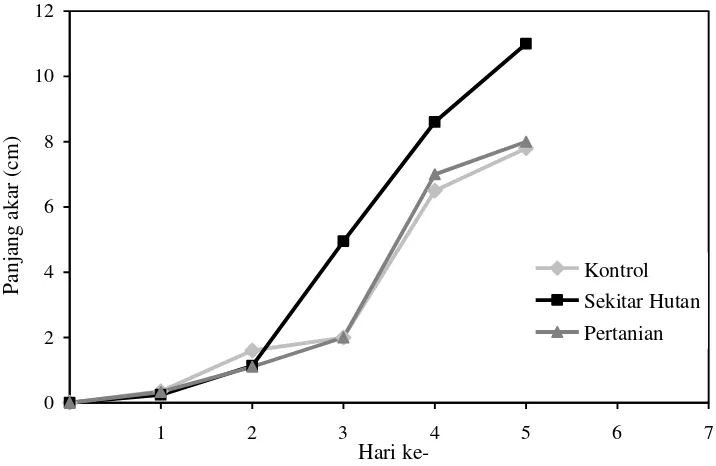
3. Grafik Pertumbuhan Tinggi kecambah Padi ... 14
4. Grafik Pertumbuhan Panjang akar Padi ... 14
5. Koloni Penicillium digitatum ... 15
10. Kenampakan Mikroskopis, a)Azotobacter sp., b)Penicillium digitatum ... 25
11. a) Injeksi isolat Azotobacter sp. pada daun tembakau, b) hasil injeksi Azotobacter sp. yang berasal dari tanah disekitar hutan pada daun tembakau umur 0 hari, c) hasil injeksi Azotobacter sp. yang berasal dari tanah pertanian pada daun tembakau umur 0 hari ... 26
12. a) Injeksi isolat Azotobacter sp. pada daun tembakau, b) hasil injeksi Azotobacter sp. yang berasal dari tanah disekitar hutan pada daun tembakau umur 3 hari setelah aplikasi, c) hasil injeksi Azotobacter sp. yang berasal dari tanah pertanian pada daun tembakau umur 3 hari setelah aplikasi ... 26
DAFTAR LAMPIRAN
Halaman 1. Sampel Tanah yang akan Diisolasi ... 23
2. Teknik Isolasi Azotobacter dan Penicillium ... 24
3. Penicillium dan Azotobacter yang berhasil dikulturkan ... 25 4. Penampakan Mikroskopis Azotobacter dan Penicillium digitatum
pada Pembesaran 1000x ... 25
5. Aplikasi Azotobacter sp. pada daun tembakau untuk uji patogenitas ... 26
I.
PENDAHULUAN
1.1. Latar Belakang
Tanah merupakan faktor lingkungan yang penting, sebab selain mempunyai hubungan timbal balik dengan tanaman yang tumbuh di atasnya, tanah juga memiliki hubungan timbal balik dengan mikroba tanah yang ada di dalamnya. Tanah umumnya mengandung berbagai unsur hara yang diperlukan oleh tanaman, tetapi kandungan hara pada lahan pertanian
semakin lama semakin berkurang karena terserap oleh tanaman untuk memenuhi kebutuhan pertumbuhannya (Sutejo et al. 1991 dalam Mujiyati dan Supriyadi 2009)
Tanah berperanan dalam siklus mineral terutama siklus nitrogen, fosfor, sulfur dan siklus karbon. Bakteri yang berperanan dalam siklus nitrogen salah satunya adalah Azotobacter. Bakteri ini bersifat non-simbiosis yang mampu mengikat Nitrogen bebas dari udara dan hidup di daerah rizhospere yang bersifat heterotrofik. Bakteri ini berfungsi sebagai pengikat N2 bebas yang mempunyai pengaruh terhadap sifat fisik dan
kimia tanah sehingga mampu meningkatkan kesuburan tanah. Populasi bakteri nitrifikasi dalam tanah akan mempengaruhi rasio konsentrasi nitrogen dalam tanah, sehingga populasi mikroba merupakan indikator tingkat kesuburan tanah (Allen dan Allen 1981).
Azotobacter merupakan bakteri yang berman faat bagi tanaman karena berdasarkan penelitian Wedhastri (2002) menyebutkan bahwa beberapa strain hasil isolasi dan seleksi mikroba penambat N non simbiotik yaitu Azotobacter pada tanah masam, yang merupakan spesies A. chroococcum mempunyai kemampuan dalam menambat nitrogen dari
udara, dan juga sebagai penghasil zat pengatur tumbuh.
Telah diketahui bahwa cendawan Penicillium adalah cendawan yang dapat menghasilkan zat antibiotic yang dinamai penisilin. Penicillium dapat menghasilkan zat antibiotik yang dapat menghambat pertumbuhan mikroba kain. Cendawan Penicillium ini telah banyak digunakan dalam bidang pertanian khususnya sebagai agen hayati untuk menghambat pertumbuhan patogen padaa tanaman.
Penelitian Soenartiningsih (2010) membuktikan bahwa cendawan dari genus Penicillium dapat menghambat Perkembangan Cendawan Rhizoctonia solani pada Jagung Secara Invitro. Selain itu, penelitian yang dilakukan oleh Hardaningsih (2011) menyebutkan bahwa cendawan dari genus Penicillium juga mampu menghambat pertumbuhan dari cendawan pathogen Sclerotium rolfsii.
Adanya potensi mikroba tanah yang berguna seperti bakteri penambat nitrogen bebas dari udara yaitu Azotobacter, dan cendawan pnghasil antibiotic yaitu Penicillium. Diperlukanlah usaha untuk mengembangkan dan mengetahui lebih lanjut sifat dari mikroba tersebut
untuk dapat lebih mengoptimalkan manfaat dari mikroba tersebut.
1.2. Rumusan Masalah
1. Bagaimanakah teknik isolasi Azotobacter di Laboratorium ?
2. Apa pengaruh pemberian inokulasi Azotobacter terhadap perkecambahan benih kacang hijau ?
3. Bagaimanakah teknik isolasi Penicillium di Laboratorium ?
4. Bagaimana pengaruh Penicillium sebagai agen antimikroba dalam menghambat pertumbuhan mikroba lain ?
1.3. Tujuan
1. Mengetahui teknik isolasi Azotobacter di Laboratorium.
2. Mengetahui pengaruh pemberian inokulasi Azotobacter terhadap perkecambahan benih kacang hijau.
3. Mengetahui teknik isolasi Penicillium di Laboratorium.
II.
TINJAUAN PUSTAKA
2.1. Morfologi dan Fisiologi Azotobacter
Azotobacter sp. merupakan bakteri non-simbiotik yang rmasuk dalam famili Azotobacteriaceae. Yang paling banyak diketahu adalah bakteri Azotobacter terdiri dari empat spesies, yaitu A. crhoococcum, A. beijerinkii, A. vinelandii dan A. paspali (Hamdi 1982).
Azotobacter dicirikan dengan sel berbentuk batang, gram negatif, bersifat aerobik obligat dan mempunyai ukuran sel yang lepih panjang dari prokariot lainnya dengan diameter sel 2 – 4 μm atau lebih. Beberapa strain motil dengan flagel peritrikha. Pada media yang mengandung karbohidrat, bekteri ini membentuk kapsul yang berfungsi melindunginya dari lingkungan luar. Selain itu bakteri ini juga memiliki struktur khusus yang disebut kista. Kista ini bersifat seperti endospora, yakni tubuh berdinding tebal, sangat reaktif dan resisten, tahan terhadap proses pengeringan,
pemecahan mekanik, ultraviolet dan radiasi ionik (Brock et al. 1994 dalam Nurhayati 2006).
Suhu optimum bagi pertumbuhan Azotobacter chroococum adalah 300C, jumlahnya dapat mencapai beberapa ratus per g-tanah. Walaupun penyebaran populasi bakteri ini tidak begitu luas, namun spesies ini merupakan kontributor penting bagi penambatan nitrogen. A. beijerinckii lebih dominan pada tanah masam, dengan pH di bawah 3,0. Penyebaran spesies ini cukup luas, banyak ditemukan di tanah tropik bahkan juga ditemukan pada daerah tempera dan antartik. Demikian pula Derxia gummosa yang banyak ditemukan di wilayah tropis Amerika Utara, mampu tumbuh dengan baik pada pH 4,5 - 6,5 (Tate 2000).
2.2. Keunggulan Bakteri Azotobacter
Genus Azotobacter tumbuh dengan baik pada kondisi NH3 juga
Azotobacter melakukan respirasi tingngi untuk melindungi nitrogenase dari O2 sehingga konsentrasi O2 intraseluler pada Azotobacter relatif lebih
sedikit (Brock et al. 1994 dalam Nurhayati 2006).
Selain itu Brock et al. (1994) dalam Nurhayati 2006 kembali mengemukakan bahwa Azotobacter chroococum mampu tumbuh dan mereduksi N2 tanpa kehadiran molibdenum yang berfungsi dalam
pembentukan nitrogenase. Jika bakteri ini ditempatkan pada media yang kekurangan amonia dan molibdenum tetapi mengandung logam vanadium, maka bakteri ini akan menghasilkan vanadium nitrogenase menggantikan posisi molibdenum yang berfungsi menstimulasi pengikatan nitrogen. Seperti pada enzim molibdenum, vanadium nitrogenase juga terdiri dari dua protein, pertama protein yang mengandung besi, kedua protein yang mengandung besi dan vanadium yang dapat mereduksi N2 menjadi NH3,
H+ menjadi H2 dan H2C2 menjadi C2H4. Namun kemampuan reduksi
vanadium nitrogenase lebih lambat bila dibanding enzim molibdenum. Salisbury dan Ross (1995) menyebutkan bahwa penambatan
nitrogen adalah reaksi reduksi N2 menjadi NH4+, dan diketahu sejauh ini
bahwa reaksi ini hanya dapat dilakukan oleh mikroorganisme prokariot. Reaksi keseluruhan penambatan N adalah sebagai berikut:
N2 + 8e + 16ATP + H2O → 2NH3 + H2 + 16ATP + 16pi + 8H
Rao (1994) juga menambahkan bahwa dalam reaksi ini juga diperlukan enzim nitrogenase yang berfungsi sebagai katalisator. Nitrogenase terdiri dari dua protein, yakni protein Fe dan protein Fe-Mo. Protein Fe mempunyai 4 atom besi di kelompok Fe4S4 , sedangkan protein
Fe-Mo mengandung 2 atom molybdenum dan 28 atom besi.
2.3. Pemanfaatan Azotobacter di Bidang Pertanian
Kemampuan Azotobacter dalam menambat nitrogen bebas dari udara dimanfaatkan manusia dibidang pertanian dengan cara membuat pupuk hayati (Biofertilizer) yang agen hayati didalamnya adalah Azotobacter. Penelitian yang dilakukan oleh Hamastuti et al. (2012) mengemukakan bahwa mikroorganisme Azotobacter chroococcum yang dibuat menjadi pupuk hayati dapat meningkatkan kadar nitrogen hingga 500% dan juga meningkatkan pertumbuhan tinggi tanaman terong 12,2% dan cabai 21,6% serta kapasitas panen terong 44,2 gram/tanaman dan cabai 11 gram/tanaman.
2.4. Penicillium dan Kemampuannya dalam Menghasilkan Zat Antimikroba
Cendawan Penicillium masuk dalam kelompok Deuteromycetes dan masuk pada kelas Trichocomaceae. Penicillium merupakan fungi imperfect atau tidak sempurna karena tidak memiliki fase seksual yang jelas. Morfologi khas dari kelas ini adalah struktur reproduksi berupa konidia. Penicillium banyak terdapat ditanah, dan beberapa terdapat di berbagai medium seperti makanan, tumbuhan, dan minuman. Deuteromycetes dapat tumbuh secara optimum pada suhu 29 – 320C (Alexopoulos dan Mims 1979).
Cendawan Penicillium memiliki ciri-ciri morfologi yang terbentuk pada media ADK memiliki warna koloni hijau, teksturnya seperti bulu,
konidia hijau, jarak antar fialid cukup rapat, berbentuk seperti botol dengan konidium di ujung-ujungnya, konidofor besekat.
menyebutkan bahwa cendawan Penicilliun yaitu spesies mampu menghambat pertumbuhan bakteri E. coli dan B. subtilis.
Penicillium mampu menghasilkan antibiotik yang dinamai penisilin yang dapat menghambat sintesis peptidoglycaan dinding sel bakteri (Deacon, 2006; Cole dan Schweikert, 2003). Penisilin menghambat sintesis dinding sel bakteri dengan cara menghambat sintesis enzim atau inaktivasi enzim untuk mensintesis peptidoglycan yang merupakan komponen penting dinding sel bakteri. Terhambatnya sintesis peptidoglycan menyebabkan hilangnya viabilitas dan sering menyebabkan sel bakteri lisis (Suwandi, 1992).
Makut dan Owolewa (2011) juga menyatakan bahwa Penicillium sp. menghasilkan senyawa antimikroba griseofulvin yang bersifat menghambat pertumbuhan fungi, diperkuat dengan pendapat dari Panda et al. (2005) yang menyebutkan penghambatan pertumbuhan fungi dilakukan oleh cendawan Penicillium dengan cara mengganggu fungsi benang spindel dan mikrotubulus sitoplasma, sehingga menghambat
III.
METODOLOGI PRAKTIKUM
3.1. Tempat dan Waktu
Pelaksanaan praktikum Mikrobiologi dan Bioteknologi Tanah dilakukan di Laboratorium Biologi Tanah Departemen ITSL IPB Pada bulan Oktober 2013 s/d Januari 2014. Pengambilan sampel tanah dilakukan di dua lokasi yaitu tanah dilahan pertanian disekitar daerah Babakan Lebak, Bogor dan tanah disekitar hutan di lingkungan Fakultas Kehutanan Institut Pertanian Bogor.
3.2. Alat dan Bahan
Alat yang digunakan untuk praktikum Mikrobiologi dan Bioteknologi Tanah adalah cangkul, timbangan analitik, Laminar Air Flow (LAF), autoclave, incubator, tabung reaksi dan rak tabung reaksi, pipet
ukur 1 ml, cawan petri, erlenmeyer 250 ml, spatula, alat suntik 1 ml, jarum ose, bunsen, pinset, centrifuge, Sepektrofotometer Uv-visible, dan kuvet.
Bahan yang digunakan adalah sampel tanah (tanah disekitar hutan dan tanah pertanian), Media Martin Agar (Rose Bengal), Media Azotobacter (Nitrogen Free Medium) , akuades steril, alkohol 90 %, kertas saring, tissue, kertas label, dan plastic..
3.3. Pelaksanaan Praktikum
3.3.1. Pengambilan Sampel Tanah
3.3.2. Isolasi Azotobacter dan Penicillium dari Sampel Tanah
Isolasi Azotobacter dari sampel tanah (tanah disekitar hutan dan tanah pertanian) dilakukan deangan tahapan sebagai berikut : 1. Untuk pengenceran 10-1Sampel tanah yang telah dtimbang
secara steril, sampel tanah (@ 10 gram) dan larutan NaCl fisiologis (90 ml) dishaker supaya tanah tersuspensi dengan baik.
2. Membuat serial pengenceran dalam tabung reaksi dengan menggunakan larutan fisiologis 9 ml hingga pengenceran 10-4 dengan cara pipet sebanyak 1 ml dari suspensi tanah (100 ml) pada pengenceran 10-1 kemudian diinokulasikan pada larutan fisiologis (9 ml) yang merupakan tingkat pengenceran 10-2, pengenceran dilakukan sampai 10-4. Shaker sebelum penginokulasian larutan ke tingkat pengenceran berikutnya. 3. Untuk inokulasi dilakukan metode tuang dengan
menginokulasikan seri pengenceran 10-3 dan 10-4, masing-masing 1 ml ke cawan petri kemudian tuangkan media NFM. 4. Inkubasi dalam incubator selama 2 hari pada suhu 290C – 310C,
bakteri Azotobacter ditandai dengan koloni bakteri berwarna
bening pada media NFM.
Isolasi Penicillium dari sampel tanah (tanah disekitar hutan dan tanah pertanian) dilakukan dengan tahapan sebagai berikut : 1. Sampel tanah yang telah dtimbang secara steril, sampel tanah
(@ 10 gram) dan aquades (90 ml) dishaker agar tanah tersuspensi dengan baik dan merupakan pengenceran 10-1. 2. Membuat serial pengenceran dalam tabung reaksi dengan
menggunakan aquades 9 ml hingga pengenceran 10-4
4. Inokulasikan seri pengenceran 10-3 dan 10-4, masing – masing 1 ml ke cawan petri kemudian tuangkan pula media Martin Agar (Rose Bengal) (Metode tuang).
5. Inkubasi selama 7 hari, cendawan Penicillium ditandai dengan cendawan yang tumbuh, hifa koloninya berwarna hijau muda ditengah dan dikelilingi oleh hifa putih dipinggirnya.
3.3.3. Pengamatan Pertumbuhan Bakteri Azotobacter
1. Bakteri di media NFM padat diremajakan pada media NFM cair
2. Hasil peremajaan kemudian diukur dengan spektrofotometer Uv-visible dengan panjang gelombang 600 Nm secara bertahap setiap 2 jam selama 30 jam
3. Catat nilai absorbansi, dan buat grafik pertumbuhan bakteri Azotobacter
3.3.4. Pengujian Patogenitas Bakteri Azotobacter
1. Isolat cair Azotobacter diambil dengan suntik sebnayak 1 ml 2. Injeksikan Isolat tersebut ke daun tembakau secara hati – hati
dan perlahan.
3. Amati perubahan yang terjadi pada daun tembakau, jika spot yang disuntikkan berubah menguning maka isolat Azotobacter mempunyai kemungkinan bersifat patogen.
3.3.3. Pengujian Azotobacter sp. terhadap Perkecambahan Benih Kacang hijau
1. Siapkan benih kacang hijau yang akan dikecambahkan.
3. Benih kacang hijau yang telah disiapkan direndam kedalam tiap perlakuan selama 6 jam.
4. Benih yang telah direndam kemudian ditumbuhkan pada media kapas yang telah dibasahi oleh masing – masing perlakuan. 5. Amati pertumbuhan panjang akar dan tinggi kecambah selama
7 hari.
3.3.5. Pengujian Kemampuan Menghasilkan Antibiotik pada Cendawan Penicillium
1. Penicillium yang telah berhasil diisolasi dimedia padat diremajakan ke dalam media Rose Bengal cair sebanyak 30 ml, kemudian diinkubasi selama 5 hari.
2. Cendawan yang telah berhasil tumbuh di media Rose Bengal cair kemudian dimasukkan kedalam tube untuk centrifuge. 3. Centrifuge selama 15 menit dengan kecepatan 3000 rpm, ambil
supernatan hasil centrifuge.
4. Kertas cakram dicelupkan ke dalam supernatan dan diletakkan diatas media NA (Nutrien Agar)
5. Media NA yang telah diletakkan dengan kertas cakram
kemudian di biarkan di udara terbuka dengan tujuan agar mikroba udara masuk dan berkembang di media NA.
6. Amati zona bening yang tampak di sekitar kertas cakram kemudian hitung daya hambatnya dengan rumus,
IV.
HASIL DAN PEMBAHASAN
4.1. Hasil
4.1.1. Isolasi Azotobacter sp.
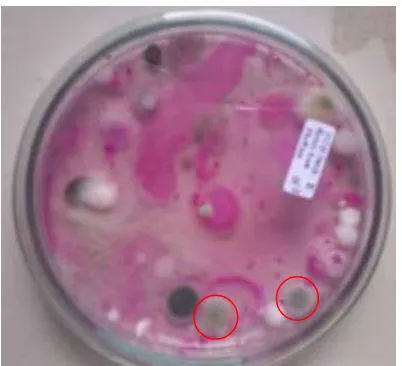
Azotobacter sp. yang berhasil diisolasi pada media NFM dari dua jenis sampel tanah menunjukkan pertumbuhan koloni berwarna bening pada media tumbuh (Gambar 1), selain itu pada tiap – tiap sampel tanah yang berbeda menunjukkan jumlah koloni yang berbeda pula (Tabel 1).
Tabel 1. Jumlah koloni Azotobacter sp. yang berhasil diisolasi pada masing – masing sampel tanah dari rizosfer alang – alang
Bakteri Jumlah Koloni/gram tanah
Tanah Pertanian Tanah Sekitar Hutan
Azotobacter sp. 1,45 x 105 2,05 x 105
Gambar 1. Koloni Azotobacter sp. dilihat dari koloni yang berwarna bening pada media NFM
0
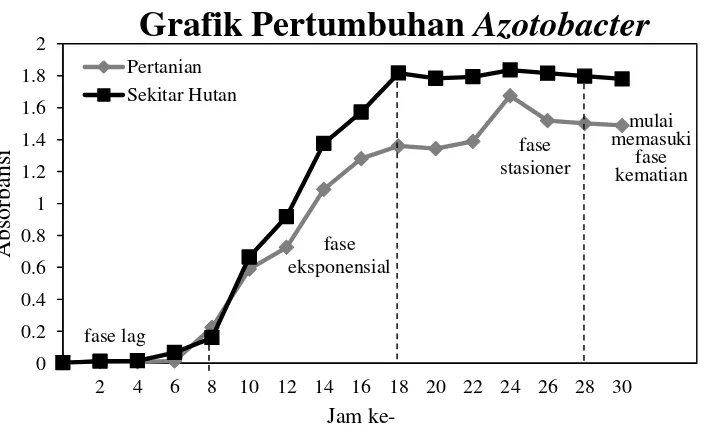
Gambar 2. Grafik Pertumbuhan Azotobacter sp.
Selain itu pengujian terhadap patogenitas Azotobacter tidak meunjukkan sifat patogen, karena setiap isolat Azotobacter baik yang berasal dari tanah sekitar hutan maupun tanah pertanian, tidak menyebabkan klorosis pada daun tembakau.
Tabel 2. Uji Patogenitas Azotobacter pada tanaman tembakau
Karena tidak ditemukannya sifat patogen dari isolat Azotobacter, maka pengujian dapat dilakukan ke tahap selanjutnya, yaitu pengujian isolat Azotobacter terhadap perkecambahan benih tanaman.
4.1.2. Pengujian Azotobacter sp. terhadap perkecambahan kacang hijau
Pengujian Azotobacter sp. pada perkecambahan kacang hijau memberikan hasil yang berbeda terhadap kacang hijau yang dikecambahkan dengan diinokulasikan Azotobacter sp. dibandingkan kacang hijau yang dikecambahkan tanpa adanya inokulasi Azotobacter sp.. Secara umum, kacang hijau yang dikecambahkan dengan inokulasi Azotobacter sp. mempunyai pertumbuhan yang lebih baik dibandingkan kacang hijau yang dikecambahkan tanpa inokulasi Azotobacter sp., terutama pada parameter panjang akar dan tinggi kecambah (Tabel 2).
Tabel 3. Pertumbuhan benih kacang hijau yang diinokulasikan
Azotobacter sp. dan yang tidak diinokulasikan Azotobacter sp. umur 5 hari setelah perkecambahan
Jenis Tanah
Parameter Pengamatan Panjang akar
(cm)
Tinggi kecambah (cm)
Kontrol 7,8 12
Tanah Pertanian 8 13,7
0
Gambar 3. Grafik Pertumbuhan Tinggi kecambah Kacang hijau
0
4.1.3. Isolasi Penicillium
Penicillium yang telah berhasil diisolasi ditunjukkan dengan tumbuhnya koloni cendawan yang mempunya hifa berwarna hijau muda ditengahnya dan hifa berwarna putih dipinggiran koloni (Gambar 3). Berdasarkan analisa secara morfologi diketahui bahwa spesies yang didapat adalah Penicillium digitatum.
Gambar 5. Koloni Penicillium digitatum
4.1.4. Pengujian Kemampuan Menghasilkan Antibiotik pada Cendawan
Penicillium
Berdasarkan hasil percobaan yang telah dilakukan, diketahui bahwa cendawan Penicillium digitatum dapat menghasilkan senyawa antibiotik. Hal ini diketahui dari zona bening yang terbentuk disekitar kertas saring yang telah dicelupkan oleh supernatan Penicillium digitatum (Gambar 4).
Tabel 4. Daya hambat Penicillium digitatum
Cendawan Diameter (mm) Daya
Hambat Total Kertas cakram
Penicillium digitatum 12,5 5 2,5
Gambar 6. Zona bening yang dihasilkan
4.2. Pembahasan
Berdasarkan percobaan yang telah dilakukan diketahui bahwa jumlah koloni yang berasal pada rizosfer alang – alang yang berasal dari lahan pertanian lebih banyak dibandingkan yang berasal dari tanah sekitar hutan. Perbedaan jumlah koloni ini kemungkinan didasari oleh banyaknya jumlah bahan organik tanah yang dapat dimanfaatkan oleh Azotobacter sp.. Tanah pertanian lebih subur dan lebih banyak mengandung bahan organik yang merupakan sumber makanan dari Azotobacter dibandingkan tanah yang berasal dari daerah di sekitar hutan. Tanah yang berada di daerah sekitar hutan (bukan daerah hutan) memiliki jumlah bahan organik
yang lebih sedikit dikarenakan selain tanahnya padat, juga populasi tanaman di daerah tersebut juga tidak terlalu banyak.
dipengaruhi faktor-faktor lingkungan. Faktor lingkungan dapat mengakibatkan perubahan sifat morfologi dan fisiologi mikrobia, juga dapat mengakibatkan laju pertumbuhan menurun ataupun meningkat.
Grafik pertumbuhan dari bakteri Azotobacter menunjukkan peningkatan pertumbuhan dari berbagai fase yaitu fase lag, fase eksponensial, fase sstatsioner, dan fase kematian. Seharusnya nilai absorbansi pada grafik pertumbuhan tidak boleh melebihi angka 1, tetapi pada praktikum ini nilai absorbansi melebihi angka 1. Ada beberapa factor yang mempengaruhi nilai absorbansi tersebu antara lain, kontaminasi, metode kerja yang aseptik, tingkat ketelitian alat, dan kalibrasi alat.
Metode kerja yang aseptik berhubungan dengan kontaminasi isolate, metode kerja yang kurang aseptik meningkatkan kemungkinan isolat terkontaminasi dengan mikroba lain. Selain itu, tingkat ketelitian dan kalibrasi alat juga mempengaruhi nilai absorbansi yang didapat, semakin teliti tingkat ketelitian dan semakin sering alat tersebut dikalibrasi, maka data yang didapat akan semakin baik.
Pengujian Azotobacter sp. pada benih kacang hijau menunjukkan bahwa secara umum pertumbuhan benih kacang hijau yang diinokulasikan dengan Azotobacter sp., pertumbuhannya lebih baik dibandingkan yang
tidak diinokulasiskan dengan Azotobacter sp. (kontrol). Pada hari ke-5, benih kacang hijau yang diinokulasikan Azotobacter sp. yang berasal dari tanah pertanian memiliki panjang akar8 cm dan tinggi kecambah 13,7 cm. Benih kacang hijau yang diinokulasikan Azotobacter sp. yang berasal dari tanah disekitar hutan memiliki panjang akar 11,1 cm dan tinggi kecambah 14,2 cm. Sedangkan, benih kacang hijau yang tanpa inokulasi Azotobacter sp. memiliki panjang akar 7,8 cm dan tinggi kecambah 12 cm.
Azotobacter sp. dapat membatu dalam perkecambahan tanaman kacang hijau dikarenakan meurut Hamastuti (2012), Azotobacter sp. mampu mengubah nitrogen (N2) dalam atmosfer menjadi amonium (NH4+)
Menurut Widiastuti et al. (2010), selain dapat memfiksasi nitrogen bebas dari udara, keunggulan lain dari Azotobacter sp. menurut adalah
dapat mensintesis hormon seperti IAA. Disebutkan dalam Patten dan Glick (2002) bahwa sintesis IAA pada bakteri melalui jalur asam indol piruvat. IAA yang disekresikan bakteri memacu pertumbuhan akar secara langsung dengan menstimulasi pemanjangan atau pembelahan sel.
Berdasarkan percobaan yang dilakukan dengan menggunakan supernatant hasil centrifuge dari cendawan Penicillium digitatum, diketahui bahwa cendawan Penicillium digitatum dapat menghasilkan zat antibiotik yang dapat menghambat pertumbuhan mikroba, hal ini dibuktikan dengan adanya zona bening pada kertas cakram yang telah
dicelupkan supernatan dari cendawan Penicillium digitatum (Gambar 6), dan
diketahui daya hambatnya sebesar 2,5.
Kemampuan Penicillium dalam menghambat mikroba lain
dikarenakan Penicillium dapat memproduksi zat antibiotic berupa penicillin
yang menghambat sintesis peptidoglycan. Penicilin menghambat sintesis
dinding sel bakteri dengan menghambat sintesis enzim atau menonaktivasi
enzim yang mensintesis peptidoglycan yang merupakan komponen penting
pada pembentukan dinding sel. Terhambatnya sintesis peptidoglycan
menyebabkan hilangnya viabilitas dan dapat menyebabkan dinding sel
menjadi pecah (lisis) (Arisanti et al. 2012). Kemapuan Penisilin dalam
menghambat pembentukan dinding sel dan merusak dinding sel mikroba lain,
menyebabkan mikroba lain tidak dapat tumbuh, otomatis menyebabkan
Penisilin sebagai zat antimikroba yang dapat akan pertumbuhan dari mikroba
V.
SIMPULAN
5.1. Simpulan
Berdasarkan praktikum yang telah dilakukan, simpulan yang dapat diambil adalah,
1. Teknik mengisolasi bakteri Azotobacter adalah dengan mengencerkan sampel tanah menggunakan metode pengenceran, kemudian untuk mengisolasi bakteri
Azotobacter dilakukan dengan metode tuang (pour plate) menggunakan media NFM padat dan diinkubasi selama 2 hari pada suhu 290C – 300C.
2. Azotobacter terbukti mampu meningkatkan perkecambahan benih kacang hijau terutama pada panjang akat dan tinggi kecambah, secara tabulasi menunjukkan bahawa bakteri Azotobacter yang berasal dari tanah disekitar hutan memberikan respon tertinggi terhadap panjang akar dan tinggi kecambah.
3. Teknik mengisolasi cendawan Penicillium adalah dengan mengencerkan sampel tanah menggunakan metode pengenceran, kemudian untuk mengisolasi cendawan Penicillium dilakukan dengan metode tuang (pour plate) menggunakan media Martin Agar dan diinkubasi selama 7 hari pada suhu 290C – 300C.
DAFTAR PUSTAKA
Afni, A. 2010. Daya Tumbuh Bakteri dari Limbah Cair Rumah Sakit yang Berpotensi Mendegradasi Fenol Terhadap Variasi Konsentrasi Glukosa Dan Fenol [skripsi]. Fakultas sains dan Teknologi Unversitas Islam Negeri Sunan Kalijaga Yogyakarta
Alexopoulus CJ., Mims CW. 1979. Introductory Micology. New York: John Wiley & Son’s.
Allen ON., Allen EK. 1981. The leguminosae: A source book of characteristics, uses, and nodulation. University of Wisconsin Press. Madison, USA.
Arisanti S., ND. Kuswytasari, M. Shovitri. 2012. Antimicrobial Assay of Soil Mold Isolates from Wonorejo Surabaya. The Journal for Technology and Science 23 (4) : 111 – 117
Cole RJ., Schweikert MA. 2003. Handbook of Secondary Fungal Metabolites. California : Academic Press Elsevier Science
Deacon JW. 2006. Fungal Biology. Malden: Blackwell Publishing.
Hamastuti H., Elysa DO., SR. Juliastuti, Nuniek H. 2012. Peran Mikroorganisme Azotobacter chroococcum, Pseudomonas fluorescens, dan Aspergillus niger pada Pembuatan Kompos Limbah Sludge Industri Pengolahan Susu. Jurnal Teknik Pomits 1 (1): 1-5
Hamdi, YA. 1982. Application Of Nitrogen-Fixing Systems In Soil Improvement And Management. Rome. Food And Agriculture Organization Of The United Nation.
Hardaningsih S. 2011. Jenis Penyakit Kedelai Dan Efektivitas Jamur Antagonis Yang Berasal Dari Kalimantan Selatan Terhadap Sclerotium rolfsii Di Laboratorium. Balai Penelitian Tanaman Kacang-kacangan dan Umbi-umbian.
Makut MD., Owolewa OA. 2011. Antibiotic-Producing Fungi Present In The Soil Environment Of Keffi Metropolis, Nasarawa State, Nigeria. Trakia Journal Of Sciences 9(2): 33-39.
Mujiyati, Supriyadi. 2009. Pengaruh pupuk kandang dan NPK terhadap populasi bakteri Azotobacter dan Azospirillum dalam tanah pada budidaya cabai (Capsicum annum). Bioteknologi 6 (2): 63-69
Panda D., Rathinasamy K., Santra MK., Wilson L. 2005. Kinetic suppression of microtubule dynamic instability by griseofulvin: Implications for its possible use in the treatment of cancer. PNAS 102 (28): 9878-9883
Pandey, A. 2000. Advances in microbial amylases [review]. Biotechnol Appl Biochem 31: 135 – 152
Patten CL., BR. Glick. 2002. Role of Pseudomonas putida indol acetic acid in development of the host plant root system. Application Enviroment Microbiologi 68: 3795 – 3801.
Prihanto AA. 2012. Perbandingan Aktivitas Antibakteri Penicillium notatum atcc 28089 dengan Penicillium sp. R1m yang Diisolasi dari Mangrove Sonneratia caseolaris. Fakultas Perikanan dan Ilmu Kelautan, Universitas Brawijaya.
Rao, NS. Subba. 1994. Mikroorganisme Tanah dan Pertumbuhan Tanaman. Terjemahan dari Soil Organisms and Growth, oleh : Herawati Susilo. Jakarta. UI-PRESS.
Salysbury, F. B dan Ross, C. W. 1995. Fisiologi Tumbuhan, jilid dua. Terjemahan Plant Physiology, 4th edition, oleh : Diah R. Lukmana dan Sumaryono. 1992. Bandung. Penerbit ITB Bandung.
Soenartiningsih. 2010. Efektivitas beberapa Cendawan Antagonis dalam Menghambat Perkembangan Cendawan Rhizoctonia solani pada Jagung Secara Invitro. Prosiding Pekan Serealia Nasional.
Suwandi U. 1992. Mekanisme Kerja Antibiotik. Pusat Penelitian dan Pengembangan P.T. Kalbe Farma: Jakarta.
Wedhastri, S. 2002. Isolasi dan Seleksi Azotobacter spp. Penghasil Faktor Tumbuh dan Penambat Nitrogen dari Tanah Masam. Jurnal Ilmu Tanah dan Lingkungan 3 (1) : 45-51
Tate RL. 2000. Soil Microbiology, second edition. New York. Jhon Wiley & Sons, Inc.
Widiastuti H. Siswanto, Suharyanto. 2010. Karakterisasi dan Seleksi Beberapa Isolat Azotobacter sp. untuk Meningkatkan Perkecambahan Benih dan Pertumbuhan Tanaman. Buletin Plasma Nutfah 16 (2): 160 – 167
Lampiran 1. Sampel Tanah yang akan Diisolasi
Gambar 7. a) Pengambilan tanah dari rhizosfer alang – alang, b) sampel tanah dari lahan pertanian, c) sampel tanah dari lahan disekitar hutan
a b
c
Sampel tanah yang
Lampiran 2. Teknik Isolasi Azotobacter dan Penicillium
Gambar 8. a) Suspensi tanah yang dishaker, b) Pengenceran sampel tanah (metode pengenceran), c) Penuangan media tumbuh (metode tuang),
d) perhitungan jumlah koloni bakteri Azotobacter
a b
c
Lampiran 3. Penicillium dan Azotobacter yang berhasil dikulturkan
Gambar 9. a)Penicillium digitatum, b)Azotobacter sp.
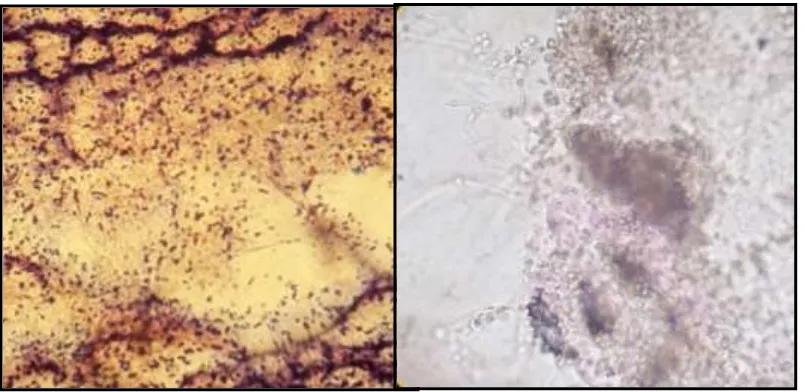
Lampiran 4. Penampakan Mikroskopis Azotobacter dan Penicillium digitatum pada Pembesaran 1000x
Gambar 10. Kenampakan Mikroskopis, a) Azotobacter sp., b) Penicillium digitatum
Lampiran 5. Aplikasi Azotobacter sp. pada daun tembakau untuk uji patogenitas
Gambar 11. a) Injeksi isolat Azotobacter sp. pada daun tembakau, b) hasil injeksi Azotobacter sp. yang berasal dari tanah disekitar hutan pada daun tembakau umur 0 hari, c) hasil injeksi Azotobacter sp. yang berasal dari tanah pertanian pada daun tembakau umur 0 hari.
Gambar 12. a) hasil injeksi Azotobacter sp. yang berasal dari tanah disekitar hutan pada daun tembakau umur 3 hari setelah aplikasi, b) hasil injeksi Azotobacter sp. yang berasal dari tanah pertanian pada daun tembakau umur 3 hari setelah aplikasi. Daun masih terlihat segar tanpa adanya gejala klorosis pada daun.
a b c
Lampiran 6. Perkecambahan benih kacang hijau umur 5 hari setelah perkecambahan