HALAMAN SAMPUL
SINTESIS 5-NITRO-2-FURFURALDIASETAT MENGGUNAKAN
FURFURAL, ASAM NITRAT DAN ASAM ASETAT ANHIDRIDA
DENGAN KATALIS ASAM P-TOLUENASULFONAT
SKRIPSI
Diajukan Untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Ilmu Farmasi
Oleh:
Carolus Borromeus Probo Bharoto Putro
NIM: 048 114 111
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA
YOGYAKARTA
2008
1
HALAMAN JUDUL
SINTESIS 5-NITRO-2-FURFURALDIASETAT MENGGUNAKAN
FURFURAL, ASAM NITRAT DAN ASAM ASETAT ANHIDRIDA
DENGAN KATALIS ASAM P-TOLUENASULFONAT
SKRIPSI
Diajukan Untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Ilmu Farmasi
Oleh:
Carolus Borromeus Probo Bharoto Putro
NIM: 048 114 111
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA
YOGYAKARTA
2008
v
PRAKATA
Puji syukur kepada Tuhan Yang Maha Esa atas berkat dan karunia-Nya
penulis dapat menyelesaikan skripsi yang berjudul “Sintesis
5-Nitro-2-Furfuraldiasetat Menggunakan Furfural, Asam Nitrat Dan Asam Asetat Anhidrida
Dengan Katalis Asam p-Toluenasulfonat” sebagai salah satu syarat untuk
mencapai gelar sarjana pada Fakultas Farmasi Universitas Sanata Dharma
Yogyakarta.
Dalam penulisan skripsi ini, penulis mendapatkan bantuan dari banyak
pihak. Pada kesempatan ini penulis ingin menyampaikan penghargaan dan ucapan
terima kasih kepada :
1. Rita Suhadi, M.Si., Apt. selaku Dekan Fakultas Farmasi Sanata Dharma
2. Lucia Wiwid Wijayanti, M.Si. selaku dosen pembimbing atas bimbingan
dan pengarahannya baik selama penelitian maupun penyusunan skripsi ini.
3. Jeffry Julianus, M.Si. selaku penguji atas segala masukan, kritik, dan
sarannya.
4. Christine Patramurti, M.Si. Apt. selaku penguji atas segala masukan, kritik,
dan sarannya.
5. Yohanes Dwiatmaka, M.Si. selaku Kepala Laboratorium Farmasi atas
bantuannya sehingga penulis dapat bekerja di laboratorium dengan lancar.
6. Mas Parlan, Mas Kunto, dan Mas Bimo atas bantuannya selama peneliti
bekerja di laboratorium
7. Mia, Dewi, Boriz, Robby, dan Vita, rekan seperjuangan dalam penelitian ini
yang selalu membantu.
v
8. Bob, Coco, Adit, Leo, Fajar, Edvan, Budiarto dan Elvan, atas
kebersamaannya selama di laboratorium.
9. Teman-teman UKF dolan-dolan, Kelas C 2004, FST 2004 dan teman-teman
angkatan 2004 lain yang telah banyak membantu dan memotivasi.
10. Teman-teman Angkatan 2005, 2006, dan 2007 yang selalu berulang kali
menanyakan dengan antusias kapan penulis mengajukan ujian terbuka.
11. Teman-teman milis kimia_indonesia@yahoogroups.com, terutama Jeliarko
Palgunadi yang telah memberikan banyak masukan mengenai reaksi.
12. Keluarga yang telah mendukung penulis untuk tetap berjuang
13. Marlisa, Eva, dan Novianti yang telah meminjamkan sumber-sumber
pustaka
14. Segenap rekan dan pihak-pihak yang membantu namun tidak dapat
disebutkan satu persatu.
Akhir kata penulis menyadari bahwa karya penulisan skripsi ini jauh dari
sempurna mengingat keterbatasan kemampuan dan pengalaman yang dimiliki.
Oleh karena itu, saran dan kritik yang sifatnya membangun sangat diperlukan oleh
penulis demi kesempurnaan skripsi ini. Semoga skripsi ini dapat memberikan
sumbangsih yang bermanfaat pada perkembangan ilmu pengetahuan.
Yogyakarta 10 Juni 2008
Penulis
vii
PERNYATAAN KEASLIAN KARYA
Saya menyatakan dengan sesungguhnya bahwa skripsi yang saya tulis ini tidak
memuat karya atau bagian karya orang lain, kecuali yang telah disebutkan dalam
kutipan dan daftar pustaka, sebagaimana karya ilmiah
Yogyakarta, 5 November 2007
Penulis,
Carolus Borromeus Probo Bharoto Putro
vii
LEMBAR PERNYATAAN PERSETUJUAN
PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Yang bertanda tangan di bawah ini, saya mahasiswa Universitas Sanata Dharma:
Nama : Carolus Borromeus Probo Bharoto Putro NIM : 048 114 111
Demi pengembangan ilmu pengetahuan, saya memberikan kepada Perpustakaan Universitas Sanata Dharma karya ilmiah saya yang berjudul:
SINTESIS 5-NITRO-2-FURFURALDIASETAT MENGGUNAKAN FURFURAL, ASAM NITRAT DAN ASAM ASETAT ANHIDRIDA DENGAN KATALIS ASAM P-TOLUENASULFONAT
berserta perangkat yang diperlukan. Dengan demikian saya memberikan kepada Perpustakaan Universitas Sanata Dharma hak untuk menyimpan, mengalihkan dalam bentuk media lain, mengelolanya dalam bentuk pangkalan data, mendistribusikan secara terbatas, dan mempublikasikan di internet atau media lain untuk kepentingan akademis tanpa perlu meminta izin dari saya maupun memberikan royalti kepada saya selama tetap mencantumkan nama saya sebagai penulis.
Demikian pernyataan ini yang saya buat dengan sebenarnya.
Dibuat di Yogyakarta Pada tanggal 31 Juli 2008
Yang menyatakan
viii
INTISARI
Peningkatan nilai ekonomis dan aktifitas teraupetik dari furfural telah dilakukan dengan mensubstitusi gugus nitro dan ester pada posisi 5 dan 2 pada cincin furan yang menghasilkan 5-nitro-furfuraldiasetat. Senyawa golongan 2-nitrofuran ini diketahui mempunyai aktifitas bakteriostatik dan bakteriosida (Lednicer dan Mitscher, 1975). Senyawa 5-nitro-2-furfuraldiasetat dapat disintesis dengan mereaksikan asam nitrat pekat dan asam p-toluenasulfonat yang ditambahkan bertetes-tetes pada asam asetat anhidrida yang kemudian ditambahkan furfural.
Tujuan dari penelitian ini adalah untuk mengetahui apakah dari prosedur penelitian yang dilakukan didapatkan rendemen senyawa 5-nitro-2-furfuraldiasetat. Analisis hasil dilakukan secara kualitatif dengan organoleptis, uji kelarutan, penentuan titik lebur, uji kromatografi lapis tipis, elusidasi struktur dengan spektroskopi inframerah dan spektroskopi resonansi magnetik inti (H1 -NMR)
Hasil dari penelitian adalah senyawa hasil sintesis berupa kristal coklat muda tidak berbau, larut dalam metanol, aseton, eter, kloroform, dan tidak larut dalam aquades, titik lebur 89-90°C, harga Rf yang berbeda dengan Rf furfural (Rf produk = 0,81; Rf furfural = 0,73). Hasil elusidasi dengan spektroskopi inframerah dan H1-NMR ditunjukkan dengan profil spektra yang diidentifikasi sebagai senyawa 5-nitro-2-furfuraldiasetat. Berdasarkan hasil analisis di atas, dapat disimpulkan bahwa senyawa hasil sinteisis adalah 5-nitro-2-furfuraldiasetat dengan rendemen 9,32%
Kata kunci: 5-nitro-2-furfuraldiasetat, furfural, asam p-toluenasulfonat, nitrasi
viii
ABSTRACT
Increasing economic value and teraupetic activity of furfural was done by subtitute nitro and ester group on 5 and 2 position of furan ring yield 5-nitro-2-furfuraldiacetate. 5-nitro-2-furfuraldiacetate, a derivative of 2-nitrofurans are known to possess both bacteriostatic and bacteriocidal properties (Lednicer and Mitscher, 1975). This molecule could be synthesized by reacting concentrated nitric acid and p-toluenesulfonic acid and then it was added dropwisely to acetic anhydride followed by furfural.
This research was aimed to know whether the synthesis pathway produces 5-nitro-2-furfuraldiacetate rendemen. The result was analyzed by qualitative test using organoleptic test, solubility test, melting point determination, thin layer chromatography separation, and structure elucidation using infrared spectroscopy (IR) and Nuclear Magnetic Resonance Spectroscopy (H1-NMR).
The result of this research showed the product was light brown odourless crystal, soluble in methanol, acetone, ether, chloroform, and insoluble in aquades, with melting point 89-90°C, and possessing different Rf value from furfural’s Rf value (Rf product = 0,81; Rf furfural = 0,73). The result of elucidation tested by IR and H1-NMR showed spectra profile identified as 5-nitro-2-furfuraldiacetate molecule. Based on the data, the product of the synthesis pathway was 5-nitro-2-furfuraldiacetate with rendemen for about 9,32%
Keywords: 5-nitro-2-furfuraldiacetate, furfural, p-toluenesulfonic acid, nitration
s: nitrofurazon, Keyword
x
DAFTAR ISI
HALAMAN SAMPUL ... i
HALAMAN JUDUL... ii
PERSETUJUAN PEMBIMBING... iii
PENGESAHAN SKRIPSI ... iv
PRAKATA... v
PERNYATAAN KEASLIAN KARYA ... vii
INTISARI... viii
ABSTRACT... ix
DAFTAR ISI... x
DAFTAR TABEL... xiv
DAFTAR GAMBAR ... xv
BAB I ... 1
PENDAHULUAN ... 1
A. Latar Belakang ... 1
1. Perumusan masalah... 2
2. Keaslian penelitian ... 3
3. Manfaat penelitian... 3
B. Tujuan Penelitian... 3
BAB II... 4
PENELAAHAN PUSTAKA ... 4
A. Sintesis 5-nitro-2-furfuraldiasetat ... 4
1. Cincin furan... 4
x
2. Aldehid... 5
3. Substitusi elektrofilik pada furan ... 7
4. Reaksi esterifikasi pada aldehid ... 10
5. Kristalisasi... 11
B. Uji Pendahuluan ... 12
1. Pemeriksaan organoleptis... 12
2. Pemeriksaan titik lebur... 12
3. Pemeriksaan kelarutan ... 13
4. Uji pemisahan menggunakan sistem KLT ... 14
C. Elusidasi Struktur ... 15
1. Spektroskopi inframerah ... 15
2. Spektroskopi NMR ... 16
D. Landasan Teori... 19
E. Hipotesis ... 20
BAB III ... 21
METODE PENELITIAN... 21
A. Jenis Penelitian... 21
B. Definisi Operasional... 21
C. Variabel Penelitian ... 21
D. Alat Dan Bahan Penelitian ... 21
1. Alat penelitian ... 21
2. Bahan penelitian... 22
E. Tatacara Penelitian... 22
xii
1. Cara sintesis ... 22
2. Uji pendahuluan dan elusidasi struktur ... 23
3. Analisis hasil ... 24
BAB IV ... 25
HASIL DAN PEMBAHASAN... 25
A. Sintesis 5-nitro-2-furfuraldiasetat ... 25
B. Uji Pendahuluan ... 31
1. Uji Organoleptis ... 31
2. Uji Kelarutan... 32
3. Uji Titik Lebur ... 33
4. Pemisahan dengan KLT ... 33
C. Elusidasi Struktur Senyawa Hasil Sintesis ... 42
1. Spektroskopi Inframerah... 42
2. Spektroskopi H1-NMR ... 46
D. Perhitungan Rendemen ... 50
BAB V... 51
KESIMPULAN DAN SARAN... 51
A. Kesimpulan ... 51
B. Saran ... 51
DAFTAR PUSTAKA ... 52
LAMPIRAN... 54
A. Perhitungan Rendemen ... 54
B. Spektra Inframerah ... 55
xii
1. Furfural... 55
2. 5-nitro-2-furfuraldiasetat... 56
C. Spektra H1-NMR ... 57
D. Data Titik Lebur Senyawa Hasil Sintesis... 58
E. Kromatogram Furfural dan Hasil Sintesis ... 59
BIOGRAFI PENULIS ... 60
xiv
DAFTAR TABEL
Tabel 1. Istilah kelarutan zat menurut Farmakope Indonesia IV ... 13
Tabel 2. Perbandingan organoleptis senyawa hasil reaksi dengan reaktan... 31
Tabel 3. Data kelarutan senyawa hasil reaksi dengan furfural... 32
Tabel 4. Data faktor retensi dan warna hasil pemisahan dengan KLT ... 34
Tabel 5. Interpretasi spektra inframerah furfural ... 42
Tabel 6. Interpretasi spektra inframerah senyawa hasil sintesis ... 44
Tabel 7. Hasil interpretasi spektra IR senyawa hasil sintesis dan furfural... 45
Tabel 8. Interpretasi spektra H1-NMR senyawa hasil sintesis dengan pelarut CDCl3... 47
xiv
DAFTAR GAMBAR
Gambar 1. hibrisasi sp2 (a), besar sudut ikatan (b), panjang ikatan (c), dan posisi
atom-atom dari furan (d) ... 5
Gambar 2. Struktur umum dari aldehid ... 6
Gambar 3. Reaksi penyerangan gugus karbonil oleh elektrofil dan nukleofil ... 6
Gambar 4. Efek induktif dari penarikan elektron... 7
Gambar 5. Stabilitas resonansi ion enolat ... 7
Gambar 6. Regioselektifitas dari substitusi elektrofilik pada tiofena. ... 8
Gambar 7. Mekanisme pembukaan cincin furan... 9
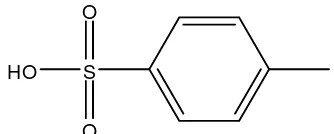
Gambar 8. Rumus Struktur asam p-toluenasulfonat ... 10
Gambar 9. Resonansi anion tosilat... 10
Gambar 10. Reaksi umum pembentukan gugus 1,1-diol ... 11
Gambar 11. Reaksi umum pembentukan ester... 11
Gambar 12. Mekanisme pembukaan furfural karena adanya asam sulfat ... 26
Gambar 13. Mekanisme deprotonasi asam p-toluenasulfonat ... 26
Gambar 14. Mekanisme pembentukan ion nitronium... 26
Gambar 15. Mekanisme pembentukan nitroasetat ... 27
Gambar 16. Mekanisme pembentukan hidrat pada furfural... 27
Gambar 17. Muatan atom-atom penyusun furfural... 28
Gambar 18. Mekanisme nitrasi pada furfural hidrat ... 29
Gambar 19. Mekanisme esterifikasi pada 5-nitro-2-furfuralhidrat ... 30
Gambar 20. Kristal senyawa hasil sintesis (a) dan furfural (b)... 31
Gambar 21. Hasil pemeriksaan dengan pemisahan secara KLT... 34
xvi
Gambar 22. Interaksi antara fase diam-fase gerak dengan furfural dan senyawa
hasil sintesis. ... 36
Gambar 23. Mekanisme serangan nukleofil oleh fenilhidrazina ... 37
Gambar 24. Mekanisme proton shift dan dehidrasi ... 38
Gambar 25. Mekanisme pembentukan (1E,1’E)-(5-nitrofuran-2-il)metilena bis (N’-fenil-aseto-hidrazonat) ... 39
Gambar 26. Mekanisme pembentukan (E)-1-(furan-2-ilmetilena)-2- fenilhidrazina ... 40
Gambar 27. Gugus kromofor dan auksokrom pada senyawa (E)-1-(furan-2-ilmetilena)-2-fenilhidrazina... 40
Gambar 28. Gugus kromofor dan auksokrom pada senyawa (1E,1’E)-(5-nitrofuran-2-il)metilena bis (N’-fenil-aseto-hidrazonat)... 41
Gambar 29. Spektra inframerah furfural... 42
Gambar 30. Spektra inframerah senyawa hasil sintesis ... 43
Gambar 31. Spektra H1-NMR senyawa hasil sintesis... 46
Gambar 32. Atom karbon metin yang mengalami induksi positif sehingga atom hidrogen yang menempel menjadi tak terperisai ... 48
Gambar 33. Lingkungan kimia atom hidrogen yang memberikan sinyal doblet.. 49
Gambar 34. Lingkungan kimia dari enam atom hidrogen α yang memberikan sinyal D berupa singlet... 50
p-tuenesulfonic acid, nitration
xvi
BAB I
PENDAHULUAN
A. Latar Belakang
Obat-obat golongan nitroheterosiklik banyak digunakan sebagai agen
kemoterapi yang efektif untuk penatalaksanaan terapi berbagai penyakit infeksi
yang disebabkan oleh mikrobia dan protozoa. Senyawa-senyawa nitroheterosiklik
ini berperan cukup penting karena dapat mengantisipasi kasus resistensi
mikroorganisme terhadap antibiotik β-laktam dan turunan sulfonamida yang telah
banyak dilaporkan (Jawetz dan Adelderg, 1996). Namun, golongan senyawa
nitroheterosiklik ini tidak mudah ditemukan pada produk alam. Oleh karena itu,
perlu dilakukan penelitian mengenai sintesis senyawa golongan nitroheterosiklik.
Turunan dari 2-nitrofuran telah diketahui mempunyai aktivitas
bakteriostatik dan bakteriosida (Lednicer dan Mitscher, 1975). Walaupun
mekanisme aksi senyawa golongan 2-nitrofuran ini masih belum diketahui secara
pasti, namun diduga bahwa mekanisme aksinya adalah penghambatan kerja enzim
sintesis DNA karena teroksidasi oleh gugus nitro. Atas dasar bahwa modifikasi
struktur 5-nitrofuran pada posisi 2 dapat meningkatkan efektivitas serta aktivitas
antibakteri secara luar biasa (Powers, 1975), maka dilakukan penelitian mengenai
sintesis 5-nitro-2-furfuraldiasetat.
Pada penelitian ini digunakan furfural sebagai senyawa yang akan
diderivatisasi. Furfural dapat diperoleh dari hidrolisis limbah agrikultur yang
mengandung pentosa, seperti tongkol jagung dan sekam padi, dalam suasana
2
asam. Penelitian mengenai sintesis turunan 2-nitrofuran ini diharapkan dapat
meningkatkan nilai ekonomi dan terapeutik furfural hasil isolasi limbah agrikultur
yang banyak tersedia di Indonesia.
Senyawa 5-nitro-2-furfuraldiasetat dapat disintesis dengan mereaksikan
asam nitrat pekat dan asam sulfat pekat yang ditambahkan bertetes-tetes pada
asam asetat anhidrida yang kemudian ditambahkan furfural (Tehrani, Zarghi, dan
Fathali, 2003). Berdasarkan orientasi yang penulis lakukan terhadap prosedur
sintesis senyawa 5-nitro-2-furfuraldiasetat (Tehrani, Zarghi, dan Fathali, 2003),
penulis tidak mendapatkan rendemen yang diharapkan. Diduga, telah terjadi
reaksi pembukaan cincin furan oleh adanya asam sulfat (Eicher dan Hauptmann,
1995). Oleh karena itu, untuk menjaga stabilitas cincin furan (Eicher dan
Hauptmann, 1995) dan mencegah hidrolisis gugus ester oleh adanya asam (Pavia,
Lampman, dan Kriz, 1995) pada senyawa 5-nitro-2-furfuraldiasetat maka pada
penelitian ini dilakukan penggunaan katalis asam p-toluenasulfonat dan
peningkatan pH (3,5-4,5) sebelum proses pemanasan.
Target molekul yang dihasilkan akan dilakukan pengujian kualitatif
dengan organoleptis, uji kelarutan, penentuan titik lebur, uji kromatografi lapis
tipis, elusidasi struktur dengan spektroskopi inframerah dan spektroskopi
resonansi magnetik inti proton (H1-NMR)
1. Perumusan masalah
Apakah dari prosedur penelitian yang dilakukan menghasilkan rendemen
senyawa 5-nitro-2-furfuraldiasetat?
2. Keaslian penelitian
Sebelumnya pernah dilakukan penelitian mengenai sintesis
5-nitro-2-furfuraldiasetat menggunakan katalis asam sulfat (Tehrani, Zarghi, dan Fathali,
2003). Sejauh penulusuran pustaka yang penulis lakukan, belum pernah dilakukan
penelitian mengenai sintesis senyawa 5-nitro-2-furfuraldiasetat menggunakan
starting material furfural, asam asetat anhidrida, dan asam nitrat dengan katalis
asam p-toluenasulfonat
3. Manfaat penelitian
Penelitian ini dapat bermanfaat sebagai berikut:
a. Manfaat metodologis. Penelitian ini diharapkan dapat mengetahui
apakah dari prosedur penelitian yang dilakukan menghasilkan rendemen senyawa
5-nitro-2-furfuraldiasetat
b. Manfaat praktis. Penelitian ini diharapkan dapat memberikan data
ilmiah tentang alternatif pemanfaatan limbah agrikultur sekam padi dan tongkol
jagung dengan mengisolasi furfural sehingga didapatkan 5-nitro-2-furfuraldiasetat
B. Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui apakah dari prosedur
penelitian yang dilakukan menghasilkan rendemen senyawa
BAB II
PENELAAHAN PUSTAKA
A. Sintesis 5-nitro-2-furfuraldiasetat
Senyawa 5-nitro-2-furfuraldiasetat dapat disintesis dengan membuat asam
nitrat pekat dan asam sulfat pekat yang ditambahkan bertetes-tetes pada asam
asetat anhidrida pada suhu -5oC sampai 5oC. Furfural ditambahkan pada larutan
ini pada kondisi yang sama. Campuran diaduk dalam pendingin es selama satu
jam kemudian ditambahkan air pada suhu kamar. Setelah tiga puluh menit dan pH
diusahakan sekitar 2,5-2,7, campuran dipanaskan selama satu jam pada suhu
55oC. Endapan yang terbentuk dikumpulkan dan direkristalisasi dengan etanol
(Tehrani, Zarghi, dan Fathali, 2003).
Dalam sintesis 5-nitro-2-furfuraldiasetat terjadi reaksi nitrasi dan
esterifikasi pada furfural. Reaksi nitrasi pada furfural berhubungan dengan teori
sustitusi elektrofilik pada cincin furan dan reaksi esterifikasi furfural erat
kaitannya dengan teori pembentukan gem-diol pada aldehid.
1. Cincin furan
Furan adalah suatu heteropentasiklik yang beranggotakan atom oksigen
(O). Berdasarkan deskripsi dari struktur elektron furan, diasumsikan bahwa semua
atom terhibridisasi sp2. Overlapping dari lima orbital atom 2pz menghasilkan
orbital molekul π (π-MOs), dimana salah satunya berikatan (bonding) dan dua
antibonding. (Eicher dan Hauptmann, 1995). Setiap atom karbon menyumbangkan
21
satu elektron dan dua elektron dari atom oksigen kepada struktur siklik
terkonjugasi. Oleh karena enam elektron ini terdistribusi pada lima atom, maka
kerapatan elektron π pada setiap atom cincin lebih besar daripada satu atom.
Dengan demikian furan mengalami kelebihan elektron π heterosiklik (Eicher dan
Hauptmann, 1995).
(a)
O
110,65O
106,07O
106,5O
(b)
O 136,2 pm
136,1 pm 143,0 pm
(c)
O α'
β' β
α 2 1
3 5
4
(d)
Gambar 1. hibrisasi sp2 (a), besar sudut ikatan (b), panjang ikatan (c), dan posisi atom-atom dari furan (d) (Eicher dan
Hauptmann, 1995)
2. Aldehid
Aldehid merupakan dua dari sekian banyak kelompok senyawa organik
yang mengandung gugus karbonil. Aldehid mempunyai sekurangnya satu atom
hidrogen yang terikat pada karbon karbonilnya. Gugus lain dalam suatu aldehid
6
O
R H
Gambar 2. Struktur umum dari aldehid (Fessenden dan Fessenden, 1986)
Gugus karbonil terdiri dari sebuah atom karbon sp2 yang dihubungkan
ke sebuah atom oksigen oleh ikatan sigma dan sebuah ikatan pi. Ikatan-ikatan
sigma gugus karbonil terletak dalam suatu bidang dengan sudut ikatan kira-kira
120° di sekitar karbon sp2. Gugus karbonil dalam aldehid bersifat polar, dengan
elektron-elektron dalam ikatan sigma dan ikatan pi. Elektron dalam ikatan pi
tersebut mudah tertarik ke oksigen yang bersifat elektronegatif. Selain pengaruh
atom elektronegatif yang menyebabkan suatu molekul menjadi polar, kepolaran
juga ditentukan oleh momen dipol yang merupakan ukuran terhadap derajat
kepolaran. Momen ikatan dan tetapan dielektrik ikut menentukan suatu molekul
termasuk polar atau nonpolar. (Fessenden dan Fessenden, 1986)
Oksigen gugus karbonil aldehid mempunyai dua pasang elektron
menyendiri. Oleh karena itu, gugus karbonil akan mudah diserang elektrofil atau
nukleofil.
C O R
R
E C O
R
R
Nu
Gambar 3. Reaksi penyerangan gugus karbonil oleh elektrofil dan nukleofil (Fessenden dan Fessenden, 1986)
Ikatan karbon-hidrogen biasanya stabil, nonpolar dan pasti tidak bersifat
asam. Tetapi dengan adanya suatu gugus karbonil terjadilah hidrogen yang
bersifat asam, terutama jika posisinya alfa terhadap dua gugus karbonil.
Keasaman ini disebabkan oleh dua hal yaitu pertama karena adanya efek induktif
oleh penarikan elektron, yang kedua karena adanya stabilitas resonansi dari ion
enolat bila kehilangan atom hidrogen sehingga ion enolat terstabilkan dengan
adanya delokalisasi muatan ion. (Fessenden dan Fessenden, 1986)
C O
C H2
C O
δ
Gambar 4. Efek induktif dari penarikan elektron (Fessenden dan Fessenden, 1986)
C
C C
O O
CH
C C
O O
CH
C C
O O
Gambar 5. Stabilitas resonansi ion enolat (Fessenden dan Fessenden, 1986)
3. Substitusi elektrofilik pada furan
Dengan analogi dengan benzena, furan dapat bereaksi dengan reagen
elektrofilik, lebih sering dengan substitusi. Furan dapat mengalami substitusi
elektrofilik 1011 lebih cepat daripada benzena dibawah kondisi yang sama. Alasan
pertama adalah energi resonansi dari furan sangat kurang dibandingkan dengan
benzena. Alasan kedua adalah cincin furan mengalami kelebihan elektron π
sedangkan pada benzena kerapatan elektron π adalah satu pada setiap atom.
Reaksi substitusi elektrofilik dari furan, seperti benzena, terjadi dengan
mekanisme adisi-eliminasi. (Eicher dan Hauptmann, 1995)
Regioselektivitas heterosiklik dari reaksi substitusi ini dapat dijelaskan
bahwa energi relatif dari keadaan transisi akan memegang peranan penting untuk
menghasilkan produk yang diharapkan dari reaksi substitusi yang terjadi yang
8
banyak menghasilkan produk. Penyumbang resonansi untuk intermediet yang
dihasilkan dari serangan ion nitronium pada karbon 2 dan karbon 3 pada tiofena
akan dibandingkan sebagai berikut:
Gambar 6. Regioselektifitas dari substitusi elektrofilik pada tiofena (Ege, 1989)
Karbokation yang terjadi ketika ion nitronium menyerang karbon 2 dari
thiofena lebih stabil daripada yang lain karena merupakan hal yang paling
mungkin yaitu delokalisasi muatan yang lebih besar. Reaksi ini tentu saja
mempunyai tingkat energi yang paling rendah sehingga secara mudah,
karbokation intermediet kehilangan proton dan produk yang dihasilkan
mempunyai cincin aromatik yang stabil (Ege, 1989).
Oleh karena campuran asam nitrat dan asam sulfat akan merusak
heterosiklik, agen penitrasi yang lebih tidak terlalu reaktif (mild) dibuat dengan
melarutkan asam nitrat dalam asam asetat anhidrida. Asetat anhidrida dapat
bereaksi sebagai agen penghidrasi untuk menghasilkan ion nitronium dari asam
nitrat (Ege, 1989).
Prosedur sintesis tersebut (Tehrani, Zarghi, dan Fathali, 2003)
menggunakan katalis asam sulfat untuk membuat ion nitronium dari asam nitrat.
Adanya asam sulfat pekat dapat menginduksi polimerisasi pada kation. Asam
sulfat encer menyebabkan hidrolisis menjadi senyawa 1,4-dikarbonil. Serangan
nuklofilik oleh air terjadi pada posisi-3 dari furan terprotonasi. Akhirnya, pada
pembalikan (reversion) dari sintesis Paal-Knoor, 2-hidroksi-2,3-dihidrofuran
menghasilkan senyawa 1,4-dikarbonil hexan-2,5 seperti pada gambar 2 (Eicher
dan Hauptmann, 1995).
Gambar 7. Mekanisme pembukaan cincin furan(Eicher dan Hauptmann, 1995)
Oleh karena dengan adanya katalis asam sulfat pekat dapat menginduksi
pembukaan cincin furan, maka pada penelitian ini menggunakan asam p
-toluenasulfonat sebagai katalis. Sulfonat adalah suatu ester anorganik dengan
10
S
O O
HO
Gambar 8. Rumus Struktur asam p-toluenasulfonat
Suatu sulfonat mempunyai gugus alkil atau aril yang terikat langsung
pada atom belerang. Asam p-toluenasulfonat (4-metilbenzenasulfonat) lazim
disebut tosilat, karena mempunyai kemungkinan stabilisasi resonansi dari anion
yang kehilangan proton dari gugus hidroksilnya, merupakan suatu asam kuat
dengan nilai pKa sebesar -0,6. Anion tosilat terstabilkan oleh resonansi dan
merupakan basa yang sangat lemah. (Fessenden dan Fessenden,1986).
S O
O
O S
O
O
O S
O O
O
Gambar 9. Resonansi anion tosilat
4. Reaksi esterifikasi pada aldehid
Aldehid dapat bereaksi dengan gugus karboksil membentuk ester. Syarat
yang harus dipenuhi adalah gugus aldehid terlebih dahulu diadisi oleh air dalam
suasana asam membentuk suatu 1,1-diol, yang disebut gem-diol, atau hidrat.
Reaksi itu reversibel, dan biasanya kesetimbangan terletak pada sisi karbonil
(Fessenden dan Fessenden, 1986).
R O
H2O R
OH
OH
suatu aldehid suatu hidrat
(dua OH pada C)
H
Gambar 10. Reaksi umum pembentukan gugus 1,1-diol (Fessenden dan Fessenden, 1986)
Dengan adanya gugus karboksil dan alkhol dalam suasana asam dan
pemanasan, maka dapat terjadi reaksi esterifikasi. Esterifikasi berkataliskan asam
dan merupakan reaksi yang reversibel.
O
R OH R'OH H , kalor R
O
OR' H2O
suatu asam karboksilat
suatu
alkohol suatu ester
Gambar 11. Reaksi umum pembentukan ester (Fessenden dan Fessenden, 1986)
5. Kristalisasi
Senyawa organik yang berwujud padat pada temperatur ruangan
biasanya dimurnikan dengan kristalisasi. Teknik dasarnya adalah melarutkan
materi dalam pelarut yang panas dan kemudian mendinginkannya secara
perlahan. Materi yang terlarut akan menurun kelarutannya pada temperatur yang
lebih rendah dan akan terpisah dari larutan ketika didinginkan. Fenomena ini
disebut sebagai kristalisasi jika kristal tumbuh perlahan dan selektif atau bisa juga
12
proses yang equilibrium dan menghasilkan materi yang sangat murni. Kristal akan
terbentuk dan kemudian tumbuh lapis demi lapis secara reversibel. Dalam hal ini
kristal akan “memilih” molekul yang benar dalam larutan. Pada presipitasi, kristal
lattice terbentuk secara cepat sehingga pengotor ikut terjebak dalam lattice. Oleh
karena itu, dijaga supaya proses purifikasi tidak terlalu cepat (Pavia, Lampman,
dan Kriz, 1995).
Proses kristalisasi sangat tergantung pada perbedaan yang besar pada
kelarutan material pelarut yang panas dan pada pelarut yang dingin. Ketika
pengotor merupakan senyawa yang mempunyai kelarutan yang sama pada pelarut
panas dan dingin maka proses purifikasi sulit untuk ditempuh dengan cara
kristalisasi (Pavia, Lampman, dan Kriz, 1995).
B. Uji Pendahuluan
Uji pendahuluan dilakukan dengan tujuan mengetahui karakteristik dari
senyawa hasil reaksi, biasanya meliputi pemeriksaan organoleptis, pemeriksaan
titik lebur, pemeriksaan kelarutan, dan perhitungan rendemen.
1. Pemeriksaan organoleptis
Uji dilakukan untuk melihat bentuk, warna, rasa dan bau dari senyawa
hasil reaksi. Uji ini merupakan uji paling sederhana tanpa bantuan alat.
2. Pemeriksaan titik lebur
Pemeriksaan titik lebur merupakan suatu aspek penting yang seringkali
dilakukan dalam penelitian sintesis suatu senyawa. Hal ini dapat dibenarkan
karena pemeriksaan titik lebur dapat memberikan informasi mengenai kemurnian
dari suatu produk sintesis senyawa. Ketajaman jarak lebur senyawa merupakan
kriteria kemurnian suatu senyawa. Pada umumnya suatu senyawa mempunyai
kemurnian yang baik apabila jarak leburnya tidak lebih dari 2oC, rentangan lebih
besar dari harga ini dapat dikatakan senyawa kurang murni (MacKenzei, 1967).
Dalam uji titik lebur didapatkan 2 temperatur. Temperatur yang pertama
adalah suhu dimana senyawa mulai meleleh. Temperatur yang kedua adalah suhu
dimana semua massa dari kristal berubah menjadi cairan yang jernih. Semakin
murni suatu senyawa semakin kecil range antara temperatur pertama dan
temperatur kedua (Pavia, Lampman, dan Kriz, 1995). Titik lebur senyawa
5-nitro-2-furfuraldiasetat adalah 90°C (Tehrani, Zarghi, dan Fathali, 2003).
3. Pemeriksaan kelarutan
Istilah kelarutan tidak saja merupakan standar atau uji kemurnian dari
suatu zat, tetapi lebih dimaksudkan sebagai informasi dalam penggunaan,
pengolahan dan peracikan suatu bahan, kecuali apabila disebutkan khusus dalam
judul tersendiri dan disertai cara ujinya secara kuantitatif (Anonim, 1995).
Tabel 1. Istilah kelarutan zat menurut Farmakope Indonesia IV (Anonim, 1995)
Istilah kelarutan
Jumlah bagian pelarut yang digunakan untuk melarutkan 1 bagian zat
14
4. Uji pemisahan menggunakan sistem KLT
Kromatografi merupakan proses diferensiasi komponen-komponen
cuplikan yang ditahan secara selektif oleh fase diam. Pada dasarnya semua
kromatografi menggunakan dua fase yaitu fase diam dan fase gerak.
Pemisahan-pemisahan tergantung pada gerakan relatif dari dua fase ini. (Sastrohamidjojo,
2001).
Fase diam dalam kromatografi lapis tipis adalah bahan penyerap atau
adsorben (Stahl, 1969). Fase diam yang umum dan paling banyak digunakan
adalah silika gel yang dicampur dengan CaSO4 untuk menambah daya lengket
partikel silika gel pada pendukung (pelat) (Mulja dan Suharman, 1995). Fase
gerak adalah medium angkut dan terdiri atas satu atau beberapa pelarut. Fase ini
bergerak dalam fase diam karena adanya gaya kapiler (Stahl, 1969). Fase gerak
untuk mengelusi 5-nitro-2-furfuraldiasetat adalah kloroform-metanol (90:10 v/v)
(Anonim, 1995).
Indentifikasi dari senyawa yang terpisah (bercak/noda) pada lapisan tipis
dapat dilakukan dengan tanpa reaksi kimia atau penyemprotan reagen (Stahl,
1969). Identifikasi senyawa 5-nitro-2-furfuraldiasetat dilakukan dengan
menyemprot reagen yang berisi larutan fenilhidrazina HCl (Anonim, 1995)
Jarak pengembangan senyawa pada kromatogram biasanya dinyatakan
dengan angka Rf atau hRf. Harga Rf didefinisikan sebagai perbandingan jarak
antara senyawa dari titik awal dengan jarak tepi muka pelarut dari awal (Stahl,
1969).
C. Elusidasi Struktur
1. Spektroskopi inframerah
Penggunaan spektroskopi inframerah pada bidang kimia organik hampir
menggunakan daerah 650 – 4000 cm-1. Daerah dengan frekuensi lebih rendah 650
cm-1 disebut inframerah jauh dan daerah dengan frekuensi lebih tinggi dari 4000
cm-1 disebut inframerah dekat. (Sastrohamidjojo, 2001)
Inti-inti atom yang terikat oleh ikatan kovalen mengalami getaran
(vibrasi) atau osilasi (oscillation), dengan cara serupa dengan dua bola yang
terikat oleh suatu pegas. Bila molekul mersap radiasi inframerah, energi yang
diserap menyebabkan kenaikan dalam amplitudo getaran atom-atom yang terikat
itu. Jadi molekul in berada dalam keadaan vibrasi tereksitasi (exicited vibration
state; energi yang terserap ini akan dibuang dalam bentuk panas bila molekul ini
kembali ke keadaan dasar). (Fessenden dan Fessenden, 1986)
Suatu ikatan dalam sebuah molekul dapat menjalani pelbagai macam
osilasi; oleh karena itu suatu ikatan tertentu dapat menyerap energi pada lebih
daripada satu panjang gelombang. Energi pada panjang gelombang ini
menyebabkan kenaikan vibrasi tekuk (bending vibrations). Tipe vibrasi yang
berlain-lainan ini disebut cara fundamental vibrasi (fundamental mode of
vibration). Banyaknya energi yang diabsorpsi oleh suatu ikatan bergantung pada
perubahan dalam momen ikatan seperti vibrasi atom-atom yang saling
berikatan-lebih besar perubahan dalam momen ikatan mengakibatkan absorpsi sejumlah
energi juga lebih besar. Ikatan non-polar tidak mengabsorpsi radiasi infra merah
16
non polar relatif menyebabkan absorpsi lemah. Pada ikatan polar menunjukkan
absorpsi yang kuat. (Fessenden dan Fessenden, 1986).
Serapan-serapan pada spektra IR dapat membrikan informasi mengenai
gugus-gugus suatu senyawa. Gugus ester (R C O
OR') dapat memberikan
serapan pada gugus C=O pada 1735 cm-1 dimana gugus yang terkonjugasi dengan
atom O dan R’ akan memberikan pergeseran serapan ke arah kiri sedangkan
gugus C-O akan memberikan 2 serapan atau lebih, satu lebih kuat dari pada yang
lainnya, pada rentang 1300-1000 cm-1. Regangan C-H memberikan serapan
sekitar 3000 cm-1. Jika gugus tersebut mempunyai sifat aromatik maka absorpsi
CH berada di sebelah kiri 3000 cm-1). Gugus nitro biasanya memberikan serapan
yang kuat pada 1600-1500 cm-1 dan 1390-1300 cm-1. Gugus furan yang
tersubstitusi pada posisi 2 memberikan serapan 100-1072 yang kurang kuat
(middle weak) (Pavia,1995). Serapan medium 815-795 cm-1 memberikan
informasi mengenai kibasan (wag) C-H pada furan yang tersubstitusi pada posisi
2. Gugus aldehid dapat memberikan serapan pada regangan C=O rata-rata pada
1725 cm-1. Sistem konjugasi yang menempel pada aldehid akan menggeser
serapan ke arah kanan. Regangan C-H pada gugus aldehid, terdiri dari
serapan-serapan lemah kira-kira pada 2750 cm-1 dan 2850 cm-1 (Pavia, Lampman, dan
Kriz, 1995)
2. Spektroskopi NMR
Inti-inti atom unsur-unsur dapat dikelompokkan sebagai mempunyai spin
atau tidak mempunyai spin. Suatu inti berspin akan menimbulkan medan magnet
yang kecil, yang terperikan oleh suatu momen magnetik nuklir, suatu vektor.
Nuklida-nuklida yang mempunyai spin dapat dimanfaatkan dalam spektroskopi
NMR, mereka menyerap energi tidak pada radiofrekuensi yang sama (Fessenden
dan Fessenden, 1986).
Dalam spektroskopi NMR, suatu medan magnet luar diciptakan oleh
suatu magnet tapalkuda permanen atau suatu elektromagnet. Kuat medan luar ini
dilambangkan dengan Ho ,dan arahnya dinyatakan oleh sebuah anak panah. Bila
molekul yang mengandung atom-atom hidrogen ditaruh dalam medan magnetik
luar, maka momen magnetik (dari) tiap inti hidrogen, atau proton, mengambil
salah satu dari sikap (orientasi) dilihat dari medan magnet luar itu. Kedua orientasi
yang diambil oleh momen magnetik nuklir itu adalah paralel atau antiparalel
terhadap medan luar (Fessenden dan Fessenden, 1986).
Bila gabungan khusus antara kuat medan magnet luar dan radio
frekuensi, menyebabkan suatu proton berpindah dari keadaan paralel ke keadaan
antiparalel, maka dikatan proton itu dalam resonansi. Istilah resonansi magnetik
nukir berarti “inti-inti dalam resonansi dalam medan magnet” (Fessenden dan
Fessenden, 1986).
Medan magnet yang sebenarnya dialami oleh sebuah proton dalam
sebuah molekul tertentu adalah gabungan dua medan: (1) medan magnet luar (Ho)
yang dipasang dan (2) medan magnet molekul imbasan (induced), suatu medan
magnet kecil yang terimbas dalam molekul itu oleh Ho. Medan magnet yang
dialami oleh sebuah proton juga diubah oleh keadaan-keadaan spin (dari)
18
aneka ragam kombinasi antara Ho dan radiofrekuensi, karena proton-proton ini
ada dalam lingkungan molekular (dan magnetik) yang berlain-lainan. Karena
berbeda-beda dalam penyerapan energi oleh proton-proton, maka dapat diperoleh
suatu spektrum dari perbagai macam proton Proton yang lebih mudah terbalik
akan menyerap energi pada Ho lebih rendah; proton-proton ini akan menimbulkan
peak bawah-medan (downfield;lebih ke kiri). Proton yang sukar membalik akan
menyerap energi pada Ho tinggi dan menimbulkan peak yang atas medan (upfield;
lebih ke kanan) (Fessenden dan Fessenden, 1986).
Dalam suatu spektrum NMR, posisi serapan oleh sebuah proton
tergantung pada kuat netto medan magnet lokal yang mengitarinya. Medan lokal
ini merupakan hasil medan terapan Ho dan medan molekul terimbas yang
mengitari proton itu dan berlawanan dengan medan terapan. Jika medan imbasan
sekitar sebuah proton itu relatif kuat maka medan itu melawan Ho dengan leibh
kuat dan diperluas medan terapan yang lebih besar untuk membawa proton itu
agar beresonansi. Dalam hal ini, proton itu dikatakan terperisai (shielded) dan
absorpsinya terletak di atas medan dalam spektrum itu. Atau sebalilknya jika
medan imbasan di sekitar sebuah proton itu relatif lemah, maka medan yang
dipakai juga lemah dan membawa proton ini ke dalam resonansi. Proton itu
dikatakan tak terperisai (deshielded) dan absorbsinya muncul di atas medan
(Fessenden dan Fessenden, 1986).
Terperisai dan tak terperisai adalah istilah relatif. Untuk memperoleh
pengukuran yang kuantitatif diperlukan suatu titik rujukan (referensi). Senyawa
yang dipilih untuk titik rujukan adalah tetrametilsilana (TMS) yang
protonnya menyerap pada ujung kanan dalam spektrum H1-NMR. Geseran kimia
dilaporkan dalam nilai δ, yang dinyatakan sebagai bagian tiap juta (ppm) dari
radiofrekuensi yang digunakan. Pada 60 MHz, 1,0 ppm ialah 60 Hz; jadi suatu
nilai δ sebesar 1,0 ppm berarti 60 Hz bawah-medan dari posisi absorpsi TMS yang
dipasang pada 0 ppm.(Fessenden dan Fessenden, 1986)
Sebuah proton yang tidak memiliki proton tetangga yang secara
magnetik tak-ekuivalen dengannya, akan menunjukkan sebuah peak tunggal, yang
disebut singlet, dalam spektra H1-NMR. Sebuah proton yang memiliki satu proton
tetangga yang tak-ekuivalen dengannya, akan memberikan suatu isyarat yang
terbelah menjadi satu peak rangkap, atau doblet. Jika sebuah proton (Ha)
mempunyai tetangga berupa dua proton yang ekuivalen satu sama lain, tetapi
tidak ekuivalen dengan dirinya, maka isyarat NMR Ha adalah suatu triplet (2 + 1
=3). Jika kedua proton itu yang ditandai dengan Hb, ekuivalen, maka keduanya
memberikan sinyal yang terpisah oleh Ha menjadi suatu doblet (Fessenden dan
Fessenden, 1986).
Geseran kimia untuk senyawa 5-nitro-2-furfuraldiasetat ialah 7,71
(singlet, 1H, C-H); 7,30 (doblet, 2H, H-C4 furan); 6,74 (doblet, 2H, H-C3 furan);
2,18 (singlet, 6H, CH3) (Tehrani, Zarghi, dan Fathali, 2003)
D. Landasan Teori
Reaksi yang terjadi pada sintesis 5-nitro-2-furfuraldiasetat adalah reaksi
nitrasi dan esterifikasi. Secara umum, untuk melakukan reaksi nitrasi perlu dibuat
suatu agen elektrofilik berupa ion nitronium yang merupakan reaksi antara asam
20
dapat merusak heterosiklik maka dibuat suatu agen penitrasi yang lebih tidak
terlalu reaktif. Agen penitrasi ini dibuat dengan melarutkan asam nitrat dengan
katalis asam kuat dalam asam asetat anhidrida. Asam asetat anhidrida dapat
bereaksi sebagai agen penghidrasi untuk menghasilkan ion nitronium dari asam
nitrat. Oleh karena adanya asam sulfat dapat menyebabkan hidrolisis menjadi
senyawa 1,4-dikarbonil maka pada penelitian ini digunakan katalis asam
p-toluenasulfonat.
Reaksi esterifikasi dapat terjadi pada gugus aldehid. Syarat utama yang
harus dipenuhi adalah adanya adisi oleh molekul air dengan adanya suasana asam
pada gugus aldehid sehingga membentuk suatu gugus 1,1-diol. Dengan adanya
gugus alkohol, dan karboksil dalam suasana asam dan pemanasan, maka dapat
terjadi reaksi esterifikasi. Reaksi in bersifat reversibel. Hasil reaksi dilakukan uji
pendahuluan dengan pemeriksaan organoleptis, titik lebur, kelarutan, dan uji
pemisahan menggunakan KLT serta elusidasi struktur menggunakan instrumen
spektroskopi inframerah dan H1-NMR.
E. Hipotesis
Berdasarkan reaktifitas furfural yang direaksikan dengan asam nitrat dan
asam asetat anhidrida dengan adanya katalis asam p-toluenasulfonat diduga
dihasilkan senyawa 5-nitro-2-furfuraldiasetat.
BAB III
METODE PENELITIAN
A. Jenis Penelitian
Penelitian ini termasuk penelitian non eksperimental.
B. Definisi Operasional
1. Starting material: merupakan senyawa yang digunakan dalam sintesis yang
merupakan senyawa awal, dalam hal penelitian ini adalah furfural, asam asetat
anhidrida, dan asam nitrat
2. Katalis: merupakan senyawa yang digunakan untuk meningkatkan laju reaksi
kimia. Dalam penelitian ini digunakan p-toluenasulfonat
3. Molekul target: merupakan senyawa yang diharapkan terbentuk pada
penelitian yaitu 5-nitro-2-furfuraldiasetat
C. Variabel Penelitian
Variabel Penelitian: Rendemen 5-nitro-2-furfuraldiasetat
D. Alat Dan Bahan Penelitian
1. Alat penelitian
Seperangkat alat gelas yang lazim untuk kegiatan sintesis, seperangkat
instrument untuk elusidasi yaitu: IR (Prestige-21 Shimadzu), H1-NMR
(JOEL-MY60), pH meter/indikator pH universal (Merck®), corong Buchner, mesin
22
alat uji titik leleh (Elektrothermal 9100), dan sistem KLT (pelat kaca, chamber
pengembang)
2. Bahan penelitian
Furfural for synthesis (Merck), asam p-toluenasulfonat GR (Merck),
asetat anhidrida analytical reagent (Analar), asam nitrat extra pure (SIMAC),
etanol 96% teknis (Bratachem), aquades, natrium hidroksida teknis (Bratachem),
kloroform teknis (Bratachem), methanol teknis (Bratachem), eter teknis
(Bratachem), aseton teknis (Bratachem), silika gel GF254 (Merck), kloroform p.a
(Merck), dan metanol p.a (Merck)
E. Tatacara Penelitian
1. Cara sintesis
Campuran asam nitrat pekat (2,5 ml) dan asam p-toluenasulfonat (1 g
dilarutkan dalam air sesedikit mungkin hingga larut) ditambahkan bertetes-tetes
pada 26 ml asam asetat anhidrid pada suhu -5oC sampai 5oC. Ke dalam larutan ini
ditambahkan furfural 3 ml, dalam kondisi yang sama. Campuran diaduk dalam
pendingin es selama 1 jam. Kemudian, campuran ditambahkan 23,3 ml air pada
suhu kamar. Sesudah 30 menit, pH diusahakan sekitar 3,5-4,5. Campuran
dipanaskan pada suhu 55oC selama 1 jam. Kemudian, campuran diaduk dengan
magnetik stirer pada suhu 0°C-15°C selama 2 jam. Campuran didiamkan di dalam
lemari pendingin sampai terbentuk endapan. Endapan yang terbentuk disaring lalu
dilakukan pencucian pada suhu kamar dengan air sampai tetesan pada corong
Buchner sampai tidak memerahkan lakmus biru dan tidak membirukan lakmus
merah. Endapan yang terbentuk dikumpulkan dan dilarutkan dengan etanol teknis
96% panas 50 ml dan diaduk dengan magnetik stirer sampai larut. Endapan
disaring panas-panas dengan corong Buchner dan labu hisap. Fase etanol panas
kemudian didinginkan pada suhu ruang sampai timbul kristal. Kristal kemudian
disaring dengan kertas saring yang telah ditara menggunakan alat corong Buchner
dan labu hisap. Kristal yang terkumpul di simpan dalam desikator
2. Uji pendahuluan dan elusidasi struktur
a. Uji organoleptis. Produk diamati bentuk, warna, dan bau.
b. Uji kelarutan. Dalam tabung reaksi, kurang lebih 10 mg serbuk hasil
sintesis ditetesi pelarut 0,1 ml, bila perlu dilakukan penggojogan, jika belum larut
ditambahkan pelarut setiap 0,1 ml dan diamati jumlah pelarut yang ditambahkan
hingga senyawa hasil reaksi tepat larut. Pelarut yang digunakan untuk uji
kelarutan adalah aqudes, metanol, aseton, eter, dan kloroform
c. Uji titik lebur. Sedikit serbuk hasil sintesis diisikan kedalam tabung
kapiler kemudian dimasukkan pada thermophan dengan suhu 60oC (dibawah titik
lebur teoritis 5-nitro-2-furfuraldiasetat yaitu 90oC). Kristal diamati dan dicatat
suhu pada saat pertama melebur hingga semua massa kristal mencair.
d. Uji KLT. Dilakukan uji KLT dengan sistem normal dengan
menotolkan furfural dan senyawa hasil sintesis (fase diam = silika gel GF 254,
fase gerak = kloroform P : metanol P = 9:1, pelarut aseton, detektor = 750 mg
24
hingga 200 ml. Tiap bercak larutan uji pada harga Rf lebih kurang 0,7) (Anonim,
1995)
e. Elusidasi struktur. Dilakukan dengan instrumen spektroskopi
inframerah (Prestige-21 Shimadzu) dan spektroskopi H1-NMR (JOEL-MY60) di
fakultas MIPA UGM Yogyakarta
3. Analisis hasil
a. Data organoleptis. Data organoleptis senyawa hasil sintesis
dibandingkan dengan furfural untuk mengetahui perbedaan bau, warna dan wujud.
b. Data uji kelarutan. Kelarutan senyawa hasil sintesis dibandingkan
dengan furfural pada pelarut aquades, metanol, aseton, eter, dan kloroform.
c. Data uji titik lebur. Semakin sempit range temperatur pertama dan
kedua pada titik lebur senyawa hasil sintesis, maka senyawa tersebut semakin
murni.
d. Data kromatogram KLT. Jika hasil elusi totolan senyawa hasil
sintesis terdapat bercak tunggal, senyawa hasil sintesis tersebut murni.
e. Data spektra inframerah dan H1-NMR. Spektra inframerah senyawa
hasil sintesis dibandingkan dengan spektra inframerah furfural untuk mengetahui
perbedaan gugus-gugus. Posisi proton pada senyawa hasil sintesis diketahui dari
data spektra H1-NMR.
f. Perhitungan rendemen. Senyawa hasil reaksi yang sudah murni
dihitung dengan persamaan:
Rendemen = Berat senyawa hasil percobaan x 100% Berat senyawa secara teoritis
BAB IV
HASIL DAN PEMBAHASAN
A. Sintesis 5-nitro-2-furfuraldiasetat
Reaksi nitrasi pada cincin furan dilakukan dengan membuat suatu ion
nitronium dengan campuran asam nitrat dan katalis asam p-toluenasulfonat.
Keunggulan yang diberikan dengan penggunaan asam p-toluenasulfonat
dibandingkan dengan asam sulfat adalah suasana reaksi yang dihasilkan lebih
tidak reaktif; tidak terjadi lonjakan suhu yang drastis sehingga pengontrolan suhu
reaksi lebih mudah dan kemungkinan terjadinya reaksi pembukaan cincin furan
sangat kecil.
Reaksi pembukaan cincin furan pada furfural sangat dipengaruhi oleh
keberadaan proton. Reaksi substitusi elektrofilik proton terhadap cincin furan
merupakan mekanisme pembukaan cincin furan. Asam sulfat mempunyai nilai
pKa = -9 sehingga keberadaan asam sulfat akan berpotensi untuk terjadi reaksi
pembukaan cincin furan 108 kali lebih spontan daripada asam p-toluenasulfonat
yang nilai pKa = -0,6. Berikut adalah mekanisme reaksi pembukaan cincin furan
pada furfural terinduksi oleh adanya asam sulfat.
26
O H
O
H O H
O O H H O H O O H O H
O O O
H 2-oxopentanedial
Gambar 12. Mekanisme pembukaan furfural karena adanya asam sulfat
S O
O
O H S
O
O
O H
Gambar 13. Mekanisme deprotonasi asam p-toluenasulfonat
H O N O
O
H H O N O
O H
H O H N
O O
Gambar 14. Mekanisme pembentukan ion nitronium
Ion nitronium ini akan bereaksi dengan asetat anhidrida membentuk nitroasetat
(gambar 15) yang sangat berguna untuk membentuk suasana yang lebih tidak
reaktif ketika proses nitrasi cincin furan. Bagaimanapun juga, karena campuran
asam nitrat dan asam sulfat akan merusak heterosiklik, agen penitrasi yang lebih
tidak terlalu reaktif dibuat dengan melarutkan asam nitrat dalam asam asetat
anhidrida (Ege, 1989). Oleh karena itu, diperlukan suatu nitroasetat sebagai agen
penitrasi cincin furan. Pencampuran antara ion nitronium dengan asetat anhidrida
perlu dijaga suhu antara -5ºC sampai dengan 5ºC bertetes-tetes untuk menghindari
reaksi eksotermis yang mengakibatkan menguapnya ion nitronium.
O O O N O O O O O N O O O
O H H
O
H O H
O N
O
O O
Gambar 15. Mekanisme pembentukan nitroasetat
Gugus aldehid pada cincin furan akan membentuk suatu 1,1-diol, yang disebut
gem-diol, atau hidrat dengan adanya air dan asam (Fessenden dan
Fessenden,1986) O O H O O H -H H
H2O
H O H
O O H H O H H -H O O H H O H
28
Reaksi ini adalah reversibel. Arah pergeseran reaksi sangat tergantung dengan
elektrofilisitas dari atom C karbonil. Rapatan elektron pada atom C karbonil pada
furfural bergeser ke arah atom O karbonil dan sistem konjugasi cincin furan.
Dengan adanya pergeseran rapatan elektron pada atom C karbonil maka, atom C
karbonil akan semakin bermuatan positif sehingga kesetimbangan reaksi bergeser
ke arah kanan. Berdasarkan perhitungan dengan kimia komputasi (gambar 17),
muatan atom C karbonil memang paling positif diantara muatan atom yang lain.
O
O H
H
H H
0,133
0,253
-0,279 -0,156
-0,096
0,176 0,168
0,195 -0,056
-0,219 -0,101
Gambar 17. Muatan atom-atom penyusun furfural
Substitusi elektrofilik terjadi pada posisi α karena pada posisi α
mempunyai koefisien HOMO (Highest Occupied Molecular Orbital) yang lebih
tinggi daripada posisi β. Selain itu substitusi elektrofilik tidak terjadi pada
heteroatom karena ada dua alasan. Alasan pertama adalah heteroatom telah
memberikan pasangan elektron bebasnya kepada sistem aromatik furan sehingga
tidak memungkinkan untuk memberikan elektron pada spesi elektofilik. Alasan
kedua adalah heteroatom oksigen mempunyai karakter kuat sebagai penarik
elektron karena sifat keelektronegatifannya yang lebih besar daripada atom C α
sehingga mempunyai kecenderungan untuk memberikan elektron pada spesi
elektrofilik sangat kecil.
O OH OH O O O OH OH O2N
H O O ±55ºC N O O δ δ O OH OH
O2N HO
O
Gambar 18. Mekanisme nitrasi pada furfural hidrat
Oleh karena dalam suasana asam dan terdapat asam asetat yang mempunya gugus
karboksilat dan adanya gugus diol maka terjadi reaksi esterifikasi. Reaksi ini
reversibel sehingga dimungkinkan dengan adanya air dan asam pada suhu 55ºC
gugus ester yang terjadi terhidrolisis kembali (gambar 19).
O
OH
OH O2N
HO O H+ HO O H O OH OH O2N
O
OH
O O2N
H
OH
OH
-H+ O
OH
O
O2N OH
OH H
30
O
OH
O
O2N OH
O
H H
-H2O O
OH
O
O2N O H
O
OH
O
O2N O
O
OH
O
O2N HO
O H+ HO O O -H+ O O O O2N
O OH OH H O O O O2N
O O O H H H O O O O2N
O O
H2O
-H+
Gambar 19. Mekanisme esterifikasi pada 5-nitro-2-furfuralhidrat
Dalam lingkungan yang sangat asam (pH 1- 2), cincin furan akan sangat berisiko
untuk terjadi reaksi pembukaan cincin (ring-opening reaction) dan terjadi
polimerisasi (Gilchrist, 1985). Oleh karena itu diperlukan suasana yang tidak
terlalu reaktif (pH 3,5-4,5) sebelum proses pemanasan. Hal yang perlu
diperhatikan adalah ketika penambahan basa perlu diperhatikan suhu dan
dilakukan bertetes-tetes karena furfural dapat terpicu secara cepat menjadi polimer
ketika ditambahkan alkali dalam suasana panas.
B. Uji Pendahuluan
Uji pendahuluan dilakukan dengan tujuan mengetahui karakteristik dan
kemurnian dari senyawa hasil reaksi, meliputi uji organoleptis, uji titik lebur, uji
kelarutan, dan uji KLT fase normal. Uji pendahuluan senyawa hasil reaksi (uji
organoleptis, uji kelarutan dan uji KLT) dilakukan dengan pembanding furfural
sebagai senyawa yang akan diderivatisasi.
1. Uji Organoleptis
Hasil pemeriksaan organoleptis yang meliputi bentuk, warna, dan bau
senyawa hasil reaksi dibandingkan dengan furfural ditunjukkan pada tabel 2.
(a)
(b)
Gambar 20. Kristal senyawa hasil sintesis setelah rekristalisasi (a) dan furfural (b)
Tabel 2. Perbandingan organoleptis senyawa hasil reaksi dengan reaktan
Pemeriksaan Senyawa hasil reaksi Furfural
Bentuk Kristal padat bulat Cair
Warna Coklat muda Coklat
32
Dari hasil pemeriksaan organoleptis di atas, maka dapat disimpulkan
bahwa senyawa hasil reaksi berbeda dengan furfural. Dengan demikian, dapat
diperkirakan rumus struktur molekul hasil reaksi sudah berbeda dengan furfural.
2. Uji Kelarutan
Pemeriksaan kelarutan senyawa hasil reaksi dilakukan selain untuk
mengetahui polaritas suatu senyawa juga untuk acuan dalam memilih pelarut yang
digunakan untuk analisa H1-NMR. Berdasarkan batasan larut berdasarkan
Farmakope Indonesia adalah IV adalah 10 sampai 30 bagian pelarut dapat
melarutkan 1 bagian zat, sedangkan batasan praktis tidak larut dalam Farmakope
Indonesia IV adalah lebih dari 10.000 bagian pelarut yang digunakan untuk
melarutkan 1 bagian zat.
Hasil pemeriksaan kelarutan menggunakan pelarut aquades, metanol
aseton, eter, dan kloroform terhadap senyawa hasil reaksi dan reaktan dapat
ditunjukkan pada tabel 3.
Tabel 3. Data kelarutan senyawa hasil reaksi dengan furfural
Pelarut Senyawa hasil reaksi Furfural
Akuades praktis tidak larut larut
Metanol larut larut
Aseton larut larut
Eter larut larut
Kloroform larut larut
Data tersebut menunjukkan bahwa kelarutan senyawa hasil reaksi berbeda
dengan furfural pada pelarut air. Dari hasil pemeriksaan kelarutan, senyawa hasil
reaksi dapat larut dalam pelarut metanol, aseton, eter dan kloroform serta tidak
larut dalam akuades. Tidak larutnya senyawa hasil reaksi dengan pelarut air
menunjukkan bahwa furfural telah mengalami perubahan struktur molekul
sehingga mengakibatkan menurunnya polaritas senyawa hasil reaksi. Dengan
bertambahnya gugus nitro dan tersubstitusinya gugus aldehid dengan gugus ester
pada furfural menyebabkan menurunnya polaritas senyawa hasil reaksi
dibandingkan dengan furfural.
3. Uji Titik Lebur
Informasi yang didapatkan dari pemeriksaan titik lebur adalah informasi
mengenai kemurnian suatu senyawa serta kebenaran identitas suatu senyawa
dengan pembanding titik lebur literatur (Pavia, Lampman, dan Kriz, 1995).
Berdasarkan uji titik lebur yang dilakukan dengan Elektrothermal 9100 di fakultas
MIPA UGM didapatkan data titik lebur senyawa hasil sintesis 89-90°C. Dengan
demikian dapat disimpulkan bahwa titik lebur dari senyawa hasil sintesis
mempunyai kemurnian yang tinggi.
4. Pemisahan dengan KLT
Kandungan suatu senyawa dapat dipisahkan dan diidentifikasi dengan
menggunakan kromatografi lapis tipis (KLT) fase normal. Berdasarkan sistem
KLT untuk 5-nitro-2-furfuraldiasetat (Anonim, 1995) dengan penotolan furfural
sebagai senyawa yang akan diderivatisasi dan senyawa hasil reaksi didapatkan
34
Gambar 21. Hasil pemeriksaan dengan pemisahan secara KLT Keterangan:
1 = furfural
2 = senyawa hasil sintesis
Fase gerak = kloroform : metanol = 9 : 1 (Anonim, 1995) Fase diam = silika gel GF 254 (Anonim, 1995)
Pereaksi penimbul bercak = Fenilhidrazina dalam HCl (Anonim, 1995)
Tabel 4. Data faktor retensi dan warna hasil pemisahan dengan KLT
Kode Bercak Rf Warna
1a 2a
0,73 0,81
Kuning oranye
Berdasarkan kromatogram didapatkan data bercak tunggal pada elusi
senyawa hasil sintesis serta bercak 1a dan 2a mempunyai warna dan nilai Rf
(faktor retensi) yang berbeda. Bercak tunggal merupakan indikasi bahwa senyawa
hasil sintesis sudah merupakan zat tunggal. Perbedaan nilai faktor retensi ini
disebabkan perbedaan afinitas dengan fase diam-fase gerak antara furfural dan
senyawa hasil reaksi. Interaksi fase diam silika dan fase gerak terhadap senyawa
hasil sintesis dan furfural ditunjukkan dengan gambar berikut:
O O Cl Cl Cl δ δ δ (a) O N O O δ δ O O O O δ δ δ δ δ δ Cl Cl Cl Cl Cl Cl δ Cl Cl Cl δ (b) O O
CH3O H
CH3O H
(c) O N O O O O O O
CH3O H
CH3O H
CH3O H
CH3O H
CH3O H
H OCH3
H OCH3
36 O Si O Si O O O H H O O (e) O Si O Si O O O O O N O O O O O O Si O O O Si O O H H H H O Si O Si O O O O Si O O O Si O O H H H H (f)
Gambar 22. Interaksi Van der Waals kloroform dengan furfural (a) dan kloroform dengan senyawa hasil sintesis (b). Ikatan hidrogen metanol dengan furfural (c) dan metanol dengan
senyawa hasil sintesis (d). Ikatan hidrogen silika dengan furfural (e) dan silika dengan senyawa hasil sintesis (f)
Interaksi silika sebagai fase diam dengan furfural dan senyawa hasil
sintesis adalah ikatan hidrogen. Ikatan hidrogen terbentuk karena pada silika
terdapat gugus –OH dimana atom hidrogen sangat mudah untuk berinteraksi
terhadap atom oksigen, atau nitrogen yang mempunyai pasangan elektron bebas.
Atom hidrogen ini berinteraksi pada atom oksigen pada furfural dan senyawa hasil
sintesis. Ikatan hidrogen antara silika dengan senyawa hasil sintesis dan furfural
ditunjukkan pada gambar 22.
Afinitas antara fase gerak (kloroform : metanol) pada senyawa hasil reaksi
lebih besar daripada afinitas fase gerak dengan furfural. Afinitas ini diperngaruhi
oleh intensitas interaksi Van der Waals senyawa hasil reaksi dengan kloroform
dan ikatan hidrogen antara metanol dan senyawa hasil reaksi lebih besar
dibandingkan dengan intensitas interaksi Van der Waals kloroform dengan
furfural dan ikatan hidrogen antara metanol dan furfural.
Afinitas ini mengakibatkan senyawa hasil reaksi terelusi lebih cepat
daripada furfural. Perbedaan kecepatan terelusi senyawa hasil sintesis dengan
furfural membuat nilai faktor retensi senyawa hasil reaksi lebih besar daripada
furfural.
Perbedaan afinitas fase diam-fase gerak antara furfural dan senyawa hasil
reaksi menunjukkan bahwa antara furfural dan senyawa hasil reaksi mempunyai
struktur yang berbeda. Ketika disemprot dengan pereaksi penampak bercak
(Anonim, 1995), bercak hasil elusi furfural (1a) menampakkan warna kuning
sedangkan bercak hasil sintesis berwarna oranye (2a). Adanya perbedaan
intensitas warna ini dapat dijelaskan dengan mekanisme reaksi berikut (gambar
23, 24, dan 25):
O O2N
O
O
O O
H N H2N
O O2N
O
O
O O
H N HN
H
Gambar 23. Mekanisme serangan nukleofil oleh fenilhidrazina
Fenilhidrazina bertindak sebagai nukleofil menyerang atom karbon karbonil.
38
nitrogen yang kekurangan muatan negatif menuju ke atom oksigen karbonil yang
kelebihan muatan.
O O2N
O O HO O H N N H Cl H O O2N
O O O O H N N H H H Cl
Gambar 24. Mekanisme proton shift dan dehidrasi
Terjadinya penambahan gugus hidroksi dan gugus amino pada atom karbon yang
sama akan menyebabkan dehidrasi secara mudah sehingga terbentuk ikatan tak
jenuh antara atom nitrogen dan atom karbon. Proses dehidrasi ini dikatalisis oleh
suasana asam.
Gugus hidroksi ini menjadi suatu gugus pergi (leaving group) yang baik
ketika terprotonasi dan posisi molekul air ini akan tergantikan oleh pasangan
elektron bebas dari atom nitrogen. Oleh karena penyemprotan pereaksi penampak
bercak dilakukan sesaat setelah sistem KLT dipanaskan 105°C selama 5 menit,
maka air dan HCl akan menguap. Reaksi yang sama terjadi pada gugus karbonil
berikutnya:
O O2N
O O O N N H N H H2N
O O2N
O O O N N H N H H2N
O O2N
O O O N N H N H N H H O O2N
O O O N N H N H N H H H Cl O O2N
O O O N N H N H N H H H Cl O O2N
O N O N H N H N
(1E,1'E)-(5-nitrofuran-2-il)metilena bis(N'-fenilasetohidrazonat)
2H2O 2HCl
Gambar 25. Mekanisme pembentukan (1E,1’E)-(5-nitrofuran-2-il)metilena bis (N’-fenil-aseto-hidrazonat)
Dengan penjelasan yang sama, mekanisme reaksi antara furfural dan
fenilhidrazina dapat ditunjukkan sebagai berikut:
O
O
N H H2N
40
O
N H N
H2O HCl
(E)-1-(furan-2-ilmetilena)-2-fenilhidrazina
Gambar 26. Mekanisme pembentukan (E)-1-(furan-2-ilmetilena)-2-fenilhidrazina
Hasil reaksi antara furfural dan fenilhidrazina menghasilkan senyawa
(E)-1-(furan-2-ilmetilena)-2-fenilhidrazina yang mempunyai gugus kromofor dan
auksokrom.
O
N N
ket.: gugus kromof or gugus auksokrom
H
Gambar 27. Gugus kromofor dan auksokrom pada senyawa (E)-1-(furan-2-ilmetilena)-2-fenilhidrazina
Adanya gugus kromofor ini, memungkinkan adanya overlap pada orbital π
sehingga terjadi penurunan beda energi pada orbital yang berdekatan. Ketika
terjadi eksitasi elektron, senyawa ini hanya membutuhkan energi yang kecil untuk
melakukan transisi elektronik. Energi yang dibutuhkan untuk melakukan transisi
elektronik berkaitan dengan frekuensi atau panjang gelombang sesuai dengan
persamaan:
λ
hc
E = (1)
dimana E adalah energi dari foton dalam satuan erg dan h adalah konstanta
Planck. Persamaan ini menunjukkan semakin kecil yang diserap maka semakin
besar panjang gelombang yang diserap. Senyawa
(E)-1-(furan-2-ilmetilena)-2-fenilhidrazina menyerap panjang gelombang antara 435-480 nm sehingga warna
komplementer yang diteruskan atau warna yang terlihat adalah warna kuning.
Senyawa (1E,1’E)-(5-nitrofuran-2-il)metilena bis
(N’-fenil-aseto-hidrazonat) yang merupakan produk dari senyawa hasil reaksi dan fenilhidrazina
(gambar 28) mempunyai gugus kromofor dan auksokrom yang lebih banyak
daripada senyawa (E)-1-(furan-2-ilmetilena)-2-fenilhidrazina. Dengan adanya
gugus kromofor dan auksokrom yang lebih banyak maka dapat terjadi pergeseran
panjang gelombang yang lebih besar yaitu 480-490 nm. Dengan rentang panjang
gelombang tersebut warna komplementer yang terlihat adalah oranye.
O N
O N
O
N N
N O
O
H H
ket.: gugus kromofor
gugus auksokrom
42
C. Elusidasi Struktur Senyawa Hasil Sintesis
1. Spektroskopi Inframerah
Keberadaan gugus-gugus fungsional dapat dianalisa secara kualitatif
dengan spektroskopi inframerah. Gambar 29 dan gambar 30 merupakan spektra
inframerah furfural dan senyawa hasil sintesis. Tabel 5 menunjukkan hasil
interpretasi spektra inframerah antara senyawa hasil sintesis dan furfural sebagai
pembanding.
Gambar 29. Spektra inframerah furfural
Tabel 5. Interpretasi spektra inframerah furfural
Kode Gugus Fungsional Bilangan Gelombang
A1 A2 B1 B2 B3
gugus C-H pada furan gugus C=C pada furan gugus C=O pada aldehid gugus C-H pada aldehid gugus C-H pada aldehid
3132,2 cm-1 1080,1 cm-1 1678,0 cm-1 2754,2 cm-1 2850,6 cm-1
Pada spektra inframerah furfural terdapat gugus aldehid, dan furan. Gugus
aldehid terdiri dari gugus C=O dan gugus C-H. Gugus C=O ditunjukkan dengan
adanya serapan pita vibrasi tarikan gugus C=O sekitar 1725 cm-1 jika normal.
Namun, karena adanya sistem konjugasi pada cincin furan, maka serapan bergeser
ke kanan (Pavia, Lampman, dan Kriz, 1995). Serapan pada 1678 cm-1 pada B1
menunjukkan gugus C=O. Gugus C-H ditunjukkan dengan adanya serapan lemah
sekitar 2750 cm-1 dan 2850 cm-1 (Pavia, Lampman, dan Kriz, 1995). Serapan
2754,2 cm-1 dan 2850,6 cm-1 pada serapan B2 dan B3 menunjukkan gugus C-H
aldehid. Serapan gugus furan terdiri dari gugus C=C yang memberikan serapan
antara 1100-1010 cm-1 dan gugus C-H pada serapan sekitar 3180-3090 cm-1.
Serapan A2 pada 1080,1 cm-1 menunjukkan gugus C=C furan dan serapan A1 pada
3132,2 cm-1 menunjukkan gugus C-H furan.
44
Tabel 6. Interpretasi spektra inframerah senyawa hasil sintesis
Kode Gugus Fungsional Bilangan Gelombang
A1
A2
A3
BB1
BB2
BB3
C1
C2
C3
D1
Gugus C-H furan
Gugus C=C konjugasi furan Gugus C-H furan
Gugus C-O gugus ester Gugus C-O gugus ester Gugus C=O gugus ester Gugus NO2
Gugus NO2
Gugus NO2
Gugus C-H
817,82 cm-1 1072,42 cm-1 3132,40 cm-1 1010,70 cm-1 1211,30 cm-1 1759,08 cm-1 1334,74 cm-1 1357,89 cm-1 1512,19 cm-1 3001,24 cm-1
Gugus furan ditunjukkan dengan adanya serapan pada gugus C-H dan
C=C. Pita vibrasi kibasan gugus C-H nampak pada serapan sekitar 815-795 cm-1
daerah sidik jari (finger print) yang ditunjukkan pada serapan A1 817,82 cm-1 dan
3180-3090 cm-1 yang ditunjukkan pada serapan A3 3132,40 cm-1. Sedangkan
gugus C=C terkonjugasi dalam cincin furan memberikan serapan pada 1100-1072
cm-1yang ditujukkan pita A2 1072,42 cm-1
Gugus ester terdiri dari gugus karbonil C=O, dan gugus C-O. Adanya
gugus ester didukung oleh adanya spektra C=O yang akan memberikan serapan
sekitar 1735 cm-1pada ester normal. Akan tetapi, jika gugus R’ yang terikat pada
atom O nonkarbonil merupakan sistem terkonjugasi maka serapan akan bergeser
ke kiri (Pavia, Lampman, dan Kriz, 1995). Pada gambar 30 pita B3 mempunyai
serapan sebesar 1759,08 cm-1 sehingga dapat diinterpretasikan sebagai gugus
C=O. Gugus C-O akan memberikan lebih dari satu serapan dimana pita yang satu
akan lebih kuat serapannya daripada pita yang lain sekitar 1300-1000 cm-1 (Pavia,
Lampman, dan Kriz, 1995). Dalam gambar 30 nampak dua buah pita B1 dan B2
yang serapannya masing-masing 1211,30 cm-1 dan 1010,70 cm-1 dimana pita B1
lebih kuat serapannya daripada B2. Pita-pita ini menunjukkan adanya gugus C-O.
Dengan adanya gugus C=O dan C-O, dapat disimpulkan senyawa hasil sintesis
memiliki gugus ester.
Gugus nitro ditunjukkan dengan adanya serapan pada serapan kuat dua
buah pita pada 1600-1500 cm-1 dan 1390-1300 cm-1 (Pavia, Lampman, dan Kriz,
1995). Pada gambar 30 ditunjukkan adanya pita C1-C2 serta C3 yang
masing-masing mempunyai serapan 1357,89-1334,74 cm-1 dan 1512,19 cm-1. Pita-pita ini
merupakan tanda adanya gugus nitro pada senyawa hasil sintesis.
Serapan gugus C-H alkana muncul pada 3000 cm-1. Serapan ini dapat
bergeser ke arah kiri jika menempel pada gugus aromatik (Pavia, Lampman, dan
Kriz,