DO NOT COPY
Performa Adsorben SG dan KS dalam Pemurnian Bioetanol Hasil Fermentasi Singkong (Manihot utilissima)
Ijang Rohman, Yaya Sonjaya, Pingky Chandra Priyanka Program Studi Kimia Jurusan Pendidikan Kimia Fakultas Pendidikan Matematika dan Ilmu Pengetahuan Alam
Universitas Pendidikan Indonesia Bandung 40514, Indonesia
ABSTRAK
Telah dilakukan penelitian mengenai pemurnian bioetanol dengan metode destilasi dan adsorpsi (batch system). Penelitian ini bertujuan untuk 1) mengetahui kemampuan adsorben (SG dan KS) sebagai agen untuk pemurnian bioetanol dan, 2) untuk mengetahui metode terbaik dalam pemurnian bioetanol. Dalam penelitian ini, dilakukan pembuatan bioetanol dari singkong (Manihot Utilissima) yang dihidrolisis menggunakan Aspergillus niger dan difermentasi menggunakan ragi. Hasil fermentasi dimurnikan melalui tahap destilasi dan adsorpsi. Sebelum diaplikasikan terhadap bioetanol, adsorben dioptimasi terlebih dahulu dengan menggunakan etanol teknis 96%. Berdasarkan hasil optimasi, diketahui bahwa waktu kontak adsorpsi dengan menggunakan adsorben SG adalah 20 menit dengan jumlah 15 gram, sedangkan waktu kontak adsorpsi adsorben KS adalah 5 menit dengan jumlah 5 gram. Hasil Adsorpsi dianalisis dengan instrumen GC. Berdasarkan hasil analisis GC, diperoleh bahwa adsorben SG mampu memurnikan bioetanol hingga 99,962% dan adsorben SG-KS mampu memurnikan hingga 99,954%. Sementara itu, adsorben KS dan KS-SG dapat memurnikan bioetanol hingga 100%. Dengan demikian dapat disimpulkan bahwa, adsorben SG dan KS sama baiknya digunakan untuk pemurnian bioetanol sedangkan pengaruh dual adsorben (SG-KS dan KS-SG) ternyata tidak berbeda secara signifikan.
Kata kunci: Adsorpsi, Bioetanol, Adsorben SG,Adsorben KS ABSTRACT
An effort to purify bioethanol using distillation and adsorption methods has been carried out. The aims of this research are to investigate the efficiency of two adsorbents, SG and KS, in the purification process of bioethanol resulted from the fermentation of Manihot Utilissima using Aspergillus niger and yeast. These adsorbents were first tested using ethanol 96 % solutions. The result showed that the optimum contact time for SG and KS were 20 minutes and 5 minutes, respectively. The purity of product resulted from the adsorption method was measured using GC analysis. The KS adsorbent and the dual adsorbent, KS-SG, were able to produce bioethanol with the purity of 100%.
DO NOT COPY
PENDAHULUAN
Bioetanol merupakan etanol hasil dari fermentasi karbohidrat, yang dapat dimanfaatkan sebagai bahan bakar. Salah satu sumber bahan baku pembuatan bioetanol adalah singkong (Manihot utilissima). Bioetanol yang didapatkan dari hasil fermentasi singkong mengandung persentasi etanol yang cukup rendah. Hal ini dibuktikan dengan beberapa penelitian yang sudah dilakukan. Diantaranya penelitian yang dilakukan oleh Ansori (2011) dan Saripah (2011) yang menghasilkan bioetanol dengan kadar masing-masing 7,03 % dan 9,69%. Hal ini seiring dengan hasil penelitian lainnya yang menyatakan bahwa kadar bioetanol hasil fermentasi singkong ini memiliki sekitar 7-15 %.
Sedangkan, menurut Badan Standarisasi Nasional, BSN (2008), bioetanol potensial untuk dimanfaatkan sebagai bahan bakar kendaraan bermotor, apabila sudah diolah menjadi fuel grade ethanol, dengan syarat bioetanol memiliki kadar kemurnian 99,5%. Keberadaan air dalam bahan bakar walaupun dengan kadar yang sedikit sangat berpengaruh terhadap performa mesin. Oleh karena itu, diperlukan pengolahan khusus untuk memisahkan etanol dari air.
Ada beberapa cara untuk dapat memisahkan etanol-air, yaitu dengan destilasi azeotrop, dan adsorpsi. Destilasi azeotrop membutuhkan biaya yang cukup tinggi. Selain itu, juga dibutuhkan solvent yang tidak ramah lingkungan seperti benzene atau sikloheksan. Cara lain untuk me-misahkan campuran azeotrop ini adalah dengan adsorpsi. Adsorben yang dapat digunakan bisa berupa adsorben organik maupun anorganik. Salah satu penelitian menggunakan
adsorben organik adalah penelitian yang dilakukan oleh Chontira Boonfung dan Panarat Rattanaphanee (2010). Berdasarkan penelitiannya, diketahui bahwa adsorpsi meng-gunakan adsorben berbasis pati mampu mendehidrasi etanol dengan produksi etanol yang didapat yaitu 0,3 gram etanol per gram adsorben. Adsorben organik seperti adsorben berbasis pati ini, cukup baik untuk adsorpsi air, namun baik tidaknya adsorben sangat bergantung pada bahan baku yang digunakan.
Penggunaan adsorben anorganik telah dilakukan oleh Ivanova, Damgaliev, dan Kostova (2009). Dalam penelitiannya, digunakan zeolit alam, clinoptilolite, yang merupakan molecular sieve, yang digunakan sebagai agen pengadsorpsi untuk memisahkan etanol dan air. Adsorben anorganik ini dipilih karena berasal dari bahan-bahan non pangan sehingga tidak terpengaruh oleh ketersediaan pangan. Namun untuk penggunaan molecular sieve seperti zeolit, dibutuhkan biaya yang cukup mahal, selain itu energi yang dibutuhkan untuk regenerasi adsorben cukup tinggi.
Oleh karena itu, dalam penelitian ini dikembangkan adsorben lain diantaranya SG dan KS. Adsorben ini dipilih karena biaya yang relatif murah dan baik untuk menyerap air.
METODE PENELITIAN Preparasi Singkong
Singkong sebanyak 4 kg diber-sihkan kemudian dihaluskan, lalu diperas hingga mendapat sari sing-kong. Sari didiamkan hingga terbentuk dua lapisan. Lapisan atas merupakan
DO NOT COPY
air dan lapisan bawah merupakan pati. Pati dipisahkan dan dikeringkan di bawah sinar matahari.
Preparasi Adsorben
Adsorben SG ditimbang, kemudian diletakkan di tempat yang tertutup rapat. Sedangkan untuk adsorben KS, KS dibersihkan, direbus, kemudian dikeringkan selama beberapa hari dibawah terik matahari, setelah kering KS disangrai lalu ditumbuk hingga menjadi serbuk.
Optimasi Adsorben
Waktu kontak adsorbsi SG dioptimasi dengan menggunakan umpan tetap 100 ml etanol teknis 96% dengan jumlah adsorben 10 gram dengan variasi waktu 5,10,15,20,30,40, dan 60 menit. Sedangkan untuk KS digunakan umpan 100 ml etanol teknis 96% dengan jumlah adsorben 5 gram dengan variasi waktu 5, 10,15, dan 20. Selanjutnya dilakukan optimasi jumlah dengan umpan tetap 100 ml etanol teknis dengan variasi jumlah untuk adsorben SG adalah 2, 5, 10, 15, 20, dan 25 sedangkan untuk KS adalah 2, 5, 10, 15, dan 20.
Pembuatan Bioetanol
Pati singkong diberi air kemudian dipanaskan dan dimasak pada suhu 80oC selama 30 menit dalam water bath shaker, pH dijaga pada suhu optimum dari Aspergillus niger, yaitu pada pH 5. Setelah suspensi mengental, dilakukan hidrolisis dengan menambahkan Jamur Aspergillus niger dalam medium cair sebanyak 10% (v/v) dan dikondisikan pada pH pada suhu 40oC kemudian diinkubasi selama 72 jam.
Setelah proses hidrolisis berakhir, jamur aspergilus yang tumbuh di atas
permukaan suspensi diambil, lalu ditambahkan ragi tape dengan konsentrasi 3% (b/v) dan diinkubasi pada suhu 30oC selama 10 hari.
Tahap Pemurnian
Pemurnian hasil fermentasi dilakukan melalui beberapa tahap, yaitu destilasi dan adsorpsi.
Bioetanol hasil dari fermentasi disaring, lalu didestilasi menggunakan set alat destilasi fraksinasi. Penampungan destilat dibagi menjadi dua bagian yaitu destilat yang turun pada suhu 78-82oC dan 90-100oC.
Destilat yang turun pada suhu
78-82oC lalu dibagi menjadi empat
bagian. Dua bagian pertama (sampel 1a dan 1b) diadsorpsi dengan adsorben SG sedangkan dua bagian lainnya (sampel 2a dan 2b) diadsorpsi dengan menggunakan adsorben KS.
Selanjutnya sampel 1a,1b, 2a, dan 2b didestilasi fraksinasi pada suhu selama 110 menit dan destilat ditampung ke dalam dua bagian yaitu destilat yang turun pada suhu 68-72oC dan 85-95oC.
Destilat pertama dari masing-masing sampel kemudian diadsorpsi. Sampel 1a dan 2a diadsorpsi menggunakan adsorben SG sedangkan sampel 1b dan 2b diadsorpsi dengan KS.
Tahap Analisis
Sampel hasil optimasi, hasil fermentasi, dan sampel yang melalui tahap pemurnian, dilakukan beberapa analisis diantaranya:
x Uji titik didih
Disiapkan air sebagai penangas dan sampel yang akan dianalisis dimasukkan kedalam tabung reaksi yang telah berisi termometer dan tabung kapiler, kemudian
gelem-DO NOT COPY
bung awal, gelembung konstan dan gelembung pertama kali masuk di amati terus menerus.
x Uji Indeks Bias
Pengujian indeks bias sampel dilakukan menggunakan alat refrak-tometer, yang dilakukan untuk semua sampel.
x Uji pH
Uji pH dilakukan untuk semua sampel menggunakan indikator universal.
x Uji berat jenis menggunakan
aerometer
Sampel yang akan diukur berat jenisnya dimasukkan ke dalam gelas ukur 100 ml dan dicatat suhu ruangan-nya. Aerometer dimasukkan secara perlahan dan hati-hati ke dalam gelas ukur. Dibaca skala pada Aerometer.
Uji kadar etanol menggunakan GC Sampel bioetanol hasil destilasi dan adsorpsi akhir, dikirim ke Laboratorium Instrumen Jurusan Pendidikan Kimia FPMIPA UPI untuk dilakukan analisis kadar etanol menggunakan instrumen GC
Tahap Pengolahan Statistika
Untuk mengetahui pengaruh berbagai metode terhadap bioetanol, dilakukan pengolahan statistika dengan menggunakan program SPSS dengan tahap pertama yaitu uji normalitas, uji kruskal-wallis lalu uji Mann-Whitney. HASIL DAN PEMBAHASAN Pembuatan Bioetanol
Pada tahap ini, pertama-tama dilakukan proses gelatinasi. Ketika pati murni dipanaskan dalam air, granula akan mengembang, dan strukturnya hancur (gelatinisasi), kemudian amilosa dan amilopektin lepas dan larut dalam suspensi. Proses ini
berakhir ditandai dengan berubahnya suspensi pati menjadi lebih kental seperti gel.
Selanjutnya dilakukan proses hidrolisis untuk mengubah amilum menjadi glukosa, sehingga dapat difermentasi untuk diubah menjadi etanol. Pada proses ini, digunakan jamur Aspergillus niger sp. Aspergillus niger dapat memproduksi enzim amilase, pektinase, amiloglukosidase, dan selulase. Enzim glukoamilase dapat memecah polisakarida seperti pati pada ikatan karbon α-1,4 dan α-1,6 dengan menghasilkan glukosa.
Proses hidrolisis ini berlangsung selama 72 jam. Pola pertumbuhan jamur Aspergillus niger terlihat jelas ketika memasuki hari ke-2, yang ditandai dengan adanya jamur yang hidup di atas permukaan substrat yang sedang diinkubasi. Setelah diinkubasi selama 72 jam, substrat sudah tidak kental seperti gel melainkan menjadi lebih cair, seperti sup.
Selanjutnya dilakukan proses fermentasi menggunakan ragi. Fermentasi ini dilangsungkan selama 10 hari dalam inkubator dengan suhu 30oC. Substrat yang sudah dihidrolisis, ditempatkan pada botol fermentor dan dipastikan bahwa tidak ada Aspergillus niger yang terbawa, karena hal ini akan menimbulkan terjadinya persaingan pengambilan nutrisi antara jamur Aspergillus niger dengan ragi tape sehingga fermentasi tidak optimal. Botol fermentasi harus bersih steril dan tertutup rapat. Hal ini bertujuan agar tidak terjadi kontaminasi pada saat fermentasi sehingga ragi dapat bekerja dengan optimum. Fermentasi ini berlangsung pada keadaan anaerob sehingga tidak diperlukan oksigen di dalamnya.
DO NOT COPY
Reaksi yang terjadi dalam fermentasi berbeda-beda tergantung pada jenis gula yang digunakan dan produk yang dihasilkan (Ansori, 2011). Secara singkat, glukosa (𝐶 𝐻 𝑂 ), melalui fermentasi akan menghasilkan etanol (𝐶 𝐻 𝑂𝐻) dan gas
karbon-dioksida (𝐶𝑂 ) yang ditunjukkan
dengan adanya gelembung pada saat proses fermentasi berlangsung. Reaksi fermentasi ini dilakukan oleh ragi adalah sebagai berikut:
𝐶 𝐻 𝑂 →2𝐶 𝐻 𝑂𝐻 +2𝐶𝑂
Setelah fermentasi selama 10 hari, substrat berubah menjadi 3 lapisan yaitu lapisan terbawah berupa endapan protein, lapisan tengah air dan etanol, sedangkan pada lapisan atas adalah serbuk putih. Pada kadar etanol yang cukup tinggi, ragi menjadi tidak aktif lagi, karena kelebihan alkohol akan menjadi racun bagi ragi itu sendiri sehingga mematikan aktifitas-nya. Adanya serbuk putih di atas permukaan substrat menunjukkan bahwa ada ragi yang mati sehingga kadar etanol yang terkandung pada hasil fermentasi tersebut sudah maksimal. Sebelum dilakukan proses detilasi, dilakukan penyaringan ter-lebih dahulu untuk menyaring endapan protein.
Berdasarkan hasil analisis, diketahui bahwa hasil fermentasi ini memiliki pH 4, indeks bias 1,3374 dan massa jenis 0,980 g/cm3. Berdasarkan konversi massa jenis terhadap % kadar etanol pada Perry’s Chemical Engineers’ Handbook pada table 2-112,dan konversi indeks bias terhadap kadar etanol, diketahui bahwa sampel memiliki kadar etanol sebesar 10 % .
Optimasi Adsorben
Tahap optimasi yang dilakukan mencakup variabel waktu dan jumlah. Umpan etanol yang digunakan merupakan etanol teknis dengan kadar 96 %. Pada optimasi waktu, umpan yang digunakan sebanyak 100 ml etanol 96% dan jumlah SG yang digunakan sebanyak 10 gram. Variasi waktu yang digunakan yaitu 5, 10, 15, 20, 30, 45, dan 60 menit. Hasil Adsorpsi kemudian diuji berat jenis, indeks bias, dan pH.
Gambar 1. Grafik optimasi waktu SG vs massa jenis
Gambar 2. Grafik optimasi waktu SG vs indeks bias
Berdasarkan grafik, terlihat angka massa jenis dan indeks bias sampel naik bersifat konstan pada waktu kontak 20, 30, 45, dan 60 menit. Hal ini menunjukkan bahwa pada adsorpsi waktu kontak 20 menit telah tercapai kondisi adsorpsi yang optimum.
0.8 0.805 0.81 0.815 0 50 100 m ass a jeni s (g/cm 3) waktu (menit) 1.3616 1.3617 1.3618 1.3619 0 50 100 indeks bi as waktu(menit)
DO NOT COPY
Gambar 3. Grafik optimasi waktu SG vs pH Sedangkan berdasarkan grafik optimasi waktu terhadap pH, terlihat tidak adanya perubahan, hal ini menunjukkan bahwa waktu kontak adsorbsi menggunakan adsorben SG tidak mempengaruhi pH sampel.
Selanjutnya dilakukan optimasi jumlah dengan variasi jumlah yaitu 2, 5, 10, 15, 20, dan 25 gram SG dengan umpan etanol tetap yaitu 100 ml etanol 96% dan waktu kontak selama 20 menit.
Gambar 4. Grafik optimasi jumlah SG vs massa jenis
Gambar 5. Grafik optimasi jumlah SG vs indeks bias
Berdasarkan grafik, massa jenis maupun indeks bias etanol meningkat pada adsorpsi dengan jumlah adsorben sebanyak 15 gram dan tidak terjadi adanya perubahan seiring dengan
meningkatnya jumlah adsorben. Hal itu disebabkan karena sudah tidak ada lagi air yang dapat terserap oleh SG dan kondisi adsorpsi sudah mencapai titik optimum.
Gambar 6. Grafik optimasi jumlah SG vs pH Sedangkan berdasarkan grafik hubungan jumlah SG terhadap pH, tidak terjadi perubahan seiring dengan meningkatnnya jumlah adsorben. Hal ini menunjukkan bahwa jumlah adsorben tidak berpengaruh terhadap pH sampel.
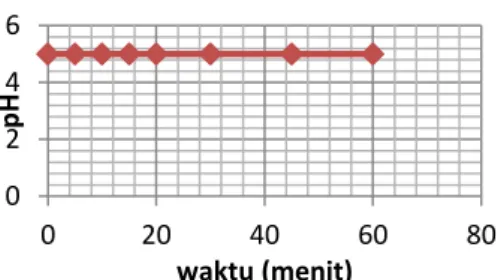
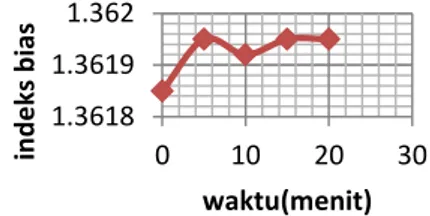
Seperti pada optimasi SG, optimasi KS yang dilakukan mencakup variabel waktu dan jumlah. Umpan etanol yang digunakan merupakan etanol teknis dengan kadar 96 %. Pada optimasi waktu, umpan yang digunakan sebanyak 100 ml etanol 96% dan jumlah KS yang digunakan sebanyak 5 gram. Variasi waktu yang digunakan yaitu 5, 10, 15, dan 20 menit. Hasil Adsorpsi kemudian diuji berat jenis, indeks bias dan pH.
Gambar 7. Grafik optimasi waktu kontak KS vs massa jenis 0 2 4 6 0 20 40 60 80 pH waktu (menit) 0.8 0.805 0.81 0.815 0 10 20 30 m ass a jeni s (g/cm 3) jumlah (gram) 1.36165 1.3617 1.36175 1.3618 1.36185 0 10 20 30 indeks bi as jumlah (gram) 0 2 4 6 0 10 20 30 pH jumlah (gram) 0.804 0.806 0.808 0.81 0.812 0 10 20 30 m ass a jeni s (g/cm 3) waktu(menit)
DO NOT COPY
Gambar 8. Grafik optimasi waktu kontak KS vs indeks bias
Berdasarkan grafik, titik puncak massa jenis maupun indeks bias etanol terdapat pada waktu adsorbsi selama 5 menit. Hal itu menunjukkan bahwa adsorpsi telah mencapai kondisi optimum pada waktu kontak 5 menit.
Gambar 9. Grafik optimasi waktu kontak KS pH
Sedangkan pada grafik hubungan waktu kontak adsorpsi menggunakan KS dengan pH, terlihat tidak adanya perubahan, sehingga dapat disim-pulkan bahwa adsorben tidak mem-pengaruhi pH sampel.
Selanjutnya dilakukan optimasi jumlah dengan variasi jumlah yaitu 2, 5, 10, 15, dan 20 dengan umpan tetap yaitu 100 ml etanol teknis 96% dengan waktu kontak selama 5 menit.
Gambar10. Grafik optimasi jumlah KS vs massa jenis
Gambar 11. Grafik optimasi jumlah KS vs indeks bias
Gambar12. Grafik optimasi jumlah KS vs pH Berdasarkan grafik hubungan jumlah adsorben KS terhadap massa jenis dan indeks bias, diketahui bahwa pada jumlah adsorben 5 gram, telah dicapai kondisi optimum adsorpsi. Sedangkan berdasarkan grafik hu-bungan jumlah adsorben terhadap pH sampel, terlihat tidak adanya peru-bahan pH. 1.3618 1.3619 1.362 0 10 20 30 indeks bi as waktu(menit) 0 2 4 6 0 10 20 30 pH waktu (menit) 0.8 0.805 0.81 0.815 0 10 20 massa jen is (g/cm 3) jumlah (gram) 1.36185 1.3619 1.36195 1.362 0 10 20 indeks bi as massa 0 1 2 3 4 5 6 0 5 10 15 20 pH jumlah (gram)
DO NOT COPY
Tahap Destilasi 1
Sampel bioetanol hasil
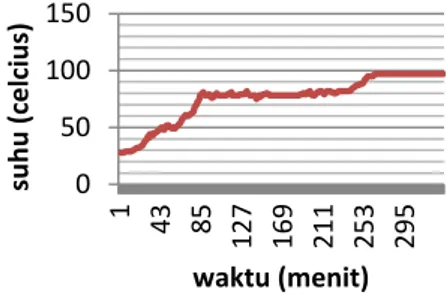
fermentasi sebanyak 1200 mL selan-jutnya didestilasi fraksinasi selama 340 menit.
Gambar 13. Grafik hubungan waktu vs
suhu destilasi hasil fermentasi
Berdasarkan grafik, terlihat adanya dua garis konstan yang menunjukkan bahwa selama proses destilasi berlangsung, terdapat dua destilat yang didapatkan. Destilat pertama turun
pada suhu 78-82 oC yang diduga
merupakan etanol hasil fermentasi, sedangkan destilat kedua mulai turun pada suhu 95oC dan konstan pada suhu 97oC yang diduga merupakan air.
Berdasarkan hasil dari destilasi 1200 ml sampel, didapatkan etanol sebanyak 422 ml. Setelah dilakukan konversi massa jenis terhadap % kadar etanol pada Perry’s Chemical engineers’ Handbook pada table 2-112, diketahui bahwa kadar etanol sebesar 14 %. Kadar ini masih sangat kecil mengingat untuk digunakan sebagai bahan bakar, etanol harus memiliki kemurnian sebesar 99,5%. Sehingga etanol hasil destilasi ini perlu dilakukan tindakan lebih lanjut.
Tahap Adsorpsi 1
Pada tahap ini, sampel bioetanol hasil destilasi ditempatkan pada corong pisah sebanyak 100 ml lalu diberi adsorben SG maupun KS. Untuk
sampel 1, ditambahkan adsorben SG sebanyak 20 gram. Sebelum adsorben digunakan terlihat bahwa SG berwar-na biru. Setelah SG dikontakkan dengan sampel bioetanol, terlihat ada-nya perubahan warna SG dari biru menjadi ungu lalu merah muda yang menunjukkan bahwa adsorben sudah jenuh dan tidak dapat menyerap air lagi.
Untuk sampel 2, sebanyak 100 ml sampel bioetanol ditambahkan ad-sorben KS sebanyak 5 gram, telihat adsorben turun ke bawah. Hal ini nunjukkan bahwa adsorben telah me-nyerap sebagian air yang terkandung dalam sampel.
Tabel 1. Data adsorbat SG dan KS
Tahap Destilasi 2
Sampel hasil adsorpsi kemudian didestilasi fraksinasi pada suhu 80-90oC dan destilat dipisahkan ber-dasarkan suhunya. Untuk sampel 1 yaitu sampel yang telah diadsorpsi oleh SG terlebih dahulu, didestilasi selama 110 menit dan menghasilkan 2 destilat yaitu destilat yang turun pada suhu 68oC-78oC dan destilat pada rentang suhu 85oC-95oC yang diperkirakan merupakan air.
Sampel 2 yang merupakan sampel hasil adsorpsi menggunakan adsorben KS juga didestilasi fraksinasi pada
0 50 100 150 1 43 85 12 7 16 9 21 1 25 3 29 5 suhu (cel ci us) waktu (menit)
Parameter Sampel 1 Sampel 2
a b a b volume (ml) 85 85,5 73 75 Massa jenis (g/cm3) 0,97 0,97 0,965 0,965 pH 5 5 5 5 Indeks bias 1,347 1,3475 1,349 1,349 Kadar etanol (%) 17 17 20 20
DO NOT COPY
suhu 80-90oC. Destilat yang
didapatkan selama destilasi ditampung menjadi 2 yaitu destilat pada rentang suhu (68oC-78oC) dan destilat yang turun pada rentang suhu diatas 90oC. Tabel 2. data destilat 1 sampel 1a & 1b Parameter Sampel 1a Sampel 1b Titik didih 68 oC 68 oC Indeks bias 1,36185 1,36184 pH 5 5 volume 14,5 14
Tabel 3. Data destilat 1 sampel 2
Parameter Sampel 2a Sampel 2b
Titik didih 68 oC 68 oC
Indeks bias 1,36189 1,36189
pH 5 5
volume 13,5 13
Untuk mengetahui kadar sampel dilakukan analisis dengan instrumen Gas Chromatography.
Tahap Adsorpsi 2
Pada tahap ini, digunakan dua macam adsorben yaitu SG dan KS. Masing-masing adsorben mengadsorp-si sampel yang telah diberi perlakuan adsorpsi dan destilasi. Adsorbsi menggunakan SG dilakukan selama 20 menit, namun SG tetap berwarna biru, hal ini menunjukkan bahwa kemungkinan sampel sudah tidak mengandung air, sehingga adsorben sudah tidak mampu menyerap air.
Sedangkan adsorpsi menggunakan KS menunjukkan bahwa KS cenderung terapung di atas permukaan sampel. Hal ini juga menunjukkan bahwa adsorben KS sudah tidak menyerap air. Hasil adsorpsi kemudian dianalisis dan didapatkan data sebagai berikut.
Tabel 4. Data adsorbat SG dan KS
parame ter Sampel 3 Sampel 4 Sampel 5 Sampel 6 Indeks bias 1,36194 1,36192 1,36195 1,36195 Titik didih (oC) 68 69 69 69 Volume (ml) 14,5 13,5 13,5 12,2 pH 5 5 5 5 Ket :
Sampel 3 = sampel 1a yang kemudian diadsorpsi dengan SG
Sampel 4 = sampel 1b yang kemudian diadsorpsi dengan KS
Sampel 5 = sampel 2a yang kemudian diadsorpsi dengan SG
Sampel 6 = sampel 2b yang kemudian diadsorpsi dengan KS
Analisis GC
Gambar 14. Kromatogram sampel 1
Sampel 1 dan 2 diuji dengan menggunakan instrumen Gas Chroma-tography di laboratorium Instrumen jurusan kimia FPMIPA UPI untuk mengetahui kadar etanol yang terkandung dalam sampel.
Berdasarkan komatogram dari sampel 1, terlihat adanya 2 puncak yang muncul, hal ini menunjukkan bahwa sampel belum benar-benar murni. Berdasarkan hasil analisis diketahui sampel memiliki waktu retensi 2,142 dan luas area 2754243, Setelah dibandingkan dengan standar, diketahui bahwa sampel mengandung etanol sebesar 99,9%.
DO NOT COPY
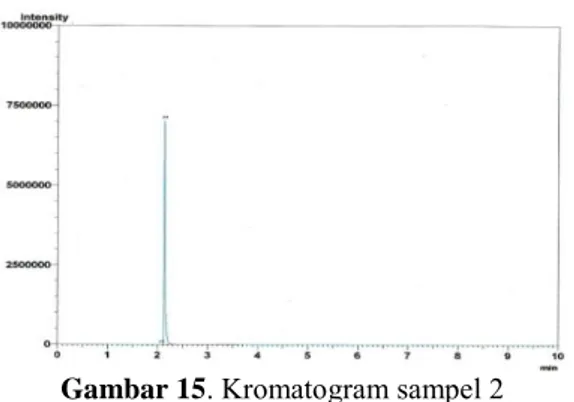
Gambar 15. Kromatogram sampel 2 Berdasarkan komatogram dari sampel 2, terlihat adanya 2 puncak yang muncul, hal ini menunjukkan bahwa sampel belum benar-benar murni. Berdasarkan hasil analisis diketahui sampel memiliki waktu retensi 2,142 dan luas area11571920, Setelah dibandingkan dengan standar, diketahui bahwa sampel mengandung etanol sebesar 99,976 %.
Gambar16.kromatogram sampel 3
Berdasarkan komatogram dari sampel 3, terlihat adanya 2 puncak yang muncul, hal ini menunjukkan bahwa sampel belum benar-benar murni. Berdasarkan hasil analisis diketahui sampel memiliki waktu retensi 2,142 dan luas area18502178, Setelah dibandingkan dengan standar, diketahui bahwa sampel mengandung etanol sebesar 99,962 %.
Gambar 17. Kromatogram sampel 4 Berdasarkan komatogram dari sampel 4, terlihat adanya 2 puncak yang muncul, hal ini menunjukkan bahwa sampel belum benar-benar murni. Berdasarkan hasil analisis diketahui sampel memiliki waktu retensi 2,140 dan luas area 5050866, Setelah dibandingkan dengan standar, diketahui bahwa sampel mengandung etanol sebesar 99,954 %.
Berdasarkan komatogram dari sampel 5,terlihat hanya ada satu puncak, yang menunjukkan bahwa sampel sudah murni. Dari puncak tersebut diketahui bahwa sampel memiliki waktu retensi 2,148 dan luas area 13889561, setelah dibandingkan dengan waktu retensi standar diketahui bahwa sampel mengandung etanol sebesar 100%.
DO NOT COPY
Gambar 19. Kromatogram sampel 6 Berdasarkan kromatogram dari sampel 2 hasil destilasi yang telah diadsorpsi oleh adsorben KS, terlihat hanya ada satu puncak, yang menunjukkan bahwa sampel sudah murni. Dari puncak tersebut diketahui bahwa sampel memiliki waktu retensi 2,147 dan luas area 10922371, setelah dibandingkan dengan waktu retensi standar diketahui bahwa sampel mengandung etanol sebesar 100%. Tahap Pengolahan Statistika
Berdasarkan uji normalitas, nilai signifikansi untuk Observasi dengan semua metode = 0,000 < 𝛼 = 0,05 maka 𝐻 ditolak, artinya metode terse-but tidak berdistribusi normal, sehing-ga dilakukan uji non parametik, salah satunya adalah uji Kruskal-Wallis.
Berdasarkan Uji Kruskal-Wallis, di dapatkan nilai 𝐴𝑠𝑦𝑚𝑝. 𝑆𝑖𝑔 = 0,999 > 𝛼, maka 𝐻 diterima, artinya keempat metode memiliki observasi yang tidak berbeda secara signifikan. Seperti pada tabel Ranks, keempat metode memiliki nilai mean rank yang tidak jauh berbeda. Sedangkan, untuk menguji antara 2 metode digunakan Uji Mann-Whitney.
Berdasarkan uji Mann-Whitney terhadap metode SG-SG dan metode SG-KS, didapatkan nilai 𝐴𝑠𝑦𝑚𝑝. 𝑆𝑖𝑔. (2 − 𝑡𝑎𝑖𝑙𝑒𝑑) = 0,871 > 𝛼,
maka 𝐻 diterima, artinya antara Metode SG-SG dan Metode SG-KS
memiliki observasi yang tidak berbeda secara signifikan.
Berdasarkan uji Mann-Whitney terhadap metode SG-SG dan metode KS-SG, didapatkan nilai 𝐴𝑠𝑦𝑚𝑝. 𝑆𝑖𝑔. (2 − 𝑡𝑎𝑖𝑙𝑒𝑑) = 0,906 > 𝛼,
maka 𝐻 diterima, artinya antara Metode SG-SG dan Metode KS-SG memiliki Observasi yang tidak berbeda secara signifikan.
Berdasarkan uji Mann-Whitney, didapatkan nilai 𝐴𝑠𝑦𝑚𝑝. 𝑆𝑖𝑔. (2 − 𝑡𝑎𝑖𝑙𝑒𝑑) = 0,994 > 𝛼, maka 𝐻 diterima, artinya antara Metode SG-SG dan Metode KS-KS memiliki Observasi yang tidak berbeda secara signifikan.
Berdasarkan uji Mann-Whitney terhadap metode SG-KS dan Metode KS-SG, nilai 𝐴𝑠𝑦𝑚𝑝. 𝑆𝑖𝑔. (2 − 𝑡𝑎𝑖𝑙𝑒𝑑) = 1,000 > 𝛼, maka 𝐻 diterima, artinya antara Metode SG-KS dan Metode KS-SG memiliki Observasi yang tidak berbeda secara signifikan.
Berdasarkan uji Mann-Whitney, didapatkan nilai 𝐴𝑠𝑦𝑚𝑝. 𝑆𝑖𝑔. (2 − 𝑡𝑎𝑖𝑙𝑒𝑑) = 0,976 > 𝛼, maka 𝐻 diterima., artinya antara Metode SG-KS dan Metode KS-KS memiliki Observasi yang tidak berbeda secara signifikan.
Berdasarkan uji
Mann-Whitney, didapatkan nilai 𝐴𝑠𝑦𝑚𝑝. 𝑆𝑖𝑔. (2 − 𝑡𝑎𝑖𝑙𝑒𝑑) = 0,99 > 𝛼,
maka 𝐻 diterima, artinya antara Metode KS-SG dan Metode KS-KS memiliki Observasi yang tidak berbeda secara signifikan.
KESIMPULAN
Berdasarkan hasil penelitian yang telah dilakukan dapat disimpulkan hal-hal berikut:
1. Adsorben SG dan KS baik
digunakan untuk pemurnian bioetanol.
2. Pengaruh dual adsorben (SG-KS dan KS-SG) ternyata tidak berbeda
DO NOT COPY
secara signifikan. Adsorben SG mampu memurnikan bioetanol hingga 99,962% dan adsorben SG-KS mampu memurnikan hingga 99,954%. Sementara itu, adsorben KS dan KS-SG dapat memurnikan bioetanol hingga 100%.
DAFTAR PUSTAKA
Ansori, I.I. (2011). Pemanfaatan Limbah Kulit Singkong Sebagai Bahan Dasar Pembuatan Bioetanol. Skripsi Sarjana Sains Jurusan Pendidikan Kimia FPMIPA UPI. Bandung : tidak diterbitkan.
Badan Standarisasi Nasional. (2008). Bioetanol Terdenaturasi Untuk Gasohol. Jakarta : Badan Standarisasi Nasional .
Fessenden, R.J. dan Fessenden, J.S. (1986). Kimia Organik Jilid 1(ed. Ketiga). Jakarta : Erlangga.
Green,D.W. dan Perry, R.H. (2008). Perry’s Chemical Engineers’ Handbook (Eight ed.). New York: The McGraw-Hill Companies,Inc.
Ivanova, E. , Damgaliev D., Kostova M. (2009). Adsorption Separation of Ethanol Water Liquid Mixtures by Natural Clinoptilolite. Journal of the University of Chemical Technology and Metallurgy. 44 : 267-274.
Juan,Camilo Diaz, Ivan D.G, Liliana, dan G.,Juan C.M.P.(2010). Separation of ethanol-water mixture using Type-A Zeolite Molecular shieve , Volume 7, Nomor 2, hal. 483-495 ISSN: 0973-4945 .
Poedjiadi, Anna dan Titin Supriyanti . (2009). Dasar-dasar Biokimia. Jakarta : UI-Press
Saripah, Ipah. (2011). Pengaruh Pengolahan Awal Pada Singkong Pahit Terhadap Produksi Bioetanol Dengan Menggunakan Jamur Aspergillus niger Pada Proses Hidrolisis. Skripsi Sarjana Sains Jurusan Pendidikan Kimia FPMIPA UPI. Bandung : tidak diterbitkan.