PENGARUH EDIBLE COATING PATI UBI JALAR PUTIH (Ipomoea batatas L.) TERHADAP PERUBAHAN WARNA APEL POTONG SEGAR
(FRESH-CUT APPLE)
Oleh: LATIFAH F24103095
2009
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
SKRIPSI
PENGARUH EDIBLE COATING PATI UBI JALAR PUTIH (Ipomoea batatas L.) TERHADAP PERUBAHAN WARNA APEL POTONG SEGAR
(FRESH-CUT APPLE)
Oleh: LATIFAH F24103095
2009
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
Latifah. F24103095. Pengaruh Edible Coating Pati Ubi Jalar Putih (Ipomoea
batatas L.) Terhadap Perubahan Warna Apel Potong Segar (Fresh-Cut Apple). Di bawah bimbingan : Dr. Ir. Adil Basuki Ahza, MS.
ABSTRAK
Pengolahan minimal (minimal processing) atau dikenal pula dengan istilah produk potong segar (fresh-cut product) merupakan pengolahan buah atau sayuran yang melibatkan pencucian, pengupasan, dan pengirisan sebelum dikemas dan menggunakan suhu rendah untuk penyimpanan sehingga mudah dikonsumsi tanpa menghilangkan kesegaran dan nilai gizi yang dikandungnya (Perera, 2007). Perlakuan proses pengolahan menyebabkan produk terolah minimal mudah mengalami penurunan mutu. Salah satu contoh penurunan mutunya adalah akibat terjadinya pencoklatan enzimatis (enzymatic browning).
Pelapisan buah menggunakan edible coating merupakan salah satu alternatif yang dapat digunakan untuk meminimalisir penurunan mutu buah terolah minimal. Edible coating merupakan lapisan terbuat dari bahan yang dapat dimakan dan berfungsi menahan laju perpindahan gas dan uap air (Baldwin, 1994). Komponen penyusun edible coating terdiri atas hidrokoloid, lemak, atau campurannya (Donhowe-Irene dan Fennema, 1994). Untuk mencegah terjadinya reaksi pencoklatan sebaiknya dipilih edible coating yang memiliki daya penahan gas yang baik, misalnya pati.
Dalam penelitian ini dilakukan pembuatan edible coating dari pati ubi jalar dengan mengkombinasikannya dengan tapioka dan diaplikasikan pada apel potong segar. Tujuan dilakukannya penelitian ini adalah (1) mengetahui pengaruh
edible coating yang terbuat dari pati ubi jalar dikombinasikan dengan tapioka
terhadap tingkat pencoklatan apel potong segar, (2) menentukan formulasi terbaik
edible coating yang memiliki kemampuan penghambatan pencoklatan apel potong
segar paling signifikan. Parameter yang diamati terutama nilai Browning Index (BI) dan laju respirasi.
Penelitian ini terdiri atas dua tahap, yakni penelitian pendahuluan dan penelitian utama. Penelitian pendahuluan meliputi pembuatan pati ubi jalar sebagai bahan pembuat edible coating serta penentuan konsentrasi pati dan CMC yang memberikan viskositas tidak terlalu kental juga tidak terlalu encer melalui pengamatan secara visual (subjektif). Terdapat empat kombinasi konsentrasi pati dan CMC yang dicobakan, yaitu (1) pati ubi jalar 1% b/v; CMC 0.5% b/v, (2) pati ubi jalar 1% b/v; CMC 1% b/v, (3) pati ubi jalar 2% b/v; CMC 0.5% b/v, dan (4) pati ubi jalar 2% b/v; CMC 1% b/v. Volume yang dimaksud yakni volume larutan pati setelah ditambahkan dengan CMC. Analisis yang dilakukan pada tahap penelitian pendahuluan adalah analisis rendemen pati, derajat putih, dan densitas kamba. Penelitian utama meliputi pengukuran laju respirasi, susut bobot, warna, dan organoleptik. Faktor yang diteliti adalah suhu penyimpanan (5°C dan suhu ruang) serta perbandingan konsentrasi pati ubi jalar dan tapioka. Rancangan percobaan menggunakan Rancangan Acak Lengkap (RAL) dengan dua kali ulangan.
g/ml. Sementara itu, formula untuk pembuatan edible coating terdiri atas pati 1% b/v larutan pati dan CMC, CMC 0.5% b/v larutan pati dan CMC, air destilata, dan gliserol 15% (v/b pati).
Hasil penelitian menunjukkan bahwa suhu berpengaruh sangat nyata (p<0.01) terhadap nilai laju respirasi apel potong segar. Nilai laju respirasi apel potong segar yang disimpan pada suhu 5°C lebih rendah dibanding apel potong segar yang disimpan pada suhu ruang.
Hasil penelitian juga menunjukkan bahwa perbandingan konsentrasi pati ubi jalar dan tapioka yang digunakan sebagai bahan pembuat edible coating tidak berpengaruh nyata (p>0.05) terhadap nilai laju respirasi. Sehingga dapat disimpulkan bahwa larutan edible coating yang digunakan tidak dapat berperan sebagai penahan laju respirasi.
Hasil penelitian menunjukkan bahwa suhu berpengaruh sangat nyata (p<0.01) terhadap susut bobot apel potong segar. Susut bobot apel potong segar yang disimpan pada suhu 5°C lebih rendah dibanding apel potong segar yang disimpan pada suhu ruang. Sedangkan perbandingan konsentrasi pati ubi jalar dan tapioka yang digunakan sebagai bahan pembuatan edible coating tidak berpengaruh nyata (p>0.05) terhadap nilai susut bobot. Hasil uji-t menunjukkan bahwa lama penyimpanan juga berpengaruh sangat nyata (p<0.01) terhadap nilai susut bobot yang diperoleh. Nilai susut bobot semakin meningkat dengan meningkatnya lama penyimpanan.
Pengamatan terhadap nilai BI dan L menunjukkan bahwa suhu penyimpanan tidak berpengaruh nyata (p>0.05) terhadap nilai Browning Index (BI) dan L (kecerahan) apel potong segar.
Hasil penelitian menunjukkan bahwa perbandingan konsentrasi pati ubi jalar dan tapioka yang digunakan sebagai bahan pembuat edible coating tidak berpengaruh nyata (p>0.05) terhadap nilai BI dan L. Nilai BI dan L tetap tinggi meskipun produk apel potong segar sudah dilapisi edible coating.
Hasil uji organoleptik apel potong segar terhadap parameter rasa menunjukkan bahwa perlakuan konsentrasi pati ubi jalar dan tapioka yang digunakan sebagai bahan pembuat edible coating tidak berpengaruh nyata (p>0.05) terhadap penilaian panelis. Hasil uji organoleptik terhadap parameter warna menunjukkan bahwa penambahan edible coating pada apel potong segar dengan berbagai konsentrasi berpengaruh sangat nyata (p<0.01) terhadap tingkat kesukaan panelis. Dibanding kontrol, apel yang terlapis edible coating lebih tidak disukai panelis.
Perlu dilakukan penelitian lebih lanjut mengenai jumlah coating yang melekat per-satuan permukaan produk untuk mengetahui keefektifan dari suatu larutan edible coating. Selain itu, pembuatan edible coating sebaiknya ditambahkan lipid untuk menurunkan susut bobot produk terlapis. Penambahan asam sitrat dan asam askorbat sebagai antioksidan sebaiknya dilakukan dalam larutan edible coating itu sendiri dan konsentrasi pemlastis (plasticizer) sebaiknya diturunkan sehingga edible coating lebih cepat kering.
PENGARUH EDIBLE COATING PATI UBI JALAR PUTIH (Ipomoea batatas L.) TERHADAP PERUBAHAN WARNA APEL POTONG SEGAR
(FRESH-CUT APPLE)
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Teknologi Pertanian
Pada Departemen Ilmu dan Teknologi Pangan Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh: LATIFAH F24103095
2009
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PERTANIAN
PENGARUH EDIBLE COATING PATI UBI JALAR PUTIH (Ipomoea batatas L.) TERHADAP PERUBAHAN WARNA APEL POTONG SEGAR
(FRESH-CUT APPLE)
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
Pada Departemen Ilmu dan Teknologi Pangan Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh: LATIFAH F24103095
Dilahirkan di Jakarta pada tanggal 12 November 1984 di Jakarta
Tanggal lulus : Bogor, Februari 2009
Menyetujui,
Dr. Ir. Adil Basuki Ahza, MS Dosen Pembimbing
Mengetahui,
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 12 November 1984 di Jakarta. Penulis merupakan anak dari pasangan bernama Syafi’i dan Mulia. Penulis menyelesaikan pendidikan dasar di MI Ash-Sholihin pada tahun 1997, MTs Negeri 12 Jakarta Barat pada tahun 2000, SMU Negeri 78 Jakarta Barat tahun 2003, dan pada tahun yang sama diterima di Departemen Ilmu dan Teknologi Pangan, Institut Pertanian Bogor melalui SPMB (Seleksi Penerimaan Mahasiswa Baru).
Penulis aktif dalam Badan Eksekutif Mahasiswa Fakultas Teknologi Pertanian (BEM-F) sebagai Staf Administrasi dan Keuangan (tahun 2004) dan Ketua Departemen Kesekretariatan (tahun 2005). Sementara itu, pada tahun 2006 penulis aktif di Badan Eksekutif Mahasiswa Keluarga Mahasiswa (BEM-KM) IPB sebagai Sekretaris Departemen Pertanian. Penulis juga aktif di berbagai kepanitiaan kampus.
Penulis menyelesaikan skripsi pada tahun 2008 dengan judul “Pengaruh
Edible Coating Pati Ubi Jalar Putih (Ipomoea batatas L.) terhadap Perubahan
Warna Apel Potong Segar (Fresh-Cut Apple)” di bawah bimbingan Dr. Ir. Adil Basuki Ahza, MS.
KATA PENGANTAR
Segala puji dan syukur penulis panjatkan ke hadirat Allah SWT yang telah memberikan rahmatNya sehingga penulis dapat menyelesaikan skripsi yang berjudul “Pengaruh Edible Coating Ubi Jalar (Ipomoea batatas L.) Terhadap
Perubahan Warna Apel Potong Segar (Fresh-Cut Apple)”.
Pada kesempatan ini penulis ingin mengucapkan terima kasih kepada : 1. Dr. Ir. Adil Basuki Ahza, MS selaku dosen pembimbing akademik atas
bimbingan, arahan, dan bantuannya selama ini.
2. Dr. Ir. Sukarno, M. Sc dan Dr. Ir. Nugraha Edhi Suyatma, DEA selaku dosen penguji.
3. Mama, Umi, Abi, K Fia, K Faris, Cing Mameh, Riva, Cing Cecet, serta seluruh keluarga yang tidak bisa disebutkan satu per satu atas kasih sayang, motivasi, dan bantuannya selama ini.
4. Ibu Rub, Pak Sidik, Pak Sob, Pak Wahid, Mas Eddy, Mas Doddy, Pak Yahya, atas bantuan selama penelitian.
5. Pak Sulyaden, Pak Tjahja Muhandri, Bu Waysima, atas kebaikan dan bantuannya.
6. Diah Rochana, Dyah Setyorini, Septina, Mb Dhenok, Niken yang telah bertugas dengan baik sebagai sie transportasi.
7. Ventri, Mely, Lia, Rina, Riwil, Ririn, Eti, Nona, Sohib, Erma, Risma, Mita, Okta, Andri, Kani, Dyah, Chie2, Henry, Dwi, Eli, Ery, Ika, Tika, Risma, Ida, Andri, Cucu, Fitri yang telah banyak membantu selama penelitian.
8. Syifa, Yeyen, Rosyi, Rifa, Asih, Astri, atas kebersamaannya.
9. Novi yang sangat setia menemani dikala sulit, Noor, Intan, Mona, Santo, Riska, I2n, Wati, Lina, Angga, dan teman-teman ITP 40 yang tidak dapat disebutkan namanya satu per satu, atas kebaikan dan keceriaan yang telah diberikan.
10.Rien, Aliy, Maryono, Ani, Adam, Aji, Ferdy, Laela, Fitri, Diah, Putra, Zulvan, Dani, Eko, Nur, Erick, Pi2t, Redy, Linda, Eva, Ramlah, Kristanto, Eka, dan seluruh teman-teman di BEM-KM atas kebersamaannya.
11.Lia, Shaqira, Fadli, Tyan, teman-teman SMU yang setia menemani dan membantu.
12.Mb Siti, Mb Ari, Mb Leni, Erven, Uyuy, Anis, Ayu, Ramadhan’ers yang selalu ceria.
13.Ami dan Rina yang selalu membantu untuk persoalan-persoalan statistik. Penulis menyadari dalam penyusunan skripsi ini masih terdapat kekurangan, untuk itu saran dan kritik dari pembaca sangat penulis harapkan sebagai perbaikan di masa mendatang.
Bogor, Februari 2009
DAFTAR ISI
Halaman
KATA PENGANTAR ... i
DAFTAR ISI ... iii
DAFTAR TABEL ... v
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... viii
I. PENDAHULUAN ... 1
A. Latar Belakang ... 1
B. Tujuan Penelitian ... 2
C. Manfaat Penelitian ... 3
II. TINJAUAN PUSTAKA ... 4
A. Edible Coating ... 4
B. Pati ... 6
C. Ubi Jalar ... 7
D. Pencoklatan (Browning) ... 9
E. Apel ... 11
F. Pengolahan Minimal (Minimal Processing) ... 12
G. Respirasi ... 14
III.METODOLOGI PENELITIAN ... 17
A. Waktu dan Tempat Penelitian ... 17
B. Bahan dan Alat ... 17
C. Prosedur Penelitian ... 17 1. Penelitian Pendahuluan ... 19 2. Penelitian Utama ... 24 D. Pengamatan ... 26 1. Rendemen ... 27 2. Derajat Putih ... 27 3. Densitas Kamba ... 27 4. Laju Respirasi ... 28 5. Susut Bobot ... 29 6. Warna ... 29
7. Organoleptik ... 30
E. Rancangan Percobaan ... 31
IV.HASIL DAN PEMBAHASAN ... 33
A. Penelitian Pendahuluan ... 33 1. Rendemen ... 34 2. Derajat Putih ... 34 3. Densitas Kamba ... 34 B. Penelitian Utama ... 35 1. Laju Respirasi ... 35 2. Susut Bobot ... 39 3. Warna ... 42 4. Organoleptik ... 45
V. KESIMPULAN DAN SARAN ... 47
A. Kesimpulan ... 47
B. Saran ... 49
DAFTAR PUSTAKA ... 50
DAFTAR TABEL
Halaman Tabel 1. Kemungkinan penggunaan edible film dan coating ……….. 5
DAFTAR GAMBAR
Halaman
Gambar 1. Struktur amilosa ... 6
Gambar 2. Struktur amilopektin ... 7
Gambar 3. Ubi jalar putih ... 8
Gambar 4. Apel Manalagi sebelum mengalami browning (kiri) dan setelah mengalami browning (kanan) ... 10
Gambar 5. Apel Manalagi ... 12
Gambar 6. Contoh produk terolah minimal ... 13
Gambar 7. Kurva laju respirasi antara klimakterik dan non-klimakterik ... 16
Gambar 8. Diagram alir penelitian ... 19
Gambar 9. Diagram alir pembuatan pati ubi jalar (Shinta, 2007) ... 20
Gambar 10. Diagram alir pembuatan pati ubi jalar modifikasi ... 21
Gambar 11. Oven yang digunakan untuk pengeringan pada pembuatan pati ... 21
Gambar 12. Blender kering yang digunakan untuk pengeringan pada pembuatan pati ... 22
Gambar 13. Diagram alir pembuatan edible coating (Santoso et al., 2004) .... 23
Gambar 14. Diagram alir pembuatan edible coating modifikasi ... 23
Gambar 15. Pemanasan dan pengadukan pati menggunakan magnetic stirrer.. 24
Gambar 16. Diagram alir aplikasi edible coating pada apel potong segar (Layuk et al., 2002) ... 25
Gambar 17. Diagram alir aplikasi edible coating pada apel fresh-cut modifikasi ... 26
Gambar 18. Chromameter Minolta CR-200 ... 29
Gambar 19. Pati ubi jalar yang telah diayak ... 33
Gambar 20. Produk yang telah mengalami kerusakan pada penyimpanan suhu ruang (kiri) dan 5°C (kanan) ... 35
Gambar 21. Grafik laju produksi CO2 tiap konsentrasi pati ubi jalar-tapioka pada suhu 5°C ... 38
Gambar 22. Grafik laju produksi CO2 tiap konsentrasi pati ubi jalar-tapioka pada suhu ruang... 39
Gambar 23. Diagram batang pengaruh konsentrasi pati ubi jalar-tapioka
terhadap susut bobot selama penyimpanan pada suhu ruang ... 41 Gambar 24. Diagram batang pengaruh konsentrasi pati ubi jalar-tapioka
terhadap susut bobot selama penyimpanan pada suhu 5°C ... 41 Gambar 25. Diagram batang pengaruh konsentrasi pati ubi jalar-tapioka
terhadap nilai BI selama penyimpanan pada suhu ruang ... 42 Gambar 26. Diagram batang pengaruh konsentrasi pati ubi jalar-tapioka
terhadap nilai BI selama penyimpanan pada suhu 5°C... 43 Gambar 27. Diagram batang pengaruh konsentrasi pati ubi jalar-tapioka
terhadap nilai L selama penyimpanan pada suhu ruang ... 43 Gambar 28. Diagram batang pengaruh konsentrasi pati ubi jalar-tapioka
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Data perhitungan analisis pendahuluan ... 54
Lampiran 2. Proses pengukuran laju respirasi ... 55
Lampiran 3a. Data laju respirasi apel potong segar (fresh-cut apple) pada suhu ruang ... 56
Lampiran 3b. Data laju respirasi apel potong segar (fresh-cut apple) pada suhu 5°C ... 56
Lampiran 4. Hasil ANOVA untuk laju respirasi ... 57
Lampiran 5a. Data analisis susut bobot pada suhu ruang …... 58
Lampiran 5b. Data analisis susut bobot pada suhu 5°C ... 58
Lampiran 6. Hasil ANOVA untuk susut bobot ... 59
Lampiran 7a. Rumus konversi nilai L dan BI ………... 61
Lampiran 7b. Data hasil pengukuran warna pada apel potong segar (fresh-cut apple) hari ke-0 ... 61
Lampiran 8a. Data hasil pengukuran warna pada apel potong segar (fresh-cut apple) yang disimpan pada suhu ruang hari ke-1 ... 62
Lampiran 8b. Data hasil pengukuran warna pada apel potong segar (fresh-cut apple) yang disimpan pada suhu ruang hari ke-2 ... 62
Lampiran 9a. Data Data hasil pengukuran warna pada apel potong segar (fresh-cut apple) yang disimpan pada suhu 5°C hari ke-1 ... 63
Lampiran 9b. Data hasil pengukuran warna pada apel potong segar (fresh-cut apple) yang disimpan pada suhu 5°C hari ke-2 ... 63
Lampiran 10a. Data hasil pengukuran warna pada apel potong segar (fresh-cut apple) yang disimpan pada suhu 5°C hari ke-3 ... 64 Lampiran 10b. Data hasil pengukuran warna pada apel potong segar
ke-4 ... 64
Lampiran 11. Hasil ANOVA untuk nilai BI ... 65
Lampiran 12. Hasil ANOVA untuk nilai L ... 66
Lampiran 13. Penampakan warna apel pada hari ke-0 ... 67
Lampiran 14a. Penampakan warna apel pada hari ke-1 penyimpanan suhu ruang ... 68
Lampiran 14b. Penampakan warna apel pada hari ke-2 penyimpanan suhu ruang ... 68
Lampiran 15a. Penampakan warna apel pada hari ke-1 penyimpanan suhu 5°C ... 69
Lampiran 15b. Penampakan warna apel pada hari ke-2 penyimpanan suhu 5°C ... 69
Lampiran 16a. Penampakan warna apel pada hari ke-3 penyimpanan suhu 5°C ... 70
Lampiran 16b. Penampakan warna apel pada hari ke-4 penyimpanan suhu 5°C ... 70
Lampiran 17. Form penilaian uji organoleptik ... 71
Lampiran 18. Skor uji organoleptik ... 72
Lampiran 19. Hasil ANOVA organoleptik parameter rasa ... 73
I.
PENDAHULUAN
A. Latar Belakang
Pengolahan minimal (minimal processing) atau dikenal pula dengan istilah potong segar (fresh-cut) merupakan pengolahan buah atau sayuran yang melibatkan pencucian, pengupasan, dan pengirisan sebelum dikemas dan menggunakan suhu rendah untuk penyimpanan sehingga mudah dikonsumsi tanpa menghilangkan kesegaran dan nilai gizi yang dikandungnya (Perera, 2007).
Buah potong segar (fresh-cut fruit) lebih tidak tahan lama dibandingkan buah segar. Berbagai perlakuan yang dialami buah potong segar seperti pengupasan, pemotongan, pengirisan dapat mengganggu integritas jaringan dan sel yang dimilikinya. Akibatnya terjadi peningkatan produksi etilen, peningkatan laju respirasi, degradasi membran, kehilangan air, dan kerusakan akibat mikroorganisme. Dampak lebih lanjut adalah terjadinya perubahan enzimatis dan penurunan umur simpan serta mutu (Baeza-Rita, 2007). Kerusakan mekanis pada produk potong segar misalnya akibat pemotongan dapat mengaktifkan enzim polifenol oksidase membentuk senyawa melanin menimbulkan warna coklat pada buah atau sayuran (Wong
et al., 1994). Padahal warna menjadi atribut mutu yang sangat penting pada
produk buah-buahan atau sayuran terolah minimal (Lin dan Zhao, 2007). Jenis buah-buahan yang sering mengalami reaksi pencoklatan adalah pisang, pir, salak, pala, dan apel.
Salah satu cara yang dapat dilakukan untuk mencegah reaksi pencoklatan adalah penggunaan edible coating. Yakni lapisan terbuat dari bahan yang dapat dimakan dan berfungsi menahan laju perpindahan gas dan uap air (Baldwin, 1994). Komponen penyusun edible coating terdiri atas hidrokoloid, lemak, atau campuran (Donhowe-Irene dan Fennema, 1994). Untuk mencegah terjadinya reaksi pencoklatan sebaiknya dipilih edible
coating yang memiliki daya penahan gas yang baik, misalnya pati. Warna
coklat ini meskipun tidak berbahaya tetapi tetap saja mengurangi mutu produk karena konsumen tidak menyukainya. Dibutuhkan edible coating dengan
karakteristik penahan gas yang baik karena dalam reaksi pencoklatan enzimatis juga melibatkan oksigen sebagai substrat pembantu (co-substrate). Semakin sedikit oksigen yang tersedia dalam jaringan buah maka reaksi pencoklatan dapat diminimalisir (Marshall et al., 2000).
Selain sebagai penahan gas yang baik untuk diterapkan sebagai bahan
edible coating, pati juga memiliki kelebihan lain, yaitu harganya yang murah,
ketersediaan yang melimpah, serta penanganan yang relatif mudah (Gontard dan Guilbert, 1994). Salah satu tanaman penghasil pati yang sangat potensial adalah ubi jalar. Belum berkembangnya usaha pati ubi jalar ini karena pemanfaatannya dalam industri yang masih sangat terbatas dibanding tapioka.
Mempertimbangkan faktor tersebut, penelitian ini dimaksudkan untuk mempelajari pengaruh penggunaan pati ubi jalar yang dikombinasikan dengan tapioka sebagai bahan edible coating terhadap perubahan warna coklat yang menjadi masalah besar pada produk apel potong segar. Apel dipilih sebagai produk potong segar karena apel termasuk jenis buah yang tidak tergantung musim sehingga menguntungkan untuk dikembangkan secara berkelanjutan. Banyaknya apel impor membuat posisi apel lokal seperti varietas Manalagi semakin terpinggirkan. Dengan mengolahnya menjadi produk potong segar, diharapkan dapat meningkatkan nilai tambah apel lokal.
B. Tujuan Penelitian
Tujuan dilakukannya penelitian ini adalah :
1. Mengetahui pengaruh edible coating yang terbuat dari pati ubi jalar dikombinasikan dengan tapioka terhadap tingkat pencoklatan apel potong segar.
2. Mempelajari laju respirasi apel potong segar melalui pengukuran jumlah CO2 yang diproduksi.
3. Menentukan formulasi terbaik edible coating yang memiliki kemampuan penghambatan pencoklatan apel potong segar (fresh-cut apple) paling signifikan.
C. Manfaat Penelitian
Manfaat dari penelitian ini adalah :
1. Formulasi edible coating yang terbaik nantinya dapat diterapkan untuk mengatasi permasalahan pencoklatan pada produk potong segar (fresh-cut
product), misalnya apel.
2. Dapat diketahui kondisi-kondisi yang diperlukan dalam pembuatan edible
II.
TINJAUAN PUSTAKA
A. Edible Coating
Edible coating adalah suatu lapisan tipis yang dibuat dari bahan yang
dapat dimakan, dibentuk melapisi makanan (coating) yang berfungsi sebagai penghalang terhadap perpindahan massa (seperti kelembaban, oksigen, cahaya, lipid, zat terlarut) dan atau sebagai pembawa aditif serta untuk meningkatkan penanganan suatu makanan (Baldwin, 1994). Saat ini, coating digunakan untuk buah-buahan dan sayuran segar yang bertujuan menghambat susut bobot, memperbaiki penampilan dengan meningkatkan kilap pada produk, dan menahan pertukaran gas antara produk dengan lingkungan (Grant dan Burns, 1994).
Terdapat tiga kelompok penyusun edible coating, yakni : hidrokoloid, lipid, dan campurannya (komposit). Yang termasuk hidrokoloid adalah protein, turunan selulosa, alginat, pektin, pati, dan polisakarida lain. Lipid dapat diperoleh dari lilin, asilgliserol, dan asam lemak. Sementara itu, komposit merupakan campuran antara lipid dan hidrokoloid (Donhowe-Irene dan Fennema, 1994).
Hidrokoloid yang digunakan untuk coating dapat dibagi berdasarkan komposisi, muatan molekul, dan kelarutan airnya. Berdasarkan komposisinya, hidrokoloid terdiri atas karbohidrat dan protein. Jenis karbohidrat yang dapat digunakan meliputi pati, alginat, pektin, gum arabik, dan pati termodifikasi. Sementara itu, dari jenis protein adalah gelatin, kasein, protein kedelai, whey, gluten gandum, dan zein jagung. Berdasarkan muatan molekulnya, hidrokoloid baik untuk pembentuk film. Sedangkan alginat dan pektin membutuhkan ion polivalen, biasanya kalsium untuk membentuk film. Menurut kelarutan terhadap air, hidrokoloid lebih rendah daya tahannya terhadap uap air dibanding protein karena sifat hidrokoloid yang hidrofilik (Donhowe-Irene dan Fennema, 1994).
Lipid sering digunakan sebagai penahan uap air atau sebagai pelapis untuk meningkatkan kilap pada produk-produk konfeksionari. Lipid jarang digunakan secara tunggal karena integritas struktur serta daya tahannya yang
rendah. Dari golongan lipid yang paling sering digunakan adalah lilin yang berfungsi menghambat respirasi dan susut bobot pada buah dan sayuran (Donhowe-Irene dan Fennema, 1994).
Film (lapisan) dari bahan komposit dapat digunakan untuk mengatasi
kekurangan-kekurangan lipid dan hidrokoloid jika digunakan secara tunggal. Jika sifat penahan uap air yang diinginkan, dapat digunakan lipid sebagai bahan edible coating. Sementara itu, sifat daya tahan lipid yang rendah dapat ditutupi dengan penggunaan hidrokoloid (Donhowe-Irene dan Fennema, 1994).
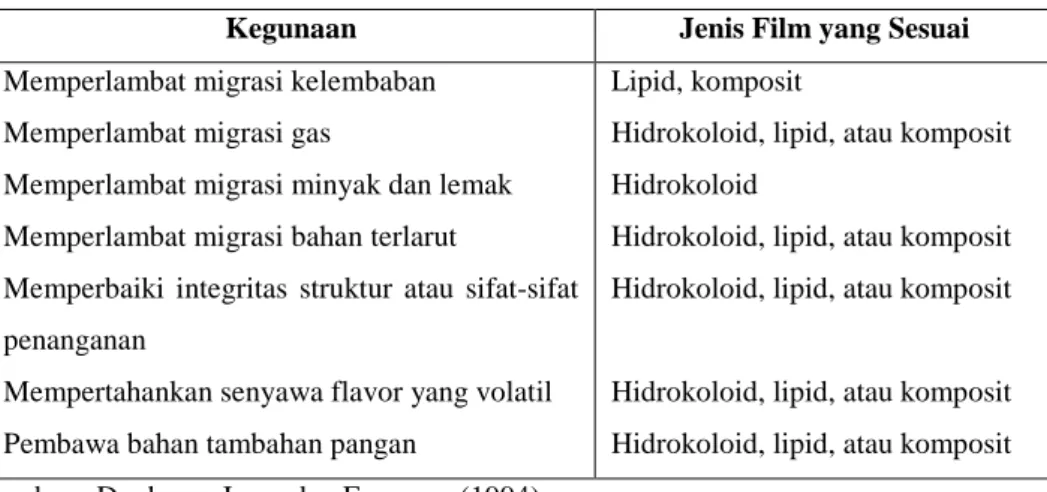
Pemilihan jenis edible coating dapat disesuaikan dengan fungsi dan kegunaan yang diinginkan, seperti terlihat pada Tabel 1.
Tabel 1. Kemungkinan penggunaan edible film dan coating
Kegunaan Jenis Film yang Sesuai Memperlambat migrasi kelembaban
Memperlambat migrasi gas
Memperlambat migrasi minyak dan lemak Memperlambat migrasi bahan terlarut
Memperbaiki integritas struktur atau sifat-sifat penanganan
Mempertahankan senyawa flavor yang volatil Pembawa bahan tambahan pangan
Lipid, komposit
Hidrokoloid, lipid, atau komposit Hidrokoloid
Hidrokoloid, lipid, atau komposit Hidrokoloid, lipid, atau komposit
Hidrokoloid, lipid, atau komposit Hidrokoloid, lipid, atau komposit Sumber : Donhowe-Irene dan Fennema (1994)
Bahan yang sering ditambahkan pada edible coating antara lain antimikroba, antioksidan, flavor, pewarna, dan plasticizer. Bahan antimikroba yang umumnya sering digunakaan adalah asam benzoat, asam sorbat, kalium sorbat, dan asam propionat. Antioksidan diperlukan untuk melindungi dari reaksi oksidasi, degradasi, dan pemudaran. Antioksidan yang sering digunakan berupa senyawa asam dan senyawa fenolik. Senyawa asam yang digunakan antara lain asam sitrat, asam sorbat, dan ester-esternya. Senyawa fenolik yang digunakan adalah BHA, BHT, propil galat, dan tokoferol. Jenis
plasticizer yang umum digunakan adalah gliserol (Anonim, 2006). Gliserol
ditambahkan untuk memperbaiki karakteristik mekanis dari film yang terbentuk (Donhowe-Irene dan Fennema, 1994).
Gliserol dibuat dengan menguraikan fruktosa difosfat dengan enzim aldosa menjadi dihidroksi aseton fosfat, kemudian direduksi menjadi α
-gliserofosfat. Setelah itu, gugus fosfat dihilangkan dengan proses fosforilasi (Winarno, 1997).
Selain plasticizer, bahan lain yang sering ditambahkan dalam formulasi coating adalah CMC. CMC (carboxymethylcellulose) atau gum selulosa merupakan eter selulosa anionik yang diperoleh dengan mereaksikan selulosa alkali dengan natrium monokloroasetat. Fungsinya antara lain menjaga tekstur alami, kerenyahan dan kekerasan produk, menghambat pertumbuhan kapang pada keju dan sosis, dan mengurangi penyerapan oksigen tanpa menyebabkan peningkatan kadar karbondioksida pada jaringan buah-buahan (Nisperos-Carriedo, 1994).
CMC jarang digunakan sebagai bahan tunggal dalam pembuatan edible
coating atau film. Tetapi kemampuannya membentuk film yang kuat dan tahan
minyak sangat baik untuk diaplikasikan (Nisperos-Carriedo, 1994).
B. Pati
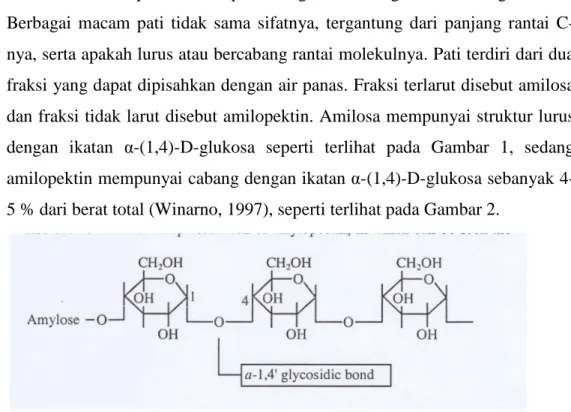
Pati merupakan homopolimer glukosa dengan ikatan α-glikosidik.
Berbagai macam pati tidak sama sifatnya, tergantung dari panjang rantai C-nya, serta apakah lurus atau bercabang rantai molekulnya. Pati terdiri dari dua fraksi yang dapat dipisahkan dengan air panas. Fraksi terlarut disebut amilosa dan fraksi tidak larut disebut amilopektin. Amilosa mempunyai struktur lurus dengan ikatan α-(1,4)-D-glukosa seperti terlihat pada Gambar 1, sedang
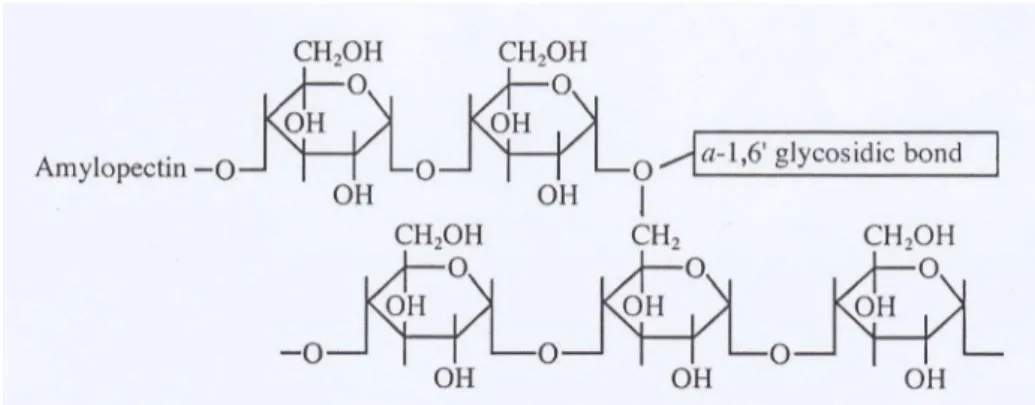
amilopektin mempunyai cabang dengan ikatan α-(1,4)-D-glukosa sebanyak
4-5 % dari berat total (Winarno, 1997), seperti terlihat pada Gambar 2.
Gambar 2. Struktur amilopektin (Cornell, 2004)
Menurut Blennow (2004), pati merupakan cadangan energi utama dalam tumbuhan dan salah satu jenis karbohidrat yang ketersediaannya melimpah. Pati yang tersimpan dalam organ tumbuhan, seperti pada jagung, kentang, gandum, dan lain-lain berperan sebagai sumber energi manusia.
Pati tersusun dari dua macam karbohidrat, amilosa dan amilopektin, dalam komposisi yang berbeda-beda. Dibandingkan amilopektin, amilosa lebih berperan dalam pembentukan edible coating. Amilosa diperlukan untuk pembentukan film dan pembentukan gel yang kuat (Nisperros-Carriedo, 1994).
Beberapa sifat pati adalah mempunyai rasa yang tidak manis, tidak larut dalam air dingin tetapi di dalam air panas dapat membentuk sol atau gel yang bersifat kental. Sifat kekentalannya ini dapat digunakan untuk mengatur tekstur makanan, dan sifat gelnya dapat diubah oleh gula atau asam. Pati di dalam tanaman dapat merupakan energi cadangan. Di dalam biji-bijian, pati terdapat dalam bentuk granula. Penguraian tidak sempurna dari pati dapat menghasilkan dekstrin, yaitu suatu bentuk oligosakarida (Winarno et al., 1980).
C. Ubi Jalar
Ubi jalar (Ipomoea batatas L.) berasal dari daerah tropik dan sub tropik Amerika, yang menyebar ke daerah tropik dan sub tropik lainnya, termasuk Indonesia. Tanaman ini termasuk famili Convolvulaceae (kekangkungan). Ubi jalar adalah tanaman merambat dengan batang yang bervariasi dalam ketebalan, panjang, dan kebiasaan pertumbuhan. Umbi
tanaman ubi jalar adalah akar yang membesar dan sebagai makanan cadangan bagi tanaman, dengan bentuk antara lonjong sampai agak bulat seperti terlihat pada Gambar 3. Warna kulit umbi bervariasi, dari putih kotor, kuning, merah muda, jingga, sampai ungu tua. Warna daging putih, krem, merah muda, kekuning-kuningan, dan jingga tergantung jenis dan banyaknya pigmen yang terdapat dalam kulit. Pigmen yang terdapat di dalam umbi ubi jalar adalah karotenoid dan antosianin (Kantor Menteri Negara Urusan Pangan dan Hortikultura dan IPB, 1999).
Gambar 3. Ubi jalar putih
Berdasarkan kekerasannya, umbi ubi jalar digolongkan atas dua kelompok, yakni yang berumbi keras dan ubi yang berumbi lunak. Ubi yang berumbi keras banyak mengandung pati, sedang ubi berumbi lunak banyak mengandung air dan gula (Kantor Menteri Negara Urusan Pangan dan Hortikultura dan IPB, 1999).
Ubi jalar merupakan salah satu komoditas utama tanaman pangan yang mempunyai daya adaptasi luas sehingga dapat tumbuh dan berkembang dengan baik di seluruh Nusantara. Komoditas ini merupakan tanaman umbi-umbian penting kedua setelah ubi kayu yang mempunyai manfaat beragam. Tidak hanya digunakan sebagai bahan pangan tetapi juga sebagai pakan ternak, bahan baku industri maupun komoditas ekpor (Hafsah, 2004).
Tantangan yang dihadapi dalam mengembangkan agribisnis ubi jalar adalah masih lambatnya kemajuan industri pengolahan produk-produk berbahan baku ubi jalar. Karena umbi ubi jalar merupakan gudang dari pati,
maka salah satu industri pengolahan yang dapat dikembangkna adalah tepung dan pati (Hafsah, 2004).
Menurut Jamrianti (2007), produksi ubi jalar cukup tinggi dibandingkan dengan beras maupun ubi kayu. Ubi jalar dengan masa panen 4 bulan dapat berproduksi lebih dari 30 ton/ha, tergantung dari bibit, sifat tanah dan pemeliharaannya. Walaupun rata-rata produksi ubi jalar nasional baru mencapai 12 ton/ha. Tetapi masih lebih besar, jika dibandingkan dengan produksi gabah (± 4.5 ton/ha) atau ubi kayu (± 8 ton/ha), padahal masa panen lebih lama dari masa panen ubi jalar.
Pati ubi jalar belum banyak dimanfaatkan di Indonesia seperti pati ubi kayu, jagung, dan garut. Sifat-sifat fisik dan kimia pati berbeda-beda, bergantung pada bahan dasarnya. Perbedaan tersebut menentukan kesesuaian penggunaannya untuk bahan olahan pangan dan nonpangan (Ginting et al., 2005).
Ubi jalar juga sangat potensial sebagai bahan baku industri. Komoditas ini dapat digunakan dalam pembuatan pati termodifikasi, yang banyak diperlukan industri makanan beku, pengalengan makanan, dan campuran makanan bayi. Berbagai produk seperti roti dan mie juga dapat diolah dari ubi jalar sebagai pensubtitusi terigu. Di Jepang, ubi jalar digunakan sebagai bahan baku dalam industri alkohol, aseton, asam laktat, dan asam cuka (Kantor Menteri Negara Urusan Pangan dan Hortikultura dan IPB, 1999).
D. Pencoklatan (Browning)
Proses pencoklatan (Browning) sering terjadi pada buah-buahan yang rusak, memar, pecah, atau terpotong seperti pada pisang, peach, pir, salak, pala, dan apel. Proses pencoklatan dapat dibagi menjadi dua jenis, proses pencoklatan enzimatis dan non-enzimatis. Reaksi pencoklatan non-enzimatis belum diketahui atau dimengerti penuh. Tetapi pada umumnya ada tiga macam reaksi pencoklatan non-enzimatis yaitu karamelisasi, reaksi Maillard, dan pencoklatan akibat vitamin C (Winarno, 1997).
Pencoklatan enzimatis terjadi pada buah-buahan yang banyak mengandung senyawa fenol (Winarno, 1997). Berdasarkan pada derajat
kekompleksannya, senyawa fenol pada tanaman dapat dibagi menjadi dua bagian, yaitu : (1) senyawa fenol sederhana dan (2) senyawa fenol kompleks (Muchtadi, 1992).
Kelompok senyawa fenol yang sederhana terdiri dari asam amino tirosin, dihidroksifenilalanin (DOPA), katekol, dan asam kafeat. Asam kafeat bila bereaksi dengan asam kuinat akan membentuk asam klorogenat. Asam klorogenat banyak terdapat pada apel, kentang, arbei, dan pir (Muchtadi, 1992).
Golongan senyawa fenol yang kompleks terdiri sari antosianin, lignin, dan tanin. Berdasarkan dapat tidaknya dihidrolisis, maka tanin dapat dibagi menjadi dua golongan, yaitu hydrolizable tannin dan condensed tannin. Yang pertama adalah tanin yang dapat dihidrolisis baik dengan asam, basa, atau enzim yang akan menghasilkan senyawa-senyawa seperti sakarida, asam galat, asam elagat atau asam yang lain. Yang kedua adalah tanin yang mempunyai struktur yang kompleks dan tidak dapat dihidrolisis. Yang termasuk ke dalam grup ini adalah katekin dan leukoantosianin, di mana molekulnya dapat terpolimerisasi (Muchtadi, 1992).
Menurut Marshall et al. (2000), pencoklatan enzimatis terjadi setelah senyawa fenolik yang bertindak sebagai substrat dan terdapat di vakuola bertemu dengan enzim polifenol oksidase yang terdapat di sitoplasma dan dibantu oleh oksigen yang bertindak sebagai substrat pembantu (co-substrate). Mekanisme pencoklatannya adalah enzim polifenol oksidase mengkatalisis oksidasi fenol menjadi o-quinon. Kemudian o-quinon secara spontan melangsungkan reaksi polimerisasi menjadi pigmen berwarna coklat yang disebut juga dengan melanin seperti yang terjadi pada apel pada Gambar 4.
Enzim-enzim yang dapat mengkatalisis oksidasi dalam proses pencoklatan dikenal dengan berbagai nama, yaitu fenol oksidase, polifenol oksidase, fenolase, atau polifenolase; masing-masing bekerja spesifik untuk substrat tertentu (Winarno, 1997). Enzim merupakan protein yang dihasilkan oleh sel hidup yang bertindak sebagai katalis dalam reaksi kimia organik, yang dapat mengubah bahan sedangkan dia sendiri tidak mengalami perubahan (Sucipto, 2008).
Untuk mencegah terbentuknya warna coklat pada buah atau sayuran dapat dilakukan dengan : (1) menghilangkan oksigen pada permukaan buah atau sayuran yang terpotong, misalnya dengan merendam dalam air; (2) menghilangkan tembaga yang terdapat pada gugus prostetik enzim polifenol oksidase dengan menggunakan pengkelat seperti EDTA, asam-asam organik, dan fosfor sehingga enzim polifenol oksidase tidak dapat melangsungkan reaksi pencoklatan enzimatis; (3) inaktivasi enzim polifenol oksidase dengan melakukan blansir pada buah atau sayuran; (4) penyimpanan dingin; (5) menggunakan senyawa antioksidan; dan (6) menggunakan edible coating (Marshall et al., 2000).
E. Apel
Menurut Sunarjono (2005), tanaman apel (Malus domesticus Borkh) diduga berasal dari sekitar Israel-Palestina, kemudian menyebar ke seluruh dunia, termasuk Indonesia. Eropa dan Australia merupakan negara yang paling dulu mengembangkan tanaman apel secara agribisnis. Di Indonesia, tanaman apel banyak terdapat di Batu (Malang) dan Soe (Timor Timur Selatan).
Buah apel berbentuk bulat hingga bulat telur, keras tetapi renyah, dan airnya sedikit. Bila buah sudah tua, warnanya ada yang merah, kuning, atau hijau (Sunarjono, 2005).
Salah satu varietas unggul yang telah dilepas adalah Manalagi, seperti terlihat pada Gambar 5. Asalnya dari Desa Gandon, Batu. Warna buahnya hijau muda kekuningan, pori kulit buahnya putih, jarang, aromanya sedap. Daging buahnya agak liat, kurang berair, warnanya putih (Kusumo, 1986).
Gambar 5. Apel Manalagi
Menurut Sunarjono (2005), selain sebagai buah segar untuk buah meja (cuci mulut), buah apel mempunyai nilai tinggi sebagai minuman (jus). Nilai gizi yang terkandung di dalamnya cukup tinggi karena selain mengandung vitamin A, B, dan C juga banyak mengandung mineral yang penting untuk menjaga kesehatan manusia.
Apel termasuk buah yang dapat mengalami reaksi pencoklatan enzimatis apabila mengalami kerusakan berupa memar ataupun pengirisan dan pemotongan (Winarno, 1997). Hal ini disebabkan di dalam apel terkandung senyawa fenol yang apabila berinteraksi dengan enzim polifenol oksidase dengan bantuan oksigen akan mengalami pencoklatan (browning). Senyawa fenol yang terkandung pada apel meliputi asam klorogenat, katekol, katekin, asam kafeat, 3,4-dihidroksifenilalanin (DOPA), p-kresol, 4-metil katekol, leukosianidin, dan flavonol glikosida (Marshall et al., 2000).
F. Pengolahan Minimal (Minimal Processing)
Pengolahan minimal (minimal processing) atau dikenal pula dengan istilah potong segar (fresh-cut) merupakan pengolahan buah atau sayuran yang melibatkan pencucian, pengupasan, dan pengirisan sebelum dikemas dan menggunakan suhu rendah untuk penyimpanan sehingga mudah dikonsumsi tanpa menghilangkan kesegaran dan nilai gizi yang dikandungnya (Perera, 2007). Akan tetapi, proses pemotongan produk-produk tersebut dapat
mengakibatkan kerusakan sel dan mempercepat kerusakan mutu (Baldwin dan Nisperros-Carriedo, 1993).
Kelebihan dari buah-buahan dan sayuran yang terolah minimal, seperti terlihat pada Gambar 6, selain kemudahan dalam penyajian adalah memungkinkan konsumen melihat secara langsung kondisi bagian dalam produk sehingga menawarkan mutu yang lebih terjamin dibandingkan buah utuh. Apalagi buah-buahan umumnya tidak terlepas dari serangan hama lalat buah (fruit fly), sehingga meskipun nampak mulus di bagian luar, akan tetapi di dalamnya bisa saja terinfestasi telur atau ulat dari lalat buah. Untuk buah berukuran besar, konsumen tidak harus mengeluarkan uang ekstra hanya untuk membeli satu buah yang beratnya kiloan. Bahkan konsumen dapat membeli beberapa jenis buah dalam satu kemasan dalam ukuran berat yang relatif kecil, sehingga bisa memenuhi selera sekaligus menghemat pengeluaran (Hasbullah, 2006).
Gambar 6. Contoh produk terolah minimal
Perlakuan-perlakuan pada produk potong segar seperti pengupasan dan pemotongan dapat menyebabkan perubahan kimia dan biokimia yang selanjutnya menyebabkan kerusakan mutu. Perubahan tersebut meliputi peningkatan respirasi, produksi etilen, perubahan warna, flavor, pembentukan metabolit sekunder, dan peningkatan pertumbuhan mikroba (Baldwin, 2007).
Perlakuan tambahan dapat diberikan untuk mengatasi masalah yang timbul akibat pengolahan minimal yang bertujuan mempertahankan kualitas dan memperpanjang masa simpan, di antaranya adalah (i) penggunaan bahan
tambahan pangan (BTP), dan (ii) penggunaan pelapis edibel. Penggunaan BTP seperti asam askorbat untuk buah mangga dan rambutan, tri sodium phosphate atau Na-alginat untuk melon terbukti dapat memperpanjang masa simpan. Pelapis edibel dapat digunakan sebagai pengemas primer yang dapat dimakan dan berfungsi untuk mengawetkan dan mempertahankan kesegaran serta kualitas produk (Hasbullah, 2006).
G. Respirasi
Setelah dipanen, buah dan sayur masih melangsungkan metabolisme hidup. Pada saat itu terjadi degradasi komponen di dalam buah dan sayur menjadi komponen yang lebih sederhana. Proses tersebut berlangsung hingga akhirnya buah atau sayur menjadi layu dan busuk (Wulandari, 2006).
Aktivitas metabolisme itu adalah respirasi atau pernapasan, di mana terjadi penyerapan oksigen (O2) dan pelepasan karbondioksida (CO2) melalui
pemecahan komponen-komponen yang terkandung di dalam buah dan sayur tersebut. Selain itu, terjadi juga transpirasi (pelepasan uap air) melalui pori-pori permukaan buah dan sayur. Transpirasi yang terus-menerus terjadi, pada akhirnya akan menyebabkan buah dan sayur menjadi layu (Wulandari, 2006).
Apabila persediaan oksigen berkurang maka buah-buahan cenderung untuk melakukan fermentasi untuk memenuhi kebutuhan energinya. Senyawa organik yang biasa digunakan dalam proses fermentasi pada umumnya adalah glukosa yang akan menghasilkan beberapa bahan lain seperti aldehida, alkohol, atau asam. Bila buah-buahan melakukan fermentasi, maka energi yang diperoleh lebih sedikit per satuan substrat dibandingkan dengan cara pernapasan (respirasi). Oleh karena itu, bila buah-buahan melakukan proses fermentasi untuk memenuhi kebutuhan energi, diperlukan substrat (glukosa) dalam jumlah yang banyak sehingga dalam waktu yang singkat persediaan substrat akan habis dan akhirnya buah tersebut akan mati dan busuk (Muchtadi dan Sugiyono, 1989).
Luka atau memar yang terjadi pada buah-buahan akan meningkatkan sintesa etilen. Dengan demikian secara tidak langsung akan meningkatkan kecepatan respirasi karena diketahui bahwa etilen dapat menstimulir reaksi
enzimatis dalam buah-buahan (Muchtadi, 1992). Perubahan-perubahan fisiologis yang disebabkan peningkatan etilen meliputi : (1) peningkatan permeabilitas sel, (2) hilangnya sekat-sekat (decompartmentation), (3) peningkatan pelayuan dan aktivitas respirasi, dan (4) peningkatan aktivitas enzim (Wong et al., 1994).
Faktor-faktor yang mempengaruhi respirasi dapat dibedakan atas dua, yaitu faktor internal (dari dalam bahan sendiri) seperti tingkat perkembangan organ, komposisi kimia jaringan, ukuran produk, adanya pelapisan alami pada permukaan kulitnya, dan jenis jaringan. Faktor eksternal (dari luar atau lingkungan di sekeliling bahan) seperti suhu, penggunaan etilen, ketersediaan oksigen, karbondioksida, terdapatnya senyawa pengatur pertumbuhan, dan adanya luka pada buah (Muchtadi dan Sugiyono, 1989).
Menurut Muchtadi (1992), terdapat tiga fase dalam respirasi, yaitu : 1. Perombakan polisakarida menjadi gula-gula sederhana,
2. Oksidasi gula-gula sederhana tersebut masih menjadi asam piruvat, dan 3. Perubahan (transformasi) aerobik dari piruvat dan asam-asam organik lain
menjadi karbondioksida, air, dan energi.
Beberapa senyawa penting yang dapat digunakan untuk mengukur proses respirasi adalah glukosa, ATP, CO2, dan O2. Oleh karena itu, beberapa
cara telah dicoba digunakan untuk mengukur perubahan kandungan gula, jumlah ATP, jumlah CO2 yang dihasilkan, dan jumlah O2 yang digunakan.
Dari keempat cara tersebut, pengukuran yang mungkin dilaksanakan dengan menggunakan cara yang sederhana dan praktis adalah dengan menghitung produksi CO2. Cara ini mudah dilakukan karena selama respirasi jumlah CO2
yang keluar relatif cukup banyak (Winarno dan Wirakartakusumah, 1979). Terdapat dua jenis respirasi yang terjadi pada buah-buahan, yaitu klimakterik dan non-klimakterik. Menurut Muchtadi (1992), buah-buahan yang termasuk golongan klimakterik misalnya pisang, mangga, pepaya, sawo, apel, advokat, dan sebagainya. Sedangkan buah-buahan yang termasuk golongan non-klimakterik misalnya semangka, jeruk, nenas, mentimun, anggur, limau, dan sejenis arbei.
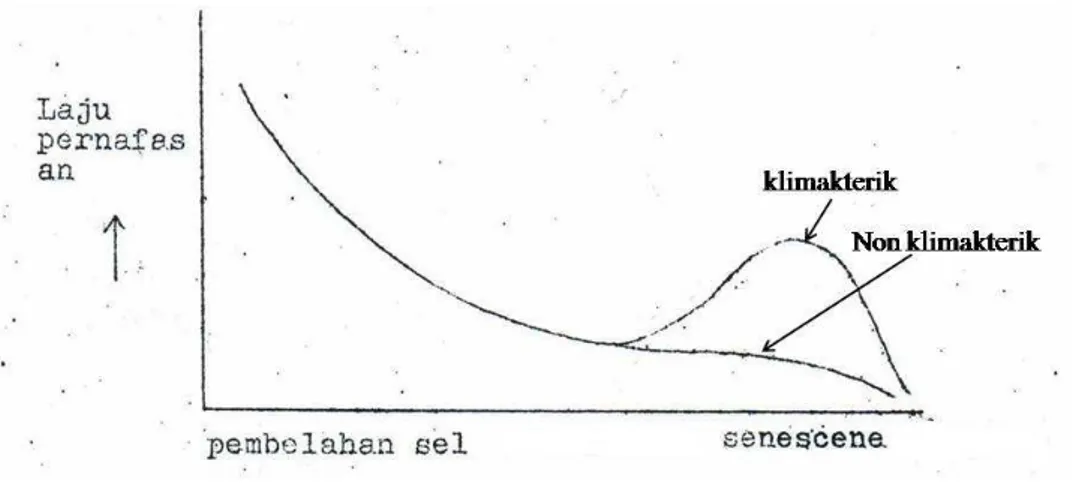
Menurut Winarno dan Wirakartakusumah (1979), klimakterik adalah suatu periode mendadak yang unik bagi buah-buahan tertentu, di mana selama proses ini terjadi serangkaian perubahan biologis yang diawali dengan proses pembuatan etilen. Menurut Winarno dan Jenie (1973), respirasi klimakterik ditandai dengan laju produksi CO2 yang terus menurun sampai mendekati senescene. Pada saat senescene produksi CO2 meningkat kemudian turun lagi
seperti terlihat pada Gambar 7.
Gambar 7. Kurva laju respirasi antara klimakterik dan non-klimakterik
Pada tahap klimakterik, kloroplas pecah terfragmentasi, endoplasmik retikula terdegradasi, dan sitoplasma penuh dengan produk-produk hasil degradasi, tetapi mitokondria masih tetap utuh. Pada saat lepas klimakterik, kloroplas akan menghilang, demikian juga endoplasmik retikula, sedangkan mitokondria akan mengadakan degradasi. Kerusakan yang terjadi pada mitokondria menyebabkan suplai energi untuk keperluan metabolisme berkurang dan akhirnya berhenti, sehingga menyebabkan terjadinya pelayuan (Muchtadi, 1992).
III.
METODOLOGI PENELITIAN
A. Waktu dan Tempat Penelitian
Penelitian ini dilakukan pada bulan April sampai September 2008. Bertempat di Laboratorium Rekayasa Proses Pangan, Departemen Ilmu dan Teknologi Pangan, Fateta IPB dan Laboratorium Teknologi Pengolahan Pangan dan Hasil Pertanian, Departemen Teknik Pertanian, Fateta IPB.
B. Bahan dan Alat
Bahan baku yang digunakan pada penelitian ini adalah ubi jalar putih yang diperoleh dari Pasar Anyar Bogor dan apel Manalagi yang diperoleh dari Pasar Induk Kramat Jati. Apel Manalagi yang digunakan memiliki tingkat kematangan sedang yang dicirikan dengan warna kuning muda. Bahan-bahan lain yang digunakan adalah tapioka yang diperoleh dari pasar, air destilata, CMC, gliserol, asam askorbat, dan asam sitrat.
Alat-alat yang digunakan meliputi pisau, pemarut, timbangan, blender kering, kain saring, oven, ayakan 100 mesh, alat-alat gelas, Whitenessmeter,
magnetic stirer, pompa vakum, baskom, penggaris, Chromameter Minolta
CR-200, neraca analitik, Gas Analyzer Shimadzu, lemari pendingin, termometer, pipet volumetrik, gelas pengaduk, gelas ukur, wrapping film (dari jenis PVC) merk WITA, dan styrofoam.
C. Prosedur Penelitian
Penelitian ini memiliki dua tahapan, yakni penelitian pendahuluan dan penelitian utama. Penelitian pendahuluan bertujuan memperoleh pati ubi jalar sebagai bahan pembuat edible coating dan menentukan konsentrasi pati dan CMC yang memberikan viskositas tidak terlalu kental juga tidak terlalu encer dengan pengamatan secara visual (subjektif). Sementara itu, penelitian utama meliputi pembuatan edible coating yang selanjutnya diaplikasikan pada apel potong segar untuk diamati. Tahapan penelitian secara lengkap dapat dilihat pada Gambar 8.
*
Pembuatan pati untuk bahan dasar edible coating (Gambar 10)
Pengamatan
Densitas kamba
Penentuan konsentrasi pati dan CMC untuk edible coating
Penilaian subjektif (secara visual) berdasarkan viskositas, yakni tidak terlalu encer dan tidak terlalu kental
Konsentrasi pati dan CMC yang
diinginkan
Penelitian utama
Pembuatan edible coating (Gambar 14) Pati 1% (b/v) CMC 0.5%(b/v) Perbandingan pati ubi jalar:tapioka 4:0 (A1)
Rendemen Derajat putih
Pati 1% (b/v) CMC 1%(b/v) Pati 2% (b/v) CMC 0.5%(b/v) Pati 2% (b/v) CMC 1%(b/v) Penelitian pendahuluan Perbandingan pati ubi jalar:tapioka 3:1 (A2) Perbandingan pati ubi jalar:tapioka 2:2 (A3) Perbandingan pati ubi jalar:tapioka 1:3 (A4) Perbandingan pati ubi jalar:tapioka 0:4 (A5) Kontrol (A6)
Aplikasi pada apel potong segar (Gambar 17)
*
Gambar 8. Diagram alir penelitian
1. Penelitian Pendahuluan
Ubi jalar putih (Ipomoea batatas L.) yang digunakan sebagai bahan penghasil pati diperoleh dari Pasar Anyar Bogor dan hanya dari satu pedagang untuk menjaga keseragaman. Pembuatan pati mengacu pada Shinta (2007) dengan modifikasi yang dapat dilihat pada Gambar 9 dan 10.
*
Pengamatan
Ubi jalar segar bersih (10 kg)
Disortasi
Dibersihkan (abrassive peeler) Kotoran
Dirajang (slicer)
Diblender Air
Diperas
Disaring (kain batis) Ampas Suhu ruang (B1) Suhu 5°C (B2) Organoleptik Warna Susut bobot Laju respirasi
*
Gambar 9. Diagram alir pembuatan pati ubi jalar (Shinta, 2007)
*
Diendapkan selama 5 jam
Pati ubi jalar basah
Dikeringkan dengan oven 40°C
Pati ubi jalar kering
Air Diperas
Disaring dengan kain saring Ampas Ubi jalar segar (5 kg)
Disortasi
Dicuci dan dikupas
Ubi jalar bersih (3.1 kg)
Diparut dengan mesin pemarut kelapa Digiling
Disaring dengan pengayak 100 mesh
*
Gambar 10. Diagram alir pembuatan pati ubi jalar modifikasi
Modifikasi pembuatan pati ubi jalar dilakukan pada tahapan pembersihan, pemarutan, dan pengeringan. Pengupasan kulit pada penelitian ini tidak menggunakan abrassive peeler melainkan dilakukan secara manual agar tidak banyak bagian yang terbuang sehingga dapat mengurangi rendemen. Pemarutan juga dilakukan dengan mesin pemarut kelapa agar lebih efisien. Pengeringan menggunakan oven (Gambar 11) pada proses pembuatan pati dilakukan dua kali, yakni sebelum dan sesudah pengecilan ukuran menggunakan blender kering yang terdapat pada Gambar 12.
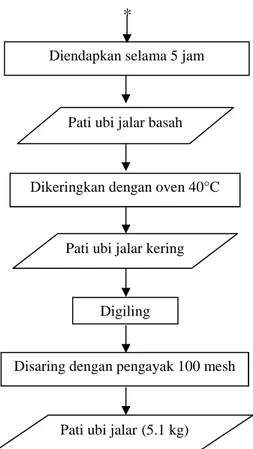
Diendapkan selama 5 jam pada suhu ruang
Pati ubi jalar basah
Dikeringkan dengan oven 40°C selama 4 jam
Disaring dengan pengayak 100 mesh
Pati ubi jalar(5.1 kg) Filtrat
Dihaluskan (blender kering) skala 1
Gambar 12. Blender kering yang digunakan untuk pengeringan pada
pembuatan pati
Selain pembuatan pati, pada penelitian pendahuluan juga dilakukan penentuan konsentrasi pati dan CMC yang memberikan viskositas tidak terlalu kental juga tidak terlalu encer yang dinilai secara visual (subjektif). Terdapat empat kombinasi konsentrasi pati dan CMC yang dicobakan, yaitu (1) pati ubi jalar 1% b/v; CMC 0.5% b/v, (2) pati ubi jalar 1% b/v; CMC 1% b/v, (3) pati ubi jalar 2% b/v; CMC 0.5% b/v, dan (4) pati ubi jalar 2% b/v; CMC 1% b/v. Volume yang dimaksud yakni volume larutan pati setelah ditambahkan dengan CMC. CMC digunakan sebagi campuran pati karena kemampuannya menyerap oksigen tanpa meningkatkan kandungan karbondioksida.
Larutan edible coating yang terlalu encer akan mengurangi efek penghambatan reaksi pencoklatan produk, dalam hal ini apel potong segar. Sementara itu, larutan edible coating yang terlalu kental selain mengakibatkan lapisan yang terbentuk tidak merata, juga akan memperlama waktu pengeringan produk serta dapat mengakibatkan fermentasi anaerobik.
Setelah diperoleh kombinasi pati dan CMC yang tepat, penelitian dilanjutkan dengan pembuatan larutan edible coating yang selanjutnya digunakan untuk melapisi apel potong segar. Mekanisme pembuatan
edible coating mengacu pada Santoso et al. (2004) dengan modifikasi
Gambar 13. Diagram alir pembuatan edible coating (Santoso et al., 2004)
Gambar 14. Diagram alir pembuatan edible coating modifikasi Pati
Air Diaduk dengan mixer selama 15 menit
Disaring
Gliserol 15% (v/b tapioka), asam
stearat, CMC
Dipanaskan pada suhu 70°C sambil terus diaduk
Degassing selama 20 menit
Larutan edible coating
Didinginkan sampai suhu kamar
Pati (2 gram)
CMC (1 gram) Air destilata (197 ml)
Diaduk manual menggunakan gelas pengaduk
Diaduk dengan magnetic stirer skala 8 selama 15 menit
Dipanaskan sampai suhu 85°C, sambil diaduk dengan magnetic stirer
Gliserol 15% (v/b pati)
Degassing dengan pompa vakum sampai tidak ada gelembung lagi
Tahapan yang dimodifikasi pada pembuatan edible coating adalah penambahan CMC dan penggunaan magnetic stirrer. Penambahan CMC pada penelitian ini dilakukan bersamaan dengan pencampuran pati dan air destilata untuk kemudian diaduk dengan gelas pengaduk. Tujuan pengadukan dengan gelas pengaduk adalah untuk mengurangi gumpalan yang diakibatkan adanya CMC sehingga larutan lebih homogen. Pada penelitian ini digunakan magnetic stirrer (Gambar 15) sebagai pengganti
mixer. Penggunan magnetic stirrer menyebabkan proses pembuatan edible coating lebih mudah karena pengadukan berlangsung otomatis. Pembuatan edible coating juga tidak ditambahi asam stearat dan degassing dilakukan
sampai tidak terlihat gelembung lagi.
Gambar 15. Pemanasan dan pengadukan pati menggunakan magnetic stirrer
2. Penelitian Utama
Setelah diperoleh kombinasi pati dan CMC yang sesuai pada penelitian pendahuluan yaitu konsentrasi pati 1% b/v dan CMC 0.5% b/v, penelitian dilanjutkan dengan aplikasi larutan edible coating tersebut pada apel potong segar. Pati yang digunakan tidak hanya dari pati ubi jalar tapi juga tapioka. Tapioka ini kemudian dicampurkan pati ubi jalar menjadi lima kombinasi perlakuan. Yaitu (1) perbandingan pati ubi jalar:tapioka 4:0, (2) perbandingan pati ubi jalar:tapioka 3:1, (3) perbandingan pati ubi jalar:tapioka 2:2, (4) perbandingan pati ubi jalar:tapioka 1:3, dan (5) perbandingan pati ubi jalar:tapioka 0:4. Penggunaan tapioka sebagai
campuran pati disebabkan kemudahan mendapatkannya di pasaran dan sering digunakan sebagai bahan baku industri. Pencampurannya dengan pati ubi jalar untuk mengetahui efektivitas kedua pati tersebut ketika dijadikan bahan baku edible coating.
Apel yang telah dilapisi edible coating dengan berbagai kombinasi perlakuan kemudian diamati laju respirasi, warna, susut bobot, dan organoleptik. Cara aplikasi edible coating terhadap apel potong segar mengacu pada Layuk et al. (2002) dengan beberapa modifikasi. Secara lengkap dapat dilihat pada Gambar 16 dan 17.
Gambar 16. Diagram alir aplikasi edible coating pada apel potong segar
(Layuk et al., 2002)
Apel
Dikupas
Dipotong dengan ukuran 3 x 1.5 x 1.5 cm
Dicelupkan larutan asam askorbat dan asam sitrat 1:1 (5 menit)
Dicelupkan dalam larutan edible coating (5 menit)
Dikeringkan pada suhu 50°C selama 20 menit
Diletakkan dalam cawan petri
Dimasukkan dalam stoples tertutup
Gambar 17. Diagram alir aplikasi edible coating pada apel potong segar
modifikasi
Modifikasi proses yang dilakukan berupa pengecilan ukuran apel potong segar menjadi 2 x 1.5 x 1cm dari semula 3 x 1.5 x 1.5 cm. Hal ini dilakukan dengan pertimbangan keterbatasan biaya. Selanjutnya pengeringan tidak dilakukan menggunakan oven tapi dengan kipas angin. Wadah yang digunakan adalah styrofoam dan ditutup dengan wrapping
film. Hal ini dilakukan karena styrofoam merupakan jenis pengemas yang
mudah ditemui. Setiap wadah styrofoam berisi empat buah potongan apel. Dan setiap kombinasi perlakuan terdiri atas dua wadah sebagai ulangan.
D. Pengamatan
Pengamatan dibagi menjadi dua, yakni pengamatan untuk penelitian pendahuluan dan pengamatan untuk penelitian utama. Pengamatan yang
Apel
Dicuci
Dipotong dengan ukuran 2 x 1.5 x 1cm
Dicelupkan larutan asam askorbat dan asam sitrat 1:1 (5 menit)
Dicelupkan dalam larutan edible coating (5 menit)
Ditiriskan
Dikeringkan dengan kipas angin hingga kering
Diletakkan dalam styrofoam
Ditutup dengan wrapping film
dilakukan pada penelitian pendahuluan meliputi pengamatan rendemen pati, derajat putih, dan densitas kamba. Sedangkan pengamatan yang dilakukan pada penelitian utama meliputi laju respirasi, susut bobot, warna, dan organoleptik.
1. Rendemen
Rendemen pati ubi jalar dihitung berdasarkan perbandingan bobot kering pati yang diperoleh terhadap bobot umbi segar tanpa kulit (bobot bersih). Perhitungan rendemen menggunakan rumus :
100% x b a pati Rendemen = Keterangan :
a = Bobot kering pati ubi jalar b = Bobot umbi ubi jalar bersih
2. Derajat Putih
Derajat putih diukur menggunakan alat Whitenessmeter. Pada alat
ini dibandingkan derajat putih contoh dengan derajat putih standar (MgO) yang bernilai 100%. Skala terkecil dari Whitenessmeter adalah 0 % (sama
dengan warna hitam) dan skala terbesar adalah 100 % (sama dengan warna putih standar MgO). Pembacaan derajat putih contoh dapat dilihat langsung pada skala yang terdapat pada Whitenessmeter. Derajat putih dari
contoh yang diukur mempunyai nilai 0-100 %.
3. Densitas Kamba (Afdi, 1989)
Densitas kamba merupakan salah satu sifat fisik bahan pangan yang berupa tepung atau biji-bijian yang dinyatakan dalam g/ml. Sampel dituang ke dalam gelas ukur 100 ml. Penuangan dilakukan dari ketinggian 10 cm. Kemudian diratakan dengan penggaris. Selanjutnya gelas ukur yang berisi pati ditimbang. Densitas kamba dihitung dengan cara membagi sampel dengan volume ruang yang ditempati seperti yang terdapat pada rumus di bawah ini.
Densitas kamba = ukur gelas volume ukur) gelas (berat -pati) ukur gelas (berat +
Nilai densitas kamba penting dalam hal konsumsi suatu produk pangan. Densitas kamba suatu bahan mempengaruhi jumlah bahan yang bisa dikonsumsi dan biaya produksinya (Peleg, 1983). Nilai densitas kamba berbanding terbalik dengan kekambaan. Semakin kecil nilai densitas kamba maka kekambaan produk tersebut semakin besar (bulky).
Artinya untuk satuan berat yang sama, produk yang memiliki densitas kamba lebih kecil akan memerlukan tempat yang lebih besar.
4. Laju Respirasi
Laju respirasi diukur dengan menggunakan sistem tertutup, dengan menempatkan buah apel potong segar (fresh-cut apple) ± 250 gram ke
dalam toples dan ditutup rapat supaya tidak ada udara yang masuk ke dalam sistem.
Pada saat pengukuran, dua buah selang yang terhubung dengan
Gas Analyzer dimasukkan ke dalam toples yang akan diukur laju
respirasinya. Pengukuran gas CO2 dilakukan secara bertahap, mulai dari 4,
8, 12, sampai 24 jam sekali setiap harinya hingga tujuh hari atau hingga produk rusak.
Menurut Saltveit (_______), persamaan laju respirasi gas CO2 dan
O2 adalah sebagai berikut :
dt dx x W V R = Keterangan :
R = Laju respirasi (ml/kg jam)
V = Volume bebas dalam respiration chamber (liter)
W = berat bahan (kg)
dt dx
5. Susut Bobot
Penentuan susut bobot dilakukan dengan mengukur bobot apel potong segar yang telah dikemas setiap hari. Pengukuran dihentikan hingga umur simpan yang diketahui melalui pengukuran laju respirasi pada tahapan sebelumnya. Bobot apel potong segar pada H-0 ditentukan sebagai bobot awal. Susut bobot merupakan selisih dari bobot pada sebelum perlakuan dan setelah perlakuan. Persamaan yang digunakan untuk mengukur susut bobot adalah sebagai berikut :
Susut bobot = _ ×100% o t o W W W Keterangan : o
W = Bobot sampel pada hari ke-0 (gram)
t
W = Bobot sampel pada hari ke-n (gram)
6. Warna
Intensitas warna diukur dengan menggunakan Chromameter
Minolta CR-200 seperti terlihat pada Gambar 18. Pada Chromameter
Minolta CR-200 digunakan sistem Y, x, dan y. Nilai ini kemudian dikonversi ke dalam nilai L untuk menunjukkan kecerahan (Lightness).
Rumus konversi yang digunakan dapat dilihat pada Lampiran 7a. Sebelum pengukuran dilakukan, Chromameter dikalibrasi dahulu dengan
calibration plate yang berwarna putih.
Nilai x yang diperoleh dari pengukuran Chromameter digunakan untuk mengetahui nilai Browning Index (BI). Browning Index (BI) biasanya digunakan sebagai indikator tingkat pencoklatan pada produk-produk mengandung gula. Semakin tinggi nilai BI menunjukkan semakin tinggi intensitas warna coklat pada produk. Berdasarkan Perez-Gago et al. (2003), nilai BI diperoleh menggunakan rumus sebagai berikut :
100 x 0.172 0.31) -(x BI=
x adalah cromaticity coordinate yang diperoleh dari pembacaan Chromameter.
7. Organoleptik
Salah satu syarat edible coating adalah tidak berasa dan jernih
(Gontard dan Guilbert, 1994). Dengan alasan itulah dilakukan pengujian organoleptik terhadap produk apel potong segar yang telah dilapisi edible coating dengan berbagai konsentrasi pati ubi jalar-tapioka. Untuk
mengetahui tingkat kesukaan panelis terhadap apel yang telah dilapisi. Uji organoleptik yang dilakukan adalah uji hedonik parameter warna dan rasa pada skala 1-5. Masing-masing kriteria penilaian tersebut adalah (1) sangat tidak suka, (2) tidak suka, (3) netral/biasa, (4) suka, dan (5) sangat suka. Jumlah panelis yang digunakan adalah 31 orang panelis. Data yang diperoleh diolah secara statistika menggunakan ANOVA melalui program SPSS 15.
Pada uji penerimaan tidak ada contoh pembanding atau contoh baku dan panelis dilarang mengingat atau membandingkan dengan contoh yang diuji sebelumnya. Tanggapan harus diberikan secara cepat dan spontan. Bahkan tanggapan yang sudah diberikan tidak boleh ditarik kembali meskipun kemudian timbul keragu-raguan. Uji penerimaan lebih subjektif daripada uji pembedaan. Karena itu beberapa panelis yang ekstrim senang atau benci terhadap suatu komoditi atau bahan tidak dapat lagi digunakan untuk melakukan uji penerimaan (Soekarto,1981).
E. Rancangan Percobaan
Faktor yang dicobakan dalam penelitian ini meliputi perbandingan konsentrasi pati ubi jalar dan tapioka (A) dan suhu penyimpanan (B) yang dilakukan dengan dua kali ulangan. Faktor perbandingan konsentrasi pati ubi jalar dan tapioka terdiri atas enam taraf atau perlakuan, yakni A1 (perbandingan pati ubi jalar:tapioka 4:0), A2 (perbandingan pati ubi jalar:tapioka 3:1), A3 (perbandingan pati ubi jalar:tapioka 2:2), A4 (perbandingan pati ubi jalar:tapioka 1:3), dan A5 (perbandingan pati ubi jalar:tapioka 0:4), serta kontrol (A6) yaitu apel yang tidak dilapisi edible
coating. Suhu penyimpanan terdiri atas dua taraf, yakni B1 (suhu ruang) dan
B2 (suhu 5°C). Masing-masing faktor menggunakan Rancangan Acak Lengkap sebagai rancangan percobaannya.
Model linier yang digunakan untuk faktor perbandingan konsentrasi pati ubi jalar dan tapioka adalah sebagai berikut (Matjik dan Sumertajaya, 2002) :
Yij = µ + τi + εij
Keterangan :
i = 1,2,3,4,5,6 dan j = 1,2
Yij = Pengamatan pada perlakuan ke-i dan ulangan ke-j
µ = Rataan umum
τi = Pengaruh perlakuan ke-i
βj = Pengaruh faktor suhu penyimpanan pada taraf ke-j
εij = Pengaruh acak pada perlakuan ke-i ulangan ke-j
Untuk faktor suhu penyimpanan model linier yang digunakan adalah sebagai berikut (Matjik dan Sumertajaya, 2002) :
Yij = µ + τi + εij
Keterangan :
i = 1,2 dan j = 1,2
Yij = Pengamatan pada perlakuan ke-i dan ulangan ke-j
µ = Rataan umum
βj = Pengaruh faktor suhu penyimpanan pada taraf ke-j
εij = Pengaruh acak pada perlakuan ke-i ulangan ke-j
Data yang diperoleh diolah secara statistika menggunakan instrumen ANOVA melalui program SPSS 15. Bila terjadi perbedaan nyata antar perlakuan, akan dilanjutkan dengan uji Duncan dengan selang kepercayaan 99% (α = 0.01).
IV.
HASIL DAN PEMBAHASAN
A. Penelitian Pendahuluan
Pengeringan yang dilakukan dua kali dalam penelitian ini bertujuan agar pengeringan pati berlangsung secara merata. Setelah dikeringkan dan dihaluskan menggunakan blender kering, selanjutnya pati disaring menggunakan ayakan 100 mesh. Pengayakan ini menghasilkan pati yang halus seperti terlihat pada Gambar 19.
Gambar 19. Pati ubi jalar yang telah diayak
Tahapan selanjutnya yang dilakukan setelah pembuatan pati adalah penentuan konsentrasi pati dan CMC yang memberikan viskositas tidak terlalu kental juga tidak terlalu encer. Terdapat empat kombinasi konsentrasi pati dan CMC yang dicobakan, yaitu (1) pati ubi jalar 1% b/v; CMC 0.5% b/v, (2) pati ubi jalar 1% b/v; CMC 1% b/v, (3) pati ubi jalar 2% b/v; CMC 0.5% b/v, dan (4) pati ubi jalar 2% b/v; CMC 1% b/v. Volume yang dimaksud yakni volume larutan pati setelah ditambahkan dengan CMC. Berdasarkan pengamatan subjektif secara visual terhadap viskositas yang dihasilkan keempat kombinasi konsentrasi pati dan CMC, diperoleh kombinasi konsentrasi pati dan CMC yang menghasilkan edible coating tidak terlalu encer dan juga tidak terlalu kental, yakni kombinasi konsentrasi pati dan CMC yang pertama dengan konsentrasi pati 1% b/v dan CMC 0.5% b/v.
1. Rendemen
Rendemen yang dihasilkan dari proses pembuatan pati sebesar 16.1%. Jika dibandingkan kadar pati rata-rata yang terdapat pada ubi jalar, yakni 22.4% (Kantor Menteri Negara Urusan Pangan dan Hortikultura dan IPB, 1999), maka efisiensi pembuatan pati ubi jalar adalah 71.9%. Efisiensi tidak mencapai 100% kemungkinan disebabkan pemerasan yang kurang sempurna sehingga masih banyak pati yang tertinggal pada ampas.
2. Derajat Putih
Derajat putih rata-rata yang dimiliki pati ubi jalar adalah 86.4%. Hasil ini lebih rendah jika dibandingkan standar derajat putih tapioka mutu I dan II berdasarkan SNI 01-3451-1994, yakni 94.5% dan 92.0%.
Perbedaan derajat putih ini terutama dipengaruhi oleh faktor genetik. Faktor genetik mempengaruhi pati dalam dua hal, yaitu secara tidak langsung dan secara langsung. Secara tidak langsung mempengaruhi melalui kandungan berbagai komponen lain yang terdapat pada bahan yang mengandung pati dan secara langsung mempengaruhi melalui tingkat keputihan pati. Bahan hasil tanaman yang mengandung pati biasanya juga mengandung komponen lain seperti pigmen dan berbagai mineral (Ega, 2002).
3. Densitas Kamba
Densitas kamba merupakan salah satu sifat fisik bahan yang dinyatakan dengan perbandingan antara berat bahan dengan volume bahan itu sendiri dalam satuan gram/mililiter.
Nilai densitas kamba yang diperoleh pada penelitian ini adalah 0.5 ± 0.09 g/ml. Nilai standar deviasi yang kecil menunjukkan bahwa densitas kamba yang dihasilkan pada penelitian ini mendekati nilai densitas kamba yang sebenarnya. Dibanding densitas kamba pati jagung yang berkisar antara 0.575 – 0.687 g/ml (Ikhlas, 1992), nilai densitas kamba pati ubi jalar yang diperoleh dalam penelitian ini lebih kecil. Hal ini menunjukkan