EVALUASI KEAMANAN VAKSIN BAKTERI Aeromonas hydrophila INAKTIF
TERHADAP IKAN, LINGKUNGAN, DAN ASPEK KEAMANAN PANGAN
Tuti Sumiati, Taukhid, dan Angela Mariana Lusiastuti Balai Penelitian dan Pengembangan Budidaya Air Tawar
Jl. Sempur No. 1, Bogor 16154 E-mail: tuti.sumiati@yahoo.com ABSTRAK
Penyakit MAS (Motile Aeromonas Septicemia) disebabkan oleh infeksi bakteri Aeromonas hydrophila, merupakan salah satu permasalahan dalam perikanan budidaya air tawar. Pengembangan vaksin bakteri inaktif dari sel A. hydrophila yang aman dan efektif merupakan produk yang diharapkan menjadi salah satu alternatif untuk pencegahan penyakit tersebut. Tujuan dari penelitian ini adalah untuk mengevaluasi keamanan vaksin bakteri A. hydrophila inaktif terhadap ikan, lingkungan dan aspek keamanan pangan. Vaksinasi dilakukan dengan metode perendaman, oral melalui pakan dan injeksi secara intra peritoneal (i.p.). Evaluasi keamanan vaksin dilakukan dengan menghitung kematian ikan akut pasca vaksinasi selama 24 jam serta menghitung jumlah kematian pada periode induksi kekebalan selama pemeliharaan pasca vaksinasi. Selain itu dilakukan analisa formalin kuantitatif dari stok vaksin, vaksin yang diencerkan, pakan, dan ikan. Efektivitas vaksin dievaluasi berdasarkan uji tantang ikan uji terhadap patogen target pada level LD50 kemudian dihitung nilai mortalitas kumulatif dan survival rate (SR). Hasil penelitian menunjukkan tidak terjadi kematian akut pada 24 jam pasca vaksinasi pada kelompok ikan yang divaksin maupun kelompok kontrol. Sedangkan pada periode induksi kekebalan tidak terdapat kematian ikan pada perlakuan perendaman. Kematian ikan masing-masing sebanyak 1 ekor ikan terjadi pada perlakuan injeksi dan pakan. Hasil analisa kadar formalin kuantitatif tidak terdeteksi adanya residu formalin baik pada vaksin yang diencerkan, ikan maupun pada media budidaya.
KATA KUNCI: keamanan, vaksin inaktif, Aeromonas hydrophila, formalin kuantitatif PENDAHULUAN
Bakteri A. hydrophila merupakan patogen penting yang menyebabkan kerugian besar dalam industri akuakultur selama puluhan tahun (Shotts et al., 1972; Olivier et al., 1981; Supriyadi & Taufik 1981; Taufik, 1982; Supriyadi & Rukyani, 1990). A. hydrophila telah banyak dilaporkan dapat menginfeksi ikan air tawar di Indonesia pada semua umur dan semua jenis ikan air yang dapat mengakibatkan kematian hingga 100%, dan sering menimbulkan kerugian yang sangat signifikan (Kamiso & Triyanto, 1990; Yuasa et al., 2002; Supriyadi et al., 2005). Infeksi MAS ditandai dengan adanya luka di permukaan tubuh, lokal haemoragi terutama pada insang, borok (tukak), abses dan kembung (Austin & Austin, 1999).
Vaksinasi merupakan salah satu metode utama untuk mencegah penyakit menular (Potter & Baiuk, 2001). Vaksinasi dalam industri akuakultur telah dianggap sangat penting dalam mengurangi kerugian ekonomi yang disebabkan oleh penyakit (Ellis et al., 1997; Rahman & Kawai, 2000; Ebanks et al., 2004; Sommerset et al., 2005). Banyak upaya telah dilakukan untuk mengembangkan vaksin yang efektif terhadap A.hydrophila (Rahman & Kawai< 2000). Beberapa jenis vaksin A. hydrophila yang telah diteliti/dikembangkan seperti dari sediaan sel utuh produk ekstra seluler, dan Lipopolisakarida. Di Indonesia penelitian vaksin A. hydrophila telah banyak dilakukan (Supriyadi et al., 1997; Dwiranti,
2008; Hadi et al., 2010a; Hadi et al., 2010b; Lusiastuti & Hadi, 2010; Sugiani & Komarudin, 2011).
Kebanyakan vaksin bakteri yang digunakan dalam budidaya sampai saat ini adalah vaksin yang dimatikan diperoleh dari kultur mikrobiologis strain tertentu hasil inaktifasi formalin (Toranzo et al., 2009). Formalin jika termakan dalam jangka pendek tidak menyebabkan keracunan, tetapi jika tertimbun di atas ambang batas dapat mengganggu kesehatan. International Proggrame on Chemical Safety menetapkan bahwa batas toleransi yang dapat diterima dalam tubuh maksimum 0,1 mg perliter (WHO, 2005). Formalin pada konsentrasi 250 ppm di perairan akan terdegradasi sempurna dalam waktu 72 jam (Chinabut et al., 1988; Xu & Rogers, 1995).
Penggunaan vaksin sebagai pencegahan suatu penyakit harus memperhatikan beberapa faktor antara lain kemurnian, keamanan, stabil serta efektif dan efisien (Sjamsudin, 1977; Sommerset et al., 2005). Vaksin yang ideal harus memenuhi beberapa persyaratan yang ditentukan antara lain imunogenik dan protektif, aman, stabil serta efektif dan efisien (Sommerset et al., 2005). Upaya penelitian yang luas dan strategi belum menghasilkan pengembangan vaksin yang aman dan efektif. Kondisi tersebut merupakan indikator lemahnya perhatian terhadap masalah kesehatan pada perikanan budidaya, dan akhir-akhir ini masalah tersebut telah menjadi issue global terutama terhadap produksi perikanan komoditas ekspor yang menuntut 4 sehat, yaitu: 1. sehat proses produksi, 2. sehat lingkungan budidaya, 3. sehat ikan, dan 4. sehat produk. Kunci untuk dapat memenuhi keempat kondisi tersebut adalah: penerapan program pengelolaan kesehatan ikan secara terintegrasi dan ramah lingkungan. Oleh karena itu, perlu dilakukan pengembangan dan pengkajian komponen-komponen teknologi pengelolaan kesehatan ikan yang modern, aplikatif, efektif dan efisien.
Vaksin bakteri dari sel utuh A. hydrophila yang diinaktivasi dengan formalin 0,3% (formalin killed) merupakan produk yang diharapkan menjadi salah satu aternatif untuk pencegahan penyakit MAS pada perikanan budidaya air tawar. Dengan demikian, ada kebutuhan khususnya di industri akuakultur, untuk mendapatkan vaksin selain berhasiat dalam pencegahan penyakit, juga aman setelah diaplikasikan baik untuk ikan, lingkungan dan konsumen. Informasi dan referensi tentang kajian bahan vaksin masih sangat terbatas. Adapun tujuan dari penelitian ini adalah untuk mengevaluasi keamanan vaksin bakteri A. hydrophila inaktif terhadap ikan, lingkungan dan aspek keamanan pangan. Sedangkan manfaat dari penelitian adalah diperoleh produk vaksin yang bermanfaat untuk pengelolaan kesehatan ikan secara terintegrasi dan ramah lingkungan.
BAHAN DAN METODE Pembuatan Vaksin
Tahapan pada proses pembuatan vaksin adalah sebagai berikut, bakteri A. hydrophila kode isolat AHL0905-2 dibiakkan pada media TSA, kemudian dipanen dan disuspensikan ke dalam NaCl 0,85% steril. Selanjutnya larutan diinaktivasi dengan formalin 0,3%. Sediaan vaksin disimpan pada suhu 4–
8oC. Sebelum digunakan vaksin diuji sterilitas dan viabilitasnya secara invivo.
Persiapan Ikan Uji
Ikan uji yang digunakan adalah ikan lele (Clarias sp.) dengan bobot rata-rata 10 gram/ekor sebagai “model” yang berasal dari populasi homogen dan diasumsikan specific pathogen free (SPF). Aklimatisasi ikan dipelihara dalam bak fiber, pemberian makan 3 x sehari. Penyifonan dan penggantian air baru untuk mempertahankan kualitas media pemeliharaan dilakukan sebanyak 5-10% dari total volume air.
Rancangan Percobaan
Rancangan percobaan yang digunakan dalam penelitian ini adalah rancangan acak lengkap. Kelompok perlakuan adalah kelompok pengujian keamanan vaksin dilakukan dengan melakukan vaksinasi ikan dengan metode aplikasi perendaman, aplikasi oral melaui pakan dan injeksi secara intra peritoneal. Kontrol adalah kelompok ikan yang tidak divaksin yang terdiri dari kontrol aplikasi perendaman, kontrol aplikasi oral dan kontrol injeksi dengan saline 0,85% secara intra peritoneal, setiap perlakuan diulang sebanyak 3 kali. Ikan yang digunakan adalah ikan lele sebagai ikan model sebanyak 30 ekor per akuarium.
Vaksinasi
Vaksinasi dilakukan pada ikan dengan tiga kelompok perlakuan yaitu perlakuan perendaman, oral melalui pakan dan injeksi. Aplikasi rendam, dosis pengenceran adalah 1 mL vaksin diencerkan dengan 10 L air bersih (10.000 x pengenceran). Ikan uji direndam dalam vaksin yang sudah diencerkan selama 30 menit. Pencampuran vaksin untuk aplikasi melalui pakan, dilakukan dengan cara menyemprotkan vaksin secara merata (3 mL/kg bobot ikan). Vaksin diencerkan terlebih dahulu supaya tersebar merata, kemudian dikeringanginkan. Ikan uji diberi pakan yang bervaksin selama 1 minggu.
Pemeliharaan selanjutnya ikan diberi pakan tanpa vaksin. Ikan kontrol diberi pakan tanpa vaksin. Perlakuan dengan metode penyuntikan dilakukan injeksi secara intra peritoneal (i.p.) dengan volume 0,1 mL. Pada perlakuan control, ikan diinjeksi dengan salin dengan volume yang sama.
Uji Tantang
Uji tantang dilakukan pada minggu ketiga pasca vaksinasi. Ikan uji diinfeksi secara buatan dengan
bakteri A. hydrophila melalui teknik penyuntikan secara IP pada dosis LD50 untuk semua kelompok
ikan perlakuan dan kontrol. Pemeliharaan ikan pasca uji tantang dilakukan selama 14 hari. Parameter Pengamatan
Potensi vaksin dievaluasi berdasarkan dua pendekatan, yaitu (1). nilai titer antibodi yang diukur dengan teknik direct agglutination test, dan (2). level proteksi relatif yang diukur melalui uji tantang
ikan uji terhadap patogen target pada dosis letal 50% (LD50).
Pengamatan terhadap tingkah laku, gejala klinis dan mortalitas ikan uji dilakukan setiap hari hingga akhir berlangsungnya proses uji tantang selama 14 hari. Pada periode uji tantang, dilakukan pula pengambilan sampel selektif terhadap individu yang menunjukkan tingkah laku dan/atau gejala klinis spesifik, minimal sebanyak satu ekor dari masing-masing kelompok perlakuan untuk diagnosa/ identifikasi patogen target.
Evaluasi Keamanan Vaksin
Evaluasi keamanan vaksin dilakukan dengan menghitung kematian ikan akut pasca vaksinasi selama 24 jam serta menghitung jumlah kematian pada periode induksi kekebalan selama pemeliharaan pasca vaksinasi (CEC 1998; EMA 2011). Selain itu dilakukan analisa formalin kuantitatif terhadap stok vaksin, vaksin yang diencerkan, pakan dan ikan setelah selesai masa pemeliharaan. Efektivitas vaksin dievaluasi berdasarkan uji tantang ikan uji terhadap patogen target pada level
LD50 kemudian dihitung nilai mortalitas kumulatif dan survival rate (SR) dan relative percent survival
(RPS).
Survival rate (SR) Effendie (1979)
SR dihitung dengan rumus:
di mana:
No = jumlah ikan pada saat awal pengujian Nt =jumlah ikan pada akhir pengujian
Relative percent survival (RPS) Ellis (1988):
HASIL DAN BAHASAN Ikan Uji
Berdasarkan hasil pemeriksaan secara mikrobiologis ikan uji sebelum digunakan terhadap keberadaan infeksi patogen target dan patogen golongan lainnya menunjukkan bahwa tidak ditemukan adanya infeksi patogen target (bakteri A. hydrophila) maupun patogen potensial dari golongan parasit, cendawan maupun bakteri lainnya. Sehingga dapat dikatakan bahwa secara umum populasi ikan uji dalam kondisi sehat dan memenuhi persyaratan sebagai ikan “SPF” serta siap untuk divaksinasi. 100% x No Nt SR 100 x kontrol ikan mortalitas % divaksin yang ikan mortalitas % 1 RPS
Sediaan vaksin yang dipakai merupakan sediaan cair yang dikemas ke dalam botol plastik yang berukuran 100 mL (Gambar 1A). Sebelum digunakan vaksin disimpan pada suhu dingin (refrigerator). Hasil pengujian sterilitas dan viabilitas diperoleh informasi bahwa tidak ada kontaminasi dari bakteri maupun jamur, serta tidak terjadi pertumbuhan kembali bakteri A. hydrophila (Gambar 1B).
Tingkah Laku dan Gejala Klinis
Pengamatan terhadap tingkah laku pada kelompok ikan uji yang divaksin dan ikan kontrol terlihat secara umum tingkah laku ikan dalam kondisi sehat dan normal. Selama masa inkubasi kekebalan terdapat ikan mati pada perlakuan vaksinasi injeksi dan vaksinasi melalui pakan dan kontrol dari masing-masing perlakuan tersebut. Kejadian kematian ikan pada perlakuan vaksin ini tidak terjadi sesaat setelah perlakuan vaksinasi, sehingga dapat dikatakan bahwa tidak terdapat kesalahan (hu-man error) pada saat perlakuan vaksinasi.
Uji tantang terhadap A. hydrophila dilakukan melalui teknik injeksi mulai hari ke-21 pasca vaksinasi. Hasil pengamatan tingkah laku ikan menunjukkan bahwa pada hari ke-1 pasca uji tantang terlihat beberapa ekor ikan yang menunjukkan tingkah laku abnormal seperti nafsu makan kurang, pergerakan lambat, lemah, berenang tidak terarah. Selain itu timbul peradangan dan terjadi kematian ikan baik pada kelompok perlakuan maupun kelompok kontrol (Gambar 2).
Pola kematian ikan lele yang terjadi pada masa induksi kekebalan dan kematian ikan setelah dilakukan uji tantang sangat berbeda. Pada masa induksi kekebalan kematian ikan terjadi tanpa adanya gejala klinis yang khas akibat infeksi pathogen. Tetapi, kematian ikan setelah perlakuan uji tantang didahului dengan adanya gejala klinis yang mengindikasikan adanya infeksi pathogen. Hasil isolasi dan karakterisasi bakteri dari ikan yang menunjukkan gejala klinis tersebut diperoleh data bahwa bakteri yang menginfeksi teridentifikasi sebagai bakteri A. hydrophila (Gambar 3).
Gambar 1. A. sediaan vaksin bakteri inaktif A. hydrophila dengan kemasan botol, b. Hasil uji sterilitas dan viabilitas sebelum vaksin diaplikasikan
Gambar 2. Gejala klinis ikan lele dumbo terserang A. hydrophila saat uji tantang terjadi peradangan pada tubuh ikan
Pola gejala klinis yang terjadi pada ikan setelah perlakuan uji tantang sesuai dengan pernyataan Kabata (1985) bahwa nafsu makan ikan akan berkurang disertai dengan tingkah laku abnormal merupakan tanda-tanda ikan terserang penyakit akibat infeksi A. hydrophila. Selanjutnya bisa terjadi kerusakan jaringan yang ditandai dengan adanya luka infeksi dan terjadi borok (Gambar 2). Kerusakan jaringan pada tubuh ikan diduga akibat adanya toksin yang dikeluarkan A. hydrophila yang terbawa oleh aliran darah ke seluruh tubuh. Aoki (1999) mengemukakan bahwa toksin yang dikeluarkan A. hydrophila akan menyebar ke seluruh tubuh melalui aliran darah sehingga menyebabkan haemolisis atau pecahnya pembuluh darah yang mengakibatkan warna kemerahan (bercak merah) pada tubuh ikan.
Efektivitas dan Evaluasi Keamanan Vaksin
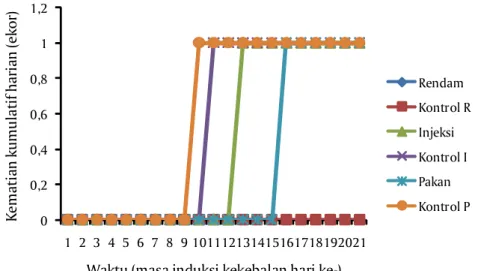
Evaluasi keamanan produk vaksin dilakukan dengan pengamatan kematian ikan akut pada 24 jam pasca vaksinasi dan selama pemeliharaan pada periode induksi kekebalan pasca vaksinasi. Hasil pengamatan mortalitas harian selama pengujian keamanan vaksin disajikan pada Gambar 4.
Gambar 4 menunjukkan bahwa tidak terjadi kematian akut pada ikan uji pada 24 jam pasca vaksinasi pada semua kelompok perlakuan dan kelompok kontrol. Sedangkan selama masa induksi kekebalan sebelum uji tantang, tidak terdapat kematian ikan pada kelompok perlakuan vaksinasi rendam dan kontrol. Kematian terjadi pada perlakuan injeksi dan pakan serta kontrolnya masing-masing 1 ekor. Kematian yang terjadi pada periode induksi kekebalan ini tanpa adanya gejala klinis yang menyertainya. Hasil observasi patologi anatomis tidak ada kelainan baik eksternal maupun internal. Tetapi hasil isolasi bakteri dari semua sampel ikan yang mati tersebut diperoleh bakteri
Gambar 3. Hasil isolasi bakteri (a) dan pewarnaan gram bakteri A. hydrophila (b) 0 0,2 0,4 0,6 0,8 1 1,2 1 2 3 4 5 6 7 8 9 101112131415161718192021 K em at ian k u m u la ti f h ar ian (e ko r)
Waktu (masa induksi kekebalan hari ke-)
Rendam Kontrol R Injeksi Kontrol I Pakan Kontrol P
yang teridentifikasi sebagai A. hydrophila. Berdasarkan petunjuk prosedur pengujian kualitas vaksin ikan (CEC, 1998; EMA, 2011), suatu vaksin dinyatakan aman apabila selama masa induksi kekebalan hanya 1 ekor ikan yang mati dari populasi 30 ekor ikan. Hal ini untuk memastikan bahwa tidak ada pengaruh negatif dari bahan-bahan yang terdapat dalam sediaan vaksin.
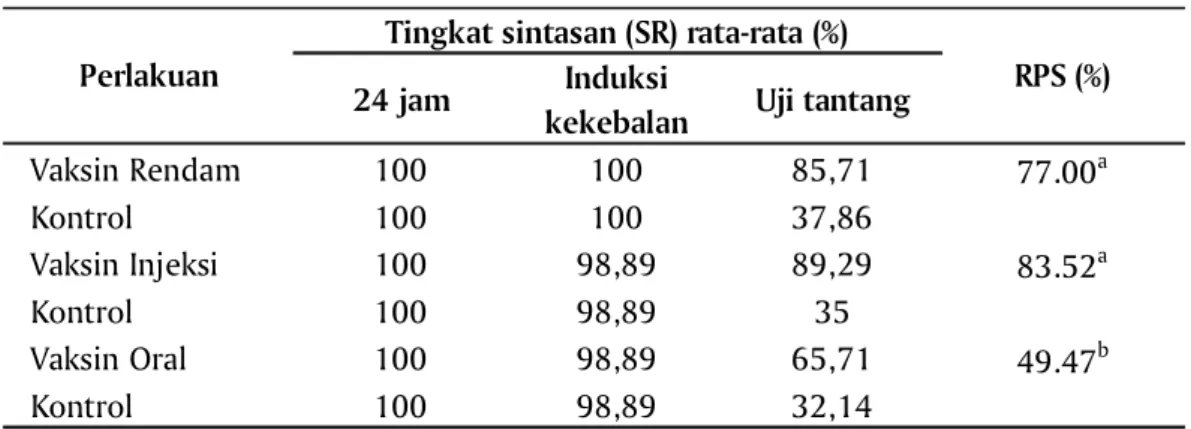
Selain pengamatan terhadap mortalitas akut, pengujian terhadap keamanan vaksin juga dievaluasi dari tingkat sintasan ikan yang divaksin dalam rentang waktu 24 jam pasca vaksinasi, selama masa pemeliharaan pada periode induksi kekebalan dan setelah dilakukan uji tantang. Hasil efektifitas pengujian keamanan vaksin pada ikan disajikan dari nilai tingkat sintasan rata-rata (SR) dan relative percent survival (RPS) pada Tabel 1.
Tabel 1 memperlihatkan bahwa pada 24 jam pasca vaksinasi SR rata-rata baik ikan yang divaksin maupun kontrol untuk semua perlakuan sebesar 100%. Sedangkan SR rata-rata selama masa induksi kekebalan sebelum uji tantang nilainya 100% untuk aplikasi perendaman dan masing-masing 98.89% untuk aplikasi pakan dan injeksi. Dari tabel tersebut diketahui bahwa sediaan vaksin aman untuk diaplikasikan. Sedangkan pada masa induksi terlihat bahwa aplikasi dengan perendaman menghasilkan nilai SR rata-rata paling tinggi yaitu 100% dibandingkan dengan kelompok yang divaksin dengan aplikasi pakan dan injeksi masing-masing 98.89%. Dari data tersebut diketahui bahwa nilai SR yang dihasilkan telah memenuhi nilai yang disyaratkan untuk pengujian keamanan produk vaksin untuk setiap aplikasi dengan berbagai teknik aplikasi (CEC, 1998; EMA, 2011).
Selain menunjukkan evaluasi keamanan, dari Tabel 1 juga menyatakan bahwa efektivitas vaksinasi dengan metode aplikasi injeksi intra peritoneal mempunyai nilai SR paling tinggi yaitu sebesar 89,29% dibandingkan kelompok vaksinasi dengan metode perendaman dan oral. Dan kelompok ikan yang divaksin menghasilkan SR lebih tinggi dibandingkan kelompok kontrol untuk semua perlakuan. Demikian juga untuk data RPS paling tinggi diperoleh dari perlakuan vaksinasi dengan metode injeksi sebesar 83,52%. Hasil perlakuan injeksi tidak berbeda nyata dengan perlakuan perendaman dengan nilai RPS sebesar 77,00%. Sedangkan nilai RPS terrendah diperoleh dari perlakuan vaksinasi dengan metode oral melalui pakan dan nilai ini berbeda nyata secara statistik baik dengan perlakuan injeksi maupun perendaman dengan nilai sebesar 49,47%.
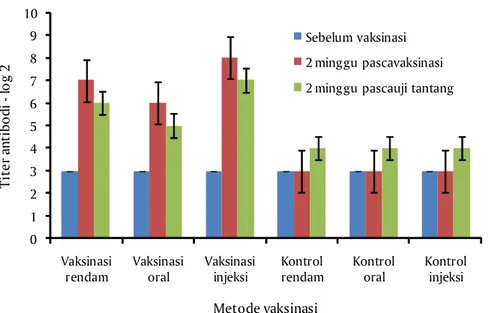
Indikator lain untuk mengetahui efektivitas vaksin dengan mengetahui level proteksi ikan yang telah divaksin. Level proteksi dievaluasi dengan menghitung nilai titer antibodi ikan untuk setiap perlakuan. Hasil pengukuran titer antibodi pengujian keamanan vaksin terlihat pada Gambar 5.
Gambar 5 memperlihatkan bahwa vaksinasi pada ikan telah menghasilkan nilai titer yang lebih tinggi pada semua perlakuan dibandingkan kelompok ikan yang tidak divaksin. Sedangkan rata-rata titer tertinggi terdapat pada kelompok yang divaksin dengan cara Injeksi, kemudia perendaman dan terakhir dengan metode oral melalui pakan. Hasil riset ini seperti yang pernah dilakukan oleh Andriani (2009) bahwa pemberian vaksin suspensi sel A. hydrophila dapat memberikan respon imun spesifik yang lebih baik. Silva et al. (2009) menyatakan bahwa perbedaan rute aplikasi vaksin telah menstimulasi respon imun dan meningkatkan nilai titer antibodi pada ikan nila.
Tabel 1 Sintasan (SR) pada pengujian keamanan vaksin
24 jam Induksi
kekebalan Uji tantang
Vaksin Rendam 100 100 85,71 77.00a Kontrol 100 100 37,86 Vaksin Injeksi 100 98,89 89,29 83.52a Kontrol 100 98,89 35 Vaksin Oral 100 98,89 65,71 49.47b Kontrol 100 98,89 32,14
Angka yang diikuti huruf yang sama memberikan pengaruh yang tidak berbeda menurut uji BNT pada taraf 5%
Perlakuan
Tingkat sintasan (SR) rata-rata (%)
Hasil analisa kadar formalin kuantitatif yang dilakukan terhadap vaksin stok, vaksin yang diencerkan sesuai dosis, pakan dan ikan disajikan pada Tabel 2.
Tabel 2 memperlihatkan hasil pengujian formalin kuantitaif pada sediaan vaksin stok residu for-malin yang terdeteksi sebesar 703,4 ppm. Residu forfor-malin tidak terdeteksi pada sampel lainnya yaitu ikan, vaksin yang diencerkan, pakan dan media budidaya dengan limit deteksi alat sebesar 0,429 ppm.
Vaksin bakteri yang beredar dan digunakan dalam budidaya sampai saat ini kebanyakan vaksin inaktif. Sediaan vaksin diperoleh dari kultur mikrobiologis strain tertentu kemudian diinaktifasi meggunakan formalin (Toranzo et al., 2009). Meskipun merupakan vaksin inaktif, tetapi vaksin yang diinaktifasi dengan formalin tidak menjadi toksik dan mampu memproteksi ikan dari bakteri patho-gen setelah dilakukan uji tantang. Jung et al. (2001) melakukan penelitian menpatho-genai residu formaldehid 37% pada urat daging ikan olive flounder (Paralitichuys olivaceus) dan black rockfish (Sebastes schlegeli) dengan perlakuan perendaman. Residu formaldehid dalam urat daging dapat luruh hingga konsentrasi yang setara dengan normal (kontrol) setelah 72 jam. Sedangkan residu formaldehid pada air pemeliharaan dengan perlakuan 200 mg/L luruh pada waktu 19 hari tanpa aerasi dan tanpa ganti air.
Gambar 5. Grafik nilai titer antibodi pengujian keamanan vaksin
0 1 2 3 4 5 6 7 8 9 10 Vaksinasi rendam Vaksinasi oral Vaksinasi injeksi Kontrol rendam Kontrol oral Kontrol injeksi T it e r an ti b o d i -lo g 2 Metode vaksinasi Sebelum vaksinasi 2 minggu pascavaksinasi 2 minggu pascauji tantang
Tabel 2. Hasil analisa formalin kuantitatif pada ikan yang divaksin dan media budidayanya
No Jenis sampel Formalin kuantitatif
(ppm)
1 Vaksin stok 703,4
2 Vaksin yang diencerkan -*
3 Pakan -*
4 Ikan (vaksinasi rendam) -*
5 Ikan (vaksinasi oral) -*
6 Ikan (vaksinasi injeksi) -*
7 Ikan (kontrol) -*
8 Media budidaya -*
Berdasarkan data-data yang disajikan diatas diketahui bahwa vaksin bakteri A. hydrophila yang diinaktifasi menggunakan formaldehide 0,3 % telah memenuhi standar prosedur operasional yang berlaku untuk produksi vaksin. Hal ini terlihat bahwa vaksin dalam kondisi steril dengan tidak terjadi pertumbuhan kembali bakteri dan tidak terdapat kontaminan lain selama masa pengujian, imunogenik dan protektif berdasarkan nilai titer dan SR rata-rata dari ikan yang divaksin. Selain itu, vaksin dapat dinyatakan aman berdasarkan dari nilai mortalitas yang sangat rendah pada ikan yang divaksin selama masa induksi kekebalan. Vaksin yang ideal harus memenuhi beberapa persyaratan yang ditentukan antara lain imunogenik dan protektif, aman, stabil serta efektif dan efisien (Sommerset et al., 2005). Hasil tersebut menunjukkan bahwa proses produksi vaksin tersebut telah memenuhi standar produksi vaksin (CEC, 1998; Alderman, 2009; EMA, 2011).
Berdasarkan informasi di atas diketahui bahwa vaksin tersebut selain bermanfaat dalam menurunkan risiko kematian ikan karena infeksi bakteri A. hydrophila, juga aman bagi lingkungan dan konsumen. Hal ini terlihat dari hasil pengujian formalin kuantitatif tidak terdeteksi residu for-malin baik pada vaksin yang diencerkan, pakan, ikan yang divaksin, maupun media budidayanya. Formalin jika termakan dalam jangka pendek tidak menyebabkan keracunan, tetapi jika tertimbun di atas ambang batas dapat mengganggu kesehatan. International Programe on Chemical Safety menetapkan bahwa batas toleransi yang dapat diterima dalam tubuh maksimum 0,1 mg perliter (WHO 2005). Formalin pada konsentrasi 250 ppm di perairan akan terdegradasi sempurna dalam waktu 72 jam (Chinabut et al., 1988; Xu & Rogers, 1995). Formaldehid yang dipakai untuk membuat bahan buffer formaldehid merupakan bahan kimia yang umum digunakan dalam proses inaktifasi sediaan vaksin. Fungsi formaldehid adalah untuk menstabilkan komponen protein atau untuk inaktifasi molekul toksin dari bakteri (Sato et al., 1984). Evaluasi yang diperoleh dari seluruh pengujian keamanan vaksin ini dapat menyatakan bahwa produk vaksin yang dihasilkan telah memenuhi syarat 4 sehat, yaitu: 1. sehat proses produksi, 2. sehat lingkungan budidaya, 3. sehat ikan, dan 4. sehat produk.
Vaksinasi pada perikanan budidaya telah terbukti memberi kontribusi yang sangat signifikan terhadap peningkatan produksi perikanan budidaya. Di Indonesia, program vaksinasi menjadi salah satu solusi terhadap adanya larangan penggunaan antibiotik dalam proses budidaya ikan. Akan tetapi, vaksinasi hanya merupakan salah satu alternatif yang ditawarkan. Adanya dukungan dan praktek berbudidaya ikan yang baik akan lebih meningkatkan produktivitas akuakultur secara nyata. Ketersediaan vaksin murni, aman, stabil, ampuh, dan efektif sangat penting untuk pemeliharaan kesehatan ikan dan keberhasilan budidaya ikan. Vaksinasi ikan dengan vaksin berkualitas tinggi merupakan cara utama pengendalian beberapa jenis penyakit ikan. Tetapi, kunci untuk dapat memenuhi keempat kondisi tersebut adalah: penerapan program pengelolaan kesehatan ikan secara terintegrasi dan ramah lingkungan.
KESIMPULAN
Berdasarkan hasil penelitian dapat disimpulkan bahwa vaksin bakteri A. hydrophila yang diinaktivasi dengan formalin 0,3% merupakan vaksin bakteri inaktif yang aman bagi ikan karena nilai mortalitas pada pengujian tidak melebihi dari nilai standar yang diperbolehkan untuk pengujian vaksin ikan. Selain itu, ikan yang divaksin aman jika dikonsumsi dan tidak mencemari lingkungan budidaya berdasarkan hasil analisa formalin kuantitatif pada ikan yang divaksin, pakan dan media budidayanya tidak terdeteksi adanya residu formalin.
UCAPAN TERIMA KASIH
Pada kesempatan ini perkenankanlah penulis mengucapkan terima kasih yang tak terhingga kepada Kepala Balai Penelitian dan Pengembangan Budidaya Air Tawar dan seluruh staff sehingga terlaksananya penelitian ini.
DAFTAR ACUAN
Alderman D J. 2009. Control of the use of veterinary drugs and vaccines in aquaculture in the Euro-pean Union. Options Méditerranéennes, A / no. 86,13 – 28.
Imunitas Ikan Nila (Oreochromis niloticus, Lin) Setelah Vaksinasi dan Booster Melalui Metode Suntik. Skripsi, Program Studi Sarjana Mikrobiologi, Sekolah Ilmu dan Teknologi Hayati (SITH). ITB. Aoki. 1999. Motile Aeromons (Aeromonas spp). J. Laboratory of Genetic and Biochemistry, 11:427 – 435. Austin B, Austin DA. 1999. Chapter 2 - Characteristics of the diseases. In Bacterial Pathogens: Diseases
of Farmed and Wild Fish. pp 13-15.
Commission of the European Communities (CEC). 1998. Specific requirements for the production and kontrol of live and inactivated vaccines intended for fish. In: The Rules Governing Medicinal Products in the European Union, Guidelines for the testing of veterinary medicinal products Volume VII, pp 245-250. Office for Official Publications of the European Communities, Luxembourg. Available at: http:/ /ec.europa.eu/enterprise/pharmaceuticals/eudralex/eudralex_en.htm
Chinabut S, Limsuwam C, Sangjan M. 1988. Formalin: its toxicity to Aeromonas hydrophila, planktons and degradation. Fisheries and Aquaculture Department, FAO. 24p
Dwiranti A. 2008. Pembuatan vaksin A. hydrophila dengan penambahan formalin 3% dan penentuan pengaruh konsentrasi vaksin dalam meningkatkan kekebalan spesifik ikan nila (Oreochromis niloticus, Lac) dengan metode vaksinasi perendaman. Skripsi Program Studi Mikrobiologi Sekolah Ilmu dan Teknologi Hayati Institut Teknologi Bandung. 75 p
Ebanks RO, Dacanay A, Goguen M, Pinto DM. Ross NW. 2004. Differential proteomic analysis of Aeromonas salmonicida outer membraneproteins in response to low iron and in vivo growth condi-tions. Proteomics 4, 1074-1085.
Effendie MI. 1979. Metode Biologi Perikanan. Gramedia Pustaka Utama, Jakarta.
Ellis AE. 1988. General principles of fish vaccination. In: Ellis A-E (ed) Fish Vaccination. Academic Press. London. hlm 1-19.
Ellis AE, do-Vale A, Bowden TJ, Thompson K, Hastings TS. 1997. In vivo production of A-protein, lipopolysaccharide, iron-regulated outer membrane proteins and 70-kDa serine protease by Aeromonas salmonicida subsp. salmonicida. FEMS Microbiology Letters 149, 157-163.
European Medicines Agency (EMA). 2011. Guideline on the design of studies to evaluate the safety and efficacy of fish vaccines. http://www.ema.europa.eu/docs/en_GB/document_librar y/ Scientific_guideline/2011/11/WC500118226.pdf. 6 Desember 2011
Hadi W, Lusiastuti AM, Sularto, Tahapari E. 2010a. Imunitas maternal terhadap A. hydrophila: pengaruh
terhadap fekunditas dan daya tetas ikan patin siam (Pangasius hypopthalmus). Journal Riset Akuakultur Vol. 5 No. 2 Agustus 2010 : 229 -235
Hadi W, Emmawati W, Lusiastuti AM. 2010b. Peningkatan produksi benih ikan patin di unit pembenihan
rakyat (UPR) melalui penerapan kekebalan bawaan (maternal immunity). Forum Inovasi Teknologi Akuakultur 2010. Buku 2: 957-961
Jung SH, Kim JW, Jeon IG, Lee YH. 2001. Formaldehyde residues in formaldehid-treated olive flounder Paralichthys olifaceus, black rockfish Sebastes schlegeli, and seawater. Aquaculture 194: 253–262. Kamiso dan Triyanto. 1990. Sistem Pertahanan dan Diagnosis Serologi Penyakit Ikan. BLPP Ciawi.
Bogor. 29 p
Lusiastuti AM, Hadi W. 2010. Penggunaan vaksin Aeromonas hydrophila: Pengaruhnya terhadap sintasan dan imunitas larva ikan patin IPangasidoon hypophthalmus). Berita Biologi 10 (2) Agustus 2010: 151 – 158.
Olivier G, Lallier R, Lariviere S. 1981. A toxigenic profile of Aeromonas hydrophila and Aeromonas sobria isolated from fish. Canadian Journal of Microbiology 27, 330-333.
Potter AA, Babiuk LA. 2001. New Approaches for Antigen Discovery, Production and Delivery: Vac-cines for Veterinary and Human Use. Current Drug Targets - Infectious Disorders 1, 249-262.
Rahman MH, Kawai K. 2000. Outer membrane proteins of Aeromonas hydrophila induce protective immunity in goldfish. Fish & Shellfish Immunology 10, 379-382.
Sato Y, Kimura M, Fukumi H. 1984. Development of a pertussis component vaccine in Japan. Lanceti hlm 122-126.
Shotts EB, Gaines JL, Martin L. and Prestwood A.K. 1972. Aeromonas induced deaths among fish and reptiles in an eutrophic inlands lake. Journal of the American Veterinary Medical Association 161,
603-607.
Silva BC, Martins ML, Jatobá A, Buglione Neto CC, Vieira FN, Pereira GV, Jerônimo GT, Seiffert WQ, Mouriño JLP. 2009. Hematological and immunological responses of Nile tilapia after polyvalent vaccine administration by different routes. Pesquisa Veterinária Brasileira 29(11):874-880
Sommerset I, Krossoy B, Biering E, Frost P. 2005. Vaccines for fish in aquaculture. Vaccines 4(1): 89 – 101.
Sugiani D, Komarudin O. 2011. Uji efektifitas sediaan produk vaksin HydroVac terhadap pengulangan aplikasi rendaman. Prosiding Seminar Nasional Ikan VI & Kongres Masyarakat Ikhtiologi Indonesia III: 151 – 159.
Supriyadi H, Rukyani A. 1990. Immunopropilaksis dengan cara vaksinasi pada usaha budidaya ikan. Seminar Nasional Ke II Penyakit Ikan dan Udang. Bogor 16-18 Januari 1990, 7 p
Supriyadi H,, Taufik P. 1981. Identifikasi dan Cara Penanggulangan Penyakit Bacterial pada Ikan Lele (Clarias batrachus), Bogor, Bull. Penel. Perik. 1(3): 447-454.
Supriyadi H, Taukhid, Moekti G. 1997. Upaya produksi dan karakterisasi hibridoma untuk penanggulangan bakteri penyakit pada ikan: I. Pembentukan hibridoma penghasil antibodi monoklonal anti Aeromonas hydrophila.Jurnal Bioteknologi Pertanian, Vol. 2(1):9-13.
Supriyadi H, Widiyati A, Sunarto A, Prihadi TH. 2005. Keragaan penyakit bakterial ikan nila (Oreochromis niloticus) pada keramba jaring apung (KJA) di lokasi berbeda. Jurnal penelitian kelapa sawit. 11 (7): 35 – 45.
Sjamsudin A. 1977. Bulletin Lembaga Penelitian Penyakit hewan No.14. Surabaya.
Taufik P. 1982. Penyakit pada ikan Gurame (Osphronemus gouramy) dan penanggulangannya. Makalah pada Pertemuan Aplikasi Teknologi Ikan Gurame. 24-26 Agustus 1992, Jogyakarta 6 pp.
Toranzo AE, Romalde JL, Magarinos B, Barja JL. 2009. Present and future of aquaculture vaccines against fish bacterial diseases. The use of veterinary drugs and vaccines in Mediterranean aquac-ulture. Options Mediterraneennes A 86: 155 – 176.
World Health Organization (WHO). 2005. Modern food biotechnology, human health and develop-ment: an evidence-based study. http://www.who.int/foodsafety/publications/biotech/biotech_en.pdf. 6 December 2011.
Xu D, Rogers WA. 1995. Formaldehyde residue in the muscle of nile tilapia. Asian Fisheries Sci. 8: 81 – 88.
Yuasa K, Panigoro N, Bahnan M, Barkat E. 2002. Panduan Diagnosa Penyakit Ikan. BBAT Jambi. DKP. 76p
DISKUSI
Nama Penanya: Muliani Pertanyaan:
Bagaimana cara mengetahui populasi patogen/bakteri vaksin? Tanggapan:
Telah ditetapkan standard baku dalam produksi vaksin Aeromonas hydrophila yaitu kultur 2,0 mikron per petri media kultur TSA. Panen 3 petri ke 100 ml pelarut PBS akan diperoleh populasi