ISOLASI DAN PENCIRIAN XILANASE DARI BAKTERI
ASAL TANAH HUTAN TAMAN NASIONAL BUKIT
DUABELAS, JAMBI, INDONESIA
KURRATAA’YUN
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2013
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Isolasi dan Pencirian Xilanase dari Bakteri Asal Tanah Hutan Taman Nasional Bukit Duabelas, Jambi, Indonesia adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juni 2013 Kurrataa’yun NIM G34090105
ABSTRAK
KURRATAA’YUN. Isolasi dan Pencirian Xilanase dari Bakteri asal Tanah Hutan Taman Nasional Bukit Duabelas, Jambi, Indonesia. Dibimbing oleh ANJA MERYANDINI and YOPI.
Xilanase merupakan enzim pendegradasi xilan yang berguna dalam penyempurnaan biokonversi biomassa lignoselulosa menjadi produk bermanfaat. Aplikasi xilanase yang luas belum dioptimalkan karena kurang tersedianya mikroba unggul. Penelitian ini bertujuan untuk mengisolasi bakteri asal tanah hutan Taman Nasional Bukit Duabelas, Jambi dan mencirikan xilanasenya yang meliputi parameter pH optimum, suhu optimum, serta stabilitasnya. Sebanyak 28 isolat potensial telah berhasil diisolasi dari tanah hutan Taman Nasional Bukit Duabelas, Jambi dan tiga di antaranya berhasil dicirikan xilanasenya (isolat 10, 18, dan 27). Isolat 10 memproduksi xilanase ekstraseluler tertinggi pada jam 12 dan jam ke-36 inkubasi kultur dengan aktivitas optimum pada pH 6 di suhu 40 oC dan 90 oC. Waktu produksi xilanase tertinggi isolat 27 tercapai pada jam ke-12 dan jam ke-30 inkubasi kultur. Kondisi optimum xilanase isolat 27 terjadi pada pH 5 di suhu 90 oC dan 50 oC, sementara xilanase isolat 18 mencapai waktu optimum produksi pada jam ke-18 dan jam ke-36 inkubasi kultur. Kondisi optimum xilanase isolat 18 tercapai pada pH 5 dan suhu 90 oC. Enzim isolat 18 memiliki waktu paruh 1 jam 7 menit pada pH dan suhu optimumnya.
Kata kunci: Xilanolitik, Xilanase, Taman Nasional Bukit Duabelas, Jambi
ABSTRACT
KURRATAA’YUN. Isolation and Characterization Xylanase from Bacterial Origin Bukit Duabelas National Park Forest Soil, Jambi, Indonesia. Supervised by ANJA MERYANDINI and YOPI.
Xylanase is a xylan-degrading enzymes which are useful to improving the bioconversion of lignocellulosic biomass into useful products. Broad application of xylanase have not optimized due to the lack of superior microbes. The aim of this study is to isolate bacterial origin Bukit Duabelas National Park, Jambi and characterize its xylanase, including its pH optimum, temperature optimum, and stability. A total of 28 potential isolates have been isolated from Bukit Duabelas National Park soil, Jambi and three were successfully characterized its xilanase (isolates 10, 18, and 27). Isolate 10 reached the highest producing extracellular xylanase at 12th and 36th hours of culture incubation with optimum activity at pH 6, temperature 40 °C and 90 oC. Isolate 27 reached its highest producing extracellular xylanase at 12th and 30th hours of culture incubation. The optimum condition of xylanase isolate 27 occurred at pH 5, temperature 90 oC and 50 oC, while xylanase isolate 18 achieve its optimum production time at the 18th and 36th hours of incubation culture. Xylanase isolate 18 achieved its optimum condition at pH 5 and temperature 90 oC and has half-life time 1 hour 7 minutes.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biologi
ISOLASI DAN KARAKTERISASI XILANASE DARI BAKTERI
ASAL TANAH HUTAN TAMAN NASIONAL BUKIT
DUABELAS, JAMBI, INDONESIA
KURRATAA’YUN
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2013
Judul Skripsi : Isolasi dan Pencirian Xilanase dari Bakteri Asal Tanah Hutan Taman Nasional Bukit Duabelas, Jambi, Indonesia
Nama : Kurrataa’yun
NIM : G34090105
Disetujui oleh
Prof Dr Anja Meryandini, MS Pembimbing I
Dr Yopi Pembimbing II
Diketahui oleh
Dr Ir Ence Darmo Jaya Supena, M.Si Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Karya ilmiah ini merupakan salah satu persyaratan untuk memperoleh gelar Sarjana Sains di Departemen Biologi IPB. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Desember 2012 hingga Maret 2013 ini ialah enzim, dengan judul Isolasi dan Pencirian Xilanase dari Bakteri Asal Tanah Hutan Taman Nasional Bukit Duabelas Jambi, Indonesia.
Terima kasih yang mendalam penulis ucapkan kepada Prof Dr Anja Meryandini, MS dan Dr Yopi selaku pembimbing atas bimbingan, ilmu pengetahuan, saran, serta kesabarannya selama penyusunan karya ilmiah. Terima kasih pula penulis sampaikan kepada Dr. Achmad Farajallah yang telah menjadi penguji sidang serta pemberi saran dalam penyusunan karya ilmiah ini. Penghargaan penulis sampaikan kepada Ibu Dewi sebagai laboran Bioteknologi Hewan dan Biomedis Pusat Antar Universitas, PPSHB dan Ibu Fitri yang telah banyak membantu dalam proses penelitian secara teknik maupun teori.
Ucapan terima kasih juga penulis sampaikan kepada teman seperjuangan, serta rekan kerja di laboratorium Bioteknologi Hewan dan Biomedis (Bu Marini, Wini, Endah, Meita, Dewi, Saleem, Mba Debbi, Kak Deddy, dan Bu Elly) yang telah banyak membantu dan menenemani selama proses penelitian; Ikra Nugraha atas semangat dan dukungannya; serta keluarga Biologi 46 atas kebersamaannya.
Ungkapan terima kasih terbesar penulis sampaikan kepada ayah, ibu atas do’a, kasih sayang, dan dukungannya hingga penulis dapat menyelesaikan studi strata satu ini dengan baik. Tidak lupa terima kasih kepada abang Man, Dela, dan Putri serta seluruh keluarga yang telah menghibur serta menemani penulis selama melaksanakan penelitian. Akhir kata, penulis berharap karya ilmiah ini bermanfaat untuk dunia sains dan pendidikan ke depannya.
Bogor, Juni 2013 Kurrataa’yun
DAFTAR ISI
DAFTAR TABEL vi DAFTAR GAMBAR vi DAFTAR LAMPIRAN vi PENDAHULUAN 1 Latar Belakang 1 Perumusan Masalah 2 Tujuan Penelitian 2 Manfaat Penelitian 2 METODE 2 Bahan 2 Alat 2Prosedur Analisis Data 3
HASIL DAN PEMBAHASAN 4
Hasil 4
Pembahasan 9
SIMPULAN DAN SARAN 12
Simpulan 12
Saran 12
DAFTAR PUSTAKA 12
LAMPIRAN 15
DAFTAR TABEL
1 pH tanah sampel tanah hutan primer TNBD, Jambi 4 2 Gula pereduksi, total gula, dan derajat polimerisasi isolat 18 9
DAFTAR GAMBAR
1 Kemampuan xilanase Isolat 10, 18, dan 27 5
2 Morfologi dan jenis Gram isolat 10, 18, dan 27 5 3 Aktivitas xilanase dan pertumbuhan Isolat 10 6 4 Aktivitas xilanase dan pertumbuhan Isolat 18 6 5 Aktivitas xilanase dan pertumbuhan Isolat 27 6 6 Pengaruh pH terhadap aktivitas enzim Isolat 10, 18, dan 18 7 7 Pengaruh suhu terhadap aktivitas enzim Isolat 10, 18, dan 27 8 8 Stabilitas xilanase Isolat 18 pada suhu 4oC, 27oC, 50oC, dan 90oC 8
DAFTAR LAMPIRAN
1. Komposisi media agar dan media produksi xilan 15 2. Komposisi reagen Dinitrosalicylic acid (DNS) 15
PENDAHULUAN
Latar Belakang
Peningkatan produksi di bidang pertanian dan industri pertanian menyebabkan peningkatan limbah yang sebagian besar merupakan limbah berlignoselulosa seperti jerami, tongkol jagung, sabut, serta tandan kosong kelapa sawit. Limbah yang dihasilkan dapat menjadi bahan pencemar lingkungan apabila tidak ditangani. Salah satu komponen utama penyusun limbah berlignoselulosa tersebut adalah xilan. Xilan merupakan komponen utama hemiselulosa dalam dinding sel tanaman, yang memiliki kerangka dasar residu 1,4-D-xilopiranosil yang rantai sampingnya tersubstitusi dengan gugus asetil, 4-O-metil-D-glukuronosil dan -arabinofuranosil. Degradasi sempurna xilan merupakan proses banyak tahap yang melibatkan aktivitas
beberapa enzim hidrolitik yang bekerja secara sinergis, yaitu (1) endo-1,4- -xilanase, (2) 1,4- -D-xilosidase, (3) -L-arabinofuranosidase,
-glukuronidase dan asetil esterase (Yang et al. 2006). Xilanase mendapat banyak perhatian dari kalangan peneliti dan industri karena peranannya dalam penyempurnaan biokonversi biomassa lignoselulosa menjadi produk-produk yang bermanfaat. Salah satu upaya pemanfaatan limbah pertanian dapat dilakukan dengan mengkonversinya ke dalam bentuk yang lebih sederhana yaitu dengan cara menghidrolisisnya.
Aplikasi xilanase secara komersial telah digunakan dalam industri makanan dan pemanfaatan limbah pertanian untuk produksi xilosa. Xilosa adalah gula rendah kalori yang dapat dikonsumsi penderita diabetes (Richana et al. 2000). Xilanase dapat menggantikan klorin yang digunakan dalam proses pemutihan bubur kertas pada industri kertas (Ruiz-Arribas et al. 1995). Selain itu xilanase telah diketahui dapat meningkatkan daya pembersih pada deterjen (Kumar et al. 2004); mengurangi viskositas saluran pencernaan ternak sehingga meningkatkan pencapaian berat dan efisiensi konversi makanannya (Adeola dan Bedford 2004); serta meningkatkan kekuatan kertas pada kelembaban tinggi (Wong et al. 1988).
Luasnya aplikasi kegunaan xilanase masih belum dioptimalkan secara maksimal. Salah satu kendala yang muncul yaitu kurang tersedianya biakan mikroba unggul. Banyak pakar dari negara maju mengakui bahwa negara yang kaya akan keanekaragaman hayatinya merupakan sumber mikroba potensial untuk bioproses (Richana et al. 2000). Indonesia merupakan salah satu negara yang memiliki keanekaragaman hayati yang tinggi, sehingga potensi mikrobanya sangat besar untuk terus dieksplorasi dan diteliti. Taman Nasional Bukit Duabelas (TNBD), Jambi merupakan salah satu daerah hutan hujan tropika dataran rendah yang masih asri dan belum terkena intervensi manusia. Biodiversitas flora dan fauna endemiknya yang cukup tinggi berpotensi sebagai habitat xilanolitik yang beragam dan unik. Selain itu, publikasi mengenai xilanolitik di daerah tersebut belum ada, sehingga eksplorasi xilanolitik di daerah tersebut sangat menarik untuk dilakukan. Oleh karena itu, penelitian ini bertujuan untuk mengisolasi bakteri asal tanah hutan
2
TNBD, Jambi dan mencirikan xilanasenya. Parameter pencirian enzimnya meliputi pH optimum, suhu optimum, serta stabilitasnya.
Perumusan Masalah
Aplikasi xilanase yang luas membutuhkan enzim xilanase yang beragam, sehingga dibutuhkan eksplorasi xilanolitik. Eksplorasi xilanolitik di Taman Nasional Bukit Duabelas belum pernah dilaporkan dan berpotensi menghasilkan isolat xilanolitik serta xilanase yang beragam..
Tujuan Penelitian
Penelitian ini bertujuan untuk mengisolasi bakteri xilanolitik asal tanah hutan Taman Nasional Bukit Duabelas, Jambi dan mengkarakterisasi xilanasenya. Parameter xilanase yang diteliti meliputi pH optimum, suhu optimum, serta stabilitasnya.
Manfaat Penelitian
Penelitian ini diharapkan mendapatkan isolat xilanolitik dan keragaman enzim xilanasenya.
METODE
Penelitian ini dilaksanakan pada bulan Desember 2012 – Maret 2013 di Laboratorium Bioteknologi Hewan dan Biomedis, PPSHB IPB dan Laboratorium Mikrobiologi Departemen Biologi, FMIPA, IPB.
Bahan
Bahan yang digunakan dalam penelitian ini meliputi sampel tanah hutan primer Jambi dari tiga plot (BF1, BF3, dan BF4); substrat xilan (Sigma Chemical Co.); Baktopepton; ekstrak khamir; MgSO4; K2HPO4; larutan DNS; dan larutan fenol 5%. Sumber isolat berasal dari bakteri yang diisolasi dari sampel tanah hutan Taman Nasional Bukit Duabelas Jambi.
Alat
Alat utama yang digunakan dalam penelitian ini meliputi inkubator bergoyang, sentrifugator, dan spektrofotometer. Peralatan pendukung lainnya meliputi Laminar Air Flow Cabinet (LAFC), ruang asam, autoklaf, water bath, pH meter serta peralatan laboratorium lainnya.
3
Prosedur Analisis Data
Pengambilan Sampel dan Pengayaan Kultur
Sampel tanah diambil secara acak berkelompok pada kedalaman 0-15 cm pada tiga plot (BF1, BF3, dan BF4) dengan lima titik pengambilan/plot. Sebanyak 5 gram setiap sampel tanah halus dimasukkan ke dalam wadah yang berisi 5 mL akuades. Suspensi tanah diaduk selama 30 menit lalu didiamkan 5 menit dan diukur pHnya (Poerwidodo 1992).
Pengayaan kultur dilakukan dengan memasukkan 1 gram sampel tanah ke dalam 50 mL medium xilan (0.5% baktopepton, 0.5% ekstrak khamir, 0.5% xilan (Sigma Chemical Co.), 0.02% MgSO4·7H2O, 0.1% K2HPO4) pH 7 dalam erlenmeyer 100 mL, lalu diinkubasi pada inkubator bergoyang 110 rpm selama 72 jam dalam suhu ruang.
Isolasi dan Seleksi Bakteri Penghasil Xilanase
Sebanyak 1 mL sampel hasil pengayaan dilakukan pengenceran serial dengan NaCl 0.85% hingga 10-4-10-7. Masing-masing hasil pengenceran diambil 0.1 mL untuk disebar dalam media padat xilan, lalu diinkubasi pada suhu ruang selama 72 jam. Koloni yang terbentuk pada media padat xilan dimurnikan dengan metode gores kuadran. Setiap koloni yang telah murni dilakukan uji pembentukan zona bening pada media xilan Oat spelt 0.5% pH 5 dengan metode pewarnaan merah kongo 0.1%. Koloni yang membentuk zona bening disubkulturkan. Tiga koloni penghasil zona bening terbaik dilakukan pengujian pewarnaan Gram dan pencirian xilanasenya lebih lanjut.
Penentuan Waktu Tertinggi Produksi dan Aktivitas Xilanase
Produksi enzim diawali dengan meremajakan isolat terpilih pada media padat xilan 0.5%. Selanjutnya dilakukan pembuatan inokulum dengan menginokulasi tiga koloni isolat ke dalam 10 mL media cair xilan 0.5%. Inokulum diinkubasi pada inkubator bergoyang hingga densitas sel yang terukur dengan spektrofotomer ( 600 nm) mencapai 0.6 – 0.8 A. Jumlah sel inokulum ditentukan dengan metode total plate count (TPC) pada pengenceran 10-6, 10-7, 10-8, dan 10-9. Sebanyak 1 mL inokulum disubkulturkan pada 100 mL media produksi enzim xilanase dalam erlenmeyer 500 mL dan diinkubasi pada inkubator bergoyang pada suhu ruang.
Ekstrak kasar xilanase setiap enam jam diperoleh dengan cara mensentrifugasi kultur pada kecepatan 7000 rpm selama 15 menit pada suhu ruang. Supernatan (ekstrak kasar enzim) digunakan untuk diukur aktivitas enzimnya. Aktivitas xilanase diukur pada substrat xilan Oat spelt 0.5% dalam bufer sitrat fosfat pH 5 pada suhu ruang dan waktu inkubasi 30 menit dengan metode 3,5-Dinitrosalicylic acid (DNS) (Miller 1959). Standar yang digunakan merupakan xilosa. Gula pereduksi yang dihasilkan diukur dengan spektrofotometer ( 540 nm). Satu unit aktivitas xilanase didefinisikan sebagai jumlah mol xilosa yang dihasilkan setiap volume milliliter enzim dalam waktu 1 menit. Pengukuran aktivitas enzim dilakukan bersamaan
4
dengan pengukuran laju tumbuh bakteri dengan mengambil 2 mL kultur bakteri secara berkala dan diukur densitasnya dengan spektrofotometer ( 600 nm) untuk dibuat kurva tumbuhnya.
Penentuan pH dan Suhu Optimum Xilanase serta Stabilitasnya
Penentuan pH optimum aktivitas xilanase dilakukan dengan mengujikan ekstrak kasar enzim yang diperoleh pada waktu produksi tertinggi. Pengukuran aktivitas enzim diuji pada substrat xilan 0.5% dalam bufer dengan rentang pH 3 – 9 (selang 0.5 unit). Penentuan suhu optimum aktivitas xilanase dilakukan dengan mengujikan ekstrak kasar enzim pada pH optimum dengan rentang suhu 30 oC – 90 oC (selang 10 oC).
Uji stabilitas enzim dilakukan pada satu isolat terpilih dengan menginkubasikan ekstrak kasar enzim pada empat suhu yang berbeda, yaitu pada suhu optimumnya, suhu 4 oC, dan suhu ruang. Ekstrak kasar enzim diuji setiap jam pada pH dan suhu optimumnya dengan substrat xilan 0.5%. Pengujian dilakukan hingga enzim tidak memiliki aktivitas lagi.
Penentuan Gula Pereduksi, Total Gula, dan Derajat Polimerisasi
Ekstrak kasar enzim diinkubasikan dengan substrat xilan Beechwood 0.5% pada pH optimum dengan perbandingan 1:1; 1.5:1; dan 2:1 selama masa stabil enzim hingga aktivitasnya 50%. Hasil inkubasi diukur jumlah gula pereduksi dan total gulanya. Pengukuran gula pereduksi dilakukan dengan metode DNS (Miller 1959), sementara total gula diuji dengan metode fenol-asam sulfat. Derajat polimerisasi enzim didapatkan berdasarkan perbandingan gula pereduksi terhadap total gulanya (Masuko et al. 2005).
Derajat Polimerisasi= Total gula (mg/mL) Gula Pereduksi (mg/mL)
HASIL DAN PEMBAHASAN
Hasil
Pengambilan Sampel dan Pengayaan Kultur
Ketiga sampel tanah dengan kode BF1, BF3, dan BF4 bersifat asam dengan nilai pH yang tidak berbeda secara signifikan (tabel 1).
Tabel 1 pH tanah sampel tanah hutan primer Taman Nasional Bukit Duabelas, Jambi, Indonesia pada tiga plot
Kode sampel tanah pH Suhu (oC)
BF1 4.66 27
BF2 4.74 27
5
Isolasi dan Seleksi Bakteri Xilanolitik
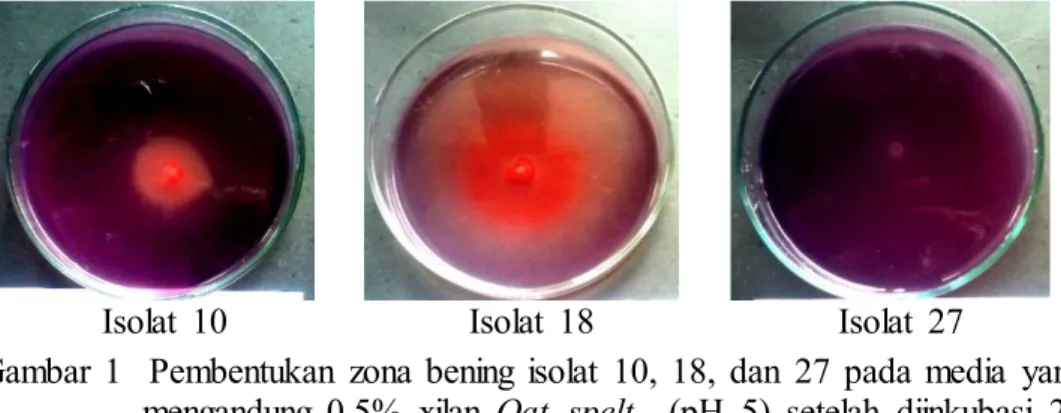
Sebanyak 28 isolat bakteri penghasil xilanase didapatkan dari hasil isolasi dan seleksi dengan nilai indeks xilanolitik berkisar antara 0.125 – 4.68. Indeks xilanolitik diperoleh dari perbandingan ukuran diameter koloni dan diameter zona bening yang dihasilkan pasca inkubasi 24 jam dan pewarnaan menggunakan merah kongo 0.1%. Terdapat tiga isolat terpilih dengan kode 10, 18, dan 27 yang memiliki nilai indeks xilanolitik berturut-turut sebesar 4.68, 4.25, dan 1.8 (Gambar 1). Ketiga isolat tersebut beturut-turut berasal dari plot yang berbeda, yaitu BF1, BF3, dan BF4.
Isolat 10 Isolat 18 Isolat 27
Gambar 1 Pembentukan zona bening isolat 10, 18, dan 27 pada media yang mengandung 0.5% xilan Oat spelt (pH 5) setelah diinkubasi 24 jam pada suhu ruang setelah diwarnai dengan merah kongo 0.1% Hasil pewarnaan Gram menunjukkan bahwa isolat 10 merupakan bakteri Gram negatif berbentuk basil pendek. Isolat 18 merupakan bakteri Gram negatif berbentuk kokus, sementara isolat 27 merupakan bakteri Gram positif berbentuk basil panjang.
Gambar 2 Morfologi dan jenis Gram isolat a). 10, b). 18 dan c). 27 dengan perbesaran 1000x. Isolat berumur 24 jam, ditumbuhkan pada media 0.5% xilan (pH 5) dan diinkubasi pada suhu ruang
Penentuan Waktu Produksi Tertinggi dan Aktivitas Xilanase Harian
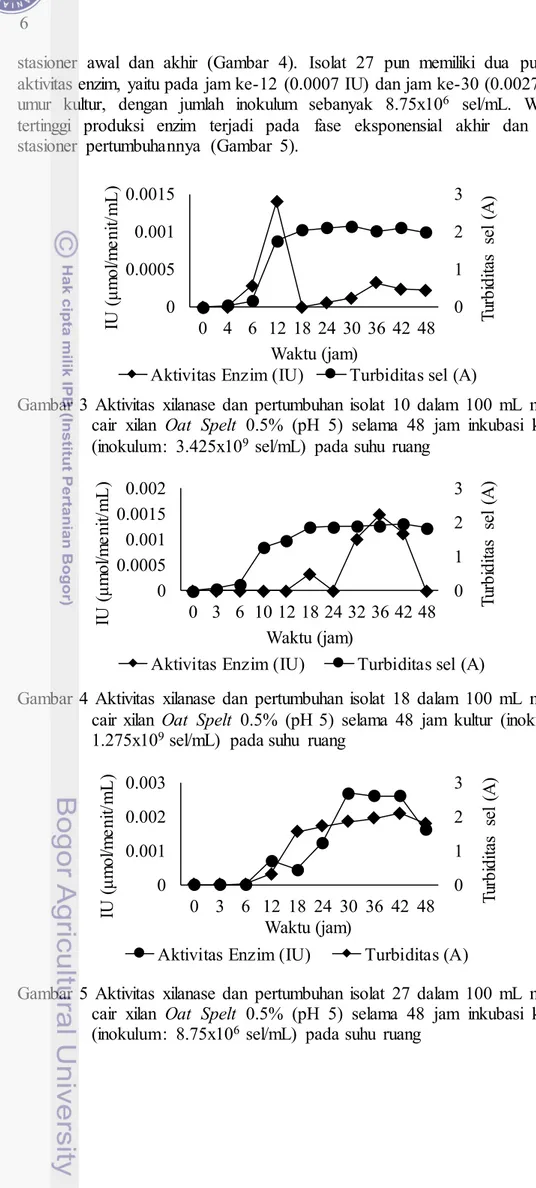
Produksi xilanase oleh ketiga isolat memiliki waktu produksi tertinggi yang berbeda-beda. Aktivitas tertinggi xilanase isolat 10 tercapai saat umur kultur 12 jam (0.0014 IU) dan puncak kedua (0.0003 IU) saat kultur berumur 36 jam dengan jumlah inokulum sebanyak 3.425x109 sel/mL. Waktu optimum produksi enzim xilanase dicapai ketika fase akhir eksponensial pertumbuhannya (Gambar 3).
Isolat 18 memiliki dua puncak aktivitas enzim, yaitu pada jam ke-18 (0.0003 IU) dan jam ke-36 (0.0016 IU) dengan jumlah inokulum 1.275x109 sel/mL. Waktu tertinggi aktivitas enzim terjadi ketika bakteri dalam fase
6
stasioner awal dan akhir (Gambar 4). Isolat 27 pun memiliki dua puncak aktivitas enzim, yaitu pada jam ke-12 (0.0007 IU) dan jam ke-30 (0.0027 IU) umur kultur, dengan jumlah inokulum sebanyak 8.75x106 sel/mL. Waktu tertinggi produksi enzim terjadi pada fase eksponensial akhir dan fase stasioner pertumbuhannya (Gambar 5).
Gambar 3 Aktivitas xilanase dan pertumbuhan isolat 10 dalam 100 mL media cair xilan Oat Spelt 0.5% (pH 5) selama 48 jam inkubasi kultur (inokulum: 3.425x109 sel/mL) pada suhu ruang
Gambar 4 Aktivitas xilanase dan pertumbuhan isolat 18 dalam 100 mL media cair xilan Oat Spelt 0.5% (pH 5) selama 48 jam kultur (inokulum: 1.275x109 sel/mL) pada suhu ruang
Gambar 5 Aktivitas xilanase dan pertumbuhan isolat 27 dalam 100 mL media cair xilan Oat Spelt 0.5% (pH 5) selama 48 jam inkubasi kultur (inokulum: 8.75x106 sel/mL) pada suhu ruang
0 1 2 3 0 0.0005 0.001 0.0015 0 4 6 12 18 24 30 36 42 48 T ur bi di ta s se l (A ) IU ( m ol /m e ni t/ m L ) Waktu (jam)
Aktivitas Enzim (IU) Turbiditas sel (A)
0 1 2 3 0 0.0005 0.001 0.0015 0.002 0 3 6 10 12 18 24 32 36 42 48 T ur bi di ta s se l (A ) IU ( m ol /m e ni t/ m L ) Waktu (jam)
Aktivitas Enzim (IU) Turbiditas sel (A)
0 1 2 3 0 0.001 0.002 0.003 0 3 6 12 18 24 30 36 42 48 T ur bi di ta s se l (A ) IU ( m ol /m e ni t/ m L ) Waktu (jam)
7
Penentuan pH dan Suhu Optimum Enzim Xilanase serta Stabilitasnya
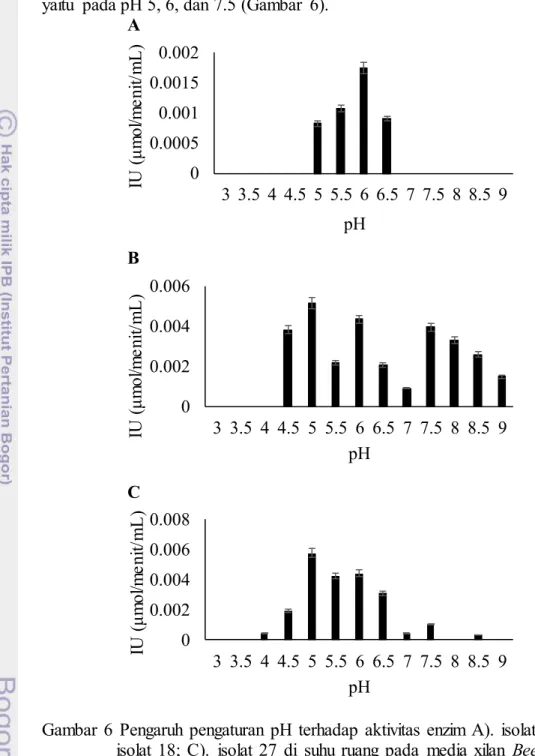
Aktivitas xilanase tertinggi ekstraseluler isolat 10 mencapai optimum pada pH 6. Adapun isolat 18 dan 27 memiliki tiga puncak aktivitas xilanase, yaitu pada pH 5, 6, dan 7.5 (Gambar 6).
A
B
C
Gambar 6 Pengaruh pengaturan pH terhadap aktivitas enzim A). isolat 10; B). isolat 18; C). isolat 27 di suhu ruang pada media xilan Beechwood 0.5%
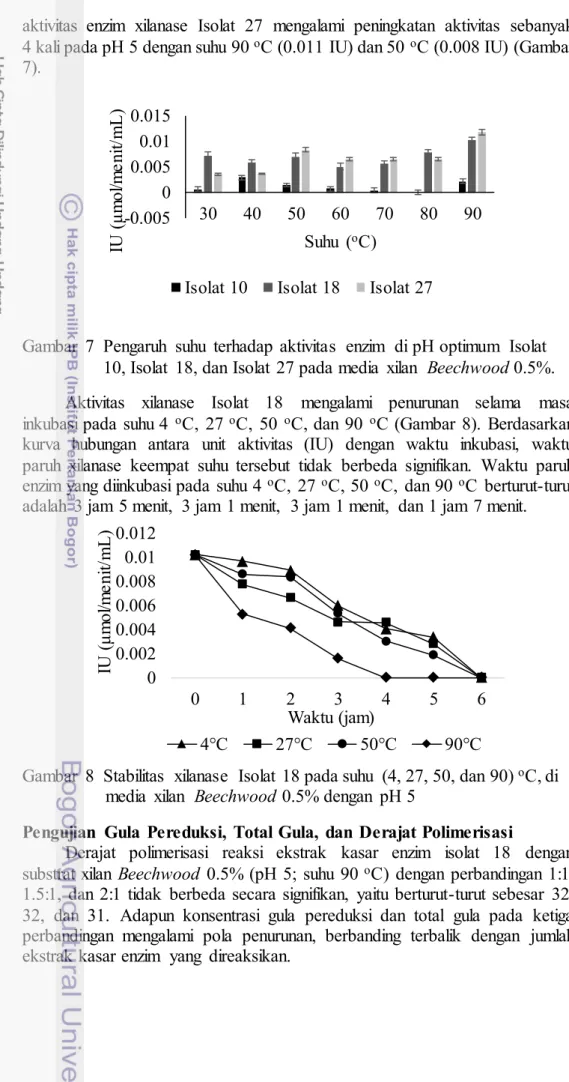
Pengaruh suhu pada pH optimum setiap isolat menunjukkan peningkatan aktivitas enzim. Aktivitas xilanase tertinggi isolat 10 pada pH 6 terjadi pada suhu 40 oC (0.003 IU) dan 90 oC (0.002 IU) dengan peningkatan aktivitas enzim mencapai 2 kali dibandingkan aktivitas tanpa optimasi suhu dan pH. Adapun aktivitas xilanase tertinggi isolat 18 pada pH 5 terjadi pada suhu 90 oC (0.010 IU) dengan peningkatan sebanyak 6 kali. Sementara
0 0.0005 0.001 0.0015 0.002 3 3.5 4 4.5 5 5.5 6 6.5 7 7.5 8 8.5 9 IU ( m ol /m e ni t/ m L ) pH 0 0.002 0.004 0.006 3 3.5 4 4.5 5 5.5 6 6.5 7 7.5 8 8.5 9 IU ( m ol /m e ni t/ m L ) pH 0 0.002 0.004 0.006 0.008 3 3.5 4 4.5 5 5.5 6 6.5 7 7.5 8 8.5 9 IU ( m ol /m e ni t/ m L ) pH
8
aktivitas enzim xilanase Isolat 27 mengalami peningkatan aktivitas sebanyak 4 kali pada pH 5 dengan suhu 90 oC (0.011 IU) dan 50 oC (0.008 IU) (Gambar 7).
Gambar 7 Pengaruh suhu terhadap aktivitas enzim di pH optimum Isolat 10, Isolat 18, dan Isolat 27 pada media xilan Beechwood 0.5%. Aktivitas xilanase Isolat 18 mengalami penurunan selama masa inkubasi pada suhu 4 oC, 27 oC, 50 oC, dan 90 oC (Gambar 8). Berdasarkan kurva hubungan antara unit aktivitas (IU) dengan waktu inkubasi, waktu paruh xilanase keempat suhu tersebut tidak berbeda signifikan. Waktu paruh enzim yang diinkubasi pada suhu 4 oC, 27 oC, 50 oC, dan 90 oC berturut-turut adalah 3 jam 5 menit, 3 jam 1 menit, 3 jam 1 menit, dan 1 jam 7 menit.
Gambar 8 Stabilitas xilanase Isolat 18 pada suhu (4, 27, 50, dan 90) oC, di media xilan Beechwood 0.5% dengan pH 5
Pengujian Gula Pereduksi, Total Gula, dan Derajat Polimerisasi
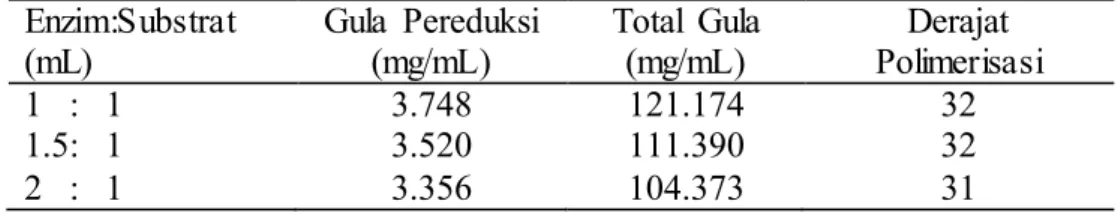
Derajat polimerisasi reaksi ekstrak kasar enzim isolat 18 dengan substrat xilan Beechwood 0.5% (pH 5; suhu 90 oC) dengan perbandingan 1:1, 1.5:1, dan 2:1 tidak berbeda secara signifikan, yaitu berturut-turut sebesar 32, 32, dan 31. Adapun konsentrasi gula pereduksi dan total gula pada ketiga perbandingan mengalami pola penurunan, berbanding terbalik dengan jumlah ekstrak kasar enzim yang direaksikan.
-0.005 0 0.005 0.01 0.015 30 40 50 60 70 80 90 IU ( m ol /m e ni t/ m L ) Suhu (oC)
Isolat 10 Isolat 18 Isolat 27
0 0.002 0.004 0.006 0.008 0.01 0.012 0 1 2 3 4 5 6 IU ( m ol /m e ni t/ m L ) Waktu (jam) 4°C 27°C 50°C 90°C
9 Tabel 2 Gula pereduksi, total gula, dan derajat polimerisasi reaksi enzim xilanase Isolat 18 terhadap substrat xilan Beechwood 0.5% pada pH 5 dan suhu 90 oC (waktu inkubasi 1.5 jam)
Enzim:Substrat (mL) Gula Pereduksi (mg/mL) Total Gula (mg/mL) Derajat Polimerisasi 1 : 1 3.748 121.174 32 1.5: 1 3.520 111.390 32 2 : 1 3.356 104.373 31 Pembahasan
Pengambilan Sampel dan Pengayaan Kultur
Sampel merupakan jenis tanah liat dengan pH asam yang berasal dari tiga plot di daerah Taman Nasional Bukit Duabelas, Jambi (BF1, BF3, dan BF4). Tanah pada daerah dengan kadar hujan dan bahan organik yang tinggi cenderung bersifat asam. Tanah wilayah Sumatera memiliki tingkat kesuburan yang rendah dengan pH berkisar antara 4.4 – 5.5 (Wasis et al. 2012). Asam humat adalah salah satu penyebab keasaman tanah di hutan. Asam humat merupakan hasil akhir dari proses dekomposisi bahan organik (Koppler et al. 2000). Pengayaan kultur dengan media selektif dilakukan untuk meningkatkan populasi mikroorganisme xilanolitik pada sampel. Xilanase diinduksi dengan adanya xilan dan lignoselulosa pada media. Wheat straw dilaporkan sebagai sumber karbon yang paling baik dalam menginduksi xilanase ekstraseluler, sementara xilosa paling baik dalam menginduksi
-xilosidase. Adapun glukosa, xilitol, dan CMC menghambat disintesisnya -xilosidase (Saraswat dan Bisaria 1996).
Isolasi dan Seleksi Bakteri Xilanolitik
Merah kongo telah dilaporkan sebagai pewarna yang paling baik dalam mengukur aktivitas enzim pada berbagai fungi secara kualitatif (Yoon et al. 2007). Merah kongo bekerja dengan mengikat polisakarida. Ketika xilan sebagai polisakarida telah terdegradasi, akan terbentuk zona bening. Zona bening yang terbentuk pada ketiga isolat menunjukkan terdapat dua degradasi warna, yaitu zona bening yang lebih terang dan yang lebih gelap. Degradasi warna tersebut menunjukkan bahwa bakteri ketiga isolat menghasilkan lebih dari satu jenis enzim xilanase dengan kemampuan memecah polisakarida yang berbeda. Struktur xilan yang kompleks membutuhkan berbagai jenis enzim untuk menghidrolisisnya secara utuh. Endo-1.4- -xilanase menghidrolisis rantai utama xilan; 1,4- -D-xilosidase memutus sebagian kecil oligosakarida; sementara -L-arabinofuranosidase, -D-glukuronidase, galaktosidase dan asetil xilan esterase menghidrolisis rantai samping xilan (Subramaniyan dan Prema 2002). Warna zona bening yang semakin terang menunjukkan degradasi xilan yang semakin sempurna dan diduga memiliki xilosidase. Perbedaan warna juga menunjukkan perubahan pH pada media. Warna biru menunjukkan pH 3, warna merah-ungu menunjukkan pH 5, dan warna jingga menunjukkan pH 7-8 (Yoon et al. 2007).
10
Metode pewarnaan Gram merupakan salah satu metode untuk mengidentifikasi jenis bakteri. Isolat 10 dan 18 tergolong Gram negatif; sementara isolat 27 tergolong Gram positif. Warna yang terbentuk pada pewarnaan Gram berdasarkan adanya perbedaan ketebalan lapisan peptidoglikan pada dinding sel bakteri. Bakteri Gram positif memiliki peptidoglikan yang tebal sehingga pengikatan pada pewarna ungu kristal sangat kuat, sementara dinding sel bakteri Gram negatif terwarnai oleh pewarna tanding Safranin akibat lapisan peptidoglikannya tipis. Beberapa bakteri Gram positif yang telah dilaporkan menghasilkan enzim xilanase di antaranya Streptomyces, Cellulomonas, Micrococcus, Staphylococcus, dan Bacillus, Clostridium absonum, dan Thermoactinomyces thalophilus; sementara xilanolitik Gram negatif yaitu Pseudomonas, Thermoanaerobacterium, Thermotoga maritime, Acidobacterium capsulatum (Beg et al. 2001, Gandarillas et al. 2012, Sharma dan Chand 2012).
Penentuan Waktu Produksi Tertinggi dan Aktivitas Xilanase
Waktu produksi tertinggi merupakan waktu saat konsentrasi dan aktivitas xilanase yang dihasilkan paling tinggi. Xilanase tergolong sebagai metabolit primer karena dibutuhkan dalam pemecahan sumber karbon xilan pada substratnya untuk kebutuhan pertumbuhannya, sehingga diproduksi sejak awal pertumbuhannya (fase lag). Isolat 10 dan 18 menunjukkan bahwa produksi xilanasenya diawali pada akhir fase eksponensial. Hal ini diduga karena kedua isolat tersebut memanfaatkan ekstrak khamir dan baktopepton terlebih dahulu dalam pertumbuhannya. Ekstrak khamir sebagai sumber nitrogen mengandung banyak mineral, vitamin, dan asam amino yang dibutuhkan untuk pertumbuhan mikroba (Li et al. 2011, Hakobyan et al. 2012). Hal ini terlihat pada gradasi warna jingga yang terbentuk pada zona bening isolat 10 dan isolat 18. Perubahan pH menjadi basa tersebut diduga akibat adanya pembentukan senyawa amonia dari basa nitrogen asam amino pada media saat katabolisme ekstrak khamir. Bakteri kemudian menghasilkan enzim ekstraseluler xilanase untuk memecah substrat xilan setelah ekstrak khamir dan baktopepton telah termanfaatkan. Produksi tertinggi yang terjadi pada fase eksponensial juga dilaporkan oleh Coman (2012) pada Streptomyces spp P12-137. Puncak aktivitas enzim kedua yang diduga sebagai jenis xilanase berbeda dihasilkan ketika fase stasioner.
Adapun isolat 27 menghasilkan xilanase sejak fase lag. Ekstrak khamir dan baktopepton diduga tidak cukup untuk menginduksi pertumbuhan isolat 27 tanpa sumber karbon lain, sehingga dibutuhkan xilanase untuk menyediakan sumber karbon sejak awal fase pertumbuhannya. Berdasarkan aktivitas enzimnya, isolat 27 pun memiliki nilai aktivitas paling tinggi dibandingkan kedua isolat lainnya. Aktivitas xilanase yang tinggi diduga berpengaruh terhadap rendahnya kemampuannya dalam memetabolisme ekstrak khamir. Sama dengan kedua isolat lainnya, puncak aktivitas enzim kedua-yang diduga sebagai xilanase jenis lain terjadi saat fase stasioner. Berbagai jenis xilanase diperlukan dalam mendegradasi sempurna struktur xilan yang kompleks (Yang et al. 2006). Setelah waktu produksi tertinggi, aktivitas enzim mengalami penurunan yang dapat disebabkan oleh
11 menurunnya jumlah substrat, feedback inhibition, serta adanya aktivitas proteolisis (White 1995).
Terdapatnya dua puncak aktivitas enzim pada ketiga isolat diduga karena adanya dua jenis enzim yang berbeda. Menurut Ahlgren (1967), dua puncak aktivitas enzim dapat menunjukkan adanya dua jenis enzim yang berbeda. Namun kemunculan dua puncak pada aktivitas enzim dapat juga disebabkan oleh adanya polisakarida (kompleks protein) dalam media. Jermyn (1962) menemukan bahwa aryl- -glukosidase yang berkombinasi dengan polisakarida menyebabkan adanya beberapa puncak pada pengukuran aktivitas enzim. Keberadaan isoenzim pun dapat menyebabkan kemunculan puncak aktivitas enzim lebih dari satu. Kemampuan enzim yang berbeda dalam mengkatalisis reaksi yang sama telah diulas oleh Wilkinson (1967). Dobozi et al. (1992) melaporkan bahwa ditemukan isoenzim pada pemisahan xilanase menggunakan isoelektrik, umumnya pada pH asam.
Penentuan pH dan Suhu Optimum Xilanase serta Stabilitasnya
Kerja enzim dipengaruhi oleh berbagai faktor abiotik, di antaranya pH dan suhu. Pengaturan pH berkaitan dengan muatan pada situs aktif enzim sehingga memiliki afinitas kimiawi yang tinggi terhadap substrat (Pelczar dan Chan 2006). Jika afinitas situs aktifnya tinggi terhadap substrat, maka jumlah substrat yang bereaksi dan produk yang dihasilkan akan lebih banyak. Xilanase isolat 10 memiliki aktivitas pada pH asam dan mencapai aktivitas tertinggi pada dua suhu. Pola yang sama terlihat pada isolat 27, dimana aktivitas enzim pada suhu dan pH optimum menunjukkan dua puncak aktivitas enzim yang juga menunjukkan bahwa kemungkinan terdapat dua jenis enzim yang memiliki suhu optimum yang berbeda. Raghukumura et al. (2004) melaporkan bahwa xilanase yang didapatkannya dari fungi laut memiliki aktivitas tertinggi pada suhu 50 oC dan 90 oC yang diketahui sebagai dua enzim yang berbeda, yaitu -xilosidase dan -L-arabinofuranosidase. Keduanya bekerja secara sinergis dalam mendegradasi xilan.
Xilanase ketiga isolat memiliki enzim yang bersifat thermostabil dan thermolabil yang optimum pada pH asam. Kombinasi pH dan suhu yang sesuai akan meningkatkan aktivitas katalitik enzim terhadap substratnya. Pengaruh suhu terhadap aktivitas enzim berkaitan dengan energi aktivasi Arrhenius dimana semakin tinggi suhu akan meningkatkan kecepatan tubrukan molekul sehingga energi untuk reaksi semakin besar dan aktivitas enzim akan semakin tinggi. Namun tingginya suhu dibatasi oleh sifat enzim sebagai protein yang terdenaturasi pada suhu tinggi (Eisenthal et al. 2006). Aktivitas xilanase isolat 18 berbanding terbalik dengan lama inkubasinya. Hal ini berkaitan dengan perubahan struktur tiga dimensi enzim selama masa penyimpanan. Waktu paruh keempat suhu yang diuji tidak berbeda nyata. Namun suhu 90 oC menunjukkan waktu paruh paling singkat. Stabilitas dua jam pertama inkubasi terlihat baik pada penyimpanan di suhu 4 oC dan 50 oC.
Pengujian Gula Pereduksi, Total Gula, dan Derajat Polimerisasi
Gula pereduksi merupakan produk dari aktivitas enzim yang bereaksi dengan substrat xilan. Gula pereduksi bersifat mereduksi karena adanya gugus hidroksi yang bebas dan reaktif (Lehninger 1982). Konsentrasi gula
12
pereduksi terlihat mengalami penurunan walaupun jumlah substrat yang direaksikan sama (Tabel 2). Hal tersebut diduga dikarenakan adanya reaksi Maillard. Reaksi Maillard merupakan reaksi yang terbentuk antara gugus karbonil gula pereduksi dengan asam amino bebas (umumnya kelompok gugus dari kelompok lisin, dapat juga dengan ujung gugus asam amino lainnya) pada suhu tinggi dan selanjutnya membentuk Amadori Rearrangement Product (ARP). Pada pH di bawah 7.0, ARP akan terdegradasi menjadi hidroksimetilfurfural (HMF) atau furfural dan pada akhirnya membentuk gugus aldol, polimer bebas N, aldimin, ketim, dan pigmen melanoid yang kecokelatan (Hodge 1953). Hal tersebut menyebabkan gula pereduksi yang telah bereaksi dengan asam amino bebas pada media yang mengandung protein tidak dapat berikatan dengan 3,5-Dinitrosalicylic acid (DNS). Akibatnya gula pereduksi yang terbaca akan menurun, begitu pula dengan total gula yang terbaca. Derajat polimerisasi (DP) pada reaksi enzim dengan substrat sebanyak 2:1 masih menunjukkan derajat polimerisasi yang besar, namun ketiga isolat tersebut berpotensi digunakan dalam pengomposan.
SIMPULAN DAN SARAN
Simpulan
Isolat 10, 18, dan 27 diduga memiliki lebih dari satu jenis enzim xilanase. Ketiga isolat memiliki xilanase yang bersifat termofilik. Xilanase isolat 18 bersifat kurang stabil pada pH dan suhu optimumnya. Nilai derajat polimerisasi produk reaksi xilanase isolat 18 masih tergolong besar.
Saran
Identifikasi lebih lanjut diperlukan terhadap jenis enzim pada ketiga isolat. Selain itu, perlu adanya rekayasa protein untuk meningkatkan stabilitas xilanase isolat 18. Pemekatan enzim serta optimasi suhu dan pH sesuai diperlukan untuk pengukuran nilai DP, sehingga dapat mengurangi jumlah total gula serta meminimalisir efek Maillard.
DAFTAR PUSTAKA
Adeola O, Bedford MR. 2004. Exogenous dietary xylanase ameliorates viscosity-induced anti-nutritional effects in wheat-based diets for white peckin ducks (Anas platyrinchos domesticus). Br J Nutr. 92:87-94.doi:10.1079/BJN20041180.
13 Ahlgren E. Eriksson K, Vesterberg O. 1967. Characterization of cellulases and related enzymes by isoelectric focusing, gel filtration and zone electrophoresis. Acta Chem Scand. 21(4): 937-944.
Beg QK, Kapoor M, Mahajan L, Hoondal GS. 2001. Microbial xylanases and their industrial applications. Rev Appl Microbiol Biotechnol. 56(3-4):326-338.doi:10.1007/s002530100704
Coman G. 2012. Modeling process for bioproduction of xylanase by Streptomyces spp. P12-137 on lignocelluloses agro-wastes. Food Technol. 36(2):49-57.
Dobozi MS, Szakacs G, Bruschi CV. 1992. Xylanase activity of Phanerochaete chrysosporium. Appl Environ Microbiol. 58(11):3466-3471.doi:0099-2240/92.
Eisenthal R, Peterson ME, Daniel RM, Danson MJ. 2006. The thermal behaviour of enzymes: implications for biotechnology. Trends Biotechnol. 24(7):289-292.doi:10.1016/j.tibtech.2006.05.04.
Gandarillas C, Soto R, Vargas VA. 2012. Xylanase production using barley straw by Bacillus sp. LB-4 isolated from laguna blanca, potosi-bolivia. Rev Boliv Quim. 29(1):63-70.doi:
Hakobyan L, Gabrielyan L, Trchounian A. 2012. Yeast extract as an effective nitrogen source stimulating cell growth and enhancing hydrogen photoproduction by Rhodobacter sphaeroides strains from mineral springs. Int. J Hydrogen Energ. 8(37):6519-6526. doi:10.1016/j.ijhydene.2012.01.077.
Hodge JE. 1953. Dehiydrated foods: chemistry of browning reactions in model systems. Agric Food Chem. 1(15): 928-943. doi:10.1021/jf60015a004.
Jermyn MA. 1962. Acceptor competition as a means of distinguishing between possible enzymic mechanisms using beta-glucosidase of Stachybotrys atra. Aust J Biol Sci. 15(1):248-260.
Kappler A, Ji R, Brune A. 2000. Synthesis and characterization of specifically 14C-labeled humic model compounds for feeding trials with soil-feeding termites. Soil Biol Biochem. 32(8-9):1271-1280.doi:10.1016/S0038-0717(00)00047-X.
Kumar KB, Balakrishnan H, Rele MV. 2004. Compatibility of alkaline xylanases from an alkaliphilic Bacillus NCL (87-6-10) with commercial detergents and proteases. J Ind Microbiol Biotechnol. 31(2): 83-87.doi:10.1007/s10295-004-0119-8.
Lehninger AL.1982. Dasar-Dasar Biokimia. Jilid ke-2. Thenawijaya M, Penerjemah. Jakarta (ID): Erlangga. Terjemahan dari: Biochemsitry 2nd edition.
Li M, Liao X, Zhang D, Du G, Chen J. 2011. Yeast extract promotes cell growth and induces production of polyvinyl; alcohol-degrading enzymes. Enz Research. 2011(1):1-8.doi:10.4061/2011/179819.
Masuko T, Minami A, Iwasaki N, Majima T, Nishimura S, Lee YC. 2005. Carbohydrate analysis by a phenol-sulfuric acid method in microplate format. Anal Biochem. 339(1):69-72.doi:10.1016/j.ab.2004.12.001
Miller GL. 1959. Use of dinitrosalicylic acid reagent for determination of reducing sugar. Anal Chem. 3(31):426-428.doi:10.1021/ac60147a030.
14
Pelczar MJ Jr, Chan ECS. 2006. Dasar-Dasar Mikrobiologi. Volume ke-1. Hadioetomo RS, Imas T, Tjitrosomo SS, Angka SL, Penerjemah. Jakarta (ID): UI Pr. Terjemahan dari: Elements of Microbiology. p 323.
Poerwowidodo. 1992. Metode Selidik Tanah. Surabaya: Usaha Nasional. Raghukumar C, Muraleedharan U, Gaud VR, Mishra R. 2004. Xylanases of
marine fungi of potential use for biobleaching of paper pulp. J Ind Microbiol Biotechnol. 31(9):433-441.doi:2264/174.
Richana N, Lestari P, Thontowi A, Rosmimik. 2000. Seleksi isolat bakteri lokal penghasil xilanase. J Mikrobiol Indones. 5(2):54-56.
Ruiz-Arribas A, Fernandes-Abalos JM, Sanchez P, Garda AL, Santamaria RI. 1995. Overproduction, Purification, and Biochemical Characterization of a Xylanase (Xys1) from Streptomyces helstedii JMB. Appl Environ Microbiol. 61(6):2414-2419.
Saraswat V, Bisaria VS. 1996. Biosynthesis of xylanolytic and xylan-debranching enzymes in Melanocarpus albomyces IIS 68. New Delhi (IN): Indian Institute of Technology.
Sharma PK, Chand D. 2012. Production of cellulose-free thermostable xylanase from Pseudomonas sp. XPB-6. I Res J Biological Sci. 1(5):31-41.
Subramaniyan S, Prema P. 2002. Biotechnology of microbial xylanases: enzymology, molecular biology, and application [ulasan]. Crit. Rev. Biotechnol. 22(1):33-46.doi:10.1080/07388550290789450.
Vieira WB, Moreira LRS, Neto AM, Filho EXF. 2007. Production and characterization of an enzyme complex from a new strain of Clostridium thermocellum with emphasis on its xylanase activity. Braz. J Microbiol. 38(2):237-242.doi:10.1590/S1517-83822007000200009.
Wasis B, Setiadi D, Purwanto ME. 2012. Perbandingan sifat kimia dan biologi tanah akibat keterbukaan lahan pada hutan reboisasi pinus di kecamatan pollung kabupaten humbang hasundutan sumatera utara. J Silvikul Trop. 3(1):33-36.
White D. 1995. The Physiology and Biochemistry of Prokaryotes. New York (US): Oxford University Press.
Wilkinson JH. 1967. Isoenzymes. Mol Nut Food Res. 11(4): 385-386.doi: 10.1002/food.19670110418.
Wong KKY, Tan LUL, Saddler JN. 1λ88. Multiplicity of -1,4-xylanase in microorganisms: function and application. Microbiol Rev. 52(3):305-317. Yang Y, Biedendieck R, Wang W, Gamer M, Malten M, Jahn D, Deckwer. 2006. High yield recombinant penicillin G amidase production and export into the growth medium using Bacillus megaterium. Microb Cell Fact. 20(10):1-8.doi:10.1186/1475-2859-10-20.
Yoon JH, Park JE, Suh DY, Hong SB, Ko SJ, Kim SH. 2007. Comparison of dyes for easy detection of extracellular cellulases in fungi. Mycobiology. 35(1):21-24.doi:10.4489/MYCO.2007.35.1.021.
15 Lampiran 1 Komposisi media agar dan media produksi xilan (Yang et al.
2006)
Bahan Media agar xilan
(% w/v)
Media produksi xilan (% w/v) Xilan 0.5 0.5 Baktopepton 0.5 0.5 Ekstrak Khamir 0.5 0.5 MgSO4o7H2O 0.02 0.02 K2HPO4 0.1 0.1 Agar 2.2 2.2
Lampiran 2 Komposisi reagen Dinitrosalicylic acid (DNS) (Miller 1959)
NaOH padat……… 10 g
KNa Tartrat………. 182 g
Na2SO3……… 0.5 g
DNS……… 10 g
16
RIWAYAT HIDUP
Penulis dilahirkan di Mataram, NTB pada tanggal 26 Oktober 1991 dari ayah Abdullah Usman dan ibu Siti Nurwahidah. Penulis merupakan putri kedua dari empat bersaudara. Tahun 2009 penulis lulus dari SMA Negeri 1 Dramaga, Bogor dan pada tahun yang sama diterima masuk di Program Studi Biologi, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor melalui jalur Ujian Talenta Mandiri (UTM) IPB. Penulis pernah melaksanakan penelitian tentang filogenetik ikan Belida dalam magang di laboratorium Molekular Zoologi IPB (2010); studi lapang mengenai Biodiversitas kecebong di Hutan Pendidikan Gunung Walat (2011); praktik lapang di Bidang Quality Control Mikrobiologi PT Sinar Sosro, Tambun, Bekasi periode Juli hingga Agustus 2012; dan penelitian tentang teknologi recovery limbah emas dengan kitosan di PT Aneka Tambang (Antam, Tbk) Pongkor, Bogor (2012).
Selama masa perkuliahan, penulis aktif di organisasi kemahasiswaan yaitu sebagai Wakil Sekretaris Badan Eksekutif Mahasiswa Tingkat Persiapan Bersama (BEM TPB), staf Departemen Keuangan Lembaga Dakwah Kampus Al-Hurriyah (LDK AH), Bendahara umum Forum of Scientific Studies (FORCES), staf Pengembangan Sumberdaya Mahasiswa Badan Eksekutif Mahasiswa G (BEM G), dan Wakil Koordinator Wilayah Ikatan Himpunan Mahasiswa Biologi Indonesia Wilayah Jawa 1 (Ikahimbi). Selain itu penulis aktif dalam berbagai kepanitian even kampus, diantaranya sebagai divisi acara Forces Fair; divisi acara Gebyar Inovasi Pemuda Indonesia 2011 (GIPI); Sekretaris Grand Biodiversity dan ulang tahun Biologi (2011); Sekretaris Musyawarah Wilayah Ikahimbi Jawa 1, Koordinator publikasi, dekorasi, dan dokumentasi SPIRIT (2011); Koordinator logistik Leadership training (2011); sekretaris seminar kewirausahaan Eclipse (2011), staf Movie IPB Green Living Movement (2011), staf Hubungan Masyarakat Masa Pengenalan Fakultas FMIPA (2011).
Penulis mendapatkan beberapa penghargaan prestasi akademik, diantaranya adalah Program Kreativitas Mahasiswa di Bidang Penelitian, Kewirausahaan, dan Pengabdian Masyarakat didanai oleh DIKTI pada tahun 2009, 2010, dan 2011; finalis Lomba Karya Tulis Ilmiah Al-Quran Festival Ilmuwan Muslim (2010); pemenang Blogger Borneo (2011); finalis Lomba Karya Tulis Ilmiah Al-Quran IPB (2011); Pemenang esai dalam seminar nasional Soil, Disaster, and Remote Sensing(2011); peserta call for paper AISC Taiwan (2011); pemenang Sineaste Award IPB (2011); mahasiswa Berprestasi 1 Departemen Biologi (2012); mahasiswa berprestasi 2 Fakultas Matematika dan Ilmu Pengetahuan Alam IPB (2012); dan sebagai delegasi Indonesia dalam kompetisi International Genetically Engineering Machine 2012, Bogor Agricultural University (IPB). Selain itu, penulis juga pernah menjadi staf pengajar di bimbingan belajar KATALIS.