UNIVERSITAS INDONESIA
PENGARUH LAJU KOROSI DENGAN PENAMBAHAN TEH BUNGA ROSELLA SEBAGAI INHIBITOR ORGANIK PADA
BAJA KARBON RENDAH DI LINGKUNGAN NaCl 3.5 % DENGAN METODE POLARISASI
SKRIPSI
ARRI PRASETYO 0706268303
FAKULTAS TEKNIK
DEPARTEMEN METALURGI DAN MATERIAL DEPOK
PENGARUH LAJU KOROSI DENGAN PENAMBAHAN TEH BUNGA ROSELLA SEBAGAI INHIBITOR ORGANIK PADA
BAJA KARBON RENDAH DI LINGKUNGAN NaCl 3.5 % DENGAN METODE POLARISASI
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknik
ARRI PRASETYO 0706268303
FAKULTAS TEKNIK
DEPARTEMEN METALURGI DAN MATERIAL DEPOK
ii
HALAMAN PERNYATAAN ORISINALITAS
Skripsi ini adalah hasil karya saya sendiri, dan semua sumber baik yang dikutip maupun dirujuk telah saya nyatakan dengan benar.
Nama : Arri Prasetyo
NPM : 0706268303
Tanda Tangan : ………..
Tanggal : Juni 2011
HALAMAN PENGESAHAN
Skripsi ini diajukan oleh : Prof. Dr. Ir. Johny Wahyuadi, DEA.
Nama : Arri Prasetyo
NPM : 0706268303
Program Studi : Teknik Metalurgi dan Material
Judul Skripsi : Pengaruh Laju Korosi Dengan Penambahan Teh
Bunga Rosella Sebagai Inhibitor Organik Pada Baja Karbon Rendah Di Lingkungan NaCl 3.5 % Dengan Metode Polarisasi
Telah berhasil dipertahankan di hadapan Dewan Penguji dan diterima sebagai bagian persyaratan yang diperlukan untuk memperoleh gelar Sarjana Teknik pada Program Studi Teknik Metalurgi dan Material Fakultas Teknik Universitas Indonesia
DEWAN PENGUJI
Pembimbing : Prof. Dr. Ir. Johny Wahyuadi, DEA.
Penguji 1 : Dr. Ir. Muhammad Anis M.Met.
Penguji 2 : Deni Ferdian S.T., M.Sc.
Ditetapkan di : Depok
Tanggal : Juni 2011
iv
KATA PENGANTAR
Puji dan syukur senantiasa saya panjatkan kehadirat Allah SWT, karena dengan berkat dan rahmat-Nya, saya dapat menyelesaikan skripsi ini dengan
sebaik-baiknya. Skripsi yang berjudul “Pengaruh Laju Korosi Dengan Penambahan Teh
Bunga Rosella Sebagai Inhibitor Organik Pada Baja Karbon Rendah Di
Lingkungan NaCl 3.5 % Dengan Metode Polarisasi” ini disusun untuk memenuhi
sebagian persyaratan akademis dalam meraih gelar Sarjana Teknik di Departemen Metalurgi dan Material Fakultas Teknik Universitas Indonesia. Saya menyadari bahwa, tanpa bantuan dan bimbingan dari berbagai pihak, dari masa perkuliahan sampai penyusunan skripsi ini, sangatlah sulit bagi saya untuk menyelesaikan skripsi ini. Oleh karena itu saya mengucapkan terima kasih kepada:
1. Prof. Dr. Ir. Johny Wahyuadi Soedarsono, DEA, selaku dosen pembimbing yang telah menyediakan waktu, tenaga, dan pikiran untuk mengarahkan saya dalam penyusunan skripsi ini.
2. Prof. Dr-Ing. Ir. Bambang Suharno, selaku Kepala Departemen Teknik
Metalurgi dan Material FTUI.
3. Dr. Ir. Muhammad Anis M.Met, selaku Pembimbing Akademis penulis.
4. Orangtua dan keluarga saya, yang telah memberikan bantuan dukungan moral
dan material.
5. Sahabat, yang telah banyak membantu saya dalam menyelesaikan skripsi ini.
Akhir kata, saya berharap Allah SWT berkenan membalas segala kebaikan semua pihak yang telah membantu. Semoga skripsi ini membawa manfaat bagi pengembangan ilmu metalurgi dan material ke depannya.
Depok, Juni 2011
Penulis
Sebagai sivitas akademik Universitas Indonesia, saya yang bertanda tangan di bawah ini :
Nama : Arri Prasetyo
NPM : 0706268303
Program Studi : Teknik Metalurgi dan Material
Departemen : Metalurgi dan Material
Fakultas : Teknik
Jenis Karya : Skripsi
Demi pengembangan ilmu pengetahuan, menyetujui untuk memberikan kepada
Universitas Indonesia Hak Bebas Royalti Noneksklusif (Non-exclusive
Royalty-Free Right) atas karya ilmiah saya yang berjudul :
Pengaruh Laju Korosi Dengan Penambahan Teh Bunga Rosella Sebagai Inhibitor Organik Pada Baja Karbon Rendah Di Lingkungan NaCl 3.5 %
Dengan Metode Polarisasi
beserta perangkat yang ada (jika diperlukan). Dengan Hak Bebas Royalti Nonekslusif ini, Universitas Indonesia berhak menyimpan, mengalihmedia atau formatkan, mengelola dalam bentuk pangkalan data (database), merawat, dan
mempublikasikan tugas akhir saya selama tetap mencantumkan nama saya sebagai penulis atau pencipta dan sebagai pemilik Hak Cipta.
Demikian pernyataan ini saya buat dengan sebenarnya.
Dibuat di : Depok
Pada Tanggal : Juni 2011 Yang menyatakan
(,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,)
v
Universitas Indonesia
ABSTRAK
Nama : Arri Prasetyo
NPM : 0706268303
Program Studi : Teknik Metalurgi dan Material
Judul Skripsi : Pengaruh Laju Korosi Dengan Penambahan Teh Bunga Rosella Sebagai Inhibitor Organik Pada Baja Karbon Rendah Di Lingkungan NaCl 3.5 % Dengan Metode Polarisasi.
Perilaku inhibisi teh bunga rosella berdasarkan pengaruh perbedaan konsentrasi yang ditambahkan (2 ml, 4 ml, 6 ml dan 8 ml) pada baja karbon rendah di lingkungan NaCl 3.5 % telah diteliti dengan menggunakan metode polarisasi. Ekstrak ubi ungu dipilih sebagai green corrosion inhibitor karena mengandung senyawa antioksidan yang dapat menghambat laju korosi. Waktu pengujian sampel baja SPCC untuk semua penambahan konsentrasi adalah sama. Hasil penelitian menunjukkan teh bunga rosella merupakan inhibitor korosi yang efektif untuk baja karbon rendah di lingkungan korosif, karena dapat menghambat laju korosi dengan efisiensi sebesar 57.32 - 59.31 % dengan penambahan konsentrasi 2 - 8 ml teh bunga rosella.
Kata kunci :
Baja karbon rendah; Teh bunga rosella; Inhibitor organik; Polarisasi; Pengaruh konsentrasi
ABSTRACT
Name : Arri Prasetyo
NPM : 0706268303
Major : Metallurgy and Material Engineering
Title : Effect of Corrosion Rate With the addition of Rosella Tea For Organic Inhibitors on Low Carbon Steel in 3.5% NaCl Environment With Polarization Method.
Behavioral inhibition of rosella flower tea based on the effect of different concentrations were added (2 ml, 4 ml, 6 ml and 8ml) on low carbon steel sample in NaCl 3.5 % environment has been investigated using polarization method. rosella flower tea is selected as green corrosion inhibitors because they contain antioxidant compounds that can inhibit the corrosion rate. SPCC steel sample immersion time for all the additional concentrations are equal, ie for 5 days. Results showed rosella flower tea is effective corrosion inhibitor for low carbon steel in corrosion environment, because it can inhibit the corrosion rate with an efficiency of 57.32 - 59.31 % with the addition of rosella flower tea concentration of 2-8 ml.
Keywords :
Low carbon steel; rosella flower tea; organic inhibitors; polarization method; Effect of concentration
vii
Universitas Indonesia
DAFTAR ISI
HALAMAN JUDUL ... i
HALAMAN PERNYATAAN ORISINILITAS ... ii
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI TUGAS AKHIR UNTUK KEPENTINGAN AKADEMIS ... v
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR GAMBAR ... x
DAFTAR TABEL ... xi
DAFTAR RUMUS ... xii
DAFTAR LAMPIRAN ... xiv
1. PENDAHULUAN ... 1 1.1. Latar Belakang ... 1 1.2. Perumusan Masalah ... 4 1.3. Tujuan Penelitian ... 5 1.4. Ruang Lingkup ... 6 1.5. Sistematika Penulisan ... 6 2. TINJAUAN PUSTAKA ... 8 2.1. Pengertian Korosi ... 8 2.1.1. Definisi Korosi ... 8
2.2 Pengaruh pH Terhadap Korosi Aqueous Baja ... 11
2.2.1. Reaksi Elektrokimia Korosi ... 11
2.2.2. Korosi Air ... 11
2.3. Pengaruh Kadar NaCL Terhadap Laju Korosi ... 12
2.4. Pengaruh pH Tergadap Laju Korosi ... 13
2.5. Korosi pada Baja karbon Rendah ... 18
2.6. Pengaruh Oksigen Terlarut terhadap Korosi Aqueous Baja ... 19
2.8. Pengukuran Laju korosi dengan Metoda Polarisasi ... 26
3. METODOLOGI PENELITIAN ... 30
3.1. Diagram Alir Penelitian... 31
3.2. Alat dan Bahan ... 31
3.2.1. Alat ... 31
3.2.2. Bahan ... 32
3.3. Prosedur Penelitian... 32
3.3.1. Preparasi Sampel ... 32
3.3.2. Persiapan Larutan Rendam ... 33
3.3.3. Persiapan Inhibitor ... 34
3.3.4. Pengujian pH ... 35
3.3.5. Pengujian Polarisasi ... 35
3.3.6. Pengambilan data ... 36
4. HASIL PENGUJIAN DAN PEMBAHASAN ... 37
4.1. Hasil Pengujian ... 37
4.1.1. Hasil Pengamatan Visual Baja Karbon Rendah (Baja SPCC) ... 37
4.1.2. Hasil Pengujian Spectroscopy Sampel ... 37
4.1.3. Hasil Pengukuran pH Larutan ... 37
4.1.4. Hasil Corrosion rate Sofware Gamry 5.06 ... 38
4.2. Kurva Polarisasi ... 38
4.2.1. Kurva Polariasasi Baja karbon tanpa inhibitor... 38
4.2.2. Kurva Polariasasi dengan penambahan 0,67% inhibitor...39
4.2.3. Kurva Poliasasi dengan penambahan 1,33% inhibitor ... 40
4.2.4. Kurva Polariasasi dengan penambahan 2% inhibitor ... 41
4.2.5. Kurva Polariasasi dengan penambahan 2,67% inhibitor... 42
4.2.6. Kurva Polarisasi Keseluruhan ... 43
4.3. Pembahasan ... 43
4.3.1. Pengujian Spectrocopy sampel ... 43
4.3.2. Pengamatan Visual tanpa dan dengan Penambahan Inhibitor ... 44
4.3.3. Pengaruh pH Larutan Terhadap Laju Korosi ... 44
ix
Universitas Indonesia
4.3.4. Penurunan Laju Korosi ... 45
4.3.5. Perbandingan Dengan Inhibitor yang Berbeda ... 47
4.3.6. Perbandingan Variabel Temperatur yang Berbeda ... 48
4.3.7. Mekanisme Pengahambatan Proses Korosi ... 51
4.3.8. Efisiensi inhibitor ... 52
5. KESIMPULAN ... 54
DAFTAR PUSTAKA ... 55
LAMPIRAN ... 58
Gambar 2.1. Pengaruh kadar ion Cl- terhadap laju korosi[5] ... 13
Gambar 2.2. Diagram pourbaix 25 C ... 14
Gambar 2.3 Pengaruh pH pada korosi aqueous baja, menggunakan HCl dan NaOH untuk mengontrol pH di dalam air yang mengandung oksigen terlarut[21}.17 Gambar 2.4. Pengaruh oksigen terlarut pada korosi baja karbon rendah di air destilasi (temperatur 25oC dan perendaman 48 jam) yang mengandung 165 ppm CaCl2[15] ……….20
Gambar 2.5 Oksigen sebagai depolarizer[20] ... 21
Gambar 2.6 Pembentukan Fe(OH)3 yang sukar larut[20] ... 21
Gambar 2.7. Pengaruh Penambahan inhibitor anodik pada suatu material [19] .. 25
Gambar 2.8 Pengaruh penambahan inhibitor katodik pada material [19] ... 28
Gambar 2.9. Kurva aplikasi mixed potencial dengan hubungan arus-potensial dan transportmassa terkontrol pada rekasi katodik[26]...29
Gambar 3.1. Diagram Alir Penelitian ... 30
Gambar 3.2. Sampel Polarisasi ... 33
Gambar 3.3. Persiapan Larutan Uji Polarisasi ... 34
Gambar 3.4. Ekstrak the rosella ... 34
Gambar 3.5. Pengujuan pH pada larutan ... 35
Gambar 3.6. Uji Polarisasi ... 36
Gambar 4.1. Sampel Polarisasi ... 37
Gambar 4.2. Kurva Polarisasi tanpa inhibitor ... 38
Gambar 4.3. Kurva Polarisasi dengan penambahan 0.67 % inhibitor ... 39
Gambar 4.4. Kurva Polarisasi dengan penambahan 1.33 % inhibitor ... 40
Gambar 4.5. Kurva Polarisasi dengan penambahan 2 % inhibitor ... 41
Gambar 4.6. Kurva Polarisasi dengan penambahan 2.67 % inhibitor ... 39
Gambar 4.8. Perubahan pH pada setiap penambahan inhibitor ... 43
Gambar 4.9. Grafik perubahan laju korosi dengan variabel inhibitor ... 46
Gambar 4.10. Grafik perbandingan laju korosi ubi ungu dan rosella ... 48
Gambar 4. 11. Grafik perubahan laju korosi pada temperatur yang berbeda ... 50
Gambar 4.12. Ilustrasi terbentuknya lapisan pelindung24 ... 51
xi
Universitas Indonesia
DAFTAR TABEL
Tabel 2.1. Produk korosi pada baja... 18
Tabel 4.1. Komposisi baja hasil pengujian spectroscopy ... 37
Tabel 4.2. hasil pengukuran pH ... 37
Tabel 4.3 Data hasil pengukuran laju korosi ... 38
Tabel 4.4. Data tafel polarisasi tanpa inhibitor ... 38
Tabel 4.5. Data tafel polarisasi dengan penambahan 0,67 % inhibitor ... 39
Tabel 4.6. Data tafel polarisasi dengan penambhan 1,33 % inhibitor ... 40
Tabel 4.7. Data tafel polarisasi dengan penambahan 2 % inhibitor ... 41
Tabel 4.8. Data tafel polarisasi dengan penambahan 2,67 % inhibitor ... 42
Tabel 4.9. laju korosi pada inhibitor wine pada NaCl 3.5 %...47
Tabel 4.10.Data hasil penambahan inhibitor teh bunga rossela pada lingkungan NaCl 3.5% pada temperatur 40o C ...49
Tabel 4.11. Tabel efisiensi inhibitor...52
Ket : ia = exchange current density awal anodik io = exchange current density akhir anodik β = Konstanta
ήc = Polarisasi
2. Persamaan 2.2.2
Ket :
io = exchange current density awal katodik ic = exchange current density akhir katodik β = Konstanta
ήc = Polarisasi
3. Persamaan 2.2.3
Ket : D = berat jenis (g/cm3)
icor = rapat arus korosi (μA/cm2) M = berat ekivalen (g/mol.equ)
4. Persamaan 3.1
Efisiensi (%) = Laju korosi tanpa inhibitor – Laju korosi dengan inhibitor x 100% Laju korosi tanpa inhibitor
xiii
Universitas Indonesia
DAFTAR LAMPIRAN
LAMPIRAN 1. Data tafel 0 ml the rosella dalam excel ... 57
LAMPIRAN 2. Data tafel 2 ml the rosella dalam excel ... 60
LAMPIRAN 3. Data tafel 4 ml the rosella dalam excel ... 65
LAMPIRAN 4. Data tafel 6 ml the rosella dalam excel ... 70
LAMPIRAN 5. Data tafel 8 ml the rosella dalam excel ... 74
BAB 1 PENDAHULUAN
1.1. Latar Belakang
Korosi merupakan suatu fenomena yang kerap dijumpai dalam kehidupan sehari-hari, tidak terkecuali di bidang industri. Korosi merupakan masalah yang sering dihadapi dan menimbulkan kerugian materi yang cukup besar, terutama dalam segi biaya dan keselamatan. Secara langsung, korosi mengharuskan biaya tinggi untuk penggantian alat-alat yang rusak karena terkorosi. Secara tidak langsung, korosi menimbulkan pencitraan buruk terhadap perusahaan yang beroperasi dan berdampak pada turunnya nilai perusahaan di mata pasar.
Korosi adalah hasil reaksi kimia merusak antara paduan logam atau logam dan lingkungannya[1]. Korosi dapat juga diartikan sebagai serangan yang merusak logam karena logam bereaksi secara kimia atau elektrokimia dengan lingkungan. Ada definisi lain yang mengatakan bahwa korosi adalah kebalikan dari proses ekstraksi logam dari bijih mineralnya. Contohnya, bijih mineral logam besi di alam bebas ada dalam bentuk senyawa besi oksidaatau besi sulfida, setelah diekstraksi dan diolah, akan dihasilkan besi yang digunakan untuk pembuatan baja atau baja paduan. Selama pemakaian, baja tersebut akan bereaksi dengan lingkungan yang menyebabkan korosi (kembali menjadi senyawa besi oksida). Korosi atau secara awam lebih dikenal dengan istilah pengkaratan merupakan fenomena kimia padabahan-bahan logam di berbagai macam kondisi lingkungan. Penyelidikan tentang sistem elektrokimia telah banyak membantu menjelaskan mengenai korosi ini, yaitu reaksi kimia antara logam dengan zat-zat yang ada di sekitarnya atau dengan partikel-partikel lain yangada di dalam matrik logam itu sendiri. Jadi dilihat dari sudut pandang kimia, korosi pada dasarnya merupakan reaksi logam menjadi ion pada permukaan logam yang kontak langsung dengan lingkungan berair dan oksigen.
2
Universitas Indonesia Korosi terjadi karena tiga faktor. Pertama, lingkungan yang korosif mendukung terjadinya korosi dimana akan terjadi reaksi kimia atau reaksi korosi antara material dengan lingkungan korosif ataupun antara material dengan material yang lain dalam lingkungan yang korosif. Contoh dari lingkungan ini adalah lingkungan udara bebas, air laut, dan tanah. Kedua, adanya katoda dan anoda juga mempengaruhi terjadinya korosi yang menghasilkan reaksi elektrokimia, yakni oksidasi dan reduksi. Pengertian anoda adalah suatu material yang mengalami reaksi oksidasi dan mengalami kehilangan material (loss material) karena mempunyai potensial yang lebih negatif jika diukur dengan dengan penghitungan potensial. Katoda adalah suatu material yang mengalami reaksi reduksi karena mempunyai potensial yang lebih positif jika diukur dengan perhitungan potensial. Ketiga, adanya material sebagai penghantar elektron yang rentan terhadap korosi.
Umumnya terdapat 4 metode dasar dalam pengendalian dan perlindungan korosi secara umum, yaitu :
1. Proteksi katodik (cathodic protection)
Proteksi yang yang melindungi anodanya dengan memperlakukannya sebagai katoda. Proteksi ini meliputi metode anoda korban dan pemberian arus tanding.
2. Pelapisan (coating)
Proteksi dengan mengisolasi permukaan logam dari kontak langsung dengan lingkungannya sehingga proses korosi dapat diminimalisir. Proteksi ini umumnya akan melindungi bagian permukaan dari kontak langsung.
3. Inhibitor
Inhibitor adalah proses pengendalian korosi dengan penambahan sedikit zat kimia pada elektrolitnya sehingga akan mengubah lingkungan kerja menjadi tidak korosif.
4. Pemilihan material dan desain (material selection and design)
Pengendalian dengan metode ini adalah dengan melakukan pemilihan material yang tepat sesuai dengan kondisi lingkungan kerja sehingga
proses korosi dapat diminimalisir. Selain itu melalui desain – desain yang tepat sesuai dengan aplikasi dilapangan.
Inhibitor korosi merupakan suatu zat kimia yang bila ditambahkan kedalam suatu lingkungan tertentu, dapat menurunkan laju penyerangan lingkungan itu terhadap suatu logam[2]. Inhibitor memiliki beberapa mekanisme kerja diantaranya adalah
1) Pembentukan lapisan tipis pada permukaan dengan ketebalan beberapa molekul inhibitor pada permukaan logam karena permukaan logam mengadsorbsi inhibitor
2) Melalui pengaruh lingkungan atau ph dari lingkungan menyebabkan inhibitor mengendap pada permukaan logam dan teradsorpsi sehingga membentuk lapisan yang melindungi dari serangan korosi
3) Inhibitor melakukan korosi terlebih dahulu terhadap logam dan menghasilkan suatu zat kimia dan mengalami proses adsorpsi pada zat tersebut dan menghasilkan suatu lapisan pasif
4) Penghilangan konstituen yang agresif dari lingkungannya.
Bahan atau zat – zat kimia yang memiliki potensial untuk dikembangkan sebagai inhibitor sangat banyak namun dari kalangan industri masih tetap menggunakan dan mempercayai inhibitor sintetis. Inhibitor sintetis masih dipercaya karena memiliki kemampuan untuk melindungi dari korosi yang sangat baik serta mudah didapat namun dibalik kelebihan tersebut masih terdapat kekurangan dimana jenis inhibitor ini memiliki bahaya keamanan dan kesehatan dari penggunaan secara terus menerus.
Sudah saatnya kita “kembali ke alam”, itu merupakan istilah yang saat ini hangat di dengar oleh masyarakat. Istilah ini dikampanyekan untuk mengajak masyarakat menggunakan bahan – bahan dari alam untuk berbagai bidang termasuk inhibitor. Inhibitor yang berasal langsung dari alam disebut dengan inhibitor organik dimana aman untuk kesehatan dan juga untuk lingkungan.
Inhibitor ekstrak bahan alam mengandung atom N, O, P, S, dan atom-atom yang memiliki pasangan elektron bebas[3] Atom ini akan berfungsi sebagai
4
Universitas Indonesia ligan dalam pembentukan senyawa kompleks dimana senyawa kompleks dapat membentuk lapisan untuk menghambat proses oksidasi[4]. Dari beberapa hasil penelitian seperti Fraunhofer (1996), ekstrak daun tembakau, teh, dan kopi dapat efektif sebagai inhibitor pada sampel logam besi, tembaga, dan alumunium dalam medium larutan garam. Keefektifan ini diduga karena ekstrak daun tembakau, teh, dan kopi memiliki unsur nitrogen yang berfungsi sebagai pendonor elektron terhadap logam Fe2+ untuk membentuk senyawa kompleks. Sudrajat dan Ilim (2006) juga mengemukakan bahwa ekstrak daun tembakau, lidah buaya, daun pepaya, daun teh, dan kopi dapat efektif menurunkan laju korosi mild steel dalam medium air laut buatan yang jenuh CO2.
Untuk mendapatkan tujuan dari penelitian ini, maka diadakan pengujian dalam skala laboratorium dengan menggunakan material baja low carbon dalam lingkungan NaCl 3.5 % dengan mengguanakan inhibitor ektrak bunga rosella yang mengandung zat anti oksidan Antosianin yang diasumsikan dapat menekan laju korosi.
1.2. Perumusan Masalah
Korosi merupakan masalah penting dan cukup besar pada berbagai bidang terutama pada bidang industri minyak dan gas. Korosi yang terjadi pada bidang perminyakan biasanya terjadi pada daerah laut. Air laut merupakan lingkungan yang korosif yang dapat merusak atau menurunkan kuatias dari material. Peralatan yang dapat rusak akibat aplikasi di air laut seperti pipa elbow, suction pump, dll. Biasanya pada minyak mentah memiliki kontaminasi yang ikut terbawa salah satunya air laut yang ikut masuk ke pipa. Air laut ini dapat menyebabkan korosi pada pipa elbow ini yang akhirnya dapat menyebabkan kebocoran dan mengganggu produksi.
Pencegahan yang dilakukan dari dalam pipa yaitu penggunaan inhibitor kedalam pipa tersebut. Inhibitor adalah suatu zat kimia yang dapat mengubah kondisi lingkungan kerja dan ditambahkan dalam jumlah sedikit baik secara kontinyu maupun periodik.
Inhibitor yang banyak digunakan saat ini merupakan inhibitor anorganik atau sintetis. Inhibitor sintetis memiliki mekanisme yang sama yaitu membentuk senyawa kompleks seperti nitrit, kromat, fosfat, urea, fenilalanin, inidazolin, dan senyawa amina. Namun bahan sintetis merupakan berasal dari bahan kimia buatan yang memiliki efek samping akan bahayanya. Selain itu dari faktor ekonomis, bahan – bahan inhibitor sintetis harganya relatif mahal dan tidak ramah lingkungan. Inhibitor anorganik jarang dipakai untuk sistem proses yang berhubungan langsung dengan manusia seperti pengolahan air bersih, sistem pendingin, dll. Pada percobaan pada kali ini digunakan air laut buatan dimana air laut buatan ini memiliki agresifitas yang lebih besar dibandingkan dengan air laut alami.Hal ini karena pada air laut alami masih terdapat ion Mg2+ dan Ca2+.Keberadaan ion ini bisa memperkecil laju korosi akibat kemampuannya dalam membentuk lapisan CaCO3 dan Mg (OH)2 dipermukaan material hasil dari reaksi katodik oksigen dipermukaan logam.
Pengujian korosi dengan inhibitor ini menggunakan teknik tahanan polarisasi (Polarisation Resistance) dimaksudkan untuk melihat ketahanan sampel terhadap oksidasi ketika diberi potensial luar. Tahanan polarisasi merupakan metoda yang cepat untuk menentukan laju korosi tanpa merusak logam dan hasil pengukuran lebih akurat dan inhibitor yang akan diteliti adalah inhibitor ekstrak dari bunga rosella yang merupakan tumbuhan yang kaya akan zat anti-oksidan. Pemilihan inhibitor teh bunga rosella ini didasarkan karena penggunaannya yang aman, mudah didapat, bersifat biodegradable, murah, dan ramah lingkungan.
1.3. Tujuan Penelitian
Tujuan dari penelitian ini adalah:
1. Mengetahui pengaruh bunga rosella sebagai inhibitor organik pada lingkungan air laut
2. Mengetahui efisiensi bunga rosella sebagai suatu inhibitor organik terhadap variabel konsentrasi dari inhibitor.
6
Universitas Indonesia
1.4. Ruang Lingkup Penelitian
1. Material yang digunakan adalah baja low carbon dengan kondisi awal yang dianggap sama untuk variabel volume inhibitor uji yang berbeda;
2. Perhitungan corrosion rate menggunakan metode polarisasi yaitu dengan software CMS 100.
3. Luas permukaan sampel polarisasi adalah ± 1 cm2 sesuai dengan standar ASTM G59
4. Inhibitor organik yang digunakan adalah ekstrak teh bunga rosella dengan variasi volume 2 ml, 4 ml, 6 ml, dan 8ml.
5. Larutan yang digunakan adalah NaCl 3,5 % (kondisi air laut).
1.5. Sistematika Penulisan
Dalam penulisan ini, sistematika penulisan disusun agar konsep dalam penulisan skripsi menjadi berurutan sehingga akan didapat kerangka alur pemikiran yang mudah dan praktis. Sistematika tersebut dapat diartikan dalam bentuk banyak bab-bab yang saling berkaitan dengan yang lain. Bab-bab tersebut diantaranya :
Bab 1 Pendahuluan
Membahas mengenai latar belakang penulisan, perumusan masalah, tujuan penelitian, ruang lingkung penelitian, dan sistematika penulisan.
Bab 2 Teori Penunjang
Membahas mengenai teori korosi secara umum baik pengertian dan jenis – jenis korosi perlindungan terhadap korosi, polariasi, aspek dan teoritis inhibitor, dan korosi pada lingkungan air laut
Bab 3 Metodologi Penelitian
Membahas mengenai diagram alir penelitian, alat dan bahan yang diperlukan untuk penelitian, dan prosedur penelitian.
Bab 4 Hasil Penelitian dan Pembahasan
Membahas mengenai pengolahan data yang didapat dari penelitian serta menganalisa hasil penelitian bai berupa angka, gambar, dan grafik, serta membandingkan dengan teori dan literatur
Bab 5 Penutup
Membahas mengenai kesimpulan dari hasil penelitian yang telah dilakukan serta saran-saran yang bisa dimanfaatkan berdasarkan hasil penelitian.
8 Universitas Indonesia
BAB 2
TEORI PENUNJANG
2.1 Pengertian Korosi
2.1.1 Definisi Korosi
Korosi adalah hasil reaksi kimia merusak antara paduan logam atau logam dan lingkungannya[1]. Korosi dapat juga diartikan sebagai serangan yang merusak logam karena logam bereaksi secara kimia atau elektrokimia dengan lingkungan. Ada definisi lain yang mengatakan bahwa korosi adalah kebalikan dari proses ekstraksi logam dari bijih mineralnya. Contohnya, bijih mineral logam besi di alam bebas ada dalam bentuk senyawa besi oksida atau besi sulfida, setelah diekstraksi dan diolah, akan dihasilkan besi yang digunakan untuk pembuatan baja atau baja paduan. Selama pemakaian, baja tersebut akan bereaksi dengan lingkungan yang menyebabkan korosi (kembali menjadi senyawa besi oksida). Korosi atau secara awam lebih dikenal dengan istilah pengkaratan merupakan fenomena kimia padabahan-bahan logam di berbagai macam kondisi lingkungan. Penyelidikan tentang sistem elektrokimia telah banyak membantu menjelaskan mengenai korosi ini, yaitu reaksi kimia antara logam dengan zat-zat yang ada di sekitarnya atau dengan partikel-partikel lain yang ada di dalam matrik logam itu sendiri. Jadi dilihat dari sudut pandang kimia, korosi pada dasarnya merupakan reaksi logam menjadi ion pada permukaan logam yang kontak langsung dengan lingkungan berair dan oksigen
Jenis-jenis korosi dapat diklasifikasikan menurut mekanisme terjadinya korosi, jenis-jenis tersebut antara lain[1] :
1. Korosi Atmosferis
Korosi ini terjadi akibat proses elektrokimia antara dua logam yang berbeda potensial dan langsung berhubungan dengan udara terbuka 2. Korosi Merata
Korosi ini adalah korosi yang terjadi secara merata dipermukaan. Bentuk korosi ini mudah diprediksi karena kecepatan atau laju korosi di setiap permukaan adalah sama.
Korosi ini adalah korosi yang terjadi secara merata dipermukaan. Bentuk korosi ini mudah diprediksi karena kecepatan atau laju korosi di setiap permukaan adalah sama.
1. Korosi Galvanis
Korosi ini terjadi akibat dua logam atau lebih yang memiliki potensial reduksi berbeda dihubungkan atau terhubung. Menurut deret volta / deret galvanik, material yang memiliki potensial reduksi yang lebih kecil akan mengalami korosi.
2. Crevice corrosion
Korosi ini terjadi karena terdapat celah antara 2 logam sejenis yang digabungkan. Sehingga terbentuk kadar oksigen yang berbeda diantara area di dalam celah dan diluarnya, sehingga akan menyebabkan korosi. 3. Pitting Corrosion
Korosi yang terjadi akibat rusaknya lapisan pasif di satu titik karena pengaruh dari lingkungan korosif. Contoh lingkungan korosif tersebut seperti pada air laut. Air laut yang mengandung Ion Cl- akan menyerang lapisan pasif dari logam. Ketika terjadi permulaan pitting pada satu titik di permukaan lapisan pasif, maka ion Cl- akan terkonsentrasi menyerang pada permukaan lapisan pasif yang terjadi pitting terlebih dahulu sehingga pitting akan menjadi dalam. Pecahnya lapisan pasif mengakibatkan gas hidrogen dan oksigen mudah masuk dan mengkorosikan material tersebut.
4. Stress Corrosion Cracking (SCC)
Korosi terjadi karena adanya tegangan beban tarik pada suatu material di lingkungan korosif. Logam pertama-tama akan terkena korosi pada suatu titik, dan kemudian akan terbentuk retakan. Retakan ini akan menjalar dan dapat menyebabkan kegagalan pada komponen tersebut. Sifat yang khas dari korosi ini adalah crack yang berbentuk akar serabut.
5. Corrosion Fatigue Cracking (CFC)
Korosi terjadi karena adanya tegangan beban fatik pada suatu material di lingkungan korosif. Hal ini sewaktu-waktu akan menyebabkan material
10
Universitas Indonesia tersebut akan terkena korosi pada satu titik yang menyebabkan crack yang menjalar berbentuk tidak serabut.
6. Korosi Erosi
Korosi yang terjadi karena adanya fluida korosif yang mengalir pada permukaan material. Fluida tersebut dapat berupa fluida liquid maupun gas dengan kecepatan tinggi. Karena kecepatan tinggi dari fluida korosif yang mengalir, terjadi efek keausan mekanis atau abrasi. Lapisan pasif atau pun coating pada permukaan material akan terkikis, sehingga kemungkinan terjadinya korosi semakin besar.
7. Hydogen Induced Cracking (HIC)
Korosi terjadi karena adanya tegangan internal pada suatu material karena adanya molekul-molekul gas hidrogen yang berdifusi ke dalam struktur atom logam. Hidrogen dapat terbentuk akibat reduksi H2O ataupun dari asam. Penetrasi hidrogen ini akan menyebabkan korosi pada material, dan kemudian terjadi perpatahan getas.
8. Korosi batas butir
Korosi terjadi akibat chrome pada sekitar batas butir membentuk presipitat chromium karbida di batas butir. Kemudian akan terjadi crack yang menjalar sepanjang batas butir.
Dalam mekanisme korosi ada 4 komponen penting yang harus ada untuk terjadinya korosi yaitu[5]:
1. Anoda, merupakan bagian logam yang berfungsi sebagai elektroda, dimana terjadi reaksi anodik. Reaksi anodik adalah reaksi yang menghasilkan elektron.
M → M+n
+ ne- ( n adalah valensi logam )
2. Katoda, merupakan elektroda yang mengalami reaksi katodik yang mengkonsumsi electron hasil dari reaksi anodik.
3. Penghantar listrik, dimana diantara katoda dan anoda harus terdapat kontak listrik agar arus dalam sel korosi dapat mengalir.
4. Elektrolit, merupakan suatu media yang bersifat menghantarkan arus listrik seperti air dan tanah.
2.2. Mekanisme Korosi Dalam Lingkungan Aqueous
2.2.1 Reaksi Elektrokimia Korosi
Pada reaksi korosi,reaksi elektrokimia memegang peranan yang sangat penting,karena dengan reaksi ini bisa mengakibatkan adanya proses transfer elektron yang membuat rekasi elektrokimia bisa terjadi. Reaksi elektrokimia meliputi reaksi anodik dan reaksi katodik.Reaksi tersebut digambarkan dibawah ini:
Reaksi Anodik : M Mn++ne- (1)
Reaksi Katodik : Mn++ ne- M (2) Reaksi oksidasi adalah reaksi yang menghasilkan pelepasan elektron dan
berakibat terbentuknya ion-ion positif. Logam yang mengalami reaksi ini disebut sebagai anoda. Reaksi oksidasi pada logam M adalah[5] :
M → M z+
+ ze- (reaksi pembentukan ion-ion positif logam)
Reaksi reduksi adalah reaksi yang menghasilkan penangkapan elektron. Logam yang mengalami reaksi ini disebut sebagai katoda. Reaksi reduksi yang sering terjadi adalah[5] :
2 H+ + 2e → H2 (reaksi pembentukan hidrogen)
O2 + 4H+ + 4e → 2 H2O (reaksi reduksi oksigen dalam larutan asam)
O2 + 2 H2O + 4e → 4 OH− (reaksi reduksi oksigen dalam larutan basa/netral)
M3+ + e → M2+ (reaksi reduksi logam)
M+ + e → M (deposisi logam)
2.2.2 Korosi Air
Korosi dalam air sangat dipengaruhi oleh beberapa faktor, yang utama di antaranya: kadar dan jenis garam, tekanan (mempengaruhi kelarutan gas-gas dalam air), kelarutan oksigen atau gas-gas reaktif, pergerakan/kecepatan aliran, pH, dan temperatur. Beberapa komponen tersebut ada yang saling menguatkan dan ada pula yang saling melemahkan. Proses korosi sangat tergantung pada ada atau tidaknya elektrolit sebagai media penghantar arus dan pertukaran ion antara daerah anodik dengan katodik [1].
12
Universitas Indonesia Air dapat menjadi media elektrolit yang kuat/agresif, jika mengandung ion-ion reduktan dan oksidan, namun dapat pula menjadi media elektrolit yang tidak agresif. Sifat air sebagai pelarut universal menjadikan material ini mudah untuk menjadi korosif jika terdapat partikel ionik ataupun gas yang terlarut di dalamnya.
Korosi dalam air sangat dipengaruhi oleh beberapa faktor, yang utama di antaranya: temperatur, kadar dan jenis garam, tekanan (mempengaruhi kelarutan gas-gas dalam air), kelarutan oksigen atau gas-gas reaktif, pergerakan/kecepatan aliran, dan PH. Beberapa komponen tersebut ada yang saling menguatkan dan ada pula yang saling melemahkan[6].
2.3. Pengaruh Kadar NaCL Terhadap Laju Korosi
Garam dalam larutan akan terurai menjadi anion dan kation pembentuknya, sehingga dalam larutan tersebut akan terbentuk ion-ion yang kekurangan dan kelebihan elektron. Ion-ion tersebut yang menjadikan larutan menjadi mudah untuk menghantarkan arus listrik[5]. Oleh karena itu, nilai konduktifitas suatu larutan akan berbanding lurus dengan nilai konsentrasi garam yang terlarut. Proses korosi dalam satu sisi merupakan proses elektrokimia yang bergantung kepada konduktifitas dari elektrolit tempat dia terjadi. Air demineral memiliki konduktifitas larutan yang lebih rendah dibandingkan air laut[7], sehingga pada umumnya laju korosi logam dalam air laut lebih tinggi daripada air demineral. Sebagaimana disebutkan sebelumnya kelarutan oksigen dalam air mempengaruhi proses korosi logam, namun dengan adanya ion-ion terlarut lainnya dalam air tersebut, kelarutan oksigen akan semakin berkurang. Sebagai contoh, semakin tinggi ion Cl- akan semakin rendah kelarutan oksigen dalam fluida tersebut. Pada beberapa literatur disebutkan bahwa kelarutan optimum oksigen dalam air untuk terjadinya proses korosi berada pada konsentrasi ion Cl 3%. Kondisi tersebut ditunjukkan pada Gambar 2.3 dimana suatu percobaan membuktikan bahwa laju korosi optimum baja karbon berada pada konsentrasi NaCl sebesar 3 – 3.5% berat.
Gambar 2.1. Pengaruh kadar ion Cl- terhadap laju korosi[5].
Pada beberapa jenis logam yang mengalami pembentukan lapisan pasif oksida, ion Cl- dapat menyebabkan proses korosi lokal, seperti korosi sumuran (pitting). Ion klorida dapat menyebabkan pitting pada baja karbon di atas pH 10 dan 25°C[8].
2.4. Pengaruh pH pada Terhadap Laju Korosi
Salah satu pengaruh lingkungan pada korosi baja yaitu pH. Perubahan pH suatu larutan akan menimbulkan kecenderungan korosi yang berbeda-beda pada potensial tertentu. Semakin kecil pH maka semakin korosif lingkungan, sehingga logam akan lebih mudah terkorosi.
Menurut Kamus Inggris Compact Oxford, "p" adalah singkatan kata dari bahasa Jerman untuk potenz, "kekuasaan", sehingga pH adalah singkatan untuk "kekuatan hidrogen"[20]. Sebuah pH lebih tinggi berarti ada lebih sedikit ion hidrogen bebas, dan bahwa perubahan satu unit pH mencerminkan sepuluh kali lipat perubahan konsentrasi ion hidrogen[9].
Kondisi pH rendah pada lingkungan asam jelas mempercepat korosi dengan menyediakan pasokan berlimpah ion hidrogen bebas. Meskipun air bahkan benar-benar murni mengandung beberapa ion hidrogen bebas, karbon dioksida bebas dalam air dapat memperbanyak konsentrasi ion hidrogen berkali-kali. Pengaruh pH pada proses korosi dapat dilihat pada Diagram Pourbaix (gambar 2.4) berikut[9]:
14
Universitas Indonesia Gambar 2.2. Diagram Pourbaix Fe pada 25˚C
Pada Diagram Pourbaix diatas, terdapat daerah-daerah yang terdiri dari tiga bagian, yaitu :
Daerah imun yaitu daerah dimana logam tetap dalam keadaannya untuk logam murni dan logam Fe tidak mengalami korosi (wilayah berwarna abu-abu).
Daerah korosi (aktif) yaitu dimana logam Fe akan membentuk ion logam yang larut dalam elektrolit (wilayah berwarna putih).
Daerah pasif yaitu daerah dimana logam Fe akan terkorosi secara lambat karena pada permukaan logam Fe akan membentuk lapisan pasif yang menghambat laju korosi (wilayah berwarna orange dan hitam).
Adapun sifat karakteristik logam Fe pada masing-masing kondisi lingkungan dengan tingkat keasaman (pH) yang berbeda adalah sebagai berikut :
Pada lingkungan pH rendah (asam), logam Fe akan berada pada kondisi imun. Tetapi jika logam Fe berada pada nilai potensial yang tinggi maka logam Fe memiliki kecenderungan untuk
terkorosi secara merata membentuk ion Fe2+ dan ion Fe3+. Reaksi yang terjadi adalah :
Reaksi Oksidasi (Anoda) : Fe Fe2+ + 2e -Reaksi Reduksi (Katoda) : 2H+ + 2e- H2
Pada lingkungan pH tinggi (basa), logam Fe akan berada pada daerah imun, yaitu terbentuk lapisan pasif berupa Fe2O3. Tetapi terdapat pula daerah aktif terkorosi dimana akan terbentuk HFeO2 -Reaksi Oksidasi (Anoda) : Fe Fe2+ + 2e
-Reaksi Reduksi (Katoda) : O2 + H2O + 2e- 2OH
-Pada lingkungan pH Netral, Logam Fe akan berada dalam daerah imun dan membentuk lapisan pasif berupa Fe2O3 dan berupa Fe3O4. Tetapi pada daerah ini, kemungkinan logam Fe berada pada daerah aktif terkorosi masih ada. Pada daerah pasif material tersebut tetap terkorosi, tetapi laju korosinya sangat lambat akibat adanya lapisan pasif.
Biasanya nilai pH pada air (elektrolit) dapat berbeda dengan pH aktual di permukaan logam tergantung dari reaksi yang terjadi di permukaan. Reduksi oksigen akan menghasilkan ion OH- yang dapat meningkatkan nilai pH, namun di bawah deposit produk korosi, nilai pH dapat ditekan. Ketika pH air (elektrolit) moderate (pH = 5), korosi uniform merupakan serangan dominan yang akan semakin meningkat dengan penurunan pH. Pada pH 4 atau < 4, maka lapisan oksida protektif, terlarut dan terekspos di permukaan metal. Korosi akan semakin cepat terjadi karena kadar oksigen terlarut berkurang pada permukaan logam di pH rendah. Kedua reaksi yaitu evolusi hidrogen dan reduksi oksigen menjadi reaksi katodik. Pada peningkatan pH di atas 4, besi oksida terpresipitasi dari larutan ke bentuk deposit. Korosi uniform secara tiba-tiba menurun, namun di bawah deposit mulai terbentuk Fe2O3 di permukaan metal. Reaksi anodiknya adalah sebagai berikut[12].
1. Fe + 3H2O Fe(OH)3 + 3H+ + 3e-
2. Fe + 2H2O FeO(OH) + 3H+ +3e
-3. Fe + 3/2H2O Fe2O3 + 3H+ + 3e
16
Universitas Indonesia Deposit tersebut bersifat sebagai penahan difusi oksigen ke permukaan logam. Pada peningkatan pH, deposit oksida besi berubah dari sedikit bersifat adherent di pH 6 menjadi keras dan kuat pada pH > 8. Pada kondisi asam kuat (pH < 4), besi atau baja karbon memperlihatkan ketergantungan kompleks laju korosi terhadap pH. Pada pH rendah, mekanisme korosi tidak hanya tergantung konsentrasi ion hidrogen, tetapi juga kehadiran ion-ion atau komponen larutan lainnya (komponen yang ada dalam larutan)[12].
Mekanisme korosi baja pada HCl yaitu laju korosi tinggi pada semua konsentrasi asam di pH < 3. Adanya ion klorida berfungi mempercepat laju korosi. Disamping itu, laju korosi meningkat dengan adanya konsentrasi ion hidrogen (terjadi penurunan pH). Tinggi rendahnya laju korosi yang terjadi berdasarkan variabel pH untuk baja yaitu, laju korosi meningkat pada pH yang sangat rendah, laju korosi tidak tergantung pH pada range pH netral, laju korosi menurun dengan peningkatan pH, dan akhirnya laju korosi meningkat kembali pada pH yang sangat rendah[12]. Pengaruh pH terhadap korosi pada baja di lingkungan air teraerasi terlihat pada Gambar 2.2. Reaksi anodik pada baja karbon yaitu :
Fe Fe2+ + 2e–
Reaksi tersebut berlaku untuk semua pH. Namun, laju korosi bervariasi dan cenderung berubah pada reaksi reduksi di katodik. Pada intermediate, range pH 4-10, deposit besi oksida porous muncul di sekeliling permukaan dan dipertahankan sekitar pH 9.5. Laju korosi mendekati konstan dan ditentukan dengan difusi pelarutan oksigen uniform melewati deposit pada intermediate range pH tersebut. Pada permukaan metal di bawah deposit, oksigen direduksi secara katodik dengan reaksi di larutan asam sebagai berikut[1]:
O2 + 2H2O + 4e- 4OH
Gambar 2.3 Pengaruh pH pada korosi aqueous baja, menggunakan HCl dan NaOH untuk mengontrol pH di dalam air yang mengandung oksigen terlarut[21]
Difusi pelarutan oksigen, mengontrol laju korosi pada level konstan di range pH 4-10. Dengan demikian, variabel metalurgi yang mempengaruhi reaksi anodik baja karbon tidak memberikan dampak terhadap laju korosi. Hal ini tidak berlaku untuk pH < 4, dimana reaksi katodik H+ berada di bawah kondisi aktivasi. Fasa karbida memperlihatkan overvoltage yang rendah (laju korosi lebih tinggi) untuk reduksi H+. Pada larutan yang lebih asam dengan pH < 4 (ada oksigen terlarut), oksida akan terlarut dan proses korosi akan meningkat, mengarah pada reduksi H+, reaksinya sebagai berikut[1] :
2H+ + 2e- H2
Ketiadaan deposit di permukaan metal dapat meningkatkan akses pelarutan oksigen, sehingga menyebabkan laju korosi baja meningkat. Pelarutan oksigen merupakan reaksi reduksi katodik dalam asam dengan penambahan oksigen terlarut berdasarkan reaksi yaitu[1] :
O2 + 4H+ + 4e- 2H2O
Sedangkan pada pH > 10, laju korosi rendah mengarah ke pembentukan film besi oksida dengan adanya pelarutan oksigen. Sedangkan pada pH di atas 14 tanpa adanya oksigen yang terlarut, laju korosi kemungkinan meningkat karena ion ferrite HFeO2- terbentuk[1]. Pada range pH 4-10, laju korosi tidak tergantung oleh pH yang dikontrol difusi oksigen. Pada pH < 4 evolusi hidrogen merupakan faktor pengontrol laju korosi. Sedangkan pada pH > 10,
Evolusi H2 mulai
18
Universitas Indonesia laju korosi menurun karena pasivasi di permukaan yang disebabkan oleh adanya oksigen dan alkalis[13].
Poin penting bahwa pH berpengaruh terhadap korosi baja karbon pada pH rendah bukan hal sederhana. Hal tersebut dikarenakan persamaan kinetik berhubungan dengan laju korosi. Selain itu, misalnya adanya ion tambahan seperti ion Cl- kemungkinan meningkatkan timbulnya localized attack contohnya pitting, crevice corrosion, dan SCC (Stress Corrosion Cracking). Jadi, pengaruh variabel pH terhadap proses korosi sangatlah kompleks[14].
2.5. Korosi pada Baja karbon Rendah
Baja karbon rendah adalah baja dengan kadar karbon sekitar 0,05-1%. Baja karbon rendah memiliki elemen paduan lain, sekitar 2%, yang sebagian besar meningkatkan sifat mekanisnya. Baja karbon rendah relatif murah, namun kualitas kekuatan dan kekerasannya bisa didapatkan melalui variasi kandungan karbon, unsur paduan, dan perlakuan panas yang diberikan.
Penambahan elemen paduan seperti Cu, Ni, Si, dan Cr pada baja karbon rendah menunjukkan pengaruh terhadap korosi. Unsur-unsur tersebut dapat meningkatkan ketahanan korosi[10]. Sedangkan penambahan unsure Si, Ti, S, Se, dan C akan menurunkan ketahanan korosi[10].
Tabel 2.1. Produk korosi pada baja[11]
Senyawa Warna Oksida Ket.
Fe2O3.H2O Fe(OH)3
Merah kecoklatan Fe3+ Hematite
Fe3O4 Hitam Fe2+/3+ Magnetite/lodestone
Fe(OH)2 Biru/Hijau Fe2+ Dapat larut, warna dapat
berubah sesuai
tingkat keasaman (pH)
FeO Hitam Fe2+ Pyrophoric
2.6. Pengaruh Oksigen Terlarut terhadap Korosi Aqueous Baja
Efek oksigen terlarut terlihat pada Gambar 2.3, dimana laju korosi meningkat dari tahap awal sampai ke tahapan tertentu, lalu turun. Penurunan laju korosi tersebut mengarah kepada terbentuknya lapisan pasif di permukaan[20]. Proses korosi pada besi atau baja pada temperatur kamar membutuhkan oksigen terlarut pada larutan netral dan alkali seperti yang terlihat pada Gambar 2.3. Film protektif magnetite (a-Fe2O3) akan stabil tanpa kehadiran oksigen. Adanya proses agitasi ataupun stirring, dapat meningkatkan transport pelarutan oksigen dan meningkatkan laju korosi. Peningkatan temperatur awalnya meningkatkan laju korosi mencapai dua kali lipat dengan kenaikan temperatur setiap 30oC, namun pada temperatur > 80o C, solubility dari pelarutan oksigen dapat menurunkan laju korosi[15].
Perbedaan transport oksigen terlarut menghasilkan perbedaan sel differensiasi aerasi, yang akan menghasilkan korosi terlokalisasi pada permukaan besi atau baja pada temperatur kamar. Oksigen terlarut sering mempunyai variabel access untuk tujuan berbeda pada permukaan yang lebih besar. pH yang lebih rendah terdapat di daerah anoda (di bawah deposit karat oksida) sedangkan di sekelilingnya merupakan daerah katoda (ber-pH tinggi) yang dihasilkan dari reaksi reduksi oksigen terlarut[16]. Apabila dibandingkan dengan logam non-ferrous, seperti copper dan zinc, maka perilaku korosi pada baja karbon sedikit sensitif terhadap kualitas air. Hal ini sesuai dengan fakta bahwa produk dari reaksi anodik pada baja karbon bersifat tidak protektif. Laju korosi pada baja dikontrol oleh proses katodik, yaitu suplai oksigen terlarut[10].
20
Universitas Indonesia Gambar 2.4. Pengaruh oksigen terlarut pada korosi baja karbon rendah di air destilasi (temperatur
25oC dan perendaman 48 jam) yang mengandung 165 ppm CaCl2[15]
Oksigen terlarut dapat merusak lapisan protektif hidrogen yang terbentuk pada permukaan kebanyakan logam, dan mengoksidasi ion-ion terlarut ke bentuk yang sukar larut. Oksigen dapat meningkatkan kecepatan korosi dengan 2 cara, yaitu[15]:
a) Pertama oksigen bertindak sebagai depolarizer seperti diperlihatkan Gambar 2.5. Artinya oksigen dengan mudah berikatan dengan atom hidrogen pada katoda sehingga reaksi korosi terjadi dengan kecepatan yang sama dengan kecepatan difusi oksigen ke permukaan katoda. Tanpa oksigen, energi untuk terjadinya evolusi gas hidrogen menjadi penghambat kecepatan korosi yang terjadi
Gambar 2.5 Oksigen sebagai depolarizer[20].
b) Kedua, oksigen mengoksidasi Fe2+ menjadi Fe3+ sehingga membentuk Fe(OH)3 yang sukar larut (pada pH = 3).
Gambar 2.6 Pembentukan Fe(OH)3 yang sukar larut[20].
Pada suatu sistem yang memiliki perbedaan oksigen terlarut di permukaannya, proses korosi (oksidasi) akan meningkat di daerah yang memiliki kelarutan oksigen terendah. Sehingga padatan, kerak, atau produk sampingan korosi yang dapat menurunkan konsentrasi oksigen menyebabkan korosi terlokalisir. Oksigen terlarut dapat menyebabkan korosi yang cukup parah hanya pada konsentrasi 40 ppb, sehingga pada umumnya pemakaian kelarutan oksigen dibatasi hingga 20 – 30 ppb[15].
22
Universitas Indonesia Laju korosi dapat meningkat dengan kenaikan kelarutan oksigen seperti terlihat pada Gambar 2.7. Pada gambar tersebut menunjukkan peningkatan temperatur akan meningkatkan laju korosi baja karbon akibat kinetika reaksi yang lebih cepat[5]. Terlihat jelas walaupun pada kelarutan oksigen yang sama, perbedaan temperatur menghasilkan laju korosi yang berbeda.
2.7. Inhibitor
Perlakuan kimia untuk perlindungan korosi pada bagian internal. Ditambahkan dalam lingkungan dengan jumlah yang sedikit (ppm atau mg/liter), umumnya 10-100 ppm, sehingga dapat mengubah sedikit permukaan material. Inhibitor berasal dari kata inhibisi, yang artinya menghambat. Jadi, inhibitor ditambahkan untuk menghambat reaksi antarmuka antara material dengan lingkungan. Adapun pembagian inhibitor sebagai berikut[17]:
a) Interfasa inhibisi interaksi inhibitor dengan permukaan logam membentuk lapisan tipis (presipitasi).
b) Interfasa inhibisi penurunan tingkat korosifitas lingkungan, misalnya : pengurangan kadar oksigen, netralisasi gas yang bersifat asam, pengaturan pH.
Adapun mekanisme kerja inhibitor secara umum dapat dibedakan sebagai berikut[18]:
1. Inhibitor teradsorpsi pada permukaan logam, dan membentuk suatu lapisan tipis dengan ketebalan beberapa molekul inhibitor. Lapisan ini tidak dapat dilihat oleh mata biasa, namun dapat menghambat penyerangan lingkungan terhadap logamnya.
2. Melalui pengaruh lingkungan (misal pH) menyebabkan inhibitor dapat mengendap dan selanjutnya teradsopsi pada permukaan logam serta melidunginya terhadap korosi. Endapan yang terjadi cukup banyak, sehingga lapisan yang terjadi dapat teramati oleh mata.
3. Inhibitor lebih dulu mengkorosi logamnya, dan menghasilkan suatu zat kimia yang kemudian melalui peristiwa adsorpsi dari produk korosi tersebut membentuk suatu lapisan pasif pada permukaan logam.
4. Inhibitor menghilangkan kontituen yang agresif dari lingkungannya. Berdasarkan sifat korosi logam secara elektrokimia, inhibitor dapat mempengaruhi polarisasi anodik dan katodik. Bila suatu sel korosi dapat dianggap terdiri dari empat komponen yaitu: anoda, katoda, elektrolit dan penghantar elektronik, maka inhibitor korosi memberikan kemungkinan menaikkan polarisasi anodik, atau menaikkan polasisasi katodik atau menaikkan tahanan listrik dari rangkaian melalui pembentukan endapan tipis pada permukaan logam. Mekanisme ini dapat diamati melalui suatu kurva polarisasi yang diperoleh secara eksperimentil.
2.7.1 Jenis-jenis Inhibitor Korosi
Secara garis besar jenis-jenis inhibitor korosi dibagi berdasarkan mekanisme inhibisinya, yaitu sebagai berikut[19]:
1. Inhibitor Anodik (passivasi)
Seperti namanya anodic inhibitor bekerja dengan menghambat terjadinya reaksi anodik. Inhibitor jenis ini bekerja dengan mengubah sifat permukan logam menjadi pasif. Terdapat dua jenis inhibitor anodik yaitu [19]:
Oxidizing ion yang bisa membentuk perlindungan pada logam tanpa membutuhkan oksigen, contoh inhibitor jenis ini adalah inhibitor berbasis nitrat, kromat, dan nitrit.
Non-Oxidizing ion adalah jenis inhibitor anodik yang membentuk lapisan pasif pada permukaan anoda dengan membutuhkan kehadiran oskigen seperti oshphate, tungsten, molybdate.
Inhibitor jenis ini biasa digunakan pada aplikasi recirculation-cooling systems, rectrifier dan cooling tower. Kelemahan dari jenis inhibitor ini adalah jumlah inhibitor yang terkandung dalam larutan harus terjaga dengan baik. Sebab jika kandungannya menurun dari batas akan membuat korosi jadi semakin cepat terjadi, serta dapat membuat korosi sumuran (pitting corrosion)
24
Universitas Indonesia Gambar 2.7. Pengaruh Penambahan inhibitor anodik pada suatu material [19]
2. Inhibitor Katodik
Inhibitor jenis ini adalah inhibitor yang bekerja dengan cara memperlambat laju korosi melalui penghambatan proses katodik. Salah satunya adalah dengan cara presipitasi di permukaan material agar menghasilkan tahanan dan impedansi dipermukaan katoda, atau dengan cara memperkecil kemampuan difusi zat yang akan tereduksi. Inhibitor katodik terbagi atas beberapa jenis berdasarkan mekanisme inhibisi-nya yaitu[19]:
Racun katodik (Cathodic Posions), yang dapat menghambat reaksi evolusi hidrogen.
Katodik Presipitasi (Cathodic Precipitate) seperti Natrium, Magnesium, Zinc yang membentuk lapisan presiptat oksida di permukaan material.
Oxygen Scavenger yang menghambat laju korosi dengan cara
megurangi kadar oksigen dalam larutan yang bisa membuat efek depolarisasi contoh dari jenis oxygen scavenger ini antara lain hydrazine, DEHA, Natrium sulfit, dan ascorbic acid.
Gambar 2.8 Pengaruh penambahan inhibitor katodik pada material [19] 3. Inhibitor Organik
Inhibitor organik memiliki keunikan karena pada inhibitor jenis ini efek katodik dan anodik juga sering muncul. Inhibitor jenis ini melindungi logam dengan cara membentuk lapisan tipis (film) yang bersifat hidrofobik sebagai hasil adsorpsi ion inhibitor oleh permukaan logam. Lapisan ini akan memisahkan permukaan logam dengan elektrolitnya, sehingga reaksi reduksi dan oksidasi pada proses korosi dapat terhambat. Contoh dari inhibitor organik ini adalah gugus kimia yang bisa membentuk ikatan co-ordinates dengan logam seperti amino (-NH2), carboxyl (-COOH), dan
phosphonate (-PO3H2)[2] .
Reaksi adsopsi pada saat pembentukan lapisan dipengaruhi oleh panas dan tekanan. Inhibitor organik akan terabsorbsi sesuai muatan ion-ion inhibitor dan muatan permukaan. Kekuatan dari ikatan absorpsi merupakan faktor penting bagi inhibitor dalam menghambat korosi.
4. Presipitasi
Inhibitor jenis ini adalah inhibitor yang memiliki sifat dapat membentuk presipitat dipermukaan logam. Contoh dari inhibitor jenis ini adalah silica dan fosfat. Contoh lain dari proses inhibitor presipitasi ini adalah pada lingkungan hard water yaitu keadaan dimana banyak terkandung ion kalsium dan magnesium yang bisa menghambat laju korosi akibat kalsium yang mengendap membentuk presipitat dipermukaan logam[19]. Inhibitor
26
Universitas Indonesia jenis ini terkadang membutuhkan oksigen untuk mendapat reaksi inhibisi yang baik.
5. Inhibitor mudah menguap (Vollatile Corrosion Inhibitors)
Inhibitor jenis ini bekerja pada ruangan tertutup dengan cara meniupkannya dari tempat ia diuapkan menuju ke lingkungan yang korosif. Inhibitor ini setelah menyentuh permukaan logam yang akan dilindungi akan terkondensasi menjadi garamnya dan memberikan ion yang bisa melindungi logam dari korosi. Kemampuan dan efektifitas dari inhibitor jenis ini tergantung dari kemampuan menguap campuran inhibitor tersebut. Untuk perlindungan yang cepat diperlukan inhibitor yang kemampuan uapnya tinggi. Namun untuk perlindungan yang lebih lambat namun untuk jangka panjang dibutuhkan inhibitor yang mampu uapnya rendah[19].
2.8. Pengukuran Laju korosi dengan Metoda Polarisasi dengan bantuan analisa Tafel.
Polarisasi Logam dalam larutan akan mencapai potensial kesetimbangan yang tergantung pada pertukaran elektron oleh reaksi anodik dan katodik. Suatu logam tidak berada dalam kesetimbangan dengan larutan yang mengandung ion-ionnya, sehingga potensial elektroda akan berbeda dari potensial korosinya, dan selisih keduanya disebut overpotensial atau polarisasi[1]. Polarisasi aktivasi terjadi saat aliran elektron dipengaruhi oleh suatu tahapan dalam reaksi tersebut. Evolusi hidrogen pada permukaan logam misalnya, terdiri dari 3 tahapan utama. Pertama, H+ bereaksi dengan sebuah elektron dari dalam logam,
H+ + e-Hads
untuk membentuk sebuah atom hidrogen teradsorbsi (Hads) pada permukaan. Kedua, dua buah atom ini harus bereaksi membentuk molekul hidrogen[1],
Hads + HadsH2
Kemudian tahap ketiga membutuhkan sejumlah molekul untuk menyatu lalu bernukleasi membentuk gelembung H2 pada permukaan logam. Hubungan antara polarisasi/overpotensial dengan laju reaksi yang diwakilkan oleh rapat
arus, ia atau ic, adalah : (2.21) untuk polarisasi anodik, dan polarisasi katodiknya adalah :
ή𝑎 = 𝛽 𝑙𝑜𝑔𝑖𝑎
𝑖𝑜
(2.21) untuk polarisasi anodik, dan polarisasi katodiknya adalah :
ή𝑐 = 𝛽 𝑙𝑜𝑔𝑖𝑐
𝑖𝑜 (2.22)
dengan i0 adalah exchange current density, a dan c sebagai tetapan anoda dan katoda Tafel. Persamaan 2.22 dapat diplot ke dalam kurva polarisasi terhadap rapat arus secara teoritis, namun tidak akan sama dengan kurva hasil pengujian. Oleh karena itu kurva hasil pengujian harus diekstrapolasikan pada bagian linier sehingga dapat mendekati kurva Tafel teoritis[4]. Pada Gambar 2.8 kecepatan korosi material dapat dikalkulasi dalam bentuk mpy (mils per year; 1 mil = 0,001 inci = 0,0254 mm), dengan rumusan sebagai berikut[4]:
𝑚𝑝𝑦 = 0.129𝑖𝑐𝑜𝑟𝑀
𝐷 (2.23)
di mana : D = berat jenis (g/cm3)
icor = rapat arus korosi (μA/cm2) M = berat ekivalen (g/mol.equ)
Gambar 2.9. Kurva Tafel praktis yang diidealkan[21].
Gambar 2.9 menunjukan grafik Tafel praktis yang diidealkan. Polarisasi konsentrasi terjadi akibat ketergantungan reaksi terhadap koefisien difusi ion
28
Universitas Indonesia terlarut (Dz) dan konsentrasinya pada larutan (CB). Hal ini berakibat semakin cepat reaksi yang melibatkan ion tersebut pada permukaan, konsentrasi ion akan semakin menipis sehingga terjadi pembatasan kecepatan reaksi itu sendiri. Hubungan yang terjadi antara koefisien difusi, konsentrasi larutan dengan kecepatan reaksi yang diwakilkan oleh rapat arus batas (iL) adalah[22]:
(2.24)
dengan adalah ketebalan gradien konsentrasi dalam larutan. Besaran iL meningkat dengan peningkatan konsentrasi, temperatur, dan pergerakan larutan yang lebih cepat. Jika diasumsikan sebuah elektroda tidak mengalami polarisasi aktivasi, maka persamaan untuk polarisasi konsentrasi dapat ditunjukkan sebagai persamaan 2.25.
(2.25)
di mana : R : konstanta gas (8,314 J/mol.K) T : temperatur absolut (273 K)
Polarisasi konsentrasi terutama terjadi pada reaksi katodik dalam korosi, karena pada reaksi anodik terdapat suplai atom logam yang tak terbatas pada permukaannya[1]. Adapun secara lebih lanjut dan khusus, iL pada alat uji rotating cylinder electrode adalah sebagai berikut;
Dimana D adalah koefisien difusi untuk pereaksi (cm2/detik), v adalah viskositas kinematic larutan (cm2/detik), dan r adalah jari-jari silinder (cm) serta Ω adalah kecepatan putaran (rad/detik).
Gambar 2.9. Kurva aplikasi mixed potencial dengan hubungan arus-potensial dan transport massa terkontrol pada rekasi katodik[26].
Dapat dilihat dari Gambar 2.11 bahwa dengan peningkatan kecepatan dari satu sampai 4, laju korosi meningkat dari A sampai D. secara umum digunakan alat uji simulasi rotating cylinder electrode untuk mensimulasikan aliran turbulen pada sistem perpipaan, karena pola aliran sangat mudah tercapai, berbeda dengan rotating disc electrode yang masih dapat memiliki bentuk pola alir laminar walau pada kecepatan putaran yang tinggi.
30 Universitas Indonesia
BAB 3
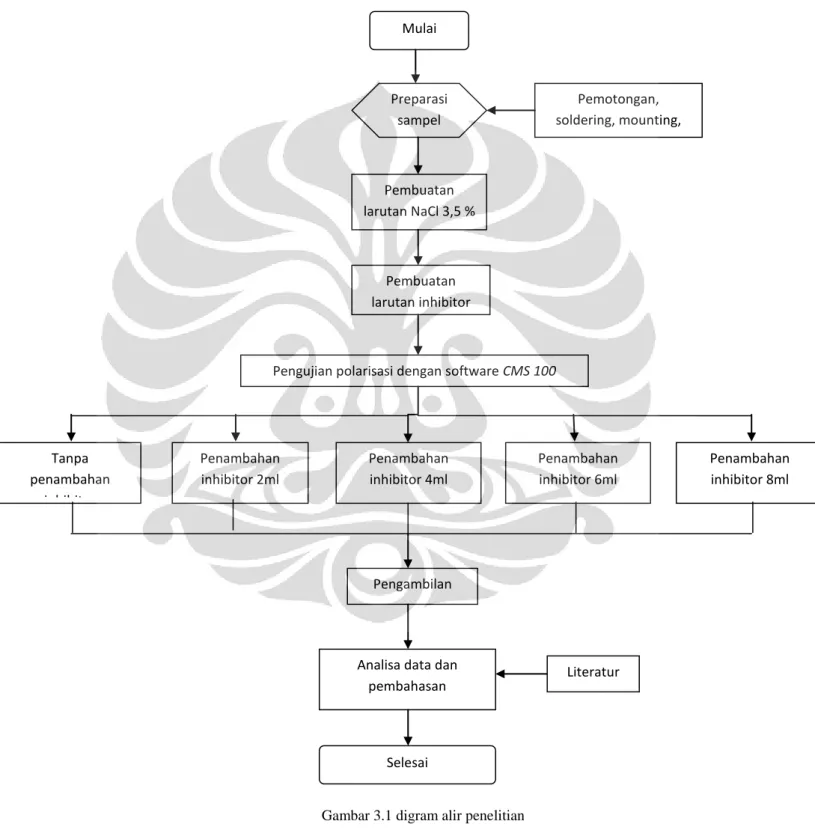
METODOLOGI PENELITIAN 3.1. Diagram Alir Penelitian
Gambar 3.1 digram alir penelitian Mulai Pemotongan, soldering, mounting, amplas. Preparasi sampel Pembuatan larutan NaCl 3,5 % Pembuatan larutan inhibitor
Pengujian polarisasi dengan software CMS 100
Penambahan inhibitor 4ml Tanpa penambahan inhibitor Penambahan inhibitor 2ml Penambahan inhibitor 8ml Penambahan inhibitor 6ml Pengambilan data Literatur Analisa data dan
pembahasan
Selesai
3.2 Alat dan Bahan 3.2.1 Alat
Alat yang digunakan untuk penelitian, antara lain:
Alat pemotong sampel
Mesin gerinda Amplas #120 dan #240 #400 #600 Timbangan digital pH meter digital Kabel tembaga Multimeter Solder Jangka sorong Software GAMRY 5.06 dan peralatan polarisasi
Elektroda standar KCl Kapas Jarum suntik Kamera digital Beaker glass
32
Universitas Indonesia
3.2.2 Bahan
Bahan yang digunakan untuk penelitian, antara lain:
Baja low carbon
o Dimensi: lingkaran dengan luas = ± 1 cm2
Garam NaCl teknis
Aquades
Ekstrak teh bunga rosella
Resin
Hardener
3.3Prosedur Penelitian 3.3.1 Preparasi Sampel
Dalam preparasi sampel dilakukan beberapa hal, antara lain:
Pemotongan sampel
Material dipotong menjadi ukuran 1,5cm x 1,5cm. Kemudian dilakukan gerinda sehingga menjadi lingkaran dengan ukuran luas ± 1cm2.Ukuran sampel polarisasi ini sesuai dengan standar ASTM G59. Pemotongan sampel ini dilakukan dengan alat pemotong yang terdapat di laboratorium TPB Departemen Teknik Metalurgi dan Material FTUI. Untuk mendapatkan sampel berbentuk lingkaran, maka terlebih dahulu sampel dipotong menjadi persegi. Kemudian sampel digerinda sehingga tepinya membentuk lingkaran.
Penyolderan sampel
Untuk menyambungkan kawat tembaga pada sampel polarisasi, maka perl dilakukan penyolderan dengan menggunakan timah sebelum sampel di-mounting.
Mounting sampel
Sampel polarisasi yang telah disolder di-mounting agar mempermudah pengamplasan permukaan sampel.
Gambar 3.2 sampel polarisasi
Pengamplasan sampel
Sampel diamplas untuk menghilangkan oksida, meratakan, dan menghaluskan permukaan sampel. Pengamplasan dimulai dari kertas amplas #120, #240, #400 dan #600.
Pengujian arus
Aliran arus pada sampel diuji dengan menggunakan multimeter.
3.3.2 Persiapan Larutan
Larutan yang digunakan pada penelitian ini adalah NaCl 3,5 % (air laut). Larutan ini dibuat dari Aquades yang dicampur dengan garam NaCl teknis. Misalkan untuk volume 1 liter aquades, maka kita dapat menambahkan 35 gram NaCl teknis agar dihasilkan larutan NaCl 3,5%.
34
Universitas Indonesia Gambar 3.3 persiapan larutan pada uji polarisasi
3.3.3 Pembuatan Inhibitor
Inhibitor teh rosella di sedu dengan air panas dengan konsetrasi 1 mg per 100 ml air aquades. Volume Inhibitor yang digunakan adalah 2 ml, 4ml, 6ml, dan 8ml untuk tiap pengujian polarisasi.
Gambar 3.4 ekstrak the rosella
3.3.4 pengujian pH
pengujian ini dilakukan pada saat inhibitor dimasukan ke dalam lingkungan 300ml larutan NaCl 3.5 % dan dilakukan dengan bantuan alat pH meter
Gambar 3.5 pengujian pH pada larutan
3.3.5Pengujian Polarisasi
Pengujian polarisasi dilakukan dengan menggunakan software Software GAMRY 5.06 dan peralatan polarisasi.
Kemudian kita akan mendapatkan kurva polarisasi dan laju korosi sebagai hasil dari pengaruh inhibitor terhadap tingkat korosi pada sampel tersebut.
Pada proses pengujian polarisasi, volume NaCl 3,5% di dalam tabung adalah 300ml. Maka untuk penambahan volume inhibitor wine no sugar selanjutnya adalah setara dengan :
Tabel 3.2. Volume penambahan inhibitor
Volume Inhibitor Konversi Dalam %
2ml 2ml/300ml = 0,67 %
4ml 4ml/300ml = 1,33 %
6ml 6ml/300ml = 2%
8ml 8ml/300ml = 2,67 %
36
Universitas Indonesia Gambar 3.6 uji Polariasasi
3.3.6 Pengambilan Data
Data yang didapatkan dari pengujian polarisasi tersebut adalah berupa kurva polarisasi serta laju korosi (corrosion rate). Dari data tersebut kita bisa menhitung efisiensi inhibitor dengan cara menghitungan dengan rumus:
Efisiensi (%) = Laju korosi tanpa inhibitor – Laju korosi dengan inhibitor x 100% Laju korosi tanpa inhibitor
4.1.4 Hasil Corrosion Rate Software GAMRY 5.06 dan peralatan polarisasi Tabel 4.3 Data hasil pengukuran laju korosi
Konsentrasi Inhibitor Corosion rate
0 mililiter 10.18 mpy 2 mililiter 4.329 mpy 4 mililiter 4.142 mpy 6 mililiter 4.344 mpy 8 mililiter 4.292 mpy 4.1. Kurva Polarisasi
4.2.1 Kurva Polarisasi Baja Karbon Rendah Tanpa Inhibitor
Gambar 4.2. Kurva polarisasi tanpa inhibitor Tabel 4.4. Data tafel polarisasi tanpa inhibitor
Icorr 22,30e-6 A-cm2
Ecorr -406,0 mV
Corrosion Rate 10,18 mpy
-8,00E-01 -7,00E-01 -6,00E-01 -5,00E-01 -4,00E-01 -3,00E-01 -2,00E-01 -1,00E-01 0,00E+00 1,00E-07 1,00E-06 1,00E-05 1,00E-04 1,00E-03 1,00E-02 1,00E-011,00E+00
Pot e n tial (m V)
Current density (i)
Grafik Polarisasi
Tanpa inhibitor
39
Universitas Indonesia
4.2.2. Kurva Polarisasi Dengan Penambahan 0,67 % Inhibitor
Gambar 4.3 Kurva polarisasi dengan penambahan 0,67 % inhibitor Tabel 4.5. Data tafel polarisasi dengan penambahan 0,67 % inhibitor
Icorr 9,470e-6 A-cm2
Ecorr -528,0 mV
Corrosion Rate 4,329 mpy
-8,00E-01 -7,00E-01 -6,00E-01 -5,00E-01 -4,00E-01 -3,00E-01 -2,00E-01 -1,00E-01 0,00E+00 1,00E-07 1,00E-06 1,00E-05 1,00E-04 1,00E-03 1,00E-02 1,00E-01 1,00E+00
Pot et ia l ( m V)
Current Density (i)
Grafik Polarisasi
Inhibitor 2ml
4.2.3. Kurva Polarisasi Dengan Penambahan 1,33 % Inhibitor
Gambar 4.4. Kurva polarisasi dengan penambahan 1,33 % inhibitor Tabel 4.6. Data tafel polarisasi dengan penambahan 1,33 % inhibitor
Icorr 9,070e-6 A-cm2
Ecorr -552,0 mV
Corrosion Rate 4,142 mpy -1,00E+00 -9,00E-01 -8,00E-01 -7,00E-01 -6,00E-01 -5,00E-01 -4,00E-01 -3,00E-01 -2,00E-01 -1,00E-01 0,00E+00 1,00E-07 1,00E-05 1,00E-03 1,00E-01
Po
te
tial (
m
V)
Current Density (i)
Grafik Polarisasi
Inhibitor 4ml
41
Universitas Indonesia
4.2.4. Kurva Polarisasi Dengan Penambahan 2 % Inhibitor
Gambar 4.5. Kurva polarisasi dengan penambahan 2 % inhibitor Tabel 4.7. Data tafel polarisasi dengan penambahan 2 % inhibitor
Icorr 10,590e-6 A-cm2
Ecorr -618,0 mV
Corrosion Rate 4,344mpy
-9,00E-01 -8,00E-01 -7,00E-01 -6,00E-01 -5,00E-01 -4,00E-01 -3,00E-01 -2,00E-01 -1,00E-01 0,00E+00 1,00E-07 1,00E-06 1,00E-05 1,00E-04 1,00E-03 1,00E-02 1,00E-011,00E+00
Pot e n tial (m V)
Current Density (i)
Grafik Polarisasi
Inhibitor 6ml
4.2.5. Kurva Polarisasi Dengan Penambahan 2,67 % Inhibitor
Gambar 4.6. Kurva polarisasi dengan penambahan 2,67 % inhibitor Tabel 4.8. Data tafel polarisasi dengan penambahan 2,67 % inhibitor
Icorr 9,390e-6 A-cm2
Ecorr -703,0 mV
Corrosion Rate 4,292 mpy -1,00E+00 -9,00E-01 -8,00E-01 -7,00E-01 -6,00E-01 -5,00E-01 -4,00E-01 -3,00E-01 -2,00E-01 -1,00E-01 0,00E+00 1,00E-08 1,00E-06 1,00E-04 1,00E-02 1,00E+00
Pot e n tial (m V)
Current Density (i)
Grafik Polariasi
Inhibitor 8ml
![Gambar 2.1. Pengaruh kadar ion Cl- terhadap laju korosi [5] .](https://thumb-ap.123doks.com/thumbv2/123dok/4084659.2795509/28.892.151.731.130.700/gambar-pengaruh-kadar-ion-cl-terhadap-laju-korosi.webp)
![Gambar 2.3 Pengaruh pH pada korosi aqueous baja, menggunakan HCl dan NaOH untuk mengontrol pH di dalam air yang mengandung oksigen terlarut [21]](https://thumb-ap.123doks.com/thumbv2/123dok/4084659.2795509/32.892.170.711.141.539/gambar-pengaruh-aqueous-menggunakan-mengontrol-mengandung-oksigen-terlarut.webp)
![Tabel 2.1. Produk korosi pada baja [11]](https://thumb-ap.123doks.com/thumbv2/123dok/4084659.2795509/33.892.159.776.354.1103/tabel-produk-korosi-pada-baja.webp)
![Gambar 2.5 Oksigen sebagai depolarizer [20] .](https://thumb-ap.123doks.com/thumbv2/123dok/4084659.2795509/36.892.152.793.123.805/gambar-oksigen-sebagai-depolarizer.webp)
![Gambar 2.8 Pengaruh penambahan inhibitor katodik pada material [19]](https://thumb-ap.123doks.com/thumbv2/123dok/4084659.2795509/40.892.152.765.117.1128/gambar-pengaruh-penambahan-inhibitor-katodik-pada-material.webp)
![Gambar 2.9. Kurva Tafel praktis yang diidealkan [21].](https://thumb-ap.123doks.com/thumbv2/123dok/4084659.2795509/42.892.148.747.267.1019/gambar-kurva-tafel-praktis-yang-diidealkan.webp)
![Gambar 2.9. Kurva aplikasi mixed potencial dengan hubungan arus-potensial dan transport massa terkontrol pada rekasi katodik[26]](https://thumb-ap.123doks.com/thumbv2/123dok/4084659.2795509/44.892.172.716.135.548/gambar-aplikasi-potencial-hubungan-potensial-transport-terkontrol-katodik.webp)