BAB IV
HASIL DAN PEMBAHASAN
4.1. Keadaan Umum Lokasi Penelitian
Pulau Bintan merupakan salah satu bagian dari gugusan pulau yang berada di wilayah Provinsi Kepulauan Riau.Wilayah administrasi gugus Pulau Bintan terdiri dari Kabupaten Bintan dan Kota Tanjungpinang. Kota Tanjungpinang terletak di Pulau Bintan dan sangat berdekatan dengan Negara Singapura yang merupakan transit dan lalu lintas perdagangan dunia dan juga Malaysia. Selain itu Pulau Bintan dan sekitarnya mempunyai potensi sumberdaya alam yang kaya, diantaranya pertambangan (bauksit), perikanan, dan pariwisata. Pulau Bintan mempunyai luas 13.903,75 km² atau sekitar 11,4% dari total luas seluruh pulau di Provinsi Kepulauan Riau (DKPPKE Kota Tanjungpinang, 2012).
Secara geografis gugus Pulau Bintan terletak pada 104° 00’ BT - 104° 53’ BTdan 0° 40’ LU - 1° 15’ LU. Adapun batas-batas wilayah Pulau Bintan adalah sebagai berikut :
Sebelah Utara : Selat Singapura/Selat Malaka Sebelah Selatan : Provinsi Jambi
Sebelah Barat : Provinsi Riau
Sebelah Timur : Selat Karimata, Laut Cina Selatan
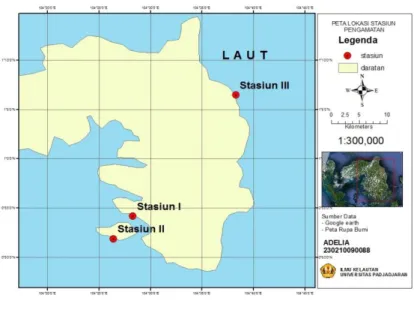
Berdasarkan survei pendahuluan yang sudah dilakukan, maka lokasi penelitian dibagi menjadi 3 stasiun pengamatan berdasarkan kondisi habitatnya.(Gambar 10).
Gambar 10. Peta Lokasi Stasiun Pengamatan
a. Pantai Impian
Pantai Impian (Stasiun I) terletak di 0⁰ 53' 52.01" LU dan 104⁰ 27' 35.14" BT. Koordinat ini berada di wilayah administratif Kelurahan Tanjungpinang Barat, Kecamatan Tanjungpinang Barat, Kota Tanjungpinang, Provinsi Kepulauan Riau.Lokasi ini telah dibuat tempat untuk konservasi siput gonggong dengan pemisahan antara zona inti yang sudah dipagari dengan kayu. Lebar zona inti ini hanya 6 meter dan sepanjang 170 meter dikarenakan wilayah distribusi yang terbatas. Pada zona ini masyarakat tidak boleh memanfaatkan siput gonggong yang ada, karena daerah ini sudah dipagar untuk daerah konservasi. Jadi masyarakat setempat hanya boleh memanfaatkan siput gonggong yang berada di luar zona inti. Terkadang banyaknya populasi menyebabkan siput gonggong berada di luar zona inti. Siput gonggong pada zona inti ini sudah berada dalam habitat aslinya di daerah substrat berlumpur dan ditumbuhi lamun.
a. Pulau Dompak/Sekatap
Pulau Dompak (Stasiun II) terletak di00⁰ 51' 59.6" LU dan 104⁰ 27' 03.5" BT. Koordinat ini berada di wilayah administratif Kampung Sekatap, Kelurahan Dompak, Kecamatan Bukit Bestari, Kota Tanjungpinang, Provinsi Kepulauan
Riau.Lokasi ini merupakan habitat asli dari siput gonggong. Lokasi ini paling banyak dijumpai nelayan yang menangkap ikan dan siput gonggong untuk dijual kembali.
Gambar 11. Lokasi penelitian yang banyak dijumpai nelayan b. Malang Rapat, Pantai Trikora
Malang Rapat, Pantai Trikora (Stasiun III) terletak di 1⁰ 54' 39.35" LU dan 104⁰ 38' 10.39" BT. Koordinat ini berada di wilayah administratif Pantai Trikora, Desa Malang Rapat, Kelurahan Kawal, Kecamatan Gunung Kijang, Kabupaten Bintan, Provinsi Kepulauan Riau (Gambar 12).
Gambar 12. Lokasi Percontohan Pengelolaan Padang Lamun Bintan Timur Stasiun ini merupakan salah satu wilayah konservasi padang lamun yang berada di kawasan Pantai Trikora, Bintan Timur. Proyek pengelolaan padang lamun ini disebut dengn TRISMADES “Trikora Seagrass Managenment Demonstration Site” yang dilaksanakan di Pantai Trikora, pesisir Timur Pulau
Bintan, Kepulauan Riau, yang difokuskan di tiga desa yakni di Desa Teluk Bakau, Desa Malang Rapat, dan desa Tanjung Berakit.Di pesisir Timur Pulau Bintan padang lamun tumbuh di sepanjang Pantai Trikora (25km) sampai Desa Tanjung Berakit yang meliputi Desa Lagoi, Pengudang, Berakit, Malang Rapat dan Teluk Bakau dengan luasan 2.600 ha. Ditemukan 10 jenis lamun yaitu: Halodule uninervis, Halodule pinifolia, Cymodecea rodundata, Cymodocea serrulata, Syringodium isoetifolium, Halophila ovalis, Halophila spinulosa, Thalassia hemprichii, Thalassodendron ciliatum dan Enhalus acoroides. Lokasi yang memiliki keanekaragaman jenis lamun yang tinggi adalah di Desa Malang Rapat, Teluk Bakau dan Desa Pegudang (Bappeda Kabupaten Bintan, 2010).Namun karena air yang cukup jernih dan keindahan pantai yang masih terjaga di lokasi ini banyak didirikan resort-resort dan rumah makan.
4.2. Komposisi dan Kerapatan Jenis Lamun
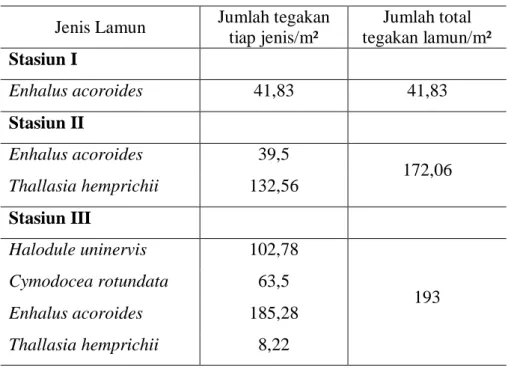
Berdasarkan pengamatan pada setiap stasiun penelitian ditemukan empat jenis lamun, yaitu Halodule uninervis, Cymodocea rotundata, Enhalus acoroides, dan Thallasia hemprichii. Jenis lamun yang ditemukan pada Stasiun I hanya Enhalus acoroides dengan rata-rata jumlah tegakan sebesar 41,83 tegakan/m².
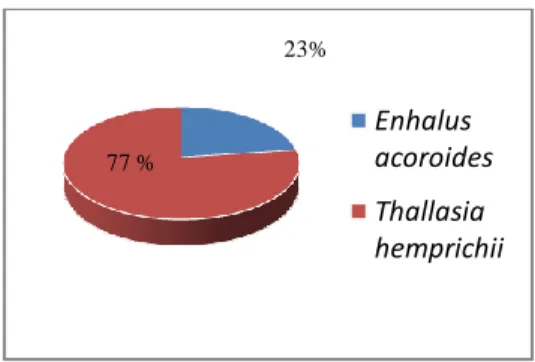
Pada Stasiun II ditemukan jenis Enhalus acoroides dan Thallasia hemprichii dengan rata-rata jumlah tegakan sebesar 172,06tegakan/m². Pada Stasiun II terdapat kerapatan relative spesies Enhalus acoroides sebesar 23% dan Thallasia hemprichii sebesar 77%. Seperti terlihat pada Gambar 12.
Gambar 13. Presentase penutupan jenis Enhalus acoroides dan Thallasia
hemprichii di Stasuin II 23% 77 % Enhalus acoroides Thallasia hemprichii
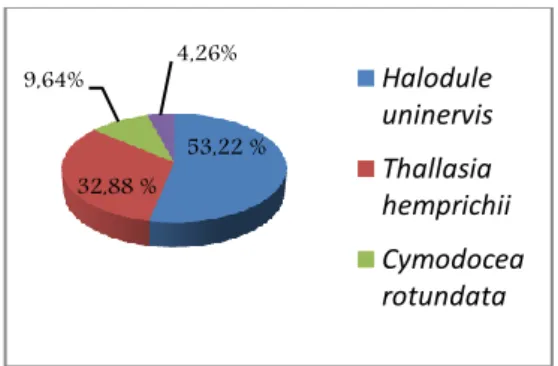
Pada Stasiun III paling banyak jenis lamun yang ditemukan, jenis Halodule uninervis, Thallasia hemprichii, Cymodocea rotundata, dan Enhalus acoroides dengan rata-rata jumlah tegakan sebesar 193 tegakan/m². Pada stasiun ini terdapatkerapatan relatif spesies Halodule uninervis 53%, Thallasia hemprichii 33%, Cymodocea rotundata 10%, dan Enhalus acoroides 4% (Gambar 13).
Gambar 14. Presentase penutupan jenis Halodule uninervis, Thallasia hemprichii,
Cymodocea rotundata, dan Enhalus acoroides di Stasiun III.
Pada Stasiun Itidak ditemukan adanya asosiasi lamun dengan jenis lainnya namun berbeda dengan kedua lokasi lainnya yang ditemukan adanya asosiasi antar dua sampai empat jenis lamun yang berbeda pada masing-masing stasiun. Pada Stasiun I tidak terjadi asosiasi karena hanya ditemukan satu jenis lamun Enhalus acoroides. Pada Stasiun II ditemukan asosiasi antara jenis lamun Enhalus acoroides dan Thallasia hemprichii. Sedangkan pada Stasiun III ditemukan asosiasi antara jenis Halodule uninervis, Cymodocea rotundata,Enhalus acoroides, dan Thallasia hemprichii. Hal ini sesuai dengan literatur yang menyebutkan bahwa tumbuhan lamun tidak hanya hidup sendiri tetapi berdampingan dengan tumbuhan lamun jenis yang lain atau biota asosiasi (Bengen, 2001). Pernyataan tersebut didukung pula Kiswara (1999) yang menyebutkan bahwa lamun dapat membentuk kelompok-kelompok kecil sampai berupa padang yang luas. Padang lamun dapat berbentuk vegetasi tunggal yang disusun oleh satu jenis lamun atau vegetasi yang disusun mulai 2-12 jenis lamun yang tumbuh. Komposisi dan kerapatan jenis yang sudah dijelaskan sebelumnya dapat dilihat pada tabel 5.
53,22 % 32,88 % 9,64% 4,26% Halodule uninervis Thallasia hemprichii Cymodocea rotundata
Tabel 5. Kerapatan jenis lamun di tiap stasiun
Jenis Lamun Jumlah tegakan tiap jenis/m² Jumlah total tegakan lamun/m² Stasiun I Enhalus acoroides 41,83 41,83 Stasiun II Enhalus acoroides 39,5 172,06 Thallasia hemprichii 132,56 Stasiun III Halodule uninervis 102,78 193 Cymodocea rotundata 63,5 Enhalus acoroides 185,28 Thallasia hemprichii 8,22
4.3. Sebaran dan Kelimpahan Siput Gonggong
Berdasarkan pengamatan dan pengambilan sampel siput gonggong yang dilakukan di ketiga stasiun penelitian hanya ditemukan satu jenis siput gonggong yaitu Strombus turturella. Dimana menurut Dody(2007) sejatinya ada empat jenis siput dari family Strombidae yang diberi nama siput gonggong Strombus turturella, Strombus canarium, Strombus luhuanus, dan Strombus urceus. Dua jenis yang disebut pertama banyak ditemukan di bagian Barat wilayah Indonesia terutama di perairan Kepulauan Riau dan Bangka Belitung. Sedangkan kedua jenis yang lainyaitu Strombus luhuanu, dan Strombus urceusberlimpah di wilayah perairan Indonesia bagian Timur yaitu NTB, Sulawesi Selatan, dan Maluku. Siput gonggong yang dijumpai di lokasi penelitian dapat dilihat pada Gambar 14.
Gambar 15. Siput gonggong yang dijumpai di lokasi penelitian
Jumlah individu yang ditemukan pada Stasiun I yaitu sebanyak enam individu dimana pada stasiun ini dekat dengan lokasi konservasisiput gonggong.Pada stasiun pengamatan ini siput gonggong yang dapat dimanfaatkan oleh masyarakat yang berasal dari luar area konservasi. Kerapatan lamun pada stasiun ini adalah 41,83 tegakan/m².
Jumlah individu pada Stasiun II hanya ditemukan sebanyak empat individu dimana pada stasiun ini memiliki tingkat kerapatan lamun yang lebih tinggi dibanding Stasiun I yaitu 172,06 tegakan/m². Kerapatan lamun bukan satu-satunya faktor penyebab tinggi dan rendahnya kelimpahan siput gonggong namun didukung juga oleh substratyang ada.Semakin banyak lumpur yang terkandung dalam substratmaka semakin tinggikandungan bahan organiknya, akibatnya kelimpahan siput gonggongjuga tinggi.Begitupula dengan Stasiun I yang dapat dikatakan memiliki kerapatan lamun yang jarang namun mampu didapatkan kelimpahan siput gonggong terbesar dikarenakan siput gonggong lebih menyukai substrat yang lunak untuk mendapatkan makanannya.
Pada Stasiun III tidak ditemukan jenis siput gonggong yang hidup di perairan ini.Hal ini dikarenakan jenis substrat pasir yang lebih mendominasi dibanding lumpur yang terkandung didalamnya.
Berdasarkan perhitungan statistik maka kelimpahan siput gonggong pada Stasiun I yaitu terdapat spesies Strombus turturellasebanyak 0,33 ind/m²,
sedangkan pada Stasiun II spesies Strombus turturella sebanyak 0,22 ind/m² dan tidak didapatkan individu pada Stasiun III (Gambar 14).
Gambar 16. Presentase kelimpahan siput gonggong
Pada ketiga stasiun pengamatan kehadiran jenis Strombus turturella 100% karena tidak ditemukan siput gonggong jenis lainnya. Kondisi kepadatan rata-rata siput gonggong di stasiun-stasiun pengamatan secara umum berada dalam kondisi yang cukup mengkhawatirkan. Mengacu kepada kajian yang dilakukan sebelumnya oleh Andirato (1989) di wilayah Sekatap/Dompak menemukan kepadatan rata-rata siput gonggong saat itu adalah 0,64 ind/m², dari hasil kajian DKPPKE Kota Tanjungpinang (2012) kepadatan gonggong sebesar 0,3 ind/m², sedangkan dari hasil kajian ini kepadatan rata-rata gonggong relatif lebih rendah yaitu hanya sebesar 0,22 ind/m². Menurut DKPPKE Kota Tanjungpinang, kondisi ini merupakan suatu indikator bahwa tingkat pemanfaatan siput gonggong selama ini telah mengakibatkan penurunan kelimpahan gonggong secara drastis.
Hadirnya siput gonggong pada beberapa lokasi lainnya seperti yang terdapat dalam stasiun-stasiun pengamatan ini dengan kepadatan relatif rendah merupakan informasi penting untuk pengelolaan selanjutnya terhadap upaya pemulihan dan kelestarian kondisi populasi siput gonggong di Perairan Bintan.
4.4. Pengukuran Morfometrik
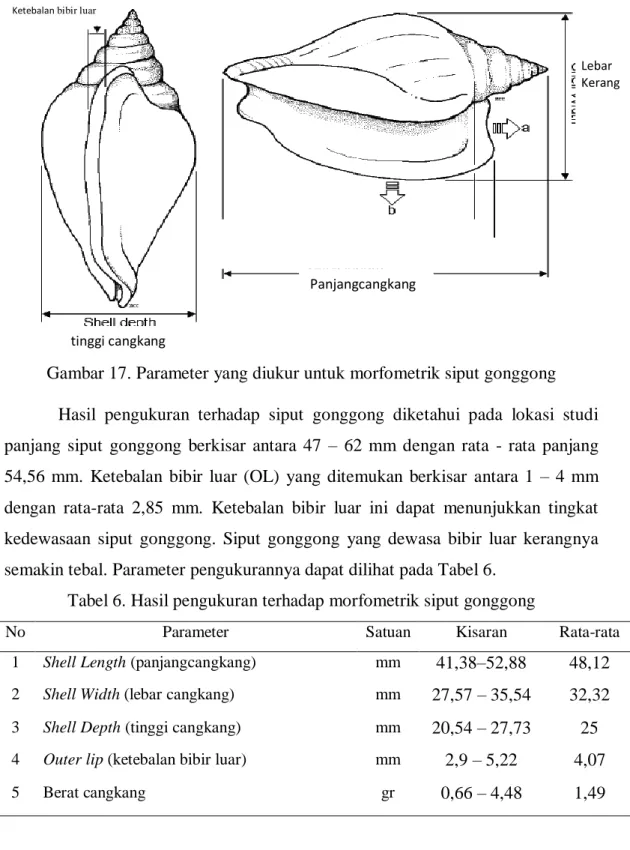
Siput gonggong yang ditemukan pada penelitian ini dilakukan pengukuran dan penimbangan beratnya. Adapun parameter yang diukur yaitu Shell Length (Panjang cangkang/SL), Shell Width (lebar cangkanng/SW), Shell Depth (Tinggi cangkang/SD), dan Outer Lip/Lip thickness (ketebalan bibir luar/OL)(Gambar 17.)
0 0,1 0,2 0,3 0,4
Kelimpahan Siput Gonggong
Stasiun I Stasiun II Stasiun III
Gambar 17. Parameter yang diukur untuk morfometrik siput gonggong
Hasil pengukuran terhadap siput gonggong diketahui pada lokasi studi panjang siput gonggong berkisar antara 47 – 62 mm dengan rata - rata panjang 54,56 mm. Ketebalan bibir luar (OL) yang ditemukan berkisar antara 1 – 4 mm dengan rata-rata 2,85 mm. Ketebalan bibir luar ini dapat menunjukkan tingkat kedewasaan siput gonggong. Siput gonggong yang dewasa bibir luar kerangnya semakin tebal. Parameter pengukurannya dapat dilihat pada Tabel 6.
Tabel 6. Hasil pengukuran terhadap morfometrik siput gonggong
No Parameter Satuan Kisaran Rata-rata
1 Shell Length (panjangcangkang) mm 41,38–52,88 48,12
2 Shell Width (lebar cangkang) mm 27,57 – 35,54 32,32
3 Shell Depth (tinggi cangkang) mm 20,54 – 27,73 25
4 Outer lip (ketebalan bibir luar) mm 2,9 – 5,22 4,07
5 Berat cangkang gr 0,66 – 4,48 1,49
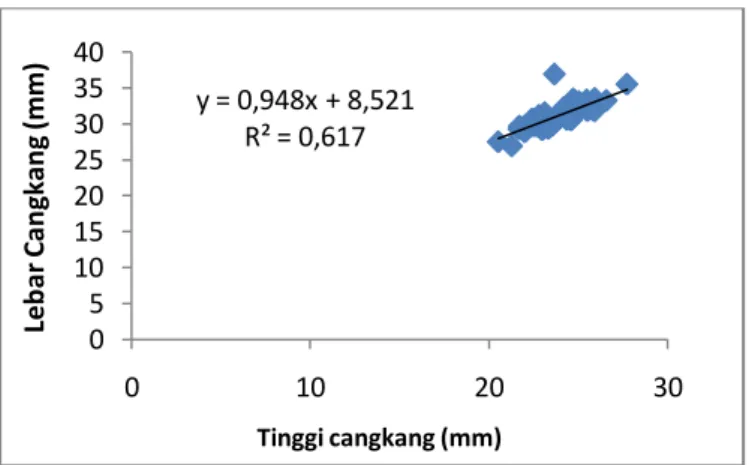
Dari Tabel 6. dapat dilihat kisaran ukuran komponen morfometrik siput gonggong yang ditemukan di lokasi penelitian. Hubungan antara komponen morfometrik yang diukur tersebut secara statistik dapat dinyatakan dalam bentuk persamaan linier. Hubungan antara komponen morfometrik tinggi cangkang dan
Ketebalan bibir luar
tinggi cangkang
Panjangcangkang
Lebar Kerang
lebar cangkang dapat dinyatakan dengan persamaan y = 0,948x + 8,521dan nilai keeratan hubungan antara kedua komponen tersebut ditunjukkan dengan nilai R² = 0,617. Ini menyatakan laju pertumbuhan antara kedua variabel berjalan beriringan, semakin besar nilai R2 semakin erat hubungan kedua komponen tersebut (Gambar 18).
Gambar 18. Grafik hubungan antara komponen morfometrik lebar cangkang (SW) dantinggi cangkang (SD)
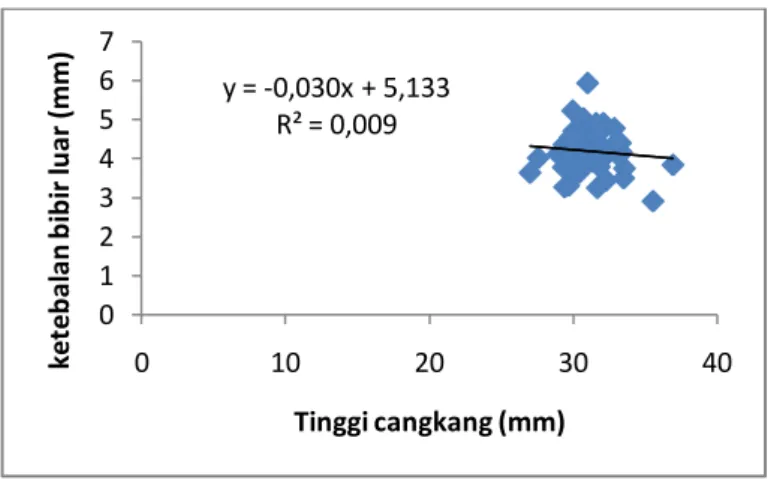
Hal sebaliknya terjadi pada hubungan antara komponen morfometrik tinggi cangkang dan ketebalan bibir luarcangkang yang dinyatakan melalui persamaan y= -0,030x + 5,133 dengan R² = 0,009. Dengan adanya nilai R2 yang sangat kecil (mendekati nilai 0) inimemberikan indikasi bahwa laju pertumbuhan tinggi cangkang siput gonggong berjalan tidak seiring dengan laju pertumbuhan ketebalan bibir luar cangkangnya (Gambar 19).
y = 0,948x + 8,521 R² = 0,617 0 5 10 15 20 25 30 35 40 0 10 20 30 Le b ar C an gka n g (m m ) Tinggi cangkang (mm)
Gambar 19.Grafik hubungan antara komponen morfometriktinggi cangkang (SD) dengan ketebalanbibir luar (OL)
Pada Gambar 18 yang menggambarkan keterkaitan antara komponen morfometrik panjang cangkang dengan berat cangkang. Hubungan ini menunjukkan tingkat keeratan hubungan antara kedua komponen morfometrik tersebut yang memberikan indikasi bahwa laju pertumbuhan panjang cangkang siput gonggong berjalan seiring dengan laju pertumbuhan beratnya.Hal ini dinyatakan dengan persamaan y = 0,150x - 2,687 dengan nilai keeratan hubungan R² = 0,882.Sama halnya dengan literatur yang menyatakan bahwa pola pertumbuhan bergantung kepada ketersediaan makanan, dimana jika makanan berlimpah maka laju penambahan berat semakin cepat. Selain itu kelompok yang berukuran besar berada pada kondisi lingkungan yang sesuai dengan persyaratan hidup dari siput gonggong dan banyak didapatkan pasokan makanan (Siddik, 2011).
Gambar 20. Grafik hubungan antara komponen morfometrik panjang cangkang (SL) dengan berat cangkang
y = -0,030x + 5,133 R² = 0,009 0 1 2 3 4 5 6 7 0 10 20 30 40 ke te b al an b ib ir lu ar (m m ) Tinggi cangkang (mm) y = 0,150x - 2,687 R² = 0,882 0 1 2 3 4 5 0 10 20 30 40 50 B era t C an gka n g Panjang Cangkang
4.5. Indeks Keanekaragaman dan Dominansi Lamun
Indeks keanekaragaman dan dominansi merupakan suatu ciri unik pada suatu komunitas. Indeks-indeks ini menunjukkan kekayaan jenis dalam suatu komunitas serta keseimbangan jumlah setiap jenis. Keanekaragaman spesies menunjukkan keberadaan suatu spesies dalam suatu ekosistem, semakin bear jumlah jenis serta semakin kaya dan seimbang distribusi diantara jenis akan meningkatkan kenekaragaman jenis yang diukur dengan indeks tersebut (Dwianto, 2001).
Berdasarkan data hasil penelitian di Perairan Bintan, maka diperoleh nilai indeks keanekaragaman dan dominansi di ketiga stasiun penelitian seperti terlihat pada Tabel 7.
Tabel 7. Indeks Keanekaragaman dan Dominansi Jenis Lamun
Stasiun Keanekaragaman Dominansi
Stasiun I 0 1
Stasiun II 0,53 0,64
Stasiun III 1,11 0,39
Berdasarkan tabel diatas maka nilai indeks keanekaragaman pada Stasiun 1 sebesar 0 yang menunjukkan bahwa pada lokasi tersebut tidak ditemukan keanekaragaman jenis lamun sama sekali atau pada stasiun tersebut hanya terdiri dari spesies tunggal lamun yaitu Enhalus acoroides. Pada Stasiun II dan Stasiun III indeks keanekaragamannya sebesar 0,53 dan 1,11. Ini menunjukkan bahwa pada kedua stasiun tersebut didapat nilai keanekaragaman jenis yang rendah dan sedang. Kondisi tersebut karena pada lokasi penelitian ditemukannya perbedaan jenis substrat sehingga mempengaruhi jenis lamun yang hidup di lokasi penelitian tersebut.
Pada Stasiun I didapat nilai indeks dominansi sebesar 1, ini menunjukkan bahwa pada stasiun tersebut memang hanya ditempati oleh satu jenis lamun saja yaitu Enhalus acoroides. Ini disebabkan pada stasiun tersebut hanya ada satu jenis lamun saja yang bisa menempati habitat di Stasiun I. Berarti jenis Enhalus
acoroides dapat beradaptasi dengan lingkungan yang memiliki substrat lumpur selain itu dapat tetap hidup di perairan yang tidak mendapat cukup cahaya matahari sehingga dapat diindikasikan bahwa jenis tersebut lebih mampu bertahan tanpa intensitas cahaya matahari yang cukup.
Pada Stasiun III didapatkan nilai indeks dominasi 0,39. Nilai ini mendekati 0 berarti tidak ada spesies yang dominan pada stasun tersebut karena pada stasiun ini ditemukan 4 jenis lamun yang berbeda. Sedangkan pada Stasiun II didapat nilai indeks dominansi sebesar 0, 64. Nilai ini mengindikasikan adanya dua spesies (berimbang) yang mendominansi pada stasiun tersebut yaitu jenis Enhalus acoroides dan Thallasia hemprichii.
4.6. Hubungan Asosiasi antar Jenis Lamun dan Siput Gonggong yang sering Dijumpai dalam Petak Ukur
Untuk melihat hubungan keberadaan spesies siput gonggong pada berbagai jenis lamun yang menjadi habitatnya dapat digunakan nilai asosiasi, dimana hasil perhitungannya dapat di lihat pada Tabel 8.
Tabel 8. Nilai E(a), Xi² pada setiap stasiun
Stasun I Spesies Strombus turturella E(a) Xi² Enhalus acoroides 1,78 0,16 Stasiun II
Spesies Strombus turturella
E(a) Xi²
Enhalus acoroides 0,92 3,6
Thallasia hemprichii 1,33 1,23
Stasiun III
Spesies Strombus turturella
E(a) Xi²
Enhalus acoroides 0 0
Thallasia hemprichii 0 0
Cymodocea rotundata 0 0
Halodule uninervis 0 0
Berdasarkan perhitungan statistik pada Stasiun I didapatkan nilai a > E(a), X²hit < X²tab pada spesies jenis lamun Enhalus acoroides dengan siput gonggong jenis Strombus turturella maka dapat disimpulkan bahwa ada 1 hubungan asosiasi positif antara jenis lamun Enhalus acoroides dengan siput gonggong jenis Strombus turturella namun asosiasi/hubunganya tidak erat.
Pada Stasiun II ditemukan juga asosiasi positif antara jenis lamun Enhalus acoroides dengan siput gonggong jenis Strombus tuturella dengan nilai a > E(a), X²hit < X²tab ini menunjukkan adanya hubungan asosiasi positif. Hasil ini sesuai dengan keadaan di lokasi pengamatan dimana hampir setiap subplot ditemukan jenis lamunEnhalus acoroides ditemukan pula siput gonggong jenis Strombus turturella. Selain itu ditemukan pula asosiasi positif antara jenis lamunThallasia hemprichii dengan jenis siput gonggong Strombus turturella namun keduanya tidak menunjukkan keeratan. Dapat dilihat asosiasi antara siput gonggong dan lamun pada gambar 21.
Gambar 21. Asosiasi antara siput gonggong dan lamun dalam satu transek
Pada Stasiun III tidak ditemukan adanya asosiasi positif antara semua jenis lamun dan siput gonggong, karena semua nilai yang didapatkan yaitu a ≤ E(a), X²hit < X²tab. Sehingga semuanya menunjukkan hubungan asosiasi negatif dan tidak ada keeratan antar satu sama lain. Di stasiun ini tidak ditemukannya siput gonggong walaupun di lokasi ini ditemukan lamun dengan keanekaragaman yang cukup tinggi. Hal ini disebabkan karena kondisi substrat padang lamun merupakan pasir dan terlalu kasar untuk perkembangbiakan larva dan habitat siput gonggong.
4.7. Pengamatan Parameter Lingkungan Fisika dan Kimia Perairan 1. Kedalaman Perairan
Pada ketiga stasiun penelitian didapatkan kedalaman yang tidak berbeda jauh. Nilai rata-rata kedalaman di Stasiun I yaitu 23,43 cm, Stasiun II yaitu 0,2 cm, Stasiun III yaitu 0. Nilai tingkat kedalaman stasiun II dan III hampir seragam dikarenakan letak ketiga stasiun yang memiliki kesamaan kontur dasar perairan. Sedangkan pada Stasiun I terdapat perbedaan yang signifikan diakibatkan perbedaan waktu pengamatan yang terlalu pagi karena mengikuti kegiatan nelayan menggunakan sampan untuk sampai ke lokasi penelitian sebelum surut.
Kedalaman perairan yang terukur pada setiap stasiun tidak terlalu ideal bagi pertumbuhan dan perkembangan lamun yang merupakan vegetasi perairan dangkal. Proses fotosintesis yang optimal karena penetrasi cahaya yang cukup didukung oleh dangkalnya perairan. Namun terlalu dangkalnya perairan ketika surut terendah membuat lamun mendapatkan sinar matahari yang berlebih dan lama kelamaan dapat menyebabkan kekeringan terhadap daun lamun yang kemudian menyebabkan rusaknya ekosistem lamun akibat paparan sinar matahari yang berlebih.
Berbeda dengan kondisi siput gonggong yang tidak terlalu bergantung terhadap kedalaman perairan karena siput gonggong lebih tergantung terhadap substrat hidupnya. Menurut Hynes (1978) dalam Honata (2010) faktor utama yang menentukan penyebaran, kepadatan, dan komposisi jenis bentik adalah substrat dasar perairan, yaitu lumpur, pasir tanah liat berpasir, kerikil, dan batu. Tipe substrat suatu perairan akan mempengaruhi penyebaran, kepadatan, dan komposisi bentos.
Gambar 22. Grafik rata-rata kedalaman di tiap stasiun (cm)
2. Suhu
Suhu dapat mempengaruhi seluruh tahapan dalam siklus hidup suatu spesies dan dapat membatasi distribusi spesies tersebut melalui pengaruhnya terhadap kemampuan bertahan, reproduksi, pertumbuhan, dan kompetisi dengan organisme lainnya pada batas toleransi suhu. Berarti suhu perairan sangat berpengaruh terhadap proses-proses biologi maupun kimia baik pada biota-biota maupun pada perairan itu sendiri. Selain itu menurut (Dwianto, 2001), peningkatan suhu akan mempengaruhi kehidupan di perairan tersebut. Suhu mempengaruhi baik aktivitas metabolisme, laju fotosintesis, proses fisiologi hewan dan perkembangan atau faktor reproduksi dari organisme.
Kondisi suhu perairan memiliki pengaruh memiliki pengaruh bagi kelangsungan hidup lamun maupun siput gonggong. Berdasarkan pengukuran langsung di lapangan didapatkan suhu rata-rata pada ketiga stasiun yaitu berkisar antara 29 – 31°C. Suhu air terendah yaitu 29,7°C didapat pada Stasiun I, sedangkan suhu tertinggi pada Stasiun III yaitu 30,8°C. Nilai parameter suhu perairan yang didapat tidak jauh berbeda hal ini disebabkan karena tingkat kedalaman perairan yang tidak jauh berbeda dan waktu pengukuran di setiap stasiun yang tidak jauh berbeda pula yaitu antara pukul 07.00 – 11.00 WIB. Dimana cahaya matahari yang masuk ke perairan intensitasnya belum terlalu tinggi.
Berdasarkan hasil pengukuran di lapangan mengindikasikan bahwa suhu air laut di semua stasiun penelitian cocok dalam kisaran suhu ideal baik bagi
0,00 10,00 20,00 30,00 Kedalaman Stasiun I Stasiun II Stasiun III
pertumbuhan dan perkembangan siput gonggong yaitu antara28,5 – 29,9°C. Menurut (Hyman, 1955), lamun bisa tumbuh dan berkembang hingga kisaran 35°C.
Gambar 23. Grafik rata-rata suhu perairan di tiap stasiun (°C )
2. Kecepatan Arus
Kecepatan arus pada ketiga stasiun penelitian tidak memiliki perbedaan yang signifikan yaitu pada Stasiun I sebesar 0,041 ms ֿ ², pada Stasiun II 0,064 ms ֿ ², dan pada Stasiun III sebesar 0,079 ms ֿ ². Hal ini diperkirakan karena perbedaan penutupan lamun pada ketiga stasiun. Pada Stasiun I ditemukan vegetasi penutupan lamun dengan tingkat kerapatan sedang dibandingkan kedua stasiun lainnya. Selain jenis lamun Enhalus acoroidesyang mendominasi, rimbun dan panjangnya daunEnhalus acoroides menyebabkan arus yang masuk akan lebih teredam yang menyebabkan kondisi perairan lebih tenang.
Berbeda dengan Stasiun III yang memiliki tingkat kerapatan lamun yang tinggidiantara stasiun lainnya dan hanya didominasi oleh jenis lamun berdaun kecil maka arus air laut tidak banyak tereduksi.
Gambar 24. Grafik rata-rata kecepatan arus di tiap stasiun (ms ֿ ²)
29,00 29,50 30,00 30,50 31,00 Suhu Stasiun I Stasiun II Stasiun III 0 0,02 0,04 0,06 0,08 Arus Stasiun I Stasiun II Stasiun III
4. Kecerahan
Pada kedua stasiun penelitian didapatkan tingkat kecerahan sebesar 100%. Ini dikarenakan di setiap stasiun pengamatan memiliki tingkat kedalaman yang hampir seragam kecuali pada Stasiun I yang memiliki tingkat kecerahan sebesar 70% karena selain kedalaman yang tinggi, substratnya berupa lumpur.Berdasarkan hasil pengukuran maka nilai transparansi pada ketiga stasiun ideal untuk pertumbuhan dan perkembangan lamun.
5. Kandungan Oksigen terlarut (DO)
Menurut KepMen LH No 51 tahun 2004, nilai baku mutu air laut yang optimal yaitu >5 mg/l untuk kandungan Oksigen terlarut. Kadar oksigen terlarut optimum bagi moluska bentik adalah 4,1 - 6,6 mg/l, sedangkan kadar minimal yang masih dalam batas toleransi adalah 4 mg/l (Clark, 1974).Ini berarti pada ketiga stasiun pengamatan tergolong dalam kondisi yang ideal baik bagi pertumbuhan dan perkembangan lamun serta siput gonggong. Yaitu 5,37 mg/l pada Stasiun I, 4,86 mg/l pada Stasiun II dan 5,09 mg/l pada Stasiun III.
Gambar 25. Grafik rata-rata DO perairan di tiap stasiun (mg/l)
6. Derajat Keasaman (pH)
Nilai derajat keasaman (pH) pada setiap stasiun memiliki nilai yang hampir sama yaitu antara 7,53 – 8,06 berarti dari pH netral hingga sedikit basa, keadaan pH ini menunjukkan homogenitas pH pada tiap stasiun. Umumnya pH air laut tidak menunjukkan perbedaan yang besar.
4,60 4,80 5,00 5,20 5,40 DO Stasiun I Stasiun II Stasiun III
Menurut KepMen LH No. 51 Tahun 2004 pH perairan optimal bagi pertumbuhan lamun yaitu dalam kisaran 7 – 8,5. Ini berarti pada ketiga stasiun pengamatan tergolong dalam kondisi pH perairan yang ideal baik bagi pertumbuhan dan perkembangan lamun maupun siput gonggong.
Gambar 26. Grafik rata-rata pH perairan di tiap stasiun
7. Salinitas
Beradasarkan pengukuran langsung di ketiga stasiun penelitian didapatkan nilai rata-rata salinitas yang berkisar antara 28 – 30 ‰. Dimana kisaran salinitas tersebut cocok bagi kelangsungan hidup baik lamun maupun siput gonggong. Lamun memiliki toleransi salinitas yang berbeda-beda, namun sebagian besar mempunyai rentang kisaran toleransi salinitas antara 10 – 40 ‰, sedangkan nilai optimum lamun terhadap salinitas air laut ialah 35 ‰.
Gambar 27. Grafik rata-rata salinitas perairan di tiap stasiun (‰)
6,90 7,00 7,10 7,20 pH Stasiun I Stasiun II Stasiun III 27,00 28,00 29,00 30,00 Salinitas Stasiun I Stasiun II Stasiun III 7,2 7 7,17
4.8.Pengamatan Substrat
Berdasarkan pengamatan secara visual di ketiga stasiun penelitian, maka didapatkan tipe substrat :
Stasiun I : Substrat lumpur
Stasiun II : Substrat pasir dengan sedikit lumpur Stasiun III : Substrat pasir dengan sedikit lumpur
Pengamatan substrat dilanjutkan pada analisis besar butir dan kandungan unsur hara di Laboratorium Kesuburan Tanah Fakultas Pertanian Universitas Padjadjaran Jatinangor, kemudian data diolah kembali menggunakan segitiga miller. Maka didapatkan hasilnya seperti terlihat pada Tabel
Tabel 9. Analisis besar butir dengan segitiga miller
Jika komposisi substrat di atas dikaitkan dengan kelimpahan siput gonggong di masing-masing stasiun, maka siput gonggong lebih banyak ditemukan pada lokasi yang komposisi substratnya didominasi oleh substrat lunak (lumpur), hal ini diperkuat dengan hasil pada Stasiun III yang didominasi substrat pasir tidak ditemukan siput gonggong. Sedangkan pasa Stasiun I dan Stasiun II dimana pada masing-masing stasiun ditemukan 7 dan 4 individu siput gonggong . Hasil analisis kandungan unsur hara dapat dilihat pada Tabel 10.
Tabel 10. Kandungan unsur hara STASIUN
TEKSTUR (%)
Analisis Tekstur Pasir Debu Liat
Stasiun I 33 46 22 Lempung
Stasiun II 56 16 14 Pasir Berlempung
STASIUN C – org N – total
Stasiun I 1.86 0.13
Stasiun II 0.38 0.03
Stasiun III 0.42 0.07
Kandungan unsur hara tertiggi berada pada Stasiun I dimana siput gonggong terbanyak ditemukan. Ini mengindikasikan bahwa sebagian besar siput gonggong lebih menyukai substrat yang halus karena pada jenis substrat ini siput gonggong lebih mudah untuk mendapatkan sumber makanannya yang terkandung dalam endapan di habitatnya (substrat) berupa unsur-unsur hara dan sisa-sisa pembusukan makhluk hidup.
Substrat dasar suatu perairan sangat berpengaruh terhadap sebaran dan kelimpahan dari siput gonggong. Siput gonggong mencerna bahan organik yang terdapat dalam pertikel-partikel substrat tersebut. Berbeda dengan Stasiun III yang komposisinyadidominasi oleh pasir dan sedikitnya kandungan zat hara pada substratnya.Pada substrat yang didominasi pasir, larva siput gonggong tidak dapat bertahan hidup karena siput ini memerlukan substrat yang lebih halus untuk membenamkan diri dan mendapatkan makanan.