Pada bab keenam ini akan dipelajari tentang pengertian larutan buffer, macam-macam larutan buffer, sifat larutan buffer, dan fungsi larutan buffer.
BAB 6
LARUTAN BUFFER
Larutan buffer adalah larutan yang mengandung asam lemah dan basa konjugasinya atau basa lemah dan asam konjugasinya. Larutan buffer mempunyai sifat menyangga usaha untuk mengubah pH seperti penambahan asam, basa, atau pengenceran. Artinya, pH larutan buffer praktis tidak berubah walaupun kepadanya ditambahkan sedikit asam kuat atau basa kuat atau bila larutan diencerkan.
A. Pengertian Larutan Buffer
Larutan buffer adalah larutan yang dapat menyangga (mempertahankan) pH. Larutan buffer memiliki pH yang
konstan, terhadap pengaruh pengenceran atau ditambah
sedikit asam atau basa. Secara teoritis berapa pun diencer-kannya pH tidak akan berubah, tetapi dalam praktiknya jika pengenceran besar sekali, jelas pH-nya akan berubah. Nama lain larutan buffer adalah larutan dapar atau larutan penyang-ga.
Tujuan Pembelajaran
Setelah merancang dan melakukan percobaan, diharapkan siswa mampu:
1. Mengukur pH larutan buffer dan bukan buffer setelah ditambah sedikit asam, basa, atau pengenceran.
2. Menghitung pH atau pOH larutan buffer dengan menggunakan prinsip kesetim-bangan.
3. Menjelaskan fungsi larutan buffer dalam kehidupan sehari-hari.
Bab 6
B. Macam-macam Larutan Buffer
1. Larutan buffer yang mengandung campuran asam lemah dan basa konjugasinya
Contoh:
Larutan yang terdiri atas: CH3COOH dan CH3COONa
Rumus: [H+] = [asam]
[basa konjugasi]
a
K
pH = –log [H+]
Keterangan:
Ka = tetapan ionisasi asam [asam] = konsentrasi asam
[basa konjugasi] = konsentrasi basa konjugasi
Contoh soal:
a. Berapa pH campuran yang terdiri atas 50 mL larutan CH3COOH 0,2 M dan 50 mL larutan CH3COONa 0,1 M bila Ka = 10–5?
Jawab: [H+] = [asam]
[basa konjugasi]
a
K
= 10–5 (0,2 )
(0,1 )
M M
= 2 10–5
pH = –log 2 10–5
= 5 – log 2
b. Tentukan pH larutan bila 25 mL larutan CH3COOH 0,2 M dicampurkan dengan 25 mL larutan KOH 0,1 M
Jawab:
[H+] = [asam]
[basa konjugasi]
a
K
= 10–5 (2,5 mmol)
(2,5 mmol)
= 10–5
pH = –log 10–5
= 5
2. Larutan buffer yang mengandung campuran basa lemah dan asam konjugasinya
Contoh: larutan yang terdiri atas NH4OH dan NH4Cl
Rumus: [OH–] = [basa]
[asam konjugasi]
b
K
pOH = –log [OH–]
pH = 14 – pOH
Keterangan:
Kb = tetapan ionisasi basa [basa] = konsentrasi basa
[asam konjugasi] = konsentrasi asam konjugasi
Contoh soal:
a. Sebanyak 50 mL larutan NH4OH 0,1 M dicampur dengan 50 mL (NH4)2SO4 0,1 M. Hitung pH cam-puran yang terjadi jika Kb = 10–5!
Jawab:
Campuran berisi larutan NH4OH dan + 4 NH maka bersifat buffer basa.
CH3COOH + KOH o CH3COOK + H2O
Untuk lebih memahami sifat larutan buffer, maka akan dipelajari pengaruh penambahan asam kuat, basa kuat, dan pengenceran terhadap pH larutan buffer dan larutan bukan buffer. Sebagai larutan buffer digunakan larutan yang me-ngandung CH3COOH 0,1 M dan NaCH3COO 0,1 M, sedangkan larutan bukan buffer digunakan larutan NaCl 0,1 M. Kegiatan 6.1 dilakukan sebagai berikut. Sebanyak 9 gelas kimia ukuran 100 mL diisi dengan larutan buffer masing-masing 10 mL. Kemudian, ke dalam gelas:
1 ditambahkan 1 mL larutan HCl 0,1 M
2 ditambahkan 5 mL larutan HCl 0,1 M
3 ditambahkan 10 mL larutan HCl 0,1 M
4 ditambahkan 11 mL larutan HCl 0,1 M
5 ditambahkan 1 mL larutan NaOH 0,1 M
6 ditambahkan 5 mL larutan NaOH 0,1 M
7 ditambahkan 10 mL larutan NaOH 0,1 M
8 ditambahkan 11 mL larutan NaOH 0,1 M
9 ditambahkan 20 mL air suling.
Setelah itu pH larutan pada setiap gelas diukur dengan indikator universal. Hal yang sama dilakukan pula terhadap larutan bukan buffer. Secara teori, pH larutan-larutan yang diuji pada Kegiatan 6.1 di atas adalah sebagai berikut.
pH awal: Larutan buffer: (4,75) Larutan bukan buffer: 7
pH setelah penambahan larutan HCl dan NaOH serta setelah pengenceran:
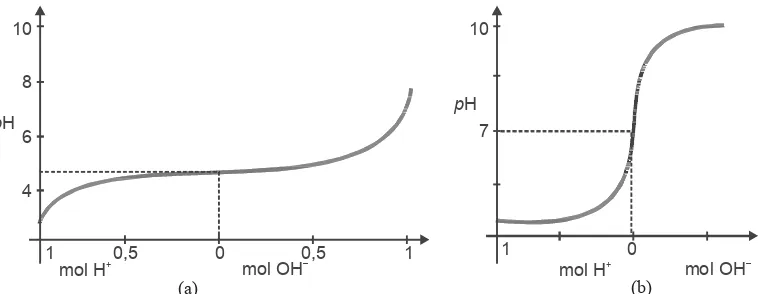
Perubahan pH larutan buffer dan bukan buffer di atas dalam bentuk grafik ditunjukkan oleh gambar 6.2.
Berdasarkan keterangan tersebut dapat disimpulkan sifat-sifat larutan buffer sebagai berikut.
1. pH larutan buffer praktis tidak berubah pada penambahan sedikit asam kuat atau sedikit basa kuat atau peng-enceran.
2. pH larutan buffer berubah pada penambahan asam kuat atau basa kuat yang relatif banyak, yaitu apabila asam kuat atau basa kuat yang ditambahkan menghabiskan komponen larutan buffer itu, maka pH larutan akan ber-ubah drastis.
3. Daya penyangga suatu larutan buffer bergantung pada jumlah mol komponennya, yaitu jumlah mol asam lemah dan basa konjugasinya atau jumlah mol basa lemah dan asam konjugasinya.
Gambar 6.2 Grafik perubahan pH larutan buffer (a) dan larutan bukan buffer (b) pada penambahan asam kuat dan basa kuat
½ ¾
¿ditambah 0,001 mol HCl
Untuk lebih jelasnya perhatikan contoh soal berikut.
Contoh soal:
100 mL larutan yang mengandung CH3COOH 0,01 mol dan CH3COONa 0,02 mol dan Ka = 10–5.
Tentukan: 1. pH larutan;
2. pH larutan bila ditambah 0,001 mol HCl; 3. pH larutan bila ditambah 0,001 mol NaOH;
4. pH larutan bila diencerkan dengan menambah 100 mL air!
Jawab:
1. [CH3COOH] = 0,01 mol/0,1 liter = 0,1 M
[CH3COONa] = 0,02 mol/0,1 liter = 0,2 M
[H+] = [asam]
[basa konjugasi]
a
K
= 10–5 (0,1)
(0,2)
= 1
2 10
–5
pH = –log 1
2 10
–5
= 5 + log 2 = 5 + 0,3010 = 5,30
2. CH3COOH = 0,01 mol CH3COONa = 0,02 mol
Reaksi:
CH3COONa + HCl o CH3COOH + NaCl
½ ¾
¿ditambah 0,001 mol NaOH
[H+] = [asam]
[basa konjugasi]
a
K
= 10–5 (0,011)
(0,019)
= 10–5 11
19
pH = –log 11
19 10
–5
= 5 – log 11
19
= 5,24
3. CH3COOH = 0,01 mol CH3COONa = 0,02 mol
Reaksi: CH3COOH + NaOH o CH3COONa + H2O
t = 0: 0,01 mol 0,001 mol 0,02 mol yang bereaksi: 0,001 mol 0,001 mol – setelah reaksi: 0,009 mol – 0,021 mol (Reaksi bergeser ke kanan)
[H+] = [asam]
[basa konjugasi]
a
K
= 10–5 (0,009)
(0,021)
= 10–5 9
21
pH = –log 9
21 10
–5
= 5 – log 9
21
Larutan buffer digunakan secara luas dalam kimia analitis, biokimia, dan bakteriologi, juga dalam fotografi, industri kulit, dan zat warna. Dalam tiap bidang tersebut, terutama dalam biokimia dan bakteriologi, diperlukan rentang pH tertentu yang sempit untuk mencapai hasil optimum. Kerja suatu enzim, tumbuhnya kultur bakteri, dan proses biokimia lainnya sangat sensitif terhadap perubahan pH.
Cairan tubuh, baik cairan intra sel maupun cairan luar sel, merupakan larutan buffer. Sistem buffer yang utama dalam
D. Fungsi Larutan Buffer
4. CH3COOH = 0,01 mol CH3COONa = 0,02 mol
[H+] = [asam]
[basa konjugasi]
a
K
= 10–5 (0,01 mol/0,2 l)
(0,02 mol/0,2 l)
= 1
2 10
–5
pH = –log 1
2 10
–5
= 5 + log 2 = 5 + 0,3010 = 5,3010
Berdasarkan contoh soal di atas dapat dilihat peru-bahan harga pH sangat kecil maka dapat disimpulkan bahwa sifat larutan buffer bila ditambah sedikit asam, basa, atau pengenceran pH-nya tetap.
½ ¾ ¿
cairan intra sel adalah pasangan asam basa konjugasi
dihidro-genfosfat-monohidrogenfosfat (H PO2 4– 2 4
HPO ). Sistem ini
bereaksi dengan asam dan basa sebagai berikut.
Adapun sistem penyangga utama dalam cairan luar sel (darah) adalah pasangan asam basa konjugasi asam
karbonat bikarbonat (H2CO3 – HCO ).3 Sistem ini bereaksi
dengan asam dan basa sebagai berikut.
H2CO3(aq) + OH–(aq)
Sistem penyangga di atas membantu menjaga pH darah hampir konstan, yaitu sekitar 7,4.
Perbandingan konsentrasi HCO3 terhadap H2CO3 yang diperlukan untuk menjadikan pH = 7,4 adalah 20 : 1. Jumlah HCO3 yang relatif jauh lebih banyak itu dapat dimengerti
karena hasil-hasil metabolisme yang diterima darah lebih banyak yang bersifat asam. Proses metabolisme dalam jaringan terus-menerus membebaskan asam-asam seperti asam laktat, asam fosfat, dan asam sulfat. Ketika asam-asam itu memasuki pem-buluh darah maka ion HCO3 akan berubah menjadi H2CO3, kemudian H2CO3 akan terurai membentuk CO2. Pernapasan akan meningkat untuk mengeluarkan kelebihan CO2 melalui paru-paru. Apabila darah harus menerima zat yang bersifat basa maka H2CO3 akan berubah menjadi HCO3. Untuk
mem-pertahankan perbandingan HCO3/H2CO3 tetap 20 : 1 maka
Apabila mekanisme pengaturan pH dalam tubuh gagal, seperti dapat terjadi selama sakit, sehingga pH darah turun di bawah 7,0 atau naik ke atas 7,8, dapat menyebabkan keru-sakan permanen pada organ tubuh atau bahkan kematian.
Faktor-faktor yang dapat menyebabkan keadaan
asidosis (penurunan pH) adalah penyakit jantung, penyakit ginjal, diabetes mellitus (penyakit gula), diare yang terus-menerus, atau makanan berkadar protein tinggi dalam jangka waktu lama. Keadaan asidosis sementara dapat terjadi karena olahraga intensif yang dilakukan terlalu lama. Alkalosis
(peningkatan pH darah) dapat terjadi sebagai akibat muntah yang hebat, hiperventilasi (bernapas terlalu berlebihan, kadang-kadang karena cemas atau histeris atau berada di ketinggian). Suatu penelitian yang dilakukan terhadap para pendaki gunung yang mencapai puncak Everest (8.848 m) tanpa oksigen tambahan menunjukkan pH darah mereka berada di antara 77,7–7,8. Hiperventilasi diperlukan untuk mengatasi tekanan oksigen yang amat rendah (kira-kira 43 mmHg) di tempat setinggi itu.
Percobaan
pH Larutan Buffer
Tujuan: mengamati perubahan pH larutan buffer
Alat dan Bahan:
- erlenmeyer - CH3COOH 0,1 M
- tabung reaksi - CH3COONa 0,1 M
- indikator universal - NaOH 0,1 M - pipet tetes - akuades/air - NaCl 0,1 M
Cara Kerja:
1. Masukkan 3 mL CH3COOH 0,1 M dengan 3 mL CH3COONa 0,1 M dalam erlenmeyer dan kocoklah. 2. Ambillah masing-masing 1 mL campuran tersebut
3. Tambahkan tetes demi tetes NaOH 0,1 M sampai p H-nya berubah dan catat berapa tetes NaOH yang diperlukan.
4. Tambahkan tetes demi tetes HCl 0,1 M pada tabung kedua sampai pH-nya berubah dan catat HCl yang diperlukan.
5. Tambahkan akuades ke dalam tabung reaksi ketiga sampai pH-nya berubah dan catat H2O yang diperlukan. 6. Ulangi percobaan di atas dengan mengganti cam-puran pada langkah nomor 1 dengan larutan NaCl 0,1 M lalu bandingkan hasilnya dan buatlah kesim-pulan.
1. Larutan buffer (penyangga) adalah larutan yang mengandung asam lemah dan basa konjugasinya atau basa lemah dan asam konjugasinya.
2. Rumus menghitung pH larutan buffer adalah sebagai berikut.
a. Larutan buffer yang mengandung asam lemah dan basa konjugasinya.
pH = pKa + log
>
>
@
@
basa konjugasi asam
b. Larutan buffer yang mengandung basa lemah dan asam konjugasinya.
pOH = pKb + log
>
>
@
@
asam konjugasi
basa
3. Sifat-sifat larutan buffer:
a. pH larutan tidak berubah jika larutan diencerkan;