Skripsi
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi
Oleh:
Sri Widya Kurniawati NIM: 104102003264
PROGRAM STUDI FARMASI
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN UNIVERSITAS ISLAM NEGERI (UIN) SYARIF HIDAYATULLAH
JAKARTA 1429 H / 2008 M
LEMBAR PERSETUJUAN SKRIPSI
NAMA : SRI WIDYA KURNIAWATI
NIM : 104102003264
JUDUL : AKTIVITAS ANTIBAKTERI DARI EKSTRAK ETANOL DAUN ASAM JAWA (Tamarindus indica Linn.) TERHADAP KULTUR AKTIF Staphylococcus aureus DAN Escherichia coli
Disetujui oleh :
Pembimbing I Pembimbing II
Nurmeilis, M.Si, Apt Megga Rat nasari Pi k ol i , M . S i
NIP. 150370225 NIP. 150321587
Mengetahui,
Ketua Program Studi Farmasi UIN Syarif Hidayatullah Jakarta
D
LEMBAR PERNYATAAN
DENGAN INI SAYA MENYATAKAN BAHWA SKRIPSI INI
BENAR-BENAR HASIL KARYA SENDIRI YANG BELUM
PERNAH DIAJUKAN SEBAGAI SKRIPSI ATAU KARYA
ILMIAH PADA PERGURUAN TINGGI ATAU LEMBAGA
PENDIDIKAN MANAPUN.
KATA PENGANTAR
Alhamdulillah, segala puji syukur penulis panjatkan kehadirat Allah SWT yang telah memberikan rahmat dan karunia-Nya sehingga penulis dapat
menyelesaikan penelitan dan penyusunan skripsi ini dengan judul ”Aktivitas Antbakteri dari Ekstrak Etanol Daun Asam Jawa (Tamarindus indica Linn.) terhadap Kultur Aktf Staphylococcus aureus dan Escherichia coli”. Skripsi ini disusun sebagai salah satu syarat untukmenyelesaikan program pendidikan tngkat sarjana Strata 1 (S1) pada Program Studi Farmasi, Fakultas Kedokteran dan Ilmu Kesehatan, Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
Pada kesempatan ini, penulis ingin mengucapkan terima kasih yang tak terhingga kepada :
1. Ibu Nurmeilis, M.Si, Apt. dan Ibu Megga Ratnasari Pikoli, M.Si, sebagai pembimbing yang sangat baik dan dengan sabar telah memberikan pengarahan, bimbingan, nasehat, dan petunjuk selama penelitan dan penyusunan skripsi ini.
2. Bapak Prof. Dr (hc). Dr, M. K Tadjudin, Sp. And, selaku dekan Fakultas Kedokteran
dan Ilmu Kesehatan UIN yang telah memberikan kesempatan kepada penulis untuk melakukan penelitan.
3. Bapak Drs. M. Yanis Musdja M. Sc, Apt sebagai Ketua Jurusan Farmasi serta karyawan Jurusan Farmasi UIN yang telah memberi kesempatan kepada penulis
untuk menyelesaikan penelitan dan penyusunan skripsi ini.
4. Dosen-dosen UIN yang telah sabar mendidik dan membantu penulis sejak awal sampai penulis menyelesaikan skripsi ini.
5. Bapak Dr. Eko Baroto Walujo, APU sebagai kepala bidang botani dari Herbarium Bogoriense LIPI Cibinong yang telah membantu mengidentfikasi sample.
6. Ibu Sinta dari dari Departemen Mikrobiologi Fakultas Kedokteran Universitas Indonesia.
8. Ayah, Mama, Via, Yoga dan Naya yang selalu memberikan doa,
dukungan, perhatan, semangat, cinta dan kasih sayang kepada penulis sehingga skripsi ini dapat terselesaikan.
9. Ipeh, Yuni, Egi, Dwi, dan Dian yang selalu menemaniku dalam berbagai situasi dan
kondisi serta memberikan perhatan lebih, bantuan, doa kepada penulis agar tetap sabar menyelesaikan skripsi ini.
10. Semua teman-teman Farmasi UIN angkatan’04 dan adik-adik kelas yang telah memberikan dorongan kepada penulis, terutama Nenda, Hariri, Lili, Syahadah, Ayie,
Vana dan Putri di Surabaya yang memberikan dukungan, bantuan, semangat serta doa hingga akhir penulisan skripsi ini.
Penulis menyadari bahwa masih banyak kekurangan dalam penulisan skripsi ini,
oleh karena itu kritk dan saran dari pembaca sangat diharapkan. Semoga penelitan ini dapat bermanfaat bagi ilmu pengetahuan dan kesehatan masyarakat.
Jakarta, Desember 2008
ABSTRAK
JUDUL : AKTIVITAS ANTIBAKTERI DARI EKSTRAK
ETANOL DAUN ASAM JAWA (Tamarindus indica Linn.) TERHADAP KULTUR AKTIF Staphylococcus aureus DAN Escherichia coli
NAMA : SRI WIDYA KURNIAWATI
FAKULTAS : KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDY FARMASI
Telah dilakukan penelitian tentang aktivitas antibakteri dengan menggunakan ekstrak etanol daun asam jawa (Tamarindus indica Linn.) terhadap bakteri Escherichia coli dan Staphylococcus aureus pada kultur aktif. Berdasarkan literatur dan pengalaman masyarakat (empiris) daun asam jawa dapat digunakan sebagai obat tradisional, yaitu untuk obat luar seperti bisul dan obat dalam seperti sariawan, demam dan batuk. Pengujian aktivitas antibakteri,penentuan Konsentrasi Hambat Minimun (KHM) dan penetapan potensi dilakukan dengan menggunakan metode hitungan cawan. Potensi antibakteri ditentukan dengan menggunakan amoksisilin sebagai antibakteripembanding.
Berdasarkan penelitian ini dapat diketahui bahwa kedua bakteri berada dalam masa paling aktif pada jam ke-2,25, karena pada titik waktu ini nilai µ yaitu, 0,037 pada E. coli dan
0,028 pada S. aureus. Nilai KHM yang diperoleh untuk bakteri E. coli adalah 80 mg/ml (80.000 ppm) dan untuk bakteri S. aureus adalah 28 mg/ml (28.000 ppm). Potensi ekstrak etanol daun asam jawa yang didapat adalah 80 mg/ml
(Tamarindus indica Linn.) memiliki daya hambat terhadap bakteri E. coli dan S. aureus walaupun potensinya relatif lebih kecil dibandingkan amoksisilin.
ABSTRACT
TITLE : ANTIBACTERIAL ACTIVITY TAMARIND LEAVES ETHANOL EXTRACT (Tamarindus indica Linn.) AGAINST ACTIVE CULTURE OF Staphylococcus aureus AND Escherichia coli
NAME : SRI WIDYA KURNIAWATI
FACULTY : MEDICAL AND SANITARY SCIENCE MAJORING IN PHARMACHY
A research about antibacterial activity assessment by using tamarind leafs ethanol extract (Tamarindus indica Linn.) against active culture of Staphylococcus aureus and Escherichia coli has been done. Based on literature
and experience of public (empiric) tamarind leafs serve the purpose of traditional medicine, for external drug like abscess and internal medicine like sprue, fever
and cough. Examination of antibacterial activity, determination of Minimum Inhibitory Concentration (MIC) and determination of its potency were done by
using total plate count method. Antibacterial potency was determined by using amoxicillin as antibacterial comparator. Both of bacteria stayed during most active at the time of 2.25 hour, because at the point the assessed µ (specific growth constant) was 0.028 per hour for S. aureus and 0.037 per hour for E. coli. MIC value obtained for S. aureus was 28 mg/ml (28000 ppm) and E. coli was 80 mg/ml (80000 ppm). Tamarind leafs ethanol extract potency against S. aureus was 80 mg/ml (80000 ppm) which was equivalent with 0.04 mg/ml (40 ppm) amoxicillin and against E. coli was 28 mg/ml (28000 ppm) which was equivalent with 0.04 mg/ml (40 ppm) amoxicillin. Those results showed that tamarind leafs ethanol extract (Tamarindus indica Linn.) had inhibition against the active culture
of S. aureus and E. coli although the potency was relative smaller than amoxicillin did.
DAFTAR ISI
Halaman
KATA PENGANTAR
iABSTRAK
iiiABSTRACT
ivDAFTAR ISI
vDAFTAR TABEL
viiiDAFTAR GAMBAR
ixDAFTAR LAMPIRAN
xBAB I PENDAHULUAN
1.1. Latar Belakang 1
1.2. Perumusan Masalah 2
1.3. Hipotesis 2
1.4. Tujuan Penelitan 3
BAB II TINJAUAN PUSTAKA
2.1. Tumbuhan Asam Jawa (Tamarindus indica Linn.) 4
2.1.1. Klasifikasi 4
2.1.2. Morfologi 5
2.1.3. Habitat 8
2.1.4. Budidaya 9
2.1.5. Penggunaan 9
2.1.6. Kandungan Kimia 9
2.1.7. Kegunaan 10
2.2. Metode Ekstraksi 10
2.3. Metode Pengujian Antbakteri 14
2.3.1. Metode Difusi 14
2.3.2. Metode Dilusi 16
2.3.3. Metode Hitungan Cawan 18
2.4. Tinjauan Tentang Bakteri 19
2.4.1. Karakter Bakteri 19
2.4.2. Pertumbuhan Bakteri 20
2.5. Infeksi Bakteri Pada Manusia 27
2.6. Tinjauan Tentang Antibakteri 29
2.6.1. Aktivitas Antbakteri 29
2.6.2. Mekanisme Kerja Antbakteri 32
2.6.3. Antbakteri Pembanding Yang Digunakan 32
2.7. Macam-macam Medium 33
BAB III KERANGKA KONSEP
35BAB IV METODOLOGI PENELITIAN
4.1. Waktu dan Tempat Penelitan 37
4.2. Alat dan Bahan 37
4.3. Metode Penelitan 38
4.3.1. Persiapan Bahan, Media dan Alat 38
4.3.2. Pembuatan Kurva Tumbuh Bakteri 40
4.3.3. Pengujian Aktvitas Antbakteri Ekstrak Daun Asam Jawa 41
4.4. Analisa Data 43
BAB V HASIL DAN PEMBAHASAN
5.1. Hasil 44
BAB VI KESIMPULAN DAN SARAN
6.1. Kesimpulan 53
6.2. Saran 53
DAFTAR PUSTAKA
54LAMPIRAN
56DAFTAR TABEL
Halaman
1. Penggolongan bakteri menurut suhu 23
2. Hasil perhitungan jumlah koloni bakteri yang dihambat dengan 45 ekstrak etanol daun asam jawa.
3. Hasil perhitungan jumlah bakteri yang mempunyai daya hambat 46 minimum ekstrak etanol daun asam jawa.
4. Hasil perbandingan ekstrak etanol daun asam jawa dengan antbiotk 47 pembanding (amoksisilin)
5. Pengukuran absorbansi pada bakteri Escherichia coli 60 6. Pengukuran absorbansi pada bakteri Staphylococcus aureus 60
7. Log jumlah sel bakteri Escherichia coli 61
8. Log jumlah sel bakteri Staphylococcus aureus 61
9. Penetapan jumlah µ pada bakteri Escherichia coli 63
10. Penetapan jumlah µ pada bakteri Staphylococcus aureus 64 11. Perhitungan jumlah koloni bakteri dengan adanya ekstrak etanol 66
daun asam jawa
13. Perhitungan jumlah koloni bakteri dengan adanya antibiotk 67 Pembanding (amoksisilin)
DAFTAR GAMBAR
Halaman
1. Gambar kurva pertumbuhan 22
2. Skema alur penelitan 36
3. Kurva tumbuh bakteri Escherichia coli dalam medium NB 44
4. Kurva tumbuh Staphylococcus aureus dalam medium NB 45
5. Skema pembuatan ekstrak etanol daun asam jawa 56 (Tamarindus indica Linn.)
6. Skema pembuatan kurva tumbuh bakteri 57
7. Skema pembuatan suspensi bakteri 58
8. Kurva standar Staphylococcus aureus 62
9. Kurva standar Escherichia coli 62
10. Gambar daun asam jawa (Tamarindus indica Linn.) 68
11. Gambar pertumbuhan koloni bakteri Escherichia coli 70 terhadap aquadest steril
12.Gambar pertumbuhan koloni bakteri Staphylococcus aureus 70
terhadap aquadest steril
13. Gambar pertumbuhan koloni bakteri Escherichia coli terhadap ekstrak 71
etanol daun asam jawa
14. Gambar pertumbuhan koloni bakteri Staphylococcus aureus 71 terhadap ekstrak etanol daun asam jawa
15. Gambar pertumbuhan koloni bakteri Escherichia coli terhadap 72
amoksisilin
terhadap amoksisilin
16. Gambar alat-alat yang digunakan 73
DAFTAR LAMPIRAN
Halaman
1. Skema kerja 56
2. Perhitungan jumlah sel 59
3. Pengukuran absorbansi pada panjang gelombang 600 nm 60
4. Log jumlah sel bakteri 61
5. Kurva standar bakteri uji 62
6. Penetapan jumlah µ 63
7. Pengenceran suspensi bakteri 65
8. Perhitungan jumlah koloni bakteri 66
8. Sampel daun asam jawa (Tamarindus indica Linn.) 68
9. Hasil determinasi daun asam jawa 69
10. Gambar pertumbuhan koloni bakteri terhadap aquadest steril (kontrol) 70
11. Gambar pertumbuhan koloni bakteri uji 71
12. Gambar pertumbuhan koloni bakteri uji terhadap antbakteri pembanding 72
BAB I
PENDAHULUAN
1.1. Latar Belakang
Berbagai penelitian menunjukkan banyaknya kejadian resistensi terhadap antibiotika mikrobial sehingga pencarian obat alternatif untuk mengobati penyakit infeksi menjadi tantangan saat ini. Upaya lain dalam mengatasi penyakit infeksi adalah mencari senyawa-senyawa aktif yang berasal dari tumbuhan. Tumbuhan mampu memproduksi metabolit sekunder yang berpotensi sebagai zat aktif yang berkhasiat sebagai obat diantaranya sebagai antibakteri (Pelczar dan Chan, 1998). Salah satu tumbuhan yang dapat dimanfaatkan adalah asam jawa
(Tamarindus indica Linn.). Asam jawa dapat dikembangkan karena
diduga memiliki komponen bioaktif yang dapat dimanfaatkan sebagai
antibakteri. Berdasarkan literatur dan pengalaman masyarakat (empiris) daun
asam jawa dapat digunakan sebagai obat tradisional, yaitu untuk obat luar
seperti bisul dan obat dalam seperti sariawan, demam dan batuk. Luka,
sariawan, dan bisul merupakan gejala terjadinya serangan bakteri (Soesilo dkk,
1989).
Di daerah tropis seperti Indonesia, penyakit yang disebabkan oleh bakteri patogen memiliki peringkat yang cukup tinggi dalam urutan penyakit yang banyak diderita oleh masyarakat. Salah satu diantaranya adalah bakteri
Staphylococcus aureus yang dapat menyebabkan penyakit bisul, infeksi luka,
Kedua bakteri tersebut merupakan jenis-jenis yang sering menimbulkan infeksi pada manusia (Warsa dkk., 1993).
Penelitian ini bertujuan membuktikan aktivitas antibakteri ekstrak etanol daun asam jawa dan mengetahui Konsentrasi Hambat Minimum (KHM) yamg dilakukan dengan perhitungan jumlah sel bakteri yang dipengaruhinya melalui metode pour plate. Selain itu, penelitian ini juga menguji potensi daun asam jawa dengan membandingkannya dengan amoksisilin. Hasil penelitian ini diharapkan dapat menjadi informasi mengenai antibakteri alternatif yang relatif aman dengan memanfaatkan daun asam jawa.
1.2. Perumusan Masalah
Dalam penelitian ini yang menjadi perumusan masalah adalah sebagai berikut: 1. Apakah ekstrak etanol daun asam jawa mempunyai aktivitas antibakteri terhadap pertumbuhan S. aureus dan E. coli pada
kultur aktif ?
2. Berapa besar potensi ekstrak etanol daun asam jawa terhadap S. aureus dan E. coli dibandingkan dengan amoksisilin ?
1.3.Hipotesis
1. Ekstrak etanol daun asam jawa mempunyai aktifitas antibakteri terhadap pertumbuhan S. aureus dan E. coli pada kultur aktif.
2. Ekstrak etanol daun asam jawa mempunyai potensi yang sama sebagai antibakteri seperti amoksisilin.
1.4. Tujuan Penelitian
1. Penelitian ini masyrakat lua
1. Mengetahui pengaruh aktivitas antibakteri dari ekstrak etanol daun asam jawa terhadap pertumbuhan S. aureus dan E. coli pada kultur aktif.
2. Mengetahui potensi antibakteri ekstrak etanol daun asam jawa terhadap antibiotik pembanding (amoksisilin)
1.5. Manfaat Penelitian
diharapkan memberikan informasi tambahan bagi terutama para peneliti di bidang farmasi, tentang khasiat daun asam jawa (Tamarindus indica Linn.) sebagai antibakteri 2. Hasil penelitian diharapkan dapat memberikan obat alternatif kepada
2.1 Tumbuhan Asam Jawa (Tamarindus indica, Linn.)
Asam jawa (Tamarindus indica, Linn.) familianya Fabaceae merupakan sebuah kultivar daerah tropis dan termasuk tumbuhan berbuah polong. Biasanya tumbuh di Afrika yang kering dari Sahara sebelah selatan sampai di India. Tanaman diperbanyak dengan biji dan secara vegetatif. Biji untuk benih diambil dari buah yang telah masak dan dapat ditanam langsung atau disemaikan dahulu. Jika ditanam pada daerah yang banyak hujan, tanamannya kurang menghasilkan buah. daun asam jawa bertangkai panjang, sekitar 17 cm dan bersirip genap. Bunganya kuning kemerahan, buah polongnya berwarna coklat dengan rasa khas asam. Didalam buah polong selain terdapat kulit yang membungkus daging buah, juga terdapat biji berjumlah 2-5, berbentuk pipih, warna coklat agak kehitaman (Soesilo dkk,
1989).
2.1.1. Klasifikasi
Divisi : Magnoliophyta Kelas : Magnoliopsida
Ordo : Fabales
Famili : Fabaceae
2.1.2. Morfologi 1. Daun
Daun pada tanaman asam jawa ini termasuk ke dalam daun majemuk, yang lebih spesifik lagi merupakan daun majemuk menyirip genap karena saling berhadapan. Duduk daun bergantian, daun majemuk dengan 8-18 pasang anak daun, panjang anak daun
1-3,5 cm.
Dalam tanaman asam jawa ini termasuk ke dalam daun bertangkai yang memiliki bagian tangkai dan helaian daun saja, yaitu (Osman, 1998) :
a. Tangkai daun
Tangkai daun asam jawa memiliki penampang melintang yang bulat dan kecil. Tangkainya juga memiliki panjang ± 0,2 cm dan berwarna hijau.
b. Helaian daun 1. Bangun daun
Memiliki bagian daun terlebar di tengah-tengah helaian daun, yaitu bangun memanjang. T. indica memiliki panjang daun sampai 15 cm, lebarnya 0,5-1 cm.
2. Ujung daun
Memiliki ujung daun yang tumpul. 3. Pangkal daun
4. Susunan tulang-tulang daun
Memiliki susunan pertulangan daun yang menyirip, jadi biasanya disebut daun majemuk menyirip.
5. Tepi daun
Termasuk ke dalam tepi daun yang rata. 6. Daging daun
Memiliki daging daun yang tipis lunak. 7. Warna daun : Hijau
8. Permukaan daun : Halus 2. Batang
Asam jawa merupakan tanaman yang berbatang jelas, dengan batang yang biasanya keras dan kuat yang disebut dengan batang berkayu. Bentuk batang bulat, dengan pohon yang selalu tegak. Pohonnya selalu hijau, tinggi sampai 30 m dengan lebat dan menyebar, serta memiliki cabang yang pendek (Osman, 1998).
3. Akar
Akar dari tanaman asam jawa ini termasuk ke dalam golongan akar tunggang (radix primaria) yang menembus ke dalam tanah. Biasanya pada akar terdapat bagian-bagian seperti : leher akar
(collum), ujung akar (apex radicis), batang akar (corpus
rasicis), cabang-cabangakar (radix lateralis), serabut
4. Bunga
Termasuk ke dalam bunga majemuk yang terdiri atas bagian- bagian sebagai berikut :
a. Bagian-bagian yang bersifat seperti batang atau cabang, yaitu :
ibu tangkai bunga, tangkai bunga, dan dasar bunga.
b. Bagian-bagian yang bersifat seperti daun, yaitu : daun-daun kelopak, daun-daun mahkota, benang sari, dan daun-daun buah penyusun putik.
Bunga asam jawa ini berukuran kecil. Selain itu bersimetri banyak (polysimetris), memiliki kelopak yang termasuk ke dalam polysepalus atau antara kelopak yang satu dengan yang lainnya saling lepas. Pada mahkotanya saling lepas atau disebut polypetalus dengan warna kekuning-kuningan dan
polong itu tidak merekah dan ketika kering akan rapuh, panjangnya mencapai 5-15 cm dengan tebal 2,5 cm, agak melengkung dan membungkus biji. Kulit cangkang luar lunak dan daging buahnya asam. Daging buahnya asam sedap dan kulit buahnya coklat. Terdapat 1-10 biji setiap polong, dibungkus oleh daging buah yang lengket. Waktu muda daging buahnya berwarna putih kehijauan dan sesudah tua menjadi coklat (Osman, 1998). 6. Biji
Dalam satu kilogram terdapat 1.800-2.600 benih. Dimana memiliki panjang sampai 18 mm, bentuk tidak teratur, warna : kemerah-merahan, coklat tua atau hitam mengkilat (Osman, 1998).
2.1.3 Habitat
Budidaya
Tipe perkecambahannya epigeal (keping biji terangkat ke atas). Perkecambahan dimulai 7-10 hari setelah penaburan dan biasanya membutuhkan setidaknya satu bulan. Kecambah harus dihindarkan dari matahari. Saat tinggi 30 cm, semai siap ditanam di lapangan. Jika pertumbuhannya merana, semai dapat tetap dipersemaian sampai tahun berikutnya, tetapi akar semai hendaknya dipotong dan harus diperlakukan hati-hati selama pemindahan. Dimungkinkan melakukan pembiakan vegetatif yaitu stek cabang tempelan dan sambungan (Joker, 2002). Penggunaan
Asam biasanya ditanam sebagai penghasil buah, tapi juga penghasil kayu yang bernilai. Daging buah yang tinggi vitamin B dapat dimakan mentah atau dibuat selai, sirup atau permen. Bunga, daun dan biji juga dapat dimakan dan digunakandalam berbagai
masakan. Kayunya digunakan sebagai bahan mebel, kayu bakar dan arang. Daunnya mempunyai nilai yang tinggi sebagai makanan ternak. Akarnya yang dalam membuat jenis ini sangat tahan terhadap badai dan cocok sebagai penghalang angin (Joker, 2002). 2.1.6. Kandungan Kimia
lain protein, lemak, hidrat arang, kalsium, fosfor, zat besi, Vit A, Vit B1, dan Vit C. Kulit bijinya mengandung phlobatannin dan bijinya mengandung albumnoid serta pati. Dan daunnya mengandung Vit B (Soesilo, 1995). Serta daunnya juga berkhasiat memperlancar buang air besar dan menghilangkan rasa sakit, karena mengandung flavonoid, juga bersifat antiradang dan juga membantu mengeluarkan keringat (Yuniarti, 2008). 2.1.7. Kegunaan
Tumbuhan asam jawa secara tradisional telah digunakan sebagai obat
luar dan obat dalam. Manfaat untuk obat luar yaitu dengan cara menumbuknya
sampai halus lalu ditempelkan pada bagian yang sakit. Sedangkan
Ekstraksi merupakan salah satu cara pemisahan senyawa organik dari tumbuhan atau mikroorganisme. Simplisia yang di ekstrak mengandung senyawa aktif yang dapat larut dan senyawa yang tidak dapat larut seperti serat, karbohidrat, protein dan lain-lain. Sedangkan yang termasuk senyawa aktif yang terkandung dalam simplisia dapat digolongkan ke dalam golongan minyak seperti atsiri, alkaloid, flavonoid dan lain-lain.
dan massa atau serbuk yang tersisa di perlakukan sedemikian hingga memenuhi baku yang telah ditetapkan. Sebagian besar ekstrak di buat dengan mengekstraksi bahan baku obat secara perkolasi (Sampurno, 2000). Ada beberapa metode ekstraksi yang umum dan biasa digunakan yaitu :
a. Ekstraksi Dengan Menggunakan Pelarut A. Cara Dingin
1. Maserasi
Adalah proses pengekstraksian sederhana dengan cara merendam sampel dalam pelarut selama waktu tertentu yang dilakukan pada suhu kamar, sehingga sampel menjadi lunak dan larut. Jumlah pelarut yang dipakai tergantung pada banyaknya sampel. Cara ini dapat menarik zat-zat berkhasiat yang tahan pemanasan maupun yang tidak tahan pemanasan. 2. Perkolasi
Adalah proses pengekstraksian dengan melewatkan pelarut yang sesuai secara lambat pada sampel dalam suatu perkolator. Cara ini lebih sempurna dari maserasi. Zat berkhasiat yang rusak atau tidak rusak dengan pemanasan dapat tertarik seluruhnya, tetapi dibutuhkan pelarut yang lebih banyak.
B. Cara Panas
1. Sokletasi
dilakukan berulang-ulang sehingga lebih sempurna dan pelarut yang digunakan relatif sedikit.
2. Digestasi
Adalah proses pengekstraksian yang hampir sama dengan maserasi tapi dengan menggunakan pemanasan pada suhu 30˚-40˚C. Cara ini digunakan untuk sampel pada suhu biasa tidak tersari dengan baik. Jika pelarut yang digunakan mudah larut pada suhu kamar maka dapat digunakan alat pendingin tegak.
3. Dekoktasi dan Infus
Adalah sediaan cair yang dibuat dengan mengekstraksi simplisia nabati dengan air pada suhu 90˚C selama 15-20 menit untuk infus sedangkan dekoktasi 30 menit dengan suhu ≥30˚C dan temperaturnya sampai titik didih.
4. Refluks
Adalah ekstraksi dengan pelarut pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya
pendingin balik. Biasanya dilakaukan pengulangan sampai 3-5 kali sehingga dapat termasuk proses ekstraksi sempurna.
b. Destilasi Uap
kontinu sampai sempurna dan di akhiri dengan kondensasi fase uap campuran (senyawa kandungan menguap ikut terdestilasi) menjadi destilat air bersama senyawa kandungan yang memisah sempurna atau memisah sebagian.
c. Cara Ekstraksi Lainnya :
1. Ekstraksi Berkesinambungan
Adalah proses yang dilakukan berulangkali dengan pelarut yang berbeda atau resirkulasi cairan pelarut dan prosesnya tersusun berturutan beberapa kali.
2. Superkritikal Karbondioksida
Penggunaan prinsip superkritik untuk ekstraksi serbuk simplisia, dan umumnya digunakan gas karbondioksida.
3. Ekstraksi Ultrasonik
Getaran ultrasonik (>20.000 Hz) memberikan efek pada proses ekstrak dengan prinsip meningkatkan permeabilitas dinding sel, menimbulkan gelembung spontan (cavitation) sebagai stres dinamik serta menimbulkan fraksi interfase.
4. Ekstraksi Energi Listrik
Energi listrik digunakan dalam bentuk medan listrik, medan magnet serta electric-discharges yang dapat mempercepat proses dan meningkatkan hasil dengan prinsip menimbulkan
gelembung spontan dan menyebarkan
2.3. Metode Pengujian Antibakteri 2.3.1. Metode Difusi
Metode ini merupakan metode umum di gunakan di laboratorium. Ketepatan yang lebih tinggi dan pemisahan komponen di dalam campuran antigen dan antibodi dapat diperoleh dengan cara membiarkan reaktan-reaktan tersebut berdifusi bersama-sama di dalam suatu gel agar. Metode ini mempunyai prinsip penetapannya yaitu mengukur luas diameter daerah hambatan pertumbuhan mikroba. Metode ini dibedakan menjadi 2 yaitu :
a. Metode Difusi Tunggal
Metode difusi tunggal dirancang oleh Oudin. Metode ini dilakukan dengan cara antigen ditaruh diatas gel agar yang mengandung antiserum di dalam suatu tabung reaksi bermulut sempit. Lalu dibiarkan selama beberapa jam atau beberapa hari, antigen itu merembes ke dalam gel membentuk pita-pita endapan. Faktor-faktor yang menentukan terjadinya reaksi ini adalah ukuran molekul.
b. Metode Difusi Ganda
diatasnya ditaruh larutan antigen. Kedua reaktan itu berdifusi ke arah masing-masing di dalam agar, dan presipitasi terjadi pada titik terdapatnya konsentrasi optimum. Ini dinamakan difusi ganda satu dimensi.
Metode difusi ganda dua dimensi yang di rancang oleh O.Ouchterlony mempunyai keuntungan di bandingkan dengan metode-metode yang di sebut di atas, yaitu bahwa berbagai antigen dan antiserum dapat di bandingkan secara langsung. Di dalam uji ini, reaktan merembes dari sumur-sumur yang di buat pada agar di dalam suatu cawan petri yang datar. Pita-pita endapan terbentuk di daerah antara sumur-sumur yang berisi antiserum dan antigen homolog dalam konsentrasi optimum (Pelczar dkk,
1998).
Selain kedua metode diatas ada juga beberapa pencadang uji larutan yaitu :
1. Silinder Gelas atau Logam
Silinder yang dipakai terbuat dari gelas atau logam tahan karat dengan diameter 6-8 milimeter. Keuntungannya jumlah larutan uji dalam silinder dapat di perbanyak untuk menjamin ketersediaan larutan uji dalam cadangan selama waktu inkubasi. Kerugiannya adalah sukar mengatur kedalaman silinder secara manual, sehingga difusi yang terjadi ada kemungkinan tidak homogen yang ditujukan oleh diameter hambatan yang tidak merupakan lingkaran.
Dengan menggunakan cakram kertas ini, jumlah larutan uji yang di serap dapat di atur homogen sesuai dengan kapasitas dan daya serap kertas yang tergantung pada diameter dan ketebalan cakram tersebut.
3. Cetak Lobang
Dapat dilakukan dengan melobangi medium agar dengan alat penghisap agar atau pelobang gabus. Keuntungannya yaitu jumlah larutan yang berdifusi dapat terukur jumlahnya dan medium yang digunakan tidak terlalu tebal, namun bila mencetak lubang kurang sempurna akan mempengaruhi difusi zat uji (Katz dkk, 1974).
2.3.2. Metode Dilusi
Metode ini menggunakan medium cair dan hambatan pertumbuhan mikroba uji yang diukur
dengan menentukan kekeruhan larutan secara visual atau dengan alat seperti spektofotometer. Cara metode ini terbagi atas:
a. Pengenceran Secara Seri
Metode ini menggunakan sejumlah tabung reaksi yang mempunyai ukuranyang sama. Tiap
ditambah zat tanpa mikroba dan tabung reaksi lain berisi medium cair di tambah mikroba uji tanpa zat dalam jumlah yang sama. Setelah inkubasi selama waktu tertentu diamati pertumbuhan mikroba secara visual.
b. Turbidimetri
Metode ini dilakukan dengan suatu turunan protein yang di murnikan dan di bakukan dalam satuan tuberkulin. Reaksi pada metode ini ialah mengerasnya jaringan yang dengan mudah dapat dirasakan, dengan garis tengah 10 mm atau lebih yang terjadi dalam waktu 48-72 jam setelah penyuntikan di dalam kulit. Uji ini diukur dengan spektofotometer UV-VIS dengan panjang gelombang 530 nm (Pelczar dkk, 1998).
c. Pengenceran pada Lempeng Agar
Disediakan sederetan sampel dengan konsentrasi bervariasi, lalu di siapkan lempengan agar dengan mencampur 18 ml medium padat yang masih mencair dengan 2 ml larutan sampel, kemudian dibiarkan mediumnya membeku. Selanjutnya suspensi mikroba uji bibiakan pada permukaan lempeng medium tersebut dan diinkubasi pada waktu dan suhu tertentu. Pengamatan daerah hambat diamati secara visual.
2.3.3. Metode Hitungan Cawan
yang dapat dilihat langsung dengan mata tanpa menggunakan mikroskop (Fardiaz dkk, 1989).
Metode hitungan cawan dapat dibedakan atas :
1. Metode Tuang (Pour Plate)
Pada metode tuang (pour plate) digunakan media agar cair yaitu dengan cara mengambil sampel yang ingin diuji sebanyak 1 ml dengan menggunakan pipet 1 ml. Kemudian dimasukkan kedalam cawan petri yang sudah terisi agar cair lalu cawan petri tersebut digerakkan di atas meja secara hati-hati untuk menyebarkan sel-sel mikroba secara merata yaitu dengan gerakan melingkar atau gerakan seperti angka delapan. Setelah memadat, cawan-cawan tersebut
diinkubasikan di dalam inkubator dengan posisi terbalik. Inkubasi dilakukan pada suhu dan waktu tertentu sesuai dengan jenis mikrobanya. Setelah akhir masa inkubasi, koloni yang terbentuk dihitung.
2. Metode Permukaan (Spread Plate)
Pada metode ini langkah pertama yang dilakukan adalah dengan menuangkan agar steril kedalam cawan petri
dan didiamkan sampai membeku. Setelah
2.4. Tinjauan Tentang Bakteri 2.4.1. Karakter Bakteri
Bakteri adalah sel prokariotik yang khas; uniselular dan tidak mengandung struktur yang terbatasi membran di dalam sitoplasmanya. Bakteri dapat dibedakan dari ukuran, susunan, dan responnya terhadap antibiotik. Bentuk sel bakteri meliputi (Pelczar dkk, 1998) : a. Kokus (bulat)
b. basil (batang) c. spirilum (spiral) d. filamen
Bentuk sel menunjukkan karakteristik spesies bakteri tersebut, tetapi dapat bervariasi tergantung kondisi pertumbuhannya. Ukuran bakteri sangat kecil berkisar antara 0,5-5 μm. Bakteri dibagi menjadi beberapa struktur, yaitu :
1. Struktur permukaan bakteri yang meliputi : a. Flagelum
Rambut yang teramat tipis mencuat menembus dinding sel dan bermula dari tubuh dasar, suatu struktur granular tepat di bawah membran sel di dalam sitoplasma. Flagel digunakan bakteri sebagai alat gerak.
b. Pili
Pili berukuran lebih kecil, lebih pendek dari flagel. Pili hanya dapat dilihat dengan mikroskop elektron. Pili tidak berfungsi untuk alat gerak tetapi sebagai alat untuk melekat pada berbagai permukaan.
Kapsul penting artinya buat bakteri maupun organisme lainnya. Bagi bakteri, kapsul merupakan penutup, pelindung dan juga berfungsi sebagai gudang makanan cadangan.
2.4.2. Pertumbuhan Bakteri
Pertumbuhan mikroba adalah peningkatan semua komponen sel, sehingga menghasilkan peningkatan ukuran sel dan jumlah sel (kecuali mikroba yang berbentuk filamen) akan menyebabkan peningkatan jumlah individu didalam populasi. Inokulum hampir selalu mengandung ribuan organisme, pertumbuhan menyatakan pertambahan
jumlah atau massa
melebihi yang ada di dalam inokulum asalnya (Pelczar dkk, 1998). 2.4.2.1. Kurva Pertumbuhan
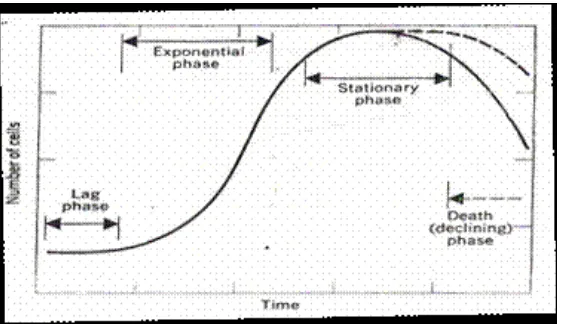
Bakteri mempunyai fase pertumbuhan secara bertahap sejak awal hingga berhenti dan dapat digambarkan dalam bentuk kurva pertumbuhan.
Kurva pertumbuhan tersebut dapat dibagi menjadi beberapa fase, yaitu (Jawetz dkk, 1996) :
1. Fase Lag (penyesuaian)
Pada fase ini sel-sel yang kekurangan metabolit dan enzim sebagai akibat keadaan yang tidak menguntungkan dalam pembiakan terdahulu,
menyesuaikan diri dengan
lingkungan yang baru. Disini dapat terlihat mulai bertambah besarnya ukuran sel.
Pada fase ini sel-sel mulai mengadakan perubahan bentuk dan meningkat jumlahnya sehingga kurva meningkat dengan tajam. Kegiatan metabolismenya tinggi dan lebih peka terhadap antibiotik. Fase ini dipengaruhi beberapa faktor yaitu bentuk dan sifat mikroba terhadap lingkungannya, kandungan nutrien dalam medium, temperatur, kadar oksigen, cahaya dan lain-lain.
3. Fase Stationer
Berkurangnya zat-zat makanan dalam perbenihan atau penumpukan hasil metabolisme
beracun menyebabkan pertumbuhan terhenti,
sehingga gambaran grafik akan
mendatar. 4. Fase Kematian
Merupakan akhir dari suatu kurva, dimana jumlah individu secara tajam menurun. Matinya sel-sel mikroba ini disebabkan habisnya zat makanan dan menumpuknya zat beracun.
2.4.2.2. Faktor Lingkungan Yang Mempengaruhi Pertumbuhan a. Suplai Nutrisi (Suharto dkk, 1993)
Mikroba sama dengan makhluk hidup lainnya,memerlukan suplai nutrisi sebagai sumber energi dan pertumbuhan selnya. Unsur-unsur dasar tersebut adalah : karbon, nitrogen, hidrogen, oksigen, sulfur, fosfor, zat besi dan sejumlah kecil logam lainnya. Ketiadaan atau kekurangan sumber-sumber nutrisi ini dapat mempengaruhi pertumbuhan mikroba hingga pada akhirnya dapat menyebabkan kematian.
b. Suhu
Suhu merupakan salah satu faktor penting dalam mempengaruhi pertumbuhan mikroorganisme. Suhu yang berkaitan dengan pertumbuhan mikroorganisme digolongkan menjadi tiga, yaitu :
1. Suhu minimum yaitu suhu yang apabila berada di bawahnya maka pertumbuhan terhenti.
2. Suhu optimum yaitu suhu dimana pertumbuhan berlangsung paling cepat dan optimum (Disebut juga suhu inkubasi)
3.Suhu maksimum yaitu suhu yang apabila berada di atasnya maka pertumbuhan tidak terjadi. Sehubungan dengan penggolongan suhu diatas,
Tabel 1 : Penggolongan bakteri menurut suhu Kelompok Suhu Minimum Suhu Optimum Suhu Maksimum
Psikrofil - 15o C 10o C 20o C
Psikrotrof - 1o C 25o C 35o C
Mesofil 5 – 10o C 30 – 37o C 40o C Thermofil 40o C 45 – 55o C 60 – 80o C Thermotrof 15o C 42 – 46o C 50o C
c. Keasaman atau Kebasaan (pH)
Setiap organisme memiliki kisaran pH masing-masing dan memiliki pH optimum yang berbeda-beda. Kebanyakan mikroorganisme dapat tumbuh pada kisaran pH 8,0-8,0 dan nilai pH di luar kisaran 2,0 sampai 10,0 biasanya bersifat merusak. d. Ketersediaan Oksigen
Mikroorganisme memiliki karakteristik sendiri-sendiri di dalam kebutuhannya akan oksigen. Mikroorganisme dalam hal ini digolongkan menjadi :
1. Aerobik : hanya dapat tumbuh apabila ada oksigen bebas. 2. Anaerob:hanya dapat tumbuh apabila tidak ada oksigen bebas. 3. Anaerob fakultatif : dapat tumbuh baik dengan atau tanpa oksigen bebas.
2.4.3. Bakteri Yang Digunakan
Dalam penelitian ini, bakteri yang digunakan adalah S. aureus dan E. coli, karena kedua bakteri tersebut termasuk bakteri yang paling banayak menyebabkan penyakit atau infeksi pada manusia (Warsa,1993). 1. Staphylococcus aureus
Klasifikasi taksonomi : Kingdom : monera Divisio : Protophyta Kelas : Schizomycetes Ordo : Eubacteriales Familia : Micrococcaceae Spesies : Staphylococcus aureus
Staphylococcus adalah sel-sel bulat yang terdapat sendiri-sendiri
atau bulat-bulat atau kadang-kadang berpasangan tetapi lebih sering kelompok- kelompok yang tidak beraturan (Volk dkk, 1990).
Staphylococcus juga termasuk dalam bakteri gram-positif, dan tidak
bergerak (Bonang, 2007). Mikroba ini bersifat aerob atau anaerob fakultatif, katalase positif, oksidase negatif, family
nonmotil, tidak membentukspora dan fermentative.
S. aureus bakteri ini bervariasi dalam pembentukan
bergantung pada kemampuannya melawan fagositosis dan efek beberapa diantara toksin dan enzim yang disekresi oleh sel (Hastowo dkk, 1992).
Batas suhu untuk pertumbuhan S. aureus adalah 15˚C dan 40˚C mempunyai suhu optimum yaitu sebesar 35˚C-40˚C dengan pH 7,4. Bakteri dapat tumbuh pada medium dengan kadar garam 7,5-10% dan dapat tumbuh baik dalam kaldu biasa pada suhu 37˚C. Pada lempeng agar, koloninya berbentuk bulat, diameter 1-2 mm, cembung, buram, mengkilat dan konsistensinya lunak (Nurhayati, 2004).
2. Escherichia coli
Menurut Krieg dan Holt (1984) dalam buku Bergey’s Manual of Systematic Bacteriology klasifikasi E. coli sebagai berikut (Krieg dkk, 1984) :
Kingdom : Procaryotee Divisio : Gracilicutes Kelas : Scotobacteria Ordo : Eubacteriales Familia : Enterobacteriaceae Genus : Escherichia
Spesies : Escherichia coli
Bakteri E. coli sering ditularkan melalui makanan, air, dan orang
ke orang. E. coli merupakan bakteri nonpatogenik fakultatif anaerobik utama pada usus manusia. Sifatnya unik karena dapat menyebabkan
seperti juga kemampuannya menimbulkan infeksi pada jaringan tubuh lain
di luar usus (Warsa dkk, 1993).
Bentuk dari bakteri ini adalah batang pendek (kokobasil), termasuk bakteri Gram negatif. Ukuran bakteri ini 0,4-0,7 µm, sebagian besar gerak positif dan beberapa stain mempunyai kapsul. E. coli tumbuh baik di semua medium dan bersifat mikroaerofilik (Nurhayati. 2004). E. coli cepat tumbuh dalam media yang diinkubasikan selama 24 jam
dalam media umum dengan temperatur 20-40˚C. Dalam media agar, koloni muncul dalam waktu 24 jam (Kurniaesnaeni, 1999).
Untuk mendeteksi bakteri E. coli patogen memerlukan metode khusus untuk mengidentifikasi toksin yang dihasilkan. Sampai saat ini metode yang masih memerlukan tes dengan binatang percobaan dan kultur jaringan yang cukup mahal dan kurang praktis. Bakteri E. coli yang diisolasi dari infeksi didalam masyarakat, biasanya sensitif terhadap obat-obatan antimikroba yang digunakan untuk organisme Gram negatif, meskipun terdapat juga stain-stain resisten, terutama pada pasien dengan riwayat pengobatan antimikroba sebelumnya. Pada pasien diare, perlu dijaga keseimbangan cairan dan elektrolitnya (Warsa dkk, 1993).
2.5. Infeksi Bakteri Pada Manusia
pembentukan abses. Infeksinya dapat berupa furunkel yang ringan pada kulit sampai berupa suatu piemia yang fatal. Kecuali impetigo, umumnya kuman ini bersifat sporadik bukan epidemik (Warsa dkk, 1993).
Infeksi S. aureus di pengaruhi oleh (Hastowo dkk, 1992) :
1. Resistensi terhadap fagositosis; resistensi ini tergantung pada protein dan bahan kapsul.
2. Kemampuan mengatasi sifat antibakterial dalam sel fagosit (intracelluler survival). S. aureus mempunyai kemampuan antibakterial intraselular. 3. Resisten terhadap faktor antibakterial dalam serum yang ditengahi oleh
koagulasi.
4. Penyebaran infeksi dipermudah dengan adanya enzim hialuronidase. Dan ditaksir bahwa 15-35% populasi umum membawa S. aureus koagulasi positif dalam hidung dan tenggorokannya. Orang-orang yang rentan terhadap bakteri S. aureus adalah pasien bedah dan luka bakar, orang-orang yang menerima obat immunosupresif atau mereka yang terkena penyakit defisiensi kekebalan, orang-orang yang terkena infeksi saluran pernapasan bagian bawah seperti influenza atau gabag serta penyakit gula. Infeksi kantong rambut yang mengakibatkan terjadinya abses permukaan yang terlokalisasi atau bisul juga tidak diragukan lagi merupakan manifestasi penyakit S. aureus. Sedangakan pada bakteri E. coli dapat menyebabkan penyakit diare pada bayi tetapi selain itu ada penyakit-penyakit lain yang disebabkan oleh E. coli yaitu (Warsa dkk, 1993) :
2. Pneumonia ; di Rumah Sakit E. coli menyebabkan ± 50% dari Primary
Nosocomia Pneumonia.
3. Meningitis pada bayi baru lahir.
4. Infeksi luka terutama luka di dalam abdomen. 2.6 Tinjauan Tentang Antibakteri
2.6.1 Aktivitas Antibakteri
Antimikroba adalah senyawa kimia yang dapat membunuh atau menghambat pertumbuhan mikroorganisme. Berdasarkanjenis mikroorganisme yang dimatikan atau dihambat pertumbuhannya, antimikroba terbagi menjadi antibakteri,antifungi, antivirus dan antiprotozoa.
Antibakteri adalah zat yang membunuh bakteri atau menekan pertumbuhan dan reproduksi mereka. Sampai saat ini, antibakteri masih merupakan salah satu obat yang paling sering digunakan (Volk dkk, 1990). Obat untuk membasmi bakteri penyebab infeksi pada manusia harus memiliki sifat toksisitas selektif setinggi mungkin. Artinya, obat tersebut haruslah bersifat sangat toksik untuk bakteri, tetapi relatif tidak toksik untuk hopes (Ganiswarna dkk, 1995)
karena daya kerjanya yang cepat dan mematikan. Sedangkan zat yang hanya menghambat pertumbuhan bakteri disebut bakteriostatik (Irianto, 2006).
2.6.2. Mekanisme Kerja Antibakteri
Secara umum mekanisme kerja antibakteri dapat dibagi atas (Hastowo dkk, 1992) :
1. Penghambatan Pertumbuhan oleh Analog
Dalam kelompok ini termasuk sulfonamida. Pada umumnya bakteri memerlukan para-aminobenzoat (PABA) untuk sintesis asam folat, yang diperlukan dalam sintesis purin. Sulfonamida memiliki struktur seperti PABA, sehingga penggunaan sulfonamida menghasilkan asam folat yang tidak berfungsi.
2. Penghambatan Sintesis Dinding Sel
Perbedaan struktur sel antara bakteri dan eukariot menguntungkan bagi penggunaan bahan antimikroba.
Penicillin dan Cephalosporin merupakan contoh klasik. Kedua
antibiotik ini menyebabkan penghambatan pada pembentukan ikatan sebrang silang. Pada konsentrasi rendah,
penicillin menghambat pembentukan ikatan
mikroorganisme menghasilkan enzim beta-laktamase enzim ini dapat merusak daya kerja penicillin.
3. Penghambatan Fungsi Membran Sel
Membran sel bakteri dan fungi dapat dirusak oleh beberapa bahan tertentu tanpa merusak sel inang. Polymixin berdaya kerja terhadap bakteri Gram-negatif, sedangkan antibiotik polyene terhadap fungi.
Polymixin dihasilkan oleh Bacillus polymyxa. Daya
kerja polymixin merusak membran sel, sehingga isi sel akan keluar. Antibakteri ini berdaya kerja terhadap sel baik yang sedang tumbuh maupun yang tidak tumbuh.
4. Penghambatan Sintesis Protein
Beberapa antibiotik menghambat sintesis protein pada bakteri. Sebagai contoh khloramphenicol,
tetracycline, dan erythomycine. Puromycin merupakan penghambat sintesis protein pada manusia. Bakteri memiliki ribosom dengan 70S, sedangkan manusia 80S. Unit ribosom pada bakteri adalah 50S dan 30S. Chloramphenicol mengikat ribosom 50S, sehingga tidak dapat berfungsi. Antibiotik ini bersifat bakteriostatik, pertumbuhan bakteri dimulai kembali bila tidak ada antibakteri ini.
2.6.3 Antibakteri Pembanding Yang Digunakan
~ Rumus bangun :
~ Pemerian : Serbuk hablur, putih; praktis tidak berbau
~ Kelarutan : Sukar larut dalam air dan metanol; tidak larut dalam benzena, dalam karbon tetraklorida dan dalam kloroform.
~Penyimpanan : dalam wadah tertutup rapat, dengan suhu kamar terkendali
Amoksisilin adalah penisilin semisintetik berspektrum luas yang spektrum aktivitasnya serupa dengan ampisilin. Bersifat stabil asam sehingga dapat diberikan secara oral. (Diyah dkk, 2005).
Untuk Penentuan KHM menggunakan bahan uji pembanding Amoksisilin. Amoksisilin yang aktif untuk bakteri kedua bakteri tersebut yaitu pada konsentrasi 1 mg atau 1000 µg (Agustini dkk, 2006).
2.7. Macam-macam Medium
1. Medium Cair
Medium cair yang biasa di gunakan adalah kaldu. Pembuatan medium ini yaitu dengan cara air murni di tambahkan dengan kaldu daging lembu dan pepton. Pepton adalah protein yang terdapat pada daging, pada air susu, pada kedelai dan pada putih telur. Medium yang telah siap tersebut ditentukan pHnya 6,8-7, jadi sedikit asam atau netral. pH tersebut adalah pH yang sesuai bagi kebanyakan bakteri. Setelah di ukur pHnya kaldu tersebut di saring menggunakan kertas saring lalu di masukkan ke dalam tabung reaksi dan disumbat dengan kapas, barulah dapat di masukkan ke dalam autoklaf.
2. Medium Padat
Dulu medium padat masih banyak menggunakan kentang yang di potong-potong. Kentang tersebut di potong-potong dengan menggunakan pipa besi lalu di masukkan ke dalam tabung reaksi kemudian di sumbat dengan kapas dan setelah itu di sterilkan di dalam autoklaf. Setelah dingin kentang dapat ditanami bakteri.
3. Medium yang Diperkaya
Bakteri patogen memerlukan makanan tambahan berupa serum atau darah yang tidak mengandung fibrinogen. Fibrinogen adalah zat yang menyebabkan darah menjadi kental, apabila keluar di luka. Serum dan darah di campurkan ke dalam medium yang sudah di sterilkan. Pencampuran ini dilakukan sebelum sterilisasi, maka serum atau darah tersebut akan mengental akibat pemanasan.
4. Medium Yang Kering
Medium ini berupa serbuk kering yang di larutkan dalam air lalu di sterilkan. Pada medium ini tidak perlu dilakukan pemeriksaan pH karena sudah dilakukan lebih dahulu pada waktu pembuatan serbuk.
5. Medium Yang Sintetik
Bahan alam banyak sekali digunakan oleh masyarakat indonesia sebagai obat tradisional yang berdasarkan pada pengalaman dan tradisi turun temurun sedangkan khasiatnya masih perlu diuji secara ilmiah. Oleh karena itu penelitian ini dilakukan untuk menguji kebenaran khasiat obat tradisional tersebut agar pemakaiannya dapat dipertanggungjawabkan secara ilmiah.
Penelitian kali ini bahan yang digunakan adalah daun asam jawa. Berdasarkan literatur dan pengalaman masyarakat (empiris) daun asam jawa dapat digunakan sebagai obat tradisional, yaitu untuk obat luar seperti bisul dan obat dalam seperti sariawan, demam dan batuk (Soesilo, 1989). Maka dari itu penelitian tentang aktivitas antibakteri dari ekstrak etanol daun asam jawa ini dilakukan untuk membuktikan khasiat yang terkandung didalamnya.
Dalam hal ini, bakteri yang digunakan adalah Staphylococcus aureus (bakteri Gram positif) dan Escherichia coli (bakteri Gram negatif) sebagai bakteri uji, karena kedua bakteri tersebut lebih sering menimbulkan infeksi pada manusia (Warsa dkk,1993). Penelitian ini juga menentukan KHM ekstrak etanol daun asam jawa dan kesetaran potensinya dengan menggunakan antibiotik pembanding yaitu amoksisilin. Metode yang digunakan baik dalam pengujian aktivitas antibakteri, penentuan KHM maupun penetapan potensi yaitu metode pour plate.
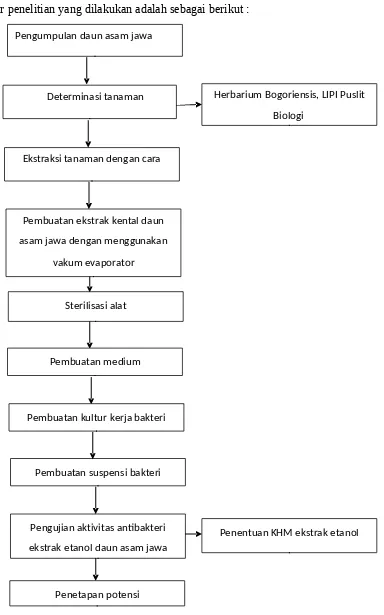
Alur penelitian yang dilakukan adalah sebagai berikut : Pengumpulan daun asam jawa
Determinasi tanaman Herbarium Bogoriensis, LIPI Puslit Biologi
Ekstraksi tanaman dengan cara
Pembuatan ekstrak kental daun asam jawa dengan menggunakan
vakum evaporator
Sterilisasi alat
Pembuatan medium
Pembuatan kultur kerja bakteri
Pembuatan suspensi bakteri
Pengujian aktivitas antbakteri ekstrak etanol daun asam jawa
Penentuan KHM ekstrak etanol
Penetapan potensi
4.1. Waktu Dan Tempat Penelitian
Penelitian ini mulai dilakukan dari bulan Juni sampai dengan September 2008 di Laboratorium Mikrobiologi, Pusat Laboratorium Terpadu Universitas Islam Negeri Syarif Hidayatullah Jakarta.
4.2. Alat Dan Bahan 4.2.1. Alat
Alat-alat yang digunakan pada penelitian ini antara lain erlenmeyer, gelas ukur, cawan petri, jarum ose, tabung reaksi, rak tabung reaksi, hot plate, vortex, autoklaf, inkubator, lampu spiritus, timbangan
analitik, LAF
(Laminar Air Flow), oven, Lemari Pendingin, kapas steril,
spatula, mikropipet, shaker inkubator, batang L, spektrofotometer UV-VIS, kertas saring dan vakum rotavapor.
4.2.2 Bahan
a. Persiapan Bahan Uji
Sampel daun asam jawa diperoleh dari daerah Rawa Lumbu Utara, Bekasi, dan telah diidentifikasi di Herbarium Bogoriensis, LIPI Puslit Biologi, Cibinong, Jawa Barat dan diketahui nama spesies daun asam jawa tersebut adalah Tamarindus indica Linn.
Simplisia yang berupa daun asam jawa yang segar dikumpulkan lalu dicuci supaya bersih agar kotoran yang melekat pada daun hilang. Setelah proses pencucian, selanjutnya proses pengeringan. Proses ini memakan waktu selama 3 - 1 minggu dengan cara diangin-anginkan.
Setelah kering kemudian diserbukkan dan diayak lalu ditampung dengan wadah.
Ekstrak kental daun asam jawa diperoleh dari 11 Liter etanol 70 %, yaitu dengan cara maserasi, merendam sampel dalam pelarut (etanol 70 %) selama 1 - 2 hari pada suhu kamar lalu sampel daun asam jawa di vakum rotavapor sampai menjadi ekstrak kental lalu diuapkan kembali didesikator untuk mendapatkan ekstrak kering.
b. Sterilisasi Alat Dan Bahan
Sterilisasi dapat dibedakan menjadi beberapa cara yaitu sebagai berikut :
Biasanya media yang disterilkan dengan autoklaf dan juga alat-alat gelas.
3. Pasterurisasi, cara ini digunakan untuk larutan – larutan yang mudah rusak apabila terkena panas yang terlalu tinggi. Pasteurisasi dilakukan dengan cara memanaskan bahan pada suhu 63˚C selama 30 menit.
c. Pembuatan Medium 1. Nutrien Agar (NA)
Biasanya medium yang digunakan untuk membiakkan bakteri uji adalah medium NA. Serbuk NA sebanyak 24 gram dilarutkan dalam 1 liter aquadest dan dipanaskan sampai mendidih sehingga larut. Lalu disterilkan dalam autoklaf pada suhu 121˚C selama 15 menit. Setelah agak dingin NA dapat disimpan dalam lemari pendingin dan dapat digunakan bila diperlukan dengan memanaskannya kembali dengan hot plate. 2. Nutrien Broth (NB)
Medium ini biasa digunakan untuk membuat suspensi bakteri. Serbuk NB sebanyak 8 gram dilarutkan dalam 1 liter aquadest dan dipanaskan sampai mendidih sehingga larut. Lalu disterilkan dalam autoklaf pada suhu 121˚C selama 15 menit. Setelah agak dingin NB dapat disimpan dalam lemari pendingin.
d. Pembuatan Kultur Kerja
e. Pembuatan Suspensi Bakteri
Bakteri Gram positif dan Gram negatif yang telah diremajakan pada umur 24 jam diambil 3 ose dan dimasukkan dalam 30 ml NB (inokulum) lalu dikocok menggunakan shaker inkubator selama 24 jam pada suhu 30˚C.
4.3.2.Pembuatan Kurva Tumbuh Bakteri
Kurva pertumbuhan dibuat untuk menentukan fase log dari bakteri uji, yaitu pada saat bakteri memulai pembiakan, sel jasad renik membelah dengan cepat, membuat pertambahan jumlah pada bakteri tersebut (Warsa dkk, 1993). Kurva pertumbuhan ini dibuat dengan cara perhitungan absorbansi menggunakan spektrofotometer dengan panjang gelombang 600 nm dan perhitungan jumlah populasi bakteri dengan metode plat count atau metode sebar.
Jumlah koloni yang dapat dihitung adalah 30-300 koloni. Jika <30 berarti pengenceran terlalu besar (suspensi terlalu encer, jika >300 berarti pengenceran terlalu kecil (suspensi kurang encer). Sedangkan perhitungan dengan spktrofotometer pada panjang gelombang 600 nm yaitu dengan cara suspensi bakteri dikocok dengan menggunakan shaker inkubator dengan kecepatan 120 rpm pada suhu kamar, dan setiap interval 30 menit dilakukan penentuan absorbansi dan pengerjaan plat count kembali seperti yang telah dilakukan pada jam ke-0.
Kemudian dibuat kurva standar antara absorbansi dengan log jumlah sel/ml sesuai dengan waktu inkubasi. Setelah didapat fase eksponensial, kemudian dilakukan pengenceran dengan menggunakan NB hingga 1x106 sel bakteri/ml, yang digunakan sebagai bakteri uji (Cappucino dkk ,1986).
4.3.3. Pengujian Aktivitas Antibakteri Ekstrak Etanol Daun Asam Jawa
Ekstrak etanol daun asam jawa dibuat dengan konsentrasi 1000 mg/ml, 100 mg/ml, 10 mg/ml, dan 1 mg/ml. Caranya dengan menimbang 1000 mg ekstrak etanol daun asam jawa dan dilarutkan dalam aquades steril sebanyak 1 ml hingga diperoleh konsentrasi 1000 mg/ml. Lalu diambil 0,1 ml dari larutan
1000 mg/ml dimasukkan ke dalam erlenmeyer dan diencerkan sampai 1 ml hingga diperoleh konsentrasi 100 mg/ml. Pengenceran dilakukan hingga diperoleh konsentrasi terkecil (1 mg/ml).
daun asam jawa yang telah dibuat dan didiamkan selama 30 menit. Setelah 30 menit campuran tersebut dimasukkan ke dalam cawan petri. Kemudian ke dalam cawan dimasukkan agar cair steril yang bertemperatur 47-50º C sebanyak 10-15 ml. Segera setelah agar dituang, cawan petri digerakan di atas permukaan meja datar secara hati-hati sehingga suspensi bakteri tersebar secara merata, yaitu dengan gerakkan seperti angka delapan. Lalu diinkubasi selama 24 jam pada suhu 30ºC. Setelah diinkubasi dihitung jumlah koloni bakterinya.
Dari prosedur tersebut dapat dilihat nilai KHM ekstrak etanol daun asam jawa. Nilai KHM dinyatakan dengan konsentrasi ekstrak etanol daun asam jawa yang terkecil dari beberapa konsentrasi yang diuji. Apabila konsentrasi yang diuji tersebut masih menumbuhkan bakteri maka konsentrasi bisa dipersempit. Prosedur tersebut juga digunakan untuk bakteri pada pembanding amoksisilin.
Hasil perhitungan jumlah koloni bakteri yang diperoleh dari ekstrak etanol daun asam jawa dibandingkan dengan jumlah pertumbuhan koloni bakteri yang digunakan pada amoksisilin. Penetapan kesetaraan potensi ekstrak etanol daun asam jawa (Tamarindus indica Linn.) dengan amoksisilin dilakukan dengan membuat variasi konsentrasi amoksisilin terlebih dahulu, yaitu dengan konsentrasi amoksisilin 0,04 mg/ml, 0,03 mg/ml, 0,02 mg/ml dan 0,01 mg/ml. Pengenceran dilakukan dengan pelarut aquades steril.
4.4. Analisa data
pertumbuhan bakteri. (Rahmayanti, 2000)
5.1. Hasil
1. Dari hasil identifikasi sampel daun asam jawa yang dilakukan Herbarium Bogoriensis, LIPI Puslit Biologi, menunjukkan bahwa yang digunakan adalah Tamarindus indica Linn. Dapat dilihat pada Lampiran 9.
1 10. 8 10. 6 10. 4 10. 2
1 0 9. 8 9. 6 9. 4 9. 2
0 1 2 3 4 5 6
Waktu (jam)
7.
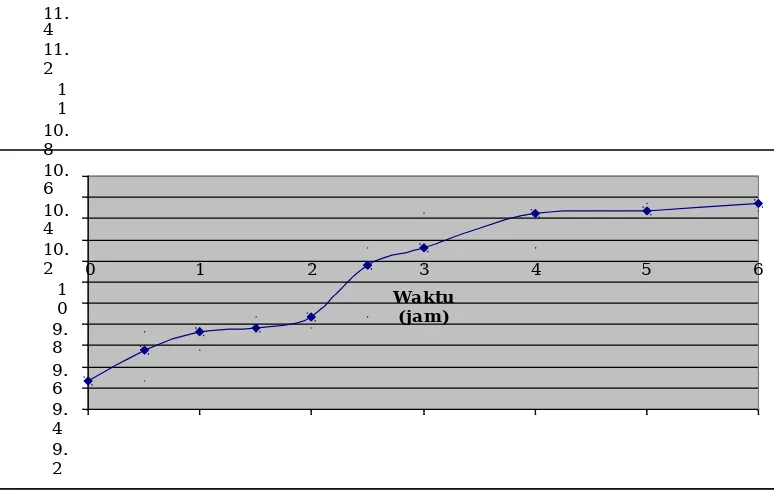
Gambar 4. Kurva tumbuh Staphylococcus aureus dalam medium NB
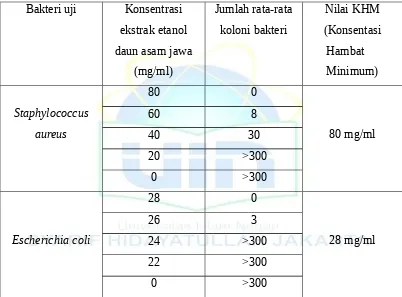
4. Pada uji aktivitas antibakteri ekstrak etanol daun asam jawa dengan konsentrasi 1 mg/ml, dan 10 mg/ml terlihat bahwa konsentrasi tersebut tidak memberikan aktivitas antibakteri pada kedua bakteri uji sedangkan untuk konsentrasi 100 mg/ml, dan 1000 mg/ml dapat dilihat pula bahwa konsentrasi tersebut memberikan aktivitas antibakteri seperti yang terlihat pada Tabel 1.
uji seperti yang terlihat pada Tabel 2.
Tabel 2. Hasil perhitungan jumlah bakteri yang mempunyai daya hambat minimum ekstrak etanol daun asam jawa
Bakteri uji Konsentrasi
Bakteri Uji
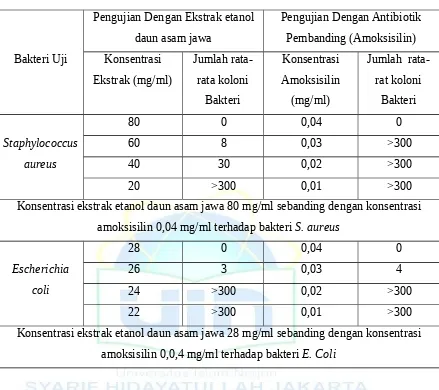
Konsentrasi ekstrak etanol daun asam jawa 80 mg/ml sebanding dengan konsentrasi amoksisilin 0,04 mg/ml terhadap bakteri S. aureus
Escherichia
Konsentrasi ekstrak etanol daun asam jawa 28 mg/ml sebanding dengan konsentrasi amoksisilin 0,0,4 mg/ml terhadap bakteri E. Coli
5.2. Pembahasan
Berdasarkan literatur dan pengalaman masyarakat (empiris) daun asam jawa dapat digunakan sebagai obat tradisional, yaitu untuk obat luar seperti bisul dan obat dalam seperti sariawan, demam dan batuk (Soesilo,
Pada penelitian ini digunakan daun asam jawa yang diperoleh dari daerah Rawa Lumbu Utara, Bekasi dan sudah diteliti kebenarannya di Laboratorium Herbarium Bogoriense, LIPI seperti yang terlihat pada Lampiran 10. Untuk melakukan pengujian aktivitas antibakteri digunakan ekstrak etanol daun asam jawa yang diperoleh dari 1 kg daun asam jawa yang direndam dengan etanol selama 1 malam proses ini dinamakan maserasi. Pelarut yang digunakan adalah etanol karena etanol merupakan pelarut yang bersifat polar, universal dan mudah didapat. Zat aktif antibakteri daun asam jawa yang bersifat polar adalah flavonoid. Ekstrak dipisahkan dari pelarutnya dengan menggunakan vakum evaporator untuk mendapatkan ekstrak kental lalu dimasukkan kedalam desikator untuk mendapatkan ekstrak kering kemudian dilakukan pengujian aktivitas antibakteri.
Sebelum melakukan pengujian kurva pertumbuhan bakteri harus ditentukan terlebih dahulu untuk mendapatkan fase log dimana pada fase ini bakteri sedang berada pada puncak pembelahan (Waluyo, 2007).
Pada awal inkubasi jumlah sel bakteri E.
0,037 per jam yang dapat dilihat pada Lampiran 6 . Setelah itu bakteri mengalami kemunduran atau berkurangnya zat-zat makanan yang mengakibatkan bakteri mulai ada yang mati dan pembelahannya terlambat tahap ini disebut juga fase stationer, fase ini berlangsung pada jam ke-5 sampai jam ke-6.
Bakteri S. aureus memasuki awal inkubasi dengan jumlah bakteri 9,48x105 sel/ml. Fase log diketahui terjadi antara jam ke-2 sampai jam ke-5. Jumlah sel bakteri pada jam ke-2 meningkat menjadi 3,99x106 sel/ml dan jumlah sel bakteri pada jam ke-5 adalah 1,77x108 sel/ml. Setelah melihat fase log pada kurva pertumbuhan dapat diambil kesimpulan bahwa bakteri berada
dalam masa paling aktif pada jam ke-2,25 karena pada waktu ini nilai µ adalah 0,028 per jam yang dapat dilihat pada Lampiran 6. Fase stationer untuk bakteri S. aureus yaitu pada jam 6 sampai dengan jam ke-8.
relatif murah. Dikatakan mudah, dan relatif murah karena sel mikroba yang ditanam pada medium agar dapat dilihat secara langsung perkembangbiakannya dan pembentukan koloninya dengan mata tanpa menggunakan mikroskop
(Fardiaz dkk, 1989). Waktu inkubasi yang menunjukkan pertumbuhan optimum bakteri yaitu selama 24 jam, karena dalam media agar koloni muncul dalam waktu 24 jam (Kurniaisnaeni, 1999).
Pada uji aktivitas antibakteri ekstrak etanol daun asam jawa dengan
konsentrasi 1 mg/ml, dan 10 mg/ml terlihat bahwa konsentrasi tersebut tidak memberikan aktivitas antibakteri pada kedua bakteri uji sedangkan untuk konsentrasi 100 mg/ml, dan 1000 mg/ml dapat dilihat pula bahwa konsentrasi tersebut memberikan aktivitas antibakteri seperti yang terlihat pada Tabel 1.
Hasil ini menunjukkan bahwa konsentrasi dari ekstrak etanol daun asam jawa dapat memberikan aktivitas antibakteri dengan jumlah bakteri yang sebanding dengan konsentrasi ekstrak etanol daun asam jawa, yaitu semakin besar konsentrasi ekstrak etanol daun asam jawa semakin besar pula bakteri yang terbunuh. Daun asam jawa mempunyai kandungan flavonoid
(Yuniarti, 2008). Menurut Mill dan Bone flavonoid mempunyai aktivitas antibakteri sehingga dapat menghambat pertumbuhan bakteri.
Pada penentuan KHM ekstrak etanol daun asam jawa digunakan konsentrasi yang bervariasi, yaitu 20, 40, 60, dan 80 mg/ml untuk bakteri
atau bisa dikatakan bahwa ekstrak etanol daun asam jawa mempunyai daya hambat, seperti yang dapat dilihat pada Tabel 2. Dalam hal ini, ekstrak etanol daun asam jawa mempunyai sifat bakterisidal,
yaitu bahan yang berkemampuan untuk membunuh atau memusnahkan bakteri (Waluyo,
2007).
Penetapan potensi dilakukan dengan membandingkan konsentrasi sampel ekstrak etanol daun asam jawa dengan konsentrasi antibakteri pembanding amoksisilin yang memberikan daya hambat yang sama, dapat dilihat pula dari jumlah koloni bakteri yang tumbuh pada setiap konsentrasinya, seperti yang terlihat pada Tabel 3.
Dalam hal ini, untuk penetapan potensi digunakan amoksisilin sebagai antibakteri pembanding. Amoksisilin merupakan salah satu jenis obat yang fungsinya membunuh bakteri atau memperlambat pertumbuhan bakteri. Kedua bakteri yang digunakan pada penelitian ini sangat sensitif terhadap amoksisilin
(Diyah dkk, 2005)
pada biakan jasad renik yang peka dan sesuai. Dari variasi konsentrasi amoksisilin tersebut diketahui bahwa pada konsentrasi 0,04 mg/ml (40 ppm) amoksisilin pembanding sudah mempunyai daya hambat terhadap kedua bakteri, dalam hal ini bakteri yang digunakan adalah S. aureus dan E. coli. Dari hasil tersebut maka dapat dibandingkan bahwa dengan konsentrasi amoksisilin yang didapat yaitu
0,04 mg/ml (40 ppm) sebanding dengan 80 mg/ml (80000 ppm) ekstrak etanol daun asam jawa untuk bakteri S. aureus, sedangkan untuk bakteri E. coli dengan konsentrasi 28 mg/ml (28000 ppm) sebanding dengan 0,04 mg/ml (40 ppm). Dari perbandingan konsentrasi tersebut terlihat bahwa ekstrak etanol daun asam jawa mempunyai aktivitas antibakteri terhadap kedua bakteri uji.
6.1. Kesimpulan
Dari hasil penelitian yang telah dilakukan dapat diambil kesimpulan sebagai berikut :
1. Ekstrak etanol daun asam jawa (Tamarindus indica Linn) memiliki aktivitas antibakteri yang bersifat bakterisidal terhadap bakteri Escherichia coli
dan Staphylococcus aureus. Konsentrasi Hambat
Minimum(KHM) bakteri Staphylococcus aureus adalah 80 mg/ml dan bakteri Escherichia coli adalah 28 mg/ml.
2. Potensi ekstrak etanol daun asam jawa yang didapat adalah 80 mg/ml (80.000 ppm) yang setara dengan 0,04 mg/ml (40 ppm) amoksisilin terhadap bakteri Staphylococcus aureus dan 28 mg/ml (28.000 ppm) ekstrak etanol daun asam jawa
setara juga dengan 0,04 mg/ml (40 ppm) amoksisilin terhadap bakteri Escherichia coli.
6.2. Saran
Mengingat dalam penelitian ini percobaan yang dilakukan masih sangat terbatas maka, dapat disarankan untuk mencari zat aktif selain flavonoid dari daun asam jawa (Tamarindus indica Linn.) yang berfungsi sebagai antibakteri.
Agustini, D. D. Profil Daya Hambat Dari Kombinasi Antibiotik Terhadap Bakteri Laboratorium dan Klinik. PT Gramedia. Jakarta. Hal 190
Cappucino, J.G. and N. Sherman. 1986. Microbiology : A Laboratory Manual. The Benjamin/Cummings Publishing Company. INC
Departemen Kesehatan Republik Indonesia. 1995. Farmakope Indonesia Edisi IV. Departemen Kesehatan Republik Indonesia. Jakarta.Hal 95-96
Diyah dan N. Wahyuning. Penggunaan Metode Spektrofotometer dengan Pereaksi Cu Untuk Penetapan Kadar Senyawa Aktif Amoksisilin. Diakses dari w w w.un a ir . ac.id pada tanggal 1 Juni 2008
Dwidjoseputro, D. 1994. Dasar-Dasar Mikrobiologi. Penerbit Djambatan. Jakarta. Hal 37-40
Fardiaz, S.1989. Penuntun Praktek Mikrobiologi Pangan. IPB-Press: Bogor. Hal 49-51
Ganiswara, S.G., R.Setiabudy, F.D.Suyatna, Purwantyastuti dan Nafrialdi. 1995. Farmakologi dan Terapi Edisi keempat. UI-Press. Jakarta.Hal 560-570 Harmita dan Maksum. 2005. Buku Ajar Analisis Hayati Edisi 2. Departemen Farmasi
FMIPA UI. Jakarta.Hal 1-46
Hastowo. Sugyo. 1992. Mikrobiologi. Rajawali Pers. Jakarta
Irianto, K. 2006. Mikrobiologi Menguak Dunia Mikroorganisme Jilid 1. Yrama widya: Bandung
Katz, F.W. 1974. Microbiological Diffusion Assay, Operation Studied with Cooper
Equation. J. Pharm. Sci.
Krieg, N.R. and Holt. J. G. 1984. Bergey’s Manual of Systematic Bacteriology, Vol 1. Baltimore. USA
Nurhayati. 2004. Uji Aktivitas Antibakteri Ekstrak Kapang Laut Terhadap
Staphylococcus aureus. Skripsi. Universitas Negeri Jakarta. Jakarta Osman, A. 1998. Asam Jawa. Jabatan Sains Makanan. UPM
Pelczar. M.J. dan E.C.S. Chan. 1998. Dasar-Dasar Mikrobiologi. Jilid 1. UI Press. Jakarta.Hal 106-113
Pelczar. M.J. dan E.C.S. Chan. 1998. Dasar-Dasar Mikrobiologi. Jilid 2. UI Press. Jakarta. Hal 49-51
Primaharinastiti, R. 2004. Bioakumulasi Logam Berat Cu Oleh Bacillus sp. Penelitian Hayati. Fakultas Farmasi Universitas Airlangga.
Rahmayanti. 2000. Uji Efek Antibakteri dan Antijamur Ekstrak Etanol (70%) Campuran Rimpang Lengkuas (Alpinia galanga Sw.), Daun Ketepeng Cina (Cassia alata Linn) dan Daun Pare (Momordica charantia Linn) Terhadap Beberapa Bakteri dan Jamur Penyebab Penyakit Kulit. Skripsi. FMIPA-UI. Jakarta
Sampurno. 2000. Parameter Standar Umum Ekstrak Tumbuhan Obat. Departemen Kesehatan
Suharto dan A. Chatim. 1993. Mikrobiologi Kedokteran. Jakarta. Hal 18-22
Volk, W.A dan Wheeler, M.F. 1990. Mikrobiologi Dasar. Penerbit Erlangga. Jakarta. Hal 148-154
Waluyo, L. 2007. Mikrobiologi Umum. UMM Press: Malang
Warsa, U.C. Karsinah. L.H. Muharyo, Suharto dan Mardiastuti. 1993. Mikrobiologi Kedokteran. Jakarta. Hal 103-154