Laporan Praktikum Hari/ tanggal : Kamis/ 03 Maret 2016
Biokimia Umum Waktu : 12.00 – 14.30 WIB.
PJP : Puspa Puspita J, S.Si, M.Sc. Asisten : 1. Muhminah
2. Sabighoh Zanjabila 3. M. Maftuchin Sholeh 4. Sri Novita Sagita
BIOFISIK II
KOLOID, BUFFER, DAN TEKANAN OSMOTIK
Kelompok 3
1. Sutisno B04150042
2. Resti Indana B04150052
3. Nais Nashiatul K B04150187
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PENDAHULUAN
Koloid, buffer, dan tekanan osmotik merupakan beberapa aspek biofisik lainnya yang terkait dengan proses kimia. Aspek biofisik tersebut sering digunakan dalam kehidupan sehari-hari terutama pada kegiatan di laboratorium. Campuran terdiri dari dua macam, yaitu campuran homogen (larutan sejati/molekuler) dan campuran heterogen (kasar/suspensi). Diantara kedua larutan ini, ada satu jenis campuran yang menyerupai larutan sejati tetapi sifatnya berbeda dengan larutan sejati maupun suspensi. Larutan ini disebut koloid. Koloid didefinisikan sebagai campuran dari dua atau lebih zat yang salah satu fasenya tersuspensi sebagai sejumlah partikel yang sangat kecil dalam fase kedua. Ukuran dispersi koloid mencapai 1 mµ sampai 0.1 µ. Fase terdispersi dan medium pendispersi dalam suatu koloid dapat saling berinterkasi satu sama lain, berdasarkan interaksi tersebut koloid sol dibagi menjadi liofil dan liofob (Oxtoby 2001).
Materi koloid dapat dihamburkan atau disebarkan dalam suatu medium sinambung, sehingga dihasilkan suatu dispersi (sebaran) koloid atau sistem koloid. Sistem koloid memiliki beberapa sifat, yaitu Efek Tyndall, Gerak Brown, dan Adsorpsi (Keenan et al. 1980). Koloid mempunyai diameter partikel pada sitemnya antara 1-100 nm sehingga tidak dapat disaring, oleh karena itu cara pembuatannya dilakukan dengan memperbesar partikel larutan atau memperkecil partikel suspensi (Chang 2007).
Buffer atau sering disebut sebagai larutan penyangga, yaitu larutan yang dapat mempertahankan harga pH tertentu terhadap usaha penambahan asam-basa dan pengenceran. Buffer merupakan campuran dari asam lemah dan garamnya serta basa lemah dan garamnya. Biasanya larutan ini digunakan untuk praktikum dan mempertahankan pH dalam tubuh (Purba 2003). Larutan buffer berperan besar dalam mengatur kelarutan ion-ion dalam larutan sekaligus mempertahankan pH dalam proses fisiologis dan biokimia. Mempertahankan pH optimum pada kerja enzim, diperlukan larutan buffer untuk mempertahankan pH dalam tubuh. Kapasitas kerja buffer paling baik apabila nilai pK sama dengan pH (Lenhinger 1982).
METODE PRAKTIKUM
Waktu Praktikum
Praktikum materi biofisik ke-2 ini dilaksanakan di Laboratorium Biokimia FMIPA IPB pada hari Kamis tanggal 25 Februari 2016 pukul 12.00 – 14.30 WIB. Membahas materi koloid, buffer, dan tekananan osmotik.
Alat dan Bahan
Alat-alat yang digunakan dalam praktikum ini antara lain: gelas piala, tabung reaksi, pH meter, pipet Mohr, pipet tetes, dan bulb.
Bahan-bahan yang digunakan dalam praktikum ini antara lain: gelatin 2%, koloid pati 2%, koloid biru berlin, koloid ferihidroksida, akuades, NaCl 03%, NaCl 0.9%, NaCl 5%, MgSO4, koloid CuSO4, eosin, larutan giemsa, asam asetat (CH3COOH), Na-asetat (CH3COONa), Na2HPO4, KH2HPO4, dan darah segar.
Prosedur Percobaan
Praktikum ini terdiri dari tiga tahap utama. Pada tahap awal dilakukan percobaan koloid. Koloid yang akan di uji adalah koloid liofil dan liofob. Koloid liofil terdiri dari 2 bahan, yakni koloid gelatin 2%, dan koloid pati 2%. Sedangkan koloid liofob terdiri dari 2 bahan yaitu koloid biru berlin dan koloid ferihidroksida.
Larutan koloid liofil. Terdiri koloid gelatin 2% dan koloid pati 2%. Percobaan gelatin 2%, dilakukan dengan cara menyiapkan gelas piala 250 ml lalu dicampurkan 2 g gelatin 2% dan 25 ml akuades dingin. Kemudian tuang 75 ml air mendidih dan aduk. Sedangkan untuk koloid pati 2%, disiapkan pula gelas piala 250 ml lalu dimasukan 2 g pati 2% dan 10 ml air dingin. Kemudian tuang air 90 ml air mendidih lalu diaduk.
Larutan koloid liofob. Terdiri dari koloid biru berlin dan koloid ferihidroksida. Percobaan koloid biru berlin, di lakukan dengan cara menyiapkan gelas piala 100 ml lalu pipet 10 ml K4Fe(CN)6 0.2 N dan FeCl3 0.02 N ke dalam gelas piala. Kemudian aduk hingga homogen. Ambil kira-kira 5 ml campuran tadi ke tabung reaksi, di encerkan seperlunya. Diamati ada atau tidaknya endapan. Selanjutnya koloid ferihidroksida, menyiapkan gelas piala 100 ml lalu pipet 1 ml FeCl3 33% serta tambahkan kedalam 200 ml akuades mendidih ke dalam gelas piala tersebut. Koloid yang telah jadi diamati dan dicatat perbedaannya.
Pengendaan koloid dengan latutan garam. Pengendapan larutan koloid liofil NaCl 10% dilakukan dengan cara menambahkan akuades kedalam larutan pekat atau yang belum mengendap hingga terbentuk endapan. Sedangakan untuk larutan koloid liofob ditambahkan akuades dan MgSO4 hingga terjadi endapan. Adapun sifat larutan koloid, disiapkan gelatin 15% kemudian dimasukan 5 ml ke dalam 4 tabung reaksi dinginkan hingga terbentuk gel. Lalu masukan larutan koloid CuSo4 5%, biru berlin, eosin, dan giemsa ke dalam tabung reaksi yang telah berisi gel gelatin tersebut. Kemudian dinginkan kembali tiap tabung reaksi tersebut selama satu malam, lalu amati larutan mana yang berdifusi lewat gel dan mana yang tidak berdifusi.
4.00:600; 2.10:7.90. Setelah dicampurkan dan homogen, diukur pH nya dan catat hasilnya. Sedangkan buffer fosfat standar (Sorensen) dicampurkan, 1/15 M Na2HPO4 dan KH2PO4 dengan perbandingan keduanya sebagai berikut: 0.50:9.50; 1.20:8.80; 2.65:7.35; 5.00:5.00; 7.15:2.85. Kemudian pH larutannya di ukur dan di catat.
Tekanan osmotik cairan sel darah. Tahap percobaan ini adalah mengukur tekanan osmotik cairan sel darah merah manusia. Tiga tabung reaksi disiapkan lalu masukan kedalam masing-masing tabung reaksi tersebut 5 ml larutan NaCl 0.3%, NaCl 0.9%, dan NaCl 5%. Kemudian darah segar diteteskan dan di suspensikan dengan larutan NaCl tadi, lalu diamati di mikroskop.
HASIL DAN PEMBAHASAN
Koloid dapat didefinisikan sebagai campuran dari dua atau lebih zat yang salah satu fasenya tersuspensi sebagai sejumlah kecil dalam fase kedua (Oxtoby 2001). Ukuran dispersinya 1 mµ sampai 0.1 µ. Fase terdispersi dan medium pendispersi dalam suatu koloid dapat berinteraksi satu sama lain. Berdasarkan interaksi tersebut, koloid sol dapat dibedakan atas liofil (suka cairan) dan liofob (tidak suka cairan). Koloid liofil merupakan koloid dimana terdapat gaya tarik menarik yang cukup besar antara fase terdispersi dengan medium pendispersi. Contoh dispersi kanji, sabun, dan detegen. Koloid liofob merupakan koloid yang terdapat gaya tarik menarik menarik yang cukup lemah atau bahkan tidak ada sama sekali antar fase terdispersi dengan medium pendispersinya. Contoh dispersi emas, belerang dalam air (Atkins 1999).
Suatu koloid di dalam medium pendispersi cair juga mempunyai sifat koligatif. Sifat ini bergantung pada jumlah partikel koloid bukan pada jenisnya. Sifat koligatif koloid umunya relative lebih rendah daripada larutan sejati dengan jumlah partikel yang sama (Laider 1982).
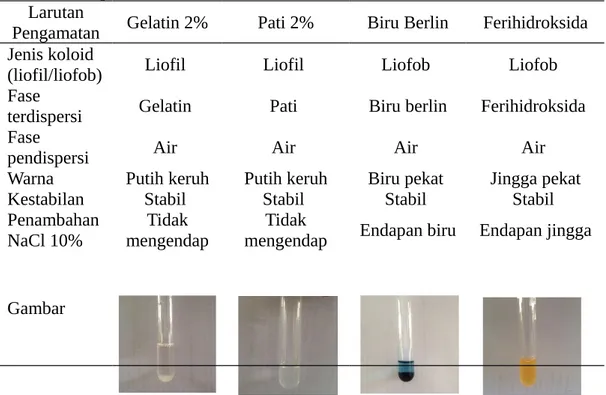
Tabel 1 Data percobaan koloid Larutan
Pengamatan Gelatin 2% Pati 2% Biru Berlin Ferihidroksida Jenis koloid
(liofil/liofob) Liofil Liofil Liofob Liofob
Fase
terdispersi Gelatin Pati Biru berlin Ferihidroksida Fase
pendispersi Air Air Air Air
Warna Putih keruh Putih keruh Biru pekat Jingga pekat
Kestabilan Stabil Stabil Stabil Stabil
Merujuk tabel pengamatan diatas percobaan ini dilakukan menggunakan larutan gelatin 2% dan larutan pati 2% yang mempunyai sifat liofil. Sedangkan percobaan larutan liofob menggunakan larutan biru berlin dan ferihidroksida.
Koloid mempunyai sifat kinetik dapat mengendap. Partikel-partikel ini cenderung mengendap karena pengaruh gravitasi bumi. Hal tersebut bergantung pada partikel terhadap mediumnya. Jika rapat massa partikel terhadap medium pendispersinya, maka partikel tersebut akan mengendap begitupun sebaliknya.
Pengendapan koloid dengan larutan garam menghasilkan data bahwa larutan dengan jenis koloid liofil (gelatin dan pati) setelah ditambahkan dengan NaCl 10% tidak menghasilkan endapan atau tetap pada fase dipersinya. Sedangkan untuk larutan jenis koloid liofob, setelah ditambahkan NaCl 10% larutan menghasilkan endapan dalam beberapa menit. Hasil percobaan ini sesuai teori, yaitu NaCl lebih mudah dalam mengkoagulasikan koloid liofob karena memiliki muatan positif dan muatan negative. Muatan tersebut kemudian akan mengikat muatan yang berlawanan pada koagulan sehingga apabila konsentrasi elektrolit cukup besar tidak akan terjadi tolak menolak dan larutan akan terendapkan (Atkins 1999).
Partikel zat terlarut akan mendifusi larutan yang konsentrasinya tinggi ke daerah yang konsentrasinya lebih rendah. Difusi erat kaitannya dengan gerak Brown, sehingga dapat dianggap molekul-molekul atau partikel koloid mendifusi karena adanya gerak Brown. Koloid liofil memiliki ciri berdifusi dengan ditandai adanya gradien warna. Gradasi warna koloid dapat terlihat apabila tabung reaksi dibalik. Sedangkan untuk koloid liofob tidak mengalami difusi, terlihat dari tabung reaksi yang jika dibalik terjadi perembesan yang tampak dari tercampurnya warna (Alberts et al. 2004).
Tabel 2 Pengamatan sifat-sifat larutan koloid
Campuran Gelatin + BiruBerlin Gelatin +CuSO4 Gelatin +Eosin Gelatin +Giemsa
Pengamatan Bercampur Difusi Difusi Difusi
Jenis koloid
(liofil-liofob) Liofil-liofob Liofil-liofil Liofil-liofil Liofil-liofil
Gambar
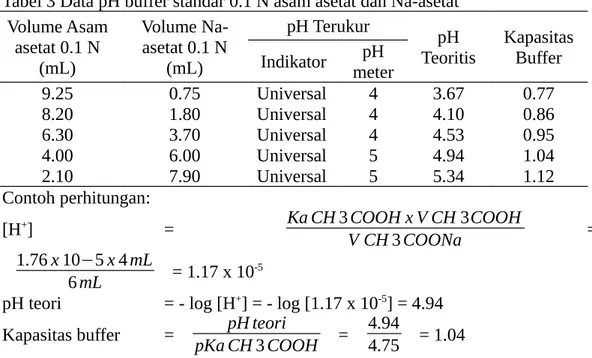
Tabel 3 Data pH buffer standar 0.1 N asam asetat dan Na-asetat
9.25 0.75 Universal 4 3.67 0.77
8.20 1.80 Universal 4 4.10 0.86
6.30 3.70 Universal 4 4.53 0.95
4.00 6.00 Universal 5 4.94 1.04
2.10 7.90 Universal 5 5.34 1.12
Contoh perhitungan: Kapasitas buffer = pH teori
pKa CH3COOH =
4.94
4.75 = 1.04
Berdasarkan tabel diatas, didapatkan pH terukur dari asam asetat dan Na-aetat dengan hasil yang berbeda menggunakan pH meter dan indicator. Hasil dari pH terukur, nilai pH yang didapatkan oleh pH meter lebih besar dibandingkan dengan nilai pH teoritis. Nili pH terbesar bernilai 5.34 dimiliki oleh campuran larutan 0.1 N asam asetat 2.10 mL dengan larutan 0.1 N Na-asetat 7.90 mL dan kapasitas buffer 1.12.
Menurut R.A. Day & Underwood (1988), umumnya nilai pH yang diukur menggunakan pH meter berbilai lebih besar karena: 1.) ketidakpastian dalam nilai tetapan disosiasi asam dan basa lemah, 2.) disebabkan oleh pendekatan yang digunakan dalam perhitungan, 3.) efek aktifitas, 4.) ketepatan menimbang garam dan memipet asam dll.
Buffer yang terdapat di tubuh manusia adalah buffer fosfat dan asetat. Kedua buffer ini memiliki fungsi yang sama tapi berbeda daya kerjanya. Sistem buffer fosfat mempunyai efektivitas maksimum pH 6.86 karena pKa H2PO4 -adalah 6.86. Jadi pasangan H2PO4- - HPO4-2 cenderung seimbang (Lehninger 2004).
Tabel 4 Data pH buffer standar Na2HPO4 dan KH2PO4 Volume
0.50 9.50 Universal 5 5.51 0.76
1.20 8.80 Universal 6 5.92 0.82
2.65 7.35 Universal 6 6.35 0.88
5.00 5.00 Universal 7 6.80 0.94
7.15 2.85 Universal 8 7.19 1.00
[OH-] = Kb Na2HPO4x V Na2HPO4
V KH2PO4 =
6.23x10−8x5mL
5mL = 6.23 x 10-8
pOH teori = - log [OH-] = - log [6.23 x 10-8] = 7.21 pH teori = 14 – pOH = 14 – 7.21 = 6.80
Kapasitas buffer = pKb NapH teori2HPO4 = 6.807.20 = 0.94
Percobaan tabel diatas dilakukan dengan mencampurkan Na2HPO4 dan KH2PO4. Semakin sedikit volume Na2HPO4 maka pH larutan dari campuran akan semakin asam. Lehninger (2004) mengemukakan kisaran pH nilai kapasitas buffer fosfat adalah 6.1 – 7.7 dan buffer asetat pada 4.2 – 5.6. Hal ini sesuai dengan percobaan yang dilakukan yakni didapat kapasitas buffer asetat pada rentang tersebut.
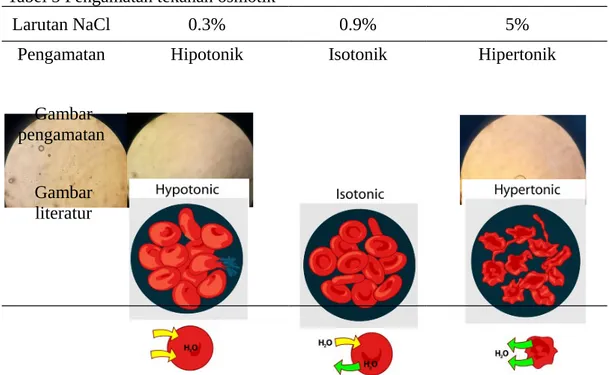
Tekanan osmotik larutan adalah tekanan yang harus diberikan kepada larutan untuk mencegah masuknya aliran air ke dalam. Tekanan ini prporsional dengan konsentrasi solut (Voet et al. 2006). Tekanan ini dapat menghentikan perpindahan molekul melalui membran semipermiabel. Sel dapat mengalami hipotonik, isotonik, atau hopertonik pada saat kondisi tekanan osmotik. Ketika sel darah merah diberikan larutan NaCl 5% sel mengalami krenasi (mengkerut), dan lisis (pecah) ketika diberi larutan NaCl 0.3%. Sedangkan sel tidak memberikan dampak apapun ketika NaCl 0.9% ditambahkan.
Krenasi terjadi akibat adanya perpindahan cairan sel keluar sel, sehingga sel mengkerut dan hanya tampak ukuran sel mengecil dari luar yang mengalami plasmolisis. Kondisi hipotonik, sel darah merah pecah akibat pembesaran sel karena rendahnya konsentrasi di luar disbanding di dalam sehingga larutan masuk ke dalam sel mengakibatkan terjadinya peningkatan tekanan turgor (Alberts et al.
2004). Berbeda pada kondisi isotonik, yaitu pada saat sel darah merah direndam dengan NaCl 0.9% sel tidak mengalami perubahan yang signifikan. Hal ini dikarenakan larutan NaCl 0.9% merupakan larutan fisiologis dan keadaan ini merupakan kondisi dimana tidak terjadi perpindahan cairan dari dalam sel keluar sel atau sebaliknya karena konsentrasinya sama.
Tabel 5 Pengamatan tekanan osmotik
Larutan NaCl 0.3% 0.9% 5%
Pengamatan Hipotonik Isotonik Hipertonik
Gambar pengamatan
SIMPULAN
Sistem koloid yang bersifat liofob dapat membentuk endapan lebih cepat disbanding koloid liofil ketika ditambahkan NaCl dan mengalami perembesan dan pencampuran. Koloid liofil cenderung tidak membentuk endapan ketika ditambahkan NaCl, namun bersifat difusi. Buffer terbaik dapat diketahui dengan mengetahui nilai kapasitas buffer terbesar yang dihasilkan saat volume asam lemah atau basa lemah terendah. Peristiwa tekanan osmotik seperti hipotonik, isotonik dan hipertonik dapat terlihat pada sel drah merah yang ditambahkan larutan NaCl 5% (hipertonik), NaCl 0.3% (hipotonik), dan NaCl 0.9% (isotonik).
DAFTAR PUSTAKA
Atkins P. 1999. Kimia Fisika. Jakarta (ID): Erlangga. Terjemahan dari: Physical
Chemistry.
Alberts et al. 2004. Essential Cell Biology 2nd Ed. New York (USA): Garland Science.
Chang R. 2006. Kimia Dasar Jilid 2. Jakarta (ID): Erlangga.
Cotton A. 1989. Kimia Anorganik Dasar. Jakarta (ID): UI-Pr. Terjemahan dari:
Basic Inorganic Chemistry.
Sriwahyuni H, Suryantoro. 2006. Pengaruh ukuran butir koloid terhadap deposisi koloid pada tanah sekitar fasilitas penyimpanan lestari limbah radioaktif.
http://23HeruSriwahyuni_211-216_koloid.pdf
Lehninger A. 1982. Dasar-Dasar Biokimia Jilid I. Jakarta (ID): Erlangga. Terjemahan dari: Principles of Biochemistry.
Nurarfa W. 2014. Biofisik II. http://whyranran.blogspot.co.id/2014/02/biofisik-ii.html?m=1