BAB III
METODE PENELITIAN
Penelitian ini dilakukan secara eksperimental meliputi pengujian aktivitas antioksidan EEDBB (Ekstrak Etanol Daun Bangun-Bangun) terhadap kadar enzim SOD (SuperOxide Dismutase) melalui metode spektrofotometri pada serum dan pemeriksaan histologi jaringan hati tikus. Tahap penelitian meliputi pengumpulan bahan uji, pembuatan simplisia dan ekstrak, karakterisasi pada simplisia dan ekstrak, skrining fitokimia simplisia dan ekstrak, uji aktivitas antioksidan secara in vivo, dan histologi jaringan hati tikus.
3.1 Alat dan Bahan 3.1.1 Alat
Alat-alat yang digunakan terdiri dari lemari pengering, oven, tanur, rotary evaporator, water bath, seperangkat alat penetapan kadar air, desikator, neraca hewan, neraca listrik, blender, mikroskop, objek kaca, tissue, spatula, alat-alat gelas laboratorium, aluminium foil, kertas saring, oral sonde, pipet tetes, spuit, selang, alat sentrifuge, alat vortex, dan spektrofotometerUV-Visible.
3.1.2 Bahan
n-heksan,toluen, kloroform, serbuk magnesium, serbuk seng, Doxorubicin, EnzyChrom™SuperOxide Dismutase Assay Kit (ESOD-100), Na-CMC (natrium carboxy methyl cellulose), dan akuades.
3.1.3 Hewan Percobaan
Hewan percobaan yang digunakan dalam penelitian ini adalah tikus putih (Rattus norvegicus) galur Wistar, jenis kelamin betina, berusia 2-3 bulan dengan berat badan150-200 g.
3.2 Prosedur Pembuatan Simplisia 3.2.1 Pengambilan Bahan
Pengambilan bahan tumbuhan dilakukan secara purposif tanpa membandingkan dengan tumbuhan yang sama dari daerah lain. Tumbuhan diambil dari daerah Kecamatan Pancur Batu, Kabupaten Deli Serdang, Sumatera Utara.
3.2.2 Determinasi Tumbuhan
Determinasi bahan tumbuhan bangun-bangun (Plectranthus amboinicus L.) dilakukan di Herbarium Medanense, Fakultas MIPA, Universitas Sumatera Utara, Medan.
3.2.3 Pembuatan Simplisia
lemari pengering hingga kering, sortasi kering, kemudian ditimbang beratnya, dan disimpan dalam wadah plastik yang tertutup rapat.
3.3 Pemeriksaan Karakteristik Simplisia
3.3.1Pemeriksaan Makroskopik dan Organoleptik
Pemeriksaan makroskopik dan organoleptik dilakukan dengan mengamati bentuk, bau dan rasa dari daun bangun, serbuk simplisia daun bangun-bangun.
3.3.2 Pemeriksaan Mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap daun bangun-bangun segar dan serbuk simplisia daun bangun-bangun. Serbuk simplisia daun bangun-bangun diletakkan di atas kaca objek yang telah ditetesi dengan larutan kloralhidrat dan ditutup dengan kaca penutup, selanjutnya diamati di bawah mikroskop.
3.3.3 Penetapan Kadar Air Simplisia
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi toluena). Alat terdiri dari labu alas bulat 500 ml, alat penampung, pendingin, tabung penyambung, dan tabung penerima.
Cara kerja:
besar air terdestilasi, kemudian kecepatan tetesan dinaikkan hingga 4 tetes tiap detik. Setelah semua air terdestilasi, bagian dalam pendingin dibilas dengan toluena. Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan mendingin pada suhu kamar. Setelah air dan toluena memisah sempurna, volume air dibaca dengan ketelitian 0,05 ml. Selisih kedua volume air yang dibaca sesuai dengan kandungan air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung dalam persen (WHO, 1992).
3.3.4. Penetapan Kadar Sari Larut Dalam Air
Sebanyak 5 g serbuk yang telah dikeringkan dimaserasi selama 24 jam dengan 100 ml air-kloroform (2,5 ml kloroform dalam air sampai 1 liter) menggunakan labu bersumbat sambil sesekali dikocok selama 6 jam pertama, kemudian dibiarkan selama 18 jam. Saring, 20 ml filtrat dipipet, diuapkan sampai kering dalam cawan penguap berdasar rata yang telah ditara dan dipanaskan pada suhu 105ºC sampai bobot tetap. Kadar sari yang larut dalam air dihitung dalam persen (Depkes RI, 2008).
3.3.5. Penetapan Kadar Sari Larut Dalam Etanol
Sebanyak 5 g serbuk yang telah dikeringkan dimaserasi selama 24 jam dengan 100 ml etanol 95% menggunakan labu bersumbat sambil sesekali dikocok selama 6 jam pertama, kemudian dibiarkan selama 18 jam. Saring, 20 ml filtrat dipipet, diuapkan sampai kering dalam cawan penguap yang berdasar rata (Depkes RI, 2008).
3.3.6. Penetapan Kadar Abu Total
diratakan. Krus dipijar perlahan-lahan sampai arang habis, pemijaran dilakukan pada suhu 600oC selama 3 jam kemudian didinginkan dan ditimbang sampai diperoleh bobot tetap. Kadar abu total dihitung dalam persen (Depkes RI, 1995). 3.3.7. Penetapan Kadar Abu Tidak Larut Dalam Asam
Abu yang diperoleh dalam penetapan kadar abu total dididihkan dalam 25 ml asam klorida 2 N selama 5 menit, bagian yang tidak larut dalam asam dikumpulkan, disaring melalui kertas saring bebas abu kemudian dicuci denganair panas dalam kurs porselen. Residu dan kertas saring dipijarkan pada suhu 60oC sampai bobot tetap, kemudian didinginkan dan ditimbang. Kadar abu tidak larut dalam asam dihitung terhadap bahan yang dikeringkan di udara (Depkes RI, 1995).
3.4 Skrining Fitokimia Simplisia
Skrining fitokimia serbuk simplisia daun bangun-bangun (Plectranthus amboinicus L.) meliputi pemeriksaan senyawa golongan flavonoid, alkaloid, saponin, tannin, glikosida, dan steroid/triterpenoid.
3.4.1 Pemeriksaan Flavonoid
3.4.2 Pemeriksaan Alkaloid
Serbuk simplisia ditimbang sebanyak 0,5 g kemudian ditambahkan 1 ml asam klorida 2 N dan 9 ml air suling, dipanaskan di atas penangas air selama 2 menit, didinginkan dan disaring. Filtrat yang diperoleh dipakai untuk uji alkaloida: diambil 3 tabung reaksi, lalu ke dalamnya dimasukkan 0,5 ml filtrat. Pada masing-masing tabung reaksi :
a. Ditambahkan 2 tetes pereaksi Mayer b. Ditambahkan 2 tetes pereaksi Bouchardat c. Ditambahkan 2 tetes pereaksi Dragendorff
Alkaloida positif jika terjadi endapan atau kekeruhan pada paling sedikit dua dari tiga percobaan di atas (Depkes RI, 1995).
3.4.3 Pemeriksaan Saponin
Serbuk simplisia ditimbang sebanyak 0,5 g dan dimasukkan ke dalam tabung reaksi, lalu ditambahkan 10 ml air panas, didinginkan kemudian dikocok kuat-kuat selama 10 detik. Jika terbentuk busa setinggi 1-10 cm yang stabil tidak kurang dari 10 menit dan tidak hilang dengan penambahan 1 tetes asam klorida 2 N menunjukkan adanya saponin (Depkes RI, 1995).
3.4.4 Pemeriksaan Tanin
3.4.5 Pemeriksaan Glikosida
Serbuk simplisia ditimbang sebanyak 2 g, lalu disari dengan 20 ml campuran etanol 95% dengan air (7:2) dan 10 ml asam klorida 2 N, direfluks selama 2 jam, didinginkan dan disaring. Diambil 20 ml filtrat ditambahkan 25 ml air suling dan 25 ml timbal (II) asetat 0,4 M, dikocok, didiamkan 5 menit lalu disaring. Filtrat disari dengan 20 ml campuran isopropanol dan kloroform (2:2), dilakukan berulang kali sebanyak 2 kali. Sari air dikumpulkan dan diuapkan pada temperatur tidak lebih dari 500C. Sisanya dilarutkan dalam 2 ml methanol. Larutan sisa digunakan untuk percobaan berikut: 0,1 ml larutan percobaan dimasukkan dalam tabung reaksi dan diuapkan di atas penangas air. Pada sisa ditambahkan 2 ml air dan 5 tetes pereaksi Molisch. Kemudian secara perlahan-lahan ditambahkan 2 ml asam sulfat pekat melalui dinding tabung, terbentuknya cincin berwarna ungu pada batas kedua cairan menunjukkan glikosida (Depkes RI, 1995).
3.4.6 Pemeriksaan Steroid/Triterpenoid
3.5 Proses Pembuatan Ekstrak Etanol Daun Bangun-Bangun (EEDBB)
Proses pembuatan ekstrak dilakukan dengan cara maserasi menggunakan pelarut etanol.Sebanyak 500g serbuk kering simplisia dengan derajat halus yang cocok dimasukkan ke dalam bejana, kemudian dituangi dengan etanol 96% sebanyak 75 bagian, ditutup dan dibiarkan selama 5 hari, terlindung dari cahaya sambil diaduk sekali-kali setiap hari. Setelah 5 hari, kemudian disaring, ampas diperas. Ampas dicuci dengan pelarut secukupnya, diaduk dan disaring hingga diperoleh 100 bagian. Tampung maserat ke dalam bejana tertutup, dibiarkan di tempat sejuk terlindung dari cahaya selama 2 hari kemudian dienaptuangkan. Pemekatan ekstrak dilakukan dengan alat rotary evaporator, kemudian ekstrak dikeringkan dengan penangas air(Depkes RI, 1979).
3.6 Karakterisasi dan Skrining Fitokimia Ekstrak Etanol Daun Bangun-Bangun (EEDBB)
Prosedur karakterisasi dan pemeriksaan golongan senyawa kimia ekstrak etanol daun bangun-bangun dilakukan sama seperti prosedur untuk karakterisasi dan pemeriksaan skrining fitokimia serbuk simplisia.
3.7 Penyiapan Pereaksi dan Bahan Uji 3.7.1 Pembuatan Suspensi CMC Na 1% b/v
3.7.2 Pembuatan Suspensi Rutin
Ditimbang rutin sebanyak 100 mg, ditambahkan suspensi CMC Na 1% sedikit demi sedikit sambil digerus homogen, lalu diencerkan dengan suspensi CMC Na 1% hingga 20 ml.
3.7.3 Pembuatan Suspensi Ekstrak Etanol Daun Bangun-Bangun (EEDBB) Dalam pengujian akan digunakan 3 variasi dosis, yakni dosis 250 mg/kg BB, dosis 500 mg/kg BB, dan dosis 750 mg/kg BB. EEDBB dimasukkan sebanyak 1,5 g ke dalam lumpang ditambahkan suspensi Na-CMC 1% b/v sedikit demi sedikit sambil digerus sampai homogen, lalu cukupkan sesuai total volume EEDBB yang dibutuhkan yaitu 20 ml.
3.7.4 Induksi Stres Pada Tikus
Penginduksian stres pada tikus dilakukan pada hari ke-8 dan ke-9 pengujian. Penginduksian dilakukan dengan memberikan doksorubisin HCl dosis 20 mg/kg bb secara intraperitonial (Thandavarayan, dkk., 2015 ; Ihab, dkk., 2009).
3.7.5 Pembuatan larutan buffer formalin 10%
Larutan buffer formalin 10 % dibuat dengan penambahan 4 g NaH2PO4 dn 6,5 g Na2HPO4 ke dalam formalin 10 % (100 mL larutan formaldehid 40% ditambah akuades 900 mL) kemudian dicukupkan dengan akuades sampai 1000 mL.
3.8 Uji Aktivitas Antioksidan EEDBB (Ekstrak Etanol Daun Bangun-Bangun) dengan Metode Spektrofotometri UV-Visible terhadap Kadar SOD.
3.8.1 Penyiapan Hewan Percobaan
Sebelum dijadikan subjek percobaan, semua tikus diadaptasikan dengan lingkungannya selama 7 hari dan diberikan perlakuan normal (aklimatisasi). Masing-masing kandang diberikan bedding (sekam) dan diberi makan secara teratur.
Hewan percobaan dikelompokkan menjadi 6 kelompok. Masing-masing terdiri dari 5 ekor tikus.
Kelompok 1 : diberikan suspensi CMC Na 1% secara per oral selama 9 hari (Normal).
Kelompok 2 : diberikan doksorubisin HCl dosis 20 mg/kg bb secara intraperitonial pada hari ke-8 dan ke-9 (Kontrol Negatif).
Kelompok 3 : diberikan suspensi EEDBB dosis 250 mg/kg bb selama 7 hari, dilanjutkan hari ke-8 dan ke-9 bersama dengan pemberian doksorubisin HCl 20 mg/kg bb secara intraperitonial.
Kelompok 4 : diberikan suspensi EEDBB dosis 500 mg/kg bb selama 7 hari, dilanjutkan hari ke-8 dan ke-9 bersama dengan pemberian doksorubisin HCl 20 mg/kg bb secara intraperitonial.
Kelompok 5 : diberikan suspensi EEDBB dosis 750 mg/kg bb selama 7 hari, dilanjutkan pada hari ke-8 dan ke-9 bersama dengan pemberian doksorubisin HCl 20 mg/kg bb secara intraperitonial.
Tikus dipuasakan selama 12 jam setelah perlakuan terakhir dan pada hari ke-10 semua hewan percobaan dianestesi dengan ketamin 70 mg/kg bb secara intraperitonial. Selanjutnyadengan segera diambil cuplikan darah dari jantung tikus untuk dilakukan pengukuran aktivitas SOD pada serumnya dan hati tikus untuk dilakukan histologi.
3.8.2 Pengambilan Serum Darah Tikus
Pengambilan serum darah tikus diawali dengan pengambilan sejumlah volume darah dari jantung dengan menusukkan syringe langsung dan disedot secara perlahan, kemudian dimasukkan ke dalam tube. Selanjutnya sentrifuge dengan kecepatan 1500-3000 rpm selama 10-15 menit dan diambil supernatan pada bagian atas berupa cairan bening agak kekuningan (Frandson, 1981).
3.8.3 Pengukuran Kadar SOD pada Serum Darah Tikus
Pengukuran kadar SOD dilakukan dengan metode Spektrofotometri UV-Visible berdasarkan prosedur EnzyChrom™ SuperOxide Dismutase Assay Kit (ESOD-100) pada panjang gelombang 440 nm. Prosedur dapat dilihat pada lampiran 15 halaman 88.
Prosedur : a. Sampel :
Disiapkan 30 sampel serum darah tikus. Kemudian sampel didilusikan menggunakan Diluent dengan perbandingan 1 : 5.
b. Standard :
Dicampurkan 8 μl SOD Enzyme dengan 392 μl Diluent agar mencapai 3 U/ml
Dipindahkan 20 μl masing-masing SOD Standard ke dalam plate 96-well alas datar. Kemudian pindahkan juga masing-masing sampel ke dalam well secara terpisah.
c. Disiapkan Working Reagent. Untuk setiap well, dicampurkan 160 μl Assay Buffer, 5 μl Xanthine dan 5 μl WST-1. Pindahkan 160 μl Working Reagent tersebut ke masing-masing well yang sudah terisi standard dan sampel, selanjutnya plate di goyangkan dengan pelan dan hati-hati agar saling tercampur.
d. Didilusikan dengan cepat XO Enzyme 1:20 dalam Diluent. Kemudian ke dalam setiap well pengujian ditambahkan 20 μl XO Enzyme yang terdilusi tersebut dengan multi-channel pipettor. Plate digoyangkan dengan pelan dan hati-hati agar saling tercampur.
e. Diukur absorbansinya segera dengan Spektofotometri, panjang gelombang 440 nm (OD0). Selanjutnya diinkubasikan selama 60 menit dalam temperatur ruangan (250C) dan keadaan gelap. Kemudian ukur kembali absorbansi dengan panjang gelombang 440 nm (OD60).
No 3U/ml SOD + Diluent Standard (U/ml)
1 80 μl + 20 μl 2.4
2 40 μl + 60 μl 1.2
3 8 μl + 92 μl 0.24
4 4 μl + 96 μl 0.12
f. Dikalkulasikan hasil absorbansinya dengan mendapatkan nilai ∆OD = OD 60 – OD0; ∆∆OD = ∆OD std 8 - ∆OD dari setiap standard dan sampel dimana ∆OD std 8 adalah standard yang tidak mempunyai aktivitas SOD dan nilai absorbansinya yang paling tertinggi. Selanjutnya dibuat plot kurva standard
∆∆OD vs[SOD](U/ml).
3.9 Pemeriksaan Histopatologi Jaringan Organ Hati Tikus dengan Pewarnaan Hematoxylin Eosin (HE)
3.9.1 Pembuatan Preparat Blok Parafin
Langkah-langkah pembuatan blok parafin adalah sebagai berikut:
a. sampel hati yang direndam dalam larutan formalin 10% selanjutnya dilakukan proses dehidrasi dengan alkohol bertingkat yaitu diawali dengan alkohol 70%, kemudian berturut-turut alkohol 80%, alkohol 95%, dan alkohol absolut. Pada masing-masing proses dilakukan selama 30 menit sampai 1 jam.
b. tahap selanjutnya adalah pencucian dengan menggunakan larutan xylol yaitu xylol 1, xylol 2, dan xylol 3 masing-masing selama 1-2 jam.
c. proses penanaman. Caranya: sampel direndam dalam campuran xylol dan parafin cair pada suhu 60–70oC, dengan perbandingan xylol : parafin berturut-turut 3:1, 1:1, dan 1:3 masing-masing selama 2 jam.
d. dilakukan pencetakan dan dibiarkan membeku, kemudian blok parafin dipotong dengan menggunakan alat mikrotom dengan ketebalan irisan 5-7 μm.
3.9.2 Pewarnaan Hematoxylin Eosin
adalah fiksasi dengan memasukkan preparat ke dalam larutan alkohol 96%. Kemudian dicuci dengan air mengalir dan direndam dalam akuades. Preparat direndam dalam hematoxylin selama 5 menit lalu dicuci dengan air mengalir selama 3 menit. Kemudian preparat dicelup ke dalam larutan acid alcohol 1% sebanyak 1-2 celupan dan dicuci kembali dengan air mengalir selama 3 menit. Setelah itu preparat diwarnai menggunakan eosin 1% dan dicuci lagi dengan air mengalir selama 3 menit. Kemudian dilakukan proses dehidrasi dengan alkohol bertingkat (alkohol 80%, 95% dan alkohol absolut) selama 3 menit serta penjernihan (clearing) dengan menggunakan xylol. Sediaan dilakukan mounting dan ditutup dengan cover glass. Preparat diamati dibawah mikroskop cahaya untuk melihat morfologi sel atau jaringan termasuk kerusakannya.
3.10 Analisis Data
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Tumbuhan
Identifikasi tumbuhan dilakukan di Herbarium Medanese, Universitas Sumatera Utara. Hasil identifikasi menunjukkan bahwa sampel termasuk famili Lamiaceace , jenis Coleus amboinicus Lour. Hasil identifikasi tumbuhan dapat dilihat pada lampiran 2 halaman 60.
4.2 Hasil Karakteristik Daun Bangun-Bangun dan Simplisia 4.2.1 Pemeriksaan Makroskopik
Hasil pemeriksaan makroskopik daun bangun-bangun segar menunjukkan daun berwarna hijau, helaian daun berbentuk bundar telur, kadang-kadang agak membundar, panjang helaian daun 3,5 cm sampai 7 cm, lebar 4 cm sampai 7 cm, pinggir daun agak bergerigi atau berombak. Pada keadaan segar helaian daun tebal, sangat berdaging dan berair, tulang daun bercabang-cabang, permukaan atas dan bawah berambut halus berwarna putih, bila dimakan berasa getir. Pada keadaan kering helaian daun tipis dan sangat berkerut, permukaan atas kasar, warna coklat sampai coklat tua, permukaan bawah berwarna lebih muda dari permukaan atas, pada kedua permukaan terdapat rambut halus berwarna putih. 4.2.2 Pemeriksaan Mikroskopik
4.2.3 Karakterisasi Simplisia dan EEDBB
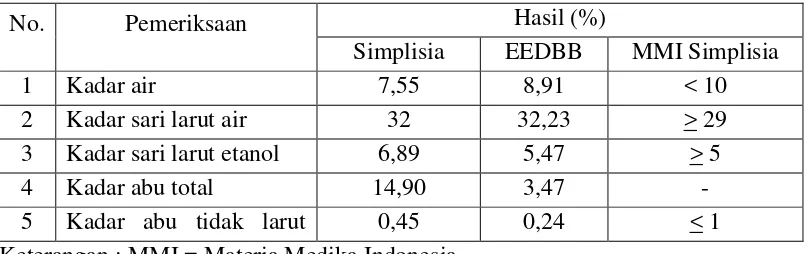
Hasil pemeriksaan kadar air, kadar sari larut air, kadar sari larut etanol, kadar abu total dan kadar abu yang tidak larut asam dapat dilihat pada Tabel 4.1 Tabel 4.1 Hasil Karakteristik Simplisia dan EEDBB
No. Pemeriksaan Hasil (%)
Simplisia EEDBB MMI Simplisia
1 Kadar air 7,55 8,91 < 10
2 Kadar sari larut air 32 32,23 > 29 3 Kadar sari larut etanol 6,89 5,47 > 5
4 Kadar abu total 14,90 3,47 -
5 Kadar abu tidak larut 0,45 0,24 < 1 Keterangan : MMI = Materia Medika Indonesia
bangun-bangun 0,45%, dan kadar ini juga memenuhi persyaratan simplisia daun bangun-bangun pada Materia Medika Indonesia yaitu kadar abu tidak larut dalam asam tidak lebih dari 1%. Hasil penetapan kadar abu total dari simplisia daun bangun-bangun adalah 14,90%, hasil penetapan kadar abu total dan persyaratan untuk ekstrak tidak dapat dibandingkan karena tidak terdapatnya monografipada Materia Medika Indonesia. Penetapankadar abu bertujuan untuk mengetahui persen dari mineral pada simplisia tersebut, semakin rendah kadar abu maka mutu simplisia semakin tinggi.
4.3 Skrining Fitokimia Simplisia dan EEDBB
Penentuan golongan senyawa kimia terhadap simplisia dan EEDBB dilakukan untuk mendapatkan informasi golongan senyawa metabolit sekunder yang terdapat di dalamnya. Hasil skrining fitokimia serbuk simplisia dan EEDBB menunjukkan adanya kandungan saponin, flavonoid, glikosida dan steroid/triterpenoid. Hasil pemeriksaan skrining fitokimia dapat dilihat pada Tabel 4.2.
Tabel 4.2 Hasil Skrining Fitokimia Simplisia dan EEDBB No. Pemeriksaan Simplisia Daun
Bangun-Bangun EEDBB
1. Alkaloid - -
2. Flavonoid + +
3. Glikosida + +
4. Saponin + +
5. Tannin - -
6. Steroid/triterpenoid + +
Keterangan: + = mengandung golongan senyawa
Hasil skrining fitokimia diatas, menunjukkan bahwa daun bangun-bangun berpotensi sebagai antioksidan, yaitu dengan adanya senyawa flavonoid. Secara in vitro, flavonoid merupakan inhibitor yang kuat terhadap peroksidasi lipid, sebagai penangkap spesies oksigen atau nitrogen yang reaktif, dan juga mampu menghambat aktivitas enzim lipooksigenase dan siklooksigenase dengan fungsinya yang juga sebagai antiinflamasi (Rohman dan Riyanto, 2005).
Ekstraksi serbuk simplisia dilakukan secara maserasi. Penyarian 260 gram simplisia daun bangun-bangun menggunakan etanol 96% menghasilkan 19,8533 gram ekstrak dengan persentase rendemen sebesar 7,636%.
4.4 Pengaruh Ekstrak Etanol Daun Bangun-Bangun Terhadap Aktivitas SOD pada Tikus
Pemeriksaan pengaruh ekstrak etanol daun bangun-bangun terhadap aktivitas SOD dilakukan secara kuantitatif dengan metode spektrofotometri UV-Vis berdasarkan prosedur Bioassay Systems (Enzychrom Superoxide Dismutase Assay Kit) pada panjang gelombang 440 nm. Metode ini berdasarkan pada prinsip kolorimetri untuk penentuan aktivitas enzim SOD dalam sampel biologi secara kuantitatif. Di dalam pengujian, superoksida (O2-) dihasilkan oleh reaksi katalisis xanthine oxidase (XO). O2- bereaksi dengan pewarna WST-1 untuk membentuk produk berwarna. SOD mengumpulkan O2- sehingga berkurangnya O2- berguna untuk reaksi kromogenik. Intensitas warna (OD440nm) digunakan untuk menentukan aktivitas SOD di dalam sampel. Semakin tinggi absorbansi yang
diperoleh (ΔΔOD) maka semakin tinggi aktivitas SOD dari sampel.Pengukuran
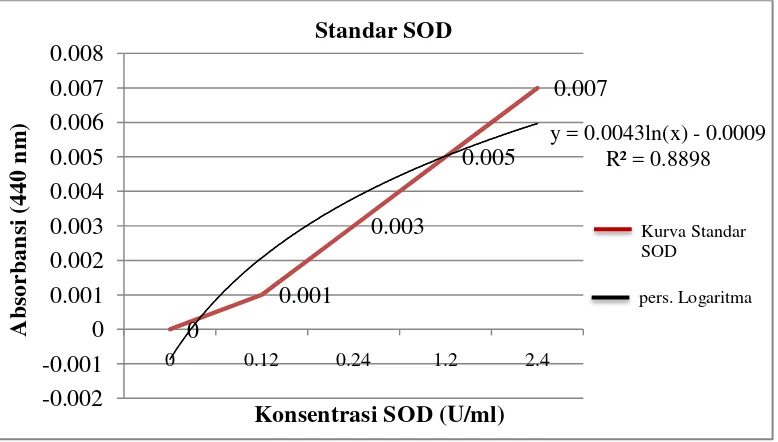
dibuat dengan mengukur absorbansi masing masing standar dengan konsentrasi0; 0,12; 0,24; 0,54; 1,2; 1,8; 2,4; 3U/ml pada panjang gelombang 440 nm. Nilai absorban setiap konsentrasi dapat dilihat pada Tabel 4.3.
Tabel 4.3 Absorbansi Standar SOD
Konsentrasi SOD (U/ml) Absorbansi (440 nm)
0 0
Berdasarkan tabel tersebut diperoleh kurva standar seperti ditunjukkan pada Gambar 4.1.
Gambar 4.1 Kurva Standar SOD
Kurva standar didapat dari hubungan berbagai konsentrasi standar dengan absorbansi yang terbentuk. Dari kurva kalibrasi ini diperoleh nilai r2. Nilai r2
berkisar antara 0 sampai 1 yang menunjukkan seberapa dekat nilai perkiraan untuk analisis regresi yang mewakili data yang sebenarnya. Dari kurva standar diperoleh persamaan garis regresi y = 0,0043 ln(x) – 0,0009 dengan nilai r2 = 0,8898.
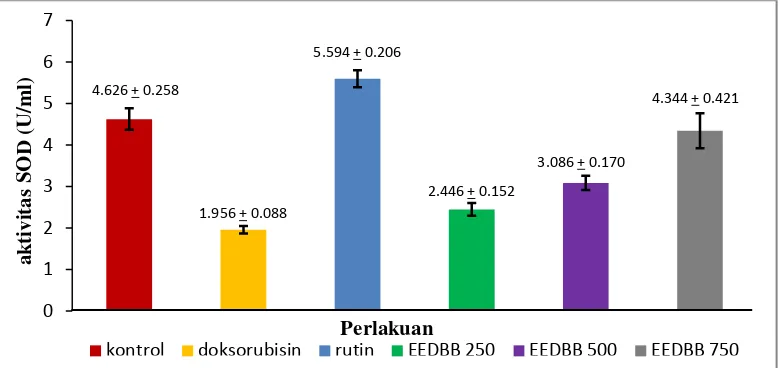
Aktivitas SOD dihitung dengan mensubstitusikan nilai absorban (y) sampel pada panjang gelombang 440 nm ke dalam persamaan garis regresi logaritma y = a ln(x) + b, yang diperoleh dari kurva standar SOD sehingga diperoleh nilai aktivitas SODnya (x). Hasil aktivitas SOD kemudian dilakukan analisis statistika menggunakan One Way Analysis of Variant (ANOVA) didapatkan perbedaan hasil pengukuran yang signifikan (p<0,05) antar kelompok perlakuan. Hasil uji aktivitas SOD ekstrak etanol daun bangun-bangun pada serum darah tikus dapat dilihat pada Tabel 4.4.
Tabel 4.4 Aktivitas SOD Ekstrak Etanol Daun Bangun-Bangun pada darah tikus Kelompok Rata-rata aktivitas SOD
(U/ml)
Kontrol 4,626 ± 0,258bc
Doksorubisin 1,956 ± 0,088ac
Rutin + Doksorubisin 5,594 ± 0,206ab EEDBB 250 + Doksorubisin 2,446 + 0,152abc EEDBB 500 + Doksorubisin 3,086 + 0,170abc EEDBB 750 + Doksorubisin 4,344 + 0,421bc Keterangan :
a : Sig (p)<0,05 ada perbedaan yang signifikan dengan kelompok kontrol
b : Sig (p)<0,05 ada perbedaan yang signifikan dengan kelompok doksorubisin
c : Sig (p)<0,05 ada perbedaan yang signifikan dengan kelompok rutin
nilaisignifikansi p < 0,05. Hasil analisis variansi dapat dilihat pada Lampiran 14, halaman 86.
Gambar 4.2 Pengaruh kelompok perlakuan terhadap aktivitas SOD
Pada Gambar 4.2 menunjukkan rata-rata nilai aktivitas SOD pada kelompok kontrol pelarut (CMC Na) adalah 4,626 ± 0,258 U/ml. Nilai tersebut menunjukkan standar nilai aktivitas enzim SOD tikus dalam keadaan sehat (normal). Hasil uji statistik menunjukkan bahwa aktivitas SOD kelompok kontrol CMC Na lebih tinggi dibandingkan dengan 3 kelompok EEDBB+doksorubisin. Kelompok rutin (kontrol positif)memiliki aktivitas SOD tertinggi (5,594 ± 0,206 U/ml) dan kelompok doksorubisin (kontrol negatif) memiliki aktivitas SOD paling rendah (1,956 ± 0,088 U/ml). Hal ini menunjukkan bahwa pemberian doksorubisin dosis toksik sebagai pemicu stres oksidatif yang akan menurunkan daya tahan antioksidan dalam tubuh dengan menunjukkan penurunan level SOD (Bulucu, dkk., 2009).
Berdasarkan analisis statistika diketahui bahwa perlakuan pemberian ekstrak etanol daun bangun-bangun memberikan pengaruh secara signifikan terhadap peningkatan aktivitas SOD.Pada kelompok EEDBB250 mg/kg bb (2,446 + 0,152 U/ml), EEDBB 500 mg/kg bb (3,086 + 0,170 U/ml), dan EEDBB 750
kontrol doksorubisin rutin EEDBB 250 EEDBB 500 EEDBB 750
mg/kg bb (4,344 + 0,421 U/ml) dibandingkan dengan kelompokdoksorubisin (kontrol negatif) yang memiliki nilai aktivitas enzim SOD paling rendah. Pemberian EEDBB mampu meningkatkan aktivitas SOD lebih tinggi dan dari hasil uji dapat dilihat bahwa semakin tinggi dosis EEDBB yang diberikan semakin tinggi aktivitas SOD yang dihasilkan.
Analisis statistik dilanjutkan untuk mengetahui kelompok perlakuan mana yang memiliki efek yang sama atau berbeda antara satu perlakuan dengan perlakuan yang lain dengan melakukan uji Post Hoc Tukey untuk semua perlakuan dimana hasil uji tersebut dapat dilihat pada lampiran 14 halaman 87, hasil uji Post Hoc Tukey, menunjukkan ada beberapa perlakuan yang tidak berbeda signifikan. Aktivitas SOD kelompok perlakuan EEDBB 750 mg/kg bb tidak memperlihatkan perbedaan signifikan (p > 0,05) terhadap kelompok perlakuankontrol (normal), hal ini menunjukkan bahwa pada dosis tersebut EEDBB mampu mengembalikan aktivitas SOD hingga normal kembali. Walaupun nilai aktivitas SOD nyaberbeda dengan kontrol (normal), pada dosis tersebut sudah memberikan aktivitas antioksidan yang paling efektif dan signifikan untuk dibandingkan dengan 2 variansi dosis EEDBB lainnya terhadap normal, sehinggakelompok EEDBB dosis 750 mg/kg bb memberikan aktivitas SOD yang paling baik. Hal ini mendukung hasil penelitian yang dilakukan Rao, et al. (2006), bahwa ekstrak etanol daun bangun-bangun memiliki kemampuan aktivitas antioksidan salah satunya dalam menangkal radikal SuperOxide dalam dosis tertentu.
dengan harapan bahwa senyawa kimia dari EEDBB mampu memproteksi tubuh tikus dari stres oksidatif yang dihasilkan dari penginduksian DOX. Berdasarkan penelitian sebelumnya, dosis 20 mg/kg bb DOX sudah dapat menyebabkan stres oksidatif (Thandavarayan, dkk., 2015 ; Ihab, dkk., 2009).
Antioksidan enzimatis (SOD) merupakan sistem pertahanan primer terhadap kondisi stres oksidatif. Ada juga antioksidan non-enzimatis yang disebut juga antioksidan sekunder karena diperoleh dari nutrisi dan non-nutrisi seperti
vitamin, β-karoten, Glutation, asam urat, flavonoid, juga termasuk dalam
kelompok ini (Winarsi, 2007). Oleh karena itu, senyawa yang berperan sebagai antioksidan yang terkandung pada EEDBB merupakan jenis antioksidan non-enzimatik yang membantu meningkatkan aktivitas non-enzimatik (SOD) dalam fungsinya untuk menangkap senyawa oksidan, mencegah reaksi berantai serta komponen-komponen tersebut tidak kalah penting perannya dalam menginduksi status antioksidan tubuh (Winarsi, 2007) dan mampu meningkatkan aktivitas gen pada sintesis enzim SOD (Han, et al., 2014).
4.5 Pemeriksaan Histologi Jaringan Hati Tikus
Kontrol pelarut (normal) Dox (Kontrol negatif)
EEDBB 250 mg/kg bb EEDBB 500 mg/kg bb
EEDBB 750 mg/kg bb Rutin (kontrol positif)
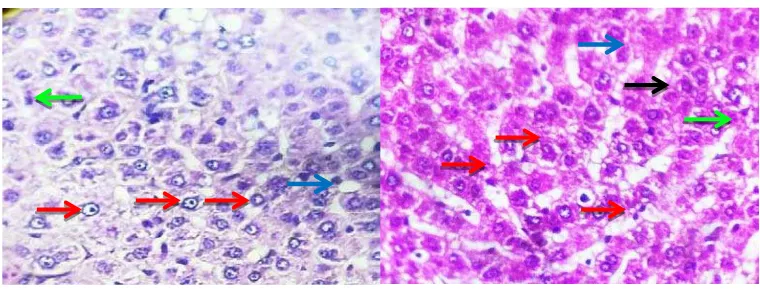
Hepatosit Normal
Gambar 4.3 Gambaran histologi hati tikus dengan pewarnaan Hematoxylin dan Eosin pada berbagai perlakuan (perbesaran 40x).
Karyoreksis
Nekrosis adalah tipe kematian sel yang berkaitan dengan hilangnya integritas membran dan bocornya komponen sel yang berujung pada disolusi sel, menghasilkan proses degradasi sel yang mati oleh enzim. Komponen sel yang bocor akan memicu reaksi lokal yaitu inflamasi yang berusaha mengeliminasi sel yang mati dan memulai program regenerasi sel. Nekrosis adalah tipe cedera yang bersifat ireversibel, ditandai dengan vakuolasi, pembengkakan sel, degradasi inti dan pelepasan secara masif isi dari sel yang berada dalam area toksisitas yang luas (Jaeschke, 2013).Perubahan inti merupakan hasil akhir dari kerusakan sel, yaitu pemecahan DNA dan kromatin yang ditandai inti sel menjadi samar (karyolisis), mengecil dan berwarna kehitaman (piknotik), kemudian pecah (karyoreksis) (Kumar, et al., 2013).
Berdasarkan hasil pemeriksaan histologi di atas, terlihat bahwa pada kelompok normal, susunan jaringan hati pada tikus masih dalam keadaan baik walaupun adanya bagian yang menunjukkan degenerasi sel. Pada semua kelompok perlakuan EEDBB 250, 500, dan 750 mg/kg bb terlihat adanya beberapa sel yang mengalami nekrosis, maupun steatosis, tetapi hepatosit normal tetap terlihat. Konsistensi degenerasi sel yang menyebar pada vakuola dan parenkim hati dengan ciri berupa steatosis. Steatosis mikrovesikular (fatty change) merupakan gangguan metabolisme lemak akibat hepatosit yang rusak, dengan ciri pernumpukan lemak dengan ukuran yang kecil, bulat, dan jernih di sitoplasma (Featherstone, 2008).
dan 750 mg/kg bb. Hal ini ditunjukkan dengan adanya beberapa sel yang mengalami nekrosis, steatosis, infiltrasi sel dan pendarahan yang dapat dilihat pada sinusoidnya. Telah dibuktikan secara histopatologi bahwa EEDBB mampu meregenerasi sel hati dengan menormalisasi fatty change dan nekrosis (Patel, 2011).
Stres oksidatif berhubungan dengan pembentukan ROS yaitu suatu oksigen yang bersifat reaktif yang juga terlibat dalam patofisiologi beberapa kerusakan jaringan. Toksisitas yang terjadi pada beberapa organ tubuh seperti hati, jantung, ginjal, otak dan lainnya berkaitan dengan aktivasi metabolisme dari komponen asing yang akan menjadi radikal bebas sehingga terjadi pembentukan ROS seperti anion superoksida, radikal hidroksi, radikal hidrogen peroksida. Reactive Oxygen Species (ROS) ini akan mengawali stres oksidatif menuju makromolekul seperti lipid, protein dan DNA yang terlibat pada pathogenesis seperti kanker, rheumatoid arthritis, infraksi miokard. Beberapa benda asing yang akan membentuk toksin berasal dari obat-obatan yang telah dinyatakan berkaitan dengan mekanisme pembentukan radikal bebas. Salah satu di antaranya adalah doksorubisin. SOD adalah satu enzimatik antioksidan yang banyak terdapat pada intraseluler yaitu pada sel-sel aerobik dan mempunyai efek antitoksik terhadap ROS (Kumar dan Gowda, 2011).
mitokondria NADH dehidrogenase dan xanthine oxidaseyang terdapat di dalam organ hati. Reaksi yang terjadi melalui proses ini menghasilkan radikal bebas semiquinone. Bila terdapat oksigen, semiquinone akan memberikan elektron yang tidak berpasangan ke molekul oksigen sehingga terbentuklah anion superoxide (O2-). Dengan terbentuk radikal bebas doksorubisin akan kembali menjadi bentuk awal. Anion superoksida ini diinaktivasi salah satunya melalui proses enzimatik oleh superoxide dismutase yang akan membentuk molekul Oksigen (O2)dan Hidrogen Peroksida (H2O2) (Siahaan, dkk., 2007).
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan hasil pengamatan pada penelitian ini adalah:
a. ekstrak etanol daun bangun-bangun mampu meningkatkan aktivitas enzim SOD, dimana aktivitas SOD pada kelompok yang diberi EEDBB menunjukkan perbedaan yang signifikan dengan kelompok yang diberi doksorubisin (stres oksidatif).
b. ekstrak etanol daun bangun-bangun mampu mencegah kerusakan hati yang diinduksi doksorubisin.
c. dari hasil penelitian menunjukkan dosis EEDBB750 mg/kg bb memiliki efek paling baik sebagai antioksidan.
5.2 Saran
Berdasarkan pembahasan dan kesimpulan pada penelitian ini adalah:
a. disarankan untuk melakukan isolasi dan identifikasi terhadap jenis senyawa flavonoid yang terkandung dalam EEDBB.