BAB II
TINJAUAN PUSTAKA
Trichosanthes
Trichosanthes merupakan genus terbesar dalam famili Cucurbitaceae yang terdiri dari sekitar 100 spesies yang tersebar di daerah tropik dan sub tropik Asia Timur, Malesia, Australia Tropik dan Fiji (Jeffrey, 1990 dalam Rugayah 1999). Trichosanthes untuk pertama kalinya diterangkan oleh Linnaeus dalam Genera Plantarum tahun 1737 dengan menyampaikan 4 spesies yaitu T. anguina, T. nervifolia, T. cucumerina, T. amara. Untuk pulau Jawa, Blume dalam Rugayah (1999) mengemukakan 13 spesies dari genus Trichosanthes yang terbagi ke dalam 3 genera. Rugayah (1999) mengidentifikasi morfologi dan anatomi 39 spesies Trichosanthes di Malesia antara lain T. borneesis (Kalimantan), T. cucumerina var. anguina (Labuan, Jakarta, Bogor, Madiun, Madura), T. globosa (Gunung Bunder), T. montana (Situ Gunung), T. ovigera (Situ Gunung, Gunung Bunder, Gunung Halimun), T. pubera (Cianten), T. quinquangulata (Gunung Halimun, Bengkulu, Irian Jaya), T. tricuspidata (Gunung Bunder, Cibodas, Sukabumi, Banten, Gunung Salak, Siberut Sumatera), T. villosa (Cianten, Batu Malang), dan T. wawrae (Gunung Halimun).
Ciri utama dari spesies-spesies Trichosanthes, sebagaimana tanaman Cucurbitaceae lainnya, yaitu tumbuh merambat atau memanjat. Bentuk buah bervariasi, ada yang bulat atau bulat lonjong (oblong). T. cucumerina var anguina buahnya berbentuk silinder bulat dengan warna hijau berbelang-belang putih, sehingga di beberapa daerah di pulau Jawa dinamakan dengan paria ular atau paria belut. T. tricuspidata memiliki daun menjari seperti paria (Momordica charantia) buah berbentuk oval dan berwarna merah menyala ketika matang. T. quinquangulata memiliki daun yang lebih lebar bersegi lima, bentuk buah bulat dengan warna merah seperti T. tricuspidata.
Spesies yang sudah dibudidayakan adalah T. cucumerina var. anguina. Buah
T. cucumerina var. anguina mengandung air 94 g, protein 0.6 g, lemak 0.3 g, karbohidrat 4 g, serat 0.8 g, Ca 26 mg, Fe 0.3 mg, P 20 mg, vitamin A 235 IU,
vitamin B1 0.02 mg, B2 0.03 mg, niacin 0.3 mg dan vitamin C 12 mg). T. cucumerina var. anguina juga menghasilkan glukosida elaterin, minyak biji
dan pucinic acid (Gildemacher et al. dalam Siemonsma dan Piluek, 1994).
Cendawan
Cendawan merupakan protista eukariotik, heterotrofik yang dapat hidup sebagai saprofit maupun parasit (Hadioetomo et al. 1986). Selitrennikof (2001) menyatakan bahwa cendawan merupakan kelompok yang sangat besar karena terdapat lebih dari 250.000 spesies cendawan di dunia. Cendawan saprofit hidup dari bahan-bahan organik yang sudah mati sebaliknya parasit hidup pada makhluk hidup dan mengambil nutrisi dari inangnya. Cendawan yang bersifat parasit disebut juga sebagai patogen yang dapat menimbulkan gejala penyakit pada hewan, tumbuhan ataupun manusia yang menjadi inangnya.
Cendawan dikelompokkan ke dalam 4 kelas yaitu Phycomycetes, Ascomycetes, Basidiomycetes dan Deuteromycetes (fungi imperfecti). Pengelompokan tersebut terutama didasarkan pada tipe miselium, bentuk spora aseksual, spora seksual dan habitat alamiahnya. Phycomycetes sering disebut sebagai cendawan tingkat rendah yang tidak memiliki sekat (aseptat) pada hifanya, sementara 3 kelas lainnya memiliki hifa yang bersekat (septat). Phycomycetes menghasilkan spora aseksual berupa sporangiospora atau kadang-kadang konidia, sementara 3 kelas lainnya menghasilkan konidia. Spora seksual pada Phycomycetes berupa zigospora atau oospora. Pada Ascomycetes spora seksualnya berupa ascospora dan pada Basidiomycetes berupa basidiospora, sementara pada Deuteromycetes belum diketahui bentuk spora seksualnya.
Spora merupakan propagul untuk pembiakan dan penyebaran cendawan. Spora bervariasi dalam bentuk, warna dan ukurannya, ada yang berupa satu sel (uniseluler) atau terdiri dari beberapa sel (multiseluler). Spora pada cendawan tertentu kadang-kadang memiliki tekstur permukaan yang tidak rata (ada ornamen
khusus) seperti uredospora dari cendawan karat (Melampsora epita) dari pohon Wilow. Sebagian besar spora memiliki dinding sel yang kaku, lebih tebal dibanding dinding sel pada hifa, karena terdiri dari beberapa lapis sel. Dinding sel tersebut ada yang mengandung pigmen seperti melanin dan juga mengandung lemak. Kadar air pada spora relatif rendah dan spora juga menyimpan nutrisi cadangan berupa lemak, glikogen dan trehalosa (http://www. fungionline. org.uk/2spores/1spore_char.html).
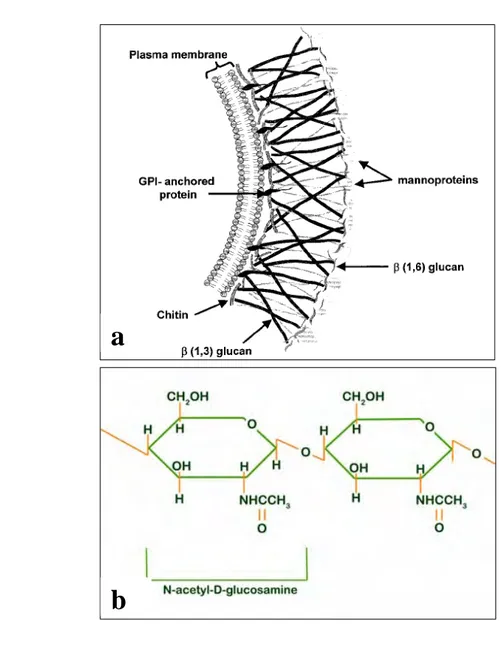
Gambar 2. a. Skema dinding sel cendawan (Selitrennikof, 2001)
b. Struktur kimia kitin http://www.ocean.udel.edu/horseshoecrab/
a
Spora yang viabel biasanya akan segera berkecambah jika berada pada kondisi lingkungan yang sesuai untuk perkecambahannya. Proses perkecambahan diawali oleh proses hidrasi, pembengkakan sel setelah proses hidrasi, peningkatan metabolisme, lalu pertumbuhan satu atau lebih tabung kecambah. Perkecambahan spora memerlukan air atau kelembaban yang relatif tinggi serta nutrisi. Untuk berkecambah, spora membutuhkan suplai nutrisi dari lingkungannya atau dengan menggunakan cadangan nutrisi yang ada di dalam sel spora tersebut.
Dinding sel cendawan disusun oleh senyawa β-glukan, kitin, lipid dan peptida (Selitrennikof 2001). β-glukan merupakan polimer dari sub unit glucan yang membentuk ikatan β-1,3/1,6-glucan, sedangkan kitin terbentuk dari ikatan 1,4-glicosidic dari sub unit 2-acetamido-2-deoxy-β-D-glucan (N-acetylgluco-saminide (GlcNac)) (Gooday, 1994, Ubhayasekera, 2005). Senyawa kitin ditemukan oleh Henry Braconnot tahun 1811 dan dinamakan sebagai “kitin” oleh A. Odier tahun 1823. Chitosan (hasil deasetilasi senyawa kitin) ditemukan oleh C. Rouget tahun 1859.
Protein Anticendawan
Selitrennikof (2001) menyatakan ada beberapa kelompok senyawa anticendawan antara lain PR-Protein, defensin, cyclophilin like-protein, glycine/histidin rich protein, RIPs, LTPs, killer proteins/killer toxin dan protease inhibitor. PR-protein merupakan protein yang terinduksi sintesisnya ketika terjadi proses patogenesis atau serangan patogen pada tanaman (Ubhayasekera, 2005). Sejumlah PR-protein juga dapat terinduksi sintesisnya oleh berbagai faktor antara lain stress kekeringan, salinitas, pelukaan, logam berat, oleh perlakuan elisitor endogen maupun eksogen; dan oleh perlakuan zat pengatur tumbuh tanaman (Karprezewska, 2003).
PR-protein dikelompokkan ke dalam 5 kelas protein yaitu PR-1, PR-2, PR-3, PR-4 dan PR-5. PR-1 protein terakumulasi pada tingkat yang tinggi setelah terjadinya infeksi patogen pada tanaman. PR-1 protein bersifat anticendawan yang diekspresikan pada tanaman transgenik dan juga pada uji aktivitas anticendawan secara in vitro dari ekstrak PR-1 protein (Tahiri-Alaoui et al. 1993;
Niderman et al. 1995). PR-1 telah ditemukan terekspresi antara lain pada padi, gandum, jagung, tembakau, Arabidopsis thaliana, dan barley (Agrawal et al. 2000; Bryngelsson et al. 1994; Molina et al. 1999; Muradov et al. 1993; Rauscher et al.1999). PR-1 protein memiliki aktivitas anticendawan pada konsentrasi rendah terhadap sejumlah Uromyces fabae, Phytophthora infestans, and Erysiphe graminis (Niderman et al. 1995).
PR-2 Protein (β-glucanase) memiliki aktivitas β-endoglucanase yang mampu menghidrolisis ikatan 1,3 β-glucan yang ada pada dinding sel cendawan, terutama pada ujung hifa cendawan sehingga menyebabkan ujung hifa menjadi lemah, lisis dan mati. PR-2 protein dikelompokkan ke dalam 3 kelas berdasarkan runutan residu asam aminonya (Agrawal et al. 2000; Cote et al. 1991; Leah et al. 1991). Glukanase Klas I merupakan protein yang bersifat basic yang ditemukan pada vakuola tanaman dengan berat molekul sekitar 33 kDa. Sedangkan glukanase kelas II dan III merupakan protein yang bersifat acidic dan ditemukan ekstraseluler dengan berat molekul sekitar 36 kDa, serta aktif pada konsentrasi sekitar 50 µg/ml. PR-2 protein menghambat cendawan Rhizoctonia solani yang menyerang tanaman dan Candida albicans serta Aspergillus fumigatus yang menginfeksi manusia. Aktivitas anticendawan PR-2 diketahui berdasarkan hasil uji in vitro dan hasil uji overekspresi overekspresi pada tanaman transgenik (Jach et al. 1995).
PR-3 proteins (chitinase) memiliki berat molekul antara 26-43 kDa (Nielsen et al. 1997). Kitinase dikelompokkan menjadi 5-6 klas (Fukamizo et al. 2003). Kitinase Klas I memiliki domain N terminal yang kaya residu sistein. Kitinase klas II memiliki sekuen yang sama dengan klas I tetapi tidak memiliki domain N-terminal yang kaya residu sistein. Kitinase klas III tidak memiliki kesamaan runutan asam amino dengan klas lainnya dan mempunyai berat molekul 28-30 kDa. Kitinase klas IV menyerupai kitinase klas I tetapi mempunyai ukuran yang lebih kecil karena delesi. Kitinase klas V menunjukkan kesamaan sekuen dengan eksokitinase bakteri dan memiliki berat molekul 41-43 kDa.
Kitinase sudah diisolasi dari bakteri, cendawan, dan tanaman (tembakau, timun, kacang-kacangan dan biji-bijian) (Selitrennikof 2001). Kitinase mempunyai aktivitas anticendawan terhadap Trichoderma reesei, Alternaria
solani, Alternaria radicina, Fusarium oxysporum, Rhizoctonia. solani, Guignardia bidwellii, Botrytis cinerea, and Coprinus comatus. Cara kerja kitinase dalam menghambat pertumbuhan cendawan adalah dengan mendegradasi polimer kitin sehingga melemahkan dinding sel cendawan. Kitinase dan glukanase dapat bekerja secara sinergis untuk menghambat pertumbuhan cendawan berdasarkan hasil uji secara in vitro dan uji overekspresi dalam tanaman transgenik ( Jach et al. 1995).
PR-4 (chitin-binding) protein merupakan protein yang mengikat kitin, memiliki berat molekul 13-14.5 kDa, dan terdiri atas 2 klas (Friedrich et al. 1991; Hejgaard et al. 1992; Ponstein et al. 1994; Van Damme et al. 1999). PR-4 protein klas 1 menyerupai hevein dan termasuk ke dalam superfamili chitin-binding lectin. Sedangkan 4 protein klas II tidak memiliki domain chitin-binding. PR-4 protein telah berhasil diisolasi dari tanaman kentang, tembakau, barley dan tomat. Mekanisme penghambatan pertumbuhan cendawan oleh PR-4 protein diduga dihasilkan dari proses ikatan PR-4 protein terhadap senyawa β-chitin melalui mekanisme yang belum sepenuhnya dapat dijelaskan, sehingga mengakibatkan terganggunya polaritas sel dan terhambatnya pertumbuhan cendawan (Bormann et al. 1999). Sementara mekanisme penghambatan pertumbuhan cendawan oleh PR-4 protein klas II belum sepenuhnya dapat dijelaskan.
PR-5 protein tidak termasuk enzim tetapi merupakan protein yang bersifat anticendawan dengan merusak membran fungi. PR-5 protein telah berhasil diisolasi dari jagung dan disebut sebagai zeamatin serta dari tembakau dan disebut sebagai osmotin. Osmotin mempunyai bobot molekul 24 kD, terakumulasi dalam vakuola selama adaptasi sel tembakau (Nicotiana tabacum var. Wisconsin 38) terhadap cekaman osmotik (Singh. et al, dalam Cheong et al, 1997). PR-5 protein juga telah berhasil dimurnikan dan dikarakterisasi dari daun labu (pumpkin). PR-5 protein dari labu tersebut mempunyai bobot molekul 28 kD dan dapat menghambat pertumbuhan hifa Fusarium oxysporum dan Neurospora crassa dalam uji in vitro. (Cheong et al. 1997).
RIPs (Ribosome Inactivating Proteins) merupakan senyawa RNA N-glikosidase yang melepaskan purin dari rRNA sehingga menahan atau
menghambat sintesis protein karena rusaknya ribosom (Barbieri et al. 1993; Ferreras et al. 1995; Langer et al. 1996; Pu et al. 1996; Taylor et al. 1990). RIPs dari tanaman dapat menghambat sintesis protein pada mamalia, bakteri, cendawan dalam kondisi in vitro dan in vivo. Tanaman penghasil RIP melindungi ribosomnya sendiri dari kerusakan oleh RIPs yang dihasilkannya dengan menempatkan RIPs dalam vakuola atau terintegrasi dalam dinding sel (Kataoka et al. 1991).
RIPs dikelompokkan menjadi 3 tipe. RIP tipe 1 merupakan N-glicosidase rantai tunggal dengan bobot molekul antara 11-30 kDa. RIP tipe 2 memiliki rantai ganda yaitu N-glycosidase (rantai A) dan rantai B (cell-binding lectin) dengan bobot molekul hingga 60 kDa (Zhang et al. dalam Selitrennikof, 2001). RIP tipe 2 ada yang toksik seperti ricin and nontoksik seperti ebulin 1 dan nigrin b. RIP tipe 3 memiliki 4 rantai yang disusun membentuk dua dimmer dari 2 tipe RIP. RIP telah diisolasi dari berbagai jenis tanaman antara lain Mirabilis expansa, Pisum sativum, Momordica charantia, Ricinus communis, Viscum album, dan Tricosanthes kirilowii (Selitrennikof, 2001).
RIP berpotensi digunakan dalam bidang pertanian sebagai antivirus, antibakteri dan anticendawan untuk proteksi tanaman (Vivanco et al. 1997). Logeman (1993) melaporkan aktivitas anticendawan in vitro dari RIP asal biji barley dan peningkatan ketahanan terhadap patogen cendawan pada tanaman tembakau transgenik yang mengekspresikan RIP biji barley (Logeman et al., 1992).
Banyak peneliti yang telah melaporkan tentang hasil pengujian aktivitas antimikroba dari protein bioaktif atau peptida antimikroba secara in vitro. Beberapa metoda yang digunakan untuk pengujian aktivitas anticendawan dari peptida antimikroba secara in vitro adalah dengan radial growth inhibiton assay (Schlumbaum et al. 1986), germinated spores antifungal bioassays, microplate antifungal bioassays, dan spore germination assays (Rajasekaran 2001). Pada radial growth inhibition assay aktivitas penghambatan pertumbuhan cendawan dilihat berdasarkan penghambatan pertumbuhan hifa cendawan. Potongan cendawan ditempatkan ditengah media PDA pada petridish dan senyawa yang akan diuji diteteskan ke potongan kertas saring pada beberapa tempat di sekitar
cendawan. Germinated spore antifungal bioassays menggunakan konidia yang sudah dikecambahkan. Daya penghambatan senyawa bioaktif dilihat berdasarkan jumlah pembentukan koloni cendawan setelah konidia yang berkecambah diinkubasi dengan senyawa bioaktif.
Microplate antifungal bioassay dilakukan dengan menggunakan miselia cendawan yang diblender. Konsentrasi fragmen miselia dihitung dengan haemacytometer. Pengujian aktivitas protein dilakukan dengan menginkubasi miselia dengan protein bioaktif dalam sumur-sumur pada plat mikro. Spore germination assay dilakukan dengan melihat pengaruh senyawa bioaktif terhadap perkecambahan konidia cendawan. Morfologi tabung perkecambahan dilihat secara mikroskopik.
Kitinase
Kitinase (E.C. 3.2.1.14) merupakan poly(1,4-(N-acetyl-β-D-glucosamini de)-glycanohydrolase. Kitinase terdistribusi luas di berbagai organisme yang memiliki kapasitas kitinolitik di alam meliputi tanaman, mikroorganisme bakteri dan cendawan, artropoda, dan beberapa hewan tingkat tinggi seperti amfibi, ikan dan mamalia (Ubhayasekera, 2005). Kitinase termasuk famili 18 dan 19 dari glycoside hydrolase (GH).
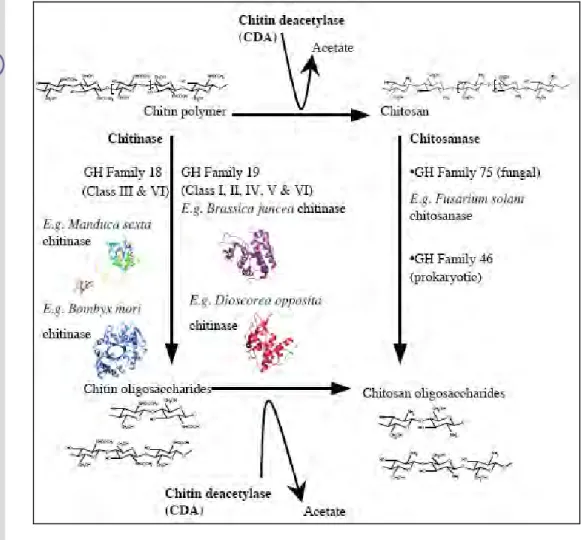
Kitinase bekerja memotong secara acak ikatan glikosida dari GlcNac untuk menghasilkan oligosakarida terlarut, terutama kitobiosa yang selanjutnya akan dihidrolisis oleh β-N-acetylglucosaminidase menjadi GlcNac (Orikoshi et al. 2005). Enzim yang terlibat dan produk yang dihasilkan dari degradasi polimer kitin dapat dilihat pada Gambar 3.
Kitinase pada tanaman tergolong sebagai endokitinase, yang merupakan protein dengan berat molekul 25 – 40 kDa, isoeletric point (3-10), dan yang mengalami modifikasi pasca translasi seperti glikosilasi dan prolil-hidroksilasi (Sticher et al. 1992; Colinge et al. 1993; Nielsen et al. 1994). pH 4-9 merupakan rentang pH optimum untuk aktivitas kitinase (Khan, 2002). Beberapa kitinase
seperti kitinase klas III dari yam memiliki pH optimum yang berbeda tergantung pada substratnya (Tsukamoto et al. 1984).
Gambar 3. Proses dan enzim yang terlibat dalam degradasi senyawa kitin (Sumber : Ubhayasekera, 2005)
Kitinase pada cendawan misalnya kitinase klas 5 yang dikode oleh gen ChiB dari Aspergilus nidulan (Yamazaki et al. 2006). ChiB yang diekspresikan di E. coli menunjukkan aktivitas hidrolisis kitin. Delesi pada ChiB tidak mempengaruhi perkecambahan dan pertumbuhan hifa tapi menurunkan aktivitas kitinase intraseluler dan ekstraseluler. Ekspresi ChiB meningkat ketika cendawan mengalami starvasi karbon (suatu kondisi yang menginduksi autolisis hifa),
sehingga ChiB diduga kuat berperan penting dalam autolisis cendawan A. nidulans.
Berdasarkan review oleh Kasprezewska (2003) yang dirangkum dari berbagai penelitian tentang kitinase, ditemukan bahwa pada tanaman sehat, beberapa bentuk kitinase yang diakumulasikan vakuola dan apoplastik disintesis secara konstitutif. Kitinase Klas I diekspresikan secara konstitutif dan terakumulasi dalam jumlah banyak pada bunga dan akar beberapa tanaman. Kitinase Klas III diekspresikan secara konstitutif pada jaringan vaskular, hidatoda dan sel penjaga Cucumis sativus dan Arabidopsis thaliana. Ekspresi konstitutif meningkat dengan bertambahnya umur tanaman dan aktivitas kitinolitik lebih tinggi pada daun tua dibandingkan daun muda. Pada Cucumis sativus, ekspresi gen penyandi kitinase Klas III meningkat secara gradual selama pertumbuhan tanaman dan akumulasi transkrip gen menurun dari bagian jaringan tanaman yang tua ke bagian tanaman yang muda. Tanaman Arabidopsis thaliana menunjukkan ekspresi gen penyandi kitinase (gen chi) yang tinggi akibat perlakuan etilen. Pola ekspresi kitinase ada yang diregulasi mengikuti perkembangan tanaman (developmentally) dan diregulasi spesifik jaringan atau organ (tissue or organ-specific regulation).
Stimulasi atau induksi ekspresi gen kitinase karena adanya serangan patogen sering ditemukan (Collinge et al. 1993; Bishop et al. 2000), dengan karakter ekspresi sistemik atau lokal (de A Gerhardt et al. 1997; Meier et al. 1993). Pada Arabidopsis thaliana, infeksi dengan patogen yang imkompatibel menyebabkan akumulasi cepat dari mRNA kitinase Klas IV (Gerhardt et al. 1997). Pada Cucumis sativus, induksi sistemik dari Kitinase Klas III berkorelasi dengan Systemic Acquired Resistance (SAR). Induksi yang sama terjadi ketika tanaman diperlakukan dengan salicylic acid (Lawton et al. 1994).
Induksi kitinase pada kondisi in vitro menunjukkan hasil yang sangat kompleks. Pada kultur in vitro Nicotiana sp., adanya auksin dan sitokinin menekan ekspresi gen kitinase Klas I. Pada kalus dan suspensi sel Cucurbita sp., gen kitinase diekspresikan dalam media dengan atau tanpa penambahan 2,4D (Arie et al. 2000). Perlakuan etilen eksogenus meningkatkan aktivitas kitinase pada kultur kalus Dioscorea japonica (Buttner et al. 1997). Faktor lain yang juga
dapat meningkatkan aktivitas kitinase adalah cekaman kekeringan, suhu rendah dan salinitas yang tinggi (Fumikazo et al. 2003).
Peroksidase
Peroksidase (PRX) merupakan enzim yang berfungsi mereduksi senyawa peroksida (H2O2) sehingga dihasilkan air dan produk yang teroksidasi. Peroksida (H2O2) merupakan produk akhir yang umumnya terbentuk dari
metabolisme oksidatif pada tanaman dan merupakan oksidan yang kuat serta bersifat toksik terhadap sel tanaman jika terakumulasi dalam jumlah besar. Untuk mencegah hal tersebut, sel-sel eukariotik mengisolir enzim penghasil senyawa peroksida dalam organel bermembran yang disebut peroksisom. Dalam peroksisom tersebut juga terdapat enzim peroksidase yang berfungsi untuk mereduksi H2O2 menjadi air, sehingga menjadi tidak berbahaya. Dalam proses
reduksi tersebut digunakan donor elektron dari amina aromatik, fenol, enediol (seperti ascorbic acid). Zat pewarna (dye) seperti o-dianisidine dapat digunakan sebagai donor elektron, karena sesudah reaksi zat tersebut akan menjadi berwarna (http://employes. oneonta.edu/helsert1/enzyme.html).
H
2O
2+ Colorless
Dye
(reduced)peroxidase> H
2O
+ Colored
Dye
(oxidized)Beberapa isoform baru peroksidase dapat diinduksi produksinya ketika terjadi interaksi inang dan patogen (Svalheim dan Robertson, 1990; Kerby dan Somerville 1989 dalam Harrison et al. 1995). Peroksidase (EC 1.11.1.7 donor:hydrogen peroxide oxidoreductase) berperan dalam lignifikasi dinding sel (Walter 1992, Lopez-Serrano et al. 2004), cross lingking komponen dinding sel (Bradley 1992), penyembuhan luka (Sherf et al. 1993) dan oksidasi auksin (Grambow dan Langenbeck-Schwich 1983). Induksi ekspresi isoform peroksidase oleh patogen juga berasosiasi dengan respon Systemic Acquired Resistance (Ye et al. 1990; Irving dan Kuc, 1990).
Peroksidase termasuk dalam famili PR-9 dan telah berhasil dikarakterisasi dari sejumlah tanaman tingkat tinggi antara lain tembakau (Lagrimini et al. 1987), kentang (Espelie et al. 1986), barley (Kristensen et al. 1999), ovul kapas (Mellon, 1991), xylem poplar (Christensen et al. 1998), selada (Bestwick, et al. 1998), dan biji radish (Kim dan Lee, 2005). Keterlibatan peroksidase dalam tahapan polimerisasi lignin diduga secara langsung berkaitan dengan meningkatnya ketahanan fisik tanaman terhadap infeksi patogen maupun kerusakan fisik (Chitoor et al. 1999).
Asam Salisilat
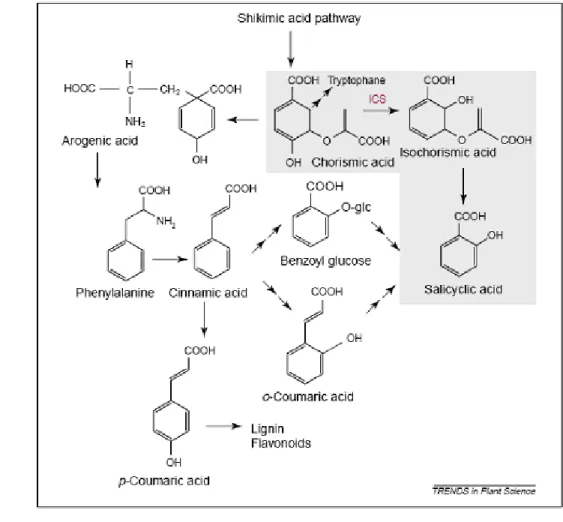
Asam salisilat (SA) merupakan senyawa yang umum terdapat dalam jaringan tanaman dan dikenal sebagai regulator berbagai proses fisiologis yang berkaitan dengan termogenesis atau dalam respon tanaman terhadap patogen. Asam salisilat disintesis dari lintasan shikimat-phenilpropanoid (Sticher et al. 1997). Asam salisilat disintesis dari fenilalanin melalui dua jalur setelah diubah terlebih dahulu menjadi asam sinamat. Asam sinamat kemudian bisa diubah menjadi benzyl glucosa atau o-coumaric acid sebelum diubah menjadi asam salisilat. Lintasan biosintesis asam salisilat seperti terlihat pada Gambar 4.
Kaitan asam salisilat dengan reaksi ketahanan tanaman terhadap patogen sudah banyak dilaporkan. Pada Arabidopsis thaliana, asam salisilat dihasilkan secara lokal maupun sistemik setelah infeksi patogen dan mendorong terbentuknya Salicylic acid-dependent (SAR) (Summermatter et al. 1995). Tanaman mutan yang tidak dapat mengakumulasi asam salisilat setelah infeksi patogen terlihat lebih rentan terhadap cendawan maupun bakteri dan tidak dapat menginduksi biosintesis Pathogenesis-Related Protein-1 (PR1), sebagai marker untuk SAR yang terinduksi oleh asam salisilat (Nawrath dan Metraux, 1999; Dewdney et al. 2000; Dong, 2001).
Perlakuan SA eksogen pada berbagai spesies tanaman dapat menginduksi PR protein pada lokasi perlakuan dan juga pada bagian tanaman lainnya menunjukkan bahwa SA berperan sebagai signal untuk SAR, suatu bentuk
ketahanan tanaman yang terinduksi untuk meningkatkan ketahanan tanaman terhadap infeksi dan serangan patogen berikutnya (Ward, et al. 1991; Delaney et al. 1994; Kessman et al. 1994; Pieterse et al. 1998; Redman et al. 1999; Audenaert et al. 2002; Ferrari et al. 2003).
Induksi biosintesis protein yang berhubungan dengan ketahanan pada tomat yang dikode oleh Intracelllular Pathogenesis-Related Gene yang dinamakan TSI-1 (Tomato Stress Induced-1) dapat terjadi dengan perlakuan asam salisilat secara eksogen. Ekspresi maksimal dari TSI-1 diperoleh pada perlakuan SA 10 mM pada 48 jam setelah perlakuan (Vidya et al. 1999).
Etilen
Etilen (ETL) merupakan hormon tanaman yang memiliki rumus kimia yang paling sederhana dalam bentuk gas alkana (CH2=CH2). Menurut Johnson
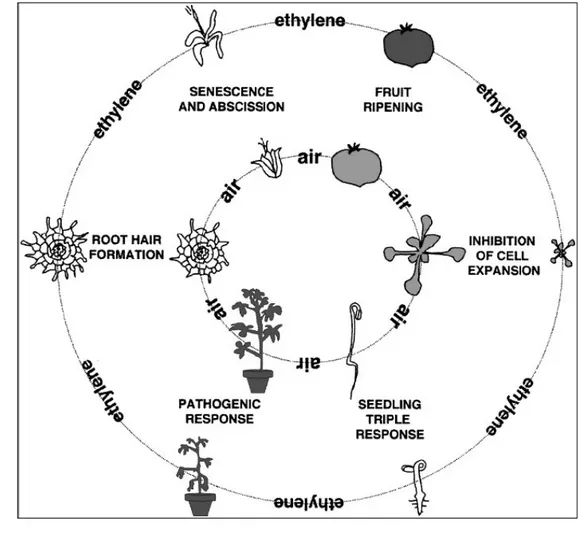
dan Ecker (1998), etilen mempunyai peranan yang besar dalam perubahan morfologi tanaman sepanjang pertumbuhan dan perkembangan tanaman seperti terlihat pada Gambar 5.
Pada fase perkecambahan etilen menyebabkan triple responses berupa penghambatan pemanjangan sel, pembengkokan batang (epikotil) dan menekan pertumbuhan apikal (Goeschl et al. dalam Johnson dan Ecker 1998). Ketika tanaman dewasa, etilen mempengaruhi determinasi seks dan mendorong pematangan buah (Abeles et al. 1992). Etilen juga melindungi tanaman dari tekanan lingkungan seperti memperkuat batang terhadap terpaan angin, membantu tanaman yang tergenang air untuk bertahan hidup dan mendorong ketahanan tanaman terhadap patogen (Dolan, 1997). Peranan penting etilen lainnya adalah dalam senesen bunga dan daun tanaman (Bleecker dan Patterson 1997).
Biosintesis etilen dalam tanaman pertama kali ditemukan pada akhir tahun 1970-an oleh Shang Fa Yang dan koleganya dari University of California, sehingga siklus dalam biosintesis etilen dikenal sebagai siklus Yang (Srivastava, 2002). Secara ringkas lintasan biosintesis diawali dari perubahan metionin menjadi S-adenosil-L-metionin (Adomet atau SAM). SAM kemudian dapat melalui dua jalur yaitu diubah menjadi 1-Aminocyclopropan-1-carboxylic acid (ACC) dan diubah selanjutnya menjadi etilen (C2H4) atau diubah menjadi
Metiltioadenosin (MTA) yang selanjutnya diubah menjadi metiltioribosa dan berikutnya kembali menjadi metionin.
Disamping lintasan biosintesis yang umum seperti tersebut di atas, etilen pada tanaman tingkat tinggi dapat dihasilkan dari oksidasi berbagai jenis molekul organik khususnya asam lemak rantai panjang yang tidak terproteksi. Beberapa enzim seperti lipoxigenase dan peroksidase dapat secara nonspesifik mengkatalisis oksidasi dan menghasilkan sejumlah etilen.
Gambar 5.Pengaruh etilen terhadap pertumbuhan dan perkembangan tanaman : (searah jarum jam dari atas ) mendorong pematangan buah, penghambatan dalam ekspansi sel, menyebabkan triple response (pembelokan ujung apikal, pembengkokan radial dari hipokotil dan pemendekan akar pada perkecambahan benih, mendorong ketahanan terhadap layu dan nekrosis setelah mengalami infeksi patogen, mendorong pembentukan rambut akar, mempercepat senesen bunga dan mendorong absisi petal (Sumber : Johnson dan Ecker 1998)
Etilen disintesis tanaman dalam level yang rendah sepanjang perkembangan tanaman, namun produksinya dapat meningkat secara tajam pada fase perkembangan tertentu seperti pada saat perkecambahan benih, pematangan buah klimakterik, dan senesen dari tipe bunga tertentu seperti anyelir. Berbagai
jenis cekaman seperti suhu dingin, panas, kekeringan, genangan, radiasi, pelukaan, perlakuan dengan logam berat seperti perak, litium atau ketika terjadi serangan patogen juga dapat menginduksi peningkatan etilen sehingga menciptakan kondisi ”cekaman etilen”. Perlakuan hormon auksin dan sitokinin juga dapat mendorong produksi etilen. Etilen dapat menginduksi sintesisnya sendiri atau disebut sebagai ”autoinduction” tapi juga dapat menghambat sintesisnya sendiri dan disebut sebagai ”autoinhibition”.
Etilen dapat dihasilkan dari senyawa sintetis antara lain berupa etefon (2-cloroetil posponic acid) dan ethrel. Etefon disimpan dalam pH rendah, namun dapat terdekomposisi dan melepaskan etilen pada pH fisiologis. Prekurser etilen berupa ACC dapat juga diberikan kepada tanaman dalam media cair dan akan diambil tanaman dan dilepaskan dalam bentuk etilen tanpa gangguan dari pH saat perlakuannya.
Seperti sudah disebutkan sebelumnya etilen dapat meningkat sintesisnya ketika tanaman diserang patogen. Namun peran etilen dalam respon patogenik menunjukkan hasil yang bervariasi. Beberapa protein yang berhubungan dengan ketahanan (PR-protein) membutuhkan signal salicylic acid (SA) untuk ekspresinya untuk menghasilkan respon Systemic Acquired Resistance (SAR) penuh dan tidak membutuhkan signal etilen (Lawton et al. 1994), namun beberapa PR-protein lainnya membutuhkan signal etilen untuk ekspresinya dalam menghasilkan SAR (Johnson dan Ecker 1998).
Cabello et al. (1994) melaporkan bahwa perlakuan etefon meningkatkan aktivitas β-1,3-glucanase dan kitinase pada batang tanaman chickpea (Cicer arietinum L.). Hughes dan Dickerson (1991) menemukan bahwa perlakuan IAA dan etilen dapat menyebabkan peningkatan aktivitas kitinase dan glukanase pada kultivar tanaman Phaseolus vulgaris yang tahan maupun yang rentan terhadap Colletotrichum lindemutianum.