MAKALAH
TEKNIK REAKSI KIMIA 1
KATALIS DAN KINETIKA REAKSI KATALITIK
LOW TEMPERATUR SHIFT CONVERSION (LTSC) DENGAN
KATALIS Cu PADA INDUSTRI PUPUK KALTIM (AMMONIA)
DISUSUN OLEH :
NAMA/NIM : 1. Atika (15 644 002) 2. Jekolesi M (15 644 005) 3. Erwin Tallu S (15 644 009) 4. Dodi Ilham S (15 644 011) JENJANG : S1-TERAPAN KELAS : IV-A KELOMPOK : 1 (SATU)JURUSAN TEKNIK KIMIA
PROGRAM STUDI TEKNOLOGI KIMIA INDUSTRI
POLITEKNIK NEGERI SAMARINDA
Daftar Isi
Kata Pengantar
... 1
BAB I ... 2
1.1 Latar Belakang ... 3
1.2 Rumusan Masalah ... 3
1.3 Tujuan Penulisan Makalah ... 3
1.4 Manfaat ... 3
BAB II ... 4
2.1 Definisi Katalis ... 4
2.2 Sejarah Katalis ... 4
2.3 Perkembangan Penggunaan Katalis Pada Industri Kimia Ammonia ... 6
2.4 Peran Katalis dalam Reaksi Kimia ... 6
2.5 Racun dan Deaktivasi Katalis ... 6
2.6 Kuantifikasi Performa Katalis ... 7
2.7 Persamaan Simulasi ... 9
2.7.1 Model Reaktor ... 9
2.7.2 Persamaan Gas Ideal ... 9
2.7.3 Kecepatan Fluida ... 10
2.7.4 Kinetika Reaksi ... 10
2.7.5 Kenaikan Temperatur Reaksi ... 11
2.7.6 Uji performa LTSC dan Katalis ... 11
2.7.6.1 Simulasi Kondisi Reaktor ... 11
2.7.6.2 Perhitungan dengan Volume Aktif Katalis ... 12
2.7.6.3 Analisis Termokopel pada Reaktor ... 13
2.7.6.4 Simulasi dengan Reaktor Low Temperature Shift Conversion ... 14
2.7.6.5 Perbandingan simulasi Kondisi operasi Aktual dengan kondisi operasi EOR dan SOR ... 16
2.7.6.6 Efek Kondisi Operasi Terhadap reaktor LTSC ... 19
2.7.6.7 Perhitungan Volume Aktif Reaktor ... 20
2.7.6.8 Pertimbangan reaktor berdasarkan profil temperatur reaktor ... 21
2.8 Katalis dalam Industri Kimia ... 22
2.9 Reaksi Katalis di Industri: Pembuatan Amonia menurut proses Haber-Bosch ... 23
2.10 Jenis Katalis dan Pengelompokan Katalis ... 24
2.10.1 Penggolongan katalis berdasarkan fasenya di dalam sistem reaksi: ... 24
2.11 Karakteristik Katalis ... 26
2.12 Katalis Heterogen ... 27
2.13 Cara kerja Katalis Heterogen ... 28
2.14 Contoh Katalis Heterogen ... 31
BAB III ... 32
3.1 Kesimpulan ... 32
1
KATA PENGANTAR
Assalamualaikum wr. wb
Puji syukur kami panjatkan kehadirat Allah Subhanahu wa ta’ala karena telah memberikan kesempatan untuk dapat menyelesaikan tugas makalah bidang studi Teknik Reaksi Kimia 1.
Kami Kelompok 1 mengucapkan terima kasih kepada dosen bidang studi teknik reaksi kimia 1 yaitu Ibu Irmawati Syahrir yang telah memberikan kami ilmu dan membimbing kami.
Kami menyadari makalah yang kami buat ini masih banyak sekali kekurangannya. Oleh karena itu kami mengharapkan kritik dan saran dari pembaca. Akhir kata kami mengharapkan semoga makalah Teknik Reaksi Kimia 1 Katalis Low Temperatur Shift Conversion (LTSC) pada Industri Pupuk Kaltim (ammonia) dapat bermanfaat bagi para pembaca.
Wassalamualaikum wr. wb
Samarinda, 08 Mei 2017
2
BAB I
PENDAHULUAN
1.1 Latar Belakang
Ilmu katalis sangat dipengaruhi oleh teknologi. Katalisis tersebut memainkan peranan dominan dalam industri kimia. Banyak proses manufaktur melibatkan kimia katalitik. Perkembangan kimia katalitik akan terus ditingkatkan dalam berbagai penelitian, terutama yang dikaitkan dengan kimia anorganik dan organologam.
Katalis meningkatkan laju reaksi kimia tanpa mempengaruhi keseimbangan. Katalis biasanya membentuk ikatan dengan reaktan dan membuka urutan langkah-langkah reaksi baru. Katalisis diklasifikasikan menurut fasa dari campuran reaktan-katalis. Dikatakan katalis homogen bilamana katalis dan reaktan berada dalam fasa yang sama, dan dikatakan katalis heterogen bilamana katalis dan reaktan berada dalam fasa terpisah (berbeda). Katalis heterogen biasanya melibatkan katalis padat, dan reaktan terikat ke permukaan katalis melalui proses chemisorption.
Kinerja katalis berkaitan dengan kinetika kimia. Aktivitas adalah ukuran dari seberapa cepat reaksi katalitik terjadi (mungkin aktivitas laju reaksi, dengan laju konstan, atau konversi); selektivitas adalah ukuran distribusi produk, seperti rasio tingkat laju kehilangan kegiatan atau selektivitas selama operasi sebagai katalis mengalami perubahan struktur dan komposisi. Permukaan katalisis sangat dipengaruhi oleh perkembangan teknologi.
Pada makalah ini diambil contoh industri ammonia pada Pupuk Kaltim dengan mengambil beberapa tahap yaitu pada Low Temperature Shift Converter. Ammonia adalah bahan baku kimia dasar dengan komoditi terbesar kedua di dunia ini. Kegunaan terbesar ammonia digunakan dalam bidang fertilizer yaitu sebagai pembuatan pupuk. Selain itu, ammonia banyak dimanfaatkan untuk bahan dasar peledak, sintetis metanol, polimer, dan sebagainya. Pembuatan dilakukan dengan menerapkan banyak tahap reaksi. Salah satu tahapan pentingnya adalah pemurnian bahan baku gas alam. Salah satu tahap penting dalam proses ini adalah sintetis karbondioksida dari karbonmonoksida untuk memperkaya kandungan gas hidrogen agar sesuai rasio minimal gas hidrogen dan nitrogen. Proses ini disebut Water Shift Conversion Reaction. Karbon monoksida dan karbondioksida harus dipisahkan karena dapat meracuni katalis pada proses ammonia converter. Konversi kabron monoksida menjadi karbon dioksida sangat vital karena CO tidak dapat dipisahkan pada unit-unit setelahnya.
Proses Shift Conversion dilakukan pada dua buah reactor berkatalis yang beroperasi pada temperatur berbeda. Reaktor High Temperature Shift Converter (HTSC) beroperasi pada suhu 360-400 oC, sedangkan pada reaktor kedua yaitu Low Temperature Shift
Converter (LTSC) beroperasi pada temperatur 200-250oC. Unjuk kerja reaktor LTSC harus dievaluasi secara terus menerus agar tidak menyebabkan kerusakan pada unit LTSC atau yang lainnya dan menghasilkan produk yang optimal.
Performa unit LTS bergantung pada aktifitas katalis Cu. Jika keaktifan katalis masih tinggi, konversi CO menjadi CO2 menjadi besar. Dalam Keadaan normal operasi temperatur harus dijaga karena temperatur yang terlalu tinggi menyebabkan nilai kesetimbangan menurun yang artinya konversi gas CO akan menurun pula. Selain itu, suhu
3
tinggi dapat menyebabkan katalis mengalami sintering karena logam tembaga yang digunakan sebagai katalis aktif mempunyai titik leleh yang lebih rendah dibandingkan jenis katalis lainnya. Sedangkan jika temperatur rendah maka kinetika reaksi akan berjalan lambat karena katalis belum teraktifasi. Proses deaktifasi katalis dipengaruhi banyak hal, selain mengalami sintering, katalis juga mudah teracuni dengan unsur sulfur dan klorida. Katalis pada LTSC pabrik Kaltim-3 cenderung handal dan performanya stabil. Masa penggantian bed pada reaktor LTSC dilakukan sejak Agustus 2006 dan telah diganti hanya
guard bed pada 26 Mei 2010. Hal ini perlu sangat diperhatikan mengingat katalis komersial
biasanya hanya bertahan 4 tahun sebab pada bed 2 yang kaya akan Cu akan mudah teracuni. Sehingga reaktor ini harus terus dievaluasi terus-menerus agar terdapat tindakan preventif sebelum pabrik mengalami shut down total.
1.2 Rumusan Masalah
Adapun rumusan masalah dari latar belakang diatas adalah :
1. Dari pemaparan latar belakang diatas maka diperlukan kajian khusus mengenai evaluasi performa katalis dengan data Start of Run, End of Run, dan aktual dengan menghitung konversi CO atau CO leak keluaran serta profil temperatur. Selain itu, juga dapat dihitung Volume aktif katalis antara kondisi SOR, EOR, dan aktual serta melakukan perbandingan profil temperatur dari termokopel yang telah dipasang. 2. Perkembangan penggunaan katalis di industri ammonia Pupuk Kaltim
3. Peran katalis dalam reaksi kimia 4. Pengelompokkan katalis
5. Katalis padat (Heterogen)
1.3 Tujuan Penulisan Makalah
Tujuan dari penulisan makalah ini adalah :
Dapat mengetahui fungsi dari katalis yang digunakan pada industri ammonia Dapat mengetahui peran katalis dan pengelompokan katalis kimia
Dapat membedakan katalis padat (heterogen)
Dapat mengetahui perkembangan penggunaan katalis diindustri Dapat mengetahui kinetika reaksinya
1.4 Manfaat
Dari penulisan makalah ini semoga dapat memberikan suatu manfaat yang baik bagi pembaca, dan dari makalah ini harapannya pembaca dapat mendapat ilmu. Karena ilmu dapat datang dari siapa saja dan ilmu datang dari segala arah.
4
BAB II
PEMBAHASAN
2.1 Definisi Katalis
Katalis adalah senyawa yang ketika ditambahkan ke reaksi kimia, mengurangi energi aktivasi dan meningkatkan laju reaksi. Jumlah katalis tidak berubah selama reaksi, karena tidak dikonsumsi sebagai bagian dari proses reaksi. Katalis menurunkan energi yang dibutuhkan untuk mencapai keadaan transisi pada reaksi, memungkinkan interaksi yang lebih pada molekul untuk mencapai keadaan tersebut. Namun, katalis tidak mempengaruhi proses reaksi yang berlangsung. Dengan kata lain, meskipun katalis mempengaruhi kinetika reaksi, keadaan ekuilibrium tetap, tidak terpengaruh. Katalisator adalah Sebuah zat yang meningkatkan laju reaksi kimia tanpa dikonsumsi dalam proses reaksi.
Katalis adalah suatu zat yang mempercepat laju reaksi reaksi kimia pada suhu tertentu, tanpa mengalami perubahan atau terpakai oleh reaksi itu sendiri. Suatu katalis berperan dalam reaksi tapi bukan sebagai pereaksi ataupun produk. Katalis memungkinkan reaksi berlangsung lebih cepat atau memungkinkan reaksi pada suhu lebih rendah akibat perubahan yang dipicunya terhadap pereaksi. Katalis menyediakan suatu jalur pilihan dengan energi aktivasi yang lebih rendah. Katalis mengurangi energi yang dibutuhkan untuk berlangsungnya reaksi.
2.2 Sejarah Katalis
Istilah katalisator berawal dari penelitian Berzelius (1836) tentang proses proses pemercepatan laju reaksi dan menjabarkannya sebagai akibat adanya gaya katalisis. Sebutan “gaya” katalisis ternyata tidak terbukti, tetapi istilah katalisator tetap digunakan untuk menyebuitkan pengaruh substansi tertentu yang ikut dalam proses tanpa mengalami perubahan. Senyawa yang menurunkan laju reaksi biasa disebut sebagai katalisator negatif atau inhibitor, yang saat ini lebih dikenal dengan istilah katalis.
Definisi katalis pertama kali dikemukakan oleh Ostwalsd sebagai suatu substansi yang mengubah laju suatu reaksi kimia tanpa merubah besarnya energi yang menyertai reaksi tersebut. Pada tahun 1902 Ostwald mendefinisikkan katalis sebagai substansi yang mengubah laju reaksi tanpa terdapat sebagai produk pada akhir reaksi, dengan kata lain katalisator mempengaruhi laju reaksi dan berperan sebagai reaktan sekaligus produk reaksi. Selanjutnya pada tahun 1941, Bell menjelaskan substansi yang dapat disebut sebagai katalis suatu reaksi adalah ketika sejumlah tertentu substansi ditambahkan maka akan mengakibatkan laju reaksi bertambah dari laju pada keadaan stoikiometri biasa. Jika substansi tersebut ditambahkan pada reaksi maka tidak mengganggu kesetimbangan. Beberapa katalis ternama yang pernah dikembangkan di antaranya:
• Katalis Asam-Basa
Katalis asam-basa sangat berperan dalam perkembangan kinetika kimia. Awal penelitian kinetika reaksi yang dikatalisis dengan suatu asam atau basa bersamaan dengan
5
perkembangan teori dissosiasi elektrolit, dimana Ostwald dan Arrhenius membuktikan bahwa kemampuan suatu asam untuk mengkatalisis reaksi tersebut adalah tidak bergantung pada sifat asal anion tetapi lebih mendekati dengan sifat konduktivitas listriknya. Penelitian lain yang menggunakan katalis asam basa antara lain Kirrchoff yang meneliti hidrolisis pati oleh pengaruh asam encer, Thenard yang meneliti dekomposisin hidrogen peroksida oleh pengaruh basa dan Wilhelmy yang meneliti tentang inversi tebu yang dikatalisis dengan asam.
• Katalis Ziegler-Natta
Katalis Ziegler-Natta ditemukaan poleh Ziegler pada tahun 1953 yang digunakan untuk polimerisasi etana, yang selanjutnya pada tahun 1955 Natta menggunakan katalis tersebut untuk polimerisasi propena dan monomer jenuh lainnya. Katalis Ziegler-Natta dapat dibuat dengan mencampurkan alkil atau aril dari unsur golongan 11-13 pada susunan berkala, dengan halida sebagai unsur transisi. Saat ini katalis Ziegler-Natta digunakan untuk produksi masal polietilen dan polipropilen.
• Katalis Friedle-Crafts
Pada tahun 1877 Charles Friedel dan James M.Crafts mreakukan penelitian tentang pembuatan senyawa amil iodida dengan mereaksikan amil klorida dengan aluminium dan yodium yang ternyata menghasilkan hidrokarbon. Selanjutnya mereka menemukan bahwa pemakaian aluminium klorida dapat menggantikan alumunium untuk menghasilkan hidrokarbon. Dengan demikian Friedel dan Crafts merupakan orang pertama yang menunjukkan bahwa keberadaan logam klorida sangat penting sebagai reaktan atau katalis. Hingga saat ini penerapan kimia Friedel-Crafts sangat luas terutama di industri kimia.
• Katalis dalam Reaksi Metatesis
Pada tahun 1970 Yves Chauvin dari Institut Francais du Petrole dan Jean-Louis Herrison menemukan katalis logam karbena (logam yang dapat berikatan ganda dengan atom karbon membentuk senyawa), atau dikenal juga dengan istilah metal alkilidena. Melalui senyawa logam karbena ini, Chauvin berhasil menjelaskan bagaimana susunan logam berfungsi sebagai katalis dalam suatu reaksi dan bagaimana mekanisme reaksi metatesis. Metatesis dapat diartikan sebagai pertukaran posisi atom dari dua zat yang berbeda. Contohnya pada reaksi AB + CD -> AC + BD, B bertukar posisi dengan C. Katalis Grubbs.
Perkembangan penemuan Chauvin dan Schrock terjadi tahun 1992 ketika Robert Grubbs dan rekannya Grubbs berhasil menemukan katalis metatesis yang efektif, mudah disintesis, dan dapat diaplikasikan di laboratorium secara baik. Mereka menemukan tentang logam rutenium tantalum, tungsten, dan molybdenum (komplek alkilidena) sebagai logam yang paling cocok sebagai katalis. Katalis menjadi standar pembanding untuk katalis yang lain. Penemuan katalis Grubbs secara tidak langsung menambah peluang kemungkinan sintesis organik di masa depan.
• Sistem Katalis Tiga Komponen
Sebuah sistem katalis dengan tiga komponen berhasil digunakan untuk membuat polimer bercabang dengan struktur-struktur yang tidak bisa didapat dengan sebuah katalis tunggal atau sepasang katalis yang bekerja bergandengan. Pada tahun 2002 Guillermo C. Bazan, seorang profesor kimia dan material di University of California, Santa Barbara; mahasiswa pascasarjana Zachary J. A. Komon; dan rekan kerja di Santa Barbara dan Symyx
6
Technologies sudah mendemonstrasikan sebuah sistem dengan tiga katalis yang homogen; ketiga campuran bekerja sama mengubah sebuah monomer tunggal - etilen - menjadi polietilen bercabang. Jumlah dan jenis cabang yang dihasilkan dapat dikontrol dengan menyesuaikan komposisi campuran katalisnya. Tiga katalis ini terdiri dari dua persenyawaan organonikel dan sebuah persenyawaan organotitanium. Satu dari katalis dengan unsur dasar nikel mengubah etilen menjadi 1-butena, sedangkan yang lainnya mengubah olefin menjadi penyebaran dari 1-alkena. Persenyawaan titanium menggabungkan etilen dari hasil reaksi-reaksi lainnya menjadi polietilen.
2.3 Perkembangan Penggunaan Katalis Pada Industri Kimia Ammonia 2.4 Peran Katalis dalam Reaksi Kimia
Katalis sangat penting dalam proses kimia. Pentingnya katalis ditunjukkan oleh kenyataan bahwa lebih dari 75% proses produksi bahan kimia di industri disintesis dengan bantuan katalis. Contoh proses kimia yang sangat penting yaitu pada reaksi Low
temperature shift conversion terjadi pada suhu 200oC hingga 250oC dan katalis yang digunakan adalah campuran dari ZnO, CuO dan Cr2O3/Al2O3 dengan komposisi bergantung pada produsen. Katalis yang digunakan bahkan dapat mengakomodasi suhu pada medium temperature sekitar 300oC. Komponen aktif pada katalis ini adalah Kristal Cu (tembaga). ZnO dan Cr2O3 berfungsi untuk structural support serta Al2O3 adalah komponen yang tidak aktif untuk membantu disperse zat dan mencegah pellet pecah. Bagian aktif dari katalis sangat rentan terhadap suhu tinggi karena mengalami thermal sintering. Selain itu, katalis ini juga mudah untuk teracuni terhadap zat-zat seperti sulfur, halogen, dan karbon yang tak jenuh sehingga dibutuhkan ZnO untuk memproteksi katalis aktif. Biasanya, ZnO dipasang sebagai lapisan penjaga pada sisi inlet reaktor. Keuntungan dari katalis LT adalah selektifitas yang tinggi dan sedikitnya produk samping pada tekanan yang tinggi dan mempunyai umur berkisar 2-3 tahun.
Walaupun pada reaksi aliran uap membawa gas hidrogen, katalis harus tetap diaktivasi. Aktivasi katalis dilakukan dengan cara mengalirkan gas hidrogen. Berikut adalah reaksi pengaktifan CuO:
𝐶𝑢𝑂 + 𝐻2 → 𝐶𝑢 + 𝐻2𝑂 ∆𝐻 = −80,8 𝑘𝐽/𝑚𝑜𝑙
Tanaka dkk. (2003) menemukan bahwa campuran oksida CuMn2O4 dan CuAl2O4 menghasilkan konversi dibandingkan katalis komersial umumnya. Selain itu,penambahan Mn sebesar 8,55% (b/b) pada Cu/Al2O3 berdasarkan penelitian yang dilakukan Dinesh dkk. (2006) dapat menghasilkan konversi CO sebesar 90% pada temperatur 513 K dan waktu tinggal 5,33 jam.
2.5 Racun dan Deaktivasi Katalis
Deaktifasi katalis pada proses LTSC banyak disebabkan karena sintering dan teracuni. Banyak pengembangan yang telah dilakukan untuk memajukan perfomansi katalis LTSC. Dewasa ini, katalis yang digunakan adalah katalis berbasis logam tembaga (Cu). Katalis ini mempunyai kelemahan terhadap temperatur tinggi sebab logam Cu
7
mengalami sintering. Sintering adalah proses tergradasinya area aktif katalis akibat dari terdistorsinya struktur kristalitnya. Hal ini terjadi karena lepasnya atom dari kristalit logam yang berpidah ke kristalit lainnya sehingga menyebabkan tubrukan dengan kristalis logam lainnya. Sintering tidak terjadi hanya pada sisi katalis aktif tetapi pada logam supported lainnya. Pendeaktifan katalis ini sangat dipengaruhi kondisi temperatur operasi. Semakin tinggi suhu operasi akan mengakibatkan katalis akan kehilangan area aktifnya semakin cepat.
Pengoperasian katalis pada temperatur rendah menyebabkan Cu akan teracuni sulfur lebih cepat sesuai dengan persamaan berikut:
2𝐶𝑢 + 𝐻2𝑆 → 𝐶𝑢2𝑆 + 𝐻2𝑂 ∆𝐻 = −54,9 𝑘𝐽/𝑚𝑜𝑙 𝑍𝑛𝑂 + 𝐻2𝑆 → 𝑍𝑛𝑆 + 𝐻2𝑂 ∆𝐻 = −76,6 𝑘𝐽/𝑚𝑜𝑙
Nilai Kesetimbangan reaksi antara tembaga bernilai 105 yang artinya reaksi ini sangat mudah untuk terjadi. Sehingga lapisan katalis awal pada inlet LTSC harus diperkaya dengan seng(II) oksida. Dilihat secara termodinamika, kesetimbangan reaksi antara reaksi seng(II) oksida dengan hidrogen sulfur lebih besar dibandingkan dengan tembaga.
2.6 Kuantifikasi Performa Katalis
Dibawah ini dijelaskan beberapa teknik atau metode untuk mengevaluasi performa dari suatu katalis. Terdapat 3 metode untuk menggambarkan perubahan performa katalis. 1. Perhitungan komposisi keluaran reaktor
Analisis outlet keluaran reaktor adalah prosedur pengukuran yang baik mengetahui performa katalis ketika temperatur dijaga konstan dan ketika reaksi yang terjadi pada katalis tidak mengalami kesetimbangan. Contohnya, sepeti hydrodesulphurization tetapi pada kenyataanya hidrogen sulfida keluaran mempunyai konsentrasi yang rendah sehingga sangat sukar untuk diuji dengan metode konvensional seperti ini.
2. Pendekatan terhadap kesetimbangan pada keluaran reaktor
Pendeketan terhadap kesetimbangan reaksi pada keluaran bed katalis adalah dengan membandingkan temperatur keluaran outlet katalis dan temperatur kesetimbangan dengan komposisi gas yang sama. Metode ini akan sangat baik jika digunakan untuk menghitung performa katalis dengan temperatur operasi yang konstan dengan sedikit reaksi kesetimbangan seperti pada secondary reformer. Tetapi jika temperatur berubah saat pengambilan data maka akan sangat mempengaruhi hasil pendeketannya nanti apalagi jika digunakan variasi waktu.
3. Menghitung aktifitas katalis atau volume aktif katalis
Untuk menghitung aktifitas katalis digunakan persamaan seperti dibawah ini. Persaman ini memiliki kelebihan karena dapat menghitung performa katalis ketika temperature berubah ubah sepanjang waktu atau ketika banyak variasi komposisi gas pada inlet reaktor. Contohnya: Low Temperature Shift Conversion.
Persamaan untuk menghitung volume aktif katalis jika diketahui komposisi reaktan:
8
Keterangan :
Jika diketahui komposisi reaktan:
Keterangan :
• 𝐴𝑒, 𝐴𝑖, 𝐴𝑜 = Konsentrasi Reaktan pada equilibrium, inlet, dan outlet Nilai Kesetimbangan dapat diukur dengan grafik pada Twigg (1989)
Gambar 2.1. Grafik Kesetimbangan Gas Karbonmonoksida
Gambar 2.2. Grafik koreksi Gambar 2.2. Faktor Koreksi terhadap Kesetimbangan gas CO
Sedangkan untuk konstanta reaksi:
9
Keterangan:
• 𝑘𝑟 = konstanta kecepatan reaksi
• = Temperatur rata-rata (Kelvin)
Tabel 2.1. Konstanta Kinetika Reaksi
2.7 Persamaan Simulasi 2.7.1 Model Reaktor
Reaktor Bagian atas terdiri dari Guard Bed sebagai pelindung lapisan lapisan, sedangkan Bed kedua sebagai tempat bereaksi. Bed bagian atas terdiri dari campuran Cu, ZnO, dan Al2O3 dan bed bagian bawah hanya terdiri dari Cu dan Al2O3. Kondisi operasi reaktor pada rentang 200 oC hingga 250 oC.
2.7.2 Persamaan Gas Ideal
Pada Permodelan ini diasumsikan gas yang terdapat pada reaksi adalah gas ideal, sehingga memenuhin hukum persamaan gas ideal. Persamaan gas ideal ditunjukkan pada persamaan di bawah ini:
𝑃𝑉 = 𝑛𝑅𝑇 Keterangan :
• P = Tekanan (atm)
• V = Volume (m3)
• n = Jumlah mol (mol)
10
• T = Suhu (K)
2.7.3 Kecepatan Fluida
Kecepatan fluida didapat dari debit gas yang melewati reaktor.
Keterangan:
• v = Kecepatan fluida (m)
• Q = Debit (m3/s)
• A = Luas Penampang Reaktor (m2)
Akibat adanya perpindahan momentum kearah radial dan diasumsikan kearah aksial kecil sehingga dapat diabaikan. Oleh karena itu, kecepatan reaksi dapat ditulis sebagai berikut:
Keterangan:
• v = Kecepatan fluida (m)
• Q = Debit (m3/s)
• A = Luas Penampang Reaktor (m2)
2.7.4 Kinetika Reaksi
Dalam jurnal A Review of the Water Gas Shift Reaction Kinetics yang dibuat oleh Byron dkk (2010), terdapat beberapa jenis persamaan kinetika untuk Low Temperature Shift Conversion. Pada simulasi ini digunakan model Moe melalui pendekatan empiris berdasarkan data pada industri. Kecepatan reaksi
dengan konstanta reaksi:
Sedangkan Kesetimbangan Reaksi :
Keterangan:
• = Kecepatan reaksi (mol/menit)
• = Konstanta kecepatan reaksi
• 𝑃𝑖 = Tekanan parsial komponen (bar)
11
• T = Temperatur (K)
2.7.5 Kenaikan Temperatur Reaksi
Perubahan temperatur pada simulasi reaktor LTSC dengan menggunakan asumsi bahwa reaktor adiabatic dan merupakan Pseudo-homogen dengan laju alir berkisar 200.000
Nm3/jam menggunakan persamaan:
Keterangan
• ∆𝑇 = Beda Temperatur (K)
• 𝑆𝐺 = rasio Steam/Gas outlet
Sehingga Temperatur nyata yang terjadi
𝑇0 = 𝑇𝑖 + ∆𝑇
Keterangan
• 𝑇𝑖 = Temperatur Inlet (K) • 𝑇0 = Temperatur proses (K)
2.7.6 Uji performa LTSC dan Katalis
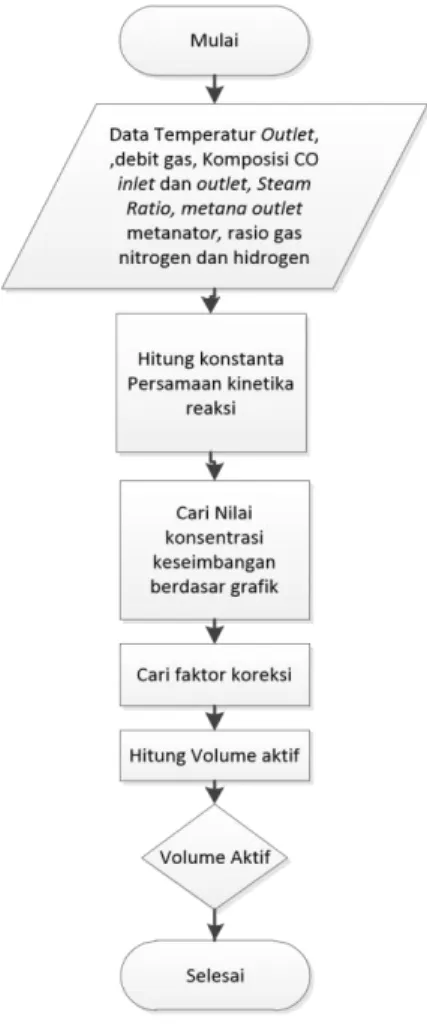
Performa Low Temperature Shift Conversion dapat diketahui simulasi berdasarkan persamaan kinetika reaksi dan termodinamika, sehingga dapat diketahui seberapa besar pengaruh dari parameter-parameter terhadap hasil output-nya. Selain itu, performa katalis pada reaktor LTSC dapat diketahui pula dengan menghitung volume aktif katalis dan menganalisis profil temperatur yang terbaca pada termokopel. Berikut akan dibahas masing-masing prosedur kerja untuk mendapatkan hasil performa katalis:
2.7.6.1 Simulasi Kondisi Reaktor
Simulasi reaktor LTSC menggunakan perangkat software Flex PDE 6.13 dengan dukungan Microsoft Excel 2013 untuk mengolah data mentah dan hasil grafik. Pada simulasi ini data pada kondisi aktual tidak terdapat laju alir fluidanya, sehingga harus dipersiapkan lebih dahulu perhitungan neraca massa dari primary reformer.
12
Gambar 3.1. Metodologi Simulasi dengan FlexPDE Berikut adalah persamaan-persamaan yang dibutuhkan dalam simulasi:
a) Fraksi mol komponen b) Kenaikan Temperatur
c) S/G output (Steam per Dry Gas Ratio) d) Tekanan Parsial komponen
e) Volume Reaktor f) Kecepatan fluida
g) Menghitung Kecepatan Reaksi
2.7.6.2 Perhitungan dengan Volume Aktif Katalis
Volume aktif katalis adalah besar volume dimana katalis masih aktif atau mampu melangsungkan reaksi. Volume aktif digunakan untuk menghitung seberapa besar katalis yang tertampung dalam reaktor dan seberapa besar pula katalis yang terdeaktifasi,
13
Gambar 3.2. Metodologi Perhitungan Volume Aktif
2.7.6.3 Analisis Termokopel pada Reaktor
Analisis kenaikan temperatur pada reaktor LTSC memanfaatkan posisi termokopel yang terletak berurutan pada reaktor. Secara berurutan dari inlet ke outlet: 215, TI-209, TI-210, TI-211, TI212, dan TR-212. Jika termokopel mengalami kenaikan temperatur dibandingkan termokopel yang paling dekat dengan inlet, maka dapat
diindikasikan pada area termokopel terjadi reaksi. Termokopel yang berurutan sama pada bagian akhir mengindikasikan bahwa reaksi telah mencapai tahap kesetimbangan
14 2.7.6.4 Simulasi dengan Reaktor Low Temperature Shift Conversion
Simulasi saat Start of Run (SOR) Simulasi saat End of Run
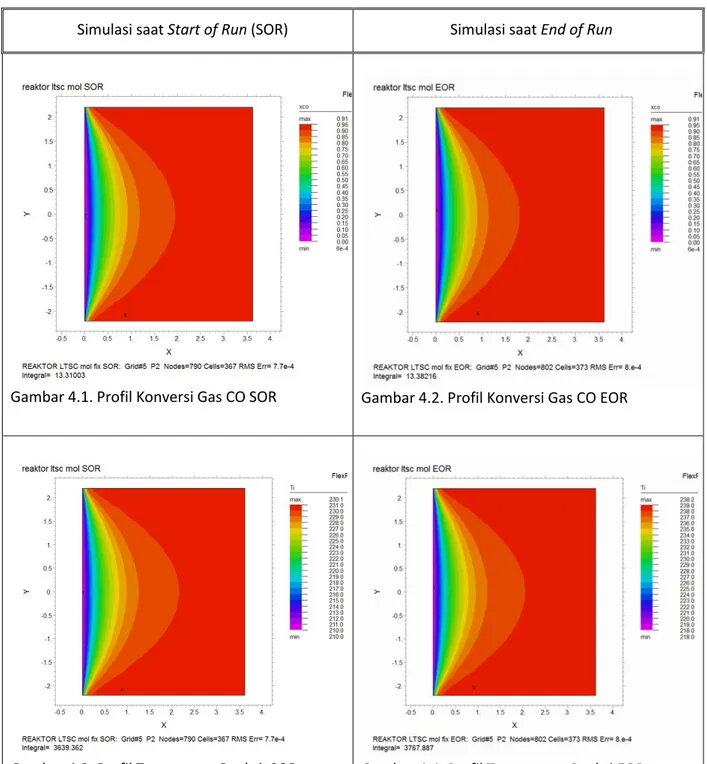
Gambar 4.1. Profil Konversi Gas CO SOR
Gambar 4.2. Profil Konversi Gas CO EOR
Gambar 4.3. Profil Temperatur Reaksi SOR
Gambar 4.4. Profil Temperatur Reaksi EOR
15
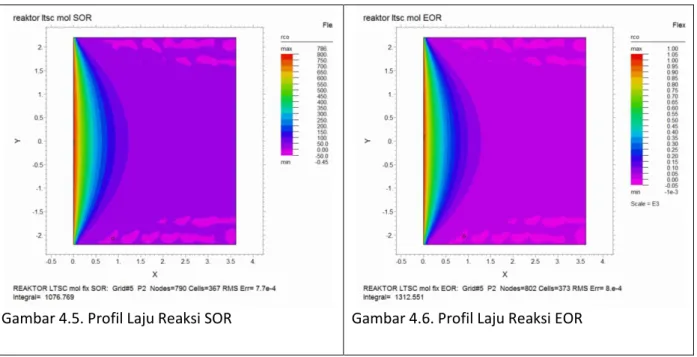
Gambar 4.5. Profil Laju Reaksi SOR Gambar 4.6. Profil Laju Reaksi EOR
Dari Persamaan kinetik dengan model Moe, model reaktor disimulasikan dengan software FlexPDE versi 6.13. Terdapat 3 tinjauan hasil simulasi yang bisa dilihat yaitu mengenai konversi gas karbon monoksida, profil temperatur, dan kondisi laju reaksi di sepanjang reaktor. Validasi data diuji dengan membandingkan hasil simulasi dengan data
Start of Run dan End of Run. Start of Run adalah kondisi dimana kondisi reaktor Low Temperature Shift Conversion baru dijalankan, sedangkan End of Run adalah kondisi
dimana reaktor LTSC akan dimatikan karena reaktor ini sudah tidak layak digunakan. Perbandingan hasil antara output simulasi dengan outlet keadaan aktual ditampilkan sebagai berikut:
Tabel 4.2. Perbandingan Data Simulasi EOR dan SOR
Konversi Simulasi Konversi Aktual Galat (%) Temperatur Simulasi Temperatur Nyata Galat (%) SOR 0,909 0,899 1,01 230,10 231,00 0,39 EOR 0,912 0,883 3,17 238,20 238,00 0,08
Dari hasil perbandingan antara simulasi dan aktual didapat kurang dari 3% galat untuk konversi dan untuk temperatur galat yang didapat kurang dari 1%.Tetapi, Penyimpangan besar terjadi pada galat konversi antara simulasi dan aktual pada End of Run sebab zona aktif katalis berkurang sedangkan pada simulasi dibuat ketika zona aktif katalis masih beraktifitas penuh. Temperatur yang dihasilkan dalam proses simulasi mempunyai nilai yang tidak jauh berbeda dengan galat kurang dari 0,5%. Hal ini menandakan proses yang terjadi dalam reaktor masih berjalan dengan baik dan dapat dikatakan sesuai dengan hasil simulasi. Namun perbedaan mendasar antara EOR dan SOR adalah temperatur inlet masing-masing proses. Pada SOR temperatur inlet sebesar 210oC dan pada EOR temperatur sebesar 220oC, hal inilah yang menjadi alasan kenapa titik akhir temperatur kedua proses ini berbeda.
16
Pada proses ini, variabel yang signifikan berubah adalah tempertur inlet dan Konsentrasi gas karbonmonoksida Inlet. Pada hasil simulasi menunjukkan tidak terjadi perbahan signifikan terhadap profil konversi CO dan Temperatur. Namun, kecepatan reaksi
End of Run lebih tinggi dibandingkan dengan Start of Run sebab temperatur reaksi pada
kondisi EOR lebih tinggi dibanding SOR. Temperatur yang lebih tinggi akan menyebabkan kinetika reaksi semakin meningkat.
Dilihat dari segi kesetimbangan, Temperatur reaksi yang meningkat akan mempengaruhi besar konversi gas karbonmonoksida. Reaksi Shift Conversion adalah eksotermis atau melepas panas sehingga kenaikan temperatur akan menyebabkan nilai kesetimbangan menurun. Tetapi pada kondisi EOR, gas karbonmonoksida inlet lebih tinggi kandungannya sehingga kesetimbangan meningkat. Jadi, pada profil konversi diatas antara SOR dan EOR sangat wajar ketika konversi kesetimbangan mendekati sama.
2.7.6.5 Perbandingan simulasi Kondisi operasi Aktual dengan kondisi operasi EOR dan SOR
Simulasi saat Aktual
Gambar 4.7. Profil Temperatur saat Aktual
17
Berikut adalah data Hasil dari simulasi dibandingkan dengan Aktual: Tabel 4.3. Perbandingan Data Aktual dengan simulasi
Kondisi Konversi Simulasi Konversi Aktual Galat (%) Temperatur Simulasi Temperatur Nyata Galat (%) Aktual 0,931 0,904 2,94 234,20 237,00 1,19
Kondisi aktual disadur dari dari rata-rata data pabrik tanggal 20 Agustus 2014. Pada kondisi ini Steam Ratio dari pabrik bernilai 3,6, nilai ini merupakan rasio yang lebih besar dibandingkan desain sebesar 2,75. Dengan kondisi seperti ini hasil reaksi jauh lebih besar karena flowrate meningkat dan beban reaktor meningkat. Peningkatan uap air dapat
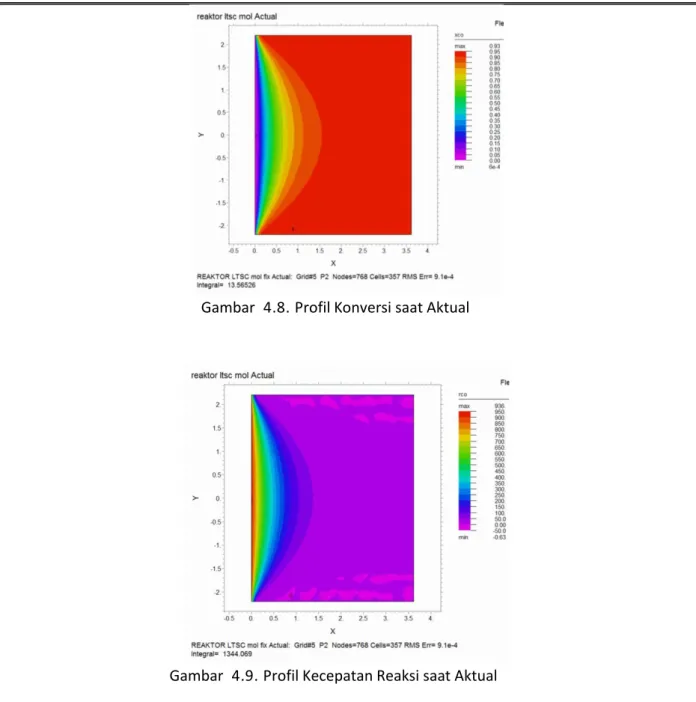
Gambar 4 . 8 . Profil Konversi saat Aktual
Gambar 4 . 9 . Profil Kecepatan Reaksi saat Aktual
18
mengakibatkan nilai kesetimbangan meningkat dan berefek pada peningkatan nilai konversi kesetimbangannya.
Temperatur Inlet yang melebihi desain yaitu sebesar 216oC bertujuan untuk mendapatkan nilai kesetimbangan tinggi dengan kinetika yang tinggi. Hal ini dilakukan untuk mencapai target konversi yang diinginkan. Dalam mengatur suhu masukan hal yang harus diperhatikan adalah temperatur keluaran dari reaktor. Temperatur yang tinggi justru akan memperpendek umur katalis karena katalis Cu akan mudah sintering pada suhu diatas desain operasional.
Temperatur keluaran simulasi bernilai 234,3 oC sedangkan temperatur keluaran aktual berada di kisaran 236-238 oC. Hasil ini melenceng sekitar 2-4 oC ,menurut Twigg (1989), hasil reaksi LTSC tidak sepenuhnya mereaksikan gas karbonmonoksida namun terdapat reaksi samping yang melibatkan gas metana dan bersifat eksoterm. Hal ini sangat wajar karena umur katalis yang telah tua sehingga kemungkinan selektifitas menurun.
Dari data Gambar 4.10 dengan banyaknya kondisi berubah seperti steam ratio, laju alir, konsentrasi inlet gas karbonmonoksida, dan temperatur inlet menyebabkan penurunan kecepatan konversi dari aktual. Hal ini dikarenakan meski kesetimbangan bernilai tinggi dan kecepatan reaksi tinggi namun jumlah mol reaktan yang meningkat.
Dari hasil simulasi juga dapat dilihat bahwa untuk mencapai konversi yang diinginkan hanya dibutuhkan sekitar kurang dari 43,6 % volume reaktor total. Volume reaktor yang tersisa oleh desain sengaja dibuat sebagai persiapan terjadinya deaktifasi katalis terhadap racun sulfur dan klorida karena performa keluaran reaktor tetap terjaga karena target yang diinginkan dibawah 0,3% volume sebab katalis Cu sangat rentan untuk terdeaktifasi.
Gambar 4 . 10 . Grafik Kecepetan Konversi antara SOR, EOR, dan Aktual
0.017 0.027 0.037 0.047 0.057 0.067 0.077 0.087 0.011 0.016 0.021 0.026 0.031 0.036 0.041 0.046 Panjang Reaktor
Laju Konversi SOR,EOR, dan Aktual
19 2.7.6.6 Efek Kondisi Operasi Terhadap reaktor LTSC
Berikut akan disampaikan kondisi pengaruh kondisi operasi terhadap performa reaktor LTSC:
1. Temperatur
Temperatur mempunyai peranan vital dalam mempengaruhi hasil konversi dan kinetika reaksi. Reaksi water shift gas adalah reaksi eksotermis, sehingga ketika suhu dinaikkan maka nilai kesetimbangan akan menurun. Sedangkan untuk kinetika reaksi, temperatur yang tinggi akan mempercepat reaksi. Kondisi operasi reaktor LTSC ada pada rentang 200-250 oC. Temperatur yang rendah akan menurunkan aktifitas katalis dan menyebabkan kinetika reaksi akan melambat. Sedangkan untuk temperatur yang tinggi, katalis akan mudah untuk sintering sehingga umur katalis reaktor tidak akan berjalan lama.
2. Laju alir reaktan
Laju alir reaktan sangat berkaitan erat dengan spesifikasi alat dan waktu tinggal zat dalam reaktor. Laju alir gas yang lambat akan berimbas pada waktu tinggal yang semakin lama dan membutuhkan volume ruang katalis yang lebih kecil, tetapi efek yang ditimbulkan adalah menurunnya produktifitas pabrik karena produksi berkurang. Sedangkan untuk laju alir tinggi dapat memberikan waktu ruang yang lama tetapi beban reaktor akan meningkat dan membutuhkan volume aktif katalis yang besar
3. Steam Ratio
Rasio steam adalah perbandingan gas proses yang dibutuhkan dengan steam yang diberikan. Peningkatan steam akan memberikan efek yang baik bagi reaksi pada Low
Temperature Shift Conversion karena steam yang tinggi akan menahan kenaikan
temperatur saat reaksi eksotermis terjadi dan akan menggeser kesetimbangan kearah produk. Namun, pemberian steam yang tinggi akan meningkatkan biaya operasi dan menurunkan keuntungan perusahaan. Selain itu, steam yang tinggi juga mengganggu proses pada pembuatan ammonia, karena menurunkan tekanan parsial gas hidrogen dan nitrogen.
4. Tekanan
Tekanan LTSC didadasarkan pada tekanan yang dipakai sistem secara keseluruhan. Jika tekanan dijaga 29-30 bar kondisi operasi, seperti konversi dan temperatur tidak berpengaruh besar. Perbedaan tekanan juga tidak mempengaruhi kesetimbangan karena jumlah koefisien reaktan dan produk sama. Tekanan hanya mempengaruhi laju debit gas pada reaktor LTSC, semakin kecil tekanan maka volume gas akan semakin besar, dan sebaliknya jika tekanan semakin besar maka volume gas akan semakin kecil.
5. Konsentrasi gas CO keluaran HT shift
Konsentrasi keluaran gas CO pada HTSC sangat mempengaruhi kinerja dari LTSC. LTSC adalah alat yang digunakan agar gas CO yang didapat semakin sedikit konsentrasinya. Semakin besar kandungan gas CO yang ada maka jumlah reaktan yang
20
bereaksi akan semakin besar sehingga waktu tingga yang dibutuhkan lebih lama walaupun nilai kesetimbangan meningkat. Selain itu, temperatur reaksi akan meningkat drastis, sehingga akan sulit untuk mengatur temperatur keluaran agar katalis tidak terjadi kerusakan.
6. Kandungan Sulfur dan Klorida
Kandungan sulfur dan klorida pada kompisisi umpan sangat berbahaya bagi katalis. Sulfur dan klorida dapat dengan mudah bereaksi dengan logam Cu (tembaga) sehingga ruang aktif katalis berkurang. Semakin besar kandungan sulfur dan klorida dalam gas maka semakin pendek pulda umur katalis.
2.7.6.7 Perhitungan Volume Aktif Reaktor
Tabel 4.4. Data Perbandingan Volume Aktif Aktual, EOR, dan SOR Kondisi Volume aktif
katalis (m3) Volume aktif/Volume reaktor SOR 70,70 0,95 EOR 31,98 0,43 Aktual 43,00 0,58
Volume aktif katalis dapat diketahui dengan pendekatan komposisi gas karbonmonoksida keluaran dan temperatur keluaran pada reaktor LTSC dan membandingkannya dengan komposisi saat mencapai keseimbangan. Reaktor LTSC
mempunyai 2 bed, bed pertama mempunyai volume 19 m3 sedangkan bed kedua
mempunyai volume 55 m3, sehingga total volume kedua bed mencapai 74 m3. Bed pertama berfungsi sebagai guard bed, yaitu sebagai lapisan pelindung akan racun sulfur dan klorida.
Guard bed mengandung senyawa ZnO yang digunakan untuk mengikat Sulfur untuk
melindungi bed yang lebih besar. Sedangkan pada bed kedua, campuran katalis tidak mengandung ZnO agar mengoptimalkan Cu sebagai katalis dan diasumsikan gas telah bersih dari kandungan racun karena melewati bed pertama.
Pada kondisi Start of Run volume aktif yang terhitung mendekati volume aktual, karena pada kondisi ini katalis masih baru dan belum mengalami deaktifasi. Sebaliknya, Kondisi saat End of Run volume aktif katalis hanya 43,6 % dari katalis yang menandakan bahwa bahwa lapisan utama bed katalis telah banyak mengalami deaktifasi sedangkan untuk mencapai konversi yang baik dibutuhkan minimal 43 persen dari volume aktif total.
Bagian yang vital dari reaktor ini adalah 25 persen awal dari atau setara volume bed awal dimana masih mengandung zat yang bisa mencegah merusah katalis Cu. Ketika bed awal telah hilang aktifitasnya maka dapat dipastikan bahwa campuran Zn dan Cu telah teracuni seluruhnya sebab logam Zn akan menarik sulfur lebih kuat dibandingkan dengan logam Cu. Lamanya pendeaktifan katalis ini sangat bergantung kandungan komposisi racun pada fluida gas pembawa serta temperatur operasi. Pada bed awal katalis terdeaktifasi seluruhnya hingga bulan Oktober 2013 kemudian dari Oktober 2013 hingga sekarang katalis telah berkurang volume aktifnya hingga 58%. Sehingga, performa katalis mengalami penurunan 17% setelah guard bed terdeaktifasi di bed utama selama 10 bulan.
21
Jika 10 bulan kedepan dibiarkan berlanjut maka volume aktif katalis tidak mampu untuk mengkonversi secara sempurna lagi, sehingga pabrik harus shutdown total.
Pada kondisi aktual, volume aktif katalis telah banyak berkurang. Volume lapisan bed awal sebagai pelindung telah terdeaktifasi akibatnya jika fluida membawa kandungan sulfur semakin banyak makan katalis akan semakin cepat teracuni. Kemudian bagian aktif katalis akan bergeser sepeti gambar di bawah ini:
Gambar 4.11. Profil Temperatur Reaktor Berkatalis
Perubahan temperatur diatas merepresentasikan reaksi yang terjadi, pada reaktor LTSC sebenernya volume aktif katalis memang dibuat lebih untuk mencegah kegagalan operasi pabrik secara tibatiba karena LTSC memegang peranan penting dalam produksi ammonia ini.
2.7.6.8 Pertimbangan reaktor berdasarkan profil temperatur reaktor Tabel 4.5. Perbandingan Data Termokopel Kondisi Desain dan Aktual
Termokopel pada reaktor Keadaan Desain (oC) Keadaan Aktual (oC) TI-215 210 215 TI-209 210 214 TI-210 220 214 TI-211 231 230 TI-212 231 237 TR-212 231 238
Metode ini adalah metode paling ringkas untuk mengetahui perfoma dari suatu katalis. Dilihat dari kenaikan temperaturnya pada keadaan desain dapat disimpulkan bahwa katalis hingga bagian termokopel TI-210 terdeaktifasi. Hal ini ini dapat diketahui karena reaksi yang terjadi bersifat eksotermis sehingga dapat menaikkan suhu gas. Suhu dimana belum terjadi reaksi akan konstan karena tidak ada energi yang dilepaskan. Pada keadaan desain reaksi pada termokopel TI-210 telah bereaksi sebagian hal ini terbukti dengan temperatur yang meningkat tetapi masih terus meningkat hingga keadaan keseimbangan hingga TI-211.
Termokopel TI-209 dan TI-210 adalah batas dari inlet dan outlet dari guard bed dimana terdapat unsur ZnO sebagai pelindung bed kedua. Bed pelindung ini digunakan
22
untuk mempertahankan performa katalis utama dengan agar berumur lama. Ketika bed utama teracuni, maka katalis dalam bed ini tidak mudah untuk diganti atau dengan kata lain harus diganti seluruhnya sehingga menimbulkan biaya yang besar. Guard bed ini diganti pada bulan Mei 2010 dan sanggup bertahan hingga bulan Oktober 2013, sehingga dapat diketahui umur guard bed hingga 3 tahun 5 bulan.
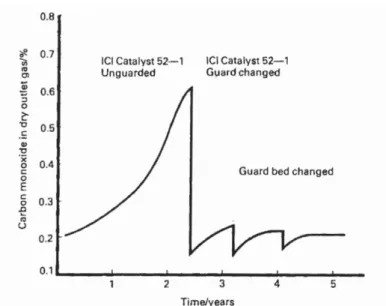
Percobaan yang dilakukan dalam buku Catalyst Handbook karangan Twigg (1989), performa katalis akan turun drastis ketika katalis pengaktifasi/logam Cu tidak terlindungi. Pelindung yang baik menggunakan katalis dengan pellets yang berukuran kecil, agar luas kontak gas dengan katalis bertambah dan kemungkinan sulfur untuk menembus lapisan pelindung sangat kecil walaupun pressure drop yang dihasilkan lebih besar. Pelindung katalis juga dapat memperpanjang umur katalis pada bed utama seperti yang dijelaskan grafik bawah ini.
Gambar 4.12. Percobaan Menggunakan Guard bed dan Unguarded (Twigg, 1989) 2.8 Katalis dalam Industri Kimia
Katalis banyak digunakan dalam berbagai macam industri. Biasanya katalis digunakan dalam industri polipropilena atau bahan-bahan kimia, seperti ammonia.
Polipropilena adalah sebuah polimer termo-plastik yang dibuat oleh industri kimia dan dapat digunakan menjadi berbagai barang-barang yang bersifat plastic. Polipropilena dapat dibuat dengan katalis Ziegler-Natta.
Katalis Ziegler-Natta adalah campuran antara senyawa-senyawa titanium seperti titanium(III) klorida atau titanium(IV) klorida dan senyawa-senyawa aluminium seperti aluminium trietil. Katalis Ziegler-Natta dapat membatasi berbagai monomer mendatang ke sebuah orientasi yang spesifik, hanya menambahkan monomer-monomer itu ke rantai polimer jika mereka menghadap ke arah yang benar.
Selain dapat memproduksi polipropilena, katalis juga dapat memproduksi ammonia dengan cara menambahkan katalis oksida besi ke dalam reaksi. Dalam memproduksi
23
ammonia digunakan suatu proses sintesis yang disebut proses Bosch. Proses Haber-Bosch ialah proses pembuatan ammonia (NH3) dengan cara memadukan antara nitrogen dan hydrogen dengan factor-faktor (tekanan dan suhu) yang optimal.
Dalam pembuatan ammonia, diperlukan tekanan yang cukup tinggi, yakni berkisar 200-1000 atm. Apabila tekanan yang digunakan tinggi, maka reaksi akan bergeser ke kanan dan secara otomatis reaksi menjadi eksoterm.
Selain tekanan yang tinggi, dalam pembuatan ammonia juga diperlukan suhu yang sesuai. Apabila suhu yang digunakan tinggi ammonia (NH3) akan mengurai dan membentuk nitrogen (N2) dan hydrogen (N2). Dan apabila suhu yang digunakan rendah, kadar reaksi pembuatan ammonia akan menurun.
2.9 Reaksi Katalis di Industri: Pembuatan Amonia menurut proses Haber-Bosch
Dalam proses pembuatannya banyak diterapkan prinsip dalam ilmu kimia, diantaranya sifat-sifat larutan, kelarutan, kejenuhan larutan, konsentrasi larutan, dansebagainya. Semua itu termasuk factor yang harus diperrhatikan dalam proses pembuatan minuman olahraga itu. Dengan mengetahui cara proses pembuatan yang baik dari minuman-minuman olahraga tersebut serta kandungan-kandungan yangsebaiknya ada dan ditiadakan di dalamnya maka siswa dapat memilah produk yanglebih layak untuk dikonsumsi. Lebih jauhnya ketika mereka terjun ke masyarakat atau berkecimpung di dunia yang berhubungan dengan produksi minuman sejenis itu maka produk yang dihasilkan itu akan lebih baik dan berkualitas daripada yang sebelumnyadikenal olehnya.
Penerapan laju reaksi dalam industry kimia dapat ditemukan pada penggunaan katalis pada industry pembuatan ammonia menurut proses Haber-Bosch. Dalam pembuatan gas ammonia dilakukan dengan mereaksikan gas nitrogen dengan gas hidrogen Nitrogen terdapat melimpah di udara, yaitu sekitar 78% volume. Walaupun demikian, senyawa nitrogen tidak terdapat banyak di alam. Satu-satunya sumber alam yang penting ialah NaNO3 yang disebut Sendawa Chili. Sementara itu, kebutuhan senyawa nitrogen semakin banyak, misalnya untuk industri pupuk, dan bahan peledak. Oleh karena itu, proses sintesis senyawa nitrogen, fiksasi nitrogen buatan, merupakan proses industri yang sangat penting. Metode yang utama adalah mereaksikan nitrogen dengan hidrogen membentuk amonia. Selanjutnya amonia dapat diubah menjadi senyawa nitrogen lain seperti asam nitrat dan garam nitrat.
Dasar teori pembuatan amonia dari nitrogen dan hidrogen ditemukan oleh Fritz Haber (1908), seorang ahli kimia dari Jerman. Sedangkan proses industri pembuatan amonia
24
untuk produksi secara besar-besaran ditemukan oleh Carl Bosch, seorang insinyur kimia juga dari Jerman. Persamaan termokimia reaksi sintesis amonia adalah :
Berdasarkan prinsip kesetimbangan kondisi yang menguntungkan untuk ketuntasan reaksi ke kanan (pembentukan NH3) adalah suhu rendah dan tekanan tinggi. Akan tetapi, reaksi tersebut berlangsung sangat lambat pada suhu rendah, bahkan pada suhu 500oC sekalipun. Dilain pihak, karena reaksi ke kanan eksoterm, penambahan suhu akan mengurangi rendemen. Proses Haber-Bosch semula dilangsungkan pada suhu sekitar 500oC dan tekanan sekitar 150-350 atm dengan katalisator, yaitu Fe2O3 Katalis ini mempercepat laju reaksinya dengan cara mengadsorbsi zat-zat pereaksi pada permukaannya, reaksinya sebagai berikut:
Seiring dengan kemajuan teknologi, digunakanlah tekanan yang jauh lebih besar, bahkan mencapai 700 atm. Untuk mengurangi reaksi balik, maka amonia yang terbentuk segera dipisahkan. Mula-mula campuran gas nitrogen dan hidrogen dikompresi (dimampatkan) hingga mencapai tekanan yang diinginkan. Kemudian campuran gas dipanaskan dalam suatu ruangan yang bersama katalisator sehingga terbentuk amonia.
2.10 Jenis Katalis dan Pengelompokan Katalis
2.10.1 Penggolongan katalis berdasarkan fasenya di dalam sistem reaksi:
1. Katalis Homogen
Yakni jika fase katalis sama dengan fase reaktan dan fase produk reaksi (atau: fase katalis = fase reaksi). Yang paling umum berupa fase cair, dengan katalis dan reaktan berada dalam larutan. Katalis homogen merupakan katalis yang mempunyai fasa sama dengan reaktan dan produk. Penggunaan katalis homogen ini mempunyai kelemahan yaitu: mencemari lingkungan, dan tidak dapat digunakan kembali. Contoh Katalis Homogen : Katalis dan pereaksi berwujud gas, dan katalis dan pereaksi berwujud cair. Sebagian besar reaksi katalis homogen adalah asam basa, seperti halnya reaksi hidrolisis dari ester atau mutarotasi glukosa.:
Keunggulan: aktivitas dan selektivitasnya tinggi, tidak mudah teracuni oleh keberadaan pengotor, mudah dioperasikan, mudah dimodifikasi, mudah untuk dipelajari. Kekurangan: sulit dipisahkan dari campuran reaksi, kurang stabil pada suhu tinggi. Karena alasan-alasan tersebut, katalisis homogen terbatas penggunaannya di industri, biasanya
25
dalam pembuatan zat kimia khusus, obat-obatan, dan makanan; kecuali pada produksi asam asetat, proses alkilasi olefin, dan hidroformilasi.
Katalis homogen adalah suatu jenis dari katalisis di mana katalis menempati fase yang sama dengan reaktan. Katalis homogen adalah senyawa yang ada dalam fase yang sama (gas atau cair) sebagai reaktan. Campuran homogen adalah Sebuah zat yang seragam dalam komposisi. Katalisis asam, katalis organologam, dan katalisis enzimatik adalah contoh katalis homogen. Paling sering, katalis homogen melibatkan pengenalan katalis fase cair ke dalam larutan reaktan. Dalam kasus tersebut, asam dan basa sering katalis sangat efektif, karena mereka dapat mempercepat reaksi dengan mempengaruhi polarisasi ikatan. Katalis homogen digunakan dalam berbagai aplikasi industri, karena memungkinkan untuk peningkatan laju reaksi tanpa peningkatan suhu. Katalis homogen umumnya bereaksi dengan satu atau lebih pereaksi untuk membentuk suatu perantara kimia yang selanjutnya bereaksi membentuk produk akhir reaksi, dalam suatu proses yang memulihkan katalisnya. Berikut ini merupakan skema umum reaksi katalitik, di mana C melambangkan katalisnya:
A + C → AC (1) B + AC → AB + C (2)
Meskipun katalis (C) termakan oleh reaksi 1, namun selanjutnya dihasilkan kembali oleh reaksi 2, sehingga untuk reaksi keseluruhannya menjadi,
A + B + C → AB + C
Contoh katalis homogen:
Reaksi berkatalis homogen, fase gas
CO (g) + ½ O2 (g) → CO2 (g) katalis: NO (g) CH3CHO (g) → CH4 (g) + CO (g) katalis: uap I2 Reaksi berkatalis homogen, fase cair
C12H22O11 + H2O → C6H12O6 + C6H12O6 katalis: asam CH3COOC2H5 + H2O → CH3COOH + C2H5OH katalis: asam Katalis gas NO2 pada pembuatan gas SO3.
Katalis gas Cl2 pada penguraian N2O
Proses katalitik pada reaksi berkatalis homogen berlangsung melalui pembentukan senyawa kompleks dan penyusunan ulang antara molekul-molekul reaktan dengan ligan katalis.
2. Katalis heterogen
Yakni jika fase katalis tidak sama dengan fase reaktan dan/atau fase produk reaksi (atau: fase katalis ≠ fase reaksi). Pada umumnya: fase katalis → padatan, fase reaksi → gas
Sifat-sifat katalis heterogen: Mudah dipisahkan dari campuran reaksi, Tahan dan stabil terhadap suhu relatif tinggi, Mudah disiapkan dalam bentuk pellet katalis padat, Konstruksinya sederhana
Hingga tahun 1980-an: sekitar 90% katalis yang digunakan di dalam proses industri kimia berupa katalis heterogen. Katalis heterogen biasanya membutuhkan pendukung (support), karena pendukung katalis memiliki kekuatan mekanik, tahan panas, mempunyai kerapatan ruah yang optimal, dan kemampuan pelarutan fase aktif. Dalam mempelajari katalis asam basa akan diketahui katalisator asam spesifik, katalisator basa spesifik, katalisator asam umum dan katalisator basa umum.
Satu contoh sederhana untuk katalisis heterogen yaitu bahwa katalis menyediakan suatu permukaan di mana pereaksi-pereaksi (atau substrat) untuk sementara terjerap. Ikatan dalam substrat-substrat menjadi lemah sedemikian sehingga memadai terbentuknya produk baru. Ikatan atara produk dan katalis lebih lemah, sehingga akhirnya terlepas.
26
Katalis padat Fe untuk Proses Haber pada pembuatan amonia: N2 (g) + 3 H2 (g) ↔ 2 NH3 (g)
Katalis padat Fe2O3-BiO2 untuk oksidasi amonia pada pembuatan asam nitrat: 4 NH3 (g) + 5 O2 (g) ↔ 4 NO (g) + 6 H2O (g)
Katalis padat Ni pada hidrogenasi hidrokarbon: R1CH=CHR2 (l) + H2 (g) → R1CH2CH2R2 (l)
(minyak tak jenuh) (lemak jenuh)
Katalis arang (C) pada pembuatan asam khlorida: H2 (g) + Cl2 (g) → 2 HCl (g)
2.10.2 Penggolongan katalis berdasarkan keberadaannya di alam:
1. Katalis biokimia
Disebut juga enzim. Merupakan senyawa protein berukuran koloid. Dijumpai dalam sistem biokimia dan makhluk hidup. Contoh: enzim-enzim dalam sistem pencernaan tubuh manusia enzim-enzim dalam tumbuhan. Bekerja pada suhu ambient. Setiap enzim mempunyai suhu optimum (suhu operasi ketika aktivitasnya mencapai maksimum). Peningkatan suhu di atas suhu optimumnya akan mengakibatkan kerusakan enzim (denaturasi protein). Contoh: Enzim amilase = membantu menghidrolisis amilum menjadi maltose; Enzim katalase = menguraikan H2O2 menjadi O2 dan H2O; Enzim lipase = menguraikan lipid menjadi gliserol dan asam lemak.
2. Katalis yang dibuat oleh manusia (man-made catalyst)
Bekerja pada suhu relatif tinggi. Sebagian besar berupa katalis padat. Contoh: Katalis V2O5 untuk reaksi oksidasi SO2 : SO2 (g) + ½ O2 (g) ↔ SO3 (g)
Katalis Fe-base untuk reaksi sintesis amonia: N2 (g) + 3 H2 (g) ↔ 2 NH3 (g)
Katalis oksida Cu-Zn untuk reaksi sintesis metanol: nmCO (g) + 2 H2 (g) ↔ CH3OH (g)
2.11 Karakteristik Katalis
Katalis tidak mengalami perubahan yang permanen dalam reaksi, tapi terlibat dalam mekanisme reaksi.
Katalis mempercepat laju reaksi tetapi tidak mengubah jenis maupun jumlah hasil reaksi.
Katalis dapat menurunkan energi aktivasi, tetapi tidak mengubah entalpi reaksi.
Katalis mengubah mekanisme reaksi dengan menyediakan tahap-tahap yang
mempunyai energi pengaktifan lebih rendah.
Katalis mempunyai aksi spesifik, artinya hanya dapat mengkatalisis reaksi tertentu. Katalis hanya diperlukan dalam jumlah sedikit.
Katalis dapat teracuni.
Kerusakan aktivitas katalis ditunjukkan dengan adanya peningkatan aktivitas berlebih atau penghambatan aktivitas. Kerusakan aktivitas katalis dapat disebabkan karena adanya kerusakan fisik atau kerusakan kimia katalis. Kerusakan fisik katalis misalnya dapat disebabkan oleh pengkristalan material pendukung katalis atau kerusakan fisik pas katalisnya sendiri. Pengikatan logam berat seperti merkuri, arsen, timah hitam dll. merupakan contoh kerusakan kimia katalis dan biasanya bersifat permanen.
27
Jika sifat kerusakannya tidak permanen, maka katalis tersebut biasanya masih dapat diregenerasi. Jika kerusakan aktivitas katalis disebabkan oleh kerusakan pada pendukung yang tahan panas, seperti alumina, yang disebabkan oleh penjerapan karbon atau tar, maka pembakaran alumina pada suhu dibawah 500oC dapat menghilangkan karbon dan tar tersebut. Selanjutnya, melalui serangkaian pengolahan reduksi, aktivitas katalis akan dapat dimunculkan kembali.
2.12 Katalis Heterogen
Katalis heterogen merupakan katalis yang memiliki fasa yang berbeda dengan reaktannya atau dapat didefinisikan bahwa katalis heterogen merupakan katalis yang fasanya tidak sama dengan reaktan dan produk. Katalis heterogen secara umum berbentuk padat dan banyak digunakan pada reaktan berwujud cair atau gas. Reaksi katalisis heterogen adalah reaksi yang menggunakan katalis yang mempunyai fasa yang berbeda dengan fasa reaktannya. Reaksi katalisis heterogen biasanya menggunakan katalis padatan dimana interaksi terjadi di permukaan padatan/gas atau cairan/padatan. Pusat aktivitas katalis terjadi di permukaan pori padatan katalis. Agar interaksi reaktan dengan pusat aktif katalis dapat berlangsung, reaktan harus berpindah dari fasa cair ke permukaan katalis.
Menurut Agustine (1996), reaksi katalisis heterogen memiliki tahapan-tahapan yang lebih kompleks dibandingkan dengan reaksi katalisis homogen. Hal ini terjadi karena pada reaksi katalisis heterogen katalis tidak terdistribusi merata ke dalam media reaksi. Lima tahap penting pada reaksi katalisis heterogen agar reaksi berjalan sempurna yaitu:
a. Transpor reaktan ke permukaan katalis b. Interaksi (adsorpsi) reaktan pada katalis.
c. Reaksi pada permukaan katalis yang melibatkan satu atau lebih reaktan teradsorpsi. d. Desorpsi produk dari permukaan katalis
e. Transpor produk menjauh dari katalis.
Menurut Triyono (1998), inti dari reaksi katalisis terjadi pada tahap ketiga, akan tetapi tahap kedua dan keempat termasuk dalam perubahan kimia, sehingga data kecepatan reaksi yang diamati melingkupi data dari ketiga tahap tersebut. Pengukuran energi aktivasi merupakan aplikasi dari kombinasi ketiga tahap tersebut. Tahap kedua, ketiga dan keempat merupakan penentu laju reaksi dengan ciri-ciri:
a. Laju reaksi sebanding dengan massa katalis atau konsentrasi komponen aktif b. Laju reaksi tidak dipengaruhi oleh pengadukan
c. Energi pengaktifan biasanya lebih besar dari 25 kJ.mol-1.
Adsorpsi reaktan pada situs aktif katalis akan melepaskan energi dalam bentuk panas, sehingga akan mempermudah molekul reaktan melewati energi aktivasi. Panas yang dilepaskan pada proses adsorpsi berkaitan dengan kekuatan adsorpsi reaktan pada permukaan katalis. Kekuatan adsorpsi reaktan pada permukaan katalis sangat menentukan aktivitas katalis tersebut. Jika adsorpsi yang terjadi sangat lemah, energi yang dilepaskan juga kecil, sehingga hanya sebagian kecil fraksi permukaan yang ditempati oleh reaktan, dan pada akhirnya reaksi berjalan dengan lambat (Gasser, 1985).
Adsorpsi terjadi karena adanya interaksi gaya permukaan padatan dengan molekul- molekul adsorbat. Energi adsorpsi yang dihasilkan bergantung pada tipe adsorpsi yang terjadi. Energi adsorpsi yang dihasilkan bergantung pada adsorpsi yang terjadi. Tipe adsorpsi ini merupakan fungsi logam dan fungsi pereaksi. Adsorpsi gaas pada permukaan padatan katalis dapat dikelompokkan menjadi dua kategori, yaitu adsorpsi fisik (fisisorpsi) dan adsorpsi kimia (kemisorpsi). Adsorpsi fisik terjadi karena adanya gaya molekuler, dimana interaksi molekul-molekul gas terhadap padatan katalis bersifat reversibel, sehingga semua molekul gas yang teradsorpsi secara fisik akan dilepaskan kembali dengan menaikkan temperatur atau menurunkan tekanan. Adsorpsi kimia terjadi karena adanya
28
interaksi tumpang tindih orbital molekul di permukaan padatan dengan molekul adsorbat. Adsorpsi kimia bersifat irreversibel, sehingga untuk melakukan desorpsi diperlukan energi yang jauh lebih besar dibandingkan energi desorpsi pada adsorpsi fisik.
Pada umumnya: fase katalis → padatan
fase reaksi → gas Sifat-sifat katalis heterogen:
Mudah dipisahkan dari campuran reaksi Tahan dan stabil terhadap suhu relatif tinggi Mudah disiapkan dalam bentuk pellet katalis padat Konstruksinya sederhana
Hingga tahun 1980-an: sekitar 90% katalis yang digunakan di dalam proses industri kimia berupa katalis heterogen.
Contoh: Katalis padat Fe untuk Proses Haber pada pembuatan amonia: N2 (g) + 3 H2 (g) ↔ 2 NH3 (g)
Katalis padat Fe2O3-BiO2 untuk oksidasi amonia pada pembuatan asam nitrat: 4 NH3 (g) + 5 O2 (g) ↔ 4 NO (g) + 6 H2O (g)
Katalis padat Ni pada hidrogenasi hidrokarbon: R1CH=CHR2 (l) + H2 (g) → R1CH2CH2R2 (l)
(minyak tak jenuh) (lemak jenuh)
Katalis arang (C) pada pembuatan asam khlorida: H2 (g) + Cl2 (g) → 2 HCl (g)
2.13 Cara kerja Katalis Heterogen
Katalis dapat bekerja dengan membentuk senyawa antara atau mengabsorpsi zat yang direaksikan. Sehingga katalis dapat meningkatkan laju reaksi, sementara katalis itu sendiri tidak mengalami perubahan kimia secara permanen. Cara kerjanya yaitu dengan menempel pada bagian substrat tertentu dan pada akhirnya dapat menurunkan energi pengaktifan dari reaksi, sehingga reaksi berlangsung dengan cepat. Secara umum proses suatu reaksi kimia dengan penambahan katalis dapat dijelaskan sebagai berikut. Zat A dan zat B yang direaksikan membentuk zat AB dimana zat C sebagai katalis.
A + B → AB (reaksi lambat)
Bila tanpa katalis diperlukan energi pengaktifan yang tinggi dan terbentuknya zat AB lambat. Namun, dengan adanya katalis C, maka terjadilah reaksi :
29
Energi pengaktifan diturunkan, maka AC terbentuk cepat dan seketika itu juga AC bereaksi dengan B membentuk senyawa ABC.
AC + B ABC (reaksi cepat).
Energi pengaktifan reaksi ini rendah sehingga dengan cepat terbentuk ABC yang kemudian mengurai menjadi AB dan C. sesuai reaksi
ABC → AB + C (reaksi cepat)
Ada dua macam katalis, yaitu katalis positif (katalisator) yang berfungsi mempercepat reaksi, dan katalis negatif (inhibitor) yang berfungsi memperlambat laju reaksi. Katalis positif berperan menurunkan energi pengaktifan, dan membuat orientasi molekul sesuai untuk terjadinya tumbukan. Akibatnya molekul gas yang teradsorpsi pada permukaan logam ini menjadi lebih reaktif daripada molekul gas yang tidak terabsorbsi. Prinsip ini adalah kerja dari katalis heterogen, yang banyak dimanfaatkan untuk mengkatalisis reaksi-reaksi gas.
Adapun mekanisme reaksi katalisis heterogen secara umum adalah sebagai berikut: 1. Difusi molekul reaktan ke permukaan katalis
2. Adsorpsi reaktan pada permukaan katalis. 3. Reaksi difusi reaktan pada permukaan katalis. 4. Reaksi dalam lapisan adsorpsi.
5. Desorpsi produk reaksi dari permukaan katalis. 6. Abfusi pada produk keluar dari permukaan katalis
Mekanisme katalisis heterogen menurut Langmuir-hinshelwood 1. Atom A dan B teradsorpsi kepermukaan katalis.
2. Atom A dan B berdifusi melalui permukaan. 3. Atom A dan B berinteraksi satu sama lain. 4. Sebuah molekul terbentuk dan terjadi desorpsi Mekanisme katalisis heterogen menurut Rideal-Eley 1. Atom A diadsorpsi oleh permukaan katalis (k).
Difusi adalah peristiwa mengalirnya / berpindahnya suatu zat dalam pelarut dari bagian berkonsentrasi tinggi ke bagian berkonsentrasi rendah. Proses difusi molekul reaktan kepermukaan atau difusi pada produk desorpsi merupakan proses yang paling lambat dan tidak dapat ditentukan kecuali pada penentuan proses teknik yang melibatkan penyerapan katalis.
2. Atom B lewat, kemudian berinteraksi dengan atom A yang ada dipermukaan katalis (k). Katalis menyediakan suatu permukaan dimana pereaksi-pereaksi (atau substrat) untuk sementara terjerap.
3. Atom A dan B saling berinteraksi satu sama lain 4. Sebuah molekul terbentuk dan terjadi desorpsi.
Terbentuk molekul produk dalam permukaan katalis kemudian terlepas molekul produk dari permukaan katalis. Ikatan dalam substrat-substrat menjadi lemah sehingga memadai terbentuknya produk baru. Ikatan antara produk baru dan katalis lebih lemah sehingga akhirnya terlepas. Permukaan padatan yang kontak dengan suatu larutan cenderung untuk menghimpun lapisan dari molekul-molekul zat terlarut pada permukaannya akibat ketidakseimbangan gaya-gaya pada permukaan. Difusi adalah peristiwa mengalirnya / berpindahnya suatu zat dalam pelarut dari bagian berkonsentrasi tinggi ke bagian yang berkonsentrasi rendah. Proses difusi molekul reaktan kepermukaan atau difusi pada produk desorpsi
30
kedalam gas utama merupakan proses yang paling lambat dan tidak dapat ditentukan kecuali pada penentuan proses teknik yang melibatkan penyerapan katalis.
Permukaan spesifik, Specific surface yang besar lebih diharapkan karena laju perpindahan massa akan meningkat sehingga akan meningkatkan laju reaksi kimia secara keseluruhan. Permukaan spesifik yang besar ini berhubungan dengan diameter partikel yang kecil dan seluruh permukaan porinya. Pori yang kecil membatasi kemampuan senyawa mendifusi ke dalam permukaan sebelah dalam, internal surface, demikian juga difusi produk keluar dari pori. Sehingga didalam pemilihan diameter pori dan keseragaman diameter pori untuk menyediakan specific surface dan tahanan difusi didalam permukaan sebelah dalam perlu diperhatikan. Tahanan difusi yang terjadi di dalam katalis disebabkan karena gesekan antar molekul maupun dengan dinding pori. Proses heterogen selalu melibatkan energi aktivasi yang cukup besar sedang difusi dalam gas tidak melibatkan energi aktivasi. Didalam adsorpsi dan desorpsi sangat lambat didalam poses heterogen karena keduanya melibatkan energi aktivasi yang cukup besar.
Secara umum, apabila suatu partikel padat terdispersi dalam suatu media cair, maka partikel tersebut dapat melalui beberapa mekanisme, yaitu :
1. Terjadinya peristiwa adsorpsi yang bersifat selektif terhadap spesies bermuatan yang terdapat didalam dispersi tersebut.
2. Terjadinya peristiwa ionisasi gugus-gugus yang terdapat pada permukaan padatan, sehingga meninggalkan muatan tertentu pada permukaan padat tersebut. Mekanisme ini sering terjadi ketika pada suatu permukaan partikel padat terdapat gugus yang mudah terionisasi, misalnya –COOH.
Adsorpsi kimia menghasilkan pembentukan lapisan monomolekular adsorbat pada permukaan melalui gaya-gaya dari valensi sisa dari molekul-molekul pada permukaan. Adsorpsi fisika diakibatkan kondensasi molekular dalam kapiler-kapiler dari padatan. Secara umum, unsur-unsur dengan berat molekul yang lebih besar akan lebih mudah diadsorpsi. Terjadi pembentukan yang cepat sebuah kesetimbangan konsentrasi antar-muka, diikuti dengan difusi lambat ke dalam partikel-partikei. Laju adsorpsi keseluruhan dikendalikan oleh kecepatan difusi dari molekul-moleku l zat terlarut dalam pori-pori kapiler dari partikel.
Bila digunakan logam atau oksidanya sebagai katalis maka kita berusaha untuk membuat permukaan yang dapat bekerja secara katalisis sebesar-besarnya. Untuk keperluan itu sering kali dipergunakan pendukung. Pendukung disini adalah dengan permukaan yang besar seperti batu apung, arang aktif oksida, aluminium, kalium oksida dan silikat oleh pelekatan bagian-bagian logam diatas bahan pendukung ini. Permukaan aktif kadang-kadang diperbesar sampai seratus kali lipat atau lebih. Karena itu bobot dari katalis dari yang sesungguhnya kadang-kadang hanya berjumlah sebagaian kecil dari seluruh bobot dari katalis yang sesungguhnya. Pada umumnya inhibitor adalah suatu zat kimia yang dapat menghambat atau memperlambat suatu reaksi kimia. Reaksi permukaan katalis dapat terhambat jika suatu substansi asing berikatan pada sisi aktif katalis sehingga memblok kepada subtrat molekul-molekul. Jenis penghambatan ini disebut peracunan dan penghambat atau katalis negatif tersebut merupakan racun katalis. Suatu katalis jika sudah terpakai beberapa kali maka aktivitasnya akan berkurang. Ini berarti bahwa kemampuan untuk mempercepat reaksi tertentu telah berkurang. Gejala ini dapat disebabkan oleh beberapa faktor diantaranya oleh suhu yang terlalu tinggi katalis dapat lumer sebagaian atau disenter, penyebab lain yaitu katalis dapat bereaksi dengan produk atau kotoran yang terdapat didalam bahan dasar. Penyebab yang terkenal dari pengurangan aktivitas katalis adalah belerang dan persenyawaan belerang, air lembab (vouch) dan uap minyak dapat dapat dimasukkan kedalam kelompok ini yang dikenal dengan racun katalis atau poisoning catalyst. Bila setelah beberapa waktu, aktivitas katalis telah turun sampai dibawah
31
minimum yang dapat diterima, katalis itu harus apkir atau berhenti. Beberapa katalis yang tidak aktif dapat diperbaiki kembali dengan jalan regenerasi. Dalam hal ini dipergunakan uap, zat cair, zat asam atau gas lain. Katalis sering juga digenerasi dengan pengolahan memakai asam mineral, dimana logamnya dapat larut.
Didalam dunia industri katalis yang digunakan: 1. Harus murni
2. Stabil tehadap panas
3. Memiliki waktu hidup yang panjang 4. Dapat diregenerasi
5. Tahan terhadap keracunan
6. Kesederhanaan dalam cara pembuatannya 7. Mudah didapat
8. Harganya murah
2.14 Contoh Katalis Heterogen
Sebagian besar reaksi antara daua phase misalnya pada interface dari gas – padat atau gas–cair, biasanya yang bertindak sebagai katalis adalah yang lebih padat, karenanya luas permukaan dari padatan harus benar – benar diperhatikan. Beberapa contoh yang dilakukan oleh dunia industri lain katalis akan menghasilkan lain produk :
a. Dekomposisi organik
C2H5OH (Al2O3 , 300oC ) C2H4 + H2O
C2H5OH (Cu , 300oC ) CH3CHO + H2O
b. Dehidrogenasi
C4H8 (Al2O3, Cr2O3 ) CH2=CHCH=CH2 + H2
Ethyl Benzene (Fe2O3, 650oC) Styrene + H2
c. Hidrasi hidrokarbon tak jenuh
Dengan adsorben asam posforat dan katalis celite maka
C2H4 + H2O (300oC ) C2H5O H
d. Hidroclorinasi
Vinil clorida dibuat dengan katalis merkuriclorida dan arang dari reaksi
CH CH + HCl (200oC) CH2=CHCl
Umumnya katalis heterogen berupa zat padat yang terdiri dari logam atau oksida logam. Contoh-contoh dari katalis heterogen adalah zeolit, CaO, MgO, dan resin penukar ion. Proses katalitik menggunakan katalis heterogen dalam industri pertama kali pada tahun 1857, menggunakan Pt untuk mengoksidasi SO2 menjadi SO3 dalam larutan asam.
32
BAB III
PENUTUP
3.1 Kesimpulan
Katalis adalah suatu zat yang mempercepat laju reaksi reaksi kimia pada suhu tertentu, tanpa mengalami perubahan atau terpakai oleh reaksi itu sendiri. Katalis terbagi menjadi tiga yaitu katalis homogeny dan katalis heterogen. Katalis memiliki fungsi utama antara lain dapat mempercepat laju reaksi. Katalis sangat berperan penting dalam reaksi kimia terutama dalam berbagai industri. Aplikasi katalis sangat banyak dalam dunia perindustrian salah satunya yang diterapkan di industri ammonia Pupuk Kaltim Pada Low
Temperatur Shift Converter menggunakan katalis campuran dari ZnO, CuO dan
Cr2O3/Al2O3 selain dapat digunakan untuk mempercepat suatu reaksi berlangsung katalis
ini bahkan dapat mengakomodasi suhu pada medium temperature sekitar 300oC. Namun
33
Daftar Pustaka
Twigg, Martin V.,“Catalyst Handbook: Second Edition”, Wolfe Publishing LTd. Cleveland, England.1989.
Smith, Byron RJ.,”A Review of The Water Gas Shift Reaction Kinetics”, International Journal of Chemical Reactor Engineering, Volume 8. 2010.
Team Start-Up Pabrik Kaltim-3. Kumpulan Bahan Training Operator Kaltim Pasifik
Amoniak, Buku I : Proses
Team Pabrik Kaltim-3.”Manual Operation”. PKT Bontang.
Defani, S. Makalah Teknologi Katalis. Institut Teknologi Bandung. 2016.
Kresna, dkk. Makalah Peran Katalis Dalam Industri Kimia. Institut Teknologi Adhi Tama Surabaya. 2015.