Prof. Dr. Ir. Trinil Susilawati, M.S.
Press
Perpustakaan Nasional RI: Katalog Dalam Terbitan (KDT)
Spermatologi
UB Press
Cetakan Pertama, April 2011
Hak Cipta dilindungi Undang-Undang All Right Reserved
Penulis : Prof. Dr. Ir. Trinil Susilawati, M.S.
Perancang Sampul : Donny Yudhia Hersanjaya, S.T. (UB Press)
Penata Letak : Ali Manshur, S.Sos. (UB Press)
Penerbit:
Universitas Brawijaya Press (UB Press) Anggota IKAPI No. 017/JTI/94
Jl. Veteran (Universitas Brawijaya) Malang 65145 Indonesia
Telp.: +62341-551611-Pswt 376 Fax. : +62341-565420
Email: ubpress@gmail.com http://www.ubpress.ub.ac.id
Penerbitan Elektronik Pertama & Terbesar di Indonesia
ISBN: 978-602-8960-04-5 xviii+176 hal, 15.5 cm x 23.5 cm
Dilarang keras memfotokopi atau memperbanyak sebagian atau seluruh buku ini tanpa seizin tertulis dari penerbit
v
Alhamdulillahhirrobil alamin, buku yang berjudul SPERMATOLOGI yang berisikan tentang kajian yang mendasar tentang isiologi spermatozoa yang meliputi: Kapasitasi, Reaksi Akrosom dan Fertilisasi, Selain itu di dalam buku ini dilengkapi dengan Inseminasi Buatan yang merupakan pengembangan teknologi yang berdasar pada Fisiologi spermatozoa.
Buku ini dibuat banyak berasal dari buku “Farm animal reproduct-ion” diedit oleh ESE Hafez dan buku “Mammalian Fertilization“ karangan Yanagimachi 1988, dengan tujuan untuk dapat membantu mahasiswa S1, S2, dan S3, serta peneliti yang mendalami tentang proses fertilisasi ataupun yang berkaitan dengan proses fertilisas serta peneliti atau praktisi yang mendalami teknik Inseminasi Buatan
Pada kesempatan ini saya mengucapkan terimakasih kepada Mayang Adelia Puspita, S.P., yang bersedia membantu untuk melakukan editing serta Prof. Dr. Drh. Aulani’am, yang bersedia membaca dan memberikan kritik dan saran sehingga lebih mudah difahami dan bermanfaat untuk pembaca.
Besar harapan saya buku ini dapat bermanfaat bagi pembaca, dan kami mengetahui bahwa buku ini masih jauh dari kesempurnaan, maka kritik dan saran untuk perbaikan edisi selanjutnya sangat diharapkan.
Penulis
KATA PENGANTAR
vii
DAFTAR ISI
Kata Pengantar ...v
Daftar Isi ...vii
Daftar Tabel ...xi
Daftar Gambar ...xiii
Pendahuluan ...1
Bab I. Sel Spermatozoa ...3
1.1. Morfologi Spermaozoa ...3
1. Kepala spermatozoa ...5
2. Akrosom ...5
3. Ekor spermatozoa ...6
1.2. Komposisi Kimia Spermatozoa ...7
1. Unsur Inorganik ...8
2. Komponen Biokimiawi ...8
3. Kromosom sex X dan Y pada spermatozoa. ...9
4. Spermatozoa X dan Y pada Unggas ...10
1.3. Seminal Plasma ...11
1. Penghasil seminal plasma (kelenjar assesories) ...12
2. Unsur Biokimia dari seminal plasma ...14
1.4. Metabolisme Spermatozoa ...15
1.5. Respirasi Spermatozoa ...18
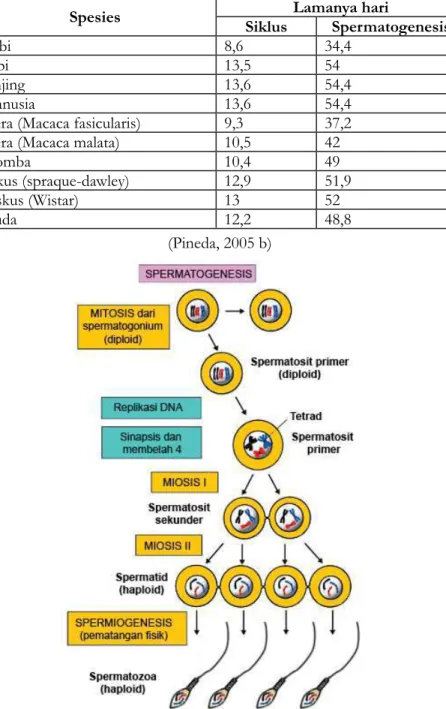
BAB II. Spermatogenesis ...21
2.1. Spermatositogenesis ...24
2.2. Spermiogenesis. ...26
viii
2.4. Fungsi Steroidogenic ...32
2.5. Faktor-faktor yang mempengaruhi spermatogenensis ...34
2.6. Peran skrotum dalam termoregulasi...36
BAB III. Kapasitasi Spermatozoa ...37
3.1. Kapasitasi Spermatozoa Secara In Vivo ...40
3.2. Kapasitasi Spermatozoa Secara In Vitro ...41
3.3. Faktor-faktor yang Mempengaruhi Kapasitasi ...42
1. Variasi Individu ...42
2. Asal spermatozoa ...42
3. Terdapatnya Kumulus Oophorus. ...43
3.4 Peristiwa-peristiwa yang Terjadi Pada Spermatozoa Selama Kapasitasi ...44
1. Perubahan-perubahan dalam adenylate cyclase ...44
2. Perubahan pada metabolisme ...45
3. Perubahan dalam ion-ion intraselluler ...46
4. Perubahan pada akrosom ...48
5. Perubahan pada Inti ...48
6. Perubahan pada selaput Plasma ...48
BAB IV. Reaksi Akrosom ...51
4.1. Enzim-enzim Akrosom ...51
4.2. Arti Fungsional Reaksi Akrosom ...53
4.3. Morfologi dan Kinetika Reaksi Akrosom ...54
1. Perbedaan Nyata antara Reaksi Akrosom “True” dan “False”. ...54
2. Sifat Alamiah Exocytotic pada Reaksi Akrosom ...56
3. Waktu Reaksi Akrosom ...56
4. Faktor penyebab alami reaksi akrosom ...57
4.4. Mekanisme Reaksi Akrosom ...58
ix
BAB V. Pembuahan (Fertilisasi) ...65
5.1. Penetrasi Spermatozoa Pada Sel Telur ...66
5.2. Penetrasi Spermatozoa Dalam Menembus Kumulus Oophorus ...67
5.3. Penetrasi Spermatozoa ke Dalam Zona Pellusida. ...68
1. Karakteristik Kimia Zona Pellusida ...68
2. Penyerangan Spermatozoa Pada Zona ...69
3. Bagaimana reseptor-reseptor spermatozoa pada zona dan reseptor-reseptor zona saling berinteraksi satu dengan lainnya? ...72
4. Penetrasi spermatozoa dalam Menembus Zona Pellusida ...72
5. Penggabungan Spermatozoa dengan Zona. ...75
5.4. tempat-tempat inisiasi fusi spermatozoa dan telur ...76
5.5. kejadian-kejadian sesudah fusi...77
5.6 aktivitas sel telur ...78
5.7 exocytosis granula-granula cortical dan hambatan polysperma ...81
5.8 dekondensasi nukleus spermatozoa dalam sitoplasma telur ...88
BAB VI. Uji Kualitas Semen ...91
6.1. Uji Makroskopis (Volume, Warna dan pH)...92
6.2. Uji Mikroskopis ...93
1. Uji Motilitas Massa ...93
2. Motilitas Individu ...95
3. Persentase Hidup Mati (Viabilitas) ...96
4. Konsentrasi Spermatozoa ...98
5. Abnormalitas Spermatozoa ... 103
x
7. Teknik Pemeriksaan kerusakan membran
spermatozoa ... 106
8. Pengamatan membran spermatozoa dengan mikroskop elektron ... 108
6.3 Pengamatan kapasitasi spermatozoa dengan pewarnaan Chlortetracycline (CTC) ... 112
6.4 Evaluasi status akrosom dengan FITC- Con A dan Methilen Blue ... 113
6.5 Hypoosmotic swelling Test (HOS TES). ... 114
6.6. Uji Biokimia ... 116
6.7. Uji Biologis ... 117
6.8 CASA ... 117
6.9. Uji Kualitas spermatozoa yang lain ... 122
6.10. Produksi Semen ... 122
BAB VII. Pengenceran, Pendinginan dan Pembekuan Semen ... 125
7.1. Media Pengenceran ... 125
1. Pengencer Tris Aminomethan Kuning telur ... 128
2. AndroMed® ... 130
3. Pengencer TCM 199 Kuning Telur ... 131
4. Pengencer Alternatif ... 133
7.2. Prosesing semen ... 134
7.3. Prinsip-prinsip pembekuan sel ( Cryobiologi) ... 135
7.4. Banyaknya pengenceran ... 138
7.5. Pembekuan semen sapi ... 139
7.6. Thawing semen ... 140
7.7. Kebijakan didalam menggunakan teknik Inseminasi Buatan ... 140
BAB VIII. Inseminasi Buatan ... 143
xi
8.2. Libido dan kualitas semen ... 146
8.3. Teknik Inseminasi Buatan ... 149
8.4. Teknik Inseminasi Buatan pada Kambing ... 150
BAB IX. Faktor-Faktor Yang Mempengaruhi Inseminasi Buatan ... 153
9.1. Kualitas semen ... 153
9.2. Sumber Daya Manusia ... 155
9.3. Fisiologi Sapi Betina ... 158
9.4. Evaluasi keberhasilan Inseminasi Buatan ... 160
Daftar Pustaka ... 163
xiii
DAFTAR TABEL
1.1. Karakteristik dan komponen kimia dalam semen ternak ...12
1.2. Kelenjar asesoris pada hewan domestik ...14
1.3 Umur, Berat dan karakteristik kualitas Semen saat pertama kali dikawinkan...15
1.4 Manipulasi in vitro pada spermatozoa ...19
2.1. Lama siklus epithel seminiferus dan spermatogenesis pada beberapa spesies mammalia ...25
2.2. Sekresi dan fungsi Sel sertoli ...32
2.3. Waktu Migrasi didalam epididimis ...35
3.1. Kondisi kapasitasi pada spermatozoa yang diejakulasikan ...38
4.1 Enzim-enzim yang terdapat pada Akrosom ...52
6.1. Score berdasar gerak massa ...94
6.2. Faktor-faktor endogenous yang mempengaruhi motilitas spermatozoa ...94
6.3. Faktor-faktor eksogenous yang mempengaruhi motilitas spermatozoa ...95
6.4. Nomenklatur dari semen analisis ... 102
6.5. Konsentrasi semen domba hubungan dengan konsistensi ... 102
6.6. Standar parameter motilitas menggunakan CASA pada beberapa hewan ... 121
7.1. Jumlah straw yang dihasilkan, penyimpanan dan hasil IB dengan menggunakan semen beku dalam kondisi rata-rata ... 128
7.2 Komposisi kimia pengencer tris aminomethan dalam 100 ml ... 129
xiv
7.4 Karakteristik bioisika dari beberapa krioprotektan ... 138 8.1 Frekuensi koleksi semen dan persiapan vagina buatan ... 189 8.2 Rata-rata lama ejakulasi, jumlah fals mounting dan lama libido pada
berbagai bangsa sapi potong ... 147 8.3 Kualitas semen pada berbagai bangsa sapi potong ... 147 8.4 Deteksi berahi dan prosedur Inseminasi Buatan ... 149
xv
1.1 Perbandingan berbagai spermatozoa ternak dan vertebrata lainnya ...3
1.2 Spermatozoa sapi diamati dengan mikroskop Differensial Inferens Contras (Nomarschi) ...4
1.3 Struktur internal spermatozoa sapi ...4
1.4 Potongan sagital pada kepala spermatozoa yang Terdapat beberapa bagian ...5
1.5 Axonema spermatozoa ...7
1.6 Mitokondria pada bagian leher spermatozoa Diamati dengan Transmisi Elektron Mikroskop (TEM) ...7
1.7 Kelenjar-kelenjar penghasil seminal plasma ...16
1.8 Jaringan kelenjar asesoris yang sebagai penghasil seminal plasma ...13
1.9 Jaringan epididimis tempat pematangan spermatozoa ...13
2.1 Skematis testis dan aluran reproduksi jantan ...21
2.2 Spermatozoa danbagian sel didalam tubuli seminiferi ...22
2.3 Sel-sel di dalam tubuli seminiferi ...23
2.4 Histologi Testis ...23
2.5 Pembelahan spermatogenesis ...25
2.6 Tahapan Miosis 1 ...26
2.7 Tahapan Miosis II ...26
2.8 Perubahan sel dari spermatid hingga spermatozoa ...26
2.9 Tahapan pembelahan spermiogenesis...27
2.10 Proses spermatogenesis pada setiap siklus ...29
2.11 Hubungan kontrol fungsi hormon dalam testis ...31
2.12 Fungsi isiologis gonadocrinin pada sel sertoli, leydig dan sel granulosa ...33
xvi
2.13 Interaksi paracrine antara sel leydig dan sel sertoli ...33
2.14 Sistesis dan produksi testosteron oleh sel leydig ...34
3.1 Gambaran spermatozoa yang belum kapasitasi, ...39
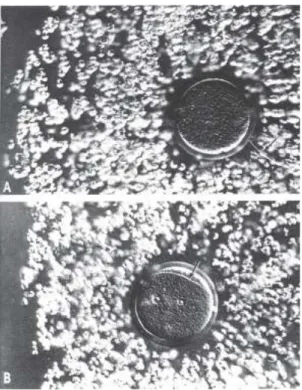
3.2 Photomicrographs yang menunjukkan kumulus oophorus yang menyelimuti sel telur (Atas), dan bawah adalah setelah terjadi fertilisasi pada Chinese hamster. ...44
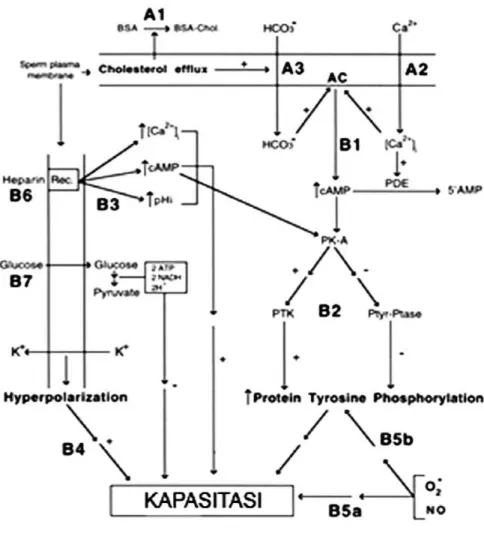
3.3 Mekanisme molekuler pada proses kapasitasi ...45
3.4 Mekanisme molekuler pada peristiwa kapasitasi spermatozoa ...47
3.5 Mekanisme molekuler yang terjadi pada membran Spermatozoa selama kapasitasi ...47
4.1 Terjadinya reaksi akrosom pada saat spermatozoa menempel pada jelli di luar sel telur. ...52
4.2 Spermatozoa yang telah mengalami reaksi acrosom dengan pewarnaan FITC Concanavalin A ...53
4.3 Diagram yang menunjukkan tahapan reaksi akrosom. (Ac) Acrosomal cap;(Eg)Equatorial Segment of the acrosome;(IAM) inner acrosomal membrane ...54
4.4 Proses reaksi akrosom pada manusia ...55
4.5 Skematis dari proses reaksi Akrosom ...56
4.6 Tahapan hilangkan ion kalsium selama proses kapasitasi dan reaksi akrosom menggunakan pewarnaan CTC ...59
4.7 Mekanisme molekuler pada proses reaksi akrosom ...60
4.8 Scanning Electron Microscop spermatozoa tanpa Akrosom ...61
4.9 Pola gerak hiperaktifasi pada spermatozoa ...62
4.10 Mekanisme molekuler kapasitasi dan hiperaktifasi ...63
5.1 Ilustrasi perjalanan spermatozoa sampai fertilisasi ...66
5.2 Ilustrasi proses penembusan sel-sel kumulus dan oosit oleh spermatozoa ...68
5.3 Masuknya spermatozoa ke Zona dengan adanya pergerakan ...75
xvii
5.5 Diagaram reaksi akrosom dan fusi antara sel telur dan spermatozoapada tikus. (Ac) Acrosome; (IAM) Inner acrosomal membrane; (MV) Egg microvilli; (PA) post acrosomal region; (PM) Sperm plasma
membrane; (N) Nucleus; (Z) Zona pellucida ...76
5.6 Diagram tahapan fusi spermatozoa selama fertilisasi dan penggabungan dengan vittelin. (Eg) Equatorial segment of the acrosome ...77
5.7 Mekanisme masuknya spermatozoa kedalam sel telur ...78
5.8 Diagram aktivasi sel telur dan perkembangan pronuclear pada Tikus ...79
5.9 Secara seri gambaran micrograph menunjukkan keluarnya intracellular Ca++ saat fusi antara spermatozoa dengan sel telur pada hamster ...81
5.10 Mekanisme molekuler saat terjadinya fertilisasi dan block Polyspermi ...83
5.11 Reaksi molekuler didalam oosit saat spermatozoa menempel pada zona pellusida...84
5.12 Sel telur yang telah difertilisasi pada kelinci(A) dan manusia (B) ...86
5.13 Proses masuknya spermatozoa dalam oosit pada proses fertilisasi ...87
5.14 Tahapan proses masuknya spermatozoa ke dalam oosit...87
5.15 Pembelahan sel Setelah terjadinya pertemuan pronuclei jantan dan betina ...90
6.1 Pola gerak spermatozoa ...96
6.2 Viabilitas spermatozoa ...97
6.3 Penghitungan spermatozoa dengan haemositometer ...99
6.4 Posisi spermatozoa yang dihitungmenggunakan haemositometer ... 100
6.5 Penghitungan spermatozoa dengan chamber makler ... 101
6.6 Gambar Abnormalitas Spermatozoa ... 104
6.7 Spermatozoa mengalami kelainan ... 105
6.8 Spermatozoa Normal dan abnormal pada membrannya mengguna-kan pewarnaan CTC dan diamati dengan mikroskop epi luoresen ... 107
xviii
6.9 Spermatozoa Normal dan abnormal pada membrannya ... 107
6.10 Spermatozoa yang mengalami kerusakan akrosom pewarnaan eosin negrosin dengan pembesaran 1000X ... 108
6.11 Spermatozoa Normal dan abnormal pada membrannya diamati dengan scanning electrone microscope ... 108
6.12 Kerusakan mambran spermatozoa ... 109
6.13 Flow cart peparasi spermatozoa untuk pengamatan mikroskop elektron transmisi ... 109
6.14 Hasil pengamatan status ekrosom dengan methileen Blue ... 114
6.15 Spermatozoa Normal dan abnormal pada Integritas membrannya ... 115
6.16 Hasil uji integritas membran babi ... 116
6.17 Kecepatan dan Gerak Spermatozoa ... 118
7.1 Melanisme masuknya cryoprotectan di dalam sel ... 137
7.2 Prosedur pembekuan semen hasil sexing menggunakan pengencer tris Aminomethan Kuning Telur ... 141
7.3 Prosedur pembekuan semen hasil sexing menggunakan pengencer Andromed® ... 142
8.1 Penampungan semen menggunakan vagina buatan ... 144
8.2 Penampungan semen babi dengan menggunkan pantom ... 145
8.3 Penampungan semen dengan menggunakan metode massage ... 145
8.4 Berbagai alat yang digunakan untuk IB kambing ... 150
8.5 Tahapan IB pada kambing ... 152
9.1 Faktor-faktor yang mempengaruhi keberhasilan IB ... 154
9.2 Peralatan penyimpanan semen beku dalan nitrogen cair ... 154
9.3 Waktu yang tepat untuk Inseminasi Buatan ... 156
9.4 Waktu yang tepat untuk IB pada sapi ... 156
9.5 Teknik Inseminasi Buatan ... 157
1
PENDAHULUAN
Spermatozoa sebelum mengalami fertilisasi atau pembuahan mengalami perubahan struktur dan fungsinya. Perubahan struktur dan fungsi spermatozoa ini mulai terjadi pada saat spermatogenesis, di dalam saluran reproduksi jantan dan saluran reproduksi betina, hingga sampai terjadinya proses fertilisasi di dalam ampulla. Perubahan struktur dan fungsi spermatozoa saat di dalam salu-ran reproduksi betina di sebut dengan kapasitasi spermatozoa yang dilanjutkan dengan reaksi akrosom.
Kapasitasi spermatozoa pada dasarnya adalah perubahan isiologis yang di dalam buku ini mulai dibahas proses kapasitasi spermatozoa secara in
vivo dan in vitro, faktor-faktor yang mempengaruhi kapasitasi yang dijelaskan secara in vitro serta peristiwa-peristiwa yang terjadi pada spermatozoa selama mengalami kapasitasi.
Setelah proses kapasitasi dilanjutkan dengan reaksi akrosom, sehingga spermatozoa mampu membuahi sel telur. Untuk lebih jelasnya tentang peristiwa reaksi akrosom ini ,maka di mulai dengan penjelasan tentang enzim-enzim yang ada di dalam akrosom, arti fungsional terjadinya akrosom, morfologi dan kine-tika reaksi akrosom, mekanisme reaksi akrosom, serta terjadinya hiperaktivasi spermatozoa yang bersamaan dengan proses reaksi akrosom.
Proses fertilisasi dimulai dari penetrasi spermatozoa pada lapisan terluar oosit yaitu kumulus oophorus yang melibatkan proses enzimatis, selanjutnya adalah penetrasi spermatozoa ke dalam lapisan terluar dari oosit yaitu zona pellusida, peristiwa penyerangan spermatozoa pada zona pellusida, Reseptor-reseptor spermatozoa pada zona dan Reseptor-reseptor-Reseptor-reseptor zona saling berinteraksi satu dengan yang lainnya. Proses penetrasi spermatozoa dalam menembus zona pellusida dan kejadian-kejadian setelah terjadinya fusi antara spermatozoa dengan sel telur.
2
Spermatozoa setelah melakukan penetrasi oosit, menyebabkan aktivasi dari oosit, selanjutnya terjadi proses exocytosis granula-granula cortical dan terjadi proses penghambatan polisperma, Sedangkan proses fertilisasi tersebut diakhiri dengan terjadinya dekondensasi nukleus spermatozoa dalam sitoplasma.
Fisiologi spermatozoa hingga terjadinya fertilisasi mendasari perkem-bangan bioteknologi reproduksi meliputi Inseminasi Buatan (IB), Transfer Embrio, Fertilisasi In Vitro dan Manipulasi Embrio, sedangkan tujuan dari Bioteknologi Reproduksi pada ternak bertujuan untuk memperbaiki Mutu Genetik ternak, sedangkan pada manusia adalah untuk membantu pasangan suami istri untuk mendapatkan anak secara bantuan. Hingga saat ini IB yang telah terbukti dapat meningkatkan mutu genetik ternak dan dapat diterima oleh masyarakat, sehingga saat ini IB telah dilaksanakan secara swadaya masyarakat. Selain itu IB merupakan cara yang ampuh untuk meningkatkan populasi ternak dan produksi ternak baik secara kualitatif maupun kuantitatif, sehingga dapat meningkatkan pendapatan baik petani maupun pemerintah daerah.
3
Spermatozoa dibentuk dalam tubuliseminiferi yang berada di dalam testes. Tubulus ini berisi rangkaian sel yang kompleks, yaitu perkembangan atau pembelahan sel dari sel germinal sampai dengan terbentuknya spermatozoa atau gamet jantan. Bentuk spermatozoa yang sempurna adalah merupakan sel yang memanjang, yang terdiri dari kepala yang tumpul yang di dalamnya terdapat
nucleus atau inti, dan ekor yang mengandung apparatus untuk bergerakan sel. Pada kepala terdapat akrosom yang memiliki struktur dinding yang rangkap yang terletak diantara membran plasma bagian anterior nucleus, Leher menghubung-kan kepala dan ekornya (lagela) yang dibagi lagi menjadi bagian tengah, pokok dan akhir yang bagian–bagian tersebut mempunyai struktur yang berbeda. 1.1. MORFOLOGI SPERMATOZOA
Spermatozoa pada masing-masing spesies mempunyai ukuran yang berbeda-beda akan tetapi bentuknya hampir sama. Perbedaan relatif ukuran dan bentuk spermatozoa pada berbagai hewan seperti pada gambar 1.1.
Gambar 1.1. Perbandingan berbagai spermatozoa ternak dan verte-brata lainnya (Garner and Hafez, 2008)
I
BAB
4
Gambar 1.2. Spermatozoa sapi diamati dengan mikroskop Differensial Inferens Contras (Nomarschi) (Susilawati, 2000)
Gambar 1.3. Struktur internal spermatozoa sapi.
Pada kepala spermatozoa terdapat akrosom, sedangkan dan pada ekor secara anatomis terdapat bagian midle piece, principal piece dan bagian ekor yang terdapat central axonemal yang terdapat 9+2 mikrotubulus, dan di balut dengan
outer ibril, lapisan mitochondria yang membentuk kolom longitudinal pada
dorsal dan ventral dan circumferial ribs.
A. Kepala
B. Leher C. Mid piece D. Principal piece E. Endpiece
7. Rest of the distal centriole
8. Thick outer longitudinal ibers 9. Mitokondria
10. Aksoneme
11. Anulus 12. Ring ibers
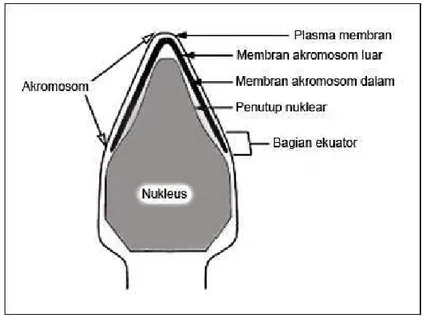
1. Plasma membran
2. membran akrosom luar 3. Akrosom
4. membran akrosom dalam 5. Nukleus
5
1.1.1. Kepala spermatozoa
Bentuk utama dari kepala spermatozoa adalah oval, tumpul mengandung nukleus dengan kromatin yang padat sekali. Kromatin terdiri dari DNA yang kompleks dari protein dasar yang dikenal sebagai protamine sperma. Jumlah kromosom spermatozoa adalah haploid atau setengah dari sel somatik, Sel spermatozoa yang haploid ini dihasilkan dari pembelahan secara meiosis sel yang terjadi selama pembentukan spermatozoa atau proses spermatogenesis. 1.1.2. Akrosom
Bagian anterior akhir dari inti spermatozoa dibungkus oleh akrosom tipis, lapisan membran yang menutup ini terbentuk pada saat proses pemben-tukan spermatozoa. Pada akrosom berisi beberapa enzim hidrolitik antara lain
proacrosin, hyaluronidase, esterase dan asam hidrolase yang dibutuhkan pada proses fertilisasi.
Bagian equator akrosom ini merupakan bagian yang penting pada spermatozoa, hal ini karena bagian anterior post akrosom ini yang mengawali penggabungan dengan membran oosit pada proses fertilisasi.
Gambar 1.4. Potongan sagital pada kepala spermatozoa yang terdapat beberapa bagian
6
Akrosom terdiri dari apical (apical ridge), Principal dan bagian equatorial. Membran bagian luar pada bagial apical dan principal segments disebut dengan akrosom luar. Juga terdapat hubungan dalam akrosom, yaitu membran dalam dan membran luar dengan inti dan plasma membran.
1.1.3. Ekor spermatozoa
Ekor spermatozoa dibagi menjadi leher, bagian tengah, pokok dan akhir. Leher menghubungkan potongan bagian basal plate bagian posterior dan bagian terbawah dari nukleus. Bagian basal plate pada bagian leher berlanjut sampai akhir, dengan sembilan serabut kasar yang mengeras pada seluruh bagian ekor.
Inti bagian tengah pada ekor bersama dengan seluruh bagian ekor mem-bentuk aksonema. Aksonema ini terdiri dari sembilan pasang mikrotubulus yang tersusun di sekitar pusat ilamen. Pada bagian tengah, susunan mikrotubulusnya adalah 9+2 yang dikelilingi oleh sembilan serabut kasar padat yang berhubungan dengan sembilan pasang aksonema. Aksonema dan iber yang padat pada bagian tengah, sekelilingnya dibungkus oleh mitokondria. Pembungkus mitokondria ini tersusun berupa pilinan yang mengelilingi serabut longitudinal ekor, Mitokon-dria menghasilkan energi yang dibutuhkan untuk pergerakan spermatozoa. Pembungkus mitokondria berakhir pada annulus.
Bagian pokok yang merupakan lanjutan dari annulus dan memanjang mendekati bagian akhir ekor, terdiri dari aksonema yang terpusat dan bergabung dengan serabut kasar. Lapisan ibrous diperkirakan memberikan stabilitas untuk gerakan ekor. Bagian akhir, merupakan batas posterior dari lapisan ibrous yang hanya berisi aksonema yang dilapisi membran plasma.
Aksonema bertanggung jawab pada pergerakan spermatozoa. Sepasang mikrotubulus tersusun dari 9 + 2, umumnya dinding ekor melipat seperti gelom-bang dengan gerakan menggeser antara sepasang daerah yang berdekatan.
Droplet protoplasmic atau sitoplasmik biasanya tidak terdapat spermato-zoa yang diejakulasikan, tersusun dari residu sitoplasmik. Meskipun termasuk spermatozoa abnormal yang diejakulasikan dari berbagai spesies, droplet yang terdapat di daerah leher, yang diketahui sebagai “Droplet Proximal”, sedangkan yang dekat annulus, disebut “Droplet Distal”.
7
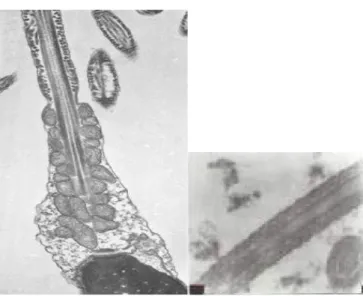
Gambar 1. 5. Axonema spermatozoa
Gambar 1.6. Mitokondria pada bagian leher spermatozoa Diamati dengan Transmisi Elektron Mikroskop (TEM)
1.2. KOMPOSISI KIMIA SPERMATOZOA
Komponen kimia spermatozoa adalah asam nukleat, protein dan lemak. Kurang lebih sepertiga dan berat kering sel spermatozoa adalah intinya kro-matin inti terdiri dari kira-kira setengah DNA dan ½ protein. Topi akrosom mengandung berbagai protein enzim. Beberapa struktur protein enzim dan lemak ditemukan di ekor.
8
1. Unsur Inorganik
Spermatozoa mengandung phospor, nitrogen, dan sulfur yang banyak. Sebagian phospor berhubungan dengan DNA, sedangkan sulfur berasal dari komponen protein inti dan keratinoid pada bagian ekor.
2. Komponen Biokimiawi
Inti spermatozoa terdiri dari kromatin yang DNA-nya distabilkan dengan konjugasi menggunakan protein khusus yaitu sebagai “Spermatozoa Histone”. Inti spermatozoa pada beberapa spesies mengandung sebagian kecil spermatozoa histone dengan berat molekul rendah, yang diketahui sebagai “Protamin”, se-dangkan spermatozoa pada spesies lain mengandung jumlah yang bervariasi pada arginin yang kaya histone. Protein dasar inti penting untuk kondensasi dan stabilisasi DNA dengan ikatan sulfhidril. Peningkatan ikatan sulfhydryl berperanan pada perjalanan spermatozoa saat diepididimis selama perjalanan menuju ke fertilisasi.
Saat spermatozoa mengalami reaksi akrosom yang sebagian besar bahan dalam akrosom dikeluarkan yang disebabkan penggabungan plasma dan membran akrosom bagian luar. Fungsi dari masing-masing enzim adalah sebagai berikut: Hialuronidase menyebabkan menyebarnya sel kumulus yang mengelilingi ovum yang baru diovulasikan menyebar. Proakrosin adalah pre-cursor enzim proteolitik akrosin, yang dapat membantu dalam mempersingkat penetrasi spermatozoa melalui zona pellusida. Namun secara bioisika, peng-induksian spermatozoa dapat secara mekanik menetrasi zona pellusida dengan cara gerakannya (gerakan spermatozoa).
Lapisan mitokondria spermatozoa, yang kaya fosfolipid, dengan berbagai ukuran mitrokondria pada beberapa spesies dan dalam cairan kimia yang dibuat. Spermatozoa mengandung enzim cytochrome oksidase pada system pernafasan dan tahap glikosis. Metabolisme enzim lain, khususnya laktat dehidrogenase yang dikenal sebagai LDH-X, juga terdapat energi yang kaya nukleotida ade-nin dan guaade-nin adalah komponen penting dalam energi spermatozoa sebagai protein aksonema, tubulin dan dynein. dynein merupakan protein dasar dalam mikrotubulus aksonema yang ditunjukkan oleh ikatan divalent ATP-ase yang diaktifkan.
9
3. Kromosom sex X dan Y pada spermatozoa mammalia.Pejantan pada mammalia menentukan jenis kelamin anak yang dila-hirkan. Sebagai hasil pembelahan reduksi selama spermatogenesis, spermatozoa hanya mengandung setengah jumlah DNA pada sel-sel somatik dari spesies yang sama dan terbentuklah dua macam spermatozoa yaitu spermatozoa yang berkromosom X dan spermatozoa yang berkromosom Y. Meskipun diduga kandungan DNA antara kromosom X dan Y pada spermatozoa hanya sekitar 4% untuk ternak, perbedaan kecil ini dapat diketahui dengan cara menggunakan pewarnaan luoresen dan Flow cytometer. Spermatozoa yang mengandung kromosom X (spermatozoa X) jika terjadi fertilisasi akan menghasilkan embrio betina, sedangkan spermatozoa yang mengandung kromosom Y (spermato-zoa Y) akan menghasilkan embrio jantan, karena pada kromosom Y terdapat
sex determining Region Y gen (SRY) yang menentukan terbentuknya testis pada hewan jantan (Bianchi, 1991; Graves, 1994 dan Koopman,1995). Panjang dan lebar spermatozoa sapi kira-kira 8-10 x 4-4,50 mikron, tebal kepala 0,50 – 1,50 mikron, bagian tengah spermatozoa mempunyai panjang 10 – 15 mikron dan diameternya sekitar 1 mikron, panjang ekor spermatozoa adalah 35-45 mikron dengan diameter 0,4-0,8 mikron, sedang panjang keseluruhan mencapai 50-70 mikron (Toelihere, 1985).
Susilawati dkk (1999) Hasil pengukuran kepala spermatozoa sapi sebanyak 2000 spermatozoa didapatkan rata panjang kepala 8,75 ± 0,25 µm, dan rata-rata lebar kepala 4,12 ± 0,22 µm. Hasil pengukuran besar kepala spermatozoa (panjang x lebar) pada semen segar diperoleh rata-rata 32,75 ± 2,36 µm2.
Flow cytometer dimodiikasikan untuk mendapatkan jenis spermatozoa
dengan populasi yang murni (seleksi jenis kelamin). Ketika spermatozoa yang telah diseleksi mendekati kemurnian 90% diinseminasikan ke betina. Sehingga rasio sex keturunan hampir sama dengan prediksi rasio spermatozoa X ke Y hasil identiikasinya . Penemuan ini penting untuk perkembangan selanjutnya untuk mengontrol jenis kelamin ternak (Garner dan Hafez, 2008)
Spermatozoa X mengandung kromatin lebih banyak di kepalanya, se-hingga mengakibatkan ukuran kepala spermatozoa X lebih besar (Garner dan Hafez, 2008), maka Susilawati dkk (1998) melakukan identiikasi spermatozoa X dan Y berdasarkan pada ukuran kepala yaitu panjang kali lebar, apabila lebih besar dari rata-rata maka dianggap spermatozoa X, sedangkan bila lebih kecil
10
adalah spermatozoa Y. Berdasarkan cara penentuan tersebut diperoleh hasil persentase spermatozoa yang diprediksi sebagai spermatozoa X sebanyak 52,10% dan spermatozoa yang diprediksi sebagai spermatozoa Y sebanyak 47,9%.
4. Spermatozoa X dan Y pada Unggas
Jenis kelamin ternak ditentukan oleh gen yang terdapat pada salah satu sex chromosom. Pada mammalia yang menentukan jenis kelamin adalah kro-mosom Y, sedangkan pada kelompok burung pada jantan berkrokro-mosom ZZ (homogametik), sedangkan betina ZW (hetero gemetik) (Ellegren, 2001 ; Hafez and Hafez, 2008; Froman, Kirby and Proudman, 2000). Gen yang menentukan jenis kelamin pada ternak jantan adalah gen SRY (Grifiths, 1991) Sedangkan pada bangsa burung yang menentukan jenis kelamin ada gen yang berada di dalam lokus yang belum diketahui fungsi pengaturannya (Ellegren, 2001).
Hingga saat ini belum diketahui dengan jelas gen mana yang mengatur jenis kelamin, di lain ihak telah berhasil diidentiikan protein pada kelompok burung betina yaitu W – linked PKCIW gene yang dapat mengekspresikan pembentukan gonad betina. Akan tetapi belum jelas pengaturan pertumbuhan gonad oleh gen DMRT1 dan PKC1W (Ellegren, 2001).
Gen DMRT1 mengexpresikan genital ridge dan saluran Wolfian per-tumbuhan alat reproduksi jantan pada tahap ke 25 (Reymon et al ;1999), DMRT diexpresikan pada burung jantan yang telah dewasa (Shan et al, 2000).
Biosintesis dan sekresi hormon gonadal berpengaruh terhadap diffe-rensiasi gonad. Pembentukan gonad (gonadogenesis) dipengaruhi oleh hor-mon exogenous. Pertumbuhan gonad pada burung lebih labil, sehingga dapat dipengaruhi oleh manipulasi hormon. Perubahan jenis kelamin dapat dilakukan dengan injeksi telur dengan estrogen atau oleh produksi estrogen. Experimen banyak dilakukan pada critical role untuk sintesis estrogen dalam sex determinasi (Scheib et al, 1983). Sinthetic inhibitors pada ensim sintetis estrogen, aromatase, dapat menyebabkan betina menjadi jantan secara permanen (Elbrecht et al , 1992). Gonad sebelah kanan untuk pembentukan jantan dan gonad sebelah kiri akan membentuk testis (Vaillant et al, 2001) dan (Smith et al, 2003). Unggas jantan yang berkromosom ZZ diberi perlakuan estrogen akan menjadi betina akan tetapi tidak permanan. Terdapat 2 akhir suatu sintesis estrogen adalah
11
P-450 aromatase dan 17β HSD diexpresikan hanya pada ZW yang mempunyai gonad betina yang mengalami defferensiasi morfologi (hari ke 6-6, 5, stage 29-30) (Kabayashi et al,1998); (Smith et al, 1997) dan Nishikimi et al (2000). Enzym ini diexpresikan oleh modulary cord pada gonad betina, enzim yang lain padapathway steroidogenic yang di expresikan pada medula pada kedua jenis kelamin (Nishikimi et al, 2000). Aromatase dan 17 βHSD adalah kunci dari komponen
sexual dimorphic. Secara logis bahwa gen W linked pada penentuan jenis kelamin
betina yang mengaktivasi aromatase dan 17 βHSD yang diexpresikan secara awal pada pembentukan alat kelamin betina. Akan tetapi tidak konsisten pada peran hormon androgen pada awal pembentukan jatan. Testosteson dan DHT tidak berpengaruh pada pembentukan telur dan reseptor androgen diekspresikan pada akhir dalam pembentukan gonad.
Estradiol berpengaruh selama perkembangan gonad dan terdapat re-septor. Yang menarik estrogen receptor alpha (Erα) diexpresikan pada kedua jenis kelamin untuk differensiasi sex dalam embrio ayam (smith et al, 1997) Tampaknya ekspresi dimulai dari gonadal cortex Ekspresinya adalah pengaturan di dalam proses pertumbuhan jantan, pada betina juga di didalam gonad sebelah kiri (smith et al, 1997 dan Andrew et al, 1995). Pertumbuhan gonad selama proses embryogenesis tampaknya resisten terhadap sex steroid akan tetapi deferensiasi dapat terjadi tanpa adanya steroidogenesis (Jost , 1970) dan (Hu et al, 2002) 1.3. SEMINAL PLASMA
Pengertian fungsional dari seminal masih diragukan, hal ini karena selama proses perjalanan spermatozoa pada uterus dan proses fertilisasi tidak ada peran dari seminal plasma. Seminal plasma, adalah suatu komponen essensial yang berfungsi pembawa (Carier) dan pelindung spermatozoa.
Seminal plasma berperan penting pada spesies babi betina dan kuda betina, hal ini karena seminal plasma bersama dengan spermatozoa sampai ke uterus, karena diejakulasikan hingga uterus. Pada sapi dan Domba seminal plasma dibutuhkan oleh spermatozoa, saat spermatozoa di ejakulasikan dan disimpan dalam vagina (komposisi semen dan karakteristik semen terdapat pada tabel 1.1).
12
Tabel 1.1. Karakteristik dan komponen kimia dalam semen ternak
Karakteristik Sapi Domba Babi Kuda Ayam
Volume ejakulasi (ml) 5-8 0,8– 1,2 150-200 60-100 60-100
Konsentrasi spermatozoa (juta/ml) 800-2000 2000-3000 200-300 150-300 150-300 Spermatozoa/ejakulasi (Bilion) 5-15 1,6-3,6 30-60 5-15 5-15
Spermatozoa motil (%) 40-75 60-80 50-80 40-75 40-75
Morfologi spermatozoa normal (%) 665- 95 80-95 70-90 60-90 60-90
Protein (g/100 ml) 6,8 5,0 3,7 1,0 1,0 pH 6,4-7,8 5,9-7,3 7,3-7,8 7,2-78 7,2-78 Fruktosa 460-600 250 9 2 2 Sorbitol 10-140 26-170 6-18 20-60 20-60 Citric acid 620-806 110-260 173 8-53 8-53 Inositol 25-46 7-14 380-630 20-47 20-47
Glyceryl Phosphoril cholin (GPC) 100-500 1100-2100 110-240 40-100 40-100
Ergothioneine 0 0 17 40-110 40-110 Sodium 225+13 178+11 587 257 257 Potasium 155+ 6 89+4 197 103 103 Calcium 40+2 6+2 6 26 26 Magnesium 8 + 0,3 6+0,8 5-14 9 9 Chloride 174-320 86 260-430 448 448
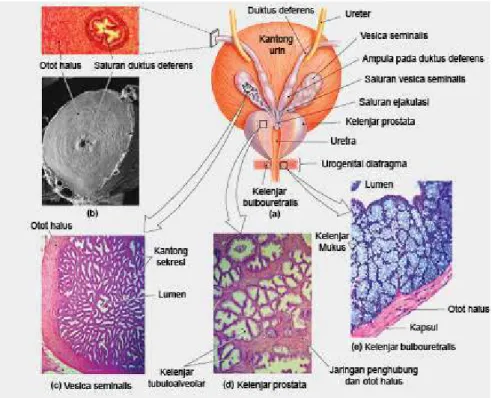
(Garner and Hafez, 2008) 1.3.1. Penghasil seminal plasma (kelenjar assesories)
Seminal plasma merupakan suatau cairan yang bermacam-macam yang dihasilkan oleh beberapa kelenjar yaitu Prostat, vesicular seminalis dan kelenjar bulbouretralis yang dituangkan kedalam uretra, saat ejakulasi mereka dicampur dengan cairan spermatozoa dan sekresi ampula dan duktus deferens. Selain itu juga cairan yang berasal dari epididimis.
13
Gambar 1.8. Jaringan kelenjar asesoris yang sebagai penghasil seminal plasma
14
Tabel 1.2 Kelenjar asesoris pada hewan domestik Spesies Kelenjar vesikularis Prostata Cowper
Bovine + + + Kucing - + -Kuda + + + Ovine + + + Procine + + + Pineda (2005b) 1.3.2. Unsur Biokimia dari seminal plasma
Seminal plasma biasanya berisi asam sitrat kadar tinggi, ergotionine, fruc-tose, glyseryphosphorylcholine dan sorbitol. Sebagian berupa asam askorbik, asam amino, peptida, protein, lemak, asam lemak dan beberapa enzim yang turut berperan (white, 1980). Anti mikroba dan imunoglobulin, terutama kelas Ig A (Shivaji, 1984 dan Ablin, 1974) terdapat juga substansi hormon yaitu androgen, estrogen, prostaglandin, FSH, LH, materi seperti chorionic gonadotropin, juga terdapat dalam kadar rendah insulin, glukagon, prolaktin, relaksin, hormon pembentuk thyroid (Garner dan Hafez, 2008).
Selain sebagai media transportasi, fungsi seminal plasma tidak begitu jelas, hal ini bisa dilihat pada Spermatozoa yang berasal dari kauda epididimis dapat membuahi telur tanpa penambahan hasil eksresi kelenjar asesoris. Kandungan biokimia pada semen, dapat digunakan sebagai indikator penunjuk fungsi khu-sus kelenjar asesoris yang menghasilkannya, misalnya Fruktosa dihasilkan oleh vesikula seminalis.
Fruktosa dan asam sitrat merupakan komponen penting kelenjar veskula pada ruminansia. Asam sitrat sendiri tersusun dalam kelenjar vesikula kuda jantan, pada kelenjar vesikula babi hutan berisi sedikit fruktosa tetapi ditandai dengan tingginya kandungan ergothioniene dan inositol. Glycerylphosphorylcholine merupakan sebuah komponen khusus dari epididimis. Ergothioniene adalah sebuah keunikan tersendiri pada kelenjar ampula kuda.
Kelenjar asesori pada banteng dan kuda jantan dapat digetarkan melalui rektum. Pada banteng gelembung vesika seminalis dan kelenjar prostatnya tidak dapat diketahui lewat rektum. Kelenjar bulbourethal bangsa sapi, umumnya tidak dapat diidentiikasikan karena tertutup oleh otot. Pada babi hutan, ukuran
15
kelenjar bulbourethalis dapat dipergunakan untuk membedakan pengebirian pada criptorchid babi hutan. Babi hutan sebelum pubertas memiliki kelenjar bulbourethalis kecil, panjangnya 5 cm, beratnya kurang dari 1 gram. Cryptor-chid babi hutan umumnya mempunyai ukuran kelenjar yang normal, kira-kira panjangnya 10 cm dan beratnya 45 gram.Tabel 1.3. Umur, Berat dan karakteristik kualitas Semen saat pertama kali dikawinkan (Garner dan Hafez, 2008)
Spesies
Mulai dapat mengawini Volume Ejakulasi
(ml)
Konsentrasi spermatozoa
(108/ml)
Bulan Berat badan (Kg)
Babi 5-8 250 100-150 0,1-0,2 Sapi 12-14 500 3-5 0,8 – 1,2 Domba 6-8 Bervariasi 0,3-1 1,2 – 1,5 Kuda 20-24 500 50-100 0,1- 1,5 Ayam 4-6 Bervariasi 0,10- 0,3 50-90 Kucing 9 3,5 0,01-0,3 1,5- 28 Anjing 10-12 Bervariasi 2-25 0,6-5,4 Marmut 3-5 0,450 0,4-0,8 0,05-0,2 Kelinci 4-12 Bervariasi 0,4-0,6 0,5 – 3,5
Kualitas semen saat ejakulasi pada sebagian besar ternak adalah berubah-ubah, hal ini karena bervariasinya sekresi dari beberapa organ asesoris termasuk epididimis (caput, corpus epididimis dan caudal epididimis), kelenjar ampular (AMP), kelenjar vesicular, kelenjar prostat dan kelenjar bulbourethal. Besarnya sekresi dari kelenjar assesori bervariasi tidak hanya diantara spesies, tetapi juga diantara individu pada spesies yang sama dan diantara ejakulasi dari individu yang sama.
1.4. METABOLISME SPERMATOZOA
Karakter motilitas (pergerakan) dari spermatozoa memudahkan dalam melihat kondisi isiologis spermatozoa. Tetapi motilitas dengan sendirinya bukan identik dengan kemampuan dalam memfertilisasi. Energi yang dibutuhkan untuk motilitas diperoleh dari persediaan intraseluler dari ATP. Penggunaan ATP ter-lihat diatur oleh tingkat endogenous dan siklus Adenosine Monophosphate (cAMP). cAMP tidak hanya mengatur pelepasan ATP tetapi juga mempunyai pengaruh pada motilitas spermatozoa. Pengaruh cAMP ini kompleks pada pergerakan
16
spermatozoa yang ditunjukkan secara in vitro dengan menambahkan dibutyryl
cAMP atau inhibitor methyl xanthines yang menghalangi degradasi intraseluler normal dari cAMP pada spermatozoa.
Meskipun banyak kehilangan organel pada spermatozoa yang berhu-bungan dengan proses metabolisme pada proses pembentukan spermatozoa, spermatozoa tetap aktif dalam metabolisme karena mempunyai enzim yang penting untuk reaksi biokimia dari glikolisis, siklus asam trikarboksilat, oksidasi asam lemak, transport electron, dan mungkin heksosa monophospat.
Energi yang langsung digunakan untuk pergerakan spermatozoa dihasi-lkan oleh serabut ekor berasal dari uraian ATP, yang diduga terdapat di dalam serbuk spiral yang mengikat berkas serabut. Nucleotid ini tersusun dari basa adenosin, yaitu ikatan lingkaran dari karbon ribose dan tiga ikatan fosfat, kedua dari yang terakhir mengandung banyak energi (P-P) dan hanya dapat tersusun menjadi suatu kelompok dengan tambahan energi yang sangat banyak. Jika ATP diaktifkan oleh enzim tertentu, maka ikatan fosfat terutama yang banyak mengandung banyak energi akan terurai, dilepaskan energi, tersisa ADP dan terbentuk fosfat anorganik.
Selanjutnya ADP (ikatan kaya energi kedua) terurai, melepaskan energi untuk kontraksi ibril, tersisa AMP (Adenosin mono phosphat) serta terbentuk fosfat anorganik lagi. Bila ATP dan ADP telah habis, kontraksi ibril sperma-tozoa akan terhenti. Supaya motilitas masih dapat berlangsung, maka ADP dan ATP harus dibangun kembali. Karena reaksi ini dapat berbalik, maka pembentukan ADP dari AMP dengan menambahkan kelompok fosfat, yang berasal sumber energi dari luar. Kebanyakan aktiitas isiologi disertai dengan pelepasan energi dari reaksi bahan organik seperti karbohidrat dan lemak.
Metabolisme spermatozoa tidak selalu membutuhkan oksigen. Oksigen hanya diperlukan bila aktiitas metabolisme tidak dapat terjadi tanpa adanya oksigen. Faktor lain dapat mengatur kebutuhan derajat kebutuhan oksigen un-tuk menghasilkan energi unun-tuk gerak. Jadi meskipun produksi energi tiap unit karbon jauh lebih eisien bila disertai dengan oksidasi daripada hanya dengan glikolisis, tetapi ternyata hasil percobaan dalam kondisi tertentu menghasilkan produksi energi dari glikolisis sama cepatnya di bawah pengaruh oksigen atau tanpa oksigen. Jalur pertukaran energi dan penyimpanan energi melewati sistim adenil, sesudah dihasilkan oleh proses glikolisis maupun respirasi.
17
Glikolisis terjadi pada kondisi an aerob, dengan tidak adanya oksigen, spermatozoa memecah glukosa, fruktosa atau mannosa menjadi asam laktat. Pada proses kegiatan fruktolisis lebih baik dari pada glukolisis, sebab fruktosa adalah gula dasar dari seminal. Spermatozoa dapat hidup dalam kondisi an aerob. Karakteristik ini penting selama penyimpanan saat proses Inseminasi Buatan.Jalur metabolisme glikolisis dengan dua bahan baku yaitu fruktosa dan glukosa. Pertama, Fruktosa-1,6-difosfat diuraikan enzim aldolase menjadi dua molekul dari 3 karbon triofosfat, yaitu 3-fosfo-glyserin aldehid (G-3-P) dan
dygydroxyaceton fosfat. Dalam proses oksidasi G-3-P dengan pemindahan unsur
hydrogen yang diikuti dengan pernyenyawaan fosfat anorganik, terbentuklah asam 1,3 difosfoglycerin. Dehidrogenase G-3-P membutuhkan suatu enzim
(di-fosforidin nucleotid,DPN) yang akan bereaksi dengan ion hydrogen dan merubah aldehid menjadi asam dan mereduksi DPN menjadi DPNH2. Penguraian dari asam difosfat glyserin menjadi asam monofosfat glyserin menghasilkan energi yang terpakai untuk membangun ADP dan ATP.
Selanjutnya fosfoglyceromutase, memisahkan fosfat dari satu atom karbon lainnya untuk membentuk asam 2-fosfoglycerat yang diaktiisir dengan katali-sator enolase, melepaskan air dan menjadi asam fosfopiruvat. Enzim
transfos-forylase sebagai katalisator reaksi yang lebih lanjut dan ikatan fosfat kaya energi dari asam fosfopiruvat. Enzim transfosforilase sebagai katalisator reaksi yang lebih lanjut dan ikatan fosfat kaya energi dari asam fosfopiruvat memerlukan unsur magnesium dan kalium. Enzim ini akan memindahkan fosfat ke AMP atau ADP membentuk ADP atau ATP dan mengisi kembali substansi energi dengan pembentukan asam piruvat. Jadi dalam lingkungan an aerob asam piruvat mengikat dua ion hydrogen dari DPNH2 dengan katalisator enzim, asam laktat dehydrogenase membentuk produk akhir anaerob asam laktat. Selanjutnya DPN menjadi bebas untuk mengikat hydrogen baru dari proses oksidasi G-3-P, sehingga memungkinkan keseimbangan proses fruktolisis.
Kedua, dengan menggunakan glukose sebagai bahan baku dikemukakan bahwa reaksi pertama menghasilkan pembentukan glukose 6-fosfat (G-6-P) dari glukosa 6 –fosfat (G-6-P) dari glukosa dan ATP. Spermatozoa merubah G-6-P menjadi fruktosa-6-P dan dengan batuan ATP dirubah menjadi fruktose –6-P dan dengan bantuan ATP dirubah menjadi fruktose –6-P dan dengan bantuan ATP dirubah menjadi fruktose –1-6-difosfat. Selanjutnya mengikuti proses dari
18
bahan pertama (Fruktose).
Setelah proses glikolisis selesai dilanjutkan dengan siklus kreb asam sitrat. Sesuai dengan hasil-hasil penelitian mengenai sistem prima ketergantungan oksigen metabolisme sel dan jaringan adalah siklus kreb asam sitrat. Jalur meta-bolisme ini merupakan jalan reaksi utama proses oksidasi bahan pokok normal spermatozoa. Bahan pokok ini merupakan produksi akhir glikolisis, asam laktat dan produksi dehidrogenase adalah asam piruvat. Reaksi keseimbangan, asam piruvat dan asam laktat, lebih berat berjalan ke arah asam laktat bila tanpa oksigen. Dalam lingkungan oksigen asam laktat diteruskan melewati piruvat ke acetil koenzim A (Acetyl Co A) yang akhirnya bersenyawa dengan oxaliasetat membentuk sitrat. Reaksi ini berkesinambungan melewati siklus krebs.
Faktor-faktor yang mempengaruhi metabolisme spermatozoa antara lain temperatur, konsentrasi semen, fosfat an organic, pH, kation dan anion, tekanan osmose, hormon, zat anti bakteri dan gas. Spermatozoa yang didinginkan di bawah temperatur badan menunjukkan motilitas menurun dan berhenti sama sekali bila temperatur berada beberapa derajat di atas titik beku. Walaupun motilitas berhenti sama sekali, metabolisme berlangsung terus secara perlahan-lahan.
Pengaruh kepadatan sel tidaklah merupakan suatu yang pasti, karena konsentrasi sel tidak memiliki arti penting dalam proses pernafasan dan gliko-lisis. Pengaruh konsentrasi sel terhadap konsumsi oksigen tidaklah disebabkan oleh jumlah oksigen yang terbatas dalam konsentrasi lebih padat, tetapi karena konsentrasi ion kalium yang lebih tinggi yang merupakan penghambat alamiah dan terdapat dalam pengatur metabolisme.
1.5. RESPIRASI SPERMATOZOA
Spermatozoa menggunakan berbagai substrat sebagai sumber oksigen. Respirasi menggunakan asam laktat dan piruvat yang berasal dari break down fruktosa untuk menghasilkan CO2 dan air. Jalur oksidasi (Oxidatif Path Ways) berada di mitokondria yang lebih eisien menghasilkan energi dibandingkan pada proses fruktolisis. Proses katabolisme ini spermatozoa merubah menjadi ATP dan digunakan untuk bergerak yang sebagian untuk memelihara proses transport aktif dari membran. Transport aktif ini vital dibutuhkan untuk trans-port ion di dalam sel. Tanpa subtrat luar, spermatozoa dapat menggunakan
Dr. Tjahjanulin Domai, M.S.
19
penyimpanan intraseluler pada plasmalogen yang dapat digunakan anergi dalam waktu pendek.
Tabel 1.4. Manipulasi in vitro pada spermatozoa (Garner dan Hafez, 2008) Teknik Prosedur Penyebab Pencucian Spermatozoa Percoll@, isolat sperma@,
Me-dium modiied Ham’s F 10, Larutan garam Tyrodes atau media isotonis lain, sebelumya dihangatkan dan di ilter sebe-lum digunakan
- Ejakulasi jelek (retrogard) - Semen beku - Oligozoosperma, motilitas spermatozoz rendah. - Menghilangkan antibodi anti sperma - Persiapan IB uterus Spermatozoa Swim up -Seleksi spermatozoa
-Meningkatkatkan kualitas spermatozoa
- Motilitas menurun - Menghilangkan potensi
patogen dan leucosit S p e r m a t o z o a s w i m
down
- Meningkatkan kualitas sper-matozoa
- Oligospermia
Manipulasi semen untuk IVF
- Swim up dan swim down - Kapasitasi in vitro
Mengurangi bahan-bahan di dalam media cryopre-servasi
Manipulasi Semen dan oosit untuk keberhasilan fertilisasi
Mikrofertilisasi Spermatozoa dimasukkan ke dalam oosit
Mikromanipulasi sper-matozoa
Intrasitoplasmic Sperm Inser-tion (ISCI)
Micromanipulator diguna-kan untuk mengawali 1 sper-matozoa ke dalam oosit Semen Sexing Flow Cytometric Sorting Memisahkan spermatozoa
21
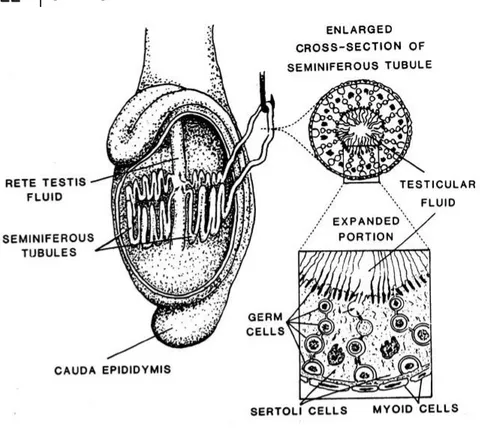
Spermatogenesis adalah suatu proses pembentukan spermatozoa (sel gamet jantan) yang terjadi hanya di Tubuli seminiferi yang terletak di Testes. Testes 90 % tersusun oleh tubuli seminiferi, sedangkan yang 10% adalah sel intertitiel dan jaringan ikat.
Gambar 2.1. Skematis testis dan aluran reproduksi jantan (Hafez, 2008a)
Spermatozoa yang dihasilkan oleh tubuli seminiferi dikeluarkan ke sa-luran reproduksi jantan yang terdapat silia dan muskulernya yang dapat meng-gerakan spermatozoa dalam proses transportasi, saluran reproduksi jantan tersebut adalah retetestes, vas defferens epididimis, vas efferens dan terakhir di uretra, gambar silia dan muskuler pada saluran reproduksi jantan terdapat pada gambar 2.1.
II
BAB
22
Gambar 2.2. Saluran transportasi spermatozoa dan bagian sel di dalam tubuli seminiferi (Garner dan Hafez, 2008).
Epithel seminiferi adalah bagian terluar dari tubuli seminiferi, yang terdiri dari 2 tipe sel yaitu sel sertoli dan sel germinal yang tumbuh dan ber-kembang. Sel germinal mengalami pembelahan secara berseri dan mengalami perkembangan, dimulai dari arah tepi menuju ke lumen. Spermatogonia adalah sistem sel yang membelah beberapa kali sebelum terbentuknya spermatosit. Spermatosit mengalami miosis dengan berkurangnya kandungan DNA menjadi setelah dari sel tubuh.
Tubuli seminiferi adalah tempat untuk proses spermatogenesis atau pembelahan sel gamet. Proses spermatogenesis merupakan 2 proses pembe-lahan 1) pembepembe-lahan mitosis dan miosis disebut dengan spermatositogenesis (Dari 2 n menjadi 2n), yaitu pembelahan dari spermatogonium sampai dengan spermatosit primer. Miosis I adalah pembelahan dari spermatosit primer ke sper-matosit sekunder (Dari 2n menjadi n), sedangkan Miosis II adalah pembelahan dari spermatosit sekunder menjadi spermatid (Dari n menjadi n). 2) Perubahan spermatid menjadi spermatozoa disebut dengan spermiogenesis
23
Gambar 2.3. Sel-sel di dalam tubuli seminiferi
24
Di dalam tubuli seminiferi terdapat sel-sel mulai spermatogonium hingga sper-matozoa, selain itu juga terdapat sel sertoli yang secara umum disebut berfungsi memberi makan spermatozoa akan tetapi sebetulnya berfungsi sebagai blood
testes barier, penghasil hormon in hibin dan aromatisasi hormon testosteron
menjadi estradiol 17β (estrogen), sedangkan di antara tubulus terdapat sel in-tertitiel yang diantaranya terdapat sel leydig. Sel leydig berfungsi menghasilkan hormon testosteron yang selain berfungsi untuk proses spermatogenesis juga berfungsi didalam pematangan spermatozoa dalam epididimis (dalam bentuk dihidro testosteron) dan meningkatkan libido untuk mengawini betina. 2.1. Spermatositogenesis
Selama perkembangan embrio, sel khusus germinal primordial berpindah dari bagian kantong kuning telur pada gonad embrio yang tidak terdeferensiasi. Setelah fetus sel primordial berubah menjadi gonosit pada ternak jantan dan terus mengalami deferensiasi (garner dan Hafez, 2008)
Sebelum pubertas sudah terbentuk spermatogonia type Ao yang berasal dari germ layer. Spermatogonia type A1 secara progresif membelah menjadi A2, A3 dan A4. Kemudian membentuk type intermediate dan selanjutnya membelah menjadi spermatosit. Proses pembelahan diatas adalah pembelahan mitosis (2N menjadi 2N). Selanjutnya spermatosit primer membelah miosis menjadi spermatosit sekunder disebut dengan miosis I, sedangkan miosis II adalah pembelahan dari spermatosit sekunder menjadi spermatid.
Menurut Garner dan Hafez (2008) sel tipe A4 membelah membentuk intermediate spermatogonia (tipe In) dan selanjutnya membentuk spermatogo-nia tipe B. Variasi bentuk spermatogospermatogo-nia ini dapat dilihat engan membuat irisan histologi epithel seminiferi yang berbasis proliferasi dari lapisan germ sel. Sel tipe A2 tidak hanya membelah yang akhirnya menjadi spermatozoa kan tetapi juga membentuk stem sel yaitu spermatogonia tipe A1, walau masih tetap ada spermatogonia tipe Ao yang merupakan cadangan dan populasi dari stem sel (Garner dan Hafez, 2008).
Spermatogonia tipe B membelah menjadi lebih kecil dan mejadi 2 spermatosit primer. Spermatosit primer mengalami pembelahan miosis yaitu profase yang terdapat tahapan pre leptotene, laptotene, Zygotene, pachytene dan diplotene sebelum menjadi spermatosit sekunder tanpa sintesa lebih lanjut,
25
sehingga hasilnya adalah spermatosit sekunder yang membelah menjadi sel haploid yaitu spermatid.Tabel 2.1. Lama siklus epithel seminiferus dan spermatogenesis pada bebera-pa mammalia
Spesies Lamanya hari
Siklus Spermatogenesis
Babi 8,6 34,4
Sapi 13,5 54
Anjing 13,6 54,4
Manusia 13,6 54,4
Kera (Macaca fasicularis) 9,3 37,2
Kera (Macaca malata) 10,5 42
Domba 10,4 49
Tikus (spraque-dawley) 12,9 51,9
Tiskus (Wistar) 13 52
Kuda 12,2 48,8
(Pineda, 2005 b)
26
Gambar 2.6. Tahapan Miosis 1
Gambar 2.7. Tahapan Miosis II 2.2. Spermiogenesis.
Round spermatid yang berubah menjadi spermatoza yang melalui peruba-han secara seri yang bersama-sama disebut dengan spermiogenesis. Perubaperuba-han meliputi kondensasi kromatin inti, pembentukan ekor spermatozoa atau lagear apparatus dan perkembangan acrosome cap, seperti pada gambar 2,8 dan 2,9
27
Gambar 2.9. Tahapan Spermiogenesis
Tahapan perubahan bentuk spermatid dibagi menjadi 4 fase yaitu fase golgi, Cap, Akrosom dan fase maturasi.
Fase Golgi 1.
Fase golgi pada tahap spermiogenesis adalah ditandai dengan pem-bentukan granul (butiran) proakrosomal dengan golgiaparatus, peleburan granul kedalam single granule acrosome sehingga menghasilkan penutup inti (nuclear envelope) dan tahap awal pertumbuhan ekor pada bagian ujung lain dari akrosom. Sentriol bagian proksimal menghilang dari inti sebagai dasar pembentukan ekor dari kepala.
Fase Cap 2.
Fase ‘cap’ ditandai dengan menyebarnya granul ke permukaan nukleus spermatid, proses dilanjutkan menuju ke bagian 2/3 bagian enterior pada masing-masing inti spermatid tertutup oleh lapisan tipis doble layer.
Selama fase ‘cap’ ini terjadi perkembangan komponen axonema pada bagian ekor yang dibentuk dari eleelemen pada distal sentriol men-galami pemanjangan di bagian sitoplasma sel. Selama awal perkembangan struktur axonema irip dengan silia yang didalamnya terdapat 2 tubulus di tengah yang dikelilingi bagian tepinya dengan 9 pasang tubulus.
28
Fase akrosom 3.
Fase akrosom pada proses spermiogenesis secara umum ditandai den-gan perubahan inti, akrosom dan pertumbuhan ekor spermatid. Pertum-buhan difasilitasi oleh pemutaran pada masing-masing spermatid, akroom menuju ke bagian ujung sedangkan ekornya menuju ke bagian lumen. Perubahan inti meliputi kondensasi kromosom pada butiran tebal dibagian kepala menjadi pipih, saat ini terjadi pertumbuhan histon secara progresif diganti dengan protein yang bentuknya ikut memanjang. Modiikasi bentuk kepala dan akrosom ini berada di sekitar sel sertoli. Proses ini berbeda-beda pada masing-masing spesies.
Perubahan morfologi inti seiring dengan menghilangnya sitoplasma di bagian kepala juga bagian cauda dan bagian proximal tumbuh ekor yang bagian sitoplasmanya tumbuh silinder sheat. Metochondria yang awalnya terdistribusi di spermatid mulai terkonsentrasi di bagian axonema yang membentuk sheat di bagian midle piace pada ekor.
Fase Maturasi 4.
Fase maturasi pada spermiogenesis ini adalah suatu tahap akhir dari proses peanjangan dan menuju lumen tubulus seminiferus. Pemanjangan spermatid ini mempunyai proses yang bervariasi sehingga bentuk pada ber-bagai spesies menjadi berbeda. Di dalam intinya terdapat granula kromatin yang secara progressif mengalami kondensasi merubah protein menjadi protamin dan membentuk materi homogenous yang seragam pada inti spermatozoa.
Selama fase maturasi ibrous sheeth dan 9 course iber (serabut kasar) memben-tuk lingkaran axonema dan terus menerus kolom ini mejadi leher. 9 serabut kasar yang dikelilingi axonema terbentuk mulai leher sampai ujung ekor. Mitokondria secara kuat dan terus menerus berkembang di bagian ekor.
Pada sel spermatid yang berbentuk bulat terdapat organel-organel an-tara lain apparatus golgi, mitokondria, sentriol dan nukleus (inti), di dalam proses pembentukan spermatozoa terjadi perubahan bantuk dari sel dan juga terjadi perpindahan lokasi dari masing-masing organel-organel tersebut, sehingga terbentuk spermatozoa yang lengkap. Aparatus golgi terletak di dalam akrosom, inti terletak pada kepala spermatozoa, mitokondria terle-tak di bagian leher sedangkan sentriol berkembang membentuk lagelum
29
pada ekor, sehingga fungsi dan bagian-bagian tersebut masih sama dengan penyusunnya.Lamanya Spermatogenesis
Pada irisan melintang tubuli seminiferi terdapat sel yang bervarasi dan bergabung membetuk perubahan berupa siklus terdapat 14 macam. Sel yang bergabung atau tahapan (stage) yang diidentiikasi pada spesies yang sama dan pada manusia terdapat 12 stage pada suatu siklus (Gambar 2.11). Secara me-nyeluruh waktu yang dibutuhkan dalam satu siklus dapat diketahui, satu siklus adalah satu seri perubahan epithel seminiferi antara tahapan perubahan.
Setiap tahapan spermiogenesis ini digunakan untuk mengklasiikasi taha-pan sikus yang bervariasi. Waktu siklus seminiferi bervariasi di masing-masing spesies. Pada Babi lamanya 9 hari, domba 10 hari, Kuda 12 hari dan Sapi 14 hari dan terdapat 4-5 siklus bervariasi pada spesies yang berbeda, sebelum terbentuk spermatozoa pada satu siklus mengalami metamorfosa selama spermatogenesis. Setia siklus epithel seminiferi diibaratkan sistem pendidikan SD mulai kelas 1 sampai lulus, dilanjut SMP mulai kelas 1 sampai lulus dan seterusnya hingga lulus setelah semua kurikulum dilaluinya dan waktu yang dibutuhkan pada masing-masing spesies berbeda untuk menyelesaikan perkembangannya.
30
Pada gambar di atas terdapat tabel di tengah mengindikasikan terdapat 12 tahapan (stage) dalam setiap siklus epithel seminiferi. Variasi tipe selnya adalah A,I,B adalah tahap keberuntuhan spermatogonia, PL pre leptotene spermatocyte, L, leptotene spermatocyt, Z, zygotene spermatocyte, P, Pachitene spermatocyte dari tage 1,5 dan X. II, Secondary spermatocyte. Step 1-14 suatu tahapan spermiogenesis yang ditunjukkan pada fase golgi (step 1-3), fase cap (step 4-7), fase akrosom (step 8- 12) dan fase maturasi (step 13-14) diadaptasi dari Bearnrson WE, Desjardins C,Am.J. Anat :1974 :140 ; 167- 180 (Garner dan Hafez, 2008)
2.3. Peran Hormon pada proses spermatogenesis
Proses pembentukan spermatozoa dan fungsi hormon steroid diatur oleh gonadotropin yang disekresi oleh sel adenohipoisa yang dikeluarkan secara pulsatif. Fungsi tersebut telah dibuktikan dengan metode hipoisektomi dan replecement terapi.
Pada saat masih bayi (juvenil), ternak janan tidak respon terhadap gonado-tropin. Setelah dewasa terdapat respon, peristiwa ini belum jelas diketahui apakah yang menyebabkan sel-sel germinal sensitif terhadap stimulasi gonadotropin.
Spermatogenesis yang normal sinergis dengan aktiitas Luteinizing Hormaon (LH, pada jantan juga disebut dengan Instertitiel Cell Stimualting Hormoe, ICSH), Folikel stimulating Hormon (FSH), prolaktin, Androgen dan hormon yang lain. Hal ini seperi penjelasan di gambar 2.13.
Fungsi masing-masing hormon FSH dan LH terhadap proses spermato-genesis masih dipertanyakan, karena tambak fungsi yang bersamaan keduanya. Hasil percobaan menunjukkan bahwa LH berfungsi untuk menstimulasi aktivitas steroidogenesis dan fungsi pembentukan sel gamet. LH berfungsi langsung pada sel leydig didalam menghasilkan hormon testosteron. FSH berfungsi di dalam spermiogenesis yang aktiitasnya hasil sekresi dari sel sertoli. Lebih lanjut IGF-1 juga diproduksi oleh sel sertoli yang berperanan penting dan tidak dapat keluar darii blood testis barier. Sehingga IGF-1 diproduksi secara lokal yang menstimulasi terjadinya pembelahan miosis pada ephitel seminiferi.
Pada sel sertoli dan sel germinal terdapat reseptor IGF-1 dan untuk
insulin Like Growth Factor-2 (IGF-2) walau ekspresinya masih belum ditemu-kan didalam sel sertoli. Unilateral kastrasi pada jantan di beberapa spesies meningkatkan level LH dan FSH dalam darah dan menstimulasi kompensasi
31
hipertropi pada testis.Aktiitas gonadotropin hormon pada testis, pembentukan spermatozoa dan steroidogenic di bawah kontrol interaktif paracrine di dalam testes meru-pakan faktor pertumbuhan.
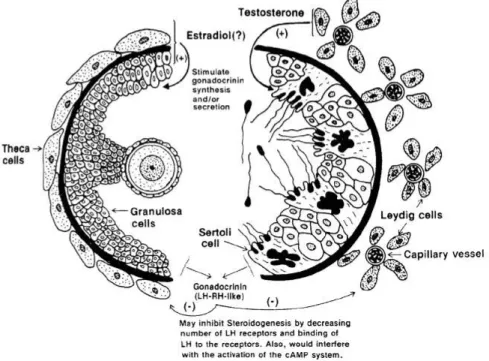
Gambar 2.11. Hubungan kontrol fungsi hormon dalam testis
Luteinizing hormon (LH) menstimulasi (+) sel leydig untuk sekresi testosteron, sedangkan FSH menstimulasi (+) pembelahan sel germinal. FSH juga menstimulasi sel sertoli untuk meningkatkan metabolisme Androgen pada organ jantan dan feed back negatif (-) pada hipothalamus, menurunkan keluarnya GnRH (FSH/LH-RH). Konsentrasi testosteron secara lokal tinggi menstimulasi pertumbuhan germinal epithelium. FSH menstimulasi sintesa
Androgen Binding Protein (ABP). Inhibin disekresi sel sertoli untuk menekan level FSH.
32
Tabel 2.2. Sekresi dari fungsi sel sertoli
Produk Fungsi
ABP, Androgen Binding Protein Transport Androgen ke organ reproduksi jantan
Estrogen, Estradiol 17β Kontrol sekresi FSH, menghambat sekreasi androgen oleh sel leydig
Koponen nutrisi esensial, termasuk enzim dan asam amino tidak dapat melintasi Blood testis barier
Kebutuhan untuk metabolisme dan hidupnya sel germinal dan memfasilitasi terjadinya mio-sis pada epithel seminiferi
Gonadocrinin Mengatur sekresi LH, penurunan reseptor LH dan mengikat LH pada sel leydig
Inhibin Kontrol sekreasi FSH
IGF-1, insulin – like growth factor 1 Pertumbuhan dan deferensiasi sel germinal, kemungkinan interaksi sel leydig untuk pro-duksi steroid.
IGF2, insulin- like growth factor 2 Androgen diterima oleh sel sertoli MIH, Mullerian Inhibiting Hormon,
diproduksi oleh sel sertoli fetus
Menghalangi pertumbuhan organ muller pada fetus jantan
Diambil dari MK Skinner, Endocrine Rev 12:45, 1991; and B.P Bullaney and M.K. Skinner Bailliere’s clin. Endocrinol metab 5 :771.1009 (Pineda, 2005a). 2.4. Fungsi Steroidogenic
Sel leydig pada instertitiel menghasilkan androgen, termasuk di dalamnya adalah testosteron adalah respon dari stimulasi LH (ACSH) yang bersinergi dengan FSH dan kemungkinan prolaktin. Prolaksi berfungsi mengatur sekresi testosteron yaitu dengan meningkatkan jumlah dan meningkatkan ainitas reseptor LH di sel leydig.
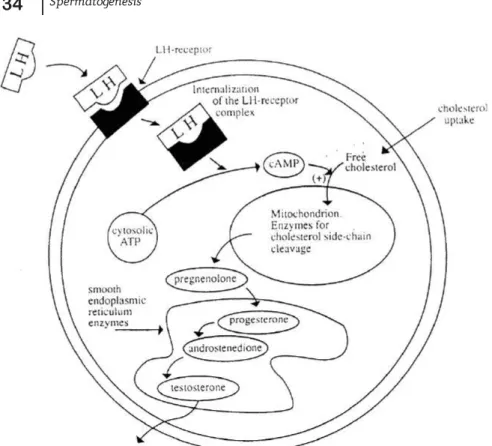
Interaksi antara LH dengan sel leydig karena aktiitas adenil siklase, termasuk aktiitas protein kinase dan sintesa RNA menghasilkan peningkat-an produksi pregnelolon dari kolesterol oleh mitokondria didalam sel leydig (Gambar 2.14).
Enzim didalam sel menyebabkan mitochondria mensintesa pregnenolon sampai akhirnya dikeluarkan testesteron oleh sel leydig. Hanya sel leydig yang dapat mensintesa cholesterol menjadi testosteron.
Testosteron yang dihasilkan sel leydig oleh parachin sel sertoli dirubah menjadi estradiol 17β kaena pengaruh FSH, hal ini terjadi pada banyak spesies (Gambar 2.15)
33
Perubahan testosteron menjadi estrogen karena adanya reseptor spesiik dapa sel sertoli. Pada proses spermatogenesis yang normal terdapat interaksi yang komplex antara sel germinal epithelium, sel leydig dan sekresi testosteron, sel sertoli dan sekresi estrogen dan gonadotropin dari pituitary.Faktor pertumbuhan IGF-1 & 2 dan regulasi lokal lain, merupakan kerja autokrin dan juga kontrol sel leydig dan sekresi sel sertoli, adrenal cortex juga mensekresi androgen dalam jumlah yang sedikit.
Gambar 2.12. Fungsi isiologi gonadocrinin pada sel sertoli, leydig dan sel granulosa (didaptasi dari sumber yang berbeda-beda termasuk R.M. Sharp,
J.Reprod. Fertil. 64 : 517, 1982) (Pineda, 2005a)
34
Gambar 2.14. Sistesis dan produksi Testosteron oleh Sel Leydig (diambil dari A.H. Payne & Young Hood. Biol. Reprod, 52 :217, 1995) (Pineda, 2005a) 2.5. Faktor-faktor yang mempengaruhi spermatogenesis
Bahan beracun 1.
Pada umumnya, sel germinal epithelium sensitif terhadap kondisi panas terutama pada perkembangan spermatid, sedangkan pengaruh radiasi panas selain pada perkembangan spermatid juga pada pem-belahan spermatogonia. Apabila testis rusak masih ada spermatozoa yang berada pada epididimis, waktu spermatozoa berada di epididimis selama 2-5 hari. Sebagian besar spesies waktu maturasi di epididimus kurang dari 5 hari. Jika spermatozoa abnormal bukannya dipengaruhi saat di epididimis tetapi saat spermatozoa yang merupakan akibat dari stress beberapa minggu yang lalu.
35
Tabel 2.3. Waktu migrasi di dalam spididimis pada berbagai spesiesSpesies Waktu migrasi (Hari)
Babi 9-14 Sapi 8-11 Domba 13 Kuda 3-7 Pengaruh Nutrisi 2.
Deisiensi makanan yang spesiik berpengaruh pada eisiensi reproduksi yang meliputi siklus estrus, kebuntingan, produksi susu dan sifat keibuan adalah dampak panjang dari kekurangan energi pada betina, sedangkan pada jantan adalah kemampuan didalam mengawini, juga penurunan berat badannya berdampak besar apabila sebelum pubertas dibandingkan setelah pubertas, yaitu hipoplasia pada testis, kelenjar asesoris dan keterlambatan pubertas.
Kekurangan energi dalam makanan berpengaruh terhadap sekresi gonadotropin, pendewasaan jadi tertunda (berat badan turun 25 – 35%) penurunan libido, epithel seminiferus tahan terhadap kerusakan, volume dan kualitas semen yang jelek.
Kekurangan Vitamin A berpengaruh terhadap Germinal epithel dan sel leydig yang menyebabkan rendahnya kualitas spermatozoa, atropi testis, pengecilan kelenjar asesoris dan pubertas terhambat.
Kekurangan vitamin E menyebabkan kerusakan testis pada tikus, tetapi tidak pernah ada kasus infertility pada ternak yang di-sebabkan oleh kekurangan vitamin E. Kekurangan vitamin E lebih banyak mempengaruhi metabolisme terutama bila terjadi sebelum pubertas. Kekurangan mineral atau mengkonsumsi yang berlebihan itoestrogen,goitrogen dan nitrat secara bersam-sama berpengaruh terhadap penampilan reproduksi jantan dan bila terjadi dalam waktu yang lama akan menyebabkan testis degeneratif (mengecil).
Eksogenous sex steroid dapat berpengaruh terhadap fungsi testis atau sekresi gonadotropin oleh pituitry, akan tetapi bila diberikan dalam jumlah yang tinggi dan jangka waktu yang lama, justru akan menekan
36
gonadotropin dan testosterin yang diinjesikan akan menekan kualitas semen hingga 11 minggu.
2.6. Peran skrotum dalam termoregulasi
Proses spermatogenesis bisa berjalan dengan baik apabila suhu dalam testis 5oC di bawah suhu tubuh, oleh sebab itu pada bagian skrotum terdapat
suatu proses thermoregulasi yang diatur oleh sistem kerja:
Otot kremaster, pada saat panas akan menjauhkan dari tubuh, sedangkan 1.
bila dingin mendekat ke tubuh.
Tunika dartos, Otot yang mengatur apabila panas akan merenggang,sedangkan 2.
apabila dingin akan mengkerut.
Pleksus Pumpiniformis, yaitu vena dan arteri yang saling berbelit untuk 3.
proses pengaturan suhu.
Proses termoregulasi ini tidak terjadi pada ternak sebelum pubertas, oleh sebab itu untuk mengamati seekor ternak telah pubertas atau telah mengalami sper-matogenesis dapat diamati pada fungsi-fungsi diatas.
37
Spermatozoa yang diejakulasikan ke dalam saluran reproduksi betina bertujuan untuk dapat memfertilisasi oosit. Di dalam alat reproduksi betina membutuhkan waktu agar dapat melakukan fertilisasi. Cairan uterus, bahan-bahan dari oviduk dan cairan folikel saat ovulasi berperanan dalam proses kapasitasi (Pineda, 2005).
Spermatozoa mammalia yang telah mengalami pemasakan di dalam epi-didimis dan terejakulasi belum dapat membuahi sel telur. Spermatozoa tersebut haruslah menetap di dalam saluran kelamin betina selama beberapa saat sebelum membuahi sel telur. Spermatozoa mengalami beberapa perubahan isiologis (fungsional) di dalam saluran kelamin betina, Perubahan-perubahan tersebut menyebabkan spermatozoa mampu melakukan pembuahan, peristiwa ini yang disebut dengan KAPASITASI.
Sejak penemuan kapasitasi oleh Chang, hingga saat ini para peneliti masih menyimpan keraguan akan perlunya kapasitasi pada spermatozoa. Hal ini karena spermatozoa yang baru terejakulasi, belum diketahui kemampuannya dalam membuahi sel telur. Bila kapasitasi dideinisikan sebagai fenomena yang hanya terjadi di dalam saluran betina, maka keraguan mereka dapat dibenarkan. Untuk pembuktiannya lebih mudah bila digunakan media buatan yang menyerupai disaluran kelamin betina untuk proses inseminasi sel telur.
Bila kapasitasi tidak dibutuhkan, maka spermatozoa yang baru terejakulasi dapat membuahi sel telur sesegera mungkin. Dalam kenyataannya, selalu terjadi selang waktu antara Inseminasi dan awal dari pembuahan. Selang waktu ini bisa terjadi selama kurang dari 1 jam atau lebih dari beberapa jam, tergantung pada spesiesnya, selang waktu ini dapat digunakan untuk menentukan waktunya kapasitasi.
Waktu kapasitasi dapat ditentukan dengan bermacam metode. Salah satunya adalah dengan mengawinkan atau melakukan Inseminasi Buatan pada