POTENSI JAMUR ANTAGONIS YANG BERASAL DARI HABITAT TANAMAN PISANG
DENGAN DAN TANPA GEJALA LAYU FUSARIUM UNTUK MENGENDALIKAN
Fusarium oxysporum f.sp. cubense SECARA IN VITRO
I Made Sudarma, D.N. Suprapta
Jurusan Agroekoteknologi, Fakultas Pertanian, Universitas Udayana
E-mail: [email protected]
ABSTRACT
Fusarium oxysporum f.sp. cubense (Foc), the cause of the
Fusarium wilt disease on banana plant, is one of the important soil borne pathogens which may lead to a signifi cant loss in Indonesia’s banana yield. This study was done in order to know the soil fungus population and antagonists in the soil of banana plant habitats with Fusarium wilt symptom (HN) and banana plant habitat without Fusarium wilt symptom (HF). The soil samples were collected from three regencies in Bali,
i.e. Karangasem, Klungkung and Jembrana which are
the main banana growing area in Bali. Soil sampling was done in two sites in each regency representing the banana habitat with and without Fusarium wilt
symptom, by collecting 100 grams of soil surrounding the banana plant at the depth of 20 cm, for soil microbes analysis with three replication. Population density of fungi were determined based on plate account technique.
A total of 115 different fungus isolate were recovered from banana crop habitats with and without Fusarium wilt symptom. These were than assessed for their antagonist ability against Fusarium oxysporum f.sp. cubense
(Foc) in vitro. Results indicated that 75 of all fungus
isolate active against Foc. The density of soil fungus which are potentially to be antagonist against Foc such as Trichoderma spp., Aspergillus spp., Penicillium spp. and Gliocladium sp. is higher in the soil of HN compared
to the soil HF. The antagonists can inhibited the Foc myselium growth 81,8 ± 3,2 %, 84,6 ± 1,9%, 83,9 ± 2% and 77,8 ± 2,4 % respectively.
Keywords : Fusarium oxysporum f.sp. cubense, antagonist
and Fusarium wilt symptom.
PENDAHULUAN
Pengendalian penyakit tumbuhan yang ramah lingkungan dan yang menunjang pertanian berkelanjutan dapat dicapai dengan menggunakan agensia hayati. Pengendalian hayati bertujuan untuk menurunkan penggunaan pestisida sintetis yang berdampak terhadap lingkungan dan pangan. Pemanfaatan mikroba atau produk mikroba untuk pengendalian penyakit tumbuhan dan untuk meningkatkan produksi tanaman merupakan bagian
terpadu dari pertanian berkelanjutan (Haggag dan Muhamed, 2007).
Jamur yang diisolasi dari dalam tanah supresif memiliki potensi yang besar untuk dimanfaatkan sebagai agensia hayati (Westphal dan Becker, 2001; Ting et al., 2009). Pemanfaatan Trichoderma spp. seperti
T. virens (Gliocladium virens), T. harzianum dan T. viride
sebagai agensia hayati telah banyak digunakan bahkan telah dijual dalam bentuk produk komersil untuk mengendalikan penyakit rebah kecambah dan penyakit akar yang disebabkan oleh Fusarium, Rhizoctonia dan Pythium spp. (Whipps dan Lumsden, 2001).
Pengendalian patogen dengan mikroba antagonis dapat dihasilkan dari satu atau lebih mekanisme antagonistik tergantung atas jenis mikroba antagonis. Pengaruh langsung terhadap patogen termasuk kompetisi untuk kolonisasi pada tempat infeksi, kompetisi karbon dan sumber nitrogen, kompetisi besi melalui produksi senyawa pengikatan besi (iron-chelating compounds) atau siderofor, senyawa antimikroba seperti
antibiotik dan HCN, degradasi faktor perkecambahan patogen atau faktor patogenisitas dan parasitisme. Faktor ini dapat bersamaan dengan mekanisme secara tidak langsung, termasuk perbaikan hara tanaman dan kompensasi kerusakan, perubahan dalam anatomi sistem akar, perubahan mikroba dalam rhizosfer dan aktivasi mekanisme ketahanan tanaman (Barea et al.,
2005).
Kepadatan populasi dan keragaman mikroba yang terdapat pada habitat tanaman pisang tanpa gejala layu Fusarium atau tanah supresif, memegang peranan
penting dalam meningkatkan kesehatan dan kualitas tanah. Kajian diperlukan untuk mengetahui potensi jamur antagonis yang berasal dari dua habitat tanaman pisang dengan dan tanpa gejala layu Fusarium.
BAHAN DAN METODE Survei Penyakit Layu Pisang
Survei penyakit layu pisang dilakukan di tiga kabupaten yaitu Karangsem, Klungkung dan Jembrana. Setiap kabupaten dipilih dua lokasi yang masing-masing mewakili lokasi HN dan HF. Di kabupaten Karangsem dipilih desa Pesedahan untuk lokasi HN dan desa Buitan untuk lokasi HF, di kabupaten Klungkung
dipilih desa Pesinggahan untuk lokasi HN dan desa Belatung untuk lokasi HF, dan di kabupaten Jembrana desa Yehsembung untuk lokasi HN dan desa Pekutatan untuk lokasi HF. Waktu survei penentuan lokasi HN dan HF dilaksanakan bulan Juli 2009, dan pengambilan tanah sampel dilakukan Agustus 2009, sedangkan waktu pelaksanaan penelitian bulan Oktober 2009 sampai dengan Juli 2010
Pengambilan tanah sampel
Tanah sampel diambil untuk setiap habitat di dekat perakaran tanaman, empat lobang dengan kedalaman kurang lebih 20 cm. Tanah yang diambil dari setiap lobang dicampur secara merata dan diambil 100 g untuk analisis mikroba tanah. Pengambilan tanah sampel diulang tiga kali. Tanah sampel kemudian dimasukkan ke dalam tas plastik dan diletakkan dalam es box. Semua tanah sampel disimpan dalam refrigerator 18 sampai 24 jam sebelum dilanjutkan dengan analisis mikroba.
Isolasi Fusarium oxysporum f.sp. cubense (Foc)
Patogen diisolasi dari pisang yang bergejala layu
Fusarium yang berlokasi di sentra penanaman pisang
di Bali. Setiap tanaman yang bergejala sakit batang semuanya diambil dimasukkan dalam plastik, kemudian di label untuk diamati di laboratorium. Isolasi patogen dilakukan dengan memotong bonggol atau batang palsu pisang sakit kira-kira 1 x 1 cm, setelah itu dicelupkan dalam Beaker glass yang berisi alkohol 70% selama dua
menit untuk menghilangkan kontaminasi pada bagian luarnya, kemudian dibilas dengan mencelupkannya ke dalam akuades steril sebanyak tiga kali. Potongan bonggol/batang sakit diletakkan pada media PDA yang sebelumnya telah diisi dengan antibiotik livoplosaxin (0,5%) dan diinkubasikan selama tiga hari pada suhu kamar. Bentuk spora (mikrokonidia, makrokonidia dan klamidospora) dilihat di bawah mikroskop dan difoto.
Isolasi jamur antagonis
Jamur ditumbuhkan pada media PDA (kentang 200 g, gula 15 g, agar 20 g), antibiotika polimizin atau livoplosaxin (penghambat bakteri), selanjutnya mikroba diambil dari tanah sampel.
Tanah sampel yang diambil kemudian dilakukan pengenceran yang diulang 3 kali (3 piring Petri), kemudian dihitung jumlah coloni (cfu = colony forming unit). Isolasi mikroba tanah dengan jalan masing-masing
10 g tanah dilarutkan dalam 90 ml akuades diaduk secara merata sehingga volume menjadi 100 ml, selanjutnya dilakukan pengenceran pengenceran 10-3 – 10-5. Cairan
diambil sebanyak 1 ml untuk dipindahkan masing-masing ke dalam media PDA, dan diinkubasikan selama 3 hari. Kelompok yang muncul merupakan jenis jamur,
yang selanjutnya dilakukan perhitungan CFU (colony forming unit), dengan tiga kali ulangan. Jamur dengan
uji mikroskopis dan dicocokkan berdasarkan buku identifi kasi Description of Pathogenic Fungi and Bacteria
(CMI, 1981), Introduction to Food-Borne Fungi (Samson et al., 1981), Fungi and Food Spoilage (Pitt dan Hocking,
1997), Illustrated genera of imperfect fungi (Barnett dan
Hunter, 1998), dan Pengenalan Kapang Tropik Umum (Indrawati et al., 1999).
Koloni yang tumbuh dimurnikan untuk mengisolasi jamur kemudian ditumbuhkan dalam media PDA miring. Setelah berumur satu minggu diidentifi kasi melalui uji mikroskopis.
Uji jamur antagonis terhadap Foc
Uji antagonis dilakukan tiga tahap, yakni : (1) uji awal antagonis untuk seluruh jamur yang didapat terhadap Foc, (II) Bioassay uji antagonis dengan ulangan 3 kali jamur antagonis terhadap Foc. Daya hambat dapat dihitung dengan menggunakan rumus, yakni : diameter koloni kontrol dikurangi dengan diameter koloni perlakuan dibagi dengan diameter koloni kontrol kali 100%.
Jamur yang telah diketahui berpotensi antagonis dari habitat tanaman pisang dengan dan tanpa gejala layu Fusarum, lebih banyak atau sedikit dapat diuji
dengan menggunakan analisis Chi kuadrat (Gomes dan Gomes, 2007; Sugiyono, 2009).
HASIL DAN PEMBAHASAN
Sebanyak 115 isolat yang terdiri atas 11 jenis jamur tanah telah berhasil diisolasi. Enam jenis berasal dari lokasi HN dan lima jenis berasal dari lokasi HF. Enam jenis jamur pada lokasi HN terdiri atas empat genus yaitu Aspergillus (A. nidulans, dan A. niger), Gliocladium sp., Penicillium (P. digitatum dan P. notatum) dan Trichoderma
spp., sedangkan pada lokasi HF ditemukan hanya dua genus yaitu : Aspergillus (A. nidulans dan A. terreus) dan Penicillium (P. digitatum dan P. notatum) (Tabel 1). Semua
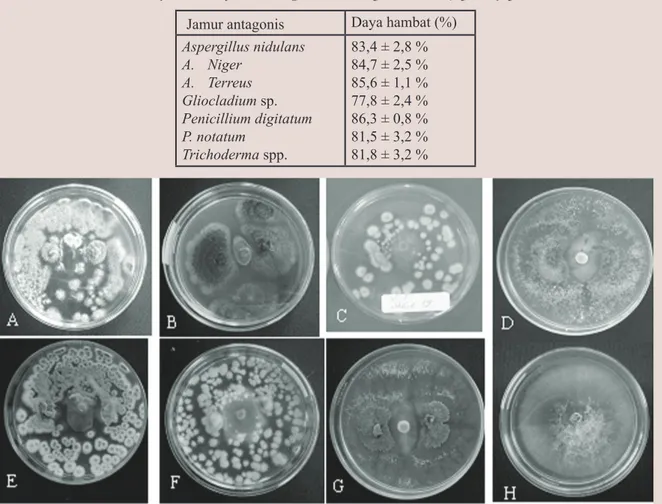
jamur antagonis ini dapat menghambat Foc melalui mekanisme kompetisi (Gambar 1).
Aspergillus spp. (A. niger, A. fumigatus dan A. repens) telah
dicoba secara in vitro, dapat menekan pertumbuhan
jamur P. palmivora penyebab penyakit busuk buah
kakao. Aspergillus niger memiliki daya hambat tertinggi
dibandingkan kedua jamur lainnya (A. fumigatus dan A. repens), yaitu sebesar 54% (Adebola dan Amadi, 2010). Aspergillus niger dapat memperbaiki pengendalian
biologi dari inokulan bakteri (P. fl uorescens) terhadap
penyakit nematoda puru akar (root-knot namtodes), jamur
antagonis ini dapat digunakan untuk melindungi biji bunga matahari dari serangan Fusarium spp. (Siddiqui
Tabel 1. Daya hambat jamur antagonis terhadap Fusarium oxysporum f.sp. cubense
Gambar 1. Jamur antagonis terhadap Foc, A = Aspergillus nidulans, B = A. niger, C = A. terreus, D = Gliocladium sp., E =
Penicillium digitatum, F = P. notatum, G = Trichoderma sp. dan H = control (Foc). B dan C umur 3 hari, sedangkan
yang lainnya umur 7 hari.
Aspergillus terreus dapat menghambat pertumbuhan
jamur patogen Botrytis cinerea karena mengeluarkan
senyawa volatile seperti :
α
-phellandrene, acetic acid pentyl ester dan 2-acetyl-5-methylfuran (Ting et al.,2010). Aspergillus nidulans dapat bersifat antagonistik
terhadap Colletotrichum gloeosporioides penyebab penyakit
antraknose pada tanaman vanili. Hasil penelitian Fakhrunnisa et al. (2006) menemukan bahwa A. niger, A. fl avus, A. terreus dan A. versicolor dapat menghambat
pertumbuhan Fusarium spp. dengan membentuk
zone hambatan secara in vitro. Bosah et al. (2010)
juga telah menemukan bahwa Aspergillus spp. dapat
menghambat pertumbuhan jamur patogen Sclerotium rolfsii dengan daya hambat sebesar 73,12 – 88,35%.
Proses penghambatan disebabkan karena Aspergillus
spp. menghasilkan enzim chitinase dan
β
-1, 3 glucanase (Laminarinase) yang mempunyai kemampuan untuk memecah komponen dinding sel jamur patogen seperti : chitin danβ
-1, 3 glucan.Jamur Gliocladium menghasilkan antibiotik dalam
aktivitasnya sebagai biokontrol yaitu gliovitrin dan gliotoksin (Handelsman dan Stabb, 1996; Whipps, 2001).
Gliocladium virens dapat menghambat pertumbuhan Sclerotium rolfsii menyebabkan penyakit lebih dari 500
spesies tanaman (Yaqub dan Shahzad, 2005). Jamur
G. penicillioides diisolasi dari pupuk kompos bersifat
mikoparasit dan memiliki kemampuan antagonis terhadap Phytophthora cinnamomi (Aryantha dan Guest,
2006). Gliocladium sp. telah dikemas dalam produk
biopestisida yang memiliki aktivitas antijamur untuk tanaman hias, sayuran dan tanaman tahunan, dapat diaplikasikan kembali setiap 1- 4 minggu (Gaskin et al.,
2010). Penyakit tanaman hortikultura yang disebabkan oleh Botrytis cinerea telah mampu dikendalikan dengan
memanfaatkan G. roseum (Sutton et al. 1997). Hasil
peneltian Punja et al. (2007) menunjukkan G. catenulatum
paling efektif menurunkan penyakit Fusarium root
dan stem rot (RSR) yang disebabkan oleh F. oxysporum
f.sp. radicis-cucumerinum pada tanaman mentimun,
dan Winarsih (2007) menggunakan G. virens utuk
mengendalikan penyakit layu Fusarium pada tanaman
tomat.
Penicillium sp. telah dicoba sebagai mikroba antagonis
terhadap Sclerotium rolfsii yang merupakan patogen tular
Jamur antagonis Daya hambat (%)
Aspergillus nidulans A. Niger A. Terreus Gliocladium sp. Penicillium digitatum P. notatum Trichoderma spp. 83,4 ± 2,8 % 84,7 ± 2,5 % 85,6 ± 1,1 % 77,8 ± 2,4 % 86,3 ± 0,8 % 81,5 ± 3,2 % 81,8 ± 3,2 %
tanah yang merusak lebih dari 500 spesies tanaman, namun daya hambatnya paling rendah dibandingkan
Trichoderma sp. dan Aspergillus sp. yakni sebesar
56.98-46.24% (Bosah et al., 2010). Manurut Haggag
dan Mohamed (2007), Penicillium sp. dapat bersifat
antagonis melalui mekanisme yaitu mengeluarkan beberapa senyawa alkaloid seperti agroklavine dan ergometrine yang memiliki sifat anti jamur terhadap
Botrytis cinerea, Fusarium solani dan Alternaria tenius. Idris et al., (2008) telah menemukan Penicillium sp. sebagai
mikroba antagonis terhadap Genoderma sp. penyebab
penyakit pada tanaman Palma. Penicillium sp. juga telah
dicoba dalam mengendalikan penyakit Lanas pada tanaman tembakau yang disebabkan oleh Phytophthora parasitica var. nicotianae (Roeswitawati, 2007).
Penicillium notatum penghasil senyawa antibakteri,
pertama kali ditemukan oleh Alexander Flaming pada tahun 1928 untuk mengendalikan khususnya bakteri cocci gram-negatif. Senyawa ini dikenal dengan penisilin. Mekanisme kerja penisilin yakni memiliki aktivitas terhadap sintesis peptidoglycan, yang menyebabkan lisis dan kematian sel. Mereka menghambat salah satu dari stadium yang dibutuhkan untuk lintas ikatan peptidoglycan, transpeptidasi, karena kemiripan streriochemical di antara molekul
penisilin dan D-Ala-D-Ala dipeptide. Enzim ini berlokasi di daerah luar dari membrane sitoplasma : protein mengikat penisilin (penicillin-binding protein/PBP)
(Bryskier, 2005).
Trichoderma spp. telah banyak diselidiki sebagai
agensia hayati untuk mengendalikan berbagai penyakit tanaman tertentu, T. harzianum dan T. viride telah
banyak dikomersialkan untuk mengendalikan penyakit busuk akar, dan penyakit rebah kecambah yang disebabkan oleh jamur Fusarium, Rhizoctonia dan Pythium (Whipps dan Lumsden, 2001; Verma et al.,
2007). Trichoderma harzianum efektif digunakan untuk
mengendalikan patogen F.culmarum, F. oxysporum, F.
moniliforme, R.solani, Sclerotium rolfsii, Gaeumannomyces graminis var. tritici dan Drechslera sorokiniana (Kucuk dan
Kivanc, 2003; Yacob dan Shahzad, 2005; Haggag dan Mohamed, 2007).
Trichoderma harzianum memiliki kemampuan antagonis paling baik dibandingkan dengan mikroba antagonis yang lain, seperti B. thuringiensis, Rhizobium meliloti and A. niger untuk mengendalikan penyakit
busuk akar tanaman bunga matahari (Dawar et al,
2008). Trichoderma viride efektif digunakan secara in vitro dalam mengendalikan patogen pascapanen
seperti : Aspergillus niger, A.fl avus, A. fumigatus, Fusarium sp.
dan Penicillium sp. (Rajendiran et al., 2010), dan dapat
membebaskan tanaman jahe dari serangan patogen
Ralstolnia solanacearum (Bustaman, 2006).
Mekanisme penghambatan jamur Trichoderma
tehadap Foc yaitu : (1) Menghasilkan enzim chitinase,
β
-1,3-glucanase (Katatny et al., 2000),β
-1,4 glucanase dan lipase yang dapat memecah senyawa chitin, glucan dan lemak dinding sel patogen (Benitez et al., 2004; Diby et al., 2005; Vinale et al., 2008); (2) mikoparasitisme(Howell, 2003); (3) antibiosis dengan menghasilkan antibiotik 6-pentyl-a-pyrone (6PP), asam heptilidat dan peptaibol (Barea et al., 2005; Vinale et al. 2008);
(4) kompetisi hara dan ruang (Lo, 1998; Benıtez et al.,
2004); (5) kolonisasi akar (Harman et al., 2004; Vinale et al. 2008); menginduksi ketahanan lokal dan sistemik
(Harman, 2006; Soesanto, 2008).
Kepadatan populasi dan jumlah jenis jamur antagonis yang terdapat pada habitat tanaman pisang tanpa gejala layu Fusarium lebih banyak dan sangat
nyata (P<0,01) dibandingkan dengan jamur antagonis yang terdapat pada habitat tanaman pisang dengan gejala layu Fusarium. Hal ini membuktikan bahwa tanah
supresif dapat melindungi tanaman pisang dari serangan Foc, karena kepadatan populasi jamur antagonis lebih banyak dibandingkan dengan tanah kondusif (Tabel 2).
Tabel 2. Kepadatan populasi jamur antagonis yang pada setiap tanah sampel
Keterangan : ** Kepadatan populasi jamur antagonis terhadap Foc pada habitat tanaman tanpa gejala layu Fusarium lebih banyak dibandingkan pada habitat tanaman pisang dengan gejala layu Fusarium (P<1%). Ao = lokasi Desa Pesedahan-Karangasem, As = lokasi Desa Buitan-Karangsem, Bo = lokasi Desa Pesinggahan-Klungkung,Bs = lokasi Desa Belatung-Klungkung, Co = lokasi Desa Yehsumbul-Jembrana, dan Cs = Habitat dengan gejala layu Fusarium Desa Pekutatan-Jembrana
Jamur antagonis
Kepadatan populasi jamur antagonis pada setiap tanah sampel x 103
Ao As Bo Bs Co Cs
Kepadatan populasi** 24 19 14 12 10 4
Jumlah jenis
KESIMPULAN
Kepadatan populasi jamur antagonis pada habitat tanaman pisang tanpa gejala layu Fusarium lebih tinggi
dibandingkan pada habitat dengan gejala layu Fusarium,
sedangkan jumlah jenisnya hampir sama. Jumlah isolat jamur yang ditemukan hasil isolasi dari habitat tanaman pisang dengan dan tanpa gejala layu Fusarium
sebanyak 115 isolat. Hasil uji antagonis menunjukkan hanya 75 isolat memiliki potensi sebagai mikroba antagonis terhadap Fusarium oxysporum f.sp. cubense
secara in vitro. Tiga genus jamur antagonis dari 75 isolat
telah diidentifi kasi yakni : Aspergillus (A. fumigatus, A. niger
dan A. terreus), Penicillium (P. digitatum, dan P. notatum) dan Trichoderma spp. masing-masing dengan daya hambat
terhadap pertumbuhan miselium Foc yaitu : 81,8 ± 3,2 %, 84,6 ± 1,9%, 83,9 ± 2% dan 77,8 ± 2,4 %.
UCAPAN TERIMA KASIH
Terima kasih ditujukan kepada kepala Laboratorium Mikrobiologi Fakultas Ilmu Pengetahuan Alam dan Matematika serta Kepala Laboratium Biopestisida Fakultas Pertanian Universitas Udayana atas kemudahan yang diberikan selama mengadakan penelitian.
DAFTAR PUSTAKA
Adebola, M.O. and J.E. Amadi, 2010. Screening three Aspergillus species for antagonistic activities against the cocoa black pod organism (Phytophthora palmivora). Agriculture and Biology Journal of North
America. 1(3): 362-365.
Aryantha, I N.P. and D.I. Guest. 2006. Mycoparasitic and antagonistic inhibition on Phytophthora cinnamomi Rands by microbial agents isolated from
manure composts. Palnt Pathology Journal 5(3) : 291-298.
Barea, J.M., M.J. Poso, R. Azcon and C. A. Aguilar. 2005. Microbial co-operation in the rhizosphere. Journal of Experimental Botany. Pp. 1-18.
Barnett, H.L., B.B. Hunter. 1998. Illustrated Genera of Imperfect Fungi. APS Press. The American Phytopathological. St. Paul, Minnesota. Pp. 218. Benıtez, T., Rincon, A.M., Limon, M.C., Codon, A.C.,
2004. Biocontrol
mechanisms of Trichoderma strains. International
Microbiology 7: 249–260.
Bosah, O., C.A. Igeleke and V.I. Omorusi. 2010. In Vitro
Microbial Control of Pathogenic Sclerotium rolfsii.
Int. J. Agric. Biol., 12: 474–476.
Bryskier, A. 2005. Penicillins. In Antibacterial Agents.
Antibacerial and Antifungal. Ed. A. Bryskier. ASM Press. Washington, DC. Pp. : 113-162.
Bustaman, H. 2006. Seleksi Mikroba Rhizosfer Antagonis Terhadap Bakteri Ralstolnia solanacearum
Penyebab Bakteri Layu Bakteri pada Tanaman Jahe di Lahan Tertindas. Jurnal Ilmu-Ilmu Pertanian. 8(1) : 12-18.
CMI. 1981. Description of Pathogenic Fungi and Bacteria. Commonwealth Micological Instutute England. Pp. 1616.
Dawar, S., S. Hayat, M. Anis and M.J. Zaki. 2008. Effect of Seed Coating Material In The Effi cacy of Microbail Aantagonists For The Control of Root Rot Fungi On Okra And Sunfl ower. Pak. J. Bot., 40(3): 1269-1278.
Diby, P., K.A. Sju, P.J. Jisha, Y.R. Sarma, A. Kumar, and M. Anandaraj. 2005. Mycolytic Enzym produced by
Pseudomonas fl uorescens and Trichoderma spp. against Phytophthora capsici, the Foot Rot Pathogen of Black
Pepper (Piper ningrum, L.). Annals of Microbiology 55(2) : 129-133.
Fakhrunnisa, M.H. Hasmi and A. Ghaffar. 2006. In Vitro
Interaction of Fusarium spp. with Other Fungi. Pak.
J. Bot., 38(4): 1317-1322.
Gaskin, J.W., P. hartel, E. Little and G. Harris. 2010. Soil Inoculants. Cooperative Extension. The University of Georgia. 6p.
Gomes, K.A. dan A.A. Gomes, 2007. Prosedur Statistik untuk Penelitian Pertanian. Edisi kedua. Penerbit Universitas Indonesia (UI-Press). 698 h.
Haggag, W.M., and H. A.L. A. Muhamed, 2007. Biotechnological Aspects of Microorganisms Used in Plant Biological Control. American-Eurasian Journal of Sustainable Agriculture, 1(1): 7-12. Handelsman, J. and E.V. Stabb. 1996. Biocontrol of
soilborne plant pathogens. The Plant Cell. 8: 1855-1869.
Harman, G.E., 2006. Overview of mechanisms and uses of Trichoderma spp. Phytopathology. 96, 190–194.
Harman, G.E., C. R. Howell, A. Viterbo, I. Chet and M. Lorito. 2004. Trichoderma species – opportubistic, avirulent plant symbionts. Natural Reviews. Microbiology. 2: 43 – 56.
Howell, C.R. 2003. Mechanisms employed by
plant diseases : the history and evolution of current concepts. Plant Disease. 87(1) : 4-9.
Idris, A.S., S. Nurahida and S. Shamala. 2008. In Vitro Methods for Evaluation of Antagonistic Fungi Against Pathogenic Genoderma. MPOB Information Press. 53: 1-2.
Indrawati. G., R.A. Samson, K. Van den Tweel-Vermeulen, A. Oetari dan I. Santoso. 1999. Pengenalan Kapang Tropik Umum. Yayasan Obor Indonesia. Universitas Indonesia (University of Indonesia Culture Collection) Depok, Indonesia dan Centraalbureau voor Schirmmelcultures, Baarn, The Netherlands. 131 h.
Kucuk, C. and M. Kivanc. 2003. Isolation of Trichoderma
spp. and Determination of Their Antifungal, Biochemical and Physiological Features. Turk. J. Biol. 27 : 247-253.
Lo, C.T. 1998. General mechanisms of action of microbial biocontrol agents. Plant Pathology Bulletin, 7:155-166.
Pitt, J.I. and A.D. Hocking. 1997. Fungi and Food Spoilage. Blackie Avademic and Professional. Second Edition. London-Weinhein-New York-Tokyo-Melboune-Madras. Pp. 593.
Punja, Z.K., S. Rose, and R.Yip. 2007. Biological control of root disease. Presented at the Canadian Greenhouse Conference. Vegetable Session. P: 1-5. Rajendiran, R., D. Jegadeeshkumar, B.T. Sureshkumar
and T. Nisha. 2010. In vitro assessment of antagonistic
activity of Trichoderma viride against post harvest
pathogens. Journal of Agricultural Technology. 6(1): 31-35.
Roeswitawati, D. 2007. Penggunaan Inokulum Antagonis (Jmaur dan Bakteri) dalam Menekan Penyakit Lanas (Phytophthora parasitica var. nicotianae
pada Tembakau. Jurnal Ilmu-Ilmu Pertanian Indonesia. Edisi Khusus, 3 : 418 – 426.
Samson, R.A., E.S. Hoekstra, and C. A.N. Van Oorschot. 1981. Introduction to Food-Borne Fungi. Centraalbureau Voor-Schimmelcultures. Institute of The Royal Netherlands. Academic of Arts and Sciences. Pp. 246.
Siddiqui, I.A., S.S. Shaukat and A. Khan. 2004. Differential impact of some Aspergillus species on
Meloidogyne javanica biocontrol by Pseudomonas fl uorescens strain CHA0. Applied Microbiology. 39:
74-83.
Sugiyono, 2009. Statistika untuk Penelitian. Penerbit Alfabeta. Bandung. 389 h.
Soesanto, L. 2008. Pengantar Pengendalian Hayati Penyakit Tanaman. Suplemen ke Gulma dan Nematoda. Rajawali Pers. PT. Raja Grafi ndo Persada. Jakarta. 573 h.
Sutton, J.C., D.L.G. Peng, H. Yu, P. Zhang and R.M.V. Sanhueza. 1997. Gliocladium reseum. A versatile
adversary of Botrytis cinere in crops. Plant Disease.
81(4) : 316-329.
Ting, A.S.Y., S. Meon, K. Jugah and A.R. Anuar. 2009. Effect of artifi cially induced suppressive soil on Fusarium wilt. InfoMusa. 12(1): 33-34.
Ting, A.S.Y., S.W. Mah and C.S. Tee. 2010. Identifi cation of Volatile Metabolites from Fungal Endophytes with Biocontrol Potential towards Fusarium oxysporum F. sp. cubense Race 4. American Journal of
Agricultural and Biological Sciences, 5 (2): 177-182. Verma, M., S. K. Brar, R.D. Tyagi, R.Y. Surampalli, and
J.R. Val´ero. 2007. Antagonistic fungi, Trichoderma
spp.: Panoply of biological control. Biochemical Engineering Journal 37: 1–20.
Vinale, F. , K. Sivasithamparam, E. L. Ghisalberti, R. Marra, S. L. Woo, M. Lorito. 2008. Trichoderma– plant–pathogen interactions. Review Article. Soil Biology & Biochemistry, 40: 1–10.
Westphal, A. and J.O. Becker, 2001. Components of soil suppressiveness against Heterodera schachii. Soil Biology and Biotechnology. 33: 9-16.
Whipps, J.M. 2001. Microbial interactions and biocontrol in the rhizosphere. Journal of Experimental Botany. 52: 487-511.
Whipps, J.M. and R.D. Lumsden. 2001. Commercial use of fungi as plant disease biocontrol agents : status and prospects. CCAB International. Eds. T.M. Butt, C. Jackson and N. Magan. Pp. 9-22.
Yacob, F. and S. Shahzad. 2005. In Vitro Evaluation of
Microbial Anatgonists Against Sclerotium rolfsii. Pak.