BAB 2
TINJAUAN PUSTAKA
2.1. Tumbuhan Bunga Mawar Putih (Rosa hybrida L.)
Tumbuhan mawar tersebar menjadi 100 spesies lebih, yang kebanyakan tumbuh di bagian daerah yang berudara sejuk. Spesies mawar dimasukkan dalam kategori semak yang berduri atau tanaman yang memanjat yang tingginya mencapai 1 sampai 5 meter, dan daunnya yang panjangnya antara 5-15cm. Daun majemuk yang tiap tangkai daun terdiri dari paling sedikit 3 atau 5 hingga 9 atau 13 anak daun. Daunnya berbentuk lonjong, pertulangan menyirip, meruncing di ujung daun, tepi beringgit. Tanaman mawar dapat tumbuh dengan baik di dataran rendah hingga dataran tinggi tetapi untuk jenis Mawar tea atau teh hibrida hanya menyukai dataran tinggi sebab bunganya akan tumbuh dengan sempurna, baik bentuk, ukuran, warna, maupun baunya. Tanaman mawar tidak menyukai air yang menggenang. Mawar dapat tumbuh dengan baik pada tanah yang derajat keasaman pH-nya anara 6-8 (Soekartiwi,1996).
Berdasarkan hasil determinasi Bunga Mawar Putih dari Herbarium Medanese diperoleh sistematika sebagai berikut:
Kingdom : Plantae
Divisi : Spermatophyta Class : Dicotyledoneae
Ordo : Rosales Famili : Rosaceae Genus : Rosa
Spesies : Rosa hybrida L. Nama Lokal : Mawar Putih
Bunga mawar memiliki berbagai macam spesies/varietas yang sangat banyak sekali dan tersebar di seluruh dunia, salah satunya adalah R. hybrida L. termasuk dalam Famili Rosaceae, sering dijuluki Prince of flower karena keindahan bentuk dan warnanya, serta baunya yang harum memikat. Mawar berwarna beragam, yaitu merah, merah jambu, kuning, ungu, putih, dan lain-lain. Mawar dapat dimanfaatkan sebagai bunga potong dan tanaman hias, serta sebagai bahan industri kosmetika atau pewangi makanan. Tim Direktorat Bina Produksi Holtikultura (1988) mencatat bahwa penggolongan mawar menjadi sembilan kelompok utama, yaitu:
1. Hybrid tea, jenis bunga mawar yang bertangkai panjang dengan bunga tunggal di ujungnya.
2. Floribunda, jenis bunga mawar yang bunganya cukup besar dan warnanya yang bervariasi dan memiliki tangkai tegak panjang.
3. Grandiflora, jenis bunga mawar yang berukuran raksasa dengan diameter dapat mencapai 7,5-12,5 cm
4. Climbing rose, jenis bunga mawar yang berkisar 5-15 cm dan tumbuh merunduk karena beratnya cabang serta tersusu dalam tandan yang jarang. Kelompok mawar ini baru dapat berbunga seelah umurnya lebih dari dua tahun
5. Polyantha, jenis bunga mawar yang memiliki bunga kecil dengan diameter 5cm dan di dekat pucuk cabang terdapat banyak ranting yang masing-masing memiliki sekuntum bunga
6. Hybrid perpetual, jenis bunga mawar dengan diameter bunga sangat lebar hingga 15 cm
7. Mawar tea, jenis bunga mawar yang disebut nenek moyang mawar di Asia dengan ukuran bunga kecil
8. Mawar tua, yang disebut dengan mawar kuno dan memiliki aroma yang sangat wangi
9. Special purpose, jenis bunga mawar yang dibedakan atas tiga golongan, yaitu mawar pohon, mawar perdu, dan mawar mini yang mana masing masing memiliki nama-nama latin mawar yang berbeda (Luqman, 1992).
2.2. Senyawa Flavonoida
Flavonoida adalah golongan polifenol yang terdiri atas 15 atom karbon yang dihasilkan oleh seluruh tumbuhan. Lebih dari 4000 jenis flavonoid telah diidentifikasi, sejumlah besar yang telah diteliti memiliki aktifitas therapeutic. Sejumlah flavonoid yang tampak memiliki aktifitas anti viral yakni melawan virus (Walsh, 2003).
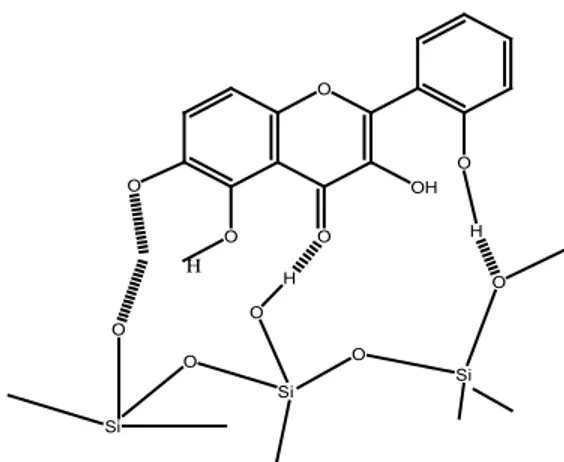
Berikut adalah struktur senyawa flavonoida dan penomorannya
O O A B C 1 2 3 4 5 6 7 8 9 10 1' 2' 3' 4' 5' 6'
Gambar 2.1. Struktur Senyawa Flavonoida
Flavonoid juga merupakan kelompok terbesar dalam hasil alam yang mana tersebar luas dalam sejumlah tumbuhan tingkat tinggi tetapi ada ditemukan juga pada beberapa tumbuhan tingkat rendah termasuk alga. Antosianidin biasanya banyak terdapat pada mayoritas bunga yang berwarna dari kelompok
angiospermae, tetapi pada bunga yang tidak berwarna juga banyak tersebar luas dan melimpah (Hill, et al., 1991).
Istilah flavonoida diberikan pada suatu golongan besar senyawa yang berasal dari kelompok yang paing umum, yaitu senyawa flavon, suatu jembatan oksigen terdapat diantara cincin A dalam kedudukan orto, dua atom karbon benzil yang terletak disebelah cincin B. Senyawa heterosiklik ini, pada tingkat oksidasi paling rendah dan dianggap sebagai struktur induk. Kerangka flavonoid dapat ditulis sebagai sistem C6-C3-C6 yang mana senyawa-senyawa flavonoid adalah senyawa 1,3 diarilpropana, senyawa isoflavonoid adalah senyawa 1,2 biarilpropana, sedang senyawa-senyawa neoflavonoid adalah 1,1 diarilpropana yang merupakan turunan flavonoida (Manitto, 1981).
2.2.1. Klasifikasi Senyawa Flavonoida
Flavonoida mengandung sistem aromatik yang terkonjugasi sehingga menunjukkan pita serapan kuat pada daerah spektrum sinar ultraviolet dan spektrum sinar tampak, umumnya dalam tumbuhan terikat pada gula yang disebut dengan glikosida (Harborne, 1996).
1.Flavonoida O-Glikosida O O O HO HO OH ROH2C
Pada flavonoid O-glikosida, satu atau lebih gugus hidroksil terikat pada gula atau lebih. Flavonoid O-glikosida ini bersifat hemiasetal yang tidak tahan asam yang diakibatkan ikatan hidroksil dapat diputus oleh adanya asam.
O
O HO
HO OH
ROH2C
Pada flavonoida C-glikosida, gula dapat terikat pada atom karbon flavonoid dengan ikatan karbon-karbon yang tahan asam apabila dibandingkan dengan flavonoid o-glikosida. Tetapi hanya beberapa jenis gula saja yang dapat berikatan dengan flavonoid C-glikosida yakni galaktosa seperti; ramnosa, xilosa dan arabinosa. Dalam hal ini tidak semua jenis gula dapat terikat pada flavonoid C glikosida. Gula dapat terikat pada atom C yang ditemukan pada atom C nomor 6 dan 8 dalam cincin A. Tetapi flavonoida juga dapat mengalami O-glikosilasi menjadi flavonoida C-glikosida.
3.Flavonoid Sulfat
Pada flavonoid Sulfat, satu ion sulfat berikatan pada gugus hidroksi fenol flavonoid tersebuth. Contohnya Flavonoida O-SO3K yang berupa garam. Senyawa flavonoida sulfat ini mudah larut dalam air. Flavonoida sulfat terikat pada hidroksi fenol yang bebas atau dapat menggantikan gula.
O O OH O KO3S 4.Biflavonoid
Pada biflavonoid merupakan dua golongan flavonoid baik berbeda atau sama yang bergabung contoh flavonol dan flavanon dan lain sebagainya. Biflavonoid jarang ditemukan sebagai glikosida.
O
O O
O
OH
(amentoflavon, suatu biflavonoid)
5.Aglikon flavonoid optis-aktif
Pada aglikon flavonoid yang aktif-optik yakni berkaitan dengan stereokimia-mutlak flavonoid. Dimana putaran 589,3 nm, garis D natrium. Yang termasuk dalam golongan aglikon optis aktif (yaitu memutar cahaya terpolarisasi-datar) adalah katekin, pterokarpan, rotenoid dan beberapa biflavonoid. Putaran aglikon flavonoid alam berkaitan dengan stereokimia mutlak flavonoid (Markham,1988). Berikut juga penggolongan flavonoida menurut Robinson berdasarkan keragaman pada rantai C3 yakni :
1.Flavonol
O
O
Flavonol sangat tersebar luas di dalam tumbuhan, baik sebagai kopigmen antosianin dalam daun bunga maupun dalam daun tumbuhan tinggi. Dalam tumbuhan terdapat banyak sekali glikosida flavonol. Sampai saat ini yang paling umum adalah kuersetin 3-rutinosida yang dikenal sebagai rutin. Flavonol adalah derivatif 3-hidroksi dari flavon dan mempunyai panjang gelombang band I pada 352 nm dan pada band II pada 240-285nm (Bhat, 2005).
2.Flavanon
O
O
Flavanon mempunyai panjang gelombang band I pada 304 nm dan pada band II pada 240-285nm. Flavanon dibentuk secara biosintesis dari khalkon oleh adanya enzim khalkon isomerase. Cincin tertutup menghasilkan 2-phenylbenzopyran-4, yang mempunyai karbon asimetris pada C-2. (Harborne, 1999).
Penentuan struktur flavanon dilakukan dehidrogenasi ikatan -2,3, memberikan flavon. Bentuk aromatik tersubstitusi biasanya dapat dikenal dengan pergeseran kimia dan bentuk penggabungan o,m,p proton-priton cincin A dan B. Flavanon terdistribusi luas di alam. Flavanon terdapat dalam kayu, daun dan bunga. Flavanon glikosida merupakan konstituen utama dari tanaman genus prunus (famili Rosaceae) dan buah jeruk (Sastrohamidjojo, 1996).
O
O
OH
Dihidroflavanol adalah 3-hidroksi derivatif dari flavanon dan mempunyai panjang gelombang maksimum band I 300-320nm dan pada band II 270-295nm (Bhat, 2005). Dalam biosintesis flavonoid, dihidroflavanol dibentuk dengan penambahan oksidasi dari gugus hidroksil pada posisi C-3 dari flavanon. Mereka ditunjukkan sebagai 3-hidroksiflavanon atau flavanon-3-ol (Harborne, 1999).
4.Kalkon
O
Kalkon merupakan senyawa C6-C3-C6 yang merupakan prekursor pertama dalam biosintesis flavonoid. Kalkon merupakan struktur flavonoida cincin C terbuka yang paling sederhana. (Harborne, 1999). Kalkon bertindak sebagai prekursor untuk pembentukan turunan flavonoid. Kalkon tidak mengandung cincin γ pyron dan mempunyai cincin terbuka yang mana terhubung dengan dua cincin aromatik dan dihubungkan oleh tiga atom karbon α,β tak jenuh. Kalkon mempunyai panjang gelombang maksimum pada band I 340-390nm dan pada band II 220-270nm (Bhat, 2005).
Pengubahan kalkon menjadi flavanon terjadi dengan mudah dalam larutan asam dan reaksi kebalikannya dalam basa. Reaksi ini mudah diamati karena
kalkon warnanya jauh lebih kuat daripada warna flavanon, terutama dalam larutan basa warnya merah jingga (Robinson,1995).
5.Isoflavon
O
O
Isoflavon adalah mengandung cincin benzo-γ −pyron. Isoflavon mempunyai substitusi phenil pada posisi 3 pada cincin pyron dan isoflavon mempunyai panjang gelombang maksimum pada band I 300-340nm dan pada band II 245-270nm (Bhat, 2005).
6.Antosianidin
O
+
Warna biru, ungu, violet dan merah yang tampak pada bunga, buah dan batang dari tumbuhan dikarenakan karena adanya pigmen antosianidin (Ikan, 1991). Antosianidin mempunyai panjang gelombang maksimum pada band I 465-550nm dan pada band II 270-280nm (Bhat, 2005).
O
O
O
OCH3 O
Istilah rotenoid pertama dikenal karena adanya rotenon dan rotenon dibentuk dari siklisasi cincin dari metoksi-isoflavon. Rotenoid sangat berpotensi sebagai insektisida dan pembunuh ikan (Dewick, 2002).
8.Auron
O
O CH
Auron memiliki kerangka 2-benzylidene-coumaranone atau 2-benzylindene-3-(2H)-benzofuranon. Auron hanya mempunyai panjang gelombang maksimum pada band I 340-430nm (Bhat, 2005).
2.3.Teknik Pemisahan
Teknik pemisahan memiliki tujuan untuk memisahkan komponen yang akan ditentukan berada dalam keadaan murni, tidak tercampur dengan komponen-komponen lainnya (Muldja, 1995). Secara umum, kondisi ekstrem dari pH, suhu, pelarut organik dan penggunaan senyawa pengoksidasi dan pereduksi harus
dihindari ketika melakukan pemisahan molekul dari bahan-bahan hidup, sebab hal ini akan berisiko menyebabkan hilangnya aktivitas biologi (Bintang ,2010).
2.3.1. Ekstraksi
Tumbuhan adalah material yang terdiri atas beberapa senyawa (kompleks) yang menghasilkan beberapa metabolit sekunder dengan kepolaran dan gugus fungsi yang berbeda dalam strukturnya. Pada umumnya senyawa bahan alam meliputi, zat lilin, asam lemak, polietilen, terpen, steroid, fenolik (fenol sederhana, feni propanoid, flavonoid, tanin, antosianin, quinon, kumarin, lignan), alkaloid, dan derivat – derivat glikosida(saponin, kardiak glikosida dan flavonoid glikosida). Beberapa pendekatan yang dilakukan untuk mengekstraksi material tumbuhan pada zaman dahulu air digunakan untuk mengekstrak. Tetapi sekarang sudah menggunakan pelarut organik dengan tingkat kepolaran yang berbeda untuk mengekstraksi kandungan tumbuhan misalkan dengan menggunaan sokletasi, reflux, destilasi uap, ekstraksi dengan menggunakan tekanan (Sarker, 2006).
Tiga metode dasar pada ekstraksi cair-cair adalah ekstraksi bertahap(batch), ekstraksi kontinyu, dan ekstraksi counter current. Ekstraksi bertahap adalah cara yang paling sederhana dimana caranya cukup dengan menambahkan pelarut pengekstraksi yang tidak bercampur dengan pelarut semula kemudian dilakukan pengocokan sehingga terjadi kesetimbangan konsentrasi zat yang akan diekstraksi pada kedua lapisan, didiamkan dan dipisahkan (Khopkar, 1990).
2.3.1.1.Perkolasi
Salah satu metode ekstraksi lainnya dapat dikenal dengan perkolasi yang menggunakan alat perkolator. Perkolator adalah suatu tabung yang berbentuk terbalik dan dibagian bawah dipasang keran. Di dalam tabung tersebuth
merupakan tempat simplisia yang akan dialiri dengan pelarut. Sehingga perkolator akan mengekstrak simplisia dan hasil ekstrak turun melalui keran sehingga dalam hal ini pelarut dapat berganti-ganti setelah pelarut yang lain habis. Metode perkolasi adalah metode maserasi cara dingin yang terbarukan yakni metode ekstraksi cara dingin (Pavia, 1995).
2.3.1.2. Sokletasi
Metode Ekstraksi sokletasi merupakan ekstraksi cara panas yang dimana menggunakan tabung soklet. Simplisia yang akan diekstraksi diletakkan dalam sebuah sarung yang terbuat dari kertas saring dan sarung soklet tersebut dimasukkan ke dalm tabung soklet. Sebuah labu didih pelarut ditempatkan dibawah tabung soklet sehingga pelarut akan menguap naik ke kondensor dan membasahi tabung soklet. Ekstraksi sokletasi berlangsung secara kontinu (Pavia,1995).
2.3.1.3. Maserasi
Maserasi adalah salah satu teknik ekstraksi yang dimasukkan dalam metode ekstraksi dingin. Maserasi dilakukan tanpa adanya penggunaan suhu dalam menarik metabolit dari simplisia. Metode ekstraksi dingin ini lebih sederhana dan dapat digunakan untuk ekstraksi maserasi skala besar menggunakan pelarut yang sesuai.
Kromatografi adaah sebuah proses fisika dalam memisahkan yang diakibatkan oleh perbedaan afinitas dengan adanya dua fase yakni fase diam dan fase gerak berupa cair yakni dinamakan kromatografi cair dan apabila fase geraknya berupa gas maka dinamakan kromatografi gas. Kedua teknik ini sangat berkembang baik dalam analisis makanan dan metabolit sekunder (Egan, 1981).
Kromatografi merupakan teknik untuk pemisahan dan pemisahan dari campuran. Teknik ini dilihat berdasarkan pemisahan warna atau noda campuran antara dua fase, yakni fase diam dan fase gerak. Ada 4 tipe kromatografi yakni ;
1. Kolom kromatografi 2. Kromatografi Lapis Tipis 3. Gas kromatografi
4. Kromatografi kertas
Pada kolom kromatografi adsorben berupa bubuk (alumina atau silika gel) yang dibungkus dalam kolom. Sampel dalam skala kecil yang ingin dipisahkan dimasukkan dalam kolom. Pelarut seperti pentana, benzen, eter, dibiarkan turu mengalir di sepanjang kolom. Fraksi-fraksi dikumpul yang merupakan komponen yang sudah dipisahkan. Pada kromatografi lapis tipis memungkinkan untuk memisahkan sampel skala kecil. Plat terbuat dari kaca yang dilapisi dengan selulosa, alumina, silika. Ini dilakukan dengan menyebarkan atau mencelupkan plat ke sebuah chamber. Setelah lempeng/plat kering, plat akan naik sesuai dengan gaya kapilaritas. Pemisahan di campuran yang terjadi di kolom kromatografi. Pada kromatografi kertas proses yang terjadi di dalamnya sama dengan KLT dan dalam hal ini kertas sebagai adsorbent dan pada kromatografi gas digunakan untuk memisahkan dan analisa molekul organik.
Tabel 2.1. Eluen yang digunakan untuk Kromatografi
Petroleum eter Sikoheksana Karbon tetraklorida Toluen
Kloroform
Metil Klorida Tingkat Kepolaran Pelarut Dietil Eter Berdasarkan gugus fungsi Etil Asetat Aseton Piridin Etanol Metanol Air Asam asetat (Bhal, 2007)
Dalam kromatografi dapat dijumpai istilah Rf, yakni Faktor reterdasi. Dibandingkan dengan metode pemisahan secara keseluruhan, klasifikasi metode kromatografi relatif lebih sederhana. Fase gerak dapat berupa gas atau cairan sedangkan fase diam dapat berupa zat cair atau padat. Jadi kita memiliki kombinasi cair-cair, cair-padat, gas-cair, gas-padat. Jika pemisahan terutama meliputi suatu partisi sederhana antara fase diam cair dan fase gerak juga, maka proses dikenal sebagai partisi. Kromatografi cair-cair sering disebut dengan ekstraksi partisi. Sehingga kromatografi merupakan proses melewatkan sampel melalui 2 teknik yakni adsorpsi (peredaan kemampuan penyerapan zat-zat yang
sangat mirip kemampuannya mempengaruhi resolusi zat terlarut dan menghasilkan kromatogram sedangkan proses partisi contohnya dapat terjadi di kromatografi lapis tipis dan kromatografi kertas (Khopkar, 1990).
2.3.2.1 Kromatografi Lapis Tipis
Pemisahan dengan kromatografi lapis tipis dilakukan dengan meletakkan ekstrak campuran sebagai noda atau garis tipis pada sebuah adsorben contohnya plat silika. Proses yang terjadi pada kromatografi lapis tipis yakni :
1.Proses Adsorpsi
Adsorben yang umum digunakan dalam adsorpsi kromatografi metabolit sekunder adalah silika dan alumina, karena noda(ekstrak) mudah untuk bergerak pada adsorben ini. Migrasi noda diakibatkan oleh perbedaan afinitas dan pemisahan yang terjadi karena adanya salah satu senyawa daam ekstrak yang akan lebih terikat atau tertahan kuat pada silika atau alumina yakni senyawa yang lebih polar akan bergerak lebih lama ketika dibandingkan dengan senyawa non polar. Silika mempunyai gugs silanol yang berikatan langsung dengan gugus hidroksil yang terbebas dengan ikatan hidrogen yang sangat kuat. Seperti gambar dibawah ini :
O O OH O O O H O H Si O Si H O O Si O H
2.Proses Partisi
Tahap ini melibatkan pengaruh tingkat kelarutan senyawa antara fasa diam dan fasa gerak. Senyawa-senyawa yang mudah larut dalam fase gerak akan bermigrasi pada plat yakni senyawa polar dan non polar akan lebih lama bermigrasi (Sarker, 2006).
Tabel 2.2 Fase Diam yang digunakan untuk Kromatografi Lapis Tipis Fase Diam Tingkat Kepolaran
Selulosa Pati Gula
Magnesium Silikat Tingkat kepolaran fase diam Kalsiun Sulfat Asam Silika Silika Gel Alumunium Oksida (Bhal, 2007) 2.3.2.2 Kromatografi Kolom
Kromatografi kolom memiliki dua fase yakni fase diam dan fase gerak. Kolom dibungkus atau dipacking dengan fase diam terlebih dahulu dan diikuti dengan memasukkan fase gerak yang turun ke bawah sesuai dengan gaya gravitasi.
Fraksi-fraksi yang dihasilkan akan dikumpulkan dan pada fraksi tersebuth telah terjadi pemisahan. Pemisahan pada kromatografi kolom ini untuk lebih mempermudah mengidentifikasi senyawa-senyawa yang belum diketahui (Sarker,2006).
Dengan menggunakan kromatografi kolom untuk isolasi flavonoid pada dasarnya dimana ekstrak total flavonoid dicampur dengan fase diam seperti selulosa, silika, poliamida. Kemudian dimasukkan fase gerak yang sesuai. Kolom berupa tabung kaca yang dilengkapi dengan keran di salah satu ujung. Fase diam pada kolom ini berupa silika dimana fase diam ini untuk memisahkan aglikon yang kurang polar misalnya, isoflavon, flavanon, metil flavon dan flavonol. Sementara apabila pada kromatografi kolom digunakan fase diam gel sphadex (deret G) maka pelarut harus air, digunakan utuk memisahkan poliglikosida yang berbeda bobot molekulnya. Fase diam digunakan berdasarkan sifat kepolaran senyawa dan pelarut yang sesuai. Dan poliamida sebenarnya juga dapat memisahkan semua flavonoid dan glikosida (Markham, 1988).
2.3.2.3 Kromatografi Lapis Tipis Preparatif
Pemisahan bergantung pada banyaknya campuran yang terkandung dalam ekstrak, KLT preparatif adalah langkah pemurnian yang digunakan di akhir metode isolasi.
Berikut langkahnya :
Biomass (Tumbuhan, dll)
Ekstraksi
Partisi
Ekstrak non polar Ekstrak Polar
Kolom kromatografi
KLT Preparatif
Dengan berat sampel paling sedikit 10mg dan biasanya menggunakan fase diam silika gel dan fase gerak adalah heksana : Etila asetat (60:40)v/v dan apabila senyawa yang kepolarannya rendah atau senyawa non polar maka digunakan
2.4 Teknik Spektroskopi
Metode-metode ini teknik spektroskopi mempunyai 3 keunggulan utama dalam bidang kimia :
1. Metode spektroskopi adalah lebih mudah dan cepat dibanding uji secara kimia.
2. Metode spektroskopi menyediakan lebih banyak informasi tentang struktur molekul.
3. Metode spektroskopi tidak merusak dan tidak mendekstruksi sampel. Ada 4 metode spektroskopi yang mana sangat luas digunakan dalam kimia organik yakni ; ultraviolet-Vis, IR, NMR dan MS (Bhal, 2007)
2.4.1 Spektrofotometer Ultraviolet-Visibel (UV-Vis)
Pada spektoskopi UV, panjang gelombang untuk daerah ultraviolet adalah 200-270 nm dan daerah visibel adalah 400-750 nm. Radiasi dari panjang gelombang cukup untuk menaikkan elektron seperti elektron non bonding atau elektron terlibat dalam ikatan phi untuk ke tingkat lebih tinggi (Bhal, 2007).
Pada spektroskopi UV, panjang gelombang dalam daerah UV dinyatakan dalam nanometer (1nm : 10-9m) atau amstrong A0 (1A0 : 10-10m). Serapa dalam UV dilaporkan dalam bilangan gelombang ( v, dalam satuan cm-1). Energi dari suatu molekul adalam jumlah elektroniknya, energi getarannya, dan energi rotasi. Urutannya ialah Eelek, Eget, Erot. Energi yang diserap di dalam energi elektronik
dari molekul yang dihasilkan dari transisi dari elektron valensi di dalam molekul. Khas dari suatu pita serapan adalah letak dan intensitasnya yang berhubungan dengan panjang gelombang dari radiasi yang mempunyai energi yang sama yang dibutuhkan oleh transisi elektron. Kromofor adalah suatu gugus kovalentidak jenuh yang bertanggung jawabutuk serapan elektronik contoh C=C, C=O, NO2, dan ausokrom adalah suatu gugus jenuh dengan elektron tidak terikat dimana bila menempel kepada suatu kromofor, mengubah baik panjang gelombang, intenitasnya serapan contoh OH, NH2, Cl. Geseran batokromik adalah geseran dari serapan ke panjang gelombang yang lebih panjang karena substitusi gugus lain. Geseran Hipsokromik adalah geseran dari serapan ke panjang gelombang yang lebih pendek karena substitusi gugus lain (Silverstain, 1981).
2.4.2 Spektrofotometer Infra Merah (FT-IR)
Adsorpsi FT-IR dikarenakan ikatan kovalen diantara molekul dari vibrasi level energi rendah ke energi level tinggi dan ikatan yang lebih kuat membutuhkan energi lebih besar untuk menggetarkan (stretching and bending). Maka absorpsi radiasi IR dan panjang gelombang yang lebih pendek (Bhal, 2007).
Suatu peta korelasi yang khas untuk frekuensi uluran dan tekukan seperti OH dan NH terdapat pada daerah bagian kiri 3000-3700 cm-1. Spektrofotometer infra merah merupakan daerah yang khusus berguna untuk mengidentifikasi gugus-gugus fungsional. Daerah ini menunjukkan adsorpsi yang disebabkan oleh modus uluran. Daerah di kanan 1400 cm-1 seringkali rumit karena modus uluran maupun tekukan yang terjadi diadsorpsi disitu. Oleh karena itu, bagian spektrum ini disebut daerah sidik jari (finger point region). Suatu ikatan dalam sebuah molekul dapat menjalani macam osilasi karena suatu ikatan tertentu dapat menyerap energi pada lebih daripada satu ikaan tertentu dapat menyerap energi
pada lebih daripada satu panjang gelombang. Misalnya, suatu ikatan OH menyerap energi pada kira-kira 3330cm-1. Energi pada panjang gelombang ini menyebabkan kenaikan vibrasi ulur (streching vibration) pada ikatan OH itu. Suatu ikatan OH itu juga menyerap pada kira-kira 1250cm-1. Energi pada panjang gelombang ini menyebabkan kenaikan vibrasi tekuk (Bending vibrations). Misalnya, ikatan non polar mengadsorpsi radiasi infra merah sangat lemah karena tidak ada perubahan momen ikatan apabila atom-atom saling berosilasi. Ikatan non polar contohnya seperti ikatan seperti C-C dan C-H dan ikatan polar menyebabkan adsorpsi pada infra merah kuat seperti C=O menunjukkan adsorpsi kuat (Fessenden,1982).
2.4.3 Spektrofotometer H-NMR
Semua proton dalam molekul yang identik dalam lingkungan kimia akan memiliki pergerseran kimia yang sama. Dengan demikian, semua proton dari TMS atau semua proton dalam benzen, siklopentana, atau aseton memiliki nilai resonansi yang berdekatan pada nilai δ.
Masing-masing komponen akan memiliki penyerapan yang tunggal dalam spektrum nmr. Proton ini dikatakan sama secara kimia. Pada kenyataannya, spektrum tidak dapat hanya dibedakan dari berapa banyak tipe proton yang berbeda pada molekul tersebut, tetapi dapat memperlihatkan berapa banyak jenis perbedaan yang ada dalam molekul tersebut. Dalam spektrum nmr, daerah dibawah masing-masing peak adalah proporsional dengan jumlah dari hidrogen yang ada pada peak tersebut (Pavia, et al. 1979).
Pada beberapa spektrum NMR akan terlihat sinyal TMS pada angka nol sehingga sinyal ini tidak perlu dianalisa. TMS dipilih sebagai standart karena: 1. TMS mempunyai 12 atom hidrogen yang keseluruhannya mempunyai
lingkungan kimia yang sama, sehingga menghasilkan sinyal singlet yang kuat karena mengandung banyak atom hidrogen.
2. Elektron-elektron pada ikatan C-H dalam senyawa ini berada dekat dengan hidrogen jika dibanding dengan senyawa lain. Ini berarti inti hidrogen sangat terlindungi dari medan magneteksternal sehingga dibutuhkan medan magnet yang besar untuk membawa atom hidrogen ke kondisi resonansi (Dachriyanus, 2004).
3. TMS merupakan cairan yang volatile, dapat ditambahkan dalam jumlah sedikit pada larutan sampel dapat diperoleh kembali dengan menguapkan pelarutnya.
4. TMS bersifat inert dan tidak larut dalam air (Supratman, 2010).
Absorbsi kebanyakan proton lain dijumpai dibawah medan absorbsi TMS. Selisih antara posisi absorbsi TMS dan posisi absorbsi suatu proton tertentu disebut pergeseran kimia. Pergeseran kimia dinyatakan sebagai bagian tiap juta (ppm) dari radio frekuensi yang kita gunakan (Fessenden, 1982).