BAB 2
TINJAUAN PUSTAKA
2.1. Tumbuhan Iler
2.1.1. Morfologi Tumbuhan Iler
Tumbuhan iler tumbuh subur di daerah dataran rendah sampai ketinggian 1500 meter diatas permukaan laut dan merupakan tanaman semusim. Umumnya tumbuhan ini ditemukan di tempat lembab dan terbuka seperti pematang sawah, tepi jalan pedesaan di kebun-kebun sebagai tanaman liar atau tanaman obat.
Tumbuhan iler memiliki batang herba, tegak atau berbaring pada pangkalnya dan merayap tinggi berkisar 30-150 cm, dan termasuk kategori tumbuhan basah yang batangnya mudah patah. Daun tunggal, helaian daun berbentuk hati, pangkal membulat atau melekuk menyerupai benuk jantung dan setiap tepiannya dihiasi oleh lekuk-lekuk tipis yang bersambungan dan didukung tangkai daun dengan panjang tangkai 3-4 cm yang memiliki warna beraneka ragam dan ujung meruncing dan tulang daun menyirip berupa alur. Batang bersegi empat dengan alur yang agak dalam pada masing-masing sisinya, berambut, percabangan banyak, berwarna ungu kemerahan. Permukaan daun agak mengkilap dan berambut halus panjang dengan panjang 7-11 cm, lebar 3-6 cm berwarna ungu kecoklatan sampai ungu kehitaman. Bunga berbentuk untaian bunga bersusun, muncul pada pucuk tangkai batang berwarna putih, merah dan ungu. Tumbuhan iler memiliki aroma bau yang khas dan rasa yang agak pahit, sifatnya dingin. Buah keras berbentuk seperti telur dan licin. Jika seluruh bagian diremas akan mengeluarkan bau yang harum. Untuk memperbanyak tanaman ini dilakukan dengan cara setek batang dan biji (Yuniarti, 2008).
2.1.2. Sistematika Tumbuhan Iler
Dari sistem sistematika (taksonomi), tumbuhan iler dapat diklasifikasikan sebagai berikut: Kingdom : Plantae Devisi : Spermatophyta Class : Dicotylendonae Ordo : Solanales Family : Lamiaceae Gens : Coleus
Speies : Coleus atropurpureus Benth.
Nama umum tumbuhan ini adalah iler. Tumbuhan ini dikenal masyarakat Indonesia dengan nama daerah yaitu: si gresing (batak), adang-adang (Palembang), miana, plado (sumbar), jawer kotok (sunda), iler, kentangan (jawa), ati-ati, saru-saru (bugis), majana (Madura) (Dalimartha, 2008).
2.1.3. Manfaat Tumbuhan iler
Tumbuhan iler bermanfaat untuk menyembuhkan hepatitis dan menurunkan demam, batuk dan influenza. Selain itu daun tumbuhan iler ini juga berkhasiat untuk penetralisir racun (antitoksik), menghambat pertumbuhan bakteri (antiseptik), mempercepat pematangan bisul, pembunuh cacing (vermisida), wasir, peluruh haid
(emenagog), membuyarkan gumpalan darah, gangguan pencernaan makanan (despepsi), radang paru, gigitan ular berbisa dan serangga (Dalimartha, 2008).
Sedangkan akar tumbuhan ini berkhasiat untuk mengatasi perut mulas dan diare.. Dalimartha juga menyebutkan bahwa tumbuhan iler dapat menyembuhkan radang telinga, mengeluarkan cacing gelang dari perut, Tetapi dengan catatan ibu hamil dilarang meminum rebusan daun iler ini karena dapat menyebabkan keguguran (Yuniarti, 2008).
2.1.4. Kandungan Tumbuhan Iler
Herba tumbuhan iler yang memiliki sifat kimiawi harum, berasa agak pahit, dingin, memiliki kandungan kimia sebagai berikut: daun dan batang mengandung minyak atsiri, fenol, tannin, lemak, phytosterol, kalsium oksalat, dan peptik substances. Komposisi kandungan kimia yang bermanfaat antara lain juga alkaloid, etil salisilat, metal eugenol, timol karvakrol, mineral (Dalimartha, 2008).
2.2. Senyawa Flavonoida
Senyawa flavonoida adalah senyawa-senyawa polifenol yang mempunyai 15 atom karbon, terdiri dari dua cincin benzena yang dihubungkan menjadi satu oleh rantai linier yang terdiri dari tiga atom karbon. Senyawa-senyawa flavonoida adalah senyawa 1,3 diaril propana, senyawa isoflavonoida adalah senyawa 1,2 diaril propana, sedangkan senyawa-senyawa neoflavonoida adalah 1,1 diaril propana.
Istilah flavonoida diberikan pada suatu golongan besar senyawa yang berasal dari kelompok senyawa yang paling umum, yaitu senyawa flavon; suatu jembatan oksigen terdapat diantara cincin A dalam kedudukan orto, dan atom karbon benzil yang terletak disebelah cincin B. Senyawa heterosoklik ini, pada tingkat oksidasi yang berbeda terdapat dalam kebanyakan tumbuhan. Flavon adalah bentuk yang mempunyai cincin C dengan tingkat oksidasi paling rendah dan dianggap sebagai struktur induk dalam nomenklatur kelompok senyawa-senyawa ini. Sifat struktur yaitu cincin A biasanya memiliki tiga gugus oksigen yang berselang seling. Sedangkan cincin B kebanyakan mempunyai gugus fungsional oksigen berkedudukan para dua oksigen, berkedudukan para atau meta terhadap C3 (Manitto, 1981).
Cara klasik untuk mendeteksi senyawa fenol sederhana ialah dengan menambahkan larutan besi (III) klorida dalam air atau etanol kepada larutan cuplikan, yang menimbulkan warna hijau, merah, ungu, biru, atau hitam yang kuat. Cara yang
ini dimodifikasi dengan menggunakan campuran segar larutan besi (III) klorida 1% masih tetap digunakan secara umum untuk mendeteksi senyawa fenol pada kromatografi kertas. Tetapi kebanyakan senyawa fenol (terutama senyawa flavonoida) dapat dideteksi pada kromatogram berdasarkan warnanya atau floresensinya dibawah lampu UV, warnanya akan diperkuat atau berubah bila diuapi ammonia. Pigmen fenolik berwarna dapat terlihat jadi dan mudah disimak selama proses isolasi dan pemurnian (Harbone, 1987).
Senyawa flavonoida terdapat pada semua bagian tumbuhan termasuk daun, akar, kayu, kulit, tepung sari, bunga, buah, dan biji. Kebanyakan flavonoida ini berada di dalam tumbuh-tumbuhan, kecuali alga. Namun ada juga flavonoida yang terdapat pada hewan, misalnya dalam kelenjar bau berang-berang dan sekresi lebah. Dalam sayap kupu-kupu dengan anggapan bahwa flavonoida berasal dari tumbuh-tumbuhan yang menjadi makanan hewan tersebut dan tidak dibiosintesis di dalam tubuh mereka. Penyebaran senyawa flavonoida tersebar pada jenis tumbuhan angiospermae, klorofita, fungi, briofita (Markham, 1988).
Senyawa varian flavonoid saling berkaitan karena alur biosintesis yang sama, yang memasukkan substrat dari alur sikimat atau alur ‘asetat-melanoat’, flavonoida pertama yang dihasilkan segera setelah kedua alur itu bertemu. Modifikasi flavonoid pengurangan hidroksilasi; metilasi gugus hidroksil atau inti flavonoida; isopreenilasi gugus hidroksil atau inti flavonoida; metilenasi gugus orto- dihidroksil; dimerisasi (pembentukan bivlafonoida); pembentukan bisulfat; dan yang terpenting glikolisasi gugus hidroksil (pembentukan flavonida o-glikosida atau inti flavonoida pembentukan flavonoida C-glikosida) (Markham, 1988).
2.2.1. Struktur Dasar Senyawa Flavonoida
Senyawa flavonoida adalah senyawa yang mengandung C15 terdiri atas dua inti fenolat yang dihubungkan dengan tiga satuan karbon. Struktur dasar flavonoida dapat digambarkan sebagai berikut :
C C C
A B
Gambar 1. Kerangka dasar senyawa flavonoida
Cincin A adalah karakteristik phloroglusinol atau bentuk resorsinol tersubstitusi
HO OH O C3-C6 A A HO O C3-C6 A B Namun sering terhidroksilasi lebih lanjut :
O C3 OH HO HO C6 A A OCH3 O C3 OCH3 H3CO H3CO C6 A
Cincin B adalah karakteristik 4-, 3, 4-, 3, 4, 5- terhidroksilasi
C3 (A) C6 R R' R'' B R = R’ = H, R’ = OH R = H, R’ = R” = OH R = R’ = R” = OH ( R = R’ = R” = H) (Sastrohamidjojo, 1996) B
2.2.2. Klasifikasi Senyawa Flavonoida
Flavonoida mengandung sistem aromatik yang terkonjugasi sehingga menunjukkan pita serapan kuat pada daerah spektrum sinar ultraviolet dan spektrum sinar tampak, umumnya dalam tumbuhan terikat pada gula yang disebut dengan glikosida (Harborne, 1996).
Pada flavonoida O-glikosida, senyawa tersebut memiliki satu gugus hidroksil flavonoida (atau lebih) terikat pada satu gula (atau lebih) dengan ikatan hemiasetal yang tidak tahan asam. Pengaruh glikosilasi menyebabkan flavonoida menjadi kurang reaktif dan lebih mudah larut dalam air. Glukosa merupakan gula yang paling umum terlibat dan gula lain yang sering juga terdapat adalah galaktosa, ramnosa, silosa, arabinosa, dan rutinosa. Adakalanya glikosida mengalami modifikasi lebih lanjut yaitu asilasi yang mempunyai satu gugus hidroksil gula atau lebih yang berikatan dengan asam seperti asam asetat. Waktu yang diperlukan untuk memutuskan suatu gula dari suatu flavonoida O-glukosida dengan hidrolisis asam ditentukan oleh sifat gula tersebut.
Pada flavonoida C-glikosida, senyawa tersebut memiliki gula yang terikat pada atom karbon flavonoida dan dalam hal ini gula tersebut terikat langsung pada inti benzena dengan suatu ikatan karbon-karbon yang tahan asam. Gula yang terikat pada atom C hanya ditemukan pada atom C nomor 6 dan 8 dalam inti flavonoida. Biasanya jenis gula yang terikat paling umum misalnya viteksin, orientin, dan juga galaktosa misalnya ramnosa, xilosa.
Pada golongan flavonoida yang mudah larut dalam air yang ditemukan hanya diflavonoida sulfat. Senyawa ini mengandung satu ion sulfat, atau lebih, yang terikat pada hidroksil fenol atau gula. Hanya terbatas pada angioepermae (Markham, 1988).
Flavonon dan flavonol jarang dijumpai dalam bentuk glikosidanya. Flavon dan flavonol secara luas terdistribusi sebagai senyawa fenolik. Antosianin adalah pigmen
tumbuhan yang secara umum berwarna merah dan jarang dijumpai berwarna biru pada suatu bunga. Khalkon termasuk butein, dengan cincin furan ditemukan dalam senyawa flavonoid. Auron merupakan pegmen berwarna kuning emas yang secara umum dijumpai pada bunga. Isoflavon dapat mengalami degredasi dengan adanya penambahan basa sehingga menghasilkan asam formiat dan deoxybenzoin, kemudian deoxybenzoin terpisah mengalami fusi (penggabungan dua inti ringan menjadi inti yang lebih berat molekulnya) basa dan metilasi. Isoflavon banyak digunakan sebagai estrogenik, insektidal, dan sebagai anti jamur (Raphael, 1991).
Menurut Robinson (1995), flavonoida dapat dikelompokkan berdasarkan keragaman pada rantai C3 yaitu :
1. Flavonol
Flavonol paling sering terdapat sebagai glikosida, biasanya 3-glikosida, dan aglikon flavonol yang umum yaitu kamferol, kuersetin, dan mirisetin yang berkhasiat sebagai antioksidan dan antiimflamasi. Flavonol lain yang terdapat di alam bebas kebanyakan merupakan variasi struktur sederhana dari flavonol. Larutan flavonol dalam suasana basa dioksidasi oleh udara tetapi tidak begitu cepat sehingga penggunaan basa pada pengerjaannya masih dapat dilakukan.
O
OH O
Struktur flavonol 2. Flavon
Flavon berbeda dengan flavonol dimana pada flavon tidak terdapat gugusan 3-hidroksi. Hal ini mempunyai serapan UV-nya, gerakan kromatografi, serta reaksi warnanya. Flavon terdapat juga sebagai glikosidanya lebih sedikit daripada jenis glikosida pada flavonol. Flavon yang paling umum dijumpai adalah apigenin dan luteolin. Luteolin merupakan zat warna yang pertama kali dipakai di Eropa. Jenis yang paling umum adalah 7-glukosida dan terdapat juga flavon yang terikat pada gula
melalui ikatan karbon-karbon. Contohnya luteolin 8-C-glikosida. Flavon dianggap sebagai induk dalam nomenklatur kelompok senyawa flavonoida.
O O 1 2 3 4 5 6 7 8 9 10 1' 2' 3' 4' 5' 6' Struktur flavon 3. Isoflavon
Isoflavon merupakan isomer flavon, tetapi jumlahnya sangat sedikit dan sebagai fitoaleksin yaitu senyawa pelindung yang terbentuk dalam tumbuhan sebagai pertahanan terhadap serangan penyakit. Isoflavon sukar dicirikan karena reaksinya tidak khas dengan pereaksi warna manapun. Beberapa isoflavon (misalnya daidzein) memberikan warna biru muda cemerlang dengan sinar UV bila diuapi amonia, tetapi kebanyakan yang lain tampak sebagai bercak lembayung yang pudar dengan amonia berubah menjadi coklat.
O
O
Struktur Isoflavon
4. Flavanon
Flavanon terdistribusi luas di alam. Flavanon terdapat di dalam kayu, daun dan bunga. Flavanon glikosida merupakan konstituen utama dari tanaman genus prenus dan buah jeruk ; dua glikosida yang paling lazim adalah neringenin dan hesperitin, terdapat dalam buah anggur dan jeruk.
O
O Struktur Flavanon
5. Flavanonol
Senyawa ini berkhasiat sebagai antioksidan dan hanya terdapat sedikit sekali jika dibandingkan dengan flavonoida lain. Sebagian besar senyawa ini diabaikan karena konsentrasinya rendah dan tidak berwarna.
O
O
OH
Struktur Flavanonol 6. Katekin
Katekin terdapat pada seluruh dunia tumbuhan, terutama pada tumbuhan berkayu. Senyawa ini mudah diperoleh dalam jumlah besar dari ekstrak kental Uncaria gambir dan daun teh kering yang mengandung kira-kira 30% senyawa ini. Katekin berkhasiat sebagai antioksidan. O HO OH OH OH OH Struktur Katekin 7. Leukoantosianidin
Leukoantosianidin merupakan senyawa tan warna, terutama terdapat pada tumbuhan berkayu. Senyawa ini jarang terdapat sebagai glikosida, contohnya melaksidin, apiferol. O OH HO OH Struktur Leukoantosianidin 8. Antosianin
Antosianin merupakan pewarna yang paling penting dan paling tersebar luas dalam tumbuhan. Pigmen yng berwarna kuat dan larut dalam air ini adalah penyebab hampir
semua warna merah jambu, merah marak , ungu, dan biru dalam daun, bunga, dan buah pada tumbuhan tinggi. Secara kimia semua antosianin merupakan turunan suatu struktur aromatik tunggal yaitu sianidin, dan semuanya terbentuk dari pigmen sianidin ini dengan penambahan atau pengurangan gugus hidroksil atau dengan metilasi atau glikosilasi.
O
OH
Struktur Antosianin 9.Khalkon
Khalkon adalah pigmen fenol kuning yang berwarna coklat kuat dengan sinar UV bila dikromatografi kertas. Aglikon flavon dapat dibedakan dari glikosidanya, karena hanya pigmen dalam bentuk glikosida yang dapat bergerak pada kromatografi kertas dalam pengembang air. (Harborne, 1996)
O
Struktur Khalkon 10. Auron
Auron berupa pigmen kuning emas yang terdapat dalam bunga tertentu dan briofita. Dalam larutan basa senyawa ini berwarna merah ros dan tampak pada kromatografi kertas berupa bercak kuning, dengan sinar ultraviolet warna kuning kuat berubah menjadi merah jingga bila diberi uap amonia. (Robinson, 1995)
HC O
O
Struktur Auron
Menurut Harborne (1996), Semua senyawa flavonoida, menurut strukturnya, merupakan turunan senyawa induk flavon dan semuanya mempunyai sejumlah sifat yang sama. Dikenal sekitar Sembilan kelas flavonoid yakni :
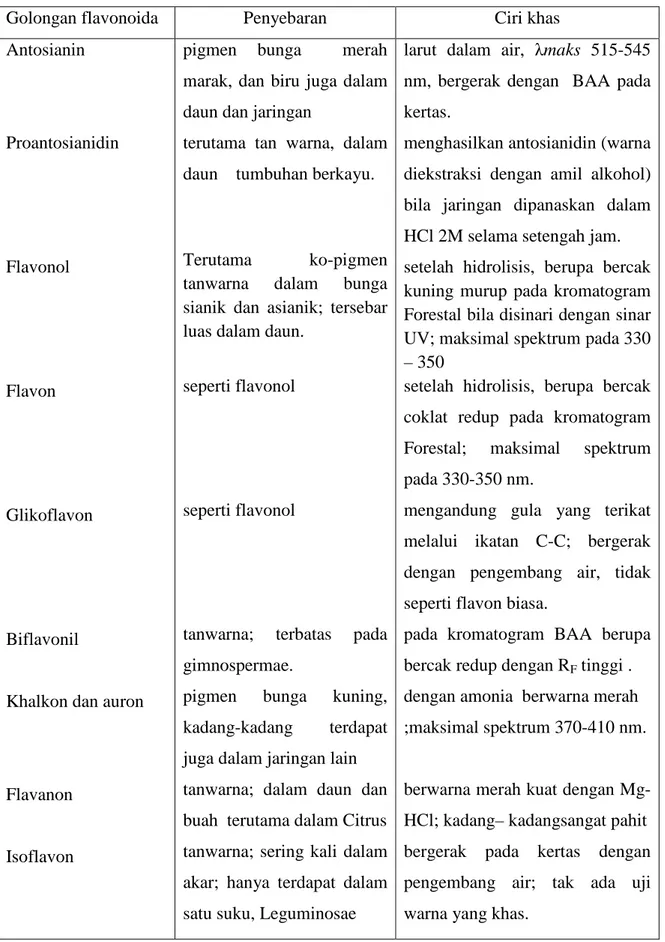
Tabel 1. Golongan-golongan Flavonoida menurut Harbone
Golongan flavonoida Penyebaran Ciri khas
Antosianin Proantosianidin Flavonol Flavon Glikoflavon Biflavonil
Khalkon dan auron
Flavanon
Isoflavon
pigmen bunga merah marak, dan biru juga dalam daun dan jaringan
terutama tan warna, dalam daun tumbuhan berkayu.
Terutama ko-pigmen tanwarna dalam bunga sianik dan asianik; tersebar luas dalam daun.
seperti flavonol
seperti flavonol
tanwarna; terbatas pada gimnospermae.
pigmen bunga kuning, kadang-kadang terdapat juga dalam jaringan lain
tanwarna; dalam daun dan buah terutama dalam Citrus tanwarna; sering kali dalam akar; hanya terdapat dalam satu suku, Leguminosae
larut dalam air, λmaks 515-545 nm, bergerak dengan BAA pada
kertas. menghasilkan antosianidin (warna
diekstraksi dengan amil alkohol) bila jaringan dipanaskan dalam HCl 2M selama setengah jam. setelah hidrolisis, berupa bercak kuning murup pada kromatogram Forestal bila disinari dengan sinar UV; maksimal spektrum pada 330 – 350
setelah hidrolisis, berupa bercak coklat redup pada kromatogram Forestal; maksimal spektrum pada 330-350 nm.
mengandung gula yang terikat melalui ikatan C-C; bergerak dengan pengembang air, tidak seperti flavon biasa.
pada kromatogram BAA berupa bercak redup dengan RF tinggi .
dengan amonia berwarna merah ;maksimal spektrum 370-410 nm.
berwarna merah kuat dengan Mg- HCl; kadang– kadangsangat pahit bergerak pada kertas dengan pengembang air; tak ada uji warna yang khas.
2.2.3. Biosintesis Awal flavonoid
Semua varian flavonoid saling berkaitan karena alur biosintesis yang sama, yang memasukkan prazat dari alur sikimat dan alur asetat-melanoat, flavonoid pertama dihasilkan segera setelah alur itu bertemu. Sekarang flavonoid yang dianggap pertama kali terbentuk pada biosintesis adalah khalkon. Modifikasi flavonoid lebih lanjut terjadi pada berbagai tahap dan menghasilkan : penambahan atau pengurangan hidroksilasi, metilasi gugs hidroksil atau inti flavonoid, dimerisasi dan glikolisasi gugus hidroksil.
2.2.4. Metoda isolasi senyawa flavonoida
Metoda Isolasi Senyawa Flavonoida oleh Harborne dilakukan dengan cara sebagai berikut : daun yang segar dimaserasi dengan MeOH, lalu disaring. Ekstrak MeOH dipekatkan dengan rotari evaporator. Lalu ekstrak pekat yang dihasilkan, diasamkan dengan H2SO4 2M, didiamkan, lalu diesktraksi dengan Kloroform. Lapisan Kloroform
diambil, lalu diuapkan, sehingga dihasilkan ekstrak polar pertengahan (Terpenoida atau senyawa Fenol) (Harborne, 1996).
2.2.5. Sifat kelarutan flavonoida
Aglikon flavonoida adalah polifenol sehingga mempunyai sifat kimia senyawa fenol, yaitu bersifat agak asam sehingga dapat larut dalam basa. Tetapi harus diingat, bila dibiarkan dalam larutan basa, dan disamping itu terdapat oksigen, banyak yang akan terurai. Karena mempunyai sejumlah gugus hidroksil, atau suatu gula, flavonoida merupakan senyawa polar, maka umumnya flavonoida cukup larut dalam pelarut polar seperti, Metanol (MeOH), Etanol (EtOH), Butanol (BuOH), Aseton, Dimetilsulfoksida (DMSO), Dimetilformamida (DMF), Air dan lain-lain.
Adanya gula yang terikat pada flavonoida cenderung menyebabkan flavonoida lebih mudah larut dalam air sehingga campuran pelarut yang disebut diatas dengan air merupakan pelarut yang lebih baik untuk glikosida. Sebaliknya, aglikon yang kurang polar seperti isoflavon, flavanon, flavon dan flavonol yang termetoksilasi cenderung lebih mudah larut dalam pelarut seperti Eter dan Kloroform (Markham, 1988).
2.3. Teknik Pemisahan
Teknik pemisahan memiliki tujuan untuk memisahkan komponen yang akan ditentukan berada dalam keadaan murni, tidak tercampur dengan komponen-komponen lainnya.
Ada 2 jenis teknik pemisahan:
1. Pemisahan kimia adalah suatu teknik pemisahan yang berdasarkan adanya perbedaan yang besar dari sifat-sifat fisika komponen dalam campuran yang akan dipisahkan.
2. Pemisahan fisika adalah suatu teknik pemisahan yang didasarkan pada perbedaan-perbedaan kecil dari sifat-sifat fisik antara senyawa-senyawa yang termasuk dalam suatu golongan (Muldja, 1995).
2.3.1. Ekstraksi
Ekstraksi dapat dilakukan dengan metode maserasi, perkolasi, dan sokletasi. Sebelum ekstraksi dilakukan, biasanya serbuk tumbuhan dikeringkan lalu dihaluskan dengan derajat kehalusan tertentu, kemudian diekstraksi dengan salah satu cara di atas. Ekstraksi dengan metode sokletasi dapat dilakukan secara bertingkat dengan berbagai pelarut berdasarkan kepolarannya, misalnya: n-heksan, eter, benzene, kloroform, etil asetat, etanol, metanol, dan air. Ekstraksi dianggap selesai bila tetesan ekstrak yang terakhir memberikan reaksi negatif terhadap pereaksi flavonoida. Untuk mendapatkan larutan ekstrak yang pekat biasanya pelarut ekstrak diuapkan dengan menggunakan alat rotari evaporator (Harborne, 1987).
Menurut prosesnya ekstraksi dapat dibagi menjadi dua yaitu Ekstraksi kontiniue dimana pelarut yang sama digunakan secara berulang-ulang sampai proses ekstraksi selesai dan biasanya alat yang digunakan adalah alat soklet. Ekstraksi yang kedua adalah ekstraksi bertahap yaitu ekstraksi selalu digunakan pelarut yang baru samppai ekstraksi selesai dan bisanya digunakan adalah corong pisah. Tekniknya cukup dengan penambahan pelarut yang tidak bercampur dengan pelarut yang pertama melalui corong pisah, kemudian dilakukan pengocokan sampai terjadi kesetimbangan konsentrasi pada kedua pelarut. Setelah didiamkan beberapa saat akan tebentuk dua lapisan. Kesempurnaan ekstraksi tergantung banyaknya ekstraksi yang dilakukan ( Yazid,E. 2005)
2.3.2. Kromatografi
Penjelasan tentang kromatografi pertama kali diberikan oleh Michael Tswett, yang mengumumkan pemberian pemisahan klorofil dan pigmen lainnya dalam suatu seri tanaman. Sekarang kromatografi mencakup berbagai proses yang berdasarkan pada perbedaan distribusi dari penyusunan cuplikan antara dua fase.
Kromatografi merupakan suatu cara pemisahan fisik dengan unsur-unsur yang akan dipisahkan terdistribusikan antara dua fasa, satu dari fasa-fasa ini membentuk lapisan stasioner dengan luas permukaan yang besar dan fasa lainnya merupakan cairan yang merembes lewat. Fasa stasioner mungkin suatu zat padat atau suatu cairan dan fasa yang bergerak mungkin suatu cairan atau suatu gas (Underwood, 1981).
Pemisahan secara kromatografi dilakukan dengan mempertimbangkan beberapa sifat fisika umum dari molekul. Sifat utama yang terlibat ialah:
- Kecenderungan molekul untuk melarut dalam cairan (kelarutan)
- Kecenderungan molekul untuk melekat pada permukaan serbuk halus (adsorbs, penjerapan)
- Kecenderungan molekul untuk menguap atau berubah ke keadaan uap (keatsirian)
Pada sistem kromatografi, campuran yang akan dipisahkan ditempatkan dalam keadaan demikian rupa sehingga komponen-komponennya harus menunjukkan dua dari ketiga sifat tersebut. Hal ini melibatkan dua sifat berlainan, misalnya penjerapan dan kelarutan, misalnya kelarutan di dalam dua cairan yang tidak bercampur.
Walaupun kromatografi melibatkan proses saling mempengaruhi antara beberapa sifat. Misalnya memasukkan senyawa ke dalam corong pisah yang berisi dua pelarut yang masing-masing mempunyai kelarutan yang terbatas dalam pelarut pasangannya (misalnya eter dan air), Senyawa itu cenderung terdistribusi atau terpartisi di antara kedua cairan itu atau fase bergantung kepada sifat kelarutannya. Partisi yang demikian merupakan persaingan antara kelarutan di dalam cairan. Jika
dimasukkan linarut ke dalam labu yang berisi cairan dan serbuk bahan padat (misalnya arang), linarut akan terdistribusi di antara permukaan bahan padat (dalam hal kedua ini, linarut menunjukkan sifat kejerapannya). Pada akhirnya dimasukkan linarut ke dalam labu yang sedikit mengandung cairan yang tidak atsiri, linarut akan menunjukkan sifat kelarutan dan keatsirian. Dalam sistem kromatografi, mungkin saja dapat memperbesar perbedaan itu, walaupun perbedaan itu sangat kecil, dan menjadikannya sebagai dasar pemisahan (Gritter, 1991).
Cara-cara kromatografi dapat digolongkan sesuai dengan sifat–sifat dari fasa diam, yang dapat berupa zat padat atau zat cair. Jika fasa diam berupa zat padat disebut kromatografi serapan, jika berupa zat cair disebut kromatografi partisi. Karena fasa gerak dapat berupa zat cair atau gas maka ada empat macam sistem kromatografi yaitu:
1. Fasa gerak cair–fasa diam padat (kromatografi serapan): a.kromatografi lapis tipis
b.kromatografi penukar ion
2. Fasa gerak gas–fasa diam padat, yakni kromatografi gas padat
3. Fasa gerak cair–fasa diam cair (kromatografi partisi), yakni kromatografi kertas. 4. Fasa gerak gas–fasa diam zat cair, yakni :
a. kromatografi gas–cair b. kromatografi kolom kapiler
Semua pemisahan dengan kromatografi tergantung pada kenyataan bahwa senyawa – senyawa yang dipisahkan terdistribusi diantara fasa gerak dan fasa diam dalam perbandingan yang sangat berbeda – beda dari satu senyawa terhadap senyawa yang lain (Sastrohamidjojo, 1991).
2.3.2.1. Kromatografi lapis tipis
Teknik ini dikembangkan pada tahun 1938 oleh Ismailoff dan Schraiber. Adsorbent dilapiskan pada lempeng kaca yang bertindak sebagai penunjang fase diam. Fase
bergerak akan merayap sepanjang fase diam dan terbentuklah kromatogram. Kecepatan pemisahan tinggi dan mudah untuk memperoleh kembali senyawa-senyawa yang terpisahkan. Biasanya yang sering digunakan sebagai materi pelapisnya adalah silika gel. Tetapi dapat juga dipakai alumina (alumina oksida), kieselgur (diatomeus earth) dan selulosa. Pemilihan sistem pelarut dan komposisi lapisan tipis ditentukan oleh prinsip kromatografi yang akan digunakan (Khopkar, S.M., 2003).
Kromatografi Lapis Tipis pada plat berlapis yang berukuran lebih besar, biasanya 5x20 cm, 10x20 cm, atau 20x20 cm. Tebal lapisan adsorben dapat bervariasi tergantung penggunaannya. Larutan campuran senyawa yang akan dipisahkan diteteskan kira-kira 1,5 cm dari bagian bawah plat dengan menggunkan pipet mikro atau syringe. Zat pelarut yang terdapat pada sampel yang diteteskan kemudian diupakan terlebih dahulu. Selanjutnya plat kromatografi dikembangkan dengan mencelupkan pada chamber yang berisi campuran zat pelarut. Pengembangan tersebut masing-masing komponen senyawa dalam sampel, akan bergerak keatas dengan kecepatan yang berbeda yang diakibatkan oleh pengaruh proses pemilihan adsorben sampai identifikasi masing-masing komponen yang terpisah (Hosttetman, 1995).
Pemisahan senyawa dengan Kromatografi Lapis Tipis seperti senyawa organik bahan alam dan senyawa organik sintetik dapat dilakukan dalam beberapa menit dengan alat yang harganya tidak terlalu mahal. Jumlah cuplikan beberapa mikrogram atau sebanyak 5 g dapat ditangani. Kelebihan KLT yang lain ialah pemakaian jumlah pelarut dan jumlah cuplikan yang sedikit. Kromatografi Lapis Tipis (KLT) merupakan salah satu metode pemisahan yang cukup sederhana yaitu dengan menggunakan plat kaca yang dilapisi silika gel dengan menggunakan pelarut tertentu Nilai utama Kromatografi Lapis Tipis pada penelitian senyawa flavonoida ialah sebagai cara analisis cepat yang memerlukan bahan sangat sedikit. (Gritter,1991).
Menurut Markham, Kromatografi Lapis Tipis terutama berguna untuk tujuan berikut:
1. Mencari pelarut untuk kromatografi kolom
2. Analisis fraksi yang diperoleh dari kromatografi kolom 3. Identifikasi flavonoida secara ko-kromatografi.
4. Menyegi arah atau perkembangan reaksi seperti hidrolisis ata metilasi 5. Isolasi flavonoida murni skala kecil
6. Penyerap dan pengembang yang digunakan umumnya sama dengan penyerap dan pengembang pada kromatografi kolom dan kromatografi kertas
(Markham, 1988).
2.3.2.2. Kromatografi Lapis Tipis Preparatif
Metode kromatografi juga dapat dilakukan dengan metode kromatografi lapis tipis preparatif yaitu pemisahan yang terdiri atas sejumlah senyawa serupa dengan kromatografi jenis yang sukar dan kadang-kadang lama dipisakan. KLT preparatif adalah cara ideal untuk memisahkan cuplikan kecil (50 mg sampai 1 g). Penjerap yang dipakai adalah silika gel dan dipakai untuk pemisaha campuran senyawa lipofil maupun campuran senyawa hidrofil.Ketebalan adsorben yang paling sering dipakai 0,5-2 mm. Ukuran plat kromatografi biasanya 20 x 20 cm atau 20 x 40 cm
Cuplikan dilarutkan dalam sedikit pelarut sebelum ditotolkan pada plat kromatografi lapis tipis preparatif. Pelarut yang baik ialah pelarut organic seperti n-heksan, etil asetat. Diklorometana. Cuplikan yang akan dipisahkan ditotolkan berupa garis pada salah satu sisi dari pelat lapisan besar dan dikembangkan secara tegak lurus pada garisan cuplikan sehingga campura akan terpisah menjadi beberapa pita. Pita penjerap tersebut diharapkan mengandung komponen campuran murni kemudian dikerok dari pelat kaca dengan spatula dan ditampung dengan logam tipis atau kertas lilin. Penjerap diletakkan dalam corong kaca memakai kertas saring lalu dielusi beberapa kali dengan pelarut yang cocok ( Gritter, 1991).
2.3.2.3. Kromatografi Kolom
Kromatografi kolom adalah kromatografi yang menggunakan kolom sebagai alat untuk memisahkan komponen-komponen dalam campuran. Alat tersebut berupa pipa gelas yang dilengkapi suatu kran di bagian bawah kolom untuk mengendalikan aliran zat cair. Ukuran kolom tergantung dari banyaknya zat yang akan dipindahkan. Pemisahan tergantung kepada kesetimbangan yang terbentuk pada bidang antar muka di antara butiran-butiran adsorben dan fase bergerak serta kelarutan relatif komponen pada fase bergeraknya (Yazid, E., 2005).
Kromatografi cair yang dilakukan dalam kolom besar merupakan metode kromatografi terbaik untuk pemisahan dalam jumlah besar (lebih dari 1 g). Pada kromatografi kolom, campuran yang akan dipisahkan diletakkan berupa pita pada bagian atas kolom penyerap yang berada dalam tabung kaca, tabung logam, dan tabung plastik. Pelarut atau fasa gerak dibiarkan mengalir melalui kolom karena aliran yang disebabkan oleh gaya berat atau didorong dengan tekanan. Pita senyawa linarut bergerak melalui kolom dengan laju yang berbeda, memisah, dan dikumpulkan berupa fraksi ketika keluar dari atas kolom (Gritter, 1991).
Dengan menggunakan cara ini, skala isolasi flavonoida dapat ditingkatkan hampir ke skala industri. Pada dasarnya, cara ini meliputi penempatan campuran flavonoida (berupa larutan) diatas kolom yang berisi serbuk penyerap (seperti selulose, silika, atau poliamida), dilanjutkan dengan elusi beruntun setiap komponen menggunakan pelarut yang cocok. Kolom hanya berupa tabung kaca yang dilengkapi dengan keran pada salah satu ujung. Menempatkan larutan cuplikan pada kolom sedemikian rupa sehingga terbentuk pita yang siap dielusi lebih lanjut (Markham, 1988).
Pengisian kolom harus dikerjakan seragam, setelah adsorben dimasukkan dapat diseragamkan kerapatannya dalam kolom dengan menggunakan vibrator. Selain itu dapat juga dikerjakan dengan memasukkan adsorben dalam bentuk larutan dan
partikelnya dibiarkan mengendap. Pengisian kolom yang tidak seragam dapat menghasilkan rongga-rongga ditengah-tengah kolom. Pada bagian bawah dan atas dari isian kolom diberi wool untuk menyangga isian. Bila kolom telah diisi bahan isian permukaan cairan tidak boleh dibiarkan turun dibawah permukaan bahan isian bagian atas, karena akan memberikan peluang masuknya gelembung-gelembung udara masuk kedalam kolom ( Hosttetman, 1995).
2.3.2.4. Kromatografi Kertas
Kromatografi kertas pertama sekali dikembangkan di pertengahan abad ke 19 dan kemudian digunakan untuk analisis kualitatif dan kuantitatif. Meskipun dalam beberapa tahun metode pemisahan ini digantikan dengan teknik kromatografi lapisan tipis. Fase gerak dalam kromatografi kertas terdiri dari selulosa. Mekanisme terhadap pemisahan melibatkan penyerapan pada zat terlarut pada selulosa dan pemisahan pada zat terlarut antara fase oganik bergerak dan air dalam kertas. (Landgrebe, 1982).
Pada kromatografi kertas, fase diam berupa zat cair, basanya air yang tersuspensi pada serat dari selembar kertas saring bermutu tinggi. Kertas yang digunakan harus digantungkan pada kaitan dalam bejana karena kertas tidak memiliki penyangga. Jika fase gerak dan fase diam telah dipilih secara tepat, bercak cuplikan awal akan dipisahkan menjadi sederet bercak, masing-masing bercak diharapkan merupakan komponen tunggal dari campuran. Kromatografi biasanya dilakukan didalam bejana yang telah dijenuhkan sejenuh mungkin dengan fase gerak. Jika tidak berwarna , bercak itu harus ditampakkan dengan menyemprotkannya memakai pereaksi pembentuk warna yang cocok atau menyinari lapisan memakai sinar ultraviolet (Gritter, 1991).
2.3.3.5. Harga Rf (Reterdation Factor)
Mengidentifikasi noda-noda dalam lapisan tipis lazim menggunakan harga Rf yang diidentifikasikan sebagai perbandingan antara jarak perambatan suatu zat dengan jarak perambatan pelarut yang dihitung dari titik penotolan pelarut zat. Jarak yang ditempuh oleh tiap bercak dari titik penotolan diukur dari pusat bercak. Untuk mengidentifikasi suatu senyawa, maka harga Rf senyawa tersebut dapat dibandingkan dengan harga Rf senyawa pembanding.
Jarak perambatan bercak dari titik penotolan Rf =
Jarak perambatan pelarut dari titik penotolan
Faktor-faktor yang mempengaruhi gerakan noda dalam kromatografi lapis tipis yang juga mempengauhi harga Rf :
1. Struktur kimia dari senyawa yang dipisahkan 2. Sifat dari penyerap dan derajat aktivasi 3. Tebal kerataan dari lapisan penyerap 4. Pelarut dan derajat kemurnian fase gerak 5. Derajat kejenuhan dari uap
6. Jumlah cuplikan yang digunakan 7. Suhu
8. Kesetimbangan
9. Teknik percobaan ( Sastrohamidjojo, 1985)
2.4. Teknik Spektroskopi
Spektroskopi adalah studi mengenai interaksi cahaya dengan atom dan molekul. Radiasi cahaya atau elektromagnet dapat menyerupai gelombang. Beberapa sifat fisika cahaya paling baik diterangkan dengan ciri gelombangnya, sedangkan sifat lain diterangkan dengan sifat partikel (Creswell, 1982).
Teknik spektroskopi adalah salah satu teknik analisis kimia–fisika yang mengamati tentang interaksi atom atau molekul dengan radiasi elektromagnetik. Ada dua macam instrumen pada teknik spektroskopi yaitu spektrometer dan spektrofotometer. Instrumen yang memakai monokromator celah tetap pada bidang fokus disebut sebagai spektrometer. Apabila spektrometer tersebut dilengkapi dengan detektor yang bersifat fotoelektrik maka disebut spektrofotometer (Muldja, 1955).
Informasi Spektroskopi Inframerah menunjukkan tipe – tipe dari adanya gugus fungsi dalam satu molekul dan Resonansi Magnetik Inti yang memberikan informasi tentang bilangan dari setiap tipe dari atom hidrogen dan juga memberikan informasi yang menyatakan tentang lingkungan dari setiap tipe dari atom hidrogen. Kombinasinya dan data yang ada kadang–kadang menentukan struktur yang lengkap dari molekul yang tidak diketahui (Pavia, 1979).
2.4.1. Spektrometri Ultra violet
Serapan molekul di dalam derah ultra violet dan terlihat dari spektrum bergantung pada struktur ultra elektronik dari molekul. Penyerapan sejumlah energi, menghasilkan percepatan dari elektron dalam orbital tingkat dasar ke orbital yang berenergi lebih tinggi di dalam keadaan tereskitasi. Dalam prakteknya spektometri ultraviolet utnuk sebagian besar dibatasi oleh sistem terkonjugasi. Suatu spetrum ultraviolet diperoleh secara langsung dari suatu alat sederhana memetakan panjang gelombang dari suatu serapan terhadap intesitas serapan (Silverstain, 1984).
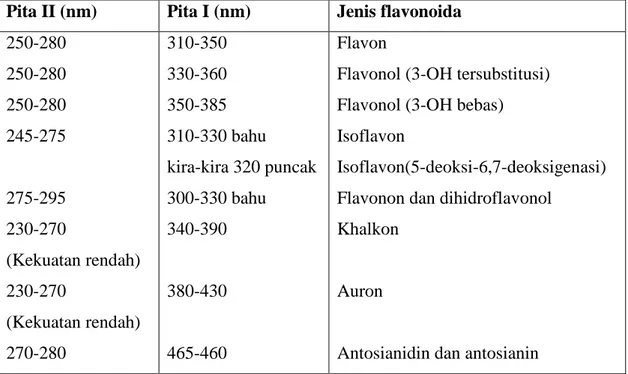
Spektrum Flavonoida biasanya ditentukan dalam larutan dengan pelarut Metanol (MeOH) atau Etanol (EtOH). Spektrum khas terdiri atas dua maksima pada rentang 240-285 nm (pita II) dan 300-550 nm (pita I). Kedudukan yang tepat dan kekuatan nisbi maksima tersebut memberikan informasi yang berharga mengenai sifat flavonoida dan pola oksigenasinya. Ciri khas spektrum tersebut ialah kekuatan nisbi yang rendah pada pita I dalam dihidroflavon, dihidroflavonol, dan isoflavon serta
kedudukan pita I pada spektrum khalkon, auron dan antosianin yang terdapat pada panjang gelombang yang tinggi.
Tabel 2. Rentangan serapan spektrum UV-Visibel golongan flavonoida Pita II (nm) Pita I (nm) Jenis flavonoida
250-280 250-280 250-280 245-275 275-295 230-270 (Kekuatan rendah) 230-270 (Kekuatan rendah) 270-280 310-350 330-360 350-385 310-330 bahu kira-kira 320 puncak 300-330 bahu 340-390 380-430 465-460 Flavon
Flavonol (3-OH tersubstitusi) Flavonol (3-OH bebas) Isoflavon
Isoflavon(5-deoksi-6,7-deoksigenasi) Flavonon dan dihidroflavonol
Khalkon
Auron
Antosianidin dan antosianin
(Markham,1988).
2.4.2. Spektrofotometri infra merah (FT-IR)
Spektrum inframerah suatu molekul adalah hasil transisi antara tingkat energi getaran yang berlainan. Pancaran inframerah yang kerapatannya kurang dari 100 cm-1 (panjang gelombang lebih daripada 100 µm) diserap oleh sebuah molekul organik dan diubah menjadi putaran energi molekul. Penyerapan ini tercantum, namun spektrum getaran terlihat bukan sebagai garis – garis melainkan berupa pita – pita. Hal ini disebabkan perubahan energi getaran tunggal selalu disertai sejumlah perubahan energi putaran. Kerapatan atau panjang gelombang penyerapan bergantung pada massa nisbi, tetapan gaya ikatan dan geometri.
Bila sinar inframerah dilewatkan melalui cuplikan senyawa organik, maka sejumlah frekuensi diserap sedangkan frekuensi yang lain diteruskan atau ditransmisikan tanpa diserap. Ikatan-ikatan yang berbeda (C-C, C=C,C-O, C=O, O-H, N-H) mempunyai frekuensi vibrasi yang berbeda dan kita dapat mendeteksi danya ikatan tersebut dalam molekul organik dengan mengidentifikasi frekuensi-frekuensi karakteristiknya sebagai pita serapan dalam spektrum inframerah. (Noerdin, D. 1985)
Untuk menafsirkan sebuah spektrum infra-merah tidak terdapat aturan yang pasti. Akan tetapi, terdapat beberapa syarat yang harus dipenuhi sebelum mencoba menafsirkan sebuah spektrum yaitu:
a. Spektrum haruslah cukup terpisah dan mempunyai kuat puncak yang memadai.
b. Spektrum harus dibuat dari senyawa yang cukup murni.
c. Spektrofotometer harus dikalibrasi sehingga pita akan teramati pada panjang gelombang yang semestinya.
d. Metode penanganan cuplikan harus ditentukan.
Jika menggunakan pelarut, maka macam dan konsentrasi pelarut serta tebal sel harus disebutkan juga (Silverstein, 1986).
Dalam molekul sederhana beratom dua atau beratom tiga tidak sukar untuk menentukan jumlah dan jenis vibrasinya dan menghubungkan vibrasi-vibrasi tersebut dengan energi serapan. Tetapi untuk molekul-molekul beratom banyak, analisis jumlah dan jenis vibrasi itu menjadi sukar sekali atau tidak mungkin sama sekali, karena bukan saja disebabkan besarnya jumlah pusat – pusat vibrasi, melainkan karena juga harus diperhitungkan terjadinya saling mempengaruhi (inter-aksi) beberapa pusat vibrasi.
Vibrasi molekul dapat dibagi dalam dua golongan, yaitu vibrasi regang dan vibrasi lentur.
1. Vibrasi regang
Di sini terjadi terus menerus perubahan jarak antara dua atom di didalam suatu molekul. Vibrasi regang ini ada dua macam yaitu vibrasi regang simetris dan tak simetri.
2.Vibrasi lentur
Di sini terjadi perubahan sudut antara dua ikatan kimia. Ada empat macam vibrasi lentur yaitu vibrasi lentur dalam bidang yang dapat berupa vibrasi scissoring atau vibrasi rocking dan vibrasi keluar bidang yang dapat berupa waging atau berupa twisting (Noerdin, 1985).
2.4.3. Spektrofotometri Resonansi Magnetik Inti Proton (1H-NMR)
Spektrometri Resonansi Magnetik Inti (Nuclear Magnetic Resonance, NMR) merupakan alat yang berguna pada penentuan struktur molekul organik. Teknik ini memberikan informasi mengenai berbagai jenis atom hidrogen dalam molekul.. Struktur NMR memberikan informasi mengenai lingkungan kimia atom hidrogen, jumlah atom hidrogen dalam setiap lingkungan dan struktur gugusan yang berdekatan dengan setiap atom hidroge (Cresswell, 1982).
Pergeseran kimia adalah pengukuran medan dalam keadaan bebas. Semua proton-proton dalam satu molekul yang ada dalam lingkungan kimia yang serupa kadang-kadang menunjukkan pergeseran kimia yang sama. Setiap senyawa memberikan penaikan menjadi puncak absorbsi tunggal dalam spektrum NMR. Di dalam medan magnet, perputaran elektron-elektron valensi dari proton menghasilkan medan magnet yang melawan medan magnet yang digunakan. Hingga setiap proton dalam molekul dilindungi dari medan magnet yang digunakan dan bahwa besarnya perlindungan ini tergantung pada kerapatan elektron yang mengelilinginya. Makin besar kerapatan elektron yang mengelilingi inti, maka makin besar pula medan yang dihasilkan yang melawan medan yang digunakan (Bernasconi,1995).
Senyawa yang paling lazim dan paling berguna dipakai sebagai acuan adalah tetrametilsilana (TMS). Beberapa keuntungan dari pemakaian standar internal TMS yaitu :
1. TMS mempunyai 12 proton yang setara sehingga akan memberikan spektrum puncak tunggal yang kuat.
CH3
CH3 Si CH3
CH3
2. TMS merupakan cairan yang mudah menguap, dapat ditambahkan kedalam larutan sampel dalam pelarut CDCl3 atau CCl4. (Silverstein, 1986)
Pada spektrometri RMI integrasi sangat penting. Harga integrasi menunjukkan daerah atau luas puncak dari tiap – tiap proton . Sedangkan luas daerah atau luas puncak tersebut sesuai dengan jumlah proton. Dengan demikian perbandingan tiap integrasi proton sama dengan perbandingan jumlah proton dalam molekul. (Muldja,1995).