ISMERI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2011
Hepatoprotektor Pada Tikus Putih Galur Sprague Dawley. Dibimbing oleh Hasim
dan Syamsul Falah.
Daun kari (Murraya koenigii), tanaman obat tradisional India merupakan
salah satu tanaman herbal yang secara in vitro dilaporkan memiliki aktivitas
antioksidan yang tinggi. Penelitian ini bertujuan menentukan kandungan fitokimia
dan aktivitas hepatoproteksi ekstrak etanol:air (1:1) daun kari secara in vivo pada
tikus Sprague Dawley yang diinduksi parasetamol dosis toksik. Aktivitas
hepatoproteksi diamati dengan menggunakan parameter uji biokimia, yaitu
mengukur aktivitas enzim alanin aminotransferase (ALT) dan aspartat
aminotransferase (AST) serum serta mengamati kajian histopatologi hati.
Sebanyak 25 tikus dibagi ke dalam 5 kelompok, yaitu kelompok normal (N),
kontrol negatif (KN) (parasetamol 500 mg/Kg BB), kontrol positif (KP)
(Curliv-plus® 42,86 mg/Kg BB), ekstrak daun kari (ED) dosis 200 mg/Kg BB dan 300
mg/Kg BB. Daun kari yang diekstrak dengan campuran pelarut etanol:air (1:1)
menghasilkan rendemen sebesar 19,2%. Hasil uji fitokimia menunjukkan adanya
kandungan senyawa alkaloid, saponin, steroid, dan tanin. Hasil analisis aktivitas
enzim transaminase serum menunjukkan bahwa induksi ED300 dan KP
memberikan efek yang signifikan (p<0,01) dalam mekanisme perlindungan hati
dibandingkan dengan ED200. Sedangkan kajian histopatologi hati menunjukkan
adanya nekrosis sel hati pada KN, regenerasi sel hati pada KP, vakuolisasi pada
ED200, dan tidak ada kelainan spesifik (normal) pada ED300. Hasil ini
mengindikasikan bahwa antioksidan ekstrak etanol:air (1:1) daun kari memiliki
potensi dalam melindungi sel hati.
as Hepatoprotector In Sprague Dawley Rats. Under the direction of Hasim and
Syamsul Falah.
Curry leaves (Murray koenigii), a traditional Indian medicinal plant is one
of the herbal plants that has been reported to have high in vitro antioxidant
activity. This study was designed to investigate phytochemical compound and
hepatoprotective activity of ethanol:water (1:1) extract of curry leaves (EWEC) on
paracetamol toxic dose induced acute liver damage in Sprague Dawley rats in
vivo. Hepatoprotection activity was measured by using biochemical parameters
such as enzymes alanine aminotransferase (ALT) and aspartate aminotransferase
(AST) serum level and to observe the histopathology study of liver. Twenty five
rats were divided into 5 groups: normal group (N), negative control group/KN
(paracetamol 500 mg/Kg BB), positive control group/KP (Curliv-plus® 42,86
mg/Kg BB), EWEC groups doses 200 mg/Kg BB and 300 mg/Kg BB. Curry leave
was extracted with a solvent mixture of ethanol:water (1:1) which resulted about
19,2% rendement. Phytochemical test indicates that EWEC contains alkaloids,
saponins, steroids, and tannins. Transaminase enzyme serum analysis shows that
the induction of EWEC 300 and KP treatment gives a significant effect (p<0.01)
on hepatoprotective compared to EWEC 200. However, liver histopathology
shows that there is a necrosis hepatocytes on KN group, regeneration on KP
group, vacuolisation on EWEC 200, and normal cells on EWEC 300. These
results indicate that the antioxidant of EWEC is potential to protect liver cells.
ISMERI
Skripsi
sebagai salah satu syarat memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2011
NIM : G84060438
Disetujui
Komisi Pembimbing
Dr. drh. Hasim, DEA
Ketua
Dr. Syamsul Falah, S.Hut., M.Si.
Anggota
Diketahui
Ketua Departemen Biokimia
Dr. Ir. I Made Artika, M.App.Sc.
Ketua Departemen Biokimia
nikmat dan karunia-Nya sehingga penulis dapat menyelesaikan karya ilmiah ini
sebagai salah satu persyaratan untuk memperoleh gelar Sarjana Sains pada
Departemen Biokimia, Fakultas Matematika & IPA Institut Pertanian Bogor.
Tema yang dipilih pada penelitian ini ialah metabolisme, dengan judul “Aktivitas
Ekstrak Etanol-Air Daun Kari (Murraya koenigii) Sebagai Hepatoprotektor Pada
Tikus Putih Galur Sprague Dawley”. Penelitian ini dilaksanakan pada bulan
Agustus hingga Oktober 2010 di Laboratorium dan Kandang Hewan Coba
Biokimia, Departemen Biokimia, Institut Pertanian Bogor, Laboratorium Patologi
Fakultas Kedokteran Hewan, Institut Pertanian Bogor, dan Laboratorium Patologi
Balai Besar Penelitian Veteriner (BALITVET) Bogor.
Terima kasih penulis ucapkan kepada Dr. drh. Hasim, DEA dan Dr.
Syamsul Falah, S.Hut., M.Si. atas bimbingan, waktu, dan perhatiannya kepada
penulis selama penelitian dan penyusunan karya ilmiah. Ucapan terima kasih juga
penulis sampaikan kepada Laboran departemen biokimia dan drh. Yulvian Sani,
Ph.D yang telah banyak membantu dalam teknis pelaksanaan penelitian ini,
kepada kedua orang tua dan seluruh keluarga tercinta atas segala doa, dukungan,
kasih sayangnya, dan selalu memberi inspirasi kepada penulis untuk selalu
berjuang keras dan menjadi lebih baik, dan kepada Farah Meutia selaku rekan
kerja, teman-teman Biokimia 43, SainTeker’s 2009, Umul, Marsudi, Feni, April,
Valen, Hery, Igoy, Izha, Luky ILKOM 43, Tuti STK 44, serta teman-teman
PPSDMS Nurul Fikri regional 5 Bogor atas dukungan dan bantuannya selama
penelitian dan penyusunan skripsi. Semoga karya ilmiah ini dapat bermanfaat bagi
pembaca dan ilmu pengetahuan, khususnya dibidang Biokimia dan Farmasi.
Bogor, Maret 2011
Ismeri
ayahanda Isnen dan ibunda Asiah sebagai anak ke-6 dari enam bersaudara. Tahun
2006 penulis lulus dari SMA Negeri 2 Bandar Lampung dan pada tahun yang
sama penulis diterima di IPB melalui jalur Seleksi Penerimaan Mahasiswa Baru
(SPMB). Tahun 2007 penulis memilih Mayor Biokimia, Fakultas Matematika
dan Ilmu Pengetahuan Alam (FMIPA) dan Manajemen Fungsional, Fakultas
Ekonomi dan Manajemen (FEM) sebagai minor.
Selama mengikuti perkuliahan, penulis pernah aktif di berbagai organisasi
kemahasiswaan. Tahun 2006-2007 penulis aktif di ROHIS A8 sebagai Ketua
Divisi PSDM. Tahun 2007-2008 penulis aktif di Badan Eksekutif Mahasiswa
(BEM) FMIPA sebagai staf ahli Departemen SAINS. Di tahun yang sama, penulis
juga aktif sebagai anggota Organisasi Mahasiswa Daerah (OMDA) Keluarga
Mahasiswa Lampung (KEMALA) dan aktif di Himpunan Profesi Community of
Research and Education in Biochemistry (CREBs) sebagai Badan Pengawas. Pada
tahun 2009-2010 penulis aktif sebagai Menteri Sains & Teknologi Badan
Eksekutif Mahasiswa (BEM) FMIPA. Disamping itu, penulis juga pernah
mendapat beasiswa SP++ dari Yayasan Damandiri pada tahun 2006-2007,
beasiswa Peningkatan Prestasi Akademik (PPA) pada tahun 2008-2009, beasiswa
BBM pada tahun 2009-2010, dan beasiswa Program Pembinaan Sumber Daya
Mahasiswa Strategis (PPSDMS) Nurul Fikri selama 2 tahun (2008 hingga 2010).
Tahun 2008 dan 2011 penulis mendapat dana hibah penelitian dari DIKTI melalui
Program Kreativitas Mahasiswa bidang Penelitian (PKMP). Selain itu, penulis
juga pernah menjadi finalis berbagai kompetisi tingkat nasional, diantaranya
Lomba Karya Tulis Mahasiswa (KATULISTIWA) Universitas Brawijaya, Lomba
Penelitian Mahasiswa Teknik Kimia Indonesia (LPMTKI) Universitas
Diponegoro, dan Lomba Karya Tulis Ilmiah Al-Qur’an (LKTIA) Institut
Pertanian Bogor. Pada penghujung masa studi di IPB penulis berkesempatan
sebagai penyaji makalah internasional pada Annual Meeting of Science and
Technology Studies (AMSTECS)-Jepang 2011.
Sebagai pengalaman profesi, penulis juga aktif sebagai asisten praktikum
Biologi Dasar untuk mahasiswa Tingkat Persiapan Bersama (TPB) IPB tahun
2008 hingga 2009. Pada semester akhir studi, penulis pernah menjalani Praktik
Lapang (PL) di Lembaga Ilmu Pengetahuan Indonesia (LIPI) dan menulis laporan
ilmiah yang berjudul “Uji Potensi Amilolitik Isolat Bakteri Asal Saluran Cerna
Manusia”. Pada tahun 2009, penulis juga pernah menjadi tentor Kimia di
Lembaga Bimbingan Belajar SPEKTRUM serta tentor Matematika di Lembaga
Bimbingan Belajar Bintang Pelajar (BP) Bogor pada tahun 2010.
Halaman
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... x
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Daun kari (Murraya koenigii) Sebagai Obat Herbal Multikhasiat ... 2
Senyawa Hepatoprotektor ... 3
Parasetamol Sebagai Hepatotoksik ... 3
Senyawa Antioksidan ... 4
Fisiologi dan Fungsi Hati ... 6
BAHAN DAN METODE
Bahan dan Alat ... 8
Metode Penelitian ... 8
HASIL DAN PEMBAHASAN
Ekstraksi dan Penapisan Fitokimia ... 10
Keadaan Hewan Coba Selama Perlakuan ... 11
Keadaan Hewan Coba Sebelum Perlakuan... 12
Aktivitas Enzim Transaminase ... 12
Gambaran Histopatologi Hati ... 15
SIMPULAN DAN SARAN ... 17
DAFTAR PUSTAKA ... 17
Halaman
1 Uji fitokimia ekstrak etanol:air (1:1) daun kari (Murraya koenigii) ... 11
2 Peningkatan bobot badan hewan coba selama perlakuan ... 12
3 Aktivitas enzim ALT dan AST serum darah tikus pada hari ke-0 ... 12
4 Perubahan aktivitas enzim ALT darah tikus pada hari ke-14 dan -21
dibandingkan dengan kelompok normal ... 14
5 Perubahan aktivitas enzim AST darah tikus pada hari ke-14 dan -21
dibandingkan dengan kelompok normal ... 15
6 Hasil uji Kruskal-Walis kelainan histopatologi hati ... 17
DAFTAR GAMBAR
Halaman
1 Daun kari (Murraya koenigii) ... 3
2 Jalur metabolik parasetamol pada hati normal (a) dan glutation <30% (b) ... 5
3 Mekanisme reaksi pada pengukuran aktivitas ALT ... 9
4 Bobot badan hewan coba selama perlakuan... 12
5 Aktivitas enzim ALT selama perlakuan ... 13
6 Aktivitas enzim AST selama perlakuan ... 13
DAFTAR LAMPIRAN
Halaman
1 Gambaran umum penelitian ... 22
2 Rancangan perlakuan hewan coba ... 23
3 Pengukuran kadar enzim ALT dan AST ... 24
4 Perhitungan dosis ... 25
5 Pembuatan sediaan histopatologi hati ... 26
6 Pewarnaan Haematoxylin-Eosin ... 27
7 Data bobot tikus selama perlakuan ... 28
8 Aktivitas ALT serum darah tikus selama perlakuan ... 30
9 Hasil uji analisis statistik aktivitas ALT serum darah tikus ... 31
10 Aktivitas AST serum darah tikus selama perlakuan ... 32
11 Hasil uji analisis statistik aktivitas AST serum darah tikus ... 33
PENDAHULUAN
Organ hati adalah organ yang berperan mengatur homeostasis dalam tubuh. Organ ini terlibat dalam hampir semua jalur biokimia yang berhubungan dengan pertumbuhan, memerangi penyakit, suplai gizi, penyediaan energi dan reproduksi (Walker & Edward 1999; Stockham & Scott 2008). Menurut Shahani (1999), hati adalah organ yang memainkan peran yang sangat penting dalam mengatur berbagai proses fisiologis di dalam tubuh. Hal ini terlihat dalam beberapa fungsi vital, seperti metabolisme, sekresi, dan penyimpanan sehingga hati menjadi sangat rentan terhadap kerusakan. Berbagai penelitian terdahulu melaporkan bahwa terdapat beragam faktor yang dapat menyebabkan kerusakan hati, antara lain kelebihan konsumsi alkohol, bakteri, jamur, virus, senyawa kimia, infeksi, dan gangguan autoimun.
Hepatitis merupakan salah satu contoh jenis penyakit hati yang sering kali terjadi pada masyarakat. Di Indonesia, penyakit ini di derita oleh sekitar 12 juta jiwa dan menduduki peringkat ketiga di Asia Pasifik (Dalimartha 2005). Hepatitis akibat obat atau toksin dapat digolongkan menjadi hepatotoksin direct dan indirect, reaksi hipersensitivitas terhadap obat, serta idiosinkrasi metabolik. Hal ini ditambah dengan pengetahuan masyarakat yang kurang
akan konsumsi obat-obatan dapat
meningkatkan resiko timbulnya penyakit hepatitis. Konsumsi obat-obatan seperti parasetamol dalam dosis berlebih pada hewan dan manusia dapat mengakibatkan kerusakan hati (Lee 2003). Obat-obat lain yang dapat menyebabkan kerusakan hati adalah obat anastetik, antibiotik, antiinflamasi,
antimetabolik dan imunosupresif,
antituberkulosa, hormon-hormon, serta obat psikotropik.
Hepatitis secara umum timbul akibat inflamasi hati. Salah satu kondisi yang terjadi adalah oksidasi membran sel oleh radikal bebas, baik dari luar tubuh (eksogen) maupun hasil metabolisme tubuh (endogen). Konsumsi parasetamol dosis tinggi dapat menyebabkan kerusakan hati secara akut atau nekrosis. Hal ini terjadi karena pengikatan kovalen pada N-asetil-p-benzokuinonimina (NAPQI), senyawa radikal hasil oksidasi parasetamol, dengan gugus –SH pada protein membran yang menghasilkan nekrosis sel dan peroksidasi lipid yang diinduksi oleh penurunan jumlah glutation (Murugesh et al. 2005). Kerusakan
hati dapat didiagnosa oleh beberapa parameter biokimia, yaitu adanya peningkatan aktivitas enzim alanin aminotransferase (ALT), aspartat aminotransferase (AST), alkalin fosfatase (ALP), gammaglutamil transferase (GGT), glutation peroksidase (GPx), superoksida dismutase (SOD), katalase, laktat dehidrogenase, 5-nukleotidase, bilirubin, dan TBA-reacting substance (TBARS) (Stockham & Scott 2008).
Saat ini, belum ada obat yang efektif dalam merangsang fungsi hati, melindungi sel hati terhadap kerusakan, dan membantu meregenerasi sel hati meskipun kemajuan pengobatan secara modern bekembang dengan pesat (Chattopadhyay 2003). Di lain sisi, berbagai upaya pengobatan gangguan fungsi hati secara klinis memerlukan biaya yang mahal dan sering kali menyebabkan efek samping yang merugikan. Oleh karena itu, masyarakat mulai beralih ke pengobatan secara tradisional sesuai dengan semboyan “Back to nature” yang sering kali memberikan efek yang cukup signifikan. Hingga saat ini juga masih dilakukan berbagai penelitian untuk mendapatkan komponen bahan aktif yang mampu berperan sebagai hepatoprotektor.
Hepatoprotektor adalah senyawa atau zat yang berkhasiat melindungi sel sekaligus memperbaiki jaringan hati yang rusak akibat pengaruh toksik (Dalimartha 2005). Dilihat dari strukturnya, senyawa yang bersifat hepetoprotektor diantaranya meliputi senyawa golongan fenilpropanoid, kumarin, lignin, minyak atsiri, terpenoid, glikosida, flavonoid, asam organik lipid, serta senyawa nitrogen (alkaloid dan xantin) (Sidik 1988). Beberapa senyawa antioksidan alami seperti flavonoid, terpenoid, dan steroid telah diteliti secara farmakologi memiliki aktivitas hepatoproteksi (Murugesh et al. 2005). Antioksidan memainkan peranan penting dalam mengikat radikal bebas dan mencegah amplifikasi senyawa radikal bebas. Sumber antioksidan terbanyak di alam adalah komponen fenolik atau polifenol, sedangkan sisanya adalah komponen nitrogen dan karotenoid (Lenny 2006).
Tumbuhan kari (Murraya koenigii) merupakan salah satu tanaman yang telah digunakan secara tradisional di Indonesia. Berdasarkan penelitian secara in vitro yang dilakukan oleh Ningappa et al. (2008), daun kari yang selama ini digunakan sebagai bumbu penyedap makanan ternyata memiliki aktivitas antioksidan yang tinggi yang terdapat pada ekstrak etanol-air (1:1) yang termasuk
dalam golongan senyawa polifenol. Pengaruh pemberian ekstrak daun kari terhadap kesehatan telah banyak diteliti, diantaranya dapat memberikan efek antikanker dan antiinflamasi (to et al. 2005; Muthumani et al. 2009), antidiabetes (Hougon 2004; Vinuthan et al. 2004; Arulselvan et al. 2006; Bhat et al. 2008; Lawal et al. 2008), dan antibakteri (Ningappa et al. 2010). Selain itu, ekstrak daun kari memiliki aktivitas hipoglikemik tanpa efek samping maupun bersifat toksik (Lawal et al. 2008). Namun, potensinya sebagai hepatoprotektor belum dilakukan. Oleh karena itu, aktivitas ekstrak etanol:air (1:1) daun kari terhadap mekanisme perlindungan hati perlu diteliti.
Penelitian ini bertujuan menguji kandungan fitokimia ekstrak etanol:air (1:1) daun kari dan menguji aktivitas hepatoproteksi ekstrak etanol:air (1:1) daun kari secara in vivo pada tikus Sprague Dawley yang diinduksi parasetamol dosis 500 mg/kg BB. Potensi yang diperoleh akan dibandingkan secara langsung dengan Curliv-plus® (obat hepatitis komersil) dosis 42.86 mg/kg BB. Adapun parameter uji yang digunakan adalah analisis kadar enzim ALT dan AST serum serta kajian histopatologi hati. Hipotesis pada penelitian ini adalah kandungan senyawa bioaktif yang terdapat di dalam daun kari (Murraya koenigii) memiliki mekanisme perlindungan hati tikus terhadap kerusakan sel hati yang diinduksi parasetamol. Senyawa-senyawa tersebut diduga dapat menghambat atau mencegah terjadinya pembentukan radikal bebas (peroksida) di dalam tubuh yang dapat mengakibatkan kerusakan pada sel-sel hati. Hasil penelitian ini diharapkan dapat menambah informasi potensi ekstrak etanol:air (1:1) daun kari sebagai hepatoprotektor dan dapat dijadikan sebagai obat hepatitis alternatif sehingga manfaat daun kari dapat dieksplorasi secara optimal.
TINJAUAN PUSTAKA
Daun Kari (Murraya koenigii) Sebagai Obat Herbal Multikhasiat
Tanaman kari (Murraya koenigii) (Gambar 1) merupakan salah satu tanaman rempah yang tergolong famili Rutaceae (jeruk-jerukan) yang diperkenalkan oleh seorang ahli botani asal Swedia dan German, yaitu Johann Andreas Murray dan Gerhard Koenig (Seidemann 2005). Secara morfologi pohon
kari bisa tumbuh mencapai 4-6 meter, memiliki tangkai panjang dan setiap tangkai mengandung 11-21 daun, memiliki bunga yang kecil dan berwarna putih, serta memiliki buah yang berwarna coklat-hitam, mengkilap, dan bisa dimakan namun bijinya beracun. Tanaman kari umumnya lebih dikenal sebagai daun kari (curry-leaf tree) yang merupakan tanaman yang banyak tumbuh di India, Nepal, Sri Lanka, dan beberapa negara Asia Selatan, serta paling banyak ditemui hampir diseluruh wilayah India (Choudhury & Garg 2007). Di Indonesia daun kari banyak terdapat di beberapa daerah di Sumatera seperti Aceh dan Medan. Daun ini banyak digunakan sebagai bahan rempah-rempah terutama sebagai bumbu pada berbagai jenis masakan dan juga digunakan untuk perawatan berbagai jenis penyakit pada sistem pengobatan tradisional.
Selain sebagai bumbu masak, daun kari juga sering digunakan sebagai jamu pengobatan alternatif. Daun kari dipakai sebagai bahan baku dalam hampir semua obat tradisional India, yang berkhasiat menyembuhkan berbagai penyakit antara lain pusing-pusing, sakit perut, kulit gatal, digigit serangga, diare, influenza, reumatik, obat luka, gigitan ular, bahkan diabetes (kong et al. 1986). Selain sebagai obat tradisional, daun ini juga dapat digunakan sebagai kosmetik dan obat jerawat, bahkan digunakan sebagai conditioner bagi rambut yang dapat mengurangi penipisan dan uban pada rambut (Choudhury & Garg 2007). Disamping itu, daun ini pula memiliki aroma yang menyengat yang disebabkan oleh kandungan minyak atsiri yang terkandung di dalamnya (Rana et al. 2004) sehingga daun ini kerap digunakan pada industri parfum dan sabun. Selain itu, daun ini kaya akan mineral (Choudhury & Garg 2007), vitamin A dan B serta mengandung banyak karbohidrat, protein, asam amino dan alkaloid (Kong et al. 1986; Tee & Lim 1991).
Khasiat daun kari dalam bidang kesehatan telah banyak diteliti, diantaranya dapat memberikan efek antikanker dan antiinflamasi (Ito et al. 2005; Muthumani et al. 2009), antidiabetes (Hougon 2004; Vinuthan et al. 2004; Arulselvan et al. 2006; Bhat et al. 2008; Lawal et al. 2008), dan antibakteri (Ningappa et al. 2010). Ekstrak daun kari memiliki aktivitas hipoglikemik tanpa efek samping maupun bersifat toksik (Lawal et al. 2008). Selain itu, daun ini memiliki kandungan mineral Cr, V, Mn, Zn, Cu dan Se yang tinggi yang dikenal memiliki peranan penting pada proses biokimia terutama
diabetes (Choudhury & Garg 2007). Beberapa literatur menyebutkan bahwa daun kari memiliki kandungan essential oils, kumarin, terpenoid, lutein, karbazol alkaloid, mahanimbin, murayanol, dan mahanin (Ramsewak et al. 1999; Tachibana et al. 2001; Nakahara et al. 2002). Berdasarkan Palaniswamy (2003), daun kari kaya akan antioksidan seperti tokoferol, β-karoten, lutein, dan alkaloid. Berdasarkan penelitian yang dilakukan oleh Ningappa et al. (2008), antioksidan tertinggi pada daun kari terdapat pada ekstrak etanol-air (1:1) yang termasuk golongan senyawa polifenol, yaitu sebesar 168 ± 5,6 mg/g ekstrak. Selain itu, ekstrak etanol:air (1:1) daun kari dapat menghambat lipid peroksida sebesar 76,4 ± 3 % pada konsentrasi rendah (50 µg/mL), menghambat superoksida dismutase (SOD) sebesar 93% pada konsentrasi 200 µg/3 mL, menghambat radikal DPPH sebesar 92 % pada konsentrasi 20 µg/mL, dan menghambat radikal hidroksil sebesar 91% pada konsentrasi 20 µg/mL.
Gambar 1 Daun kari (Murraya koenigii)
Senyawa Hepatoprotektor
Hepatoprotektor adalah senyawa atau zat yang berkhasiat melindungi sel hati terhadap pengaruh zat toksik yang dapat merusak hati, bahkan dapat memperbaiki jaringan hati yang telah rusak (Dalimartha 2005). Secara empiris telah banyak tanaman yang tumbuh di Indonesia yang digunakan oleh masyarakat sebagai obat penyakit hati, seperti brotowali, kembang merak, rebung bambu, mengkudu, tomat, jagung, pepaya, wortel, lidah buaya, akar kuning, temulawak dan kunyit. Namun, masih sedikit diantara tumbuhan tersebut yang telah dibuktikan secara ilmiah kebenarannya. Sebagian besar zat hepatoprotektor tersebut adalah senyawa yang tergolong antioksidan. Senyawa ini bekerja dalam menghambat atau memperlambat proses oksidasi radikal bebas (Murray 2009).
Sejak tahun 1976 telah dilakukan usaha untuk menemukan senyawa bioaktif yang
berasal dari tumbuhan yang memiliki aktivitas hepatoprotektor. Pada tahun 1983 ilmuwan Korea telah melakukan penapisan terhadap 78 jenis tumbuhan yang biasa digunakan rakyat Korea untuk pengobatan hepatitis dan 21 diantaranya terbukti sebagai hepatoprotektor. Di Indonesia, penelitian mengenai tanaman obat yang sering digunakan oleh masyarakat sebagai obat hepatitis juga telah banyak dilakukan. Misalnya, penelitian yang dilakukan oleh Yuningsih (1987) terhadap ekstrak air temulawak (Curcuma xanthorizha Robx) dapat menurunkan aktivitas SGOT dan SGPT darah kelinci dalam keadaan terinfeksi hepatitis B, Harun & Syahri (1999) yang meneliti aktivitas daun dewa yang memiliki sifat antioksidan yang mampu menghambat sifat hepatotoksik senyawa halotan yang terpapar di udara, Batubara (2003) dan Adji (2004) yang berhasil membuktikan aktivitas ekstrak saponin akar kuning sebagai hepatoprotektor, Marliana (2005) yang membuktikan khasiat buah mahkota dewa sebagai hepatoprotektor, Rustandi (2006) yang melihat aktivitas ekstrak daun sangitan dalam peroksidasi lipid serum darah tikus yang diinduksi parasetamol, dan Panjaitan (2008) yang menguji aktivitas hepatoprotektor ekstrak akar pasak bumi, serta Aryadi (2009) yang membuktikan khasiat ekstrak bunga rosella sebagai hepatoprotektor terhadap tikus yang diinduksi parasetamol.
Parasetamol Sebagai Hepatotoksik
Hepatotoksin adalah senyawa yang dapat menyebabkan gangguan pada jaringan hati. Hepatotoksin juga merupakan zat yang mempunyai efek toksik pada hati dengan dosis berlebihan atau dalam jangka waktu yang lama. Hepatotoksin yang menyebabkan gangguan pada jaringan hati, tergantung pada dosis pemberian, interval waktu pemberian yang singkat antara pencernaan obat dan reaksi melawan, serta kemampuan untuk menimbulkan perubahan yang sama pada jaringan hati (Dalimartha 2005).
Berdasarkan mekanismenya terhadap perusakan hati, hepatotoksin dibagi menjadi dua macam, yaitu hepatotoksin intrinsik dan ekstrinsik. Hepatotoksin intrinsik merupakan hepatotoksin yang dapat diprediksi, tergantung pada dosis dan melibatkan mayoritas individu yang menggunakan obat dalam jumlah tertentu. Rentang waktu antara mulainya dan timbulnya kerusakan hati sangat bervariasi, dari beberapa jam sampai beberapa minggu. Salah satu contohnya adalah
menyebabkan nekrosis hati yang dapat diprediksi pada pemberian over dosis. Di sisi lain, hepatotoksin ekstrinsik atau idiosinkratik merupakan hepatotoksin yang tidak dapat diprediksi. Hepatotoksin ini terkait dengan hipersensitivitas atau kelainan metabolisme. Respon dari hepatotoksin ini tidak dapat diprediksi dan tidak tergantung pada dosis pemberian. Tahap inkubasi toksin ini bervariasi, tetapi biasanya berminggu-minggu atau berbulan-bulan. Contohnya seperti sulfonamid, isoniazid, halotan, dan klorpromazin (Gibson 1991).
Parasetamol atau N-asetil-p-aminofenol merupakan obat yang berkhasiat analgetik anatipiretik non narkotik turunan para aminofenol. Parasetamol cepat diserap secara sempurna oleh saluran pencernaan dan tersebar ke seluruh cairan tubuh. Konsentrasi tertinggi berada pada plasma darah setelah 1-3 jam masuk ke dalam tubuh. Sebanyak 25% parasetamol berada terikat dengan protein (Lee 2003). Parasetamol termasuk salah satu obat yang sering dikonsumsi oleh masyarakat, dapat menyebabkan kerusakan hati apabila dikonsumsi 7,5 gram sekaligus, dan pada pemakaian lebih dari 15 gram sekaligus akan menyebabkan nekrosis atau kematian sel hati (Dalimartha et al. 2005). Dosis parasetamol 500 mg/kg BB yang diinduksikan pada tikus Sprague Dawley mampu membuat kerusakan membran sel hepatosit (Aryadi 2009), sedangkan dosis untuk tikus galur Wistar adalah 750 mg/kg BB (Murugesh et al. 2005). Di sisi lain, dosis parasetamol pada tikus Rattus Norvegicus sebesar 2 g/kg BB (Balamurugan et al. 2008).
Gambar 2 menunjukkan proses
metabolisme parasetamol di dalam tubuh. Pada dosis normal, parasetamol yang masuk
ke dalam tubuh akan mengalami
biotransformasi di dalam hati dengan mekanisme konjugasi (metabolisme fase II) dengan glukuronat sebanyak 40%-67%, sulfonat 20-46%, serta <5%-nya adalah sistein, beberapa metabolit terhidroksilasi dan terdeasetilasi. Hasil reaksi konjugasi ini menghasilkan senyawa yang larut air (hydrosoluble) dan tidak toksik sehingga dapat disekresikan melalui urin (Wong et al. 1981; Lee 2003) (Gambar 2a).
Pada keadaan over dosis, sisa parasetamol akan dibiotransformasi oksidatif oleh sitokrom P-450 (metabolisme fase I) sehingga membentuk suatu metabolit elektrofil N-asetil-p-benzoikuinonimina (NAPQI) yang bersifat hepatotoksik dan reaktif. NAPQI kemudian akan bereaksi dengan biomolekul
penyusun membran sel hati, seperti fosfolipid dan protein bergugus –SH. Detoksifikasi NAPQI diawali oleh konjugasi dengan glutation tereduksi (GSH) menjadi asam merkapturat yang bersifat hydrosoluble non toxic dan dapat diekskresikan oleh ginjal (Wong et al. 1981) (Gambar 2a).
Jika laju pembentukan NAPQI lebih besar dari laju detoksifikasi oleh GSH, maka akan terjadi oksidasi berbagai biomolekul penyusun membran seperti lipid atau gugus SH pada protein (Wong et al. 1981). Proses ini menyebabkan kandungan GSH hati <30% dari normalnya, sehingga NAPQI berikatan dengan makromolekul protein sel hati membentuk senyawa semikuinon. Senyawa ini akan mereduksi O2 menjadi O2•, kemudian
membentuk senyawa radikal bebas lagi yang akan mengoksidasi fosfolipid lain secara berantai. Hal ini mengakibatkan kerusakan sel hati sampai timbul nekrosis hati, yaitu terjadinya gangguan integritas membran plasma, keluarnya isi sel, dan timbulnya respon inflamasi (Gambar 2b). Respon ini menyebabkan banyak sel yang mati (Gibson & Sket 1991) yang ditandai dengan peningkatan ALT dan AST, bilirubin, alkalin fosfatase, gammaglutamil transferase (GGT), serta dehidrogenase laktat pada serum selama 24 jam setelah pemberian (Firmansyah 2006).
Senyawa Antioksidan
Antioksidan, secara umum dapat didefinisikan sebagai senyawa yang dapat menunda, memperlambat dan mencegah proses oksidasi lipid. Sedangkan dalam arti khusus, antioksidan adalah zat yang dapat menunda atau mencegah terjadinya reaksi oksidasi radikal bebas. Senyawa dikatakan memiliki sifat antioksidatif bila senyawa tersebut mampu mendonasikan satu atau lebih elektron kepada senyawa prooksidan, kemudian mengubah senyawa oksidan menjadi senyawa yang stabil (Packer 1995).
Antioksidan, berdasarkan sumbernya dibagi menjadi 2 kelompok, yaitu antioksidan sintetik dan antioksidan alami. Beberapa contoh antioksidan sintetik adalah Butil Hidroksi Anisol (BHA), Butil Hidroksi Toluen (BHT), propil galat, tert-butil hidroksi quinon (TBHQ) dan tokoferol, sedangkan antioksidan alami berasal dari tumbuhan, yang pada umumnya adalah senyawa fenolik atau polifenolik yang dapat berupa golongan flavonoid. Berdasarkan asal terbentuknya, antioksidan dibagi menjadi dua kelompok, yaitu antioksidan endogen dan eksogen. Sedangkan berdasarkan mekanisme kerjanya,
antioksidan dapat dikelompokkan menjadi 3 kelompok, yaitu: (a) Antioksidan primer (antioksidan endogen/antioksidan enzimatis), contohnya enzim superoksida dismutase (SOD), katalase, dan glutation peroksidase (GPx). Enzim-enzim ini mampu menekan atau menghambat pembentukan radikal bebas dengan cara memutus reaksi berantai dan mengubahnya menjadi produk lebih stabil; (b) Antioksidan Sekunder (antioksidan eksogen/antioksidan non enzimatis), contoh antioksidan sekunder ialah vitamin E, vitamin C, β-karoten, isoflavon, asam urat, bilirubin, dan albumin. Senyawa-senyawa ini dikenal sebagai penangkap radikal bebas (scavenger free radical), kemudian mencegah amplifikasi radikal; (c) Antioksidan Tersier, misalnya enzim metionin sulfoksida reduktase, yang berperan dalam perbaikan biomolekul yang disebabkan oleh radikal bebas (Packer & Ong 1998).
Menurut Ong et al. (1995), terdapat lima mekanisme kerja antioksidan seluler, yaitu: (1) Berinteraksi langsung dengan oksidan, radikal bebas atau oksigen tunggal; (2) Mencegah pembentukan jenis oksigen reaktif; (3) Mengubah jenis oksigen reaktif menjadi kurang toksik; (4) Mencegah kemampuan oksigen reaktif; (5) Memperbaiki kerusakan
yang timbul.
Penggunaan senyawa antioksidan saat ini semakin meluas seiring dengan semakin besarnya pemahaman masyarakat tentang
peranannya dalam menghambat penyakit degeneratif seperti penyakit jantung, arterisklerosis, kanker, serta gejala penuaan. Masalah-masalah tersebut berkaitan dengan kemampuan antioksidan dalam bekerja sebagai inhibitor (penghambat) reaksi oksidasi oleh radikal bebas reaktif yang menjadi salah satu penyebab penyakit-penyakit di atas (Packer & Ong 1998). Tubuh manusia dapat menghasilkan senyawa antioksidan secara alami, tetapi jumlahnya sering kali tidak cukup untuk menetralkan radikal bebas yang masuk ke dalam tubuh (Hernani & Rahardjo 2005). Antioksidan alami mampu melindungi tubuh terhadap kerusakan yang disebabkan oleh oksigen reaktif dan mampu menghambat terjadinya penyakit degeneratif serta mampu menghambat peroksida lipid pada makanan. Keseimbangan antara antioksidan dan radikal bebas menjadi kunci utama pencegahan stres oksidatif dan penyakit-penyakit kronis yang dihasilkan (Packer et al. 1995).
Stres oksidatif adalah keadaan ketidakseimbangan antara prooksidan dan antioksidan. Keaadaan stres oksidatif dapat disebabkan oleh beberapa faktor, antara lain adalah kurangnya antioksidan atau kelebihan produksi radikal bebas. Radikal bebas sebetulnya diproduksi secara fisiologis oleh sel sebagai konsekuensi logis pada reaksi biokimia dalam kehidupan aerobik. Namun, jika radikal bebas berlebihan dan antioksidan selluler tetap atau lebih sedikit, maka Gambar 2 Jalur metabolik parasetamol pada hati normal (a) dan glutation <30% (b)
kelebihan radikal bebas ini tidak dapat dinetralkan dan akan berakibat pada kerusakan sel itu sendiri. Kondisi stres oksidatif yang berakibat pada kerusakan sel, dapat menyebabkan terjadinya percepatan proses penuaan, dan dapat menimbulkan penyakit jantung, kanker, dan diabetes melitus (Packer & Ong 1998).
Prof. Bernhard Waltz dari Institute of Nutritional Physiology (FRNC) Karlshure, Jerman menyatakan bahwa senyawa fitokimia memiliki efek biologi yang efektif dalam menghambat pertumbuhan kanker, berfungsi sebagai antioksidan, antimikroba, menurunkan kolesterol darah, menurunkan kadar glukosa darah, bersifat antibiotik, dan menimbulkan efek peningkatan kekebalan. Fitokimia yang bersifat antioksidan aktif adalah karotenoid, polifenol, fitoestrogen, inhibitor protease, dan sulfida. Karotenoid seperti lycopene dan canthaxanthin, adalah jenis antioksidan yang
memiliki kemampuan tinggi dalam
memproteksi oksidasi yang disebabkan oleh radikal bebas. Sedangkan polifenol dikenal sebagai antioksidan tanaman yang sangat superior. Polifenol dari anggur merah dan flavanol quersetin adalah senyawa fitokimia yang dapat mencegah oksidasi low density lipoprotein (LDL) dan kolesterol sehingga dapat mencegah timbulnya penyakit kronis (Packer & Ong 1998).
Fisiologi dan Fungsi Hati
Hati merupakan organ tubuh yang besar, kompleks, dan terdapat di dalam rongga perut kanan atas, di bawah diafragma kanan, dan dilindungi tulang iga kanan bawah. Organ ini berwarna coklat tua dan berbobot antara 1.200-1.600 g atau sekitar 2.5% dari bobot total orang dewasa. Organ ini terbagi menjadi dua lobus, lobus kanan besarnya enam kali bagian kirinya. Setiap lobus terdiri atas ribuan lobulus yang merupakan unit fungsional. Setiap lobulus terdiri atas sel-sel hepatosit yang berbentuk kubus dan tersusun melingkar mengelilingi vena sentralis. Di antara lobulus (interlobular) terdapat saluran empedu dan kapiler (sinusoid) yang merupakan cabang vena porta dan arteria hepatika (Dalimartha 2005). Sinusoid dibatasi oleh sel Kupffer yang merupakan sistem retikuloendotelial dan mempunyai fungsi serupa dengan sel makrofag (Kaplan & Pesce 1998). Pada tikus, hati terletak pada bagian anterior ruang abdominal, memanjang dari tulang belakang sampai cartilago xiphoidea. Hati tikus terdapat empat lobus (median, lateral kanan, lateral kiri, dan kaudal). Bila dilakukan
hipatektomi, sel hati mampu melakukan regenerasi meskipun hanya sebagian sel hati yang dapat diganti. Tikus tidak memiliki kantung empedu, saluran empedu dari beberapa lobus membentuk saluran empedu umum yang masuk ke deudenum (Fox et al. 1984).
Secara garis besar, fungsi hati dapat digolongkan menjadi lima besar, yaitu detoksifikasi, sekresi, penyimpanan cadangan makanan, hematologis, proteksi, dan juga berperan dalam proses metabolisme biomolekul (karbohirat, lipid, asam amino, hormon dan bilirubin) (Kaplan & Pesce 1998). Pada metabolisme tubuh, hati berperan dalam metabolisme karbohidrat, protein, dan lipid yang dikirim oleh vena porta setelah diabsorbsi dari usus. Hati dapat menyintesis lebih dari 1000 protein plasma, seperti albumin dan globulin secara de novo dari asam amino esensial dan non esensial. Hati juga dapat menyintesis asam lemak, trigliserida, kolesterol, apolipoprotein, lipoprotein, dan kolesterol ester dalam fosfolipid. Beberapa bahan hasil metabolisme ini dapat tersimpan dalam hati, seperti glikogen, trigliserida, Fe, dan Cu (Stockham & Scott 2008). Sebagai Haematologis, organ hati berfungsi mengatur keseimbangan cairan elektrolit, dan mengatur volume darah dan bersifat sebagai spons/filter karena semua makanan dan substansi yang telah diserap oleh usus halus akan dialirkan ke hati melalui sistem portal. Fungsi hati lainnya adalah detoksifikasi toksin dan radikal bebas, yaitu melalui reaksi konjugasi dengan beberapa senyawa yang dihasilkan di dalam hati, seperti glutation, asam glukoronat, glisin, dan asetat. Hati juga berfungsi sebagai organ pertahanan tubuh, yaitu dengan adanya sel Kupffer yang mempunyai kemampuan fagositosis sel-sel tua, partikel atau benda asing, sel tumor, bakteri, virus, dan parasit di dalam hati. Hati memiliki kapasitas cadangan yang besar, yaitu hanya dengan 10% - 20% jaringan hati yang masih berfungsi ternyata sudah cukup untuk
mempertahankan hidup pemiliknya.
Kemampuan regenerasi jaringan yang mati cukup besar sehingga akan cepat digantikan dengan yang baru (Dalimartha 2005).
Hati merupakan organ yang paling sering mengalami kerusakan. Ada dua alasan mengapa hati mudah terkena racun dan kemudian mengalami kerusakan. Alasan pertama, hati menerima lebih dari 80% suplai darah dari vena porta. Vena tersebut membawa zat-zat toksik dari tumbuhan, fungi, bakteri, logam mineral, dan zat-zat kimia lain
yang diserap di usus ke darah portal untuk ditransportasikan ke hati. Kedua, hati menghasilkan enzim-enzim biotransformasi untuk berbagai macam zat eksogen dan endogen untuk dieliminasi di dalam tubuh. Proses ini mungkin juga mengaktifkan beberapa zat menjadi bentuk lebih toksik dan dapat menyebabkan terjadinya perlukaan hati seperti karbon tetraklorida (Jeon 2003).
Sel hati memiliki bentuk ultrastruktur yang mencerminkan bahwa sel terlibat dalam berbagai fungsi metabolik yang luas. Sel ini mengandung berbagai enzim, yang meliputi enzim alanin aminotransferase (ALT), enzim aspartat aminotransferase (AST), alkalin fospatase (ALP), gamaglutamil transpeptidase (GGT), laktat dehidrogenase, dan 5-nukleotidase, bilirubin, lipid, lipid peroksida. Enzim adalah protein yang dihasilkan oleh sel hidup dan umumnya terdapat di dalam sel.
Dalam keadaan normal terdapat
keseimbangan antara pembentukan dan penguraian enzim. Beberapa diantara enzim tersebut dapat dijadikan sebagai parameter kerusakan hati (Ganong 2002). Apabila terjadi kerusakan sel atau peningkatan permeabilitas membran sel, enzim akan banyak keluar ke ruang ekstra sel dan ke dalam aliran darah sehingga dapat digunakan sebagai sarana untuk membantu diagnostik penyakit tertentu. Pemeriksaan enzim yang biasa dilakukan untuk diagnosis kerusakan hati adalah ALT dan AST (Ratnaningsih 2003).
Enzim ALT dan AST merupakan enzim intraseluler yang berfungsi untuk mengatalisis pemindahan gugus amino dari alfa amino ke asam alfa keto. Enzim AST merupakan enzim mitokondria yang berfungsi mengatalisis pemindahan bolak-balik gugus amino dari asam aspartat ke asam α-oksaloasetat membentuk asam glutamat dan oksaloasetat. Enzim ini tidak spesifik untuk disfungsi hati karena enzim ini juga banyak ditemukan pada otot rangka, pankreas, jantung dan ginjal. Kadar enzim AST akan meningkat apabila terjadi kerusakan sel yang akut seperti nekrosis hepatoseluler dan infark kardium. Jumlah AST meningkat secara nyata dalam gangguan fungsi hati dan saluran empedu, penyakit jantung dan pembuluh darah, serta gangguan fungsi ginjal dan pankreas. Sedangkan ALT merupakan enzim yang terdapat pada sitosol hati dan terlibat dalam glukoneogenesis, meningkatnya kadar enzim ALT dalam darah terutama disebabkan oleh kerusakan sel hati dan sel otot rangka. Kerusakan diawali dengan perubahan permeabilitas membran yang diikuti dengan
kematian sel. Enzim ini berperan dalam mengkatalisis pemindahan gugus amino dari alanin ke asam α-ketoglutarat membentuk asam glutamat dan asam piruvat (Kaplan & Pesce 1998). Menurut Stockham & Scoot (2008), enzim ALT merupakan indikator terbaik dalam melihat kerusakan hati. Pada gangguan sel hati yang ringan maka enzim sitoplasma akan merembes ke dalam serum terutama enzim ALT. Oleh karena itu, kadar enzim ALT bersifat khas dan spesifik terhadap kerusakan sel hati sehingga sangat cocok sebagai tes untuk menentukan adanya gangguan fungsi hati walaupun dalam derajat ringan. Pada manusia, nilai normal kadar enzim ALT berkisar antara 5 hingga 25 U/L, dan AST antara 5 hingga 35 U/L (Baron 1992). Sedangkan pada tikus, nilai normal kadar enzim ALT berkisar antara 19,3 hingga 68,9 U/L dan AST antara 29,8 hingga 77,0 U/L (Pillchos et al. 2004 di dalam Windyagiri 2006).
Bahan-bahan toksik dapat menyebabkan berbagai jenis kerusakan hati, diantaranya degenerasi, perlemakan hati, nekrosis hati, dan sirosis. Degenerasi suram, berbutir, albuminoid atau parenkim sering terlihat pada kejadian keracunan dan bersifat reversibel. Ciri-ciri sel hati yang mengalami degenersi adalah hati membesar, tepinya membulat, konsistensinya rapuh, sedangkan bidang sayatannya berwarna belang atau beraspek seperti telah dimasak. Perlemakan hati terjadi bila hati mengandung berat lipid lebih dari 5%. Beberapa hal yang dapat menyebabkan perlemakan patologis hati adalah hipoksemi karena hati tidak dapat membakar lemak, atau karena adanya toksin yang mengakibatkan penurunan fungsi lipolitik hati dan terjadi penimbunan lipid intrasel sehingga sitoplasma tampak bervakuola (Ressang 1984).
Nekrosis hati adalah kematian sel hati. Nekrosis dapat bersifat fokal (sentral, pertengahan, dan perifer) atau masif. Pada umumnya nekrosis toksopatik hanya
memerlukan waktu singkat untuk
menimbulkan gejala klinis. Biasanya secara hispatologi terlihat nekrosis setempat, teratur dan tersebar di seluruh hati, akan tetapi bila racun sangat kuat maka akan terlihat gambaran nekrosis terpencar. Sirosis hati adalah suatu keadaan yang menggambarkan pangerasan hati. Sirosis dapat disebabkan oleh berbagai hal tetapi penyebabnya belum diketahui secara pasti. Pada umumnya bahan-bahan toksik dan parasit dapat menyebabkan sirosis hati (Ressang 1984; Price 1995).
BAHAN DAN METODE
Bahan dan Alat
Hewan percobaan yang digunakan dalam penelitian ini adalah tikus putih jantan strain Sprague Dawley sebanyak 25 ekor dengan kondisi sehat, memiliki aktivitas normal, dan berumur 2 bulan dengan bobot badan berkisar antara 200-250 gram, yang diperoleh dari Pusat Studi Biofarmaka (PSB) Bogor. Daun kari (Murraya koenigii) yang digunakan diperoleh dari koleksi Balai Penelitian Tanaman Tropis (BALITRO) Bogor.
Bahan-bahan yang digunakan dalam penelitian ini adalah serbuk daun kari ukuran 40 mesh, parasetamol, kloroform, etanol absolut (Merck), NaCl 0,9%, NaOH, FeCl3,
xilol, parafin, LiCl, akuades, kit reagen ALT dan AST (Labkit), metanol 30%, etanol 30%, 70%, 80%, 90%, 96%, pewarna Meyer’s Haemotoxylin, eosin, dan Curliv-plus® (obat hepatitis komersil) dan beberapa pereaksi fitokimia yang meliputi pereaksi Dragendorf, Meyer, Wagner, serta campuran asam asetat anhidrida dan H2SO4 pekat sebagai pereaksi
metode Lieberman Buchard.
Alat-alat yang digunakan dalam penelitian ini adalah alat-alat gelas, kertas saring biasa dan whatman No. I, aluminium foil, oven, mortar, shaker orbital, vacum rotavavor, penangas air, neraca analitik, freeze dry, spektrofotometer (BioSystem BTS-330), mikroskop, dan sentrifus klinis. Peralatan lainnya adalah corong pisah, pipet tetes, pipet Mohr, pipet mikro, batang pengaduk, cawan, mikrotom, syiring, gunting bedah, sonde oral, vial, Tissue Tec, dan pH meter.
Metode Penelitian Preparasi Sampel
Daun kari (Murraya koenigii) dikeringkan dibawah sinar matahari secara langsung dan menggunakan oven pada suhu 40-50°C. Setelah daun benar-benar kering, kemudian dilakukan penggilingan dengan menggunakan mesin Discmill hingga terbentuk serbuk berukuran 40 mesh.
Ekstraksi Daun Kari (Murraya koenigii) (Ningappa 2008)
Ekstraksi daun kari dilakukan dengan mengacu pada metode Ningappa (2008) dengan sedikit modifikasi. Sebanyak 300 gram daun kari yang sudah berbentuk serbuk dimaserasi dengan cara direndam ke dalam 800 mL etanol:air (1:1 v/v) pada suhu kamar
selama sehari-semalam. Larutan tersebut diletakkan pada shaker orbital dengan kecepatan 250 rpm. Hal ini bertujuan mempercepat proses ekstraksi. Proses ekstraksi dilakukan berulang-ulang sampai filtrat yang dihasilkan jernih. Larutan hasil maserasi dipisahkan melalui penyaringan vacum dengan menggunakan kertas saring biasa kemudian disaring kembali dengan kertas saring Whatman No. I. Filtrat hasil penyaringan kemudian dipekatkan dengan menggunakan vacuum rotavavor pada suhu 50oC. Ekstrak yang diperoleh ditempatkan di dalam botol tertutup dan disimpan di dalam lemari es dengan suhu 4-8oC.
Analisis Fitokimia (Harbone 1987)
Uji Alkaloid. Ekstrak daun kari sebanyak
1 gram ditambahkan 10 mL kloroform dan beberapa tetes NH4OH. Fraksi kloroform
dipisahkan dan diasamkan dengan H2SO4.
Fraksi H2SO4 dimasukkan ke dalam 3 buah
tabung reaksi, lalu ditambahkan pereaksi Dragendorf pada tabung pertama, pereaksi Meyer pada tabung kedua, dan pereaksi Wagner pada tabung ketiga. Terdapatnya alkaloid ditunjukkan dengan terbentuknya endapan putih oleh pereaksi Meyer, endapan merah oleh pereaksi Dragendorf, dan endapan coklat oleh pereaksi Wagner.
Uji Saponin. Ekstrak daun kari sebanyak
1 gram ditambahkan air secukupnya dan dipanaskan selama 5 menit. Larutan tersebut didinginkan kemudian dikocok. Timbulnya busa sampai selang waktu 10 menit menunjukkan adanya saponin.
Uji Flavonoid dan Senyawa Fenolik.
Ekstrak daun kari sebanyak 1 gram ditambah metanol 30% sampai terendam lalu dipanaskan sekitar 5 menit. Filtratnya ditambah NaOH 10% (b/v) atau H2SO4 pekat.
Terbentuknya warna merah karena
penambahan NaOH menunjukkan adanya senyawa fenolik hidrokuinon sedangkan warna merah yang terbentuk akibat penambahan H2SO4 pekat menunjukkan
adanya senyawa flavonoid.
Uji Triterpenoid dan Steroid. Ekstrak
daun kari sebanyak 1 gram ditambah 10 mL eter. Lapisan eter yang terbentuk dipipet lalu diuapkan pada penangas air. Residu yang didapat kemudian ditambah pereaksi Lieberman Buchard (3 tetes asam asetat anhidrida dan 1 tetes H2SO4 pekat). Warna
merah atau ungu menunjukkan kandungan triterpenoid pada sampel sedangkan warna hijau menunjukkan adanya kandungan steroid.
Uji Tanin. Ekstrak daun kari sebanyak 1
gram ditambahkan 10 mL akuades kemudian dididihkan selama 5 menit. Larutan ini disaring dan filtratnya ditambah 5 tetes FeCl3
1% (b/v). Warna biru tua atau hitam kehijauan menunjukkan terdapatnya tanin.
Perlakuan Hewan Coba dan Rancangan Percobaan
Tikus dikelompokkan menjadi 5 kelompok dan masing-masing kelompok terdiri atas 5 ekor. Tikus dikandangkan secara individu beralaskan sekam dan diberi pakan standar sebanyak 20 g/ekor/hari dengan minum secara ad libitum. Sebelum percobaan dilakukan, tikus diaklimatisasi selama 14 hari untuk menyeragamkan cara hidup dan pola makan, menghindari risiko timbulnya stress, dan membiasakan diri dengan lingkungannya. Kemudian perlakuan pada hewan percobaan dilakukan selama 3 minggu. Bobot badan dan jumlah pakan yang digunakan diamati setiap hari.
Tikus kelompok I merupakan kelompok kontrol normal (N) yang selama penelitian hanya diberi pakan standar dan dicekok akuades. Kelompok II adalah kelompok hepatotoksik/kontrol negatif (KN) yang dicekok parasetamol dengan dosis 500 mg/kg BB. Kelompok III merupakan kelompok pembanding/kontrol positif (KP) yang dicekok menggunakan Curliv-plus® (obat hepatoprotektor komersil) dengan dosis 42,86 mg/kg BB. Sedangkan kedua kelompok lainnya merupakan kelompok perlakuan. Kelompok IV dicekok dengan ekstrak daun kari dengan dosis 200 mg/kg BB dan kelompok V dicekok dengan ekstrak daun kari dengan 300 mg/kg BB. Perlakuan pada semua kelompok percobaan dilakukan selama 3 minggu dan induksi parasetamol dosis 500 mg/kg BB pada kelompok III, IV, dan V dilakukan pada minggu ke-2. Hal ini bertujuan untuk mengkondisikan stres oksidatif pada tikus. Pengambilan darah pada kelima kelompok dilakukan melalui pembuluh darah vena ekor (ujung ekor dipotong) sebanyak empat kali, yaitu pada hari ke-0,-7,-14 dan -21 untuk pengukuran kadar enzim ALT dan AST serum darah. Sebelum pengambilan darah, tikus dipuasakan selama 16-18 jam. Selanjutnya tikus dikorbankan dengan cara dibius dengan eter yang kemudian dilakukan nekropsi untuk pengujian histopatologi hati. Perhitungan dosis pemberian parasetamol, curliv-plus®, dan ekstrak daun kari dapat dilihat pada Lampiran 4, dan rancangan percobaan dapat dilihat pada Lampiran 2.
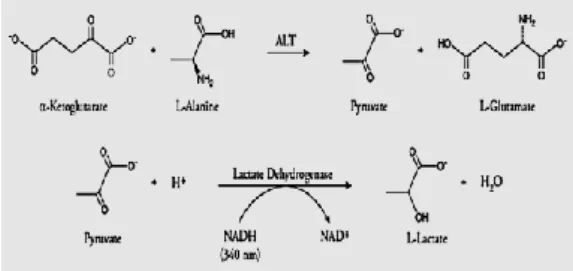
Pengukuran Kadar ALT dan AST
Metode analisis ALT dan AST mengacu pada International Federation of Clinical Chemistry (IFCC) (2002). Prinsip pengukuran aktivitas ALT dan AST adalah mengukur laju berkurangnya jumlah NADH menjadi NAD+ pada reaksi yang terjadi antara enzim dan substrat yang dapat diukur pada panjang gelombang 340 nm. Contoh mekanisme reaksi yang terjadi dapat dilihat pada Gambar 3. Sampel darah tikus disentrifugasi pada kecepatan 3000 rpm selama 15 menit untuk mendapatkan serumnya. Setelah itu, dilakukan analisis kadar ALT dan AST. Sebanyak 100 µL serum darah tikus dicampur dengan 1000 µL reagen, kemudian diukur serapannya dengan menggunakan spektrofotometer BioSystem BTS-330 pada panjang gelombang 340 nm (Lampiran 3).
Pengukuran aktivitas kedua enzim tersebut dilakukan dengan cara yang sama, hanya saja reagen yang digunakan berbeda. Reagen yang
digunakan dalam pengukuran AST
mengandung buffer tris, L-aspartat, α-ketoglutarat, laktat dehidrogenase, malat dehidrogenase, dan NADH. Sedangkan pereaksi yang digunakan dalam pengukuran ALT mengandung buffer tris, L-alanin, α-ketoglutarat, laktat dehidrogenase, dan NADH.
Gambar 3 Mekanisme reaksi pada pengukuran aktivitas ALT
Pembuatan Preparat Histopatologi Hati
Metode yang digunakan adalah metode Jusuf (2009) yang terdiri atas 4 tahap, yaitu fiksasi, dehidrasi, pencetakan (embedding), dan pewarnaan (staining). Tahap fiksasi dilakukan dengan memotong organ hati dengan ukuran 2x2x1 cm, dimasukkkan ke dalam buffer neutral formalin (BNF) 10% selama 3x24 jam, kemudian dipotong lagi dengan ukuran lebih tipis. Potongan-potongan hati tersebut dilanjutkan ke tahap dehidrasi, yaitu dengan perendaman menggunakan etanol bertingkat (etanol 70%, 80%, 96%, absolut I, absolut 2). Kemudian etanol dihilangkan dengan xilol I dan II masing-masing selama 40 menit. Infiltrasi
menggunakan parafin cair dilakukan pada suhu 60oC selama 4 kali masing-masing selama 30 menit. Sebelum pencetakan cetakan dicuci dengan campuran etanol 96%, xilol, dan air.
Pencetakan dilakukan dengan penuangan parafin panas dalam blok cetakan sebanyak setengah cetakan dengan alat Tissue Tec. Potongan hati dimasukkan secara perlahan-lahan agar tidak menyentuh dasar cetakan lalu ditutup lagi dengan parafin cair. Setelah beku, organ dalam parafin tersebut dipotong dengan alat mikrotom setebal 4 - 5 μm. Potongan yang diperoleh dimasukkkan ke dalam air hangat (40oC) untuk melelehkan parafin, kemudian diletakkan dalam kaca objek. Potongan tadi dikeringkan dalam oven inkubator bersuhu 56oC selama satu malam.
Tahap pewarnaan Haematoxylin Eosin (HE) dilakukan setelah diparafinisasi, yaitu preparat direndam menggunakan xilol I dan xilol II masing-masing selama 2 menit, rehidrasi dengan etanol absolut selama 2 menit, kemudian dengan etanol 96% dan 80% masing-masing selama 1 menit, dan dicuci dengan air mengalir. Kemudian preparat direndam dalam pewarnaan Mayer’s Haemotoxylin selama 8 menit, dicuci dengan air mengalir, dimasukkan ke dalam LiCl selama 30 detik, dan dicuci lagi dengan air mengalir. Kemudian irisan preparat diberi pewarna eosin selama 2-3 menit, lalu dicuci. Setelah itu, irisan hati dicelupkan dalam etanol 96% dan absolut I masing-masing sebanyak 10 kali dan diteruskan dengan etanol absolut II selama 2 menit, xilol I selama 1 menit dan xilol II selama 2 menit. Setelah diangin-anginkan beberapa saat, preparat yang telah diwarnai tersebut kemudian diberi permounting medium dan ditutup dengan kaca penutup. Setelah terbentuk sediaan histologi, kemudian dilakukan pengamatan terhadap perubahan yang terjadi pada sel-sel hati dengan menggunakan mikroskop cahaya.
Pengamatan Histopatologi Hati (Kiernan 1990)
Pengamatan kerusakan sel hepatosit yang meliputi nekrosis, degenerasi butir, degenerasi lemak, oedema sirosis, dan pendarahan dilakukan dengan cara pemberian skoring lesio organ hati, yaitu sebagai berikut:
0: normal (tidak ada perubahan spesifik) 1: kerusakan ≤ 25% dari daerah pandang 2: kerusakan 25-50% dari daerah pandang 3: kerusakan 50-75% dari daerah pandang 4: kerusakan 75-100% dari daerah pandang
Analisis Data (Gaspersz 1994)
Pengamatan terhadap kadar enzim ALT dan AST dilakukan dengan menggunakan Rancangan Acak Lengkap (RAL), yaitu uji analysis of Varian (ANOVA) pada tingkat kepercayaan 95% dan taraf α=0.05. Sedangkan pengamatan histopatologi jaringan hati dilakukan dengan menggunakan cara skoring lesio, selanjutnya data dievaluasi dengan menggunakan analisis statistik nonparametrik Kruskal-Wallis yang dilanjutkan dengan uji Duncan. Seluruh data tersebut dianalisis menggunakan program perangkat lunak statistical analysis system (SAS). Model RAL adalah sebagai berikut:
Y
ij= µ + τ
i+ ε
ij.
Keterangan:µ = Pengaruh rataan umum
τi = Pengaruh perlakuan ke-i, i = 1, 2, 3, 4, 5
εij = Pengaruh galat perlakuan ke-i dan
ulang-an ke-j, j = 1, 2, 3, 4
Yij = Pengamatan perlakuan ke-i dan ulangan
ke-j
i = 1 adalah perlakuan pemberian pakan standar dan cekok akuades
i = 2 adalah perlakuan pemberian pakan standar, akuades, dan parasetamol dosis 500 mg/Kg BB
i = 3 adalah perlakuan pemberian pakan standar, akuades, parasetamol, dan Curliv-plus® dosis 42,86 mg/Kg BB i = 4 adalah perlakuan pemberian pakan
standar, akuades, parasetamol, dan ekstrak daun kari dosis 200 mg/Kg BB i = 5 adalah perlakuan pemberian pakan
standar, akuades, parasetamol, dan ekstrak daun kari dosis 300 mg/Kg BB
HASIL DAN PEMBAHASAN
Ekstraksi dan Penapisan Fitokimia
Rendemen ekstrak etanol:air (1:1) daun kari yang didapat setelah dipekatkan dengan menggunakan vacuum rotavavor adalah 19,2%. Nilai tersebut lebih besar jika dibandingkan dengan hasil penelitian yang telah dilakukan oleh Ningappa et al. (2008) yaitu sebesar 12%. Hal ini disebabkan oleh modifikasi metode maserasi yang dilakukan yang meliputi lama ekstraksi, jumlah pelarut yang digunakan, dan cara ekstraksi yang dilakukan, yaitu dilakukan secara bertingkat dan dengan bantuan shaker orbital dengan
Tabel 1 Uji fitokimia ekstrak etanol:air (1:1) daun kari (Murraya koenigii)
Uji Hasil Alkaloid +++ Flavonoid - Fenolik - Saponin ++++ Steroid +++ Tanin ++++ Triterpenoid - Keterangan :
Tanda (-) : Tidak terdeteksi Tanda (+) : Adanya intensitas reaksi Alkaloid : Sedikit endapan (+) sampai banyak endapan (++++) Flavonoid : Merah (+) sampai merah tua (++++)
Fenolik : Merah (+) sampai merah tua (++++)
Saponin : Sedikit busa (+) sampai busa melebihi larutan (++++) Steroid : Hijau muda (+) sampai hijau tua (++++)
Tanin : Hijau (+) sampai hijau kehitaman (++++)
Triterpenoid : Merah (+) sampai merah tua (++++)
kecepatan putar 250 rpm sehingga proses ekstraksi berlangsung optimal dan ekstrak yang didapat menjadi lebih banyak. Sedangkan proses ekstraksi oleh Ningappa hanya dilakukan melalui satu tahap ekstraksi.
Tabel 1 menunjukkan hasil uji fitokimia ekstrak etanol:air (1:1) daun kari. Berdasarkan hasil hasil tersebut, ekstrak etanol:air (1:1) daun kari menunjukkan adanya kandungan alkaloid, Saponin, steroid, dan tanin. Hal ini sesuai dengan beberapa hasil penelitian terdahulu yang dilakukan oleh Kong et al. (1986); Tee & Lim (1991); Ramsewak et al. (1999); Tachibana et al. (2001); Nakahara et al. (2002); dan Palaniswamy (2003). Berdasarkan uji secara in vitro yang dilakukan oleh Ningappa et al. (2008), menyatakan bahwa ekstrak etanol:air (1:1) daun kari mengandung senyawa antioksidan yang merupakan golongan senyawa polifenol.
Menurut Winarti & Nurdjanah (2005),
Senyawa fitokimia merupakan senyawa kimia yang terkandung dalam tanaman dan memiliki peranan yang sangat penting bagi kesehatan dan pencegahan terhadap beberapa penyakit degeneratif. Beberapa senyawa fitokimia yang bersifat antioksidan aktif diketahui memiliki fungsi fisiologis adalah karotenoid, fitosterol, saponin, glikosinolat, polifenol, inhibitor protease, monoterpen, fitoestrogen, sulfida,
dan asam fitat. Senyawa-senyawa tersebut banyak terkandung dalam sayuran, tanaman
rempah dan tanaman obat. Menurut Craig
(1999), diet yang menggunakan
rempah-rempah dalam jumlah banyak sebagai
penyedap makanan dapat menyediakan
berbagai komponen aktif fitokimia yang
bermanfaat menjaga kesehatan dan
melindungi tubuh dari penyakit kronis.
Keadaan Hewan Coba Selama Perlakuan
Selama perlakuan secara in vivo, salah satu syarat pada perlakuan hewan coba adalah kondisi hewan harus dalam keadaan sehat. Beberapa parameter yang mudah diamati untuk mengetahui kesehatan hewan coba adalah dengan mengamati peningkatan bobot badan dan konsumsi pakan (Lu 2006). Kondisi tikus yang sehat ini menjadi faktor yang penting karena dapat memperkecil nilai galat percobaan yang terukur ketika memasuki tahap percobaan.
Gambar 4 menunjukkan grafik bobot badan (BB) hewan coba selama perlakuan. Pada gambar terlihat jelas bahwa kelompok normal terjadi peningkatan BB tikus yang lebih besar dibandingkan dengan kelompok yang lain. Fluktuasi pada BB tikus yang terjadi disebabkan oleh nafsu makan yang berbeda-beda antar satu tikus dengan tikus yang lain. Disamping itu, hal ini disebabkan oleh tikus dipuasakan selama 24 jam sebelum pengambilan darah sehingga terjadi penurunan BB yang cukup drastis. Kelompok KN menunjukkan peningkatan BB terendah jika dibandingkan dengan kelompok yang lain. Hal ini disebabkan oleh salah satu efek pemberian parasetamol yang dapat menurunkan nafsu makan. Menurut Gan (1980), toksisitas parasetamol dapat menimbulkan gejala-gejala anoreksia, mual, muntah, serta sakit perut yang terjadi dalam 24 jam pertama, dan dapat berlangsung terus menerus selama seminggu atau lebih. Gejala-gejala inilah yang menyebabkan menurunnya nafsu makan yang berpengaruh terhadap BB hewan coba.
Secara keseluruhan, pada semua kelompok terjadi peningkatan BB hewan coba (Tabel 2). Peningkatan ini disebabkan oleh kondisi tikus yang masih berada dalam tahap pertumbuhan (<6 bulan). Peningkatan BB yang paling tinggi ditunjukkan oleh kelompok Normal, yaitu 18,88%. Sedangkan peningkatan terendah ditunjukkan oleh kelompok KN, yaitu 7,97%. Sedangkan pada kelompok KP dan kelompok perlakuan dosis 200 dan dosis 300 terjadi peningkatan bobot tikus secara
berturut-turut yaitu sebesar 13,42%, 11.81%, dan 12,31%.
Gambar 4 Bobot badan hewan coba selama perlakuan
Tabel 2 Peningkatan bobot badan hewan coba selama perlakuan
Kelompok Bobot (g) Peningkatan
(%) awal akhir Normal 232,0 275,8 18,88 KN 238,4 257,4 7,97 KP 228,0 258,6 13,42 ED 200 230,4 257,6 11,81 ED 300 234,0 262,8 12,31
Keadaan Hewan Coba Sebelum Perlakuan
Pada hari ke-0 (setelah tikus diadaptasikan/aklimatisasi selama 14 hari), dilakukan analisis serum pada kelima kelompok perlakuan. Hal ini dilakukan untuk mengetahui keadaan normal aktivitas enzim ALT dan AST sebelum perlakuan yang kemudian akan dijadikan keadaan populasi normal. Aktivitas enzim dinyatakan dalam satuan U/L yang berarti bahwa satu unit aktivitas enzim transaminase setara dengan 1 µmol piruvat dan oksaloasetat yang dihasilkan per menit pada kondisis perlakuan. Hasil uji aktivitas enzim ALT dan AST pada hari ke-0 menunjukkan hasil yang seragam dengan rataan aktivitas enzim ALT sebesar 1,96 ± 0,82 U/L dan rataan aktivitas enzim AST sebesar 1,84 ± 0,33 U/L (Tabel 3). Nilai tersebut berada pada kisaran yang sangat rendah. Hal ini sesuai dengan hasil penelitian terdahulu yang dilakukan oleh Cabaud (1956), yang menyatakan bahwa aktivitas normal enzim ALT berada pada kisaran 1 – 45 U/L dan aktivitas normal enzim AST berada pada kisaran 4 – 40 U/L. Hal ini menunjukkan bahwa pada hari ke-0 tikus pada semua kelompok percobaan berada pada kisaran normal sehingga dapat disimpulkan bahwa semua tikus dalam kondisi sehat dan tidak terjadi kerusakan pada organ hati.
Aktivitas enzim ALT dan AST tersebut, jika dibandingkan dengan hasil penelitian yang dilakukan Adji (2004) dan Marliana (2005) menunjukkan hasil yang jauh berbeda. Adji (2004) melaporkan bahwa aktivitas enzim ALT dan AST pada tikus Sprague Dawley sebelum masa percobaan berkisar antara 18,29 – 29,23 U/L dan 32,0 – 67,01 U/L. Sedangkan Marliana (2005) menyatakan bahwa sebelum masa percobaan, kadar enzim ALT dan AST pada tikus Sprague Dawley adalah sebesar 16,29 – 28,55 U/L dan 39,23 – 71,53 U/L. Perbedaan hasil analisis tersebut mungkin disebabkan oleh beberapa faktor, diantaranya adalah faktor stres yang dapat terjadi melalui peningkatan aktivitas syaraf simpatik perifer (Arakawa et al. 1966), perbedaan bobot tikus, hemolisis, keadaan fisiologis dan makroenzim yang berbeda, alat dan metode analisis yang digunakan, bahkan perbedaan kit reagen yang digunakan juga dapat mempengaruhi hasil analisis (Hollans & Logan 1966).
Tabel 3 Aktivitas enzim ALT dan AST serum darah tikus pada hari ke-0
Kelompok ALT (U/L) AST (U/L)
Normal 2,2 ± 1,10 2,0 ± 0,71 KN 2,8 ± 0,84 2,2 ± 1,10 KP 2,6 ± 0,55 2,0 ± 0,71 ED 200 1,2 ± 0,45 1,6 ± 0,55 ED 300 1,0 ± 0,00 1,4 ± 0,55 Rerata 1,96 ± 0,82 1,84 ± 0,33 n = 25
Aktivitas Enzim Transaminase
Daya hepatotoksik parasetamol terhadap hati dapat dikaji dari aktivitas enzim ALT dan AST serum darah setelah pemberian dosis toksik. Kerusakan hati dapat menyebabkan produk sekresinya seperti enzim ALT dan AST bebas keluar sel dan masuk ke pembuluh darah sehingga kadar ALT dan AST dalam darah menjadi meningkat bahkan melebihi batas normal. Pada keadaan kronis, aktivitas enzim ALT dan AST dalam darah dapat mengalami peningkatan sebanyak 1-5 kali lebih tinggi bila dibandingkan dengan keadaan normal, bahkan menurut Akbar (1995), peningkatan kadar ALT dan AST dapat mencapai 5 hingga 10 kali lebih tinggi dibandingkan dengan keadaan normal.
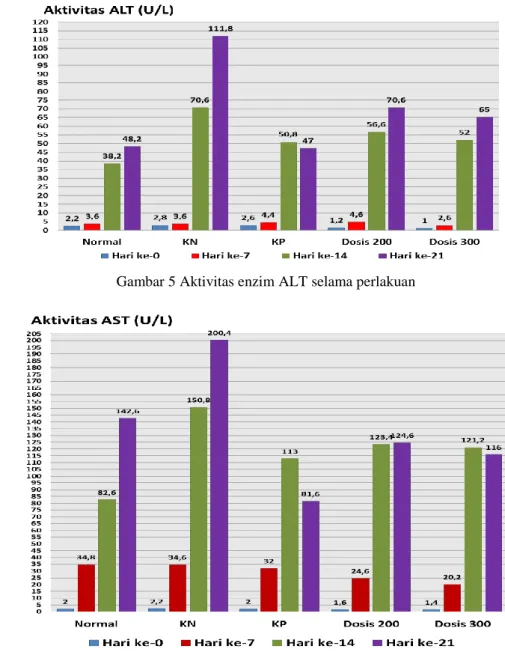
Gambar 5 dan Gambar 6 menunjukkan hasil analisis aktivitas enzim ALT dan AST serum darah tikus selama perlakuan. Aktivitas enzim ALT pada kelompok normal selama perlakuan dari hari ke-0 hingga hari ke-21
Gambar 6 Aktivitas enzim AST selama perlakuan berkisar antara 2,2 – 48,2 U/L. Sedangkan
aktivitas enzim AST berkisar antara 2,0 – 142,6 U/L. Berdasarkan Pillichos et al. (2004), nilai aktivitas enzim ALT dan AST normal pada tikus berkisar antara 19,3 – 68,9 U/L dan 29,8 – 77,0 U/L. Nilai aktivitas enzim ALT yang diperoleh ini dapat dikatakan berada pada ambang batas normal. Namun, pada aktivitas enzim AST menunjukkan hasil yang jauh berbeda dan lebih tinggi. Hal ini disebabkan oleh keberadaan AST yang tidak hanya dijumpai pada sitosol hati, tetapi juga dijumpai pada otot rangka, pankreas, jantung dan ginjal. Selain itu, hal ini juga disebabkan oleh darah tikus yang mengalami hemolisis yang dapat dilihat dari warna serum darah yang agak kemerahan sehingga menyebabkan aktivitas
enzim AST menjadi lebih tinggi. Hollands & Logan (1966), menyatakan bahwa fenomena hemolisis pada serum darah dapat menyebabkan peningkatan aktivitas enzim AST secara signifikan namun tidak berpengaruh terhadap aktivitas enzim ALT. Menurut Adji (2004), fenomena hemolisis dapat disebabkan oleh mekanisme biokimia, fisik maupun kimia. Oleh karena itu, aktivitas enzim ALT bersifat khas dan spesifik terhadap kerusakan sel hati sehingga merupakan indikator terbaik dalam melihat dan menentukan adanya gangguan fungsi hati walaupun dalam derajat ringan (Stockham & Scoot 2002).
Pada kelompok KP dan kelompok perlakuan, obat curliv sebagai pembanding dan ekstrak daun kari diberikan selama 7 hari