INFEKSI PARASIT DARAH PADA SAPI PERAH DI
KAWASAN USAHA TERNAK (KUNAK) CIBUNGBULANG,
KABUPATEN BOGOR
MURSALIM KALMAN
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
BOGOR 2017
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini Saya menyatakan bahwa skripsi berjudul Infeksi Parasit Darah pada Sapi Perah di Kawasan Usaha Ternak (KUNAK) Cibungbulang, Kabupaten Bogor adalah benar karya Saya dengan arahan dari Komisi Pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari Penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini Saya melimpahkan hak cipta dari skripsi Saya kepada Institut Pertanian Bogor.
Bogor, Februari 2017 Mursalim Kalman NIM B04120213
ABSTRAK
MURSALIM KALMAN. Infeksi Parasit Darah pada Sapi Perah di Kawasan Usaha Ternak (KUNAK) Cibungbulang, Kabupaten Bogor. Dibimbing oleh UMI CAHYANINGSIH dan ELOK BUDI RETNANI.
Kasus penyakit yang disebabkan oleh parasit darah umumnya bersifat kronis, namun pada beberapa kasus ada yang bersifat akut. Kerugian ekonomi yang disebabkan oleh penyakit parasit darah dapat berupa pertumbuhan terhambat, penurunan bobot badan, penurunan daya reproduksi, penurunan produksi susu, dan abortus. Penelitian ini bertujuan untuk mengetahui keberadaan parasit darah dan tingkat parasitemia pada sapi perah di kawasan usaha ternak (KUNAK) Cibungbulang, Kabupaten Bogor. Terdapat 100 sampel darah sapi perah dalam penelitian ini yang terdiri dari 21 sampel dari kelompokm umur ≤ 2 tahun dan 79 sampel dari kelompok umur >2 tahun. Variabel yang diamati adalah presentase hewan yang terinfeksi dan tingkat infeksi dengan mengetahui persentase parasitemia. Hasil penelitian dari 100 sampel ditemukan 69 ekor yang terinfeksi (69%). Ada 3 jenis parasit darah yang ditemukan dalam penelitian ini yaitu Babesia sp., Anaplasma sp. dan Theileria sp.. Persentase hewan terinfeksi parasit tertinggi yaitu Theileria sp. (50%), kemudian Anaplasma sp. (15%) dan terendah Babesia sp. (4%).Persentase parasitemia pada berbagai tingkat umur memiliki nilai sama yaitu kurang dari 1%, yang tergolong dalam tingkat parasitemia rendah. Kata kunci: parasit darah, tingkat infeksi, persentase parasitemia
ABSTRACT
MURSALIM KALMAN. Infection of Blood Parasites on Dairy Catle in Kawasan Usaha Ternak (KUNAK) Cibungbulang, Bogor. Supervised by UMI CAHYANINGSIH and ELOK BUDI RETNANI.
Cases of disease caused by blood parasites were generally chronic but in some cases there is also acute. The economic loses caused by blood parasites disease may include stunted growth, weight loss, decreased reproduction, reduced of milk production, and abortion. This study aim determined the presence of blood parasites and parasitemia levels in dairy cattle in Cattle Trade Area Cibungbulang, Bogor. There are 100 blood samples from dairy cattle in this study that consisting of 21 samples fromthe group aged ≤ 2 years and 79 samples from the group aged >2 years. Variables observed were the persentage of infected animal and infection rate with the percentage of parasitaemia.The result are from 100 samples, 69 samples are infected (69%). There are 3 types of blood parasites found in this study namely Babesia sp., Anaplasma sp., and Theileria sp.. Highest infecetion rate was Theileria sp. (50%), then Anaplasma sp. (15%) and the lowest Babesia sp. (4%).The percentage of parasitaemia at various age levels have the same value that is <1%, which is classified as mild parasitaemia.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan
pada
Fakultas Kedokteran Hewan
INFEKSI PARASIT DARAH PADA SAPI PERAH DI
KAWASAN USAHA TERNAK (KUNAK) CIBUNGBULANG,
KABUPATEN BOGOR
MURSALIM KALMAN
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
BOGOR 2017
PRAKATA
Puji dan syukur Penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Oktober sampai Desember 2015, adalah Infeksi Parasit Darah pada Sapi Perah di Kawasan Usaha Ternak (KUNAK) Cibungbulang, Kabupaten Bogor.
Penulis mengucapkan terima kasih kepada Ibu Prof Dr Drh Umi Cahyaningsih, MS dan Ibu Dr Drh Elok Budi Retnani, MS selaku dosen pembimbing skripsi, Drh H. Abdul Zahid, MSi selaku dosen pembimbing akademik serta kepada Prof Dr Drh Tutik Wresdiyati, Dr Drh Eko Sugeng Pribadi, MS dan Dr Drh Aryani Sismin S, MSc Saya ucapkan terimakasih yang sedalam-dalamnya kerena telah besedia membantu Saya selama berada di fakultas ini. Terimakasih penulis ucapkan kepada Ibu Nani, Bapak Harisman serta rekan penelitian saya Rizal Arifin Akbari dan Muhammad Yahya. Ungkapan terima kasih yang tak terhingga penulis sampaikan kepada keluarga tercinta Ayahanda La Salifa, Ibunda Marsalina, dan seluruh keluarga atas doa, dukungan dan kasih sayangnya. Ucapan terimakasih juga penulis berikan kepada teman-teman mahasiswa dari Fakultas Kedokteran Hewan IPB terutama teman-teman yang terus memberikan semangat serta dukungan sampai dapat terselesaikannya skripsi ini.
Semoga skripsi ini bermanfaat bagi Pembaca.
Bogor, Februari 2017
DAFTAR ISI
ABSTRAK iii
DAFTAR TABEL xii
DAFTAR GAMBAR xii
PENDAHULUAN 1 Latar Belakang 1 Tujuan Penelitian 1 Manfaat Penelitian 2 TINJAUAN PUSTAKA 2 Babesia spp. 2 Anaplasma spp. 4 Theilleria spp. 6
Pencegahan dan Pengobatan 8
METODE PENELITIAN 8
Waktu dan Tempat Penelitian 8
Prosedur Penelitian 8
Prosedur Analisis Data 9
HASIL DAN PEMBAHASAN 10
Persentase Sapi Terinfeksi Parasit dan Tingkat Parasitemia 10 Persentase Sapi Terinfeksi Parasit Berdasarkan Umur 11
Rataan Parasitemia Berdasarkan Umur 11
SIMPULAN DAN SARAN 13
DAFTAR PUSTAKA 13
DAFTAR TABEL
1 Persentase infeksi parasit dan persentase parasitemia 10
2 Infeksi parasit berdasarkan umur 11
3 Persentase parasitemia berdasarkan umur 11
DAFTAR GAMBAR
1 Siklus hidup Babesia sp 3
2 Siklus hidup Anaplasma sp 5
3 Siklus hidup Theileria sp. 7
4 Pengambilan sampel darah pada v.jugularis dan v.coxigea 9 5 Infeksi parasit pada darah sapi A) Theleria sp., B) Anaplasma sp.
PENDAHULUAN
Latar Belakang
Sapi perah merupakan hewan memamah biak dengan susu sebagai produk utama dalam peternakan. Susu dan produk olahannya adalah bahan pangan bagi konsumsi manusia. Kebutuhan susu semakin meningkat seiring dengan perkembangan jumlah penduduk, tingkat pendapatan, dan kesadaran masyarakat. Oleh karena itu, populasi dan produktifitas sapi perah di Indonesia harus ditingkatkan. Salah satu masalah yang dihadapi peternak sapi perah di Indonesia adalah penyakit yang diakibatkan parasit darah.
Kasus penyakit yang disebabkan oleh parasit darah umumnya bersifat kronis, namun dapat juga bersifat akut dan menyebabkan kematian jika derajat infeksinya tinggi. Penyakit pada hewan diantaranya dengan pertumbuhan ternak yang terhambat, penurunan bobot badan, penurunan daya reproduksi (Nasution 2007), penurunan produksi susu, dan abortus (Kocan etal. 2003). Perhitungan kerugian ekonomi di Tanzania terkait tick borne disease mencapai US$ 364 juta/tahun dengan 68% kerugian disebabkan oleh theileriosis, 13% disebabkan oleh anaplasmosis dan babesiosis, dan sisanya oleh penyakit lain (Kivaria 2006).
Penyebaran parasit darah terjadi di seluruh dunia baik Amerika, Eropa, Afrika, Australia maupun Asia. Babesia sp. pertama kali dilaporkan di Amerika tahun 1969 (Cunha dan Barnet 2006). Babesia bigemina di Indonesia pertama kali ditemukan pada tahun 1896 pada kerbau di Tegal, Jawa Tengah namun spesies lain seperti Babesia divergens ditemukan tahun 1918 pada ternak yang diimpor dari Australia (Oka 2010). Theileria sp. pertama kali ditemukan tahun 1912 di pulau Jawa dan menurut DITJENAK (2012) Theileria sp. telah tersebar di Kalimantan Selatan, Sumatera Utara, Aceh dan kabupaten Bogor. Tahun 1912 Anaplasma spp. dilaporkan menyerang kerbau di daerah Cileungsi, Kabupaten Bogor. Anaplasma sp. juga pernah dilaporkan menyerang sapi di daerah Sumatera Utara, Bojonegoro dan Madiun (DITJENAK 2012). Indonesia sebagai negara tropis merupakan lingkungan yang baik bagi perkembangan parasit, sehingga parasit pada ternak merupakan kendala biologis yang sulit diatasi, terutama pada peternakan tradisional (Partoutomo 2004). Infeksi parasit darah dalam jumlah banyak jika tidak diobati dapat menyebabkan kematian sapi terutama pada usia muda.
Kawasan Usaha Peternakan (KUNAK) merupakan salah satu peternakan rakyat yang terletak di Kabupaten Bogor dengan jumlah populasi sapi perah sebanyak 1000 ekor. Kajian tentang infeksi parasit darah pada peternakan sapi perah di kawasan tersebut belum pernah dilakukan. Oleh karena itu, perlu dilakukan penelitian tentang adanya infeksi parasit darah pada ternak sapi perah di wilayah tersebut.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui adanya infeksi parasit darah dan derajat parasitemia pada sapi perah di Kawasan Usaha Ternak (KUNAK) Cibungbulang, Kabupaten Bogor.
2
Manfaat Penelitian
Dengan diketahuinya terdapat parasit darah di Kawasan Usaha Ternak (KUNAK) kajian faktor resiko parasit darah terhadap produktifitas ternak dapat dipelajari lebih lanjut.
TINJAUAN PUSTAKA
Babesia spp. Klasifikasi menurut Levine (1995)
Kingdom : Protozoa Filum : Apicomplexa Kelas : Sporozosida Ordo : Eucoccidiorida Subordo : Piroplasmorina Famili : Babesiidae Genus : Babesia
Babesia sp. adalah parasit darah yang dapat menyebabkan babesiosis. Klasifikasi parasit ini menurut Levine (1995), termaksuk dalam filum Apicomplexa, kelas Sporozosida dan famili Babesiidae. Parasit darah ini lebih sering menyerang sapi umur dewasa dibanding sapi umur muda. Hal tersebut dikarenakan sapi umur muda memiliki antibodi pasif dari induknya (kolostrum) (CFED 2008). Masa inkubasi Babesia sp. sangat singkat (1‒2 minggu) mengakibatkan jika sapi terinfeksi Babesia sp. sapi tersebut dapat sembuh dengan sendiri (Taylor et al. 2007).
Jenis Babesia sp.yang dapat menginfeksi sapi adalah B. bovis, B. bigemina, B. divergens, dan B. jakimovi (Ristic dan Kreier 1981). Babesia sp. dapat menyebabkan penyakit yang serius pada sapi, yaitu penyakit Cattle Tick Fever, Texas Fever, Red Water Fever, Piroplasmosis (Soulsby 1982). Babesia sp. yang biasanya menginfeksi sapi-sapi yang ada di Indonesia adalah Babesia bigemina dan Babesia bovis.
Morfologi
Babesia sp. memiliki bentuk seperti biji apel. Menurut Levine (1970), merozoit dalam eritrosit berbentuk bundar, atau tidak teratur. Pada Babesia bovis ditemukan bentuk ”cincin - signet” bervakuol, yang mempunyai merozoit-merozoit berukuran 1.5–2.4 μm dan terletak di bagian tengah eritrosit. Sedangakan Babesia bigemina dalam eritrosit berbentuk piriform, bulat, oval, atau tidak teratur. Merozoit yang berbentuk piriform ditemukan secara khas berpasang-pasangan dengan diameter 2–3 μm dan panjang 4–5 μm.
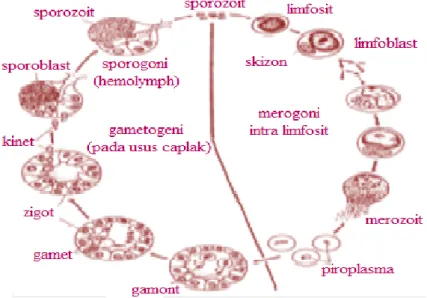
Siklus hidup
Siklus reproduksi Babesia terdiri atas siklus seksual dan aseksual (Gambar 1) .Siklus seksual terjadi di dalam tubuh caplak. Caplak menghisap darah inang terinfeksi, yang mengandung Babesia sp. dalam fase gametosit. Fase gametosit ini akan menghasilkan mikrogamet dan makrogamet yang akan bersatu
3
menjadi zigot dan kemudian zigot berkembang menjadi ookinet (Uilenberg 2006). Ookinet bermigrasi ke epitel saluran pencernaan, hemolimfe dan ovarium yang akan menyebabkan larva caplak positif terinfeksi Babesia sp. (transmisi transovarial) (Lubis 2006). Caplak juga mengalami transmisi transtadial, larva yang berkembang menjadi nimfa atau dewasa, secara otomatis pada setiap stadium caplak juga akan terinfeksi (Homer et al. 2000) dan berpotensi sebagai inang antara (Uilenberg 2006). Fase sporogoni terjadi ketika ookinet masuk ke dalam kelenjar ludah caplak, larva atau nimfa yang menyebabkan terjadinya hipertrofi sel kelenjar ludah dan perkembangan multinukleat sporoblast menjadi sporozoit. Sporozoit kemudian akan masuk ke dalam tubuh sapi bersamaan dengan gigitan caplak.
Gambar 1 Siklus hidup Babesia sp. (Levine 1992).
Keterangan Gambar : Sp : Sporozoit, Tr : Tropozoit, Mz : Merozoit, Gm : Gamet, Zg : Zigot, Ki : Kinet, Sb : Sporoblas.
Siklus aseksual terjadi di dalam tubuh sapi, tepatnya di dalam eritrosit.Sporozoit (fase infektif) masuk ke dalam eritrosit melalui saliva caplak terinfeksi yang menggigit sapi. Sporozoit akan berubah menjadi trophozoit yang mengalami pembelahan biner dan bertunas menjadi dua atau empat membentuk merozoit. Pembelahan menyebabkan terjadinya kerusakan pada eritrosit sehingga merozoit keluar dan mencari eritrosit baru (Homer et al. 2000). Siklus ini akan terus berlanjut sampai infeksi yang terjadi tidak terkontrol sehingga sapi mati. Ketika caplak menghisap darah inang yang mengandung parasit, sebagian merozoit akan rusak di dalam saluran pencernaan dan sebagian merozoit lain mengalami perubahan menjadi fase gametosit. Fase inilah yang akan berperan dalam reproduksi seksual.
Gejala klinis
Gejala klinis yang ditimbulkan akibat babesiosis bersifat akut yang dicirikan dengan anemia, ikterus, hemoglobinuria, splenomegali dan demam (Taylor et al. 2007). Penyakit ini sangat patogen pada sapi dewasa, sedangkan pada anak sapi
4
kurang dari satu tahun relatif lebih tahan. Gejala lain yang nampak pada sapi adalah bulu kusam, lesu, nafsu makan turun, ruminasi terhenti, kulit tipis dan ikterik.
Diagnosa
Diagnosa penegakan penyakit babesiosis dapat dilakukan dengan cara pemeriksaan mikroskopis melalui preparat ulas darah, Enzim Linked Immunosorbent Assay (ELISA) dan Polymerase Chains Reaction (PCR) (Rodriguez et al. 2013).
Penularan
Penularan parasit dilakukan oleh caplak Ixodidae seperti Boophilus microplus dan Boophilus annulatus yang mentransmisi B. bovis dan B. bigemina (Cantu et al. 2007). Parasit ini masuk ke dalam tubuh caplak pada saat caplak mengisap darah inang yang terinfeksi. Babesia sp. akan memperbanyak diri di dalam sel epitel saluran pencernaan, selanjutnya menyebar ke seluruh tubuh dan melakukan invasi ke indung telur. Babesia sp. akan berada di dalam telur caplak yang akan berkembang menjadi larva (transmisi transovarial) (Lubis 2006).
Anaplasma spp.
Klasifikasi menurut Levine (1995)
Kingdom : Bacteria Filum : Protobacteria Kelas : Alphaproteobacteria Ordo : Rickettsiales Famili : Anaplasmataceae Genus : Anaplasma Morfologi
Anaplasma sp. berukuran kecil dan berbentuk bulat seperti bola, berukuran 0.3-0.4 μm dan dapat menyebabkan anaplasmosis (Boone et al. 2001). Anaplasma sp. akan terlihat berwarna ungu dengan pewarnaan Giemsa, terletak di tepi atau di tengah eritrosit (Quinn et al. 2008). Anaplasma marginale bersifat patogen dan Anaplasma central bersifat non-patogen. Anaplasma sp. menyebabkan anemia, pyrexia, kelemahan, dan ikterus (Foley dan Biberstein 2004). Beberapa hewan yang dapat menjadi induk semang dari Anaplasma sp. yaitu sapi, kerbau, bison, unta, biri-biri, kambing (Astyawati 2005).
Siklus hidup
Tahapan infeksi anaplasmosis pada mamalia dibagi menjadi empat stadium yakni inkubasi, perkembangan, persembuhan dan karier. Stadium inkubasi dimulai ketika Anaplasma sp. mulai menginfeksi sel darah hingga 1% dari sel darah total (Kocan et al. 2010). Pada stadium inkubasi sel darah terlihat lisis tapi tidak menujukan gejala klinis.Stadium perkembangan mulai menunjukkan gejala klinis akibat manifestasi gangguan sel darah merah, PCV, dan hemoglobin yang menurun serta meningkatnya level parasitemia.
5
Stadium persembuhan dan karier akan dialami hewan terinfeksi jika dapat melewati stadium inkubasi dan perkembangan. Pada stadium persembuhan jumlah sel darah merah, PCV, dan hemoglobin kembali ke rentang normal, akan tetapi hewan tersebut bisa menjadi karier dan menjadi sumber anaplasmosis bagi hewan domestik sehat lainnya (Foley dan Bieberstein 2004). Masa inkubasi Anaplasma sp. terjadi (2‒12 minggu) yang merupakanmasa awal masuknya parasit hingga timbulnya gejala klinis (Quinn et al. 2008; Kocan et al. 2010).
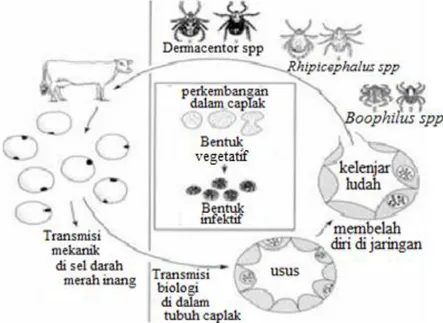
Sel darah merah yang terinfeksi Anaplasmasp. dihisap oleh caplak kemudian masuk ke sel-sel usus. Setelah Anaplasmasp. berkembang di sel-sel usus, banyak jaringan yang ikut terinfeksi termaksuk kelenjar saliva. Dua bentuk dari Anaplasma sp. yaitu bentuk vegetatif dan bentuk infektif. Kedua bentuk tersebut ditemukan di dalam tubuh caplak terinfeksi. Bentuk vegetatif muncul pertama kali dengan pembelahan biner. Bentuk infektif dapat bertahan hidup di luar sel. Sapi terinfeksi Anaplasma sp. ketika bentuk infektif yang ada dalam kelenjar saliva masuk ke dalam tubuh sapi melalui gigitan caplak (Kocan et al. 2004) (Gambar 2).
Gambar 2 Siklus hidup Anaplasma sp. (Kocan et al. 2003)
Gejala klinis
Gejala klinis yang tidak jelas pada sapi umur kurang dari 1 tahun, dan kejadian fatal per akut pada sapi lebih dari 3 tahun. Gejala klinis yang dapat ditemukan antara lainpyrexia, anemia, ikterus, anoreksia, nafas cepat, penurunan produksi susu dan abortus. Anaplasma marginale yang dapat menyebabkan penyakit-penyakit high fever, anemia, bilirubinemia, bilirubinuria.
Diagnosa
Diagnosa penegakan penyakit anaplasmosis dapat dilakukan dengan cara pemeriksaan mikroskopis melalui preparat ulas darah, Enzim Linked Immunosorbent Assay (ELISA) dan Polymerase Chains Reaction (PCR) (Rodriguez et al. 2013).
6
Penularan
Anaplasmosis merupakan penyakit infeksius pada hewan ternak yang ditandai dengan anemia. Cara penularanya melalui vektor yaitu caplak dan lalat. Seluruh stadium perkembangan caplak memiliki potensi menyebarkan Anaplasma sp. (Kocan et al. 2010). Vektor caplak dari Anaplasma adalah Boophilus, Rhipicephalus, Hyalomma, Demacentor dan Ixodes (Kocan et al. 2004; Hamou et al. 2012). Transmisi Anaplasma sp. Juga dapat disebabkan oleh gigitan lalat. Lalat penghisap darah family Tabanidae dilaporkan mampu menjadi inang antara mekanik dari A. marginale di kawasan Eropa tengah-timur (Hornok et al. 2008). Menurut Foley dan Biberstein (2004), Anaplasma juga dapat ditularkan oleh lalat Tabanus, Stomoxys, nyamuk Psorophora, dan Aedes aegypti.
Theilleria spp. Klasifikasi menurut Levine (1995)
Kingdom : Protozoa Filum : Apicomplexa Kelas : Sporozosida Ordo : Eucoccidiorida Subordo : Piroplasmorina Famili : Theileriidae Genus : Theileria
Parasit darah Theileria sp. merupakan penyebab theileriosis. Penyakit yang banyak tersebar di kawasan Afrika, Asia, dan Australia tersebut sering menyerang sapi dan domba (Taylor et al. 2007). Menurut derajat patogenitasnya Theileria sp. dibagi atas Theileria sp. yang patogen dan Theleria sp. yang non pathogen (Levine 1992). Sapi yang baru lahir sampai usia dara (<2 tahun), biasanya lebih tahan terhadap infeksi parasit darah (Levine 1995). Theileria sp. yang menginfeksi sapi adalah Theileria annulata, Theileria parva, Theileria mutans, Theileria sergenti, Theileria taurotragi dan Theileria velifera (Billiow 2005). Masa inkubasi Theileria sp. hanya berjarak sekitar 1‒3 minggu, sehingga memungkinkan sapi dapat sembuh sendiri jika terinfeksi Theileria sp. (Bakken et al. 2006).
Morfologi
Theileria sp.berbentuk batang dengan ukuran 1.5-2.0 × 0.5-1.0 μm (Levine 1995). Bentuk lain yang umumnya dijumpai pada eritrosit adalah bundar, oval dan ada juga ditemukan berbentuk koma.
Siklus hidup
Theileria sp. hidup di sel darah merah dan limfosit, memiliki siklus hidup fase aseksual dan seksual. Pembelahan aseksual terdiri dari stadium skizogoni dan merogoni yang terjadi di dalam sirkulasi limfosit dan eritrosit induk semang. Stadium skizogoni diawali ketika caplak yang terinfeksi sporozoit menggigit induk semang. Dalam tubuh inang, sporozoit yang telah menjadi tropozoit melakukan pembelahan di limfosit dan berkembang menjadi makroskizon. Dalam limfosit makroskizon mengalami pembelahan menjadi mikromerozoit.
7
Pembelahan yang terus menerusakan menyebabkan terjadinya limfolisis mengakibatkan terlepasnya mikromerozoit ke dalam sel darah merah. Mikromerozoit yang menginfeksi sel darah merah akan berubah menjadi piroplasma yang akan menginfeksi caplak. Piroplasma mengalami pembelahan biner dan memasuki fase seksual (Bishop et al. 2004).
Fase seksual terjadi dalam usus caplak yang diawali dengan stadium gametogoni. Mikromerozoit yang berasal dari sel darah merah kemudian akan berdiferensiasi menjadi gamet jantan dan gamet betina yang nantinya akan berdifusi menjadi zigot. Dalam epitel usus, zigot berubah menjadi kinet. Kinet akan bersirkulasi ke dalam kelenjar saliva yang kemudian mengalami perubahan menjadi sporoblast. Satu sporoblast mampu menghasilkan 30 000 hingga 50 000 sporozoit yang nantinya digunakan untuk menginfeksi inang melalui gigitan caplak (Urquhart et al. 2003).
Gambar 3. Siklus hidup Theileria sp. (Bishop et al. 2004)
Gejala klinis
Infeksi Theilleria sp. menyebabkan kelemahan, bobot badan turun, anoreksia, suhu tubuh tinggi, petechiae pada mukosa konjungtiva, pembengkakan nodus limfatikus, anemia dan batuk.Sedangkan infeksi pada stadium lanjut menyebabkan hewan tidak dapat berdiri, suhu tubuh dibawah normal (T<38.5ºC), ikterus, dehidrasi, dan kadang ditemukan darah di feses (Kelles et al. 2001).
Diagnosa
Diagnosa penegakan penyakit theileriosis dapat dilakukan dengan cara pemeriksaan mikroskopis melalui preparat ulas darah, Enzim Linked Immunosorbent Assay (ELISA) dan Polymerase Chains Reaction (PCR) (Rodriguez et al. 2013).
Penularan
Penularan theileriosis diperantarai caplak Rhipichepalus, Hyalomma, Amblyomma dan Haemaphysalis (Urquhart et al. 2003). Caplak tersebut membawa bibit penyakit dari sapi terinfeksi ke sapi yang sehat melalui gigitan.
8
Pencegahan dan Pengobatan
Pencegahan babesiosis, anaplasmosis dan theleriosis memiliki kesamaan. Beberapa cara yang dapat dilakukan adalah dengan menghindari kontak lansung antara sapi dengan vektor caplak serta pemberantasan populasi vektor caplak masing-masing agen. Selain itu membersihkan lingkungan seperti penyemprotan insektisida pada kandang dan lingkungan dapat mencegah meningkatnya populasi vektor.
Jika sapi telah terinfeksi babesiosis, dapat dilakukan pengobatan dengan menggunakan diminazene, diaceturate, imidocarb dan amicarbalide. Jika terinfeksi anaplasmosis dapat dilakukan pengobatan dengan menggunakan antibiotik seperti doxycycline, oxytetracycline dan imidocarb. Sedangkan jika terinfeksi theleriosis dapat diberi obat seperti Trypan blue, Phenamidine isothionat dan preparat Quinoline. Pengobatan ini bersifat supporting yang artinya hanya untuk mengurangi gejala.Sapi yang terinfeksi dapat sembuh dengan sendirinya tergantung pada sistem kekebalan tubuh.
METODE PENELITIAN
Waktu dan Tempat Penelitian
Pengumpulan sampel ini dilaksanakan pada bulan Oktober sampai Desember 2015 di Kawasan Usaha Ternak (KUNAK) Cibungbulang, Kabupaten Bogor. Pengolahan sampel dan analisis hasil penelitian dilakukan di Laboratorium Protozoologi, Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner, Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Prosedur Penelitian
Pengumpulan Data
Data diperoleh dari hasil pemeriksaan parasit darah dari sampel ulas darah pada sapi perah di Kawasan Usaha Ternak (KUNAK) Cibungbulang, Kabupaten Bogor. Pengambilan sampel dilakukan dengan cara purposive sampling yaitu prosedur memilih sampel berdasarkan pertimbangan karakteristik yang cocok yang diperlukan untuk menjawab penelitian ( Juanda 2009).
Pengambilan Sampel Darah
Sampel darah sapi yang diambil sebanyak 100 ekor melalui vena coxigealis pada ekor dan vena jugularis pada leher menggunakan yang dihubungkan dengan vacuteiner berisi antikoagulan heparin.Lima mikroliter darah diambil dari vacutainer dengan menggunakan mikropipet lalu diteteskan pada tepi gelas objek. Ambil gelas objek lain dan tempelkan di atas gelas objek yang telah diteteskan darah tadi, kemudian gelas objek didorong membentuk sudut 45º sehingga terbentuk ulas darah tipis.
9
Gambar 4. Pengambilan sampel darah pada v. jugularis dan v. coxigealis
Pewarnaan sampel ulas darah
Sediaan ulas darah dikeringkan selama 1 menit dan difiksasi menggunakan metanol selama 5 menit. Setelah dibiarkan kering, sediaan ulas darah dimasukkan ke dalam kotak preparat untuk dibawa ke laboratorium. Preparat ulas darah diwarnai menggunakan larutan Giemsa 10% dengan cara merendamnya selama 30 menit. Preparat ulas darah yang telah diwarnai dicuci dengan aquades dan dikeringkan (Mahmmod et al. 2011).
Pemeriksaan sampel ulas darah
Pemeriksaan ulas darah dilakukan secara acak pada lima lapang pandang dengan perbesaran 1000 kali. Jumlah parasit intraseluler darah dihitung untuk tiap 500 butir sel darah merah (Alamzan et al. 2008).
Untuk penelitian kali ini menghitung parasitemia dilakukan modifikasi yaitu jumlah parasit intraseluler darah dihitung untuk tiap 1000 butir sel darah merah dengan rumus:
Prosedur Analisis Data
Data yang diperoleh dianalisis menggunakan uji Kruskal-Wallis untuk membandingkan tingkat parasitemia terhadap umur. Analisa data menggunakan program SPSS 16.0 2010.
10
HASIL DAN PEMBAHASAN
Persentase Sapi Terinfeksi Parasit dan Tingkat Parasitemia
Tabel 1. Persentase infeksi parasit dan tingkat parasitemia
Jenis Parasit Jumlah Sampel
(ekor)
Jumlah sapi yang Terinfeksi Parasit (%) Rata-Rata Parasitemia (%) Babesia sp. 100 4 0.12 Anaplasma sp. 100 15 0.10 Theileria sp. 100 50 0.11
Sapi tidak terinfeksi parasit 100 31 -
Dari Tabel 1, hasil pemeriksaan sampel menunjukkan 69 % sapi terinfeksi parasit darah dan sisanya 31 % tidak terinfeksi parasit. Tingginya presentase sapi yang terinfeksi parasit dapat disebabkan oleh faktor lingkungan dan kondisi sapi tersebut. Hasil pengamatan di lapangan disekitaran kandang adalah tumbuhan rumput hijaun yang berpotensi sebagai tempat caplak untuk bertelur. Kondisi lingkungan di Kunak yaitu suhu rendah, kelembaban tinggi dan curah hujan tinggi merupakan habitat yang cocok untuk caplak. Menurut Imam (2001), caplak hidup di daerah yang memiliki suhu rendah dan lembab. Rata-rata sapi yang ada di lapangan juga terlihat kurus dan banyak feses di tubuhnya. Hal ini mengindikasikan sapi tidak pernah dimandikan sehingga seluruh stadium perkembangan caplak mulai dari stadium larva, nimfa dan dewasa kecuali telur dapat berlansung di tubuh sapi. Semua stadium kecuali telur, mendapatkan makanan dari menghisap darah pada tubuh inang (Levine 1990). Hal ini menyebabkan sapi sangat mudah terinfeksi parasit.
Theleria sp. merupakan parasit darah yang paling banyak menginfeksi sapi. Hal ini terlihat dari 69 ekor sapi yang terinfeksi parasit, ada sebanyak 50 ekor yang terinfeksi Theileria sp., 15 ekor sapi terinfeksi Anaplasma sp., serta terinfeksi Babesia sp. hanya 4 ekor sapi. Sapi banyak terinfeksi parasit darah Theileria sp., Anaplasma sp. dan Babesia sp., seperti terlihat pada Gambar 5, diduga dapat disebabkan karena ada jenis caplak yang menjadi vektor dari penyebaran Theileria sp. yaitu Rhipichepalus, Hyalomma, Amblyomma dan Haemaphysalis(Urquhart et al. 2003) dan jenis caplak yang menjadi vektor dari Anaplasma sp. dan Babesia sp. yaitu Boophilus microplus (Cantu et al. 2007).
Gambar 5 Infeksi parasit pada darah sapi A) Babesia sp., B) Anaplasma sp. . C) Theileria sp.
B
C
11
Persentase Sapi Terinfeksi Parasit Berdasarkan Umur
Rata-rata sapi yang terinfeksi Babesia sp. meningkat seiring dengan bertambahnya usia. Hal ini sama dengan literatur yang menyatakan bahwa secara umum sapi umur muda kurang rentan dibandingkan sapi dewasa terhadap infeksi Babesia sp. (Benavides dan Sacco 2007). Pada sapi dewasa juga seiring bertambahnya umur, kepekaan sapi terhadap stres lingkungan akan semakin meningkat sehingga memudahkan berbagai vektor serangga mentransimisikan parasit ke dalam tubuh sapi dewasa (Lubis 2006). Hasil pemeriksaan ulas darah menunjukkan pada sapi berumur muda (kurang dari 2 tahun) tidak ditemukan adanya sapi yang terinfeksi Babesia sp.. Hal ini dikarenakan pada sapi umur muda memiliki antibodi pasif dari induknya (kolostrum) (CFED 2008). Selain mendapatkan kolostrum, sapi umur muda juga yang masih mengonsumsi susu dari induknya, banyak mendapatkan nutrisi yang sangat berfungsi untuk sistem kekebalan tubuh.
Pada sapi yang terinfeksi Anaplasma sp. juga menunjukkan hasil yang sama seperti sapi yang terinfeksi Babesia sp. yaitu meningkat seiring bertambahnya usia. Hanya saja pada Anaplasma sp. sapi cenderung terinfeksi pada semua tingkatan umur. Hal ini sama dengan literatur yang menyatakan bahwa sapi berbagai umur dapat terinfeksi Anaplasma sp. dan sapi berbagai tingkatan umur jika sekali terinfeksi Anaplasma sp. maka secara persisten akan menjadi karier hidup (Kocan et al. 2000; Aubry dan Geale 2010). Sapi yang terinfeksi Anaplasma sp. juga walaupun sudah berada dalam masa persembuhan, sapi tersebut bisa menjadi sumber anaplasmosis bagi hewan domestik sehat lainnya (Foley dan Bieberstein 2004).
Hasil pemeriksaan ulas darah untuk sapi yang terinfeksi Theileria sp. dapat dilihat dari Tabel 2 memiliki nilai yang berbeda dengan infeksi Babesia sp. dan Anaplasma sp. Persentase sapi yang terinfeksi Theileria sp. pada umur muda (< 2 tahun) lebih tinggi daripada persentase sapi pada umur dewasa (>2 tahun). Hal ini karena induk yang terinfeksi Theileria sp., di dalam kolostrum induk tidak terbentuk antibodi terhadap theleriosis (Gronvold et al. 1996).
Rataan Parasitemia Berdasarkan Umur
Rataan parasitemiaBabesia sp., Anaplasma sp. dan Theileria sp. pada sapi umur muda menunjukkan hasil yang tidak berbeda nyata dengan sapi umur dewasa (Tabel 3). Rata-rata parasitemia pada berbagai tingkat umur digolongkan tingkat parasitemia rendah karena memiliki nilai kurang dari 1% (Camacho 2004).
Keterangan : uji Kruskal-Wallis
Tabel 2. Infeksi parasit berdasarkan umur
Umur sapi Jumlah
(ekor)
Jumlah sapi yang terinfeksi parasit (%)
Babesia sp. Anaplasma sp. Theileria sp.
≤ 2 tahun 21 0 14.29 66.67
> 2 tahun 79 5.06 15.19 45.57
Tabel 3.Rataan parasitemia berdasarkan umur
Umur sapi Jumlah
(ekor)
Rata-rata parasitemia
Babesia sp. Anaplasma sp. Theileria sp.
≤ 2 tahun 21 0.00± 0.00 0.10 ±0.05 0.09 ±0,05
12
Hasil pemeriksaan ulas darah Babesia sp. menunjukkan rataan parasitemia sedikit meningkat seiring dengan peningkatan umur sapi. Sapi yang umur kurang dari 2 tahun nilai rataan parasitemia nol yang berarti hewan tersebut belum terpapar Babesia sp.. Menurut CFED (2008), sapi umur muda masih memiliki antibodi pasif dari induknya (kolostrum) sehingga dapat mencegah dari infeksi Babesia sp.. Secara umum sapi umur muda kurang rentan dibandingkan sapi dewasa terhadap infeksi Babesia sp. (Benavides dan Sacco 2007). Sapi anak lebih tahan terhadap babesiosis daripada sapi dewasa (Levine 1995). Akan tetapi ada juga sapi berusia muda yang masih terinfeksi Babesia sp. Infeksi tersebut terjadi pada saat lepas sapih yaitu terjadi peralihan pemberian pakan dari susu menjadi pakan hijauan. Pedet yang baru lepas sapih rumennya belum berfungsi dengan baik sehingga perubahan pakan secara langsung dapat menyebabkan sistem imun tidak bekerja secara maksimal untuk melindungi tubuh (Williamson dan Payne 1993). Selain itu, susu jauh lebih banyak mengandung nutrisi yang berguna untuk sistem pertahanan tubuh dibandingkan dengan rumput hijauan. Rataan parasitemia babesiosis pada populasi sapi berbagai tingkatan umur dikategorikan dalam tingkat parasitemia rendah (parasitosis kurang dari 1%). Rendahnya infeksi dimungkinkan karena masa inkubasi Babesia sp. yang pendek (1‒2 minggu) mengakibatkan infeksi dapat sembuh dengan sendiri (Taylor et al. 2007).
Rataan parasitemia Anaplasma sp. menunjukkan hasil yang tidak berbeda nyata antara umur muda dan umur dewasa. Hal ini terlihat dari Tabel 3, rata-rata parasitemia pada sapi umur muda dan umur dewasa memiliki hasil yang sama. Nilai rataan parasitemia Anaplasma sp. berdasarkan tingkatan umur sama dengan Babesia sp. yaitu tergolong parasitemia rendah (kurang dari 1%). Terdapat beberapa kemungkinan terkait rendahnya rataan tersebut diantaranya karena hewan sedang berada dalam masa inkubasi (2‒12 minggu) yang merupakan masa awal masuknya parasit hingga timbulnya gejala klinis ataupun masa karier yaitu masa saat sapi terinfeksi parasit tetapi tidak menimbulkan gejala (Quinn et al. 2008; Kocan et al. 2010).
Rataan parasitemia Theileria sp. juga menunjukkan hasil yang tidak berbeda nyata antara umur muda dan umur dewasa. Hal ini dapat terlihat dari Tabel 3, nilai rata-rata parasitemia pada umur muda sangat sedikit perbedaannya dengan nilai rata-rata parasitemia pada umur dewasa. Sapi yang baru lahir sampai usia dara (<2 tahun), biasanya lebih tahan terhadap infeksi parasit darah (Levine 1995). Hal tersebut karena hewan usia muda masih mendapatkan kolostrum dari susu induknya yang berguna sebagai antibodi (CFED 2008). Berdasarkan hasil perhitungan, rataan parasitemia Theileria sp. juga kurang dari 1% yang tergolong dalam infeksi rendah. Hal tersebut dimungkinkan karena masa inkubasi Theileria sp. yang berjarak hanya sekitar 1‒3 minggu, selain hal tersebut dapat juga disebabkan oleh infeksi parasit yang telah berada dalam stadium persembuhan (1‒ 2 minggu) yaitu masa dimana hewan yang terinfeksi dapat melewati masa inkubasi (Bakken et al. 2006). Pada stadium persembuhan jumlah sel darah merah, PCV, dan hemoglobin kembali ke rentang normal, akan tetapi hewan tersebut bisa menjadi karier yang menularkan pada hewan peka lainnya (Uilenberg 2006).
13
SIMPULAN DAN SARAN
Berdasarkan hasil penelitian ini dapat disimpulkan bahwa di Kawasan Usaha Ternak (KUNAK) dari 100 sampel darah sapi yang diperiksa ditemukan 69 ekor yang terinfeksi parasit darah (69%). Ada 3 jenis parasit darah yang ditemukan dalam penelitian ini yaitu Babesia sp., Anaplasma sp. dan Theileria sp.. Persentase hewan terinfeksi parasit tertinggi yaitu Theileria sp. (50%), kemudian Anaplasma sp. (15%) dan terendah Babesia sp. (4%). Rataan derajat parasitemia pada berbagai tingkat umur memiliki nilai sama yaitu kurang dari 1%, yang tergolong dalam tingkat parasitemia rendah. Saran untuk penelitian ini adalah perlu dilakukan penelitian lanjutan mengenai prevalensi dan faktor resiko terjadinya infeksi parasit ini pada usaha peternakan sapi.
DAFTAR PUSTAKA
Alamzan C, Medrano C, Ortiz M, de la fuente J. 2008. Genetic Diversity of Anaplasma marginale strains from an outbreak of bovine anaplasmosis in an endemic area. J Vet Parasitol. 158(1-2):103-109.
Astyawati T. 2005. Bahan Kuliah Protozoologi. Bogor (ID):Insitut Pertanian Bogor.
Aubry P, Geale DW. Transboundary and emerging disease: A review of bovine anaplasmosis. 2010. J Vet Sci. 58(1):1-30.
Bakken S, Dumler S, Chen SM, Eckman, Marak R, Van etta L, Walker H. 2006. Human granulocytic ehrlichiosis in the upper mid-west United States. JAMA. 129(3):247‒269.
Benavides MV, Sacco MS. 2007. Differential Bos taurus cattle response to Babesia bovis infection. J Vet Parasitol.150(1):54-64.
Billiow M. 2005. The epidemiology of Bovine Theileriosis in the Eastern Province of Zambia.Laboratorium voor Parasitologie. Brusel (BG): Faculteit Diergeneeskunde. Universiteit Gent.
Bishop R, Musoke A, Morzaria S, Gardner M, Nene V. 2004.Theileria: intracellular protozoan parasites of wild and domestic ruminants transmitted by Ixodid ticks. J Vet Parasitol. 129:271‒283.
Boone DR, Richard WC, George MG. 2001. Bergey’s Manual of Systematic Bacteriology. New York (US): Springer.
Camacho T. 2004. Roles of the Maltese Cross Form of Babesia micorti in the Development of Parasitemia in B. micorti Infection. ASM. 72(8):4929‒2930. Cantu A, Ortega JA, Mosqueda J, Zeferino GV, Scott EH, John EG. 2007.
Immunologic and molecular identification of Babesia bovis and Babesia bigemina in free-ranging white-tailed deer in Northern Mexico. J Wildl Dis. 43(3):504–507.
[CFED] Committee on Foreign and Emerging Diseases of the United States Animal Health Association. 2008. Foreign Animal Diseases. Edisi ke-7. Canada (CD): Boca Publication Group, Inc.
14
Cunha BA, Barnett B. 2006. Babesiosis. eMedicine Journal [online]. [diunduh
pada 21 Januari 2017]. Tersedia pada
http://www.emedicine.com/med/topic195.htm
[DITJENAK]. Direktorat Jenderal Peternakan dan Kesehatan Hewan. 2012. Manual Penyakit Hewan Mamalia. Jakarta (ID): Direktorat Jenderal Peternakan dan Kesehatan Hewan Kementrian Pertanian RI.
Foley J, Biberstein. 2004. Jawetz, Melnick, & Adelberg’s Medical Microbiology. Brooks GF, Morse SA, Butel JS; editor. New York (US): Mc Grawl Hill. Gronvold J, Henriksen SA, Larsen, M, Nansen P. 1996. Biological control aspects
of biological control-with special reference to arthropods, protozoans and helminths of domesticated animals. J Vet Parasitol.64(1):47-64.
Hamou SA, Rahali T, Sahibi H, Belghyti D, Losson B, Goff W, Rhalem A. 2012. Molecular and serological prevalence of Anaplasma marginale in cattle of North Central Morocco. J Vet Sci. 93(3):1318–1323.
Homer MJ, Delfin IA, Telford III SR, Krause PJ, Persing DH. 2000. Babesiosis. Clin Microbiol Rev. 13(3):451.
Hornok S, Foldva’ri G, Elek V, Naranjo V, Farkas R, Fuente J. 2008. Molecular identification of Anaplasma marginale and Rickettsia endosymbionts in blood-sucking flies (Diptera: Tabanidae, Muscidae) and hard ticks (Acari: Ixodidae). J Vet Parasitol. 154:354-359.
Imam SH. 2001. Aspek Biologis Caplak Sapi Boophilus microplus Indonesia dalam Kondisi Laboratorium [skripsi]. Bogor (ID): Institut Pertanian Bogor. Juanda B. 2009. Ekonometrika Permodelan dan Pendugaan. Bogor (ID): IPB
Press. 53 hlm.
Kelles I, Deger S, Altug N, Karaca M, Akdemir C. 2001. Tick-borne disease in cattle: clinical and haematological findings, diagnosis, treatment, seasonal distribution, breed, sex and age factors and the transmitter of the disease. Yyu Vet Fak Derg. 12:26-32.
Kivaria FM. 2006. Estimated direct economic cost associated with tick-borne diseases on cattle in Tanzania. Trop Anim Health Prod. 38(4):291-299.
Kocan KM, Blouin EF, Barbet AF. 2000. Anaplasmosis control. Past, present, and future. Ann NY Acad Sci. 916(1):501-509.
Kocan KM, Fuente J, Guglielmone AA, Mele´ndez RD. 2003. Antigens and alternatives for control of Anaplasma marginale infection in cattle. J Clin Microbiol. 16(4):698-712.
Kocan KM, de la Fuente J, Blouin EF, Garcia JC. 2004. Anaplasma marginale (Rickettsiales: Anaplasmataceae): recent advances in defining host pathogen adaptations of a tick-borne rickettsia. J Vet Parasitol.129:285-300.
Kocan KM, Feunte JDL, Blouin EF, Coetzee JF, Swing SA. 2010. The natural history of Anaplasma marginale. J Vet Parasitol. 167(2):95-107.
Levine ND. 1970. Protozoan Parasites of Domestic Animal and of Man. Minneapolis (US): Burgess Publ.
Levine ND. 1990. Protozoologi Veteriner. Ashadi G, penerjemah. Yogyakarta (ID): Gadjah Mada University Pr. Terjemahan dari: Veterinary Protozoology. Levine ND. 1992. Protozoologi Veteriner.Ashadi, G. penerjemah; Yogyakarta
15
Levine ND. 1995. Protozoologi Veteriner. Soekardono S, penerjemah; Brotowidjojo D, editor. Yogyakarta (ID): Gadjah Mada University. Terjemahan dari: Veterinary Protozoology.
Lubis FY. 2006. Babesiosis (piroplasmosis). Cermin Dunia Kedokteran. 152:27-29.
Mahmmod YS, Elbalkemy FA, Klaas IC, Elmekkawy MF, Monazie AM. 2011. Clinical and haematological study on water buffaloes (Bubalus bubalis) and crossbred cattle naturally infected with Theileria annulata in Sharkia province, Egypt. Ticks and Tick-borne Dis. 2(3):168-171.
Nasution AYA. 2007. Parasit darah pada ternak sapi dan kambing di lima Kecamatan, Kota Jambi [skripsi]. Bogor (ID): Institut Pertanian Bogor. Oka Ibm. 2010. Ilmu Penyakit Parasitic Protozoa. Bali (ID): Udayan Pr.
Partoutomo S. 2004. Pengendalian parasit dengan Genetic Host Resistance. WARTAZOA. 14(4):160-172.
Quinn PJ, Markey BK, Carter ME, Donnelly WJ, Leonard FC. 2008. Veterinary Microbiology and Microbial Disease. Oxford (UK): Blackwell Pub.
Ristic M, Kreier JP. 1981. Babesiosis. New York (US): Academic Press.
Rodriguez A, Schnittger L, Tomazic M, Florin-Fhristensen M. 2013.Current and Prospective Tools for the Control of Cattleinfecting Babesia Parasites. New York (US): Research Gate.
Soulsby EJL. 1982. Helminth, Arthropods and Protozoa of Domesticated Animal. New York (US): Academic Inc.
Taylor MA, Coop R, Wall R. 2007. Veterinary Parasitology.Edisi ke-3 Hongkong (HK): Graphicraft Limited.
Uilenberg G. 2006. Babesia-a historical overview. JVet Parasitol. 138(1):3-10. Urquhart GM, Armour J, Duncan JL, Dunn AM, Jennings FW. 2003. Veterinary
Parasitology. Edisi ke-2. Scotland (UK): Blackwell Pub.
Williamson FG,Payne WJA. 1993. Pengantar Peternakan di Daerah Tropis. Darmadja SD, penerjemah. Yogyakarta (ID): Universitas Gadjah Mada Pr.
17
RIWAYAT HIDUP
Penulis memiliki nama lengkap Mursalim Kalman merupakan putra keempat dari 5 bersaudara dari Bapak La Salifa dan Ibu Marsalina. Penulis dilahiran di Lawama pada tanggal 7 September 1993. Penulis menempuh pendidikan di SD Negeri 14Tongkuno (2001), SMP Negeri 2 Tongkuno (2006), SMA Negeri 2 Kendari (2009) dan diterima di Fakultas Kedokteran Hewan Institut Pertanian Bogor melalui jalur Beasiswa Utusan Daerah (BUD) pada tahun 2012. Selama kuliah di IPB, penulis merupakan anggota aktif dari Divisi Eksternal Himpunan Mahasiswa Profesi (HIMPRO) Ruminansia FKH IPB sekaligus anggota dari Clan Domba-Kambing HIMPRO Ruminansia FKH IPB.