1
BAB 1
PENDAHULUAN
Fisika Zat Padat adalah bagian dari ilmu fisika yang mempelajari struktur dan berbagai sifat fisika dari suatu bahan (zat) dalam fasa padat. Fasa padat adalah suatu fasa dimana atom-atomnya menempati posisi yang tetap. Kebanyakan elemen kimia pada suhu ruang adalah bahan dengan fase padat. Secara umum, terdapat dua jenis zat padat yaitu kristal dan amorf. Kristal adalah satu jenis zat padat yang memiliki struktur kimia dengan tingkat keteraturan dan kesetangkupan yang tinggi (long range order) pada seluruh volumenya. Sedangkan amorf adalah jenis zat padat dimana strukturnya tidak memiliki keteraturan dan kesetangkupan yang tinggi pada seluruh volumenya. Pada buku ajar ini, akan dibahas zat padat berjenis kristal dengan tingkat keteraturan dan kesetangkupan yang tinggi. Sifat-sifat fisis yang akan dibahas meliputi berbagai struktur kristal, gaya ikat dan ikatan atom di dalam kristal serta kisi kristal. Dibahas pula konsep panas jenis sebagai fungsi dari suhu menurut Einstein dan Debye, konsep elektron bebas dalam kristal, teori pita energi dan penerapan teori pita energi ini pada bahan semikonduktor serta menghubungkan teori pita energi dengan dinamika elektron dalam logam. Pada akhir bagian buku ini, dibahas sekilas tentang konsep kemagnetan serta berbagai contoh bahan magnet serta aplikasinya.
Kompetensi yang ingin dicapai setelah mempelajari buku ajar ini adalah memiliki kemampuan untuk menganalisis struktur, sifat dan perilaku elektron dalam suatu zat padat. Untuk mencapai kompetensi di atas, pembaca diharapkan dapat:
Menjelaskan konsep struktur kristal.
Menjelaskan konsep gaya ikat dan ikatan atom dalam kristal.
Menjelaskan konsep panas jenis sebagai fungsi dari suhu menurut Einstein dan Debye.
Menjelaskan konsep elektron bebas dalam kristal.
Menunjukkan teori pita energi dan berbagai model yang mendasarinya. Menerapkan teori pita energi pada bahan semikonduktor.
Menerapkan dan menghubungkan teori pita energi dengan dinamika elektron dalam logam.
2
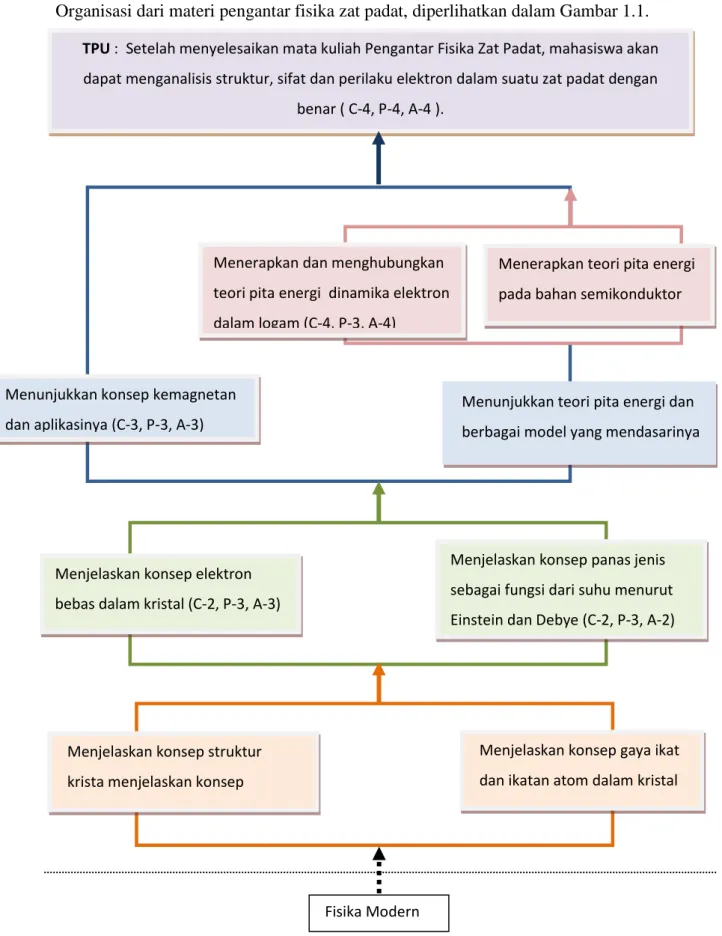
Organisasi dari materi pengantar fisika zat padat, diperlihatkan dalam Gambar 1.1. TPU : Setelah menyelesaikan mata kuliah Pengantar Fisika Zat Padat, mahasiswa akan dapat menganalisis struktur, sifat dan perilaku elektron dalam suatu zat padat dengan
benar ( C-4, P-4, A-4 ).
Menunjukkan teori pita energi dan berbagai model yang mendasarinya (C-3, P-3, A-3)
Menunjukkan konsep kemagnetan dan aplikasinya (C-3, P-3, A-3)
Menerapkan dan menghubungkan teori pita energi dinamika elektron dalam logam (C-4, P-3, A-4)
Menerapkan teori pita energi pada bahan semikonduktor (C-4, P-3, A-4)
Fisika Modern Menjelaskan konsep elektron
bebas dalam kristal (C-2, P-3, A-3)
Menjelaskan konsep panas jenis sebagai fungsi dari suhu menurut Einstein dan Debye (C-2, P-3, A-2) (C-2, P-3, A-3)
Menjelaskan konsep struktur krista menjelaskan konsep struktur kristal (C-2, P-2, A-2)
Menjelaskan konsep gaya ikat dan ikatan atom dalam kristal (C-2, P-2, A-2)
3
BAB 2
STRUKTUR KRISTAL
2. 1 Kisi Kristal
Zat padat dapat dibedakan menjadi dua, yaitu kristal dan amorf. Kristal adalah zat padat yang memiliki struktur yang terdiri dari atom dan gugus-gugusnya dengan tingkat keteraturan dan kesetangkupan yang tinggi. Sedangkan zat padat yang atom-atomnya tidak memiliki tingkat keteraturan disebut amorf.
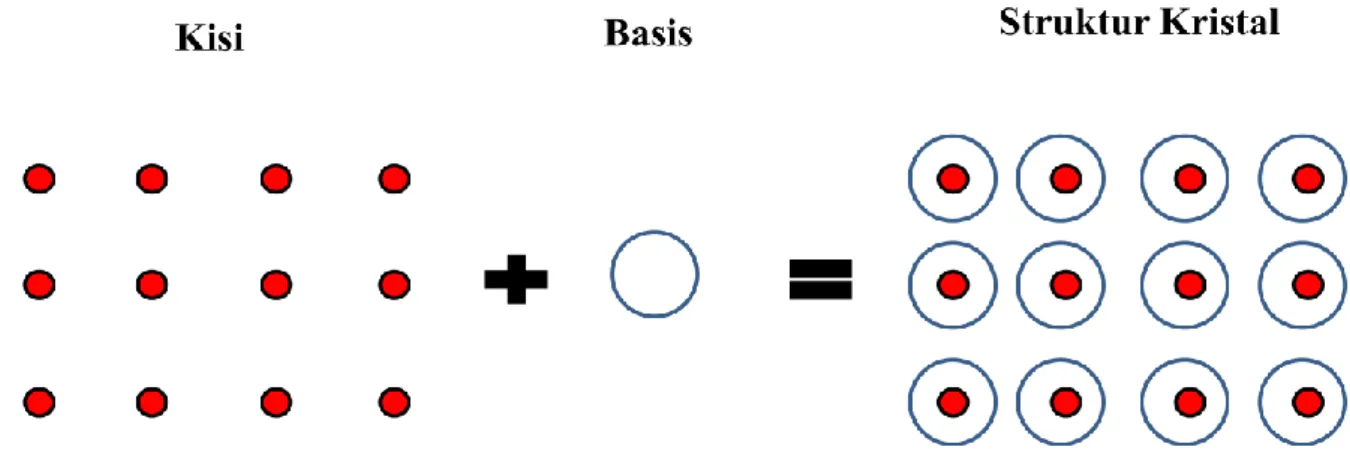
Kristal yang ideal adalah kristal yang memiliki struktur kristal dengan tingkat kesetangkupan unit atom yang tak berhingga dalam seluruh volume kristalnya serta tidak memiliki cacat geometrik. Unit atom yang dimaksud dapat berupa atom tunggal atau kumpulan dari beberapa atom yang disebut basis. Basis tersebut melekat pada posisi-posisi tertentu dengan titik-titik posisi yang disebut kisi. Sehingga dapat disimpulkan bahwa struktur dari sebuah Kristal merupakan penjumlahan antara kisi dengan basisnya (Struktur
Kristal = Kisi + Basis). Contoh sederhana penjumlahan kisi dengan basis yang
menghasilkan struktur kristal digambarkan pada Gambar 2.1.
Gambar 2.1: Contoh terbentuknya struktur kristal yang berasal dari penjumlahan kisi dan basis.
Kumpulan kisi khusus yang semua kisinya memiliki pola geometri yang sama disiebut kisi Bravais. Pola susunan kisi pada kisi Bravais ini dapat dibedakan menjadi tiga sesuai dengan tingkat dimensinya yaitu kisi satu dimensi, kisi dua dimensi dan kisi tiga dimensi.
Kisi satu dimensi yaitu pola pengulanagn kisi yang berada pada satu garis lurus satu dimensi baik pada arah sumbu x, y atau z.
4
Kisi dua dimensi yaitu pola pengulangan kisi pada dua dimensi. Pada umumnya terdapat 5 jenis pola pengulangan pada kisi dua dimensi ini yaitu kisi genjang, kisi bujur sangkar, kisi heksagonal, kisi segi panjang dan kisi segi panjang berpusat.
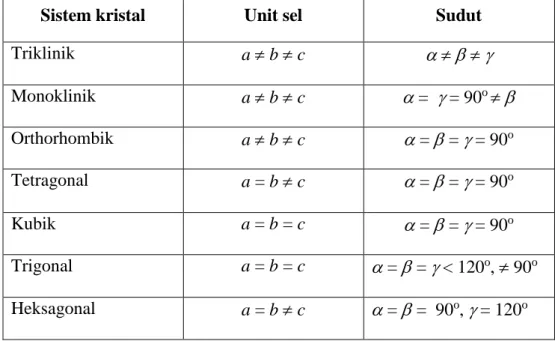
Kisi tiga dimensi yaitu pola pengulangan kisi dalam ruang tiga dimensi (space lattice). Terdapat 7 sistem kristal dalam ruang tiga dimensi yaitu triklinik, monoclinik, orthorhombik, tetragonal, kubik, trigonal dan heksagonal.
Tabel 1 memperlihatkan 7 sistem kristal dalam ruang tiga dimensi beserta geometri selnya. Panjang, lebar dan tinggi dari sistem kristal ini dituliskan dengan simbol a, b dan c. Sedangkan sudut-sudutnya dituliskan dengan simbol , dan .
Tabel 1: Tujuh sistem kristal dalam ruang tiga dimensi beserta geometri selnya.
Sistem kristal Unit sel Sudut
Triklinik a b c Monoklinik a b c = = 90o Orthorhombik a b c = = = 90o Tetragonal a = b c = = = 90o Kubik a = b = c = = = 90o Trigonal a = b = c = = < 120o, 90o Heksagonal a = b c = = 90o, = 120o
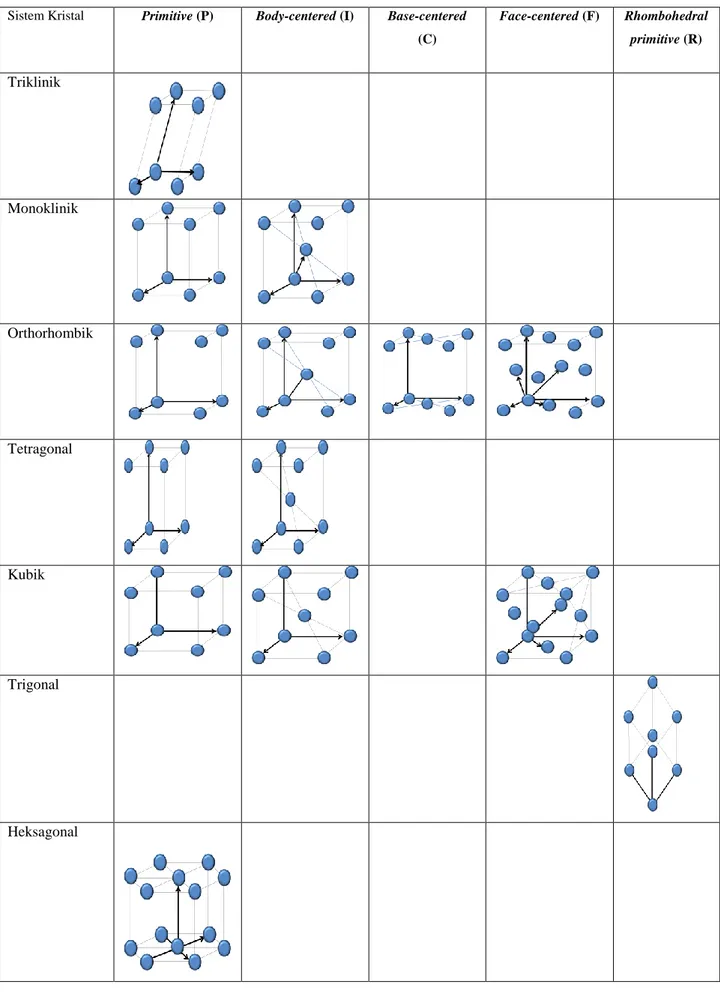
Di dalam ruang tiga dimensi, terdapat 5 tipe dasar pengulangan kisi yaitu kisi primitive (P), kisi body-centered (I), kisi base-centered (C), kisi face-centered (F), kisi rhombohedral primitive (R).
Berikut adalah penjelasan dari ke-5 tipe dasar kisi tersebut.
1. Kisi Primitive (P)
Kisi Primitive (P) adalah tipe kisi dimana titik-titik kisi hanya terdapat pada titik-titik sudut kristal. Tipe kisi primitive terdapat pada hampir semua sistem krisal yaitu sistem kristal triklinik, monoklinik, orthorhombik, tetragonal, kubik, heksagonal.
5
2. Kisi Body-centered (I)
Kisi Body-centered (I) adalah tipe kisi dimana titik-titik kisi terletak pada setiap sudut kristal ditambah titik pada pusat sel. Tipe kisi ini terdapat pada sistem kristal monoklinik, orthorombik, tetragonal dan kubik.
3. Kisi Base-centered (C)
Kisi Base-centered (C) adalah tipe kisi dimana titik-titik kisi terletak pada setiap sudut kristal ditambah dua titik pada permukaan atas dan bawah setiap sel. Tipe kisi ini hanya terdapat pada sisitem kristal orthorombik.
4. Kisi Face-centered (F)
Kisi Face-centered (F) adalah tipe kisi dimana titik-titik kisi terletak pada setiap sudut kristal ditambah dengan titik-titik pada semua pusat bidang permukaan kristal. Tipe kisi ini terdapat pada sistem kristal orthorombik dan kubik.
5. Kisi Rhombohedral primitive (R)
Kisi Rhombohedral primitive (R) adalah tipe kisi dimana titik-titik kisi terletak pada setiap sudut kristal yang khusus berbentuk rhombohedral. Tipe kisi ini hanya terdapat pada sisitem kristal trigonal.
Jika kita hitung dari variasi sistem kristal dan tipe kisi, jumlah kisi Bravais pada sistem tiga dimensi adalah 14 jenis. Tabel 2 memperlihatkan 14 jenis kisi Bravais lengkap dengan gambar berdasarkan pembagian sistem kristal dan tipe kisinya. Sistem kristal Triklinik dan Heksagonal hanya memiliki tipe kisi P. Sistem kristal Monoklinik dan Tetragonal memiliki dua tipe kisi yaitu tipe P dan I. Sistem kristal Orthorombik memiliki kemungkinan 4 tipe kristal yaitu P, I, C dan F. Sistem kristal Kubik memiliki 3 tipe kristal yaitu P, I dan F, sedangkan sistem kristal Trigonal memiliki satu tipe kristal yaitu tipe R.
6
Tabel 2: 14 jenis gambar kisi Bravais beserta kelompok sistem kristal dan tipe kisinya. Sistem Kristal Primitive (P) Body-centered (I) Base-centered
(C) Face-centered (F) Rhombohedral primitive (R) Triklinik Monoklinik Orthorhombik Tetragonal Kubik Trigonal Heksagonal
7
2.2 Geometri Kisi Kristal dan Kisi Resiprok
Arah orientasi bidang yang dibentuk dari titik-titik kisi Bravais sangat menetukan sifat dari suatu kristal. Oleh sebab itu diperlukan sistem penomoran yang dapat merepresentasikan setiap bidang yang ada pada suatu kristal. Seorang ilmuwan Inggris yaitu W. H. Miller memperkenalkan sistem pengkodean bidang kristal yang kemudian diberi nama indeks Miller. Indeks Miller merupakan suatu pengkodean, pendefinisian atau penamaan untuk melihat orientasi dari suatu permukaan. Indeks Miller mendefinisikan set permukaan yang paralel antara satu dengan yang lainnya. Indeks Miller tidak mendefinisikan bidang berdasarkan koordinat, tapi melihat keseluruhan orientasi bidang. Hal ini menyebabkan bidang yang memiliki arah orientasi yang sama akan tergabung dalam satu kelompok yang sama. Misalnya arah suatu titik dari titik asal (0, 0, 0) adalah (a, b, c). Jika kita memiliki bidang lain yang jarak dari titik asalnya 2 kali dari (a, b, c) maka dapat ditulis (2a, 2b, 2c). Arah bidang ini akan sama dengan arah bidang (a, b, c). Sehingga arah bidang (1, 0, 0) akan memiliki implikasi yang sama dengan arah bidang (2, 0, 0) atau (3, 0, 0).
Indeks miller ditulis dalam kurung tanpa menggunakan symbol koma. Setiap arah orientasi bidang dikodekan dengan tiga jenis integer yaitu (h k l). Proses penggkodean menggunakan aturan indeks Miller ini dilakukan dengan proses pembalikkan domain posisi menjadi domain orientasi. Proses pembalikkan domain ini menghasilkan suatu nilai kisi yang disebut kisi resiprok (kisi balik). Kisi resiprok inilah yang kemudian menggambarkan arah orientasi dari setiap bidang pada kristal.
Cara menentukan indeks Miller adalah sebagai berikut:
1. Menenentukan titik potong antara bidang yang bersangkutan dengan sumbu-sumbu (x, y, z) atau sumbu-sumbu primitif dalam satuan konstanta kisi (a, b, c)
2. Menentukan kebalikan (resiprok) dari titik potong antara bidang dengan sumbu-sumbu tersebut.
3. Menentukan tiga bilangan bulat (terkecil) yang mempunyai perbandingan yang sama 4. Indeks Miller diperoleh dari proses bagian 3 diatas dengan indeks (h k l)
5. Bila terdapat nilai h, k, atau l yang negatif, maka indeks tersebut dituliskan dengan garis di atasnya (ℎ̅ 𝑘 𝑙), artinya h bernilai negatif.
8
Gambar 2.2: Bidang yang memotong sumbu x, y, z masing-masing pada skala 2, 2 dan 3.
1. Menentukan titik potong antara bidang dengan sumbu x, y, z. Bidang ABC memotong sumbu-sumbu: 2 di titik A untuk sumbu x, 2 di titik B sumbu y, 3 di titik C sumbu z. Maka titik potong antara bidang dengan sumbu x, y, z (intercept) dapat dituliskan sebagai: (2, 2, 3).
2. Menentukan resiprok dari intercept di atas adalah (12,12,13).
3. Menentukan tiga bilangan bulat terkecil dari bilangan resiprok diatas. Misal masing-masing dikali dengan bilangan bulat 6, maka resiprok diatas menjadi (3, 3, 2). Maka Indeks Miller untuk bidang pada Gambar 2.2 adalah (3 3 2).
Contoh lain untuk bidang kubus sederhana seperti diperlihatkan pada Gambar 2.3 adalah sebagai berikut:
9
1. Perpotongan bidang BCGF dengan sumbu x, y, z adalah ∝ di sumbu x, 1 di sumbu y, ∝ di sumbu z
2. Resiproknya: ∝1,11,∝1 = 0, 1, 0
3. Tiga bilangan bulat terkecil dari bilangan resiprok 0, 1, 0 adalah (0, 1, 0) 4. Indeks Millernya: (0 1 0)
Tanda {0 1 0} menyatakan kumpulan bidang-bidang yang sejajar dengan bidang (0 1 0). Sama halnya dengan Bidang ADHE yang sejajar dengan bidang BCGF, maka indeks bidang ADHE adalah {0 1 0} begitu juga dengan bidang ABCD sejajar dengan bidang EFGH, maka bidang ABCD adalah {0 0 1}, dan seterusnya. Jadi, apabila bidangnya menempel di sumbu, indeksnya akan sama dengan indeks bidang yang sejajar dengannya.
Menentukan d
hkldhkl adalah jarak antar bidang pada suatu kristal. Resiprok untuk dhkl ini disimbolkan oleh 𝐺ℎ𝑘𝑙. Persamaan resiprok ruang untuk dhk dalam arah 𝑛̂ adalah sebagai berikut:
𝐺ℎ𝑘𝑙 = 2𝜋𝑛̂ℎ𝑘𝑙 𝑑ℎ𝑘𝑙
Persamaan dhkl untuk kristal dengan sistem orthogonal dapat dijabarkan sebagai persamaan berikut ini: 1 𝑑2 = ℎ2 𝑎2+ 𝑘2 𝑏2 + 𝑙2 𝑐2
Sedangkan persamaan dhkl untuk kristal dengan sisitem kubik adalah: 1
𝑑2 =
ℎ2 + 𝑘2+ 𝑙2 𝑎2 Contoh soal:
Suatu unit cell berbentuk kubik memiliki nilai indeks Miller (1 1 0) dan panjang a=5,2 A (0,52 nm). Tentukan nilai dhkl nya!
Jawab: 1 𝑑2 = ℎ2+ 𝑘2+ 𝑙2 𝑎2 𝑑2 = (0,52)2 12+ 12+ 0 𝑑ℎ𝑘𝑙 = 0,368 × 10−9𝑚.
10
2.3 Difraksi Sinar – X
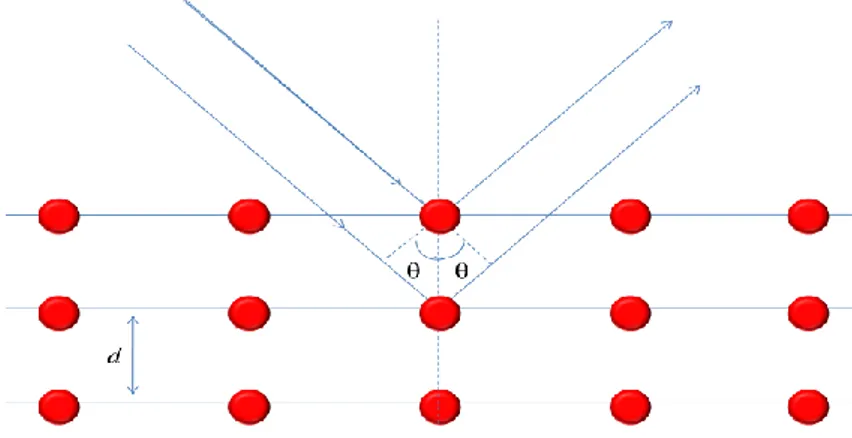
Difraksi sinar-X (X-ray difractions/XRD) merupakan metode karakterisasi yang memanfaatkan sifat dari sinar-X yang memiliki panjang gelombang 0.01-10 nm untuk mengidentifikasi arah bidang kisi pada suatu kristal dengan cara mengamati interferensi konstruktif yang dihasilkan pada sudut tertentu. Sinar-X merupakan radiasi elektromagnetik yang memiliki energi tinggi sekitar 200 eV sampai 1 MeV. Difraksi sinar-X juga dapat digunakan untuk menentukan ukuran partikel. Difraksi sinar-sinar-X terjadi ketika suatu basis dalam suatu kristal teradiasi secara koheren, menghasilkan interferensi konstruktif pada sudut tertentu. Dasar dari penggunaan difraksi sinar-X untuk mempelajari arah bidang kisi kristal adalah berdasarkan persamaan Bragg :
n λ = 2 d sin θ ; n = 1,2,…
λ adalah panjang gelombang sinar-X yang digunakan, d adalah jarak antara dua bidang kisi, θ adalah sudut antara sinar datang dengan bidang normal, dan n adalah bilangan bulat yang disebut sebagai orde interferensi.
Berdasarkan persamaan Bragg, jika seberkas sinar-X dijatuhkan pada suatu bahan kristal, maka bidang kristal itu akan mendifraksikan sinar-X kristal tersebut. Sinar yang didifraksikan akan ditangkap oleh detektor kemudian diterjemahkan sebagai sebuah puncak difraksi pada sudut θ tertentu. Makin banyak bidang kristal yang terdapat dalam sampel, makin kuat intensitas pembiasan yang dihasilkannya. Tiap puncak yang muncul pada pola XRD mewakili satu bidang kristal yang memiliki orientasi tertentu dalam sumbu tiga dimensi. Puncak-puncak yang telah didapatkan dari data pengukuran kemudian dicocokkan dengan standar difraksi sinar-X untuk hampir semua jenis material. Standar ini dikenal sebagai JCPDS (Joint Committee on Powder Difraction Standards). Gambar 2.4 meperlihatkan proses hamburan pada Kristal berdasarkan hokum Bragg.
11
XRD difraktometer memiliki 3 buah komponen utama, yaitu pembangkit sinar-X, tempat bahan (sample holder) dan detektor. Prinsip kerja difraktometer sinar-X dimulai ketika pembangkit sinar-X menghasilkan radiasi ektromagnetik, yang kemudian ditembakkan ke bahan yang akan diuji. Sinar-X yang dihamburkan bahan akan ditangkap oleh detektor yang kemudian dioleh menjadi beberapa informasi yang dapat diintrepertasikan dan dihitung untuk mendapatkan informasi struktur kristal dari bahan tersebut. Dari proses pengukuran yang dilakukan, dapat diperoleh beberapa informasi antara lain sebagai berikut:
1. Posisi puncak difraksi pada sudut θ tertentu, jarak antar bidang (dhkl), struktur
kristal dan orientasi dari sel satuan (dhkl) struktur kristal dan orientasi dari sel
satuan.
2. Intensitas relatif puncak difraksi, memberikan gambaran tentang posisi atom dalam sel satuan.
3. Bentuk puncak difraksi 4. Jarak antar bidang (dhkl)
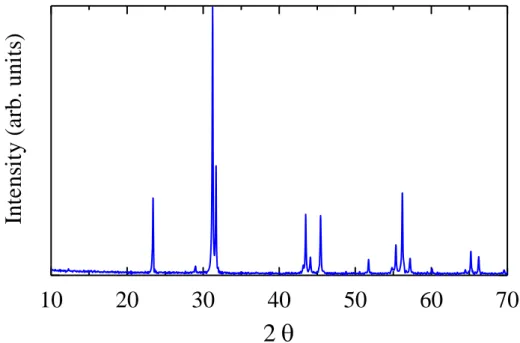
Contoh data hasil XRD untuk bahan superkonduktor dipelihatkan pada Gambar 2.5.
Gambar 2.5: Contoh data XRD untuk bahan superkonduktor
10
20
30
40
50
60
70
2
Int
e
ns
it
y (a
rb. uni
ts
)
12
Contoh soal perhitungan sudut Bragg pada suatu sistem kristal pada suatu percobaan. Hitunglah sudut bragg pada kristal kubik dengan unit cell a = 6 A, untuk bidang (2 2 1) dengan panjang gelombang 1,54 A.
Jawab: 1 𝑑2 = ℎ2+ 𝑘2+ 𝑙2 𝑎2 𝑑2 = (6)2 22+ 22+ 12 𝑑ℎ𝑘𝑙 = 2 𝐴 2𝑑 𝑠𝑖𝑛𝜃 = 𝑛 𝑠𝑖𝑛𝜃 = 𝑛 2𝑑 Untuk n=1 𝑠𝑖𝑛𝜃 =1 × 1,54𝐴 2 × 2𝐴 = 0,385 𝜃 = 22,64° Untuk n=2 𝑠𝑖𝑛𝜃 =2 × 1,54𝐴 2 × 2𝐴 = 0,77 𝜃 = 50,35°
Jadi sudut Bragg untuk Kristal ini adalah 𝜃1 = 22,64° dan 𝜃2 = 50,35°
Daftar Bacaan:
Birkholz, M., 2006,Thin Film Analysis by X-Ray Scattering.WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim.
13
BAB 3
GAYA IKAT
3.1 Gaya ikat
Pada umumnya zat padat merupakan zat yang memiliki struktur yang stabil. Kestabilan struktur zat padat ini disebabkan oleh susunan atom-atom dalam kristal berada pada kedudukan dengan enrgi potensial sistem minimum. Pada banyak atom, nilai energi potensial minimum dapat dengan cepat terpenuhi dengan cara barikatan dengan atom lain. Sebagai contoh kristal Natrium Clorida (NaCl) memiliki struktur yang lebih stabil dibandingkan dengan sekumpulan atom-atom bebas dari Na dan Cl. Hal ini menunjukkan bahwa energi atom-atom bebas penyusun kristal lebih besar daripada energi kristalnya.
Ikatan antar atom sangat berhubungan erat dengan jarak antar atom dan besarnya energi yang diperlukan untuk mengikat atom-atom tersebut. Energi yang diperlukan untuk mengikat dua atau lebih atom dinamakan energi ikat. Energi ikat ini sebenarnya adalah pendekatan untuk menggambarkan gaya ikat antar atom. Seperti halnya dalam bahasan fisika klasik, dua atom akan saling mengikat jika gaya tarik menarik antar dua atom tesebut. Selain itu adanya gaya tolak antar atom karena jenis muatan dan adanya larangan pauli, berkontribusi pada energi potensial yang terbentuk dalam kristal pada saat terjadi ikatan atom.
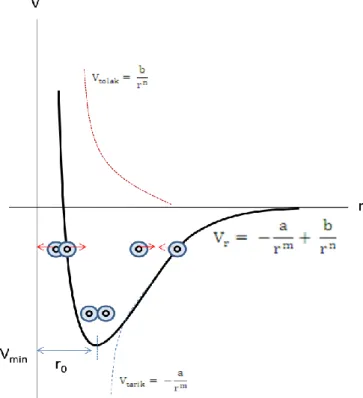
Besarnya energi potensial yang berasal dari gaya tarik dan gaya tolak antar atom dituliskan dengan persamaan
Vr = − a rm+
b rn Vr = energi potensial total
a = konstanta tarik menarik b = konstanta tolak-menolak r = jarak antar atom
m, n = konstanta karakteristik jenis ikatan dan tipe struktur. Nilai m adalah 1 untuk jenis ion dan m = 6 untuk jenis molekul. Konstanta n tergantung dari konfigurasi elektron. Konstanta ini disebut juga eksponen Born. Misal untuk unsur He yang konfigurasi elektronnya 1s2, nilaki konstanta n adalah 5. Sedangkan Ne dengan konfigurasi 2s2 2p6,
14
nilai konstanta n adalah 7. Nilai konstanta n unsur lain dapat diperoleh dari berbagai referensi.
Vtarik= −ram disebut juga Vtarik yaitu energi potensial yang terkait dengan gaya tarik antar
atom.
Vtolak = rbn disebut juga Vtolak yaitu energi potensial yang terkait dengan gaya tolak antar
atom.
Gambar 3.1: Kurva perubahan energi potensial (V) terhadap jarak antar antar atom (r).
Gambar 3.1 memperlihatkan kurva perubahan energi potensial terhadap jarak antar atom. Ikatan yang paling stabil antar atom terjadi pada saat energi potensial minimum yaitu pada posisi ro. Pada saat r lebih besar dari ro, kedua atom saling tarik. Sedangkan pada saat r lebih kecil dari ro, kedua atom akan saling menolak. Jarak ro dikenal pula dengan istilah jarak interatomik setimbang. Gaya tarik dan gaya tolak akan saling menghilangkan pada kedudukan ro yang merupakan keadaan setimbang.
3.2 Ikatan Atom dalam Kristal
Ikatan kristal merupakan ikatan hasil interaksi antara atom, khususnya elektron terluar dari atom-atom bersangkutan. Seperti telah disebutkan pada bagian 3.1, terbentuknya ikatan
15
atam antar dua atau lebih atom ditentukan oleh keadaan yang dapat menghasilkan nilai energi potensial yang minimum. Beberapa cara untuk mendapatkan nilai energi potensial minimum adalah sebagai berikut :
1) Penyesuaian jenis muatan total yang dimiliki masing-masing atom 2) Penyesuaian konfigurasi elektron paling luar dari masing-masing atom
3) Penempatan atom-atom pembentuk kristal menurut susunan orbital atom yang memiliki keberkalaan dan kesatangkupan dalam ruang tiga dimensi yang berukuran tidak berhingga.
Ikatan kristal terbagi dua kategori yaitu katagori ikatan utama atau primer dan katagori ikatan sekunder. Kategori ikatan utama adalah jenis ikatan yang sangat kuat. Ikatan utama ini terdiri dari tiga macam ikatan yaitu ikatan ionik, ikatan kovalen, dan ikatan logam. Katagori ikatan sekunder yaitu ikatan hydrogen dan ikatan van der waals. Konfigurasi yang stabil dari gas mulia menjadi konfigurasi yang cenderung untuk dicapai oleh unsur-unsur lain dalam membentuk ikatan atom.
3.2.1 Katagori Ikatan Utama
3.2.1.1 Ikatan Ionik
Ikatan ionik terbentuk dari hasil interaksi elektrostatik antara atom/ion yang memiliki muatan yang berbeda yaitu ion positif dan negatif. Contoh ikatan ionik yaitu kristal NaCl yang terbentuk dari interaksi elektrostatik antara ion Na+ dengan Cl-. Kation (Na+) bereaksi dengan anion (Cl-) membentuk Natrium Klorida (NaCl) yang bermuatan netral. NaCl memiliki kofigurasi elektron yang lebih stabil dibandingkan dengan kedua ion pembentuknya. Persamaan sederhana reaksi kimianya adalah sebagai berikut:
Na+ + Cl- → NaCl
Ikatan ionik biasanya terjadi antara atom-atom yang mudah melepaskan elektron (logam-logam golongan utama) dengan atom-atom yang mudah menerima elektron (terutama golongan VIA den VIIA). Contoh lain ikatan ionik adalah CaCl2, MgBr2, BaO dan FeS.
3.2.1.2 Ikatan Kovalen
Ikatan kovalen atau disebut juga ikatan homopolar adalah ikatan yang terbentuk karena adanya pemakaian bersama pasangan elektron. Terbentuknya ikatan kovalen karena adanya kecenderungan dari berbagai atom untuk mencari keadaan stabil dimana energi
16
potensialnya paling minimum. Konfigurasi yang paling stabil itu adalah konfigurasi elektron gas mulia. Oleh sebab itu beberapa atom saling berikatan untuk membentuk konfigurasi elektron gas mulia.
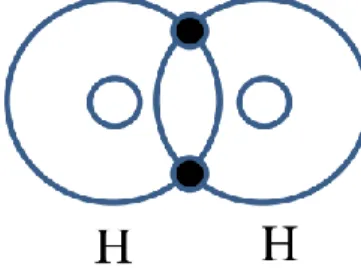
Contoh paling sederhana adalah ikatan antara dua atom H. Atom H memiliki konfigurasi elektron 1s1. Satu elektron dari masing-masing atom H saling berbagi untuk mendapatkan konfigurasi paling stabil 1s2 seperti diperlihatkan pada Gambar 3.2.
Gambar 3.2: Contoh ikatan kovalen pada molekul hidrogen (H2).
Konfigurasi elektron yang dihasilkan setelah terbentuknya ikatan menyebabkan ikatan kovalen pada suatu molekul atau kristal sangat kuat. Contoh kristal yang terbentuk dari ikatan kovalen adalah ZnS, GaSh, InAs dan SiC.
3.2.1.3 Ikatan logam
Ikatan logam hampir mirip dengan ikatan valensi. Ikatan logam terbentuk akibat adanya elektron valensi yang merupakan elektron bebas yang dapat bergerak di seluruh kristal. Elektron bebas ini dapat bertindak sebagai pengikat antar kation yang berada berdekatan pada suatu kristal. Namun demikian, ikatan logam ini bukanlah ikatan yang berarah seperti halanya ikatan kovalen. Ikatan logam merupakan ikatan yang tidak berarah. Hal ini disebabkan elektron bebas yang bergerak dapat menempati posisi dimanapun pada kristal. Unsur-unsur pada table periodik pada umumnya adalah logam yang dapat menjadi molekul yang besar berupa padatan. Bila dua atom logam saling mendekat, maka akan terjadi tumpah tindih antara orbital-orbitalnya sehingga membentuk suatu orbital molekul. Semakin banyak atom logam yang saling berinteraksi, maka semakin banyak tumpang tindih orbital yang akan terjadi.
3.2.2 Katagori Ikatan Sekunder
17
Ikatan hidrogen terjadi ketika sebuah atom hidrogen yang memiliki satu buah elektron berikatan dengan atom lain seperti atom N, O, atau F yang mempunyai pasangan elektron bebas. Hidrogen dan atom N atau O atau F akan berinteraksi membentuk suatu ikatan hidrogen dengan besar energi ikatan sekitar 0,1 eV. Kekuatan ikatan hidrogen ini dipengaruhi oleh perbedaan elektronegativitas antara atom-atom dalam molekul tersebut. Semakin besar perbedaannya, semakin besar ikatan hidrogen yang terbentuk. Pada air (H2O), terjadi dua ikatan hidrogen pada tiap molekulnya. Akibatnya jumlah total ikatan hidrogennya lebih besar daripada asam florida (HF).
3.2.2.2 Ikatan Van Der Waals
Atom-atom gas mulia (He, Ne, Ar, Kr, Xe) dapat membentuk suatu ikatan kristal lemah. Ikatan kristal tersebut terjadi akibat adanya interaksi elektrostatis anatara dipole-dipole listrik yang muncul karena adanya distorsi yang sangat kecil pada distribusi elektronnya. Interaksi antar dipole inilah yang menghasilkan gaya tarik-menarik antar atom gas mulia yang disebut gaya Van der waals. Gaya ini sangat lemah, namun demikian, keberadaan gaya ini menyebabkan munculnya ikatan atom yang disebut ikatan Van der waals. Selain pada gas mulia, ikatan ini juga ditemukan pada beberapa ikatan molekul organic.
18
BAB 4
KAPASITAS PANAS
4.1 Getaran Termal Kristal dan Kuantitas Energinya
Pada Bab 2, telah dibahas bahwa kristal tersusun oleh basis atom-atom yang “diam” pada posisinya di titik kisi. Sesungguhnya, diatas suhu mutlak 0 K, atom-atom dan kisi tersebut tidaklah diam, tetapi bergetar pada posisi kesetimbangannya. Getaran atom-atom dan kisi diatas suhu mutlak tersebut adalah sebagai akibat dari energi termal yang dimiliki atom-atom terkait dengan gejala termal. Sifat termal kristal tersebut di dekati secara teori melalui studi tentang kapasitas panas zat padat pada volume tetap (CV). Nilai CV sebagai fungsi dari suhu dianalisis dan dijelaskan dengan berbagai eksperimen, teori dan model.
Kapasitas panas suatu zat padat dapat dirumuskan sebagai perubahan energi terhadap suhu yang dapat dituliskan dengan persamaan :
CV= ∆E∆T
Analisis nilai Cv berdasarkan kuantitas dari energinya pertama kali dikemukan oleh Dulong dan Petit tahun 1819. Dulong dan Petit meninjau getaran atom-atom dan kisi zat padat sebagai osilator harmonik. Satu getaran atom dan kisi identik dengan sebuah osilator harmonik. Osilator harmonik merupakan suatu konsep dalam mekanika klasik yang menggambarkan sebuah massa m yang terkait pada sebuah pegas dengan tetapan pegas k. Untuk osilator harmonik satu-dimensi, energinya dapat dirumuskan :
E = Ek+ Ep E = 1
2mv2+ 1 2kx2
Energi rata-rata untuk setiap energi pada kaidah klasik dirumuskan sebagai 12kBT sehinga energi total rata-ratanya menjadi
E =12kBT +12kBT= kBT
dengan kB adalah tetapan Boltzmann dan T adalah suhu osilator. Selanjutnya, karena atom-atom dalam kristal membentuk susunan tiga-dimensi, maka setiap kilomol kristal mamiliki NA atom yang berosilasi dalam tiga-dimensi, sehingga energi dalamnya adalah sebagai berikut E = NA(1 2mvx2+ 1 2kx2+ 1 2mvy2+ 1 2ky2+ 1 2mvz2+ 1 2kz2)
19 E = NA( 1 2kBT + 1 2kBT + 1 2kBT + 1 2kBT + 1 2kBT + 1 2kBT) E = 3NAkBT = 3RT
R adalah konstanta gas yang berasal dariNAkB. Dengan demikian kapasitas panasnya adalah :
CV = dE dT= 3R
Hasil ini menunjukkan bahwa kapasitas panas zat padat tidak bergantung pada suhu dan berharga 3R. Jika hasil ini dibandingkan dengan hasil percobaan, dapat diketahui bahwa nilai 3R untuk kapasitas panas zat padat, hanya berlaku untuk suhu tinggi. Sedangkan untuk suhu rendah, hasi percobaan menunjukkan adanya kebergantungan nilai kapasitas panas terhadap suhu. Beberapa teori dan model kemudian muncul untuk menjelaskan kebergantungan nilai Cv terhadap suhu padaa suhu rendah.
4.2 Kapasitas Panas Menurut Einstein
Einstein pada tahun 1907 mengemukakan teori tentang kapasitas panas dengan menganggap getaran atom-atom dan kisi dalam kristal sebagai osilator-osilator bebas yang bergetar tanpa saling mempengaruhi. Energi masing-masing osilator dirumuskan sebagai energi diskrit En = n2πh ωE = nℏωE. En adalah energi osilator, n adalah bilangan bulat 0, 1, 2, 3 dan seterusnya, h adalah tetapan planck dan ωE adalah frekuensi sudut dari setiap osilator. Pada tingkat dasar n = 0, energi osilator E0 = 0. Tingkat berikutnya n = 1, 2 dan seterusnya. Sesuai dengan persamaan energi diskrit diatas, perbedaan energi antar tingkat adalah hω. Einstein merumuskan bahwa sebaran energi osilator mengikuti rumusan distribusi Boltzman. Sebaran energi osilator untuk harga energi yang diperkenankan dirumuskan sebagai berikut :
f(En) ∝ exp(− En kBT)
Persamaan diatas menyatakan kebolehjadian keadaan dimana energinya dapat ditempati. Pada keseimbangan termal, energi rata-rata osilator dengan menggunakan sebaran distribusi Boltzman dinyatakan oleh :
E̅ =∑ nℏωEexp(− nℏωE kBT ) ∞ n=1 ∑ exp(−nℏωE kBT ) ∞ n=1
20 E̅ = ℏωE
exp(ℏωE kBT) − 1
Selanjutnya, untuk satu mol osilator tiga-dimensi memiliki energi dalam : E = 3NAE̅ = 3NAℏωE
exp(ℏωE kBT) − 1
Dengan menggunakan persamaan untuk kapasitas panas Sehingga kapasitas panasnya : CV= dE dT Sehingga CV = d( 3NAℏωE exp(ℏωE kBT) − 1 ) dT CV= 3R (ℏωE kBT) 2 exp(ℏωk E BT) {exp(ℏωE kBT) − 1} 2
Dalam model Einstein, didefinisikan suhu karakteristik Einstein ( ΘE ) yang dirumuskan sebagai ΘE ≡ ℏωE
kB, sehingga persamaan CV dapat dituliskan kembali menjadi
CV= 3R ( ΘE T) 2 exp(ΘE T ) {exp(ΘE T ) − 1} 2
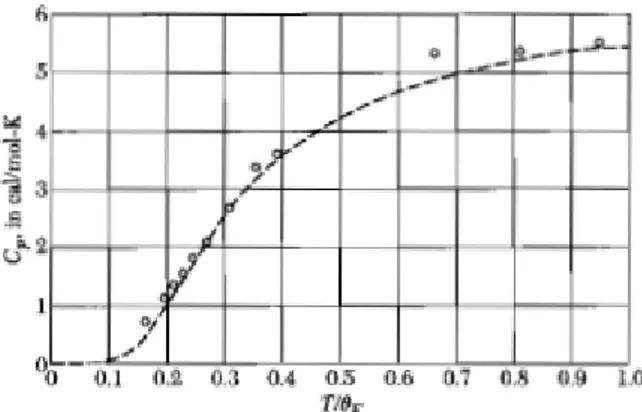
NilaiCV menurut persamaan ini dirumuskan sebagai fungsi dari suhu. Hal ini akan menghasilkan kurva yang secara kualitatif mendekati kurva eksperimen dalam Gambar 4.1. Untuk suhu yang sangat tinggi, ΘTE ≪ 1 atau ΘTE → 0, maka CV ≈ 3R. Hasil pada suhu tinggi sesuai dengan rumusan klasik Dulong-Petit dan sesuai pula dengan hasil percobaan. Untuk T → 0 maka CV→ 0. Hasil percobaan untuk suhu mendekati 0, menghasilkan nilai kapasitas panas yang mendekati 0 pula.
Untuk T yang rendah, ΘTE≫ 1, maka
CV ≈ 3R (ΘE T) 2 exp(ΘE T ) {exp(ΘT )}E 2 ≈ 3R (ΘE T) 2 exp(−ΘE T)
21
Perhitungan nilai CV untuk suhu rendah ini tidak menghasilkan data yang sama dengan hasil percobaan. Hal ini menunjukkan model perumusan CV menurut Einstein masih perlu perbaikan konsep.
Gambar 3.1 Kapasitas panas berdasarkan model Einstein (garis putus-putus). Titik-titik bulat merupakan data percobaan nilai kapasitas panas untuk intan (diamond) [A. Einstein,
Ann. Physik 22, 180 (1907)]
4.3 Kapasitas Panas Menurut Debye
Dalam model Einstein, atom-atom dianggap bergetar secara independen dari atom di sekitarnya. Debye kemudian merumuskan bahwa gerakan atom sebenarnya tidaklah independen melainkan saling berinteraksi satu atom dengan atom lainnya. Interaksi antar atom tersebut diibaratkan sebagai gelombang mekanik yang menjalar dalam medium zat padat sehingga dengan anggapan tersebut, atom-atom akan bergerak secara kolektif. Frekuensi getaran atom dianggap bervariasi dari ω = 0 sampai dengan batas tertentu yaitu ω= ωD. Batas frekuensi ωD disebut frekuensi potong Debye. Anggapan ini mengubah persamaan dasar Cv menjadi mode osilasi yang kapasitas panas bergantung pada frekuensi yang tersebar antara ω = 0 sampai ω= ωD.
Energi total getaran atom pada kisi menurut model Debye ini diberikan oleh ungkapan :
E = ∫ E̅(ω)g(ω) ωD
0
dω
E̅(ω)adalah energi rata-rata osilator yang merupakan fungsi dari frekuensi dalam selang antara ω = 0 dan ω = ωD, g(ω) adalah kerapatan moda getar (density of state) yang memenuhi persamaan
∫ωDg(ω)
22
Jika kerapatan moda getar berupa gelombang yang merambat dalam dua arah, maka rapat moda getar per satuan volume bahan untuk setiap selang frekuensi adalah
g(ω) = ω2 2π2v
φ3
v merupakan kecepatan fasa dari gelombang yang dapat dijabarkan dengan kecepatan logitudinal (vL) dan kecepatan transversal (vT), sehingga rapat moda getar per satuan volume bahan untuk setiap selang frequensi adalah
g(ω) = 3ω 2 2π2[ 1 vL3+ 2 vT3] Sehingga ∫ωDg(ω) 0 dω = 3NA= ∫ 3ω2 2π2[ 1 vL3 + 2 vT3] ωD 0 dω 3NA = 3D3 6π2 [ 1 vL3+ 2 vT3] Jika kedua ruas dikali dengan 3ω2
D 3 , maka 3NA3 ω2 D3 = 3D3 6π2 [ 1 vL3+ 2 vT3] 3 ω2 D3 9NA ω2 D3 = 3ω2 2π2 [ 1 vL3+ 2 vT3] = g(ω) Jadi bentuk baru dari g(ω) adalah
g(ω) = 9NAω
2
D3,
sehingga g(ω)d(ω) dapat pula dituliskan
g(ω)d(ω) = 9NA ω2
D3 d(ω), dengan mendefinisikan energi rata-rata osilator adalah
E̅(ω) = ℏ [ekℏBT− 1]
Energi total menjadi
E = ∫ E̅(ω)g(ω) ωD 0 dω E = 9NA ℏ D3 ∫ ω2 [ekℏBT− 1] ωD 0 dω
23
Kapasitas panas dengan rumusan Debye ini dituliskan CV= dE dT CV= 9NA ℏ2 D3k BT −2∫ ω4e ℏ kBT [ekℏBT− 1] 2 ωD 0 dω Dengan memisalkan x ≡kℏ BT dan D ≡ ℏD
kB yang disebut juga suhu Debye, maka
CV= 9NA ℏ2 D3k BT −2(kBT ℏ ) 5 ∫ x4ex [ex− 1]2 D T 0 dx CV= 9R ( T D) 3 ∫ x 4ex [ex− 1]2 D T 0 dx
Pada suhu tinggi yaitu T≫D, ex ≅ 1 + x, sehingga
∫ x4ex [ex− 1]2 D T 0 dx = ∫ x2 D T 0 dx =1 3( D T ) 3 CV= 9R (T D) 3 ∫ [exx4−1]ex2 D T 0 dx=9R ( T D) 3 1 3( D T) 3 = 3R
Dengan penyederhanaan persamaan tersebut maka nilai kapasitas panas adalah CV= 3R yang sesuai dengan model klasik Dulong-Petit maupun Einstein pada suhu tinggi.
Pada suhu rendah (T≪D), D akan mendekati tak hingga (D → ∞) sehingga CV∝ T3. Hasil ini sangat cocok dengan hasil percobaan baik untuk Cu, Ag, Pb, C maupun material lain yang diujicobakan.
4.4 Perambatan Gelombang dalam Kristal dan Konsep Fonon
Seperti telah dijelaskan pada Bagian 4.3 bahwa model dan teori yang dikemukakan oleh Debye tentang kapasitas panas suatu zat padat menghasilkan nilai yang sesuai dengan hasil percobaan. Model yang dikembangkan oleh Debye terutama menyangkut pada getaran termal atom-atom dalam kristal merupakan getaran kolektif yang saling berhubungan satu dengan yang lainnya. Sebaran energi yang digunakan untuk
24
menganalisis getaran kolektif tersebut dihitung dengan menggunakan distribusi Bose-Einstein. Konsep kapasitas panas pada suatu zat padat atau kristal yang dikemukakan pada Bagian 4.1 sampai 4.3 ini lebih menonjolkan pada konsep getaran atau energi yang bersumber dari kalor atau panas (suhu) yang tersimpan dalam kristal. Konsep getaran kisi pada kristal dapat pula disebabkan oleh hal lain seperti gelombang elektromagnetik ataupun gelombang suara. Namun demikian konsep getaran kisi pada kristal baik yang disebabkan panas (getaran termal) ataupun sebab lain adalah sama. Konsep-konsep getaran ini dapat menyebabkan terjadinya perambatan getaran yang digambarkan sebagai perambatan gelombang dalam kristal. Getaran kisi dan perambatannya dalam kristal memunculkan suatu istilah baru yaitu fonon.
Fonon adalah suatu paket energi yang menggambarkan pergerakan dari getaran (perambatan gelombang) dari suatu kisi yang bergetar dengan frekuensi yang sama yang ditinjau dari sudut pandang mekanika kuantum. Seperti telah diketahui, pada mekanika klasik, perambatan getaran dengan frekuensi yang sama hanya dipandang sebagai peristiwa perambatan gelombang biasa. Namun pada tinjauan mekanika kuantum, perambatan getaran biasa dipandang memiliki dualisme sifat yaitu gelombang (wave-like) dan partikel (particle-like). particle-like inilah yang merupakan inti darikonsep fonon. Bila dihubungkan dengan model Debye, energi fonon ini terkuantisasi dalam bentuk En= nℏωE
Dalam hal ini dapat dibayangkan bahwa rambatan gelombang mekanik atau gelombang suara identik sengan adanya aliran arus fonon yang membawa energi dan momentum dalam jumlah tertentu.
Jika membahas masalah perambatan fonon, akan sangat mudah membayangkan fonon sebagai suatu gas pada suatu ruang tertentu. Pada setiap daerah dalam ruang selalu terdapat fonon yang bergerak acak ke segala arah. Penggunaan model gas ini memungkinkan munculnya lintasan bebas rata-rata fonon dan tumbukkan antar fonon.
25
BAB 5
ELEKTRON BEBAS
Seperti telah dijelaskan pada Bab 2, sebuah kristal tersusun dari kisi dan basis yang merupakan atom baik berupa atom tunggal ataupun molekul. Secara umum setiap jenis atom mengandung elektron-elektron yang mengelilingi sebuah inti seperti yang dijelaskan dalam model atom Bohr. Elektron-elektron tersebut dapat dikatagorikan menjadi dua yaitu elektron yang terikat erat pada ikatan atom-atom dan elektron bebas yang lebih dikenal dengan nama elektron valensi. Elektron bebas ini dapat bergerak secara bebas di seluruh kristal. Elektron yang bebas bergerak tersebut dinamakan elektron bebas. Sedangkan elektron yang tidak dapat bergerak bebas, yaitu elektron yang terikat dalam atom maupun ikatan antar atom disebut elektron terikat atau elektron domestik.
Keberadaan elektron bebas pada sebuah kristal menjadi salah satu faktor yang harus dipertimbangkan pada perhitungan kapasitas panas suatu zat padat. Teori-teori kapasitas panas yang dibahas pada Bab 4 sesungguhnya membahas kapasitas panas zat padat yang tergolong non logam dimana elektron-elektron yang menyusun atom-atomnya secara umum tergolong ke dalam elektron domestik. Untuk golongan zat padat yang digolongkan sebagai logam dimana elektron bebas sangat dominan sebagai penyusun kristal tersebut, teori perhitungan kapasitas panasnya harus dirumuskan ulang dengan mempertimbangkan keberadaan elektron bebas tersebut.
Seperti halnya pada pembahasan kapasitas panas pada Bab 4, keberadaan elektron bebas yang mempengaruhi berbagai sifat suatu kristal akan ditinjau berdasarkan teori klasik yang disebut elektron bebas klasik dan teori kuantum yang disebut elektron bebas terkuantisasi.
5.1 Elektron Bebas Klasik
Besarnya kapasitas panas pada suhu tinggi atau suhu ruang yagn diungkapkan baik oleh Dulong-Petit, Einstein maupun oleh Debye adalah Cv = 3R. Asumsi yang digunakan untuk mendapatkan persamaan tersebut adalah bahwa getaran kisi dalam suatu krisal memiliki energi termal tertentu. Paket energi dari getaran kisi yang terkuantisasi dikenal dengan nama fonon. Nilai Cv yang dijabarkan oleh Dulong-Petit, Einstein dan Debye tersebut
26
sebenarnya belum memasukkan nilai energi termal yang tersimpan dalam gerak termal elektron bebas. Atau dengan kata lain Cv tersebut hanya memperhitungkan kehadiran fonon sehingga kapasitas panas logam dengan memperhitungkan kehadiran elektron dan fonon dapat ditulis sebagai berikut : CV= CV_fonon+ CV_elektron
Cv yang berasal dari kontribusi fonon pada suhu tinggi adalah CV_fonon = 3R . Sedangkan Cv yang berasal dari kontribusi elektron dapat dijabarkan dari energi rata-rata elektron pada suhu T dengan jumlah elektron valensi yang disumbangkan oleh satu atom pada kristal dilambangkan oleh Zv dituliskan dengan persamaan sebagai berikut:
E = Zv3
2NAkBT = 3 2ZvRT
CV_elektron dapat dirumuskan sebagai berikut CV_elektron =dEdT= 32ZvR.
Sehingga Cv yang berasal dari kontribusi fonon dan elektron adalah
CV= CV_fonon+ CV_elektron= 3R +3
2RZv = (3 + 3
2Zv ) R
Nilai Cv tersebut menunjukkan bahwa kapasitas panas suatu kristal yang memiliki elektron bebas (yang dapat dikatagorikan sebagai logam) 50 % lebih tinggi dari kristal yang tidak memiliki elektron bebas (yang dapat dikatagorikan sebagai isolator). Pada kenyataanya, pada suhu tinggi atau suhu ruang, kapasitas panas suatu logam tidaklah berharga satu setengah kali dari harga kapasitas panas bahan isolator melainkan hampir sama berharga 3R. Hal ini menunjukkan bahwa kajian kapasitas panas klasik tersebut belum tepat menggambarkan kontribusi dari elektron bebas terhadap kapasitas panas suatu logam.
5.2 Elektron Terkuantisasi
Untuk menjelaskan fenomena fisika khususnya konsep kapasitas panas yang dihubungkan dengan keberadaan elektron bebas dalam kristal, konsep fisika kuantum sangat diperlukan dijabarkan secara jelas dan terperinci. Dua konsep kuantum yang sangat penting dalam pembahasan elektron bebas dalam suatu kristal atau zat padat adalah konsep kuantisasi energi elektron bebas dan konsep larangan pauli yang dapat membedakan satu jenis elektron dengan elektron lainnya berdasarkan bilangan kuantum yang melekat pada setiap elektron tersebut.
27
Elektron bebas yang secara kuantum dipandang memiliki sifat dualistic sebagai benda dan gelombang dapat bebas bergerak dalam seluruh volume kristal sebagai gelombang deBroglie. Syarat batas Born-von Karmann yang harus dipenuhi adalah sebagai berikut:
eikxL+ eikyL+ eikzL= 1
L adalah rusuk kristal dan kx, ky, kz adalah vektor propagasi gelombang pada arah x, y dan z. Masing-masing vektor propagasi tersebut dapat dijabarkan sebagai:
kx = nx2πL, ky = ny2πL, kz= nz2πL, dengan nx, ny, nz adalah bilangan 0, ±1, ±2, …
Energi elektron dalam ruang k dapat dituliskan sebagai: En = ℏ2 2m0(kx 2+ k y 2+ k z 2)
m0 adalah massa elektron bebas.
Jumlah keadaan elektron persatuan volume dengan energi antara E dan (E + E) adalah
g(E)∆E = 1 2π2( 2m0 ℏ2 ) 3 2 E12 ∆E
Jadi rapat keadaan elektron adalah
g(E) = 1 2π2( 2m0 ℏ2 ) 3 2 E12
Konsep rapat elektron ini adalah salah satu konsep penting ketika akan merumuskan kapasitas panas yang berasal dari kontribusi elektron bebas.
Larangan Pauli
Larangan Pauli menyatakan bahwa tidak ada dua atau lebih elektron dalam satu sistem memiliki energi dan bilangan kuantum yang tepat sama. Larangan Pauli dapat dijabarkan dengan tepat oleh statistic Fermi Dirac yaitu
f(E) = 1
1 + exp(E − EF kBT )
28
Statistik Fermi Dirac ini memunculkan konsep energi Fermi yang merupakan jumlah energi yang dimiliki suatu kristal pada keadaan 0 K.
Pada T = 0 K, f (E) = 1. Sedangkan pada T selain 0, nilai dapat ditutunkan dari persamaan di atas.
Jumlah elektron per satuan volume pada T = 0 dituliskan sebagai
n = 1 3π2( 2m0EF0 ℏ2 ) 3 2
Energi total yang dimiliki elektron pada T = 0 dapat dituliskan sebagai
E = ∫ g(E)f(E Ek 0 )dE Karena g(E)dE = 1 2π2( 2m0 ℏ2 ) 3 2 E12 dE, Maka E = ∫ 1 2π2( 2m0 ℏ2 ) 3 2 E12 dE Ek 0 = 1 5π2( 2m0 ℏ2 ) 3 2 E F0 5 2
Dengan mensubstitusikan nilai n =3π12(2m0EF0
ℏ2 ) 3
2 maka akan diperoleh E =3
5nEF0
Dari persamaan tersebut dapat terlihat bahan elektron dengan harga energi sekitar EF dapat berperan pada analisis CV_elektron. Dalam analisis selanjutnya perlu tinjauan lebih detail tentang fungsi Fermi-Dirac tentang energi. Hal ini disebabkan dalam bahasan energi kinetik elektron bebas fungsi Fermi Dirac terdapat dalam persamaan energi kinetik yang dituliskan dengan persamaan sebagai berikut:
Ee= ∫ (1 − f(E))g(E)(EF− E)dE + ∫ f(E)g(E)(EF− E)dE ∞ Ek Ek 0 CV_elektron = dEe dT = ∫ (− dF dT)g(E)(EF− E)dE + ∫ dF dTg(E)(EF− E)dE ∞ Ek Ek 0
29 CV_elektron = ∫(dF
dT)g(E)(E − EF)dE ∞
0
Pada suhu rendah kEBT
F ≪ 1 m dF dT= E − EF kBT2 eE−EkBTF (1 + eE−EkBTF)2
Dengan memisalkan x =E−EF
kBT maka persamaan kapasitas panas hasil kontribusi elektron
bebas dapat disederhanakan menjadi CV_elektron= g(E)kB2T ∫ x 2ex (ex+1)2dx ∞ −∞ = π2 3 g(E)kB 2T=π2kB2 2EF T
Sehingga CV= CV_fonon+ CV_elektron = BT3+ AT, dengan A dan B adalah konstanta yang diperoleh dari perumusan CV_elektron dan CV_fonon
5.3 Perilaku Elektron Bebas dalam Logam
Walaupun model elektron bebas klasik tidak dapat merumuskan dengan benar konsep kapasitas panas, namun model ini berhasil menjelaskan pengaruh keberadaan elektron bebas tersebut terhadap sifat listrik seperti nilai tahanan jenis listrik (konduktivias termal) dari bahan yang memiliki elektron bebas di dalam kristal pembentuknya.
Elektron bebas yang bergerak sepanjang sebuah bahan yang memiliki panjang L dan luas penampang A akan memunculkan konsep arus listrik (I). Dalam bahan yang mengalir alru listrik akan timbul medan listrik E. Arus listik yang mengalir dalam suatu penampang tersebut memunculkan nilai kerapatan yang dituliskan sebagai J = AI
Hukum Ohm yang menyatakan memperlihatkan hubungan antara kerapatan arus listrik dengan medan listrik yang timbul dituliskan dalam bentuk persamaan:
J = σ. E
σ adalah besaran yang menunjukkan konduktivitas dari bahan. Besarnya konduktivitas adalah berbanding terbalik dengan nilai hambatan (resistivitas) : σ = 1ρ.
30
Nilai hambatan suatu bahan sangat ditentukan geometri dari bahan itu sendiri. Resistivitas merupakan besaran pembanding antara nilai resistansi dengan faktor geometri dari suatu bahan. R = ρLA
Resistivitas Listrik
Seperti telah dijelaskan pada bagian sebelumnya bahwa resistivitas listrik berbanding terbalik dengan nilai konduktivitasnya. Hambatan yang memunculkan nilai resistivitas dapat disebabkan oleh dua faktor yaitu pertama adanya vibrasi kisi yang menyebabkan tumbukan antara elekton bebas dengan fonon, kedua adanya ketidakmurnian (impuritas). Jadi nilai resistivitas dapat dituliskan sebagai penjumlahan antara kedua komponen tersebut. = f + i
Pada suhu rendah (T<<) nilai resistivitas hanya bergantung pada nilai impuritas bahan.
Gambar 5.1 memperlihatkan grafik ketergantungan nilai resistivitas terhadap suhu untuk bahan logam dengan tingkat ketidakmurnian tertentu. Resistivitas menurun seiring dengan menurunnya suhu yang menunjukkan kontribusi dari fonon juga menurun. Pada suhu 0 K, hanya kontribusi dari ketidakmurnian yang berpengeruh pada nilai resistivitas.
Gambar 5.1: Grafik ketergantungan nilai resistivitas terhadap suhu untuk bahan logam dengan tingkat ketidakmurnian tertentu.
31
BAB 6
TEORI PITA ENERGI
Model elektron bebas yang dijelaskan pada Bab 5, dapat memberikan penjelasan yang baik terhadap kapasitas panas dan hambatan listrik bahan logam. Namun demikian, seiring dengan perkembangan teknologi dan penemuan berbagai bahan yang memiliki sifat listrik yang berbeda-beda, model ini tidak memberikan penjelasan yang jelas terhadap berbagai hasil percobaan seperti perbedaan besar konduktivitas atau resistivitas pada logam (konduktor), semikonduktor dan isolator. Nilai konduktivitas bahan berada pada rentang 108 -1m-1 untuk jenis konduktor sampai dengan 10-16 -1m-1 untuk bahan isolator. Rentang yang cukup lebar dari nilai resisivitas ini perlu dikaji lebih detail dan tidak bisa diterangkan hanya dengan model elektron bebas seperti pada Bab 5. Pada bab ini akan dibahas beberapa keadaan elektron dalam kristal yang dapat menjelaskan berbagai keadaan zat padat. Model atau teori yang paling cocok untuk menjelaskan rentang yang cukup lebar dari nilai resistivitas bahan disebut teori pita energi.
6.1 KONSEP PITA ENERGI
Hal yang paling sederhana yang menyebabkan model elektron bebas tidak dapat menjelaskan rentang yang lebar dari nilai resistivitas bahan adalah dikarenakan penyederhanaan tentang keadaan atom/kristal beserta perilaku elektron valensi. Menurut model elektron bebas, atom/kristal tidak memiliki energi potensial yang dapat menghalangi pergerakan elektron valensi sehingga elektron valensi ini bebas bergerak dalam kristal dan hanya dibatasi oleh permukaan kristal itu sendiri. Tetapi pada kenyaataannya, energi potensial pada suatu atom/kristal merupakan fungsi posisi elektron yang dapat bernilai 0 sampai dengan tak hingga tergantung dari jenis bahannya. Artinya, nilai energi potensial ini bergantung pada posisi elektron tersebut di dalam kristal diukur relatif terhadap inti atom. Di samping itu, energi potensial itu juga mungkin timbul akibat adanya elektron-elektron konduksi lainnya di dalam kristal itu. Jadi keadaan energi potensial yang sebenarnya di dalam kristal adalah sangat komplek. Oleh karena itu, beberapa pendekatan dilakukan untuk menjelaskan perilaku dan keadaan elektron bebas dalam kristal.
Salah satu pendekatan untuk menjelaskan perilaku dan keadaan elektron bebas dalam kristal itu adalah bahwa energi potensial dari atom-atom dalam kristal merupakan fungsi yang periodik dengan perioda sebesar konstanta tertentu. Asumsi ini juga
32
menganggap bahwa energi potensial akibat elektron-elektron lainnya dalam kristal selain elektron valensi adalah konstan. Energi potensial yang periodik itu merupakan landasan dari teori pita energi dalam zat padat. Selanjutnya, perilaku elektron di dalam potensial ini dijelaskan menjabarkan fungsi gelombang elektron dengan menggunakan pendekatan satu elektron. Fungsi gelombang ini mengambarkan kemungkinan gerak elektron di dalam energi potensial listrik periodik tertentu yang kemudian dapat secara langsung diketahui daerah-daerah yang dapat diduduki oleh elektron dan yang dilarang untuk diduduki oleh elektron ini. Daerah-daerah tersebut kemudian digambarkan sebagai pita-pita energi dan celah energi yang masing-masing menggambarkan daerah yang dapat diduduki dan tidak dapat diduduki oleh elektron.
Untuk memahami teori dan konsep pita energi, perlu dipelajari teorema dan fungsi Bloch, model Kronig-Penney dan model elektron hampir bebas.
6.2 TEOREMA DAN FUNGSI BLOCH
Salah satu bagian penting dari teori pita energi yang dapat menyempurnakan bahasan perilaku elektron dalam kristal adalah munculnya besaran energi potensial yang dapat membatasi pergerakan dari elektron. Felix Bloch adalah ilmuwan swiss yang mencetuskan gagasan adanya potensial periodik dan memodifikasi fungsi gelombang elektron bebas dengan fungsi potensial periodik tersebut. Bloch menyelesaikan persamaan gelombang Schrodinger dengan memasukkan syarat bagi fungsi potensial U(𝑟⃗)yang memiliki sifat periodik seperti yang terdapat dalam kristal.
Persamaan Schrodinger untuk elektron yang bergerak dalam energi potensial yang nilainya tetap (U0) dan satu dimensi dapat ditulis dalam bentuk persamaan berikut:
d2(x) dx2 +
2m
2
(E − U0)(x) = 0
Sedangkan jika terdapat potensial periodik U(𝑟⃗)seperti yang digagas Bloch, maka bentuk persamaan Schrodinger untuk satu elektron yang berada dalam potensial periodik tersebut pada arah 𝑟⃗ adalah sebagai berikut:
d2(𝑟⃗) dr2 + 2m 2 (E − 𝑈(𝑟⃗))(𝑟⃗) = 0 [− 2 2m d2 dr2+ 𝑈(𝑟⃗)](𝑟⃗) = E(𝑟⃗)
33
Bloch menunjukkan bahwa solusi persamaan Schrodinger adalah fungsi gelombang yang memiliki periodisitas kisi 𝑢(𝑟⃗) yang dituliskan sebagai berikut:
(𝑟⃗) = 𝑢(𝑟⃗)eik𝑟⃗
fungsi gelombang tersebut dinamakan fungsi Bloch. Fungsi tersebut harus memenuhi syarat batas periodik yaitu:
𝑢(𝑟⃗ + a) = 𝑢(𝑟⃗)
dan
(𝑟⃗ + a) =(𝑟⃗)
Dengan a adalah vektor translasi kisi. Ini berarti fungsi gelombang harus sama pada titik-titik yang secara fisis adalah ekivalen dalam kisi kristal. Faktor eik𝑟⃗ dalam fungsi Bloch adalah merupakan bentuk persamaan gelombang datar, dengan k adalah vektor gelombang.
6.3 MODEL KRONIG - PENEY
Kronig- Penney memperkenalkan model sumur potensial kotak yang merupakan potensial periodik yang dapat menyelesaikan persamaan Schrodinger dalam satu dimensi berikut:
Gambar 6.1 Model sumur potensial kotak yang digagas oleh Kronig-Penney [C. Kittle, Introduction to Solid
34
Sumur potensial persegi dengan Uo = 0 memiliki lebar a, dipisahkan oleh penghalang energi yang lebarnya b dan tinggi Uo. Luas penghalang b Uo, berubah dari tak berhngga sampai nol. Sebagian dari fungsi gelombang bergetar dalam kolam dan meluruh secara eksponensial dalam penghalang.
Persamaan Schrodinger umum dapat dibagi menjadi dua bagian: d2(x) dx2 + 2m 2 (E − U0)(x) = 0 Untuk daerah 0 < x < a d2(x) dx2 + 2m 2 (E)(x) = 0 Untuk daerah -b < x< 0 d2(x) dx2 + 2m 2 (E − U0)(x) = 0
Kedua persamaan di dua daerah tersebut berulang secara periodik diseluruh x. Untuk memudahkan penulisan, dua buah besaran rill yang memiliki dimensi vektor gelombang di lambangkan oleh dan sebagai berikut:
2 = 2m 2 E 2 = 2m 2 (U0− E)
Sehingga persamaan Schrodinger untuk dua daerah pada sumur potensial tersebut adalah sebagai berikut: Untuk daerah 0 < x < a d2(x) dx2 +2(x) = 0 Untuk daerah -b < x< 0 d2(x) dx2 −2(x) = 0
35
Bentuk penyelesaian dari persamaan ini adalah sebagai berikut:
Untuk daerah 0 < x < a
= 𝐴eix+ 𝐵e−ix Untuk daerah -b < x< 0
= 𝐶eix+ 𝐷e−ix
Selanjutnya, dengan membuat asumsi penyederhanaan Uo → ∞ dan b→ 0 sehingga hasil kali dari Uob menjadi tertentu dan dapat disesuaikan dan periodisitas kisi menjadi a.
Dengan menggunakan syarat batas berikut :
(−b < x < 0) =(a < x < a + b)
Maka diperoleh
A + B = 𝐶 + 𝐷
i(A − B) =(C − D)
Pada x = a, maka dapat dirumuskan persamaan pada batas sumur potensial a dan –b sebagai berikut:
𝐴eia+ 𝐵e−ia = (𝐶e−b+ 𝐷eb)eik(a+b)
𝑖(𝐴eia− 𝐵e−ia) =(𝐶e−b− 𝐷eb)eik(a+b)
Sehingga dapat dutuliskan kembali
[2− 2
2] sinhb sina + coshb cosa = cos k(a + b)
Dengan penyederhanaan kasus Uo→ ∞, b→ 0 dan >> , b << 1 serta P =2 ba2 diperoleh bentuk persamaan:
P
36
Dengan k = ±πa dapat digambarkan bentuk grafik untuk menggambarkan persamaan tersebut sebagai berikut:
Gambar 6.2 Grafik fungsi persamaan Pasina + cosa = cos ka dari model sumur potensial kotak yang digagas oleh Kronig-Penney [C. Kittle, Introduction to Solid State Physics, pp 170] Nilai dari cos ka yang dapat diselesaikan adalah cos ka = ±1, sehingga persamaaan untuk grafik yang memiliki niai lebih dari 1 atau kurang dari -1, maka grafik tersebut tidak akan memiliki bentuk penyelesaian. Dengan kata lain daerah pada Gambar 6.2 yang berada diatas 1 atau di bawah -1 adalah daerah terlarang yang kemudian disebut sebagai band gap. Sedangkan daerah diantara 1 dan -1 adalah daerah yang diperbolehkan terdapat elektron didalamnya.
6.4 MODEL ELEKTRON HAMPIR BEBAS
P
asina + cosa
37
BAB 7
BAHAN SEMIKONDUKTOR
Semikonduktor merupakan material zat padat yang memiliki harga resistivitas antara 10-2 – 109 Ω.cm. Terdapat dua jenis tipe semikonduktor yaitu semikonduktor intrinsik dan semikonduktor ekstrinsik. Semikonduktor intrinsik merupakan semikonduktor murni tanpa atom pengotor,sedangkan semikonduktor ekstrinsik merupakan semikonduktor yang telah diberi atom pengotor. Pemberian atom pengotor pada semikonduktor dapat menyebabkan munculnya dominasi muatan pembawa.Bila konsentrasi elektron lebih banyak dari konsentrasi hole maka akan terbentuk semikonduktor tipe-n demikian pula sebaliknya bila hole lebih banyak dari elektron maka akan terbentuk semikonduktor tipe-p.
Material Semikonduktor
Bila ditinjau dari sifat listriknya, suatu bahan zat padat dapat dikelompokan menjadi beberapa bagian:
1. Bahan isolator yang memiliki harga resistivitas antara 1014 – 1022 Ω.cm 2. Bahan semikonduktor yang memiliki harga resistivitas antara 10-2 – 109 Ω.cm 3. Bahan konduktor yang memiliki harga resistivitas 10-5 Ω.cm
Salah satu cara untuk menunjukkan perbedaan antara konduktor, semikonduktor, dan isolator yaitu dengan penggambaran tingkat-tingkat energi dalam bentuk pita energi untuk elektron-elektron dalam bahan. Penggambaran pita energi untuk masing-masing material tersebut ditunjukkan pada gambar 1 berikut.
38
Ketiga jenis bahan tersebut banyak dimanfaatkan untuk bahan baku pembuatan komponen- komponen elektronik, misalnya bahan isolator banyak digunakan sebagai lapisan dielektrik pada kapasitor metal-oksida-semikonduktor, bahan semikonduktor digunakan sebagai lapisan aktif pada komponen-komponen elektronik maupun komponen optoelektronik sedangkan konduktor sering digunakan untuk pembuatan kontak pada komponen elektronik.
Setiap bahan semikonduktor memiliki karakteristik fisis tertentu sehingga dalam aplikasinya harus merujuk pada karakteristik fisisnya tersebut sebagai contoh untuk aplikasi sensor sinar ultraviolet yang tingkat sensitifitasnya tinggi tentu kita harus memilih bahan yang memiliki energi gap yang cukup lebar seperti semikonduktor galium nitrida dengan energi gap sekitar 3,4 eV. Kita bisa juga menggunakan bahan silikon untuk aplikasi sensor ultraviolet namun divais ini kurang sensitif dibandingkan bahan galium nitrida.
Pada awal perkembangannya bahan semikonduktor yang pertama kali dieksplorasi adalah Germanium, namun sampai saat ini bahan semikonduktor yang banyak diteliti untuk bahan baku pembuatan divais elektronik maupun optoelektronik adalah Silikon dengan pertimbangan bahan silikon cukup melimpah di alam ini dan harganya relatif murah. Selain silikon material lain yang banyak dipelajari dan diteliti adalah material paduan dari golongan II-VI atau III-V dalam tabel periodik (gambar 1) baik binary (paduan 2 unsur) maupun ternary (paduan 3 unsur) seperti ZnO, GaN, AlN, InN, GaAs, GaSb, AlGaN, AlGaSb, GaNAs dan sebagainya dimana material-material paduan tersebut masing-masing memiliki ciri khas dan keunikan tersendiri baik dari sifat listrik maupun sifat optiknya yang aplikasinya dapat disesuaikan dengan karakteristik fisisnya masing-masing.
39
Gambar 2 Unsur-unsur yang banyak digunakan sebagai bahan semikonduktor
Model Ikatan atom pada bahan Semikonduktor
Kristal semikonduktor tersusun dari atom-atom yang letaknya saling berdekatan dan saling berikatan satu sama lain membentuk suatu ikatan kristal yang disebut ikatan kovalen. Sebagai ilustrasi dari model ikatan kristal tersebut, di bawah ini digambarkan terbentuknya ikatan kristal pada bahan Silikon. Gambar 3a menunjukan ilustrasi ikatan kovalen dari atom Silikon pada kondisi temperature nol Kelvin, untuk kasus ini setiap atom Silikon menyumbangkan satu elektron untuk tiap pasangan ikatan kovalen. Apabila kristal semikonduktor tersebut diberi energi termal dengan kata lain temperaturnya dinaikan, maka penambahan energi termal tersebut dapat menyebabkan putusnya ikatan kovalen, hal ini dapat membangkitkan pasangan elektron-hole dimana elektron tersebut dapat bebas dari keadaan valensi ke keadaan konduksi sedangkan kekosongan yang ditinggalkan elektron akan menjadi hole seperti nampak pada gambar 3b.
40 (a)
(b)
Gambar 3 Gambaran ikatan kovalen atom silikon pada kondisi (a) temperatur nol Kelvin, (b) pada temperatur di atas nol Kelvin
41
Model Pita Energi Semikonduktor
Setiap atom penyusun kristal semikonduktor memiliki sejumlah elektron valensi pada kulit terluarnya yang menempati keadaan valensi (gambar 4b), keadaan elektron valensi ini memiliki tingkat energi yang besarnya EV. Elektron valensi ini berkontribusi pada pembentukan ikatan kovalen antara atom-atom penyusun kristal semikonduktor. Sedangkan keadaan dimana elektron sudah terbebas dari ikatan kovalen disebut keadaan konduksi dengan tingkat Energi EC (gambar 4a). Apabila kristal semikonduktor tersebut temperaturnya dinaikan maka akan ada penambahan energi termal yang menyebabkan terputusnya ikatan kovalen yang terbentuk. Pemutusan ikatan kovalen ini akan menghasilkan elektron bebas yang sudah dalam keadaan konduksi dengan tingkat energi EC. Pada gambar 4c diilustrasikan keadaan elektron konduksi dimana setelah terjadinya pemutusan ikatan kovalen, elektron valensi pada tingkat energi EV akan berpindah kekeadaan konduksi dengan tingkat Energi EC. Selisih antara tingkat energi konduksi dengan tingkat energi valensi ini dinamakan energi celah pita (energi gap) dimana energi gap tersebut merupakan energi minimal yang
dibutuhkan untuk memutuskan ikatan kovalen pada kristal semikonduktor.
(a) (b) (c) Gambar 4.
42 Tabel 1 Energi gap bahan semikonduktor
Tipe Semikonduktor
Berdasarkan pergerakan pembawa muatan dalam semikonduktor ada tiga cara yaitu:
1. Eksitasi elektron (semikonduktor instrinsik), 2. Impurity (Semikonuktor ekstrinsik), dan 3. Semikonduktor nonstoikiometri.
1.Eksitasi Elektron (semikonduktor intrinsik).
Dalam semikonduktor besar celah pita terlarang (band gap) sedemikian rupa sehingga elektron dapat melompati band gap dari pita valensi ke pita konduksi dengan energi minimum yang dibutuhkan sama dengan energi gap.
43
Gambar 5. Energi gap dalam golongan IV (skematik)
Pada Gambar 5 terlihat energi gap untuk C (intan), Si, Ge, dan Sn. Jumlah pembawa muatan dalam bahan tersebut dalam satu golongan semakinnkebawah akan semakin meningkat, akibatnya konduktivitas pun akan meningkat seperti yang ditunjukan pada Tabel 2. konduktivitas ini merupakan sifat dari bahan dan tidak ditimbulkan oleh ketidakmurnian (impurity). Oleh karena itu disebut semikonduktor intrinsic.
Tabel 2. Energi gap dalam semikonduktor elementer.
Elemen Enegi gap (eV) T=20oC Konduktivitas (T=20oC C (intan) Si Ge Sn (kelabu) 6 1.1 0.7 0.1 < 10-16 5 x 10-4 2 106
Ketiga unsur dalam golongan IV tersebut (Si, Ge, dan Sn) merupakan satu- satunya unsur yang bersifat semikonduktor dan memiliki struktur Kristal yang sama. Selain itu ada pula senyawa campuran golongan III ( B, Al, GA, In) dengan golongan V (N, P, As, Sb) memiliki sifat sebagai semikonduktor dan memiliki srtruktur yang sama misalnya SiC,AlSb, GaN,InAs, Zns dan contoh senyawa lainnya (van Vlack, 1994).
Pada material semikonduktor khususnya semikonduktor intrinsik, eksitasi elektron terjadi melewati bandgap dari pita valensi ke pita konduksi. Contohnya pada pembentukan ikatan atom Si (silikon). Senyawa silikon memiliki band gap sebesar 1,12 eV . Jika senyawa silikon tersebut diberi energi termal atau diberi energi cahaya yang lebih besar atau sama dengan 1,12 eV, maka elektron dari tingkat valensi akan tereksitasi ke tingkat konduksi.
44
Gambar 6. Diagram pita energi pada silikon
2. Impurity (semikonduktor ekstrinsik).
Ketidakmurnian dalam semikonduktor akan mempengruhi jumlah pembawa muatan dalam semikonduktor sehingga akan mengubah
konduktivitasnya. Pemberian pengotor (dopant) dapat menyebabkan munculnya tingkat energi baru dalam energi gap. Perubahan tingkat energi ini dapat digolongkan menjadi dua bagian tingkat energi yaitu tingkat akseptor dan tingkat donor. Tingkat akseptor merupakan tingkat energi yang muncul di ujung atas tingkat valensi, karena dapat menerima elektron yang meninggalkan pita valensi. Sedangkan tingkat donor merupakan tingkat energi yang muncul di ujung bawah pita konduksi, karena tingkat ini dapat memberikan elektron ke tingkat konduksi.
Gambar 7. Pemberian dopant pada struktur band gap semikonduktor memunculkan tingkat energi baru yaitu tingkat donor dan tingkat akseptor
Adanya pengotor (dopan) dapat mengubah nilai konduktivitas dan resistivitasnya.
45
Jika ke dalam semikonduktor transisi (intrinsik) ditambahkan dengan atom dari golongan V, maka dalam semikonduktor tersebut akan terdapat elektron yang berlebih, sehingga elektron yang berlebih tersebut akan bertindak sebagai donor contohnya adalah SiP, GeAs, ZnO dan yang lainnya. Oleh karena itu semikonduktor yang memiliki elektron yang berlebih dikenal dengan semikonduktor tipe-n.
Gambar 8. semikonduktor tipe-n
Elektron bebas sebagian besar terjadi karena doping, dan sebagian kecil lainnya bersama hole karena generation akibat agitasi termal. Elektron bebas menjadi pembawa muatan mayoritas dan hole sebagai pembawa muatan minoritas.
Semikonduktor tipe P
Akan tetapi sebaliknya jika ke dalam semikonduktor transisi ditambahkan dengan atom dari golongan III, hal itu akan mengakibatkan dalam semikonduktor menjadi kekurangan elektron sehingga membuat semikonduktor menjadi lebi posistip contohnya adalah SiB, GeAl dan yang lainnya. Semikonduktor jenis ini dikenal dengan semikonduktor tipe-p .
Gambar 9. semikonduktor tipe-p