PEDOMAN PEMBINAAN
PEDAGANG BESAR FARMASI
DIREKTORAT BINA PRODUKSI DAN DISTRIBUSI KEFARMASIAN DIREKTORAT JENDERAL BINA KEFARMASIAN DAN ALAT KESEHATAN
KATA PENGANTAR
Puji syukur kita panjatkan ke hadirat Tuhan Yang Maha Esa bahwa Pedoman Pembinaan Pedagang Besar Farmasi ini telah berhasil disusun oleh Direktorat Bina Produksi dan Distribusi Kefarmasian, Direktorat Jenderal Bina Kefarmasian dan Alat Kesehatan, Kementerian Kesehatan Republik Indonesia.
Pedoman Pembinaan ini dilaksanakan berdasarkan amanat PP 72 tahun 1998 tentang Pengawasan Sediaan Farmasi dan Alat Kesehatan.
Penyusunan Pedoman ini berdasarkan Peraturan Pemerintah Nomor 38 Tahun 2007 tentang Pembagian Urusan Pemerintahan antara Pemerintah , Pemerintah Daerah Provinsi dan Pemerintah Daerah Kabupaten/Kota dan berdasarkan Keputusan Menteri Kesehatan RI Nomor 1148/MENKES/PER/VI/2011 tentang Pedagang Besar Farmasi dan Cara Distribusi Obat yang Baik (CDOB).
Pedoman ini diharapkan dapat digunakan sebagai acuan bagi petugas di Pusat, Dinas Kesehatan Provinsi, Dinas Kesehatan Kabupaten/Kota dan pelaku usaha di bidang sarana produksi dan distribusi kefarmasian.
Buku pedoman ini masih sangat jauh dari sempurna, sehingga masih sangat memungkinkan untuk dilakukan revisi atau perbaikan.
Terima kasih kami sampaikan kepada seluruh pihak yang telah berkontribusi dalam penyusunan buku ini. Kritik dan saran kami harapkan untuk perbaikan buku ini mendatang.
Jakarta, 2011
Direktur Bina Produksi dan Distribusi Kefarmasian
ii KATA SAMBUTAN
Assalamu’alaikum Wr.Wb.
Puji syukur kita panjatkan ke hadirat Allah SWT, karena atas rahmat dan karunia-Nya, Pedoman Pembinaan Pedagang Besar Farmasi ini dapat diselesaikan.
Pedoman Pembinaan Pedagang Besar Farmasi ini merupakan acuan dalam melakukan pembinaan sebagai salah satu upaya yang dilakukan oleh Kementerian Kesehatan untuk melindungi masyarakat terhadap peredaran obat yang tidak memenuhi persyaratan keamanan, khasiat/manfaat dan mutu.
Pedoman ini saya harapkan dapat digunakan sebagai acuan dalam kegiatan pembinaan Pedagang Besar Farmasi oleh petugas di tingkat Pusat, Provinsi maupun Kabupaten/Kota.
Pada kesempatan ini, saya ucapkan terima kasih dan penghargaan kepada semua pihak yang telah berperan serta dalam penyusunan Pedoman Pembinaan Pedagang Besar Farmasi ini.
Semoga Allah SWT senantiasa meridhoi upaya kita dan membawa manfaat bagi masyarakat dan bangsa Indonesia.
Jakarta, 2011
Direktur Bina Produksi dan Distribusi Kefarmasian
DAFTAR ISI
KATA PENGANTAR...i
KATA SAMBUTAN...ii
DAFTAR ISI...iii
SK DIREKTUR TENTANG PEDOMAN PEMBINAAN PEDAGANG BESAR FARMASI...v
SK TIM PENYUSUNAN ...vii
BAB I PENDAHULUAN...1
1. LATAR BELAKANG...1
2. TUJUAN...2
3. SASARAN...2
4. PENGERTIAN...2
5. RUANG LINGKUP...3
BAB II PERIZINAN PEDAGANG BESAR FARMASI...4
1. PERSYARATAN PERMOHONAN IZIN PEDAGANG BESAR FARMASI...4
2. PENERBITAN IZIN PEDAGANG BESAR FARMASI...5
3. BIAYA PENERBITAN IZIN PEDAGANG BESAR FARMASI………..6
4. PERUBAHAN IZIN PEDAGANG BESAR FARMASI ………...6
5. MASA BERLAKU IZIN PEDAGANG BESAR FARMASI ………...7
6. PELAPORAN ………...7
BAB III PEMBINAAN PEDAGANG BESAR FARMASI...8
1. KEWENANGAN PEMBINAAN...8
2. ASPEK PEMBINAAN...9
A. PERSONALIA...9
B. BANGUNAN...10
C. DOKUMENTASI...10
3. LANGKAH PEMBINAAN...11
iv
2) Langkah 2 :Pelaksanaan Pembinaan dan Pengumpulan Data………...12
3) Hasil Pembinaan ………..……...……….13
4) Penyusunan Laporan dan Rekomendasi...13
BAB IV EVALUASI DAN ANALISA HASIL PEMBINAAN...14
1. EVALUASI HASIL PEMBINAAN...14
2. TINDAK LANJUT PEMBINAAN...14
BAB V PENUTUP...15
KEPUTUSAN
DIREKTUR BINA PRODUKSI DAN DISTRIBUSI KEFARMASIAN NOMOR : HK.03.06/01/428B/2011
TENTANG
PEDOMAN PEMBINAAN PEDAGANG BESAR FARMASI
DIREKTUR BINA PRODUKSI DAN DISTRIBUSI KEFARMASIAN,
Menimbang : a. bahwa pelaksanaan amanat PP Nomor 72 Tahun 1989 tentang Pengawasan Sediaan Farmasi dan Alat Kesehatan;
b. bahwa sesuai dengan huruf (a) diatas perlu ditetapkan Keputusan Direktur Bina Produksi dan Distribusi Kefarmasian tentang Pedoman Pembinaan Pedagang Besar Farmasi;
Mengingat : 1. Ordonansi Obat Keras (Staatsblad Nomor 419 tahun 1949); 2. Undang-Undang Nomor 5 tahun 1997 tentang Psikotropika;
3. Undang-Undang Nomor 32 Tahun 2004 tentang Pemerintahan Daerah;
4. Undang-Undang Nomor 25 Tahun 2007 tentang Penanaman Modal; 5. Undang-Undang Nomor 14 Tahun 2008 tentang Keterbukaan
Informasi Publik;
6. Undang-Undang Nomor 35 tahun 2009 tentang Narkotika; 7. Undang-Undang Nomor 36 tahun 2009 tentang Kesehatan;
8. Peraturan Pemerintah No. 72 tahun 1998 tentang Pengamanan Sediaan Farmasi dan Alat Kesehatan;
9. Peraturan Pemerintah Nomor 38 tahun 2007 tentang Pembagian Urusan Pemerintahan antara Pemerintah, Pemerintah Daerah Propinsi dan Pemerintah Daerah Kab/Kota;
10. Peraturan Pemerintah Nomor 13 Tahun 2009 tentang Jenis dan Tarif Atas Jenis Penerimaan Negara Bukan Pajak yang berlaku pada Departemen Kesehatan;
11. Peraturan Pemerintah Nomor 51 Tahun 2009 tentang Pekerjaan Kefarmasian;
12. Peraturan Pemerintah Nomor 44 Tahun 2010 tentang Prekursor; 13. Keputusan Presiden Nomor 103 Tahun 2001 tentang Kedudukan,
Tugas, Fungsi, Kewenangan, Susunan Organisasi, Tata Kerja Lembaga Pemerintah Non Departemen;
14. Peraturan Presiden Nomor 24 Tahun 2010 tentang Kedudukan, Tugas, dan Fungsi Kementerian Negara serta Susunan Organisasi,Tugas, dan Fungsi Eselon 1 Kementerian Negara; 15. Peraturan Presiden Nomor 36 Tahun 2010 tentang Daftar Bidang
vi 16. Keputusan Menteri Kesehatan Republik Indonesia Nomor 287/Menkes/SK/XI/76 tentang Ketentuan Pengimporan, Penyimpanan dan Penyaluran Bahan Baku;
17. Keputusan Menteri Kesehatan Nomor 189/Menkes/SK/III/2006 tentang Kebijakan Obat Nasional;
18. Peraturan Menteri Kesehatan Republik Indonesia Nomor 1144/Menkes/Per/VIII/2010 tentang Organisasi dan Tata Kerja Kementerian Kesehatan RI;
19. Peraturan Menteri Kesehatan Republik Indonesia Nomor 1148/MENKES/PER/VI/2011 tentang Pedagang Besar Farmasi;
M E M U T U S K A N Menetapkan :
Pertama : KEPUTUSAN DIREKTUR BINA PRODUKSI DAN DISTRIBUSI KEFARMASIAN TENTANG PEDOMAN PEMBINAAN PEDAGANG BESAR FARMASI.
Kedua : Pedoman Pembinaan Pedagang Besar Farmasi, sebagaimana dimaksud pada diktum pertama sebagai landasan kerja pelaksanaan pembinaan Pedagang Besar Farmasi.
Ketiga : Pedoman Pembinaan Pedagang Besar Farmasi, sebagaimana dimaksud pada diktum kedua agar digunakan sebagai pedoman oleh petugas kesehatan dalam rangka pembinaan dan pelaku usaha. Keempat : Hal-hal yang belum ditetapkan dalam keputusan ini akan diatur dan
ditetapkan kemudian.
Kelima : Keputusan ini berlaku sejak tanggal ditetapkan, dengan ketentuan apabila dikemudian hari ternyata terdapat kekeliruan dalam keputusan ini akan dilakukan perbaikan sebagaimana mestinya.
Ditetapkan di Jakarta pada tanggal 14 Juli 2011
Direktur Bina Produksi dan Distribusi Kefarmasian
Drs. T. Bahdar J. Hamid, Apt, M.Pharm NIP 19560807 19860311001
KEPUTUSAN
DIREKTUR BINA PRODUKSI DAN DISTRIBUSI KEFARMASIAN NOMOR : HK.03.06/01/428C/2011
TENTANG
TIM PENYUSUN PEDOMAN PEMBINAAN PEDAGANG BESAR FARMASI DENGAN RAHMAT TUHAN YANG MAHA ESA
DIREKTUR BINA PRODUKSI DAN DISTRIBUSI KEFARMASIAN,
Menimbang : bahwa dalam rangka mempersiapkan serta menyelenggarakan Pedoman Pembinaan Pedagang Besar Farmasi perlu dibentuk Tim Penyusun Pedoman Pembinaan Pedagang Besar Farmasi yang ditetapkan dengan Keputusan Direktur Bina Produksi Dan Distribusi Kefarmasian;
Mengingat : 1. Peraturan Pemerintah Nomor 72 tahun 1998 tentang Pengamanan Sediaan Farmasi dan Alat Kesehatan;
2. Peraturan Menteri Kesehatan Republik Indonesia Nomor 1144/MENKES/PER/VIII/2010 Tentang Organisasi dan Tata Kerja Kementerian Kesehatan;
3. Peraturan Menteri Kesehatan Republik Indonesia Nomor 1148/MENKES/PER/VI/2011 tentang Pedagang Besar Farmasi.
MEMUTUSKAN Menetapkan :
KESATU : KEPUTUSAN DIREKTUR BINA PRODUKSI DAN DISTRIBUSI KEFARMASIAN TENTANG TIM PENYUSUN PEDOMAN PEMBINAAN PEDAGANG BESAR FARMASI;
KEDUA : Membentuk Tim Penyusun Pedoman Pembinaan Pedagang Besar Farmasi dengan susunan keanggotaan sebagaimana tercantum dalam Lampiran Keputusan ini;
KETIGA : Tugas Tim sebagaimana dimaksud dalam Diktum KEDUA sebagai berikut:
1. Mengadakan rapat-rapat persiapan dan koordinasi dengan pihak terkait;
ix 3. Melaksanakan pembahasan Draft Pedoman Pembinaan Pedagang
Besar Farmasi; dan
4. Menyempurnakan draft setelah mendapat masukan dalam pembahasan.
KEEMPAT : Dalam melakukan tugasnya Tim bertanggung jawab kepada Direktur Bina Produksi Dan Distribusi Kefarmasian;
KELIMA : Masa tugas Tim terhitung mulai tanggal ditetapkannya Keputusan ini sampai dengan akhir Tahun 2011;
KEENAM : Segala biaya yang timbul dalam pelaksanaan tugas Tim dibebankan pada DIPA Direktorat Bina Produksi dan Distribusi Kefarmasian Tahun 2011;
KETUJUH : Keputusan ini mulai berlaku sejak tanggal ditetapkan.
Ditetapkan di Jakarta pada tanggal 14 Juli 2011
Direktur Bina Produksi dan Distribusi Kefarmasian
Lampiran Keputusan
Direktur Bina Produksi Dan Distribusi Kefarmasian
Nomor HK.03.06/01/428C/2011 Tanggal 14 Juli 2011
TIM PENYUSUN
PEDOMAN PEMBINAAN PEDAGANG BESAR FARMASI
Penasehat : Direktur Jenderal Bina Kefarmasian dan Alat Kesehatan Penanggung Jawab : Direktur Bina Produksi dan Distribusi Kefarmasian
Ketua : Kepala Sub Direktorat Produksi dan Distribusi Obat dan Obat Tradisional;
Sekretaris : Kepala Seksi Perizinan Sarana Produksi dan Distribusi; Anggota : 1. Kepala Bagian Hukum, Organisasi dan Humas;
2. Kepala Seksi Standarisasi Produksi dan Distribusi 3. Kepala Sub Bagian Tata Usaha Direktorat Bina Produksi
dan Distribusi Kefarmasian;
4. Kepala Sub Direktorat Produksi dan Kosmetika dan Makanan;
5. Kepala Seksi Standarisasi Produksi Kosmetika dan Makanan;
6. Kepala Seksi Perizinan Produksi Kosmetika;
7. Kepala Sub Direktorat Produksi dan Distribusi Narkotika; 8. Kepala Seksi Sediaan Farmasi Khusus;
9. Kepala Sub Direktorat Kemandirian Obat dan Bahan Baku Obat;
10. Kepala Seksi Kerjasama;
11. Kepala Seksi Analisis Obat dan Bahan Baku Obat; 12. Kepala Sub Bagian Hukum
13. Damaris Parrangan; 14. Nofiyanti;
xi Sekretariat : 1. Isnaeni Diniarti, S.Farm., Apt;
2. Diara Oktania;
3. Ari Ariefah Hidayati, S.Farm., Apt.
Ditetapkan di Jakarta pada tanggal 14 Juli 2011
Direktur Bina Produksi dan Distribusi Kefarmasian
BAB I PENDAHULUAN
1. LATAR BELAKANG
Pembangunan di bidang obat bertujuan untuk menjamin ketersediaan dan keterjangkauan obat yang aman, berkhasiat dan bermutu bagi masyarakat dengan jenis dan jumlah yang sesuai kebutuhan seperti yang tercantum dalam kebijakan obat nasional. Dalam rangka menjamin ketersediaan dan keterjangkauan obat, baik obat esensial, obat generik, obat bermerek dagang, maka Pedagang Besar Farmasi perlu dibina agar dapat memenuhi persyaratan yang ditetapkan sesuai dengan tujuan di bidang peredaran obat. Penyusunan Pedoman ini berdasarkan Peraturan Pemerintah Nomor 38 Tahun 2007 tentang Pembagian Urusan Pemerintahan antara Pemerintah , Pemerintah Daerah Provinsi dan Pemerintah Daerah Kabupaten/Kota yang memberikan tugas dan kewajiban kepada Provinsi untuk melaksanakan pembinan di bidang sarana produksi dan distribusi farmasi dan berdasarkan Keputusan Menteri Kesehatan RI Nomor 1148/MENKES/PER/VI/2011 tentang Pedagang Besar Farmasi dan Cara Distribusi Obat yang Baik (CDOB).
Keputusan Menteri Kesehatan Nomor 1144 Tahun 2010 tentang Organisasi dan Tata Kerja Kementerian Kesehatan telah membentuk Direktorat Bina Produksi dan Distribusi Kefarmasian dengan tugas pokok melaksanakan penyiapan penyusunan norma, standar, prosedur, dan kriteria, serta pemberian bimbingan teknis dan evaluasi di bidang produksi dan distribusi kefarmasian. Untuk melaksanakan tugas di atas, Direktorat Bina Produksi dan Distribusi Kefarmasian menyelenggarakan fungsi:
a. Penyiapan perumusan kebijakan di bidang produksi dan distribusi kefarmasian;
b. Pelaksanaan kegiatan di bidang produksi dan distribusi kefarmasian; c. Penyiapan penyusunan norma, standar, prosedur, dan kriteria di bidang
produksi dan distribusi kefarmasian;
d. Penyiapan pemberian bimbingan teknis, pengendalian, kajian, dan analisis di bidang produksi dan distribusi kefarmasian;
2
f. Pelaksanaan peizinan di bidang produksi dan distribusi kefarmasian; dan g. Pelaksanaan urusan tata usaha dan rumah tangga Direktorat.
Selain itu, masyarakat juga harus dilindungi dari peredaran obat yang tidak memenuhi persyaratan keamanan, khasiat/manfaat dan mutu. Karena itulah Direktorat Bina Produksi dan Distribusi Kefarmasian perlu melaksanakan pembinaan di bidang sarana distribusi obat.
Pembinaan Pedagang Besar Farmasi meliputi berbagai aspek yaitu perizinan, Cara Distribusi Obat yang Baik (CDOB), peredaran obat, pelaporan, pemantauan, serta evaluasi kegiatan distribusi.
Untuk melaksanakan pembinaan Pedagang Besar Farmasi perlu disusun pedoman yang dapat digunakan sebagai acuan oleh petugas kesehatan di pusat dan daerah.
2. TUJUAN
a. Sebagai acuan dalam pelaksanaan pembinaan di sarana distribusi obat atau bahan obat guna memberikan panduan kepada aparatur kesehatan pusat dan daerah;
b. Sebagai acuan dalam pelaksanaan penilaian sarana distribusi obat atau bahan obat dalam rangka perubahan izin
c. Memenuhi kebutuhan masyarakat akan obat atau bahan obat, yang memenuhi persyaratan mutu, keamanan dan khasiat/manfaat;
d. Melindungi masyarakat dari bahaya peredaran obat dan bahan obat yang tidak memenuhi persyaratan mutu, keamanan, dan khasiat/manfaat; e. Sebagai acuan/pedoman untuk melakukan pemantauan dan evaluasi
pembinaan dalam pengembangan Pedagang Besar Farmasi.
f. Sebagai sarana pengumpulan data untuk merencanakan, merumuskan, dan mengkoordinasikan program dan kegiatan pembinaan pengembangan yang berbasis bukti di bidang distribusi obat/bahan obat.
3. SASARAN
a. Petugas Kesehatan di Pusat
b. Petugas Kesehatan Dinas Kesehatan Provinsi
c. Petugas Kesehatan Dinas Kesehatan Kabupaten/Kota d. Pelaku usaha di bidang sarana distribusi obat.
4. PENGERTIAN
pengadaan, penyimpanan, penyaluran obat dan/atau bahan obat dalam jumlah besar sesuai ketentuan peraturan perundang-undangan.
b. PBF Cabang adalah cabang PBF yang telah memiliki pengakuan untuk melakukan pengadaan, penyimpanan, penyaluran obat dan/atau bahan obat dalam jumlah besar sesuai ketentuan peraturan perundang-undangan.
c. Obat adalah bahan atau paduan bahan, termasuk produk biologi yang digunakan untuk mempengaruhi atau menyelidiki sistem fisiologi atau keadaan patologi dalam rangka penetapan diagnosis, pencegahan, penyembuhan, pemulihan, peningkatan kesehatan dan kontrasepsi untuk manusia .
d. Bahan Obat adalah bahan baik yang berkhasiat maupun tidak berkhasiat yang digunakan dalam pengolahan obat dengan standar dan mutu sebagai bahan baku farmasi termasuk baku pembanding.
e. Cara Distribusi Obat yang Baik yang selanjutnya disingkat CDOB adalah cara distribusi/penyaluran obat dan/atau bahan obat yang bertujuan untuk memastikan mutu sepanjang jalur distribusi/penyaluran sesuai persyaratan dan tujuan penggunaannya.
f. Kepala Balai Besar/Balai Pengawas Obat dan Makanan yang selanjutnya disebut Kepala Balai POM adalah kepala unit pelaksana teknis di lingkungan Badan Pengawas Obat dan Makanan.
g. Kepala Badan Pengawas Obat dan Makanan yang selanjutnya disebut Kepala Badan, adalah Kepala Badan yang tugas dan tanggung jawabnya di bidang pengawasan obat dan makanan.
h. Direktur Jenderal adalah Direktur Jenderal pada Kementerian Kesehatan yang tugas dan tanggung jawabnya di bidang pembinaan kefarmasian dan alat kesehatan.
i. Menteri adalah menteri yang menyelenggarakan urusan pemerintahan di bidang kesehatan.
5. RUANG LINGKUP
4 BAB II
PERIZINAN PEDAGANG BESAR FARMASI
Pedagang Besar Farmasi sebagai salah satu sarana distribusi obat dan bahan obat dalam pelaksanaan kegiatannya harus memiliki izin sesuai dengan Peraturan Menteri kesehatan Nomor 1148/MENKES/PER/VI/2011 tentang Pedagang Besar Farmasi.
1. PERSYARATAN PERMOHONAN IZIN PEDAGANG BESAR FARMASI a. Pedagang Besar Farmasi merupakan bidang usaha penanaman modal
dalam negeri sesuai dengan Perpres 36 tahun 2010 tentang bidang usaha terbuka dan tertutup;
b. Pemeriksaan administrasi meliputi pemeriksaan setempat untuk memperhatikan kesesuaian dokumen (sesuai daftar tilik) → Lampiran. c. Untuk memperoleh izin PBF, pemohon harus memenuhi persyaratan
sebagai berikut:
NO PERSYARATAN KETERANGAN
1 Bentuk perusahaan Perseroan Terbatas/koperasi
Akta Pendirian PT disahkan oleh mencantumkan jenis usaha di bidang farmasi/obat-obatan
3 Penanggung Jawab Harus apoteker
memiliki STRA dan SIKA
KTP sesuai dengan domisili perusahaan.
Perjanjian kerjasama
Ada pernyataan tidak bekerja ditempat lain
4 Struktur Organisasi Sesuai dengan Akta Notaris
Dewan komisaris/Direksi tidak terlibat pelanggaran peraturan perUU dibidang kefarmasian.
5 Bangunan dan sarana Bukti kepemilikan sewa atau milik
Lokasi sesuai peruntukannya
Lokasi sesuai dengan permohonan
Tersedianya peralatan keamanan keselamatan kerja (K3)
Peta lokasi dan denah bangunan sesuai
6 Gudang penyimpanan Bukti penguasaan gudang
Lokasi sesuai peruntukannya
Lokasi sesuai dengan permohonan
Tata ruang yang memadai sesuai dengan peruntukannya
Tersediannya kelengkapan penyimpanan sesuai produk yang didistribusikan
Tersedianya peralatan keamanan keselamatan kerja (K3)
7 Administrasi pendukung dan Dokumentasi
Kartu Stock (manual atau komputer)
Faktur pemesanan
Daftar Pustaka
Software Pelaporan
d. PBF yang akan menyalurkan bahan obat juga harus memenuhi persyaratan:
memiliki laboratorium yang mempunyai kemampuan untuk pengujian bahan obat yang disalurkan sesuai dengan ketentuan yang ditetapkan Direktur Jenderal; dan
memiliki gudang khusus tempat penyimpanan bahan obat yang terpisah dari ruangan lain
2. PENERBITAN IZIN PEDAGANG BESAR FARMASI
Berkas permohonan yang sudah lengkap dan ditandatangani oleh direktur/ketua dan apoteker calon penanggung jawab akan diproses sesuai dengan alur sebagai berikut :
1) Untuk memperoleh izin PBF, pemohon harus mengajukan permohonan kepada Direktur Jenderal dengan tembusan kepada Kepala Badan, Kepala Dinas Kesehatan Provinsi dan Kepala Balai POM dengan menggunakan contoh formulir 1 terlampir;
2) Paling lama dalam waktu 6 (enam) hari kerja sejak diterimanya tembusan permohonan, kepala dinas kesehatan provinsi melakukan verifikasi kelengkapan administratif;
6
4) Paling lama dalam waktu 6 (enam) hari kerja sejak dinyatakan memenuhi kelengkapan administratif, kepala dinas kesehatan provinsi mengeluarkan rekomendasi pemenuhan kelengkapan administratif kepada Direktur Jenderal dengan tembusan kepada Kepala Balai POM dan pemohon dengan menggunakan formulir 2 terlampir;
5) Paling lama dalam waktu 6 (enam) hari kerja sejak dinyatakan memenuhi persyaratan CDOB, Kepala Balai POM mengeluarkan rekomendasi hasil analisis pemenuhan persyaratan CDOB kepada Direktur Jenderal dengan tembusan kepada Kepala Badan, kepala dinas kesehatan provinsi dan pemohon dengan mengunakan contoh formulir 3 terlampir ;
6) Paling lama dalam waktu 6 (enam) hari kerja sejak menerima rekomendasi sebagaimana dimaksud pada point (4) dan point (5) serta persyaratan lainnya yang ditetapkan, Direktur Jenderal menerbitkan izin PBF dengan menggunakan contoh formulir 4 terlampir;
7) Dalam hal ketentuan sebagaimana dimaksud pada point (4), (5), dan (6) tidak dilaksanakan pada waktunya, pemohon dapat membuat surat pernyataan siap melakukan kegiatan kepada Direktur Jenderal dengan tembusan kepada Kepala Badan, Kepala Balai POM dan Kepala Dinas Kesehatan Provinsi dengan menggunakan contoh formulir 5 terlampir;
8) Paling lama 12 (dua belas) hari kerja sejak diterimanya surat pernyataan sebagaimana dimaksud pada point (7), Direktur Jenderal menerbitkan izin PBF dengan tembusan kepada Kepala Badan, kepala dinas kesehatan provinsi, Kepala Dinas Kesehatan Kabupaten/Kota dan Kepala Balai POM;
3. BIAYA PENERBITAN IZIN PEDAGANG BESAR FARMASI
Terhadap permohonan izin PBF dikenai biaya sebagai penerimaan negara bukan pajak sesuai ketentuan peraturan perundang-undangan;
Dalam hal permohonan atau persetujuan izin ditolak, maka biaya yang telah dibayarkan tidak dapat ditarik kembali.
4. PERUBAHAN IZIN PEDAGANG BESAR FARMASI Perubahan izin harus dilakukan apabila terjadi :
1. Perubahan fisik
2. Perubahan non fisik
Setiap perubahan alamat kantor/gudang di lokasi yang sama,
perubahan penanggung jawab, NPWP atau nama perusahaan wajib melakukan perubahan izin Pedangan Besar Farmasi kepada Direktur Jenderal setelah mendapat rekomendasi dari Dinas Kesehatan.
3. Perubahan terhadap akte pendirian Pedagang Besar Farmasi
Perubahan terhadap akte pendirian perseroan terbatas/koperasi karena perubahan struktur komisaris, direksi, pemegang saham, ketua maupun pengurus harus dilaporkan kepada Direktur Jenderal dengan tembusan kepada Kepala Badan dan Kepala Dinas Kesehatan Propinsi setempat.
5. MASA BERLAKU IZIN PEDAGANG BESAR FARMASI
a. Izin Pedagang Besar Farmasi berlaku 5 (lima) tahun dan dapat diperpanjang selama memenuhi persyaratan ;
b. Pengakuan Pedagang Besar Farmasi Cabang berlaku mengikuti jangka waktu izin Pedagang Besar Farmasi.
6. PELAPORAN
1. Setiap PBF dan cabangnya wajib menyampaikan laporan kegiatan setiap 3 (tiga) bulan sekali meliputi kegiatan penerimaan dan penyaluran obat dan/atau bahan obat kepada Direktur Jenderal dengan tembusan kepada Kepala Badan, kepala dinas kesehatan provinsi dan Kepala Balai POM; 2. Selain laporan triwulanan kegiatan penerimaan dan penyaluran
sebagaimana dimaksud pada point (a) Direktur Jenderal setiap waktu dapat meminta laporan kegiatan penerimaan dan penyaluran obat dan/atau bahan;
3. Setiap PBF dan PBF Cabang yang menyalurkan narkotika dan psikotropika wajib menyampaikan laporan bulanan penyaluran narkotika dan psikotropika sesuai ketentuan peraturan perundang-undangan.
4. Laporan dapat dilakukan secara elektronik dengan menggunakan teknologi informasi dan komunikasi .
8 BAB III
PEMBINAAN PEDAGANG BESAR FARMASI
Pembinaan terhadap Pedagang Besar Farmasi dilaksanakan oleh Direktorat Jenderal Bina Kefarmasian dan Alat Kesehatan c.q. Direktorat Bina Produksi
dan Distribusi Kefarmasian baik secara mandiri maupun secara bekerja sama dengan instansi terkait, antara lain dengan organisasi pemerintah daerah yang bertanggung jawab atas urusan pemerintahan bidang kesehatan di provinsi (Dinas Kesehatan Provinsi) dan kabupaten / kota (Dinas Kesehatan Kabupaten/Kota).
Pembinaan Pedagang Besar Farmasi mencakup berbagai aspek dalam rangka peningkatan kualitas pengelolaan obat dan bahan obat di sarana distribusi. Pembinaan dapat dilakukan secara berjenjang oleh Pemerintah, pemerintah daerah provinsi, dan pemerintah kabupaten/kota
1. KEWENANGAN PEMBINAAN
Kewenangan pembinaan Pedangang Besar Farmasi secara berjenjang adalah sebagai berikut.
a. Penanggung jawab / Koordinator Pelaksana Urusan pemerintah Bidang Kesehatan di Pusat adalah Kementerian Kesehatan
b. Penanggung jawab / Koordinator Pelaksana Urusan Pemerintah bidang Kesehatan di Propinsi adalah Dinas Kesehatan Provinsi
c. Penanggung jawab / Koordinator Pelaksana Urusan Pemerintah Bidang Kesehatan di Kabupaten / Kota adalah Dinas Kesehatan Kabupaten / Kota.
Tabel 1. Pelaksana Kewenangan Pembinaan
Sesuai dengan PP 38 tahun 2007
No. Kementerian kesehatan R.I
Pemerintah Daerah Provinsi
Pemerintah Daerah Kab/Kota
1. Penyiapan perumusan dan pelaksanaan evaluasi di bidang sarana distribusi kefarmasian. teknis dan evaluasi di bidang sarana
2. Pelaksanaan Pembinaan dalam rangka
Pemantauan Pelaksanaan Cara Distribusi Yang Baik lingkup seluruh wilayah 3. Pembinaan dalam rangka
pemantauan Pelaksanaan
2. ASPEK PEMBINAAN A. PERSONALIA
10 B. BANGUNAN
Bangunan Kantor dan gudang pedagang Besar Farmasi harus berlokasi sesuai dengan peruntukannya.
Bangunan untuk penyimpanan harus dapat menjamin mutu dan keamanan obat dan bahan obat tersebut.
Bangunan harus cukup luas sesuai kebutuhan, tetap kering dan bersih, bebas dari barang-barang yang tidak diperlukan.
Bangunan harus memiliki sirkulasi udara yang baik dan penerangan yang cukup untuk dapat melaksanakan kegiatan dengan aman dan benar
Tersedia ruang terpisah dan terkunci untuk penyimpanan produk tertentu (narkotika, psikotropika).
Ruangan atau tempat yang digunakan untuk menyimpan obat dan bahan obat yang memerlukan kondisi khusus perlu ditambahkan sarana penunjang yang memadai.
C. DOKUMENTASI
Dokumentasi pengelolaan pengadaaan dan penyaluran obat dan bahan obat merupakan bagian dari sistem informasi yang meliputi prosedur, metoda dan instruksi kerja, catatan, laporan serta jenis dokumentasi lain yang diperlukan dalam perencanaan, pelaksanaan, pengendalian serta evaluasi seluruh rangkaian kegiatan pengadaan dan penyaluran obat. Sistem dokumentasi hendaklah menggambarkan secara lengkap asal-usul setiap jenis produk, serta penyalurannya sehingga memungkinkan apabila diperlukan penelusuran kembali. Sistem dokumentasi digunakan pula dalam pemantauan dan pengedalian untuk pelaksanaan pengelolaan yang berdayaguna dan berhasilguna. Dokumen hendaklah mencakup data penting dan dijaga agar selalu aktual. Tidak diperkenankan diadakan perubahan-perubahan, semua koreksi untuk perubahan dan perbaikan harus dilakukan oleh atau atas sepengetahuan penanggung jawab.
Dokumen yang dimaksud diatas adalah sebagai berikut : a. Prosedur tetap atau SOP setiap tahapan distribusi b. Dokumentasi pemesanan
c. Dokumentasi penerimaan untuk produk yang diterima dan ditolak d. Dokumentasi penyimpanan
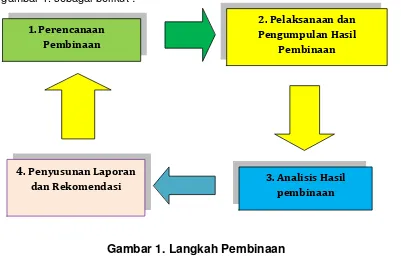
3. LANGKAH PEMBINAAN
Langkah pembinaan sarana distribusi farmasi dilaksanakan dengan alur sesuai gambar 1. sebagai berikut :
Gambar 1. Langkah Pembinaan
Langkah 1: Perencanaan Pembinaan A. Perencanaan pembinaan :
a. Pembentukan Tim Pembina
Tim pembina perlu ditetapkan peran dan ruang lingkup tugasnya, misalnya mulai dari perencanaan pembinaan, pelaksanaan pembinaan, pendokumentasian dan pelaporan. Selain petugas pusat dan daerah, apabila diperlukan Direktur/Kepala Dinas dapat membentuk atau menggunakan tim penilai independen dari lingkungan perguruan tinggi atau organisasi LSM. Tim pembina pusat/daerah hanya dapat melakukan tugasnya setelah mendapat surat tugas dari Direktur/Kepala Dinas.
b. Penetapan jadwal pembinaan dan penyediaan anggaran.
Sebelum melakukan pembinaan tim pembina harus menetapkan jadwal dalam rangka persiapan pembinaan. Anggaran harus didasarkan pada ruang lingkup pekerjaan dan jadwal pembinaan.
c. Penyampaian informasi kepada pihak terkait.
Informasi mengenai kegiatan pembinaan sebaiknya disampaikan kepada industri farmasi yang akan dibina untuk memperoleh dukungan dan kerjasama.
1.Perencanaan Pembinaan
2. Pelaksanaan dan Pengumpulan Hasil
Pembinaan
3. Analisis Hasil pembinaan
12
d. Pemilihan narasumber Kunci
1) Narasumber kunci adalah orang yang bertanggung jawab atas pelaksanaan kegiatan operasional sehari-hari dari suatu organisasi / perusahaan. Narasumber kunci dipilih berdasarkan pengalaman dan keterlibatan mereka saat ini dalam, atau berdasarkan pengetahuan mereka mengenai, kebijakan, manajemen dan sistem.
2) Perlu untuk memperoleh narasumber kunci yang berimbang dan bukan sejumlah narasumber kunci yang mewakili secara berlebihan aktor-aktor tertentu.
3) Wawancara dengan sebanyak mungkin narasumber kunci untuk menguatkan temuan pembinaan.
e. Persiapan Wawancara
Wawancara hendaknya dilakukan melalui persiapan dengan memperhatikan tujuan wawancara dan kompetensi narasumber.
Langkah 2 : Pelaksanaan Pembinaan dan Pengumpulan Data Pelaksanaan pembinaan awal dapat dilakukan dengan melakukan:
1. Diskusi dan konsultasi baik formal maupun semi formal dengan narasumber kunci di industri farmasi.
2. Wawancara terstruktur atau teknik lain seperti e-mail, fax, atau telepon. 3. Review dokumen. Melalui review dokumen teknis dan rekaman yang
relevan dan tersedia (baik yang dipublikasikan maupun tidak dipublikasikan) dari sumber primer dan sekunder. Di dalam dokumen ini termasuk legislasi dan regulasi di bidang distribusi obat, rekaman / catatan inspeksi, rekaman / catatan penerapan CDOB dan lain-lain.
4. Pemeriksaan lapangan dilakukan apabila hasil wawancara dan review dokumen belum dapat menggambarkan kondisi sarana distribusi obat dan bahan obat yang memerlukan pembinaan.
Aspek yang Perlu Diperhatikan Dalam Pelaksanaan Pembinaan Aspek yang dievaluasi pada Pedagang Besar Farmasi meliputi: 1. Informasi Umum
2. Informasi Gudang
- Luas bangunan gudang - Struktur organisasi - Sumberdaya manusia - Fasilitas
- Sumber energi - Sumber air
- Pembuangan / pengolahan limbah - CDOB yang dimiliki
3. Informasi Pengelolaan Pedagang Besar Farmasi
Langkah 3 : Analisis Hasil Pembinaan
Data dan informasi yang dikumpulkan dari pelaksanaan pembinaan harus dianalisa dan dikaji agar didapat informasi yang valid. Informasi tersebut dapat digunakan sebagai dasar untuk pembinaan selanjutnya dalam rangka meningkatkan kualitas industri farmasi.
Langkah 4 : Penyusunan Laporan dan Rekomendasi
14 BAB IV
BAB IV EVALUASI DAN TINDAK LANJUT PEMBINAAN
1. Evaluasi Hasil Pembinaan
Evaluasi hasil pembinaan harus dilaksanakan secara berkesinambungan dengan memperhatikan semua aspek dalam pembinaan yaitu perencanaan, pelaksanaan, analisis, dan dampak pembinaan sehingga hasil evaluasi tersebut dapat digunakan sebagai dasar untuk melakukan perbaikan terus menerus dalam rangka pelaksanaan pembinaan yang lebih baik.
2. Tindak Lajut Pembinaan
BAB V PENUTUP
16 DAFTAR PUSTAKA
1. Undang-Undang Nomor 36 tahun 2009 tentang Kesehatan;
2. Peraturan Pemerintah No. 72 tahun 1998 tentang Pengamanan Sediaan Farmasi dan Alat Kesehatan;
3. Badan POM, 2005, Cara Distribusi Obat yang Baik (CDOB)
4. Peraturan Pemerintah Nomor 38 tahun 2007 tentang Pembagian Urusan Pemerintahan antara Pemerintah, Pemerintah Daerah Propinsi dan Pemerintah Daerah Kab/Kota;
5. Kementerian Kesehatan RI, Rencana Strategis Kementerian Kesehatan Tahun 2010-2014, Jakarta;
Lampiran 1
EVALUASI DALAM RANGKA PEMBINAAN
PEDAGANG BESAR FARMASI
I. DATA ADMINISTRASI
1 Nama Perusahaan
2 Alamat dan Telepon Perusahaan
3 Bentuk Badan Usaha
4 Nama Pimpinan/Pemilik/Direktur
5 Nama Penanggungjawab Teknis (PJT)
6 Pendidikan Penanggungjawab Teknis (PJT)
7 Lamanya bekerja PJT
8 Alamat Gudang
9 Nomor Izin PBF dan masa berlaku
II. DATA LOKASI DAN BANGUNAN
1 Lokasi kantor, gudang, Kaw. )ndustri/Pertokoan/Perum/…
2 Bangunan Permanen/Semi permanen/Tidak permanen
3 Jauh dari sumber pencemaran Ya/Tidak
4 Sumber Air PAM/Pompa Mesin/Pompa Tangan/Sumur
Timba
5 Sumber Listrik PLN/Generator
III. DATA KARYAWAN
1 Jumlah karyawan/SDM yang ada ……….orang
2 Tingkat pendidikan ……….orang
SD ……….orang
SMP ……….orang
SMU ……….orang
SAA ……….orang
Analisis Kimia ……….orang
D3 ……….orang
S1 ……….orang
S2 ……….orang
18
IV. ALUR PROSES DISTRIBUSI
Dari Gudang penyimpanan sampai pengiriman produk jadi
V. GUDANG PENYIMPANAN
No Gudang Penyimpanan Keterangan
1 Apakah mempunyai Kartu Stock (manual dan atau Komputer)
2 Apakah ada tempat penyimpanan khusus
3 Apakah jumlah gudang penyimpanan cukup dan memadai
4 Apakah menggunakan sistem penyimpanan secara FIFO
5 Apakah memiliki PJ Gudang dan bekerja penuh waktu
6 Apakah memiliki peralatan Distribusi yang memadai
VI. DOKUMENTASI
No Dokumentasi Keterangan
1 Apakah ada SOP di setiap tahapan distribusi 2 Apakah mempunyai dokumentasi pemesanan 3 Apakah mempunyai dokumentasi penerimaan
untuk
a. Produk yang diterima b. Produk yang ditolak
c. Faktur atau surat penyerahan barang
4 Apakah mempunyai Dokumetasi Penyimpanan a. Faktur atau surat penyerahan barang diarsipkan
berdasarkan Nomor Urut dan tanggal penerimaan
b. Kartu Stock
kembalian (Recall) dan keluhan konsumen dan telah dilaksanakan dengan baik serta jelas penanggungjawab pelaksananya
6 Apakah memiliki fasilitas penyimpanan dokumentasi yang baik
VII. SARAN DAN MASUKAN
Pemilik / Penanggung Jawab, Petugas Pusat,
Nama/NIP Tanda tangan
………
……… ………..
Petugas Daerah,
Nama/NIP Tanda tangan
………
20
Lapiran 2 . ANALISIS HASIL PEMERIKSAAN (POINT I S/D VIII)
NO PRINSIP-PRINSIP POKOK YA/TIDAK ANALISA SEBAB & PEMECAHANNYA
KETENTUAN UMUM
1. Produk farmasi memiliki manfaat yang sesuai dengan tujuan produksi, dan didesain, diproduksi, dan dikemas dalam cara yang sesuai untuk fungsi dari produk tersebut.
2. Karakteristik dan performance produk farmasi tidak berdampak buruk bagi kesehatan dan keselamatan pasien, pengguna, dan jika digunakan dalam masa berlakunya (waktu kadaluarsa) yang dapat terjadi pada kondisi normal penggunaan dan pemeliharaan sesuai dengan instruksi produsen.
3. Produk farmasi dikemas sehingga karakteristik dan manfaat produk tidak memberi dampak buruk selama kondisi pemindahan dan penyimpanan produk (misal suhu dan kelembaban yang fluktuasi) sesuai dengan instruksi dan informasi yang diberikan produsen.
4 Kesesuaian dengan standar prosedur tentang
penerimaan dan identifikasi bahan pengemas.
5 Kesesuian dengan standar prosedur penyimpanan bahan
baku.
NO PRINSIP-PRINSIP POKOK YA/TIDAK ANALISA SEBAB & PEMECAHANNYA
6 Terdapat sistem dokumentasi mengenai pencatatan
distribusi produk farmasi.
7 Terdapat sistem dokumentasi mengenai penanganan
komplain dari penggunaan produk farmasi.
8 Terdapat sistem dokumentasi mengenai pengaturan
pemeliharaan produk farmasi.
9 Tempat penyimpanan produk farmasi memiliki desain
ergonomi termasuk tekanan udara yang baik sehingga meminimalkan risiko kontak antar produk farmasi yang berbeda sehingga menimbulkan perubahan fungsi dari produk farmasi.
10 Tempat penyimpanan produk farmasi didesain
sedemikian rupa sehingga meminimalkan risiko
tercampurnya zat lain dalam produk farmasi secara tidak sengaja.
11 Tempat penyimpanan produk farmasi didesain
sedemikian rupa sehingga meminimalkan risiko
Formulir-1
Nomor : Lampiran :
Perihal : Permohonan Izin Pedagang Besar Farmasi
Kepada Yth.
Direktur Jenderal Bina Kefarmasian dan Alat Kesehatan Kementerian Kesehatan Republik Indonesia
di - JAKARTA
Bersama ini kami mengajukan permohonan untuk mendapatkan Izin Pedagang Besar Farmasi dengan data sebagai berikut:
1. Pemohon d. Alamat Laboratorium dan Nomor telepon : ... 3. Apoteker Calon Penanggung Jawab
a. Nama : ... b. Surat Tanda Registrasi Apoteker : ... 4. Data Lampiran:
a. fotokopi Kartu Tanda Penduduk (KTP)/identitas direktur/pengurus; b. susunan direksi/pengurus;
c. pernyataan komisaris/dewan pengawas dan direktur/pengurus tidak pernah terlibat pelanggaran peraturan perundang-undangan di bidang farmasi;
d. akta pendirian badan hukum yang sah sesuai ketentuan peraturan perundang-undangan; e. fotokopi Surat Izin Tempat Usaha berdasarkan Undang-Undang Gangguan (HO);
f. surat Tanda Daftar Perusahaan;
g. fotokopi Surat Izin Usaha Perdagangan; h. fotokopi Nomor Pokok Wajib Pajak;
i. surat bukti penguasaan bangunan dan gudang; j. peta lokasi dan denah bangunan;
k. peta lokasi, denah bangunan, laboratorium dan daftar peralatan bagi PBF yang akan menyalurkan bahan obat
l. surat pernyataan kesediaan bekerja penuh apoteker penanggung jawab; dan m. fotokopi Surat Tanda Registrasi Apoteker penanggung jawab.
Demikianlah permohonan kami, atas perhatian dan persetujuan Bapak/Ibu kami sampaikan terima kasih.
...,... Apoteker Calon Penanggung Jawab Direktur /Ketua Koperasi
(...) (...) Tembusan :
1. Kepala Badan Pengawas Obat dan Makanan 2. Kepala Dinas Kesehatan Provinsi ...
21 Formulir-2
DINAS KESEHATAN PROVINSI ………
Nomor : ………...…….. Lampiran : ... Perihal : Rekomendasi
Kepada Yth.
Direktur Jenderal Bina Kefarmasian dan Alat Kesehatan Kementerian Kesehatan Republik Indonesia
di –
JAKARTA
Sehubungan dengan tembusan surat permohonan izin PBF dari ……… Nomor ………..
tanggal ………, bersama ini kami sampaikan bahwa telah dilakukan verifikasi persyaratan
administratif terhadap pemohon: 1. Pemohon
a. Nama Direktur/Ketua Koperasi (*) : ... b. Alamat dan Nomor telepon : ... c. E-mail : ... d. Nomor Pokok Wajib Pajak : ... 2. Perusahaan
a. Nama Perusahaan : ... b. Alamat Kantor dan Nomor telepon : ... c. Alamat Gudang dan Nomor telepon : ... d. Alamat Laboratorium dan Nomor telepon (*) : ... 3. Apoteker Calon Penanggung Jawab
a. Nama : ... b. Surat Tanda Registrasi Apoteker : ... Dengan hasil: Memenuhi kelengkapan administratif.
Demikian kami sampaikan, atas perhatiannya diucapkan terima kasih.
Kepala Dinas Kesehatan
( ……….…………. )
Tembusan :
1. Kepala Balai Besar/Balai Pengawas Obat dan Makanan di ………. 2. Pemohon
Formulir -3
BALAI BESAR/BALAI PENGAWAS OBAT DAN MAKANAN DI ...
Nomor : Lampiran :
Perihal : Rekomendasi Hasil Analisis Pemenuhan Persyaratan CDOB Kepada Yth.
Direktur Jenderal Bina Kefarmasian dan Alat Kesehatan Kementerian Kesehatan Republik Indonesia
di – JAKARTA
Sehubungan dengan tembusan surat permohonan izin PBF dari ………. Nomor ………..
tanggal ………., bersama ini kami sampaikan bahwa telah dilakukan analisis pemenuhan
persyaratan CDOB terhadap pemohon: 1. Pemohon 3. Apoteker Calon Penanggung Jawab
a. Nama : ... b. Surat Tanda Registrasi Apoteker : ... Dengan hasil: Memenuhi persyaratan CDOB
Demikian kami sampaikan, atas perhatiannya diucapkan terima kasih.
Kepala Balai Besar/Balai
(...) Tembusan :
1. Kepala Badan Pengawas Obat dan Makanan 2. Kepala Dinas Kesehatan Provinsi ………. 3. Pemohon
23 Formulir -4
KEPUTUSAN
DIREKTUR JENDERAL BINA KEFARMASIAN DAN ALAT KESEHATAN NOMOR...
TENTANG
IZIN PEDAGANG BESAR FARMASI ...
DIREKTUR JENDERAL BINA KEFARMASIAN DAN ALAT KESEHATAN,
Membaca : 1. Surat permohonan dari ……… Nomor ……… tanggal
………. untuk memperoleh Izin PBF;
2. Rekomendasi dari Dinas Kesehatan Provinsi Nomor: ... tanggal ...; 3. Rekomendasi dari Kepala Balai Besar/Balai POM di ... Nomor
…………tanggal ………;
Menimbang : bahwa permohonan ……….. tersebut dapat disetujui, oleh karena itu perlu menerbitkan Izin PBF;
Mengingat : Peraturan Menteri Kesehatan Nomor ... tentang Pedagang Besar Farmasi;
MEMUTUSKAN :
Menetapkan :
Kesatu : KEPUTUSAN DIREKTUR JENDERAL BINA KEFARMASIAN DAN ALAT KESEHATAN TENTANG IZIN PEDAGANG BESAR FARMASI ...
Kedua : Memberikan Izin PBF kepada ……… Nomor Pokok Wajib Pajak (NPWP) ……… dengan ketentuan sebagai berikut.
1. Apoteker Penanggung jawab obat...STRA... 2. Apoteker Penanggung jawab bahan obat...STRA... 3. Alamat kantor : ………..
Keempat : PBF sebagaimana dimaksud dalam diktum kedua harus melaksanakan dokumentasi pengadaan, penyimpanan, dan penyaluran obat/bahan obat sesuai Pedoman Cara Distribusi Obat yang Baik (CDOB).
Kelima : Keputusan ini mulai berlaku pada tanggal ditetapkan.
Ditetapkan di : Jakarta
Pada tanggal : ……….…. Direktur Jenderal
Bina Kefarmasian Dan Alat Kesehatan,
………..………
Tembusan:
1. Kepala Badan Pengawas Obat dan Makanan 2. Kepala Dinas Kesehatan Provinsi ………
3. Kepala Balai Besar/Balai Pengawas Obat dan Makanan di ... 4. Kepala Dinas Kesehatan Kabupaten/Kota...
Formulir-5
Nomor : ………..….. Lampiran :
Perihal : Pernyataan siap melaksanakan kegiatan Kepada Yth.
Direktur Jenderal Bina Kefarmasian dan Alat Kesehatan Kementerian Kesehatan Republik Indonesia
di –
JAKARTA
Dengan hormat,
Sehubungan dengan surat permohonan izin PBF kami Nomor …………. tanggal ………….. dan menunjuk ketentuan Pasal 8 ayat (6) Peraturan Menteri Kesehatan Nomor...… tentang Pedagang Besar Farmasi dengan ini kami menyatakan bahwa PT/Koperasi* ……… yang beralamat di Jl. ………… telah siap untuk melaksanakan kegiatan sebagai Pedagang Besar Farmasi.
Demikian pernyataan ini kami sampaikan, atas perhatiannya diucapkan terima kasih.
Apoteker Calon Penanggung Jawab Direktur /Ketua Koperasi
(...) (...)
Tembusan:
1. Kepala Badan Pengawas Obat dan Makanan 2. Kepala Dinas Kesehatan Provinsi ...
3. Kepala Balai Besar/Balai Pengawas Obat dan Makanan di ………...
Coret yang tidak perlu
25 Formulir-6
Nomor : Lampiran :
Perihal : Permohonan Pengakuan PBF Cabang
Kepada Yth.
Kepala Dinas Kesehatan Provinsi ... di -
...
Bersama ini kami mengajukan permohonan untuk mendapat Pengakuan sebagai PBF Cabang dengan data sebagai berikut:
1. Pemohon 3. Apoteker Calon Penanggung Jawab
a. Nama : ... b. Surat Tanda Registrasi Apoteker : ... 4. Data Lampiran:
a. fotokopi Kartu Tanda Penduduk (KTP)/identitas direktur cabang/pengurus cabang; b. fotokopi izin PBF yang dilegalisir oleh Direktur Jenderal;
c. surat penunjukan sebagai kepala PBF cabang;
d. pernyataan kepala PBF cabang tidak pernah terlibat pelanggaran peraturan perundang-undangan di bidang farmasi;
e. fotokopi Surat Izin Tempat Usaha berdasarkan Undang-Undang Gangguan (HO); f. surat pernyataan kesediaan bekerja penuh apoteker calon penanggung jawab; g. surat bukti penguasaan bangunan dan gudang; dan
h. peta lokasi dan denah bangunan
i. peta lokasi, denah bangunan, laboratorium dan daftar peralatan bagi PBF cabang yang akan menyalurkan bahan obat;
j. fotokopi Surat Tanda Registrasi Apoteker calon penanggung jawab.
Demikianlah permohonan kami, atas perhatian dan persetujuan Bapak/Ibu kami sampaikan terima kasih.
...,... Apoteker Calon Penanggung Jawab Kepala PBF Cabang
(...) (...) Tembusan:
1. Direktur Jenderal
2. Kepala Dinas Kesehatan Kabupaten/Kota...
Formulir -7
DINAS KESEHATAN PROVINSI ………
Nomor : ………...…….. Lampiran : ... Perihal : Rekomendasi
Kepada Yth.
Kepala Dinas Kesehatan Provinsi ... di -
...
Sehubungan dengan tembusan surat permohonan pengakuan PBF Cabang dari ……… Nomor
……….. tanggal ………, bersama ini kami sampaikan bahwa telah dilakukan verifikasi
kelengkapan administratif terhadap pemohon: 1. Pemohon 3. Apoteker Calon Penanggung Jawab
a. Nama : ... b. Surat Tanda Registrasi Apoteker : ... Dengan hasil: Memenuhi kelengkapan administratif
Demikian kami sampaikan, atas perhatiannya diucapkan terima kasih.
Kepala Dinas Kesehatan Kabupaten/Kota………,
( ……….…………. )
Tembusan :
1. Direktur Jenderal
2. Kepala Balai Besar / Balai Pengawas Obat dan Makanan di ………. 3. Pemohon
27 Formulir-8
BALAI BESAR/BALAI PENGAWAS OBAT DAN MAKANAN DI ...
Nomor : Lampiran :
Perihal : Hasil Analisis Pemenuhan Persyaratan CDOB Kepada Yth.
Kepala Dinas Kesehatan Provinsi ... di -
...
Sehubungan dengan tembusan surat permohonan pengakuan sebagai PBF Cabang dari
………. Nomor ……….. tanggal ………., bersama ini kami sampaikan bahwa
telah dilakukan analisis pemenuhan persyaratan CDOB terhadap pemohon: 1. Pemohon
a. Nama Kepala Cabang : ... b. Alamat dan Nomor telepon :...
c. E-mail : ………...
2. Perusahaan
a. Nama Perusahaan : ...
b. Nomor Pokok Wajib Pajak : ………...
c. Alamat Kantor dan Nomor telepon : ... d. Alamat Gudang dan Nomor telepon : ... e. Alamat Laboratorium dan Nomor telepon* : ... 3. Apoteker Calon Penanggung Jawab
a. Nama : ... b. Surat Tanda Registrasi Apoteker : ... Dengan hasil: Memenuhi persyaratan CDOB
Demikian kami sampaikan, atas perhatiannya diucapkan terima kasih.
Kepala Balai Besar/Balai POM di ...
(...) Tembusan :
Pemohon
Formulir-9
KEPUTUSAN
KEPALA DINAS KESEHATAN PROVINSI ... NOMOR...
TENTANG
IZIN ATAU PENGAKUAN PBF CABANG ...
Membaca : 1. Surat permohonan pengakuan sebagai PBF Cabang dari ………
Nomor ……… tanggal ……….;
2. Rekomendasi dari Kepala Dinas Kesehatan Kabupaten/Kota Nomor ...tanggal...;
3. Rekomendasi dari Kepala Balai Besar/Balai POM di ... Nomor
…………tanggal ………;
Menimbang : bahwa permohonan pengakuan PBF cabang ... dapat disetujui, oleh karena itu perlu menerbitkan pengakuan sebagai PBF Cabang;
Mengingat : Peraturan Menteri Kesehatan Nomor ... tentang Pedagang Besar Farmasi;
MEMUTUSKAN :
Menetapkan:
Kesatu : KEPUTUSAN KEPALA DINAS KESEHATAN PROVINSI ... TENTANG PENGAKUAN PBF CABANG...
Kedua : Memberikan Pengakuan kepada PBF……….. Nomor Pokok
Wajib Pajak (NPWP) ……… sebagai cabang dari PBF...
yang beralamat di ... dengan Nomor Izin: ... dengan ketentuan sebagai berikut:
1. Apoteker Penanggung jawab obat...STRA... 2. Alamat kantor : ………..
3. Alamat gudang obat : ...
Ketiga : PBF Cabang sebagaimana dimaksud dalam diktum kedua harus melaksanakan dokumentasi pengadaan, penyimpanan, dan penyaluran obat/bahan obat sesuai Pedoman Cara Distribusi Obat yang Baik (CDOB). Keempat : Pengakuan PBF cabang berlaku mengikuti masa berlaku izin PBF
Kelima : Keputusan ini mulai berlaku pada tanggal ditetapkan.
Ditetapkan di: ……….…….
1. Direktur Jenderal Bina Kefarmasian dan Alat Kesehatan, Kementerian Kesehatan RI 2. Kepala Badan Pengawas Obat dan Makanan
3. Kepala Balai Besar/Balai Pengawas Obat dan Makanan di ... 4. Kepala Dinas Kesehatan Kabupaten/Kota ...
29 Formulir-10
Nomor : ………..….. Lampiran :
Perihal : Pernyataan siap melaksanakan kegiatan Kepada Yth.
Kepala Dinas Kesehatan Provinsi ... di –
...
Dengan hormat,
Sehubungan dengan surat permohonan pengakuan sebagai PBF Cabang kami Nomor
………. tanggal ………….. dan menunjuk ketentuan Pasal 10 ayat (6) Peraturan Menteri
Kesehatan Nomor...… tentang Pedagang Besar Farmasi dengan ini kami menyatakan bahwa PT/Koperasi ……… yang beralamat di Jl. ………… telah siap untuk melaksanakan kegiatan sebagai PBF Cabang.
Demikian pernyataan ini kami sampaikan, atas perhatiannya diucapkan terima kasih.
Apoteker Calon Penanggung Jawab Kepala Cabang
(...) (...)
Tembusan:
1. Direktur Jenderal Bina Kefarmasian dan Alat Kesehatan, Kementerian Kesehatan RI 2. Kepala Badan Pengawas Obat dan Makanan