BAB 2
TINJAUAN PUSTAKA
2.1 Tumbuhan Azalea (Rhododendron kamfaeri Planch)
Azalea (Rhododendron spp.) banyak ditanam dipegunungan. Azalea pada dasarnya dapat bertumbuh dalam rumah kaca dan dapat berbunga pada kondisi apapun. Azalea terlihat sangat indah ketika mekar (Baudendistel, 1982).
Bunga Azalea mempunyai ragam merah yang berbeda-beda , ada juga yang berwarna kuning dan putih. Memiliki dua jenis kelopak bunga yakni tunggal dan ganda. Daunnya tunggal berbentuk lonjong dan tumbuh di semua cabang. Azalea sebaiknya tidak terkena sinar matahari langsung, memerlukan sirkulasi udara yang sejuk dan tidak lembab. Bila daun-daunnya kekuningan , tandanya azalea sedang kurang sehat. Tanaman ini tidak memerlukan banyak air (Don, 2006). Azalea dapat ditanam secara soliter atau berkelompok. Bentuk bunganya menyerupai baling-baling kapal. Tanaman asal India ini akan berbunga sepanjang tahun terutama jika mendapat pencahayaan yang baik (Ratnasari, 2007).
Berikut ini merupakan sistematika Tumbuhan Azalea berdasarkan hasil determinasi dari Herbarium Medanense, Universitas Sumatera Utara :
Kingdom : Plantae Divisi : Spermatophyta Class : Dicotyledonae Ordo : Ericales Famili : Ericaceae Genus : Rhododendron
2.1.1 Jenis Tumbuhan Azalea
Bunga Azalea banyak dibudiayakan oleh banyak ahli Hortilkutura. Azalea sering kali digambarkan berdasarkan bentuk bunga dan berdasarkan waktu mekar. Bunga azalea memiliki jenis alami (native). Bunga Azalea banyak dilakukan persilangan sehingga menghasilkan jenis hybrid. Berikut ini merupakan beberapa jenis bunga azalea berdasarkan bentuk bunga.
1. Azalea alami
Bunga Azalea alami banyak sekali tumbuh di daerah Georgia. Dan memilki warna bunga dari putih ke pink, kuning, oranye, dengan ujung bunga berbentuk tajam. Berikut ini merupakan beberapa jenis bunga azalea alami:
a. Alabama Azalea, R. alabamense b. Piedmont Azalea, R. canescens c. Flame Azalea, R. calendulaceum) 2. Azalea Hybrid
Azalea alami disilang sehingga menghasilkan jenis Azalea hybrid. Azalea ini dihasilkan dengan berbagai warna dan bentuk. Berikut ini beberapa jenis bunga Azalea Hybrid:
a. Kurume hybrid b. Glenn Dale hybrid c. Back Acre hybrid d. Robin Hill hybrid
Bunga Azalea pada saat ini telah memiliki banyak jenis, sehingga banyak hybrid bunga Azalea digunakan untuk menciptakan hybrid Azalea yang lainnya (Wade, 2013)
2.2 Senyawa Bahan Alam
Bahan alam didefinisikan sebagai senyawa organik dengan bobot molekul antara 100 hingga 2000. Dimana bahan alam ini dapat digunakan dalam bentuk tanaman mentah, bahan makanan, resin, dan eksudat tanaman atau ekstrak bahan tanaman. Secara historis bahan alam merupakan inti pengobatan dan masih menjadi sumber utama obat, istilah yang digunakan untuk menjelaskan senyawa yang dapat dikembangkan menjadi obat. Bahan alam telah menjadi dasar pengobatan, dan bahkan sekarang, banyak senyawa yang penting bagi farmasi dan kedokteran yang diperoleh dari sumber alam. Masyarakat umum telah lama tertarik pada bahan alam, yang memberikan kesan aman dan nontoksik ( Herbert, 1995).
Senyawa bahan alam yang beraneka ragam pada umumnya dikelompokkan berdasarkan kesamaan strukturnya atau jalur biosintesisnya. Zat essensial untuk hidup digunakan untuk dasar-dasar kehidupan ; tumbuh, berkembang, dan bereproduksi. Sedangkan zat pendukung kehidupan digunakan sebagai zat pertahanan dari gangguan mahluk lain, menarik mahluk lain, dan untuk menetralkan racun. Senyawa alami secara umum adalah molekul kimia berupa mineral, metabolit primer, dan metabolit sekunder. Bahan alam dibedakan menjadi dua berdasarkan fungsi terhadap mahluk hidup yakni Metabolit Primer dan Metabolit Sekunder (Saifudin, 2014).
2.3 Senyawa Metabolit Sekunder
Metabolit sekunder adalah senyawa yang disintesis oleh tumbuhan, mikrobia, atau hewan melalui proses biosintesis yang menunjang kehidupan. Sifat-sifat kimiawi metabolit sekunder umumnya memiliki berat molekul yang kecil dan umumnya tidak larut dalam air karena bersifat semi polar, dan struktur kimianya sangat beragam. Metabolit sekunder sangat banyak dijumpai dialam dan ditemukan hal baru setiap tahun dikarenakan dilakukan penelitian biosintesis metabolit sekunder dilaboratorium. Dengan demikian beerdasarkan jalur biosintesis, metabolit sekunder digolongkan menjadi gologan asetat ( poliketida dan asam lemak), golongan mevalonat (terpenoid), golongan shikimat ( fenil propanoid), dan golongan alkaloid ( Saifudin, 2014).
Pada jaman modern senyawa organik yang diisolasi dari kultur mikroorganisme, seperti halnya dari tanaman,telah banyak digunakan untuk mengobati berbagai macam penyakit. Senyawa-senyawa organik yang berasal dari sumber-sumber alami ini menyusun suatu kelompok besar yang disebut produk-produk alami (natural products), atau yang lebih dikenal sebagai metabolit sekunder. Metabolit sekunder dapat dibedakan secara akurat dari metabolit primer berdasarkan kriteria berikut: penyebarannya terbatas, terdapat terutama dalam tumbuhan dan mikroorganisme. Metabolit sekunder tidaklah bersifat essensial untuk kehidupan. Hal yang menarik untuk diperhatikan ialah bahwa metabolit sekunder dibiosintesis terutama dari banyak metabolit-metabolit primer: asam amino, asetil koenzim A, asam mevalonat, dan zat antara (intermediate) dari alur shikimat ( Herbert, 1995).
2.4 Senyawa Flavonoida
Senyawa flavonoida sebenarnya terdapat pada semua bagian tumbuhan termasuk daun, akar, kayu, kulit, tepung sari, bunga, buah, dan biji. Kebanyakan flavonoida ini berada didalam tumbuh-tumbuhan, kecuali alga. Namun ada juga flavonoida yang terdapat pada hewan, misalnya dalam kelenjar bau berang-berang dan sekresi lebah (Markham, 1998).
Menurut Rahmat (2009) yang dikutip dari Peterson dan Dawyer (2000), antosianin adalah flavonoid bermuatan yang biasanya berikatan dengan gula. Antosianin memberikan warna merah, biru dan ungu pada buah-buahan dan sayur-sayuran. Flavonon ditemukan pada famili jeruk. Flavon umumnya ditemukan pada daun , sedangkan isoflavon seringkali ditemukan dalam kacang-kacangan terutama kacang kedelai. Isoflavon berbeda dari flavon dengan penempatan cincin benzene. Banyak tanaman obat menunjukkan khasiatnya yang baik seiring dengan tingginya kandungan quercetin. Quercetin memiliki aktivitas anti peradangan dan anti tumor.
2.4.1 Struktur senyawa flavonoida
Senyawa flavonoida pada umumnya digambarkan sebagai senyawa bahan alam yang terdiri dari karbon-karbon yang dihubungkan yaitu 𝐶𝐶6-𝐶𝐶3-𝐶𝐶6. Struktur flavonoida dibagi kedalam tiga kelas berdasarkan pada posisi ikatan terhadap cincin aromatic dengan benzopiran, pembagian kelas struktur flavonoida tersebut yakni : Flavonoid (gambar 2.1), isoflavonoid (gambar 2.2), neoflavonoid ( gambar 2,3), Struktur dari pembagian flavonoida dapat dilihat pada gambar berikut :
Gambar 2.1 Flavonoid Gambar 2.2 Isoflavonoid
Gambar 2.3 Neoflavonoid
Struktur dari Flavonoid diatas dihubungkan secara biogenetik oleh prekursor yang sama yaitu khalkon (Grotewold, 2006).
2.4.2 Klasifikasi Senyawa Flavonoida
Flavonoid merupakan salah satu kelas dari polifenol yang terdiri dari beberapa sub kelas seperti flavones, flavonol, flavanonol, flavanon, flavan, dan antosianin. Flavonoid juga sering dijumpai dalam bentuk aglikon yaitu pada saat hidrogennya tidak tersubstitusi oleh gula. Namun dialam flavonoida sering dijumpai dalam membentuk ikatan dengan glikosida (Rahmat, 2009).
O 2 O 3 O 4
Flavonoida mengandung sistem aromatik yang terkonjugasi sehingga menunjukkan pita serapan kuat pada daerah spektrum sinar ultraviolet dan spektrum sinar tampak, umumnya dalam tumbuhan terikat gula yang disebut dengan glikosida (Harbone, 1996)
Menurut Markham klasifikasi Flavonoida terdiri atas : 1. Flavonoida O-Glikosida
Flavonoid biasanya terdapat sebagai flavonoid O-Glikosida; pada senyawa tersebut satu gugus hidroksil flavonoid ( atau lebih) terikat pada satu gula (atau lebih) dengan ikatan hemiasetal yang tak tahan asam. Pemutusan gula dari flavonoid dapat dilakukan dengan menambahakan asam.
2. Flavonoida C-Glikosida
Gula dapat juga terikat pada atom karbon flavonoid dan dalam hal ini gula tersebut terikat langsung pada ini benzene dengan suatu ikatan karbon-karbon yang tahan asam, glikosida yang demikian disebut C-glikosida.
3. Flavonoida sulfat
Golongan flavonoid lain yang mudah larut dalam air yang mungkin ditemukan hanya sulfat. Senyawa ini mengandung satu ion sulfat , atau lebih, yang terikat pada hidroksil fenol atau gula. Secara teknis senyawa ini sebenarnya bisulfat karena terdapat sebagai garam , yaitu flavon-O-SO3K.
4. Biflavonoida
Seperti yang ditunjukkan oleh namanya, biflavonoid adalah suatu flavonoid dimer. Flavonoid yang biasanya terlibat ialah flavon dan flavanon. Ikatan antara flavonoid dapat berupa ikatan karbon-karbon atau ikatan eter. Biflavonoid jarang ditemukan dalam bentuk glikosida, dan penyebarannya terbatas.
5. Aglikon flavonoida yang optis aktif
Sejumlah aglikon flavonoid mempunyai atom karbon asimetrik dan dengan demikian menunjukkan keaktifan optik (yaitu memutar cahaya terpolarisasi-datar) ( Markham, 1981).
Menurut Robinson (1995), flavonoida dapat dikelompokkan berdasarkan keragaman pada rantai C3 yaitu :
1. Katekin dan proantosianidin
Katekin dan proantosianidin adalah dua golongan senyawa yang mempunyai banyak kesamaan. keduanya senyawa tak berwarna, terdapat pada seluruh dunia tumbuhan terutama pada tumbuhan berkayu. Berikut ini merupakan struktur dari katekin pada gambar 2.4 berikut :
Gambar 2.4 Struktur Katekin
Proantosianidin dipilah kedalam tiga kelompok:
a. Leukoantosianidin klasik adalah flavan 3,4 diol. Contoh Leukoantosianidin adalah Melaksidin. Struktur dari Melaksidin dapat dilihat pada gambar 2.5 berikut:
Gambar 2.5 Struktur Melaksidin
b. Struktur dimer yang pada pemanasan dengan asam menghasilkan satu molekul katekin dan satu molekul antosianidin ditambah hasil sekunder rumit yang lain.
c. Polimer, yang terdiri atas monomer Flavonoid, tetapi yang lainnya mungkin membentuk ikatan glikosida dengan polisakarida
HO OH O OH OH OH H H H O OH HO OH OH OH OH H OH
2. Flavanon dan Flavanonol
Flavanon sering terdapat sebagai aglikon dan terdistribusi luas dialam. Terdapat dalam kayu, daun, dan bunga. Tetapi beberapa flavanon terdapat dalam bentuk glikosida, contoh nerigenin. Struktur Flavanon dapat dilihat pada gambar 2.6 berikut :
Gambar 2.6 Struktur Flavanon
Flavanonol barangkali merupakan flavonoid yang paling kurang dikenal. Senyawa ini berkhasiat sebagai antioksidan. Sebagian besar senyawa ini diabaikan karena keberadaannya sedikit dan tidak berwarna. Struktur flavanonol dapat dilihat pada gambar 2.7 berikut :
Gambar 2.7 Struktur flavanonol 3. Flavon , flavonol, isoflavon
Flavon dan flavonol merupakan senyawa yang paling tersebar luas dari semua pigmen tumbuhan kuning, Flavon larut dalam pelarut organik dan berikut struktur Flavon dalam gambar 2.8 :
Gambar 2.8 Struktur flavon
O O O O O OH O
O O
Flavonol lazim sebagai konstituen tanaman yang tinggi dan terdapat dalam berbagai bentuk terhidroksilasi. Flavonol paling sering terdapat sebagai glikosida, biasanya 3-glikosida, dan aglikon flavonol yang umum yaitu kamferol, kuersetin, dan mirisetin yang berkhasiat sebagai antioksidan dan antiimflamasi. Berikut pada gambar 2.9 struktur Flavonol :
Gambar 2.9 Struktur flavonol
Isoflavon adalah 3-fenil kromon tidak begitu menonjol, tetapi senyawa ini penting sebagai fitoeleksin (senyawa pelindung) dan beberapa isoflavon menujukkan aktivitas sebagai insektida, dan antifungi. Berikut pada gambar 2.10 struktur dasar dari Isoflavon :
Gambar 2.10 Struktur Isoflavon
4. Antosianin
Antosianin adalah pigmen daun bunga merah sampai biru yang biasa (meski pun apigenidin kuning). Struktur dasar dari Antosianin dapat dilihat pada gambar 2.11:
Gambar 2.11 Struktur Antosianin
O O
OH
O
5. Khalkon dan dihidrokalkon
Khalkon terdapat dalam sejumlah tanaman, namun distribusinya dialam tidak banyak. Struktur khalkon merupakan struktur dasar dari flavonoid. Berikut struktur khalkon pada gambar 2.12:
Gambar 2.12 Struktur Khalkon
Dihidrokhalkon jarang terdapat di alam. Phlorizin adalah salah satu jenis dari Dihidrokhalkon.Phlorizin telah lama dikenal dalam bidang farmasi, berikut struktur phlorizin pada gambar 2.13 :
Gambar 2.13 Struktur Phlorizin 6. Auron
Auron berupa pigmen kuning emas terdapat dalam bunga tertentu. Struktur Auron pada gambar 2.14 berikut :
Gambar 2.14 Struktur Auron
O OH OH HO O Glukosa O CH O
2.5 Hidrolisa
Senyawa bahan alam sering ditemukan berikatan dengan senyawa lain. Salah satu yang senyawa yang berikatan dengan flavonoida adalah glukosa dan polisakarida. Flavonoid glikosida biasanya terdiri dari satu atau dua glikosida. Flavonoid yang terdiri dari dua glikosida disebut dengan diglikosida. Posisi kedua glikosida bisa berbeda (di- O glikosida dan di-C-O glikosida) ataupun dapat ditemuka dalam posisi yang sama ( O-glikosida dan C- glikosida) . Pemutusan gula ini berguna untuk memudahkan pemisahan pada kromatografi. Senyawa yang berikatan dengan O-, N-, dan S- glukosa dapat dengan mudah dihidrolisa menggunakan asam. Tetapi C-glukosa sedikit tahan dengan asam ( Dewick, 2002).
2.6 Teknik pemisahan
2.6.1 Ekstraksi
Metode ekstraksi paling sederhana dan menjadi pilihan adalah maserasi (perendaman). Yakni merendam material didalam pelarut. Maserasi (merendam dalam pelarut). Tahapan ekstraksi melewati dua mekasnisme dasar yaitu :
1. Disolusi : proses terendamnya senyawa target oleh solvent.
2. Difusi : proses terbawanya senyawa oleh solvent keluar dari sel. Dalam ekstraksi pemilihan pelarut ekstraksi sangat penting. Kegagalan
mengekstraksi biomassa dapat menyebabkan kehilangan zat aktif. Selain itu, penggunaan metode ekstraksi yang tidak tepat, seperti pemanasan terhadap biomassa dengan suatu pelarut, dapat menyebabkan penguraian bahan alam yang berakibat aktivitas biologisnya menjadi hilang. Terdapat juga metode ekstraksi sederhana yakni ekstraksi dingin. Ekstaksi dingin dilakukan dengan cara merendam sampel dengan pelarut yang sesuai dalam suhu kamar. Keuntungan cara ini merupakan metode ekstraksi yang mudah karena ekstrak tidak dipanaskan sehingga kemungkinan kecil bahan alam menjadi terurai(Heinrich, 2005).
2.6.2 Kromatografi
Kromatografi adalah istilah umum untuk berbagai cara pemisaham berdasarkan partisi cuplikan antara fase bergerak, dapat berupa gas atau zat cair, dan fase diam, dapat berupa zat cair atau zat padat. Kita mengetahui bahwa Tswett sebagai penemu kromatografi dimana pada tahun 1903 menguraikan karyanya mengenai pemakaian kolom kapur untuk memisahkan pigmen daun. Istilah Kromatografi dipakai oleh Tswett untuk menggambarkan daerah berwarna yang bergerak dibagian bawah kolom.
Dalam kromatografi terjadi pemisahan hal ini disebabkan molekul-molekul sampel tertahan oleh fase diam atau dibawa oleh fase gerak, tergantung pada afinitas senyawa untuk kedua fase tersebut (Jhonson, 1991). Kromatografi telah mengalami banyak perkembangan dan berikut merupakan gambar beberapa cabang dari kromatografi :
Kromatografi
Kromatografi Gas Kromatografi cair
Gas-Cair Gas-Padat
Pertukaran
Ion Eksklusi
Kromatografi
Partisi Penjerapan Cair- Padat
Kromatografi Kertas
Kromatografi Lapis Tipis
2.6.2.1 Kromatografi Kolom
Kromatografi kolom merupakan salah satu metode pemisahan kromatografi konvensional yang bersejarah karena dari sinilah bermula metode kromatografi. Kolom gelas dengan kran pada salah satu ujungnya diisi oleh fasa diam berupa silika atau alumina. Ukuran diameter partikel fasa diam berkisar 100 µm. campuran yang akan dipisahkan dituangkan pada bagian atas kolom yang berisi fasa diam. Begitu pula fase gerak berupa pelarut organik seperti heksan atau eter dialirkan dari bagian atas kolom. Komponen-komponen yang telah terpisah dari campurannya bergerak terbawa fase gerak ke bawah kolom. Jumlah komponen penyusun campuran dapat terlihat sebagai cincin-cincin berwarna sepanjang kolom gelas.
Akhirnya, komponen-komponen dari campuran meninggalkan kolom gelas satu persatu dan dapat ditampung pada tempat yang berbeda. Untuk melakukan pemisahan dengan metode kromatografi kolom diperlukan waktu yang relative lama, bisa berjam-jam hanya untuk memisahkan satu campuran. Selain itu, hasil pemisahan kurang jelas artinya kadang-kadang sukar mendapatkan pemisahan secara sempurna karena pita komponen yang satu bertumpang tindih dengan yang lainnya.. Ukuran patikel yang cukup besar membuat luas permukaan fase diam relative kecil sehingga tempat untuk berinteraksi antara komponen-komponen dengan fasa diam menjadi terbatas. Apabila ukuran diameter partikel diperkecil supaya luas permukaan fasa diam bertambah maka menyebabkan semakin lambatnya aliaran fasa gerak atau fasa gerak tidak mengalir sama sekali. Selain itu fasa diam yang sudah terpakai tidak dapat digunakan lagi untuk pemisahan campuran yang lain karena sukar meregenerasi fasa diam ( Hendayana, 2006).
Mekanisme pemisahan pada kromatografi pembagian dapat didasarkan pada perbedaan koefisien partisi komponen-komponen campuran dalam fase gerak dan fase diam. Kecepatan proses pemisahan dapat dinyatakan dengan harga Rf komponen campuran.
Rf=Laju perambat an komponen sampel Laju perambatan fase gerak
Adsorben yang digunakan harus memenuhi syarat berikut: 1. Tidak larut dalam pelarut yang digunakan
2. Inert
3. Cukup aktif sehingga memungkinkan permabatan sampel 4. Tidak berwarna agar pemisahan dapat diamati
5. Memungkinkan fase gerak dapat mengalir dengan baik 6. Dapat diproduksi dengan sifat konstan
Serta pemilihan adsorben diharapkan memiliki polaritas yang sama dengan sampel, sedangkan untuk pelarut digunakan pelarut yang memiliki sifat berlawanan. Bila digunakan pelarut yang kurang polar, pemisahan sempurna, tetapi lambat sehingga volume eluen yang diperlukan lebih banyak jika dibandingkan dengan pelarut yang lebih polar (Harmita, 2009).
2.6.2.2 Kromatografi Lapis Tipis
Kromatografi Lapis Tipis metode yang paling banyak digunakan untuk memurnikan sejumlah komponen. Metode ini menggunakan lempeng kaca atau aluminium yang telah dilapisi dengan penyerap (misalnya silika gel) dengan ketebalan tertentu tergantung pada jumlah bahan yang akan dimuat kedalam lempeng. Lempeng lapis penyerap sering menggunakan indicator fluoresensi (𝐹𝐹254) sehingga bahan alam yang mengabsorpsi sinar UV gelombang-pendek (254 nm) akan tampak sebagai bercak hitam pada latar hijau. Pada sinar UV gelombang-panjang, senyawa tertentu dapat menampakkan fluoresensi biru atau kuning terang (Heinrich, 2005).Kelebihan dari KLT pada penelitian Flavonoid ialah sebagai cara analisis cepat yang memerlukan bahan yang sangat sedikit.
KLT berguna untuk tujuan berikut:
a. Mencari pelarut untuk kromatografi kolom
b. Analisis fraksi yang diperoleh dari kromatografi kolom c. Identifikasi flavonoid secara ko-kromatografi
Plat Kromatografi Lapis Tipis dapat dibuat sendiri dengan adsorben yang telah disediakan dan sampel yang merupakan campuran senyawa yang akan dipisahkan, sampel dilarutkan dalam pelarut yang mudah menguap kemudian sampel tersebut ditotolkaan pada plat dengan menggunakan pipet mikro atau juga dapat menggunakan pipa kapiler. Tetesan sampel harus diusahakan sekecil mungkin dilakukan berulang kali dan dikeringkan. Plat Kromatografi Lapis Tipis yang telah diteteskan sampel dalam system pelarut untuk pengembangan. Pemilihan system pelarut dipakai berdasarkan atas prinsip like dissolve like, yang berarti pemilihan system pelarut berdasarkan kepolaran dari sampel dimana sampel yang bersifat nonpolar digunakan system pelarut yang non polar juga. berikut menurut Markham (1988) senyawa Flavonoida akan menunjukkan warna bercak khas yang dihasilkan pada penyerap kromatografi ( bisa digunakan kromatografi kertas dan lapis tipis) berdasarkan golongan flavonoid yang dikandung oleh ekstraksi sampel. Tabel 2.1 berikut warna bercak khas jenis flavonoida dengan menggunakan sinar UV:
Tabel 2.1 Warna Khas Jenis Flavonoida dengan Sinar UV Warna bercak Dengan sinar UV
Sinar UV Tanpa NH3
Sinar UV Dengan NH3
Jenis Flavonoid yang mungkin Tak Nampak Fluorosensi biru
muda
Isoflavon tanpa 5-OH bebas Kuning redup dan
kuning atau fluorosensi jingga
Perubahan warna sedikit atau tanpa perubahan
Flavonol yang mengandung 3-OH bebas dan dihidroflavonol
Fluorosensi kuning
Jingga atau merah Auron yang mengandung 4’OH bebas dan 2-4 OH khalkon
Hijau-kuning
Hijau-biru atau hijau
Perubahan warna sedikit atau tanpa perubahan
a. Auron yang tak mengandung 4’OH bebas dan flavanon tanpa 5-OH bebas b. Flavonol yang mengandung 3-OH bebas dan disertai atau tanpa 5-OH bebas Merah jingga
redup atau merah senduduk
Biru Antosianidin 3-Glikosida
Merah jambu atau fluorosensi kuning
Biru Sebagian besar antosianidin 3,5
Kromatografi sering digunakan untuk uji pendahuluan kandungan flavonoida suatu ekstrak, dengan menggunakan pelarut alcohol dan bejana sebagai penyangga serta menggunakan sinar UV untuk mengidentifikasi golongan senyawa flavonoid dalam suatu ektraksi sampel.
Proses pengembangan akan lebih baik bila ruangan pengembangan dalam kondisi tertutup. Dan visualisasi kromatogram dapat dilakukan dengan menggunakan sinar UV (Adnan, 1997)
2.6.2.3 Komatografi Lapis Tipis Preparatif
KLT berskala preparatif memiliki kelebihan dibandingkan dengan KLT biasa, dimana dapat menghasilkan bahan yang cukup murni untuk uji biologis dan elusidasi struktur. KLT Preparatif digunakan sebagai prosedur pembersih akhir untuk pemisahan 2-4 senyawa (Heinrich, 2005). Pada KLT preparative, cuplikan yang akan dipisahkan ditotolkan berupa garis pada salah satu sisi plat dan dikembangkan secara tegak lurus pada garis cuplikan sehingga campuran akan terpisah menjadi beberapa pita. Pita ditampakkan dengan menggunakan sinar UV dan penyerap yang mengandung pita dikerok dari plat kaca (Gritter, 1991 ).
Penjerap Kromatografi Lapis Tipis mengandung pengikat dan indikator fluorosensi yang susunan kimianya biasanya tidak ketahui. Ketika senyawa yang dipisahkan dengan KLTP diekstraks, pengikat, indicator, dan pencemar lain kemungkinan besar terekstraksi pula. Makin polar pelarut pengekstraksi makin banyak bahan yang tidak diinginkan yang terekstraksi. Fase gerak biner sangat sering dipakai pada pemisahan secara KLTP : n-heksana : etilasetat, n-heksana : aseton. Serta pengembangan plat KLTP biasanya dilakukan dalam bejana kaca yang dapat menampung beberapa plat. Keefesienan pemisahan dapat ditingkatkan dengan cara pengembangan berulang (Hostettman, 1995)
2.7 Adsorben
Adsorben dapat bersifat polar atau non polar. Silika gel dan alumina, adsorben yang paling banyak digunakan dalam kromatografi, kedua-duanya bersifat polar. Kedua adsorben tersebut lebih mudah mengadsorbi solute yang bersifat lebih polar dari pada solute yang bersifat nonpolar. Dengan demikian alkohol akan teradsorbsi lebih kuat daripada eter dan selanjutnya dari pada senyawa- senyawa hidrokarbon. Sebagai contoh adsorben yang nonpolar adalah charcoal (Adnan, 1997 ). Silika dan Alumina mempunyai gugus hidroksil antaraksi yang menentukan sifat penjerapan. Jumlah dan tatasusun gugus hidroksil ini menentukan keaktifan. Makin besar jumlah gugus hidroksil pada senyawa, makin kuat senyawa itu ditahan. Begitu juga dengan tatasusun isomer dari senyawa maka urutan elusi dari yang paling lemah adalah orto, meta dan para ( Johnson, 1991).
Berikut ini merupakan beberapa jenis adsorben yang sering digunakan pada kromatografi untuk pemisahan senyawa bahan alam khususnya Flavonoida :
1. Selulosa
Selulosa ideal digunakan untuk memisahkan glikosida yang satu dengan yang lain, atau memisahkan glikosida dari aglikon, serta unuk memisahkan aglikon yang kurang polar.
2. Silika
Silika paling banyak digunakan untuk memisahkan aglikon yang kurang polar, misalnya isoflavon, flavanon, metil flavon , dan flavonol.
3. Poliamida
Poliamida cocok untuk memisahkan semua flavonoid. Tetapi dapat mencemari fraksi-fraksi.
4. Gel sephadex
Bahan ini dirancang untuk memisahkan campuran, terutama berdasarkan pada ukuran molekul (bila digunakan pelarut air); molekul besar terelusi lebih dahulu. Pada cara ini sephadex berguna untuk memisahkan poliglikosida yang berbeda bobot molekulnya, bila sebagai pengelusi dipakai pelarut organik (Markham, 1988).
2.8 Teknik Spektroskopi
Spektroskopi adalah studi mengenai interaksi energy elektromagnetik dengan materi. Dalam Kimia Organik lebih dikenal dengan spektroskopi molecular (Field et al. 2008). Teknik spektroskopi merupakan cara yang terbaik saat ini untuk penentuan struktur senyawa organik karena dapat dilakukan dalam waktu singkat dan jumlah sampel yang sedikit (mg atau µg ). Pada saat ini teknik-teknik spektroskopi sangat berkembang, bahkan stereokimia dan posisi gugus-gugus fungsi pembentuknya dapat ditentukan. Penentuan struktur kimia senyawa organik secara spektroskopi dapat dilakukan jika senyawa organik tersebut dalam keadaan murni, adanya pengotor akan dihasilkan spektra yang lebih kompleks sehingga menyulitkan dalam interpretasi spektra. Setiap senyawa organik akan menyerap energy gelombang elektromagnetik yang berbeda-beda, oleh karena itu teknik-teknik spektroskopi dapat digunakan untuyk menentukan struktur senyawa organik yang tak diketahui atau untuk mempelajari karakteristik ikatan dari senyawa-senyawa organik yang diketahui (Supratman, 2010).
2.8.1 Spektrofotometri Ultra Violet dan Visibel (UV-VIS)
Kegunaan spektrometri UV-VIS ini terletak pada kemampuannya mengukur jumlah ikatan rangkap atau konjugasi aromatik didalam suatu molekul. Letak serapan dapat dipengaruhi oleh substituent (ausokrom) yang menimbulkan pergeseran dalam diena terkonjugasi, senyawa aromatic dan karbonil terkonjugasi. Satuan yang digunakan utuk panjang gelombang ini adalah nanometer (nm =
109m). spektrum tampak terentang dari 400 nm (ungu) ke 750 nm (merah), sedangkan ultraviolet berjangka dari 200 nm ke 400 nm (Supratman, 2010). Karena penyerapan radiasi ultraviolet atau tampak oleh molekul mengarah transisi antara tingkat energi elektronik molekul , maka spektroskopi ini sering disebut sebagai spektroskopi elektronik. Spektrum UV – Vis biasanya diukur dalam larutan yang sangat encer dan kriteria yang paling penting dalam pilihan pelarut. Biasanya digunakan pelarut yang tidak memiliki ikatan rangkap (Kumar, 2006).
Spekrofotometer UV-VIS pada umumnya digunakan untuk :
1. Menentukan jenis kromofor, ikatan rangkap yang terkonjugasi dan ausokrom dari suatu senyawa organik.
2. Menjelaskan informasi dari struktur berdasarkan panjang gelombang maksimum suatu senyawa
3. Mampu menganalisis senyawa organik secara kuantitatif dengan menggunakan hukum Lambert-Beer.
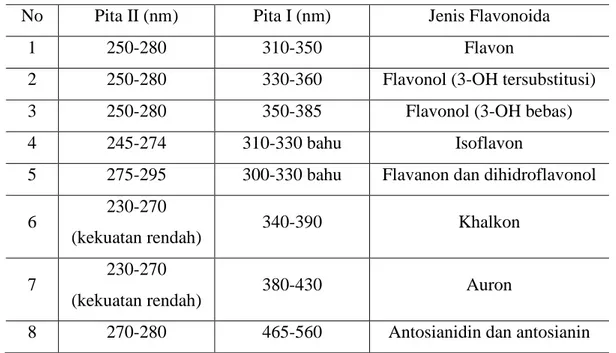
Sinar ultraviolet berada pada panjang gelombang 200-400 nm sedangkan sinar tampak berada pada panjang gelombang 400-800 nm (Dachriyanus, 2004) Spektrum flavonoid biasanya ditentukan dalam larutan dengan pelarut metanol (MeOH, ) atau etanol (EtOH), meski perlu diingat bahwa spektrum yang dihasilkan dalam etanol kurang memuaskan sehingga pada umumnya pelarut metanol yang digunakan untuk menentukan serapan pita yang dihasilkan. Perubahan penyulihan pada cincin A cenderung tercerminkan pada serapan pita II, sedangkan perubahan penyulihan pada cincin B dan C cenderung lebih jelas tercermin pada serapan pita I (Markham, 1988).
Tabel 2.2 Rentangan Serapan Spektrum UV-Visible golongan Flavonoida No Pita II (nm) Pita I (nm) Jenis Flavonoida
1 250-280 310-350 Flavon
2 250-280 330-360 Flavonol (3-OH tersubstitusi)
3 250-280 350-385 Flavonol (3-OH bebas)
4 245-274 310-330 bahu Isoflavon
5 275-295 300-330 bahu Flavanon dan dihidroflavonol
6 230-270
(kekuatan rendah) 340-390 Khalkon
7 230-270
(kekuatan rendah) 380-430 Auron
2.8.2 Spektrofotometer Inframerah (IR)
Spektroskopi inframerah tentunya merupakan salah satu teknik analisis yang paling penting untuk para ilmuwan saat ini . Salah satu keuntungan besar dari inframerah spektroskopi adalah hampir semua sampel di hampir semua negara dapat dipelajari .Cairan, pasta , bubuk , film , serat , gas dan permukaan semua bisa diperiksa dengan pilihan teknik sampling . Akhirnya dilakukanlah berbagai pengembangan instrumentasi , dengan berbagai teknik sensitive dikembangkan dalam rangka untuk memeriksa sampel. Spektrometer inframerah telah tersedia secara komersial sejak tahun 1940-an.
Spektroskopi inframerah adalah suatu teknik yang didasarkan pada getaran dari atom molekul . Spektrum inframerah umumnya diperoleh dengan melewatkan sinar radiasi inframerah melalui sampel dan radiasi akan diserap pada energi tertentu . energi di mana setiap puncak dalam penyerapan spektrum muncul bersesuaian dengan frekuensi getaran dari bagian dari sampel molekul . Getaran molekul akan dilihat di sini , karena ini penting untuk interpretasi spektrum inframerah.
Suatu molekul akan memberikan suatu ciri khusus pada penyerapan Inframerah, karena momen dipole listrik pada molekul tersebut akan berubah ketika bergetar. Ini adalah aturan batasan untuk spektroskopi inframerah. Getaran melibatkan perubahan panjang ikatan stretching ( peregangan ) atau bending ( menekuk ). Beberapa stretching biasanya berbentuk simetris dan bending biasanya berbentuk asimetris.molekul memiliki atom-atom yang berbeda seperti HCN , ClCN atau ONCl , maka panjang ikatan tidak lagi simetris dan getaran asimetris yang sama (Stuart, 2004). Dua molekul senyawa yang memiliki struktur kimia yang berbeda akan memiliki spektrum inframerah yang berbeda pula. Hal ini dapat dimengerti karena kedua molekul tersebut memiliki jenis ikatan dan frekuensi vibrasi yang berbeda. Walaupun memilki jenis ikatan yang sama, ikatan-ikatan tersebut berada dalam dua senyawa yang berbeda sehingga mempunyai frekuensi vibrasi yang berbeda (karena kedua ikatan yang sama tersebut berada dalm lingkungan yang berbeda).
Dengan demikian , spektrum inframerah dapat dikatakan sebagai sidik jari suatu molekul, seperti yang dimiliki oleh setiap orang ( Harmita, 2002).
Suatu ikatan dalam sebuah molekul dapat mengalami berbagai vibrasi molekul. Secara umum terdapat dua tipe vibrasi molekul:
Stretching (vibrasi regang/ulur) : vibrasi sepanjang ikatan sehingga terjadi perpanjangan atau pemendekan ikatan.
Bending (vibrasi lentur/tekuk) : vibrasi yang disebabkan oleh sudut ikatan sehingga terjadi pembesaran atau pengecilan sudut ikatan. Gerakan vibrasi yang teramati dengan spektrum inframerah jika menghasilkan perubahan momen dipole (µ≠0) sedangkan jika (µ=0) akan teramati dalam spektrum raman.
Oleh karena itu suatu ikatan tertentu dapat menyerap energy lebih dari satu panjang gelombang. Contohnya ikatan O-H menyerap energy pada frekuensi 3330 cm-1 ; energy pada panjang gelombang ini menyebabkan kenaikan vibrasi regang ikatan O-H itu. Suatu ikatan O-H itu juga menyerap pada kira-kira 1250-1 ; energy pada panjang gelombang ini menyebabkan kenaikan vibrasi lentur. Tipe vibrasi yang berlain-lainan ini disebut dengan vibrasi fundamental.
Berikut ini merupakan beberapa serapan karakteristik gugus fungsi molekul organik:
1. Karbon-Karbon dan Karbon-Hidrogen
Ikatan antara atom sp3 (ikatan tunggal C-C) mengakibatkan adanya pita serapan yang lemah dalam spektrum inframerah. Ikatan antara karbon sp2 (C=C) seringkali menunjukkan absorpsi karakteristik sekitar 1600-1700 cm-1. Ikatan karbon-karbon aril menunjukkan serapan pada frekuensi sedikit lebih rendah (lebih kekanan dalam spektrum itu), hal ini diakibatkan adanya delokalisasi electron 𝜋𝜋 sehingga orde ikatan berkurang. Ikatan antara karbon sp (C≡C) menunjukkan serapan yang lemah, tetapi sangat karakteristik, pada 2100-2250 cm-1, suatu daerah spektrum dimana kebanyakan gugus-gugus lain tidak menunjukkan absorpsi.
Hampir semua senyawa organik mengandung ikaatan C-H. serapan yang disebabkan oleh vibrasi regang C-H seringkali berguna dalam menetapkan hibridisas atom karbonnya.berbagai jenis ikatan C-H menunjukkan serapan dibagian tertentu dari daerah regang C-H (3300-2700 cm-1 dan tergantung juga dengan posisi relative C-H dari gugus fungsi.
2. Senyawa karbonil
Salah satu pita dalam spektrum inframerah yang paling berbeda ialah pita yang disebabkan oleh modus vibrasi regang karbonil. Pita ini merupakan pita kuat dijumpai pada daerah 1640-1820 cm-1. Gugus karbonil merupakan bagian dari sejumlah gugus fungsional.
3. Eter
Eter mempunyai suatu pita yang berasal dari vibrasi regang C-O yang terletak dalam daerah sidik jari pada 1050-1260 cm-1 karena oksigen bersifat elektronegatif, regang akan menyebabkan perubahan besar dalam momen ikatan.
4. Alkohol
Alkohol menunjukkan serapan regang O-H yang jelas pada 3000-3700 cm-1, disebelah kiri serapan C-H. Ikatan hydrogen mengubah posisi pada penampilan pita serapan inframerah. Bila ikatan hydrogen kurang ekstensif akan Nampak pita O-H yang lebih runcing dan kurang intensif (Supratman,2010)
Spektrofotometer inframerah pada umumnya digunakan untuk: 1. Menentukan gugus fungsi suatu senyawa organik
2. Mengetahui informasi struktur suatu senyawa organik dengan membandingkan daerah sidik jarinya.
2.8.3 Spektroskopi Resonansi Magnetik Inti Proton
Spektroskopi resonansi magnet proton dapat digunakan untuk menentukan jenis lingkungan atom yang berbeda yang ada didalam molekul; jumlah atom hydrogen pada atom karbon tetangga. Sinyal-sinyal resonansi muncul karena proton-proton dalam molekul berada dalam molekul berada dalam lingkungan kimia yang berlainan. Sinyal-sinyal resonansi tersebut letaknya terpisah karena adanya geseran kimia (chemical shift). beberapa sinyal tidak berupa garis tunggal tetapi mengikuti pola pemecahan (splitting) yang karakteristik, seperti doublet, triplet, dan kuartet. Pemecahan disebabkan oleh pengandengan spin-spin (spin-spin coupling), yaitu interaksi magnetic suatu inti dengan inti yang lain (Harmita,2009).
Chemical shift dan spin-spin coupling berhubungan dengan lingkungan kimia pada inti. Sebuah spektrum 1H NMR adalah grafik antara frekuensi resonansi (chemical shift) vs. intensitas absorpsi Rf oleh sampel. Spektrum biasanya dikalibrasikan kedalam ppm (parts per million) (Field et al, 2008).
Pergeseran kimia (chemical shift) dapat diukur dalam Hz tapi sering digambarkan dalam ppm.
Chemical shift (δ) dalam ppm =pergeseran kimia dari TMS dalam Hz
frekuensi spektrometer dalam MHz
Dalam 1H NMR, yang diukur adalah perbedaan antara frekuensi resonansi suatu jenis proton dan frekuensi resonansi proton senyawa pembanding, misalnya Tetrametilsilan (TMS). Dan pelarut yang tidak memiliki proton.TMS juga dapat digunakan untuk 13C-NMR karna alasan berikut :
1. Stabil secara kimia, simetris dan beresonansi.
2. Proton pada gugus metil senyawa ini lebih terperisai dibandingkan proton senyawa lain.
3. TMS memberikan signal yang tajam (singlet) 4. Bersifat inert dan titik didih rendah (26,5 oC)