BAB II
TINJAUAN PUSTAKA 2.1 Protein
Protein berasal dari bahasa yunani yaitu proteos, yang bearti yang utama atau yang di dahulukan. Kata ini diperkenalkan oleh ahli kimia Belanda, Geraldus Mulder (1802-1880). Ia berpendapat bahwa protein adalah zat yang paling penting dalam setiap organisme (Ellya, 2010).
Protein merupakan polimer yang panjang dari asam-asam amino yang bergabung melalui ikatan peptida. Komposisi rata-rata unsur kimia yang terdapat dalam protein adalah karbon 55%, hidrogen 7%, oksigen 23%, nitrogen 16%, sulfur 1% dan kurang dari 1% fosfor (Winarno, 1991; Tarigan, 1983).
2.2 Non Protein Nitrogen (NPN)
NPN merupakan senyawa-senyawa bukan protein yang mengandung nitrogen seperti asam amino bebas, asam nukleat, amonia, urea, trimetilamina, (TMA), dimetilamina (DMA), nitrat dan lain-lain. Asam amino bebas yang terdapat dalam jaringan hidup merupakan hasil residu dari sintesis protein yang tidak rampung atau kemungkinan dari hasil degradasi dari protein, sedangkan dari asam amino bebas ini dapat terbentuk senyawa-senyawa NPN lainnya yang merupakan hasil deaminasi atau dekarboksilasi dari asam amino bebas, yang dikatalis oleh enzim-enzim tertentu (Bell, 1963).
Adanya NPN dalam bahan makanan yang kaya protein perlu diketahui untuk memberi gambaran nilai gizi yang sebenarnya dari bahan makanan tersebut. Pada umumnya NPN yang terdapat dalam bahan makanan mentah hanya sedikit
dibandingkan dengan kandungan proteinnya. Jadi nilai gizi dari bahan mentah sebenarnya tidak begitu dipengaruhi oleh adanya NPN tersebut (Tarigan, 1983).
Pada bahan makanan yang telah mengalami perubahan-perubahan baik karena pengaruh kondisi dari luar ataupun karena proses pengolahannya kemungkinan sekali NPN-nya semakin bertambah, tergantung pada cara pengolahan yang diterapkan. Hasil peruraian protein pada proses pengolahan dapat terjadi sampai asam amino bebas yang tidak mempunyai nilai gizi lagi. Sehingga penentuan kadar NPN dalam bahan makanan yang telah diproses penting sekali untuk mengetahui nilai gizi yang sebenarnya tersedia dalam bahan makanan tersebut (Silalahi, 1994).
2.3 Ciri-ciri Molekul Protein
1. Berat molekulnya besar, ribuan sampai jutaan sehingga merupakan suatu makro molekul.
2. Umumnya terdiri dari 20 macam asam amino.
3. Terdapat ikatan kimia lain yang menyebabkan terbentuknya lengkungan-lengkungan rantai polipeptida menjadi struktur tiga dimensi protein.
4. Strukturnya tidak stabil terhadap beberapa faktor seperti pH, radiasi, temperatur, medium pelarut organik dan deterjen.
5. Umumnya reaktif dan sangat spesifik, disebabkan terdapatnya gugusan samping yang reaktif dan susunan khas struktur makromolekul (Ellya, 2010).
2.4 Sifat Protein 1. Denaturasi
Pada umumnya, protein sangat peka terhadap pengaruh-pengaruh fisik dari zat kimia, maka mudah mengalami perubahan bentuk. Perubahan atau modifikasi pada
terjadinya denaturasi adalah panas, pH, tekanan, aliran listrik, dan adanya bahan kimia seperti urea, alkohol, dan sabun. Temperatur merupakan titik tengah dari proses denaturasi yang disebut dengan melting temperature (Tm) yang pada umumnya protein mempunyai nilai Tm kurang dari 100ºC, apabila diatas suhu Tm, maka protein akan mengalami denaturasi. Protein yang mengalami denaturasi akan menurunkan aktivitas biologinya dan berkurang kelarutannya, sehingga mudah mengendap (Yazid, 2006). Sketsa proses denaturasi protein dapat dilihat pada Gambar 2.1 berikut ini:
Gambar 2.1 Sketsa proses denaturasi protein 2. Ion zwiter dan pH isoelektrik
Larutan asam amino dalam air mempunyai muatan positif maupun negatif sehingga asam amino disebut ion zwiter. Setiap jenis protein dalam larutan mempunyai pH tertentu yang disebut pH isoelektrik (berkisar 4-4,5). Pada pH isoelektrik molekul protein mempunyai muatan positif dan negatif yang sama, sehingga saling menetralkan atau bermuatan nol. Pada titik isoelektrik, protein akan mengalami pengendapan (koagulasi) paling cepat (Yazid, 2006).
Sifat ini timbul karena adanya gugus amino (-NH2) yang bersifat basa dan gugus karboksil (-COOH) yang bersifat asam yang terdapat pada molekul protein pada ujung-ujung rantainya, maka dengan larutan asam atau pH rendah, gugus amino pada protein akan bereaksi dengan ion H+, sehingga protein bermuatan positif, sebaliknya dalam larutan basa gugus karboksilat bereaksi dengan ion OH-, sehingga protein bersifat negatif. Adanya muatan pada molekul protein menyebabkan protein bergerak dibawah pengaruh medan listrik (Yazid, 2006).
4. Pembentukan ikatan peptida
Pembentukan ikatan peptida terbentuk karena sifat amfoternya, maka dua molekul asam amino atau lebih dapat bersenyawa satu sama lain dengan melepaskan satu molekul air membentuk ikatan antara gugus karboksil (-COOH) asam amino yang satu dengan gugus amino (-NH2) yang lain disebut dengan ikatan peptida. Senyawa yang dibentuk oleh 2 molekul asam amino dinamakan dipeptida, 3 molekul dinamakan tripeptida dan seterusnya sampai yang dibentuk oleh banyak molekul disebut polipeptida (Poedjiadi, 1994). Pembentukan ikatan peptida dapat dilihat pada Gambar 2.2 berikut ini:
Ikatan peptida H O H H O H H
H2N-C- C OH + H-N-C-COOH H2N- C-C-N-C-COOH + H2O R1 H R2 R1 R2
Asam amino Asam amino Dipeptida Gambar 2.2 Pembentukan ikatan peptida
2.5 Penggolongan Protein
Protein merupakan senyawa polipeptida yang tersusun dari berbagai jenis asam amino, sehingga sifat protein juga dapat ditentukan oleh sifat asam amino penyusunnya. Berdasarkan keanekaragaman penyusun struktur protein, maka penggolongan protein dilakukan dengan berbagai kriteria sebagai berikut:
A.Berdasarkan bentuk morfologisnya protein digolongkan atas dua golongan (Budianto, 2009), yaitu:
1. Protein serabut (fibrous protein) yaitu protein yang berbentuk serabut atau lempengan, terutama disusun oleh polipeptida primer dan sekunder. Contoh protein serabut adalah kolagen yang terdapat pada tulang rawan, miosin pada otot, keratin pada rambut, dan fibrin pada gumpalan darah.
2. Protein bulat (globular protein) yaitu protein yang berbentuk bulat atau lonjong, perbandingan panjang dengan tebal kurang dari 10, tersusun oleh polipeptida struktur tersier dan kuartener. Contoh protein globular adalah albumin terdapat dalam telur, susu, plasma dan hemoglobin; globulin terdapat pada otot, serum, kuning telur; histon terdapat dalam jaringan-jaringan kelenjar timus, pankreas, dan protamin.
B.Berdasarkan kelarutannya dalam air atau pelarut lain, protein digolongkan atas beberapa golongan (Winarno, 1991), yaitu:
1. Albumin: larut dalam air dan terkoagulasi oleh panas. Contohnya adalah ovalbamin (dalam telur), seralbumin (dalam serum), laktalbumin (dalam susu).
2. Skleroprotein: tidak larut dalam pelarut encer, baik larutan garam, asam, basa, dan alkohol. Contohnya kolagen (pada tulang rawan), miosin (pada otot), keratin (pada rambut).
3. Globulin: tidak larut dalam air, terkoagulasi oleh panas. Larut dalam larutan garam encer, dan dapat mengendap dalam larutan garam konsentrasi tinggi (salting out). Contohnya adalah miosinogen (dalam otot), ovoglobulin (dalam kuning telur), legumin (dalam kacang-kacangan).
4. Glutelin: tidak larut dalam pelarut netral, tetapi larut dalam asam atau basa encer. Contonya adalah glutelin (dalam gandum), orizenin (dalam beras).
5. Prolamin (gliadin): larut dalam alkohol 70-80% dan tidak larut dalam air maupun alkohol absolut. Contohnya adalah prolamin (dalam gandum), gliadin (dalam jagung), zein (dalam jagung).
6. Protamin: larut dalam air dan tidak terkoagulasi dalam panas.
7. Histon: larut dalam air dan tidak larut dalam amonia encer, dapat mengendap dalam pelarut protein lainnya, dan apabila terkoagulasi oleh panas dapat larut kembali dalam asam encer. Contohnya adalah globin (dalam hemoglobin).
C.Berdasarkan hasil hidrolisanya protein dibagi atas dua golongan (Budianto, 1991), yaitu:
1. Protein tunggal (protein sederhana): hasil hidrolisa dari asam-asam amino. Contohnya: albumin, globulin, keratin dan hemoglobin.
2. Protein jamak (protein konyugasi atau protein kompleks): adalah protein yang mengandung senyawa lain yang non protein, hasil hidrolisanya asam amino dan bukan asam amino. Contohnya glikoprotein terdapat pada hati, lipoprotein terdapat pada susu, dan kasein terdapat pada kuning telur.
D.Berdasarkan fungsi protein (Almatsier, 2004), yaitu:
2. Protein Pengangkut, mampu mengikat, membawa, dan melepaskan molekul protein tertentu, misalnya hemoglobin mengangkut O2 dalam darah, lipoprotein mengangkut lipida dalam darah dan mioglobin mengangkut O2 dalam otot.
3. Protein pembangun, sebagai protein pembangun dan pengganti protein yang rusak pada organel atau jaringan. Contohnya glikoprotein, keratin, kolagen dan elastin. 4. Protein otot, protein yang mengontrol gerak oleh otot, misalnya miosin dalam otot,
dinein dalam rambut.
5. Protein pertahanan tubuh, protein ini dikenal dengan imunoglobulin (Ig), dimana merupakan suatu protein khusus yang dapat mengenal, mengikat, dan menghancurkan benda-benda asing yang masuk dalam tubuh seperti virus, bakteri, dan sel asing, misalnya berbagai antibodi, fibrinogen (dalam proses pembentukan darah).
6. Protein hormon, sebagai pembentuk hormon, contohnya insulin.
7. Protein Racun, protein yang bersifat racun, misalnya risin dalam beberapa jenis beras, racun ular.
8. Protein Makanan, protein yang dijadikan sebagai cadangan energi, misalnya albumin, orizenin, dan sebagainya.
E. Berdasarkan strukturnya, protein digolongkan atas tiga golongan yaitu: 1. Struktur primer
Struktur primer adalah struktur dasar dari protein. Susunan linier asam amino dalam protein yang merupakan suatu rangkaian unik dari asam amino yang menentukan sifat dasar dari berbagai protein, dan secara umum menentukan bentuk struktur sekunder dan tersier (Martoharsono, 1998).
2. Struktur sekunder
Struktur sekunder adalah rantai polipeptida yang berlipat-lipat dan merupakan bentuk tiga dimensi dengan cabang-cabang rantai polipeptidanya tersusun saling berdekatan. Protein terbentuk oleh adanya ikatan hidrogen antar asam amino dalam rantai sehingga strukturnya tidak lurus, melainkan bentuk zig zag dengan gugus R mencuat keatas dan kebawah. Contoh struktur ini adalah bentuk α-heliks pada wol, serta bentuk heliks pada kolagen (Martoharsono, 1998). Skema α-heliks dapat dilihat pada Gambar 2.3 berikut ini:
Gambar 2.3Skema α-heliks
3. Struktur tersier
Struktur tersier adalah susunan dari struktur sekunder yang satu dengan struktur sekunder yang lain. Biasanya bentuk-bentuk sekunder ini dihubungkan oleh ikatan hidrogen, ikatan garam, ikatan hidrofobik, dan ikatan disulfida. Ikatan disulfida merupakan ikatan yang terkuat dalam mempertahankan struktur tersier protein (Gaman,
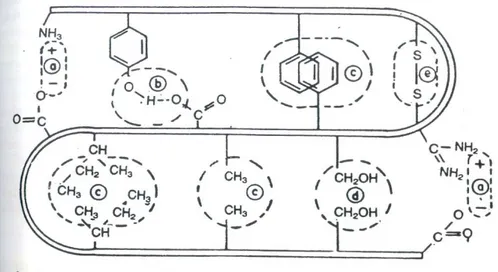
1992). Ikatan-ikatan yang mempertahankan struktur sekunder dan tersier protein dapat dilihat pada Gambar 2.4.
Gambar 2.4 Ikatan-ikatan yang mempertahankan struktur sekunder, dan struktur tersier protein; a. interaksi elektrostatik; b. ikatan hidrogen; c. interaksi hidrofobik; d. interaksi hidrofilik; e. ikatan disulfida 4. Struktur kuartener
Struktur primer, sekunder, dan tersier umumnya hanya melibatkan satu rantai polipeptida, tetapi bila struktur ini melibatkan beberapa polipeptida dalam membentuk suatu protein, maka disebut dengan struktur kuartener (Martoharsono, 1998). Tingkatan struktur protein dapat dilihat pada Gambar 2.5 berikut ini:
F. Berdasarkan sumbernya, protein digolongkan atas dua (Budianto, 2009) yaitu: 1. Protein hewani
Protein hewani adalah protein yang berasal dari hewan, dimana hewan yang memakan tumbuhan mengubah protein nabati menjadi protein hewani. Contoh daging sapi, daging ayam, susu, udang, telur, belut, ikan gabus dan lain-lain.
2. Protein nabati
Protein nabati adalah protein yang berasal dari tumbuh-tumbuhan. Contoh jagung, kacang kedelai, kacang hijau, dan jenis kacang-kacangan lainnya yang mengandung protein tinggi. Kacang kedelai merupakan sumber protein nabati yang mempunyai mutu atau nilai biologi tertinggi dan sedangkan yang relatif rendah mutunya dalam sumber protein adalah padi-padian dan hasilnya.
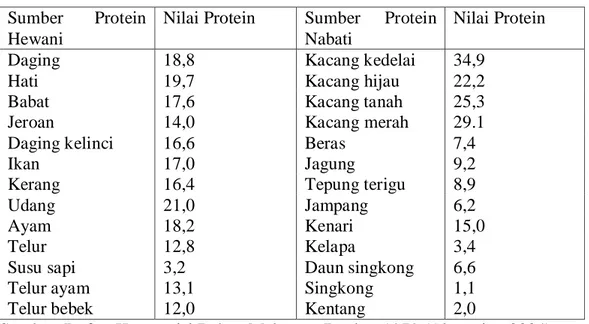
Nilai protein dalam berbagai bahan makanan dapat dilihat pada Tabel 2.1 berikut ini:
Tabel 2.1 Nilai protein berbagai bahan makanan (gram/100 gram) Sumber Protein
Hewani
Nilai Protein Sumber Protein Nabati
Nilai Protein
Daging 18,8 Kacang kedelai 34,9
Hati 19,7 Kacang hijau 22,2
Babat 17,6 Kacang tanah 25,3
Jeroan 14,0 Kacang merah 29.1
Daging kelinci 16,6 Beras 7,4
Ikan 17,0 Jagung 9,2
Kerang 16,4 Tepung terigu 8,9
Udang 21,0 Jampang 6,2
Ayam 18,2 Kenari 15,0
Telur 12,8 Kelapa 3,4
Susu sapi 3,2 Daun singkong 6,6
Telur ayam 13,1 Singkong 1,1
Telur bebek 12,0 Kentang 2,0
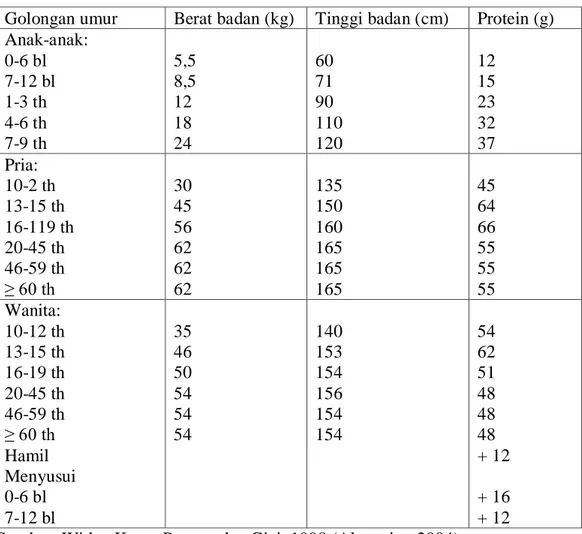
Angka kecukupan protein yang dianjurkan (tiap orang per hari) dapat dilihat pada Tabel 2.2 berikut ini:
Tabel 2.2 Angka kecukupan protein yang dianjurkan (per orang per hari) Golongan umur Berat badan (kg) Tinggi badan (cm) Protein (g) Anak-anak: 0-6 bl 7-12 bl 1-3 th 4-6 th 7-9 th 5,5 8,5 12 18 24 60 71 90 110 120 12 15 23 32 37 Pria: 10-2 th 13-15 th 16-119 th 20-45 th 46-59 th ≥ 60 th 30 45 56 62 62 62 135 150 160 165 165 165 45 64 66 55 55 55 Wanita: 10-12 th 13-15 th 16-19 th 20-45 th 46-59 th ≥ 60 th Hamil Menyusui 0-6 bl 7-12 bl 35 46 50 54 54 54 140 153 154 156 154 154 54 62 51 48 48 48 + 12 + 16 + 12 Sumber: Widya Karya Pangan dan Gizi, 1998 (Almatsier, 2004). 2.6 Manfaat Protein
1. Pertumbuhan dan pemeliharaan tubuh. Pertumbuhan bearti penambahan sel/jaringan, dan pemeliharaan adalah mengatur sel-sel yang rusak. Jaringan-jaringan tertentu membutuhkan lebih banyak jenis asam amino tertentu.
2. Pembentukan senyawa-senyawa penting tubuh, seperti hormon, enzim, dan hemoglobin.
3. Pembentuk antibodi tubuh, yaitu zat yang digunakan untuk memerangi organisme atau bahan asing lain yang masuk dalam tubuh, termasuk kemampuan untuk
menetralkan bahan-bahan beracun dan obat-obatan. Kemampuan ini sangat menentukan daya tahan tubuh seseorang.
4. Berperan dalam pengangkutan zat-zat gizi, yakni pengangkutan dari saluran cerna ke dalam darah dan dari darah ke jaringan-jaringan serta ke sel-sel.
5. Pengatur keseimbangan air dalam sel, air diantara sel, dan air di dalam pembuluh darah.
6. Sumber energi, selain karbohidrat dan lemak, protein juga merupakan sumber energi tubuh. Jika tubuh kekurangan energi, fungsi protein sebagai pembangun berkurang untuk menyediakan energi (Widodo, 2009).
2.7 Akibat Kekurangan dan Kelebihan Protein 2.7.1 Akibat kekurangan protein
1. Kwashiorkor
Istilah Kwashioskor pertama kali diperkenalkan oleh Dr. Cecily Wiliams pada tahun 1993 di Ghana, Afrika. Penyakit ini lebih banyak terdapat pada usia dua hingga tiga tahun yang komposisi gizi makanannya tidak seimbang terutama dalam hal protein (Yuniastuti, 2008).
Gejala penyakit Kwashioskor (Widodo, 2009), adalah sebagai berikut:
a) Pertumbuhan terhambat. b)Otot-otot berkurang dan lemah.
c) Bengkak (edema) terutama pada perut, kaki dan tangan. d)Muka bulat seperti bulan (moonface).
e) Gangguan psikimotor. f) Nafsu makan kurang.
Ciri-ciri penyakit Kwashioskor (Ellya, 2010), adalah sebagai berikut:
a) Rambut halus, jarang, dan pirang kemerahan kusam.
b) Kulit tampak kering (xerosis) dan memberi kesan kasar dengan garis-garis permukaan yang jelas.
c) Didaerah tungkai dan sikut serta bokong terdapat kulit yang menunjukkan hiperpigmentasi dan kulit dapat mengelupas dalam lembar yang besar, meninggalkan dasar yang licin berwarna putih mengkilat.
d) Perut anak membuncit karena pembesaran hati. 2. Marasmus
Marasmus berasal dari kata yunani yang bearti wasting (merusak). Marasmus umumnya merupakan penyakit pada bayi (12 bulan pertama), karena terlambat diberi makanan tambahan. Marasmus adalah penyakit kelaparan dan terdapat banyak diantara kelompok sosial ekonomi rendah di sebagian besar negara sedang berkembang dan lebih banyak dari kwashiorkor (Yuniastuti, 2008).
Gejala penyakit Marasmus (Widodo, 2009), adalah sebagai berikut:
a) Pertumbuhan yang terhambat. b)Lemak dibawah kulit berkurang. c) Otot-otot berkurang dan melemah. d)Muka seperti orang tua (0ldman’s face). 2.7.2Akibat kelebihan protein
Jika terlalu berlebihan mengkomsumsi protein juga akan sangat membebani kerja ginjal. Protein secara berlebihan tidak menguntungkan tubuh. Makanan yang tinggi proteinnya biasanya tinggi lemak sehingga menyebabkan obesitas. Diet protein
tinggi yang sering dianjurkan untuk menurunkan berat badan berkurang beralasan. Kelebihan protein pada bayi dapat memberatkan ginjal dan hati yang harus memetabolisme dan mengeluarkan kelebihan nitrogen dan juga dapat menyebabkan asidosis, dehidrasi, diare, kenaikan amonia darah, kenaikan ureum darah, dan demam (Ellya, 2010).
2.8 Asam Amino
2.8.1 Pengertian asam amino
Asam amino adalah asam karboksilat yang terdiri atas atom karbon yang terikat pada satu gugus karboksil (-COOH), satu gugus amino (-NH2), satu gugus hidrogen (-H) dan satu gugus radikal (-R) atau rantai cabang (Almatsier, 2004). Struktur asam amino dapat dilihat pada Gambar 2.6 berikut ini:
COOH (gugus karboksil) (gugus hidrogen) H C R (gugus radikal)
NH2 (gugus amino)
Gambar 2.6 Struktur asam amino 2.8.2 Sifat-sifat asam amino
Pada umumnya asam amino larut dalam air dan tidak larut dalam pelarut organik non polar seperti eter, aseton, dan kloroform. Sifat asam amino berbeda dengan asam karboksilat maupun dengan sifat amina. Perbedaan sifat antara asam amino dengan asam karboksilat dan terlihat pula pada titik leburnya. Asam amino mempunyai titik lebur yang lebih tinggi bila dibandingkan dengan asam karboksilat atau amina. Apabila asam amino larut dalam air, gugus karboksilat akan melepas ion H+, sedangkan gugus amino akan menerima ion H+. Oleh adanya gugus tersebut maka asam amino dapat
membentuk ion yang bermuatan positif dan juga bermuatan negatif (zwitterion) atau ion amfoter (Poedjiadi, 1994).
2.8.3Penggolongan asam amino
Asam amino yang terdapat dalam molekul protein tidak semua dapat dibuat oleh tubuh kita. Jadi apabila ditinjau dari segi pembentukannya asam amino dapat dibagi dalam dua golongan (Poedjiadi, 1994), yaitu:
1. Asam amino esensial adalah asam amino yang tidak dapat dibuat atau disintesis dalam tubuh dan harus diperoleh dari makanan sumber protein.
2. Asam amino non esensial adalah asam amino yang dapat dibuat atau disintesis dalam tubuh dengan mengkonversikan satu asam amino menjadi asam amino yang lain dalam sel-sel tubuh.
Penggolongan asam amino esensial dan non esensial dapat dilihat pada Tabel 2.3 berikut ini:
Tabel 2.3 Asam amino esensial dan asam amino non esensial Asam amino esensial Asam amino non esensial
Isoleusin Alanin
Leusin Arginin
Lisin Aspargin
Metionin Asam aspartat
Fenilalanin Sistein
Treonin Asam glutamat
Triptofan Glisin
Valin Ornitin
Histidin (esensial untuk anak-anak) Prolin Serin Tirosin Sumber: Yuniastuti (2008)
2.9 Metode Analisa Protein 2.9.1 Analisa kualitatif 1. Reaksi Xanthoprotein
Larutan asam nitrat pekat ditambahkan hati-hati kedalam larutan protein. setelah dicampur terjadi endapan putih yang berubah menjadi kuning apabila dipanaskan. Reaksi ini terjadi adalah nitrasi pada inti benzena yang terdapat pada molekul protein. reaksi ini positif untuk protein yang mengandung tirosin, fenilalanin, dan triptofan (Poedjiadi, 1994).
2. Reaksi Biuret
Larutan protein dibuat alkalis dengan NaOH kemudian ditambahkan larutan CuSO4 encer. Uji ini untuk menunjukkan senyawa-senyawa yang mengandung gugus amida asam yang berada bersama gugus amida yang lain. Uji ini memberikan reaksi positif yang ditandai dengan timbulnya warna merah violet atau biru violet (Bintang, 2010).
2.9.2 Analisa kuantitatif 1. Metode Lowry
Konsentrasi protein diukur berdasarkan optikal density pada panjang gelombang 600 nm. Untuk mengetahui banyaknya protein dalam larutan, lebih dahulu dibuat kurva standar yang melukiskan hubungan antara konsentrasi dengan OD (absorbansi). Larutan lowry ada dua macam yaitu larutan A yang terdiri dari dari fosfotungstat-fosfomolibdat (1:1) dan larutan B yang terdiri dari Na2CO3 2% dalam NaOH 0,1 N, CuSO4 dan Na-K-tartrat 2%. Cara penentuannya adalah: 1 mL larutan protein ditambahkan 5 mL Lowry B, dikocok dan dibiarkan selama 10 menit. Kemudian ditambah 0,5 mL lowry A dikocok dan dibiarkan 20 menit, selanjutnya diamati OD-nya pada panjang gelombang 600 nm (Sudarmadji, 1989).
Kebanyakan protein mengabsorbsi sinar ultraviolet maksimum pada 280 nm. Hal ini terutama oleh adanya asam amino tirosin, triptophan, dan fenilalanin yang ada pada protein tersebut. Pengukuran protein berdasarkan absorbsi sinar UV adalah cepat, mudah, dan tidak merusak bahan (Sudarmadji, 1989).
3.Metode Turbidimetri atau Kekeruhan
Kekeruhan akan terbentuk dalam larutan yang mengandung protein apabila ditambahkan bahan pengendap protein misalnya Tri Chloro Acetic (TCA), Kalium Ferri Cianida [K4Fe(CN)6] atau asam sulfosalisilat. Tingkat kekeruhan diukur dengan alat Turbudimeter. Cara ini hanya dipakai untuk bahan protein yang berupa larutan atau hasilnya, tetapi biasanya hasilnya kurang tepat (Sudarmadji, 1989).
4. Metode Pengecatan
Beberapa bahan pewarna misalnya orange G, orange 12 dan amido black dapat membentuk senyawaan berwarna dengan protein dan menjadi tidak larut. Dengan mengukur sisa bahan pewarna yang tidak bereaksi dalam larutan (dengan colorimeter), maka jumlah protein dapat ditentukan dengan cepat (Sudarmadji, 1989).
5. Titrasi Formol
Larutan protein dinetralkan dengan basa (NaOH), kemudian ditambahkan formalin akan membentuk dimenthiol. Dengan terbentuknya dimenthiol ini bearti gugus aminonya sudah terikat dan tidak akan mempengaruhi reaksi antara asam (gugus karboksil) dengan basa NaOH sehingga akhir titrasi dapat diakhiri dengan tepat. Indikator yang digunakan adalah fenolftalein, akhir titrasi bila tepat terjadi perubahan warna menjadi merah muda yang tidak hilang dalam 30 menit. Titrasi formol ini hanya tepat untuk menentukan suatu proses terjadinya pemecahan protein dan kurang tepat untuk penentuan protein (Sudarmadji, 1989).
6. Metode Kjeldahl
Metode Kjeldahl merupakan metode sederhana untuk penetapan nitrogen total pada asam amino, protein, dan senyawa yang mengandung nitrogen. Metode Kjeldahl cocok untuk menetapkan kadar protein yang tidak larut atau protein yang mengalami koagulasi akibat proses pemanasan maupun proses pengolahan lain yang biasa dilakukan pada makanan. Metode ini digunakan untuk menganalisis kadar protein kasar dalam bahan makanan secara tidak langsung karena senyawa yang dianalisisnya adalah kadar nitrogennya. Dengan mengalikan hasil analisis tersebut dengan faktor konversi 6,25 diperoleh nilai protein dalam bahan makanan tersebut (Sudarmadji, 1984).
Penentuan kadar protein dengan metode ini memiliki kelemahan karena adanya senyawa lain yang bukan protein yang mengandung N akan tertentukan sehingga kadar protein yang diperoleh langsung dengan metode Kjeldahl ini disebut dengan kadar protein kasar (crude protein) (Sudarmadji, 1984).
Metode Kjeldahl dilakukan dengan beberapa tahapan kerja yaitu: 1. Tahap Dekstruksi
Pada tahap ini sampel dipanaskan dengan asam sulfat pekat sehingga terjadi dekstruksi menjadi unsur-unsurnya, dimana seluruh N organik dirubah menjadi N anorganik yaitu elemen karbon (C) teroksidasi menjadi karbondioksida (CO2) dan hidrogen (H) teroksidasi menjadi air (H2O), sedangkan elemen nitrogennya akan berubah menjadi ammonium sulfat (NH4)2SO4. Asam sulfat yang dipergunakan untuk dekstruksi harus dalam jumlah yang cukup dan diperhitungkan untuk dapat menguraikan bahan protein, lemak, dan karbohidrat didalam sampel (Bintang, 2010; Yazid, 2006).
Untuk mempercepat dekstruksi maka ditambahkan katalisator. Gunning menganjurkan menggunakan kalium sulfat (K2SO4) dan tembaga (II) sulfat (CuSO4). Dengan penambahan katalisator ini, maka titik didih asam sulfat akan ditinggikan sehingga proses dekstruksi akan berjalan dengan cepat. Tiap 1 gram kalium sulfat akan mampu meningkatkan titik didih asam sulfat 3ºC. Suhu dekstruksi berkisar antara 370ºC- 410ºC. Proses dekstruksi diakhiri jika larutan telah menjadi warna hijau jernih (Bintang, 2010; Yazid, 2006).
Reaksi yang terjadi pada proses dekstruksi adalah:
Protein + H2SO4 Katalisator (NH4)2SO4 + CO2 + SO2 + H2O 2. Tahap Destilasi
Pada tahap ini amonium sulfat (NH4)2SO4 yang terbentuk pada tahap dekstruksi dipecah menjadi amonia (NH3) dengan penambahan NaOH sampai alkalis dan dipanaskan. Amonia yang dibebaskan selanjutnya akan ditangkap oleh larutan baku asam. Larutan baku asam yang dipakai adalah asam sulfat (H2SO4). Agar supaya kontak antara asam dan amonia berjalan sempurna, maka ujung selang pengalir destilat harus tercelup kedalam larutan asam. Destilasi diakhiri bila semua amonia terdestilasi sempurna yang ditandai dengan destilat tidak bereaksi basa (Bintang, 2010; Yazid, 2006).
Reaksi yang terjadi pada tahap destilasi yaitu:
(NH4)2SO4 + 2 NaOH Na2SO4 + 2 H2O + 2 NH3
3. Tahap Titrasi
Penampung destilat yang digunakan adalah asam sulfat berlebih, maka sisa asam sulfat yang tidak bereaksi dengan amonia dititrasi dengan NaOH 0,02 N menggunakan
indikator mengsel. Titik akhir titrasi dapat ditandai dengan perubahan warna dari warna ungu menjadi hijau (Sudarmadji, 1984).
Reaksi yang terjadi pada tahap titrasi yaitu: NH3 + H2SO4 (NH4)2SO4
Kelebihan H2SO4 + 2 NaOH Na2SO4 + 2 H2O Kadar protein dihitung dengan persamaan berikut ini:
Kadar Protein (%) = (Vb- Vt)
Berat sampel (mg)×N NaOH×14,007×FK×100% Fk = Faktor konversi atau perkalian = 6,25
Besarnya faktor konversi nitrogen tergantung pada persentase nitrogen yang menyusun protein dalam bahan pangan yang dianalisa tersebut (Budianto, 2009). Besarnya faktor konversi dari bermacam-macam bahan makanan dapat dilihat pada Tabel 2.4 berikut ini:
Tabel 2.4 Tabel faktor konversi dari bermacam-macam bahan makanan
No Bahan Makanan Faktor konversi
1 Makanan lain (umum) 6,25
2 Beras (semua jenis) 5,95
3 Tepung 5,70
4 Kacang tanah 5,46
5 Kacang kedelai 5,71
6 Kelapa 5,30
7 Susu (semua jenis) / keju 6,38
8 Gandum biji 5,83
Ketelitian penentuan kadar NPN tergantung pada kemampuan dari metode yang digunakan untuk memisahkan protein dari NPN. Setelah dipisahkan kadar protein dan NPN dapat ditentukan dengan menggunakan metode Kjeldahl. Dari analisis yang telah
mengendapkan protein dalam bahan makanan. Keuntungan pemakaian larutan asam trikloroasetat (ATA) ialah pengerjaan mudah, endapan protein yang diperoleh mudah dipisahkan dari larutan asam trikloroasetat (ATA) dan tidak mempengaruhi ketelitian metode Kjeldahl (Silalahi, 1994).
2.10 Ulat Kidu (Rhynchophorus ferrugineus)
Nama latinnya adalah Rhynchophorus ferrugineus atau lebih dikenal dengan ulat sagu. Masyarakat Karo di Sumatera Utara menyebutnya dengan ulat kidu. Ulat ini adalah larva dari kumbang sagu yang diperoleh dari batang pohon sagu yang membusuk yaitu cara mengetahuinya dengan cara mendengar, bila dari batang pohon terdengar ada suara bergerak bearti didalamnya ada ulat kidu. Ulat kidu merupakan salah satu sumber protein hewani yang dapat dikonsumsi dan diolah sebagai bahan makanan dengan cara digoreng, direbus dan dapat juga dijadikan sebagai bahan substitusi pakan ternak. Ulat ini juga mengandung beberapa asam amino non esensial seperti asam aspartat (1,84%), asam glutamat (2,72%), tirosin (1,87%) dan asam amino esensial seperti lisin (1,97%), dan 1, 07% methionin (Anonim, 2011).
Sistematika dari ulat kidu menurut (Anonim, 2012) adalah: Kingdom : Animalia Filum : Arthropoda Kelas : Insecta Ordo : Coleoptera Suku : Curculionidae Genus : Rhynchophorus