PENGOLAHAN LIMBAH METHYLEN BLUE DENGAN TiO
2DIMODIFIKASI Cu DAN N
Agus Salim Afrozi, Auring R, Sulistioso GS, dan Joko Nurchamid
Pusat Sains dan Teknologi Bahan Maju – BATAN Email : agussal@batan.go.id
ABSTRAK
PENGOLAHAN LIMBAH METHYLEN BLUE DENGAN TiO2 DIMODIFIKASI Cu dan N, Dalam penelitian sebelumnya diperoleh data bahwa TiO2 cukup baik dalam mendegradasi limbah methylen blue,
namun pengaruh penambahan dopan pada TiO2 terhadap aktivitas TiO2 tersebut belum dilakukan. Tujuan
penelitian ini adalah untuk mengetahui pengaruh penambahan Cu dan N terhadap aktivitas fotokatalis TiO2
dalam pengolahan limbah methylen blue. Prekursor yang digunakan adalah TiO2 99,9% rutile. Penambahan
dopan Cu dilakukan dengan cara impregnasi. Komposisi Cu dalam katalis divariasikan dari 3% dan 10% berat TiO2. Penambahan dopan N dilakukan dengan metode perendaman dengan konsentrasi NH3 sebesar 0,3 M.
Hasil karakterisasi X-Ray Difraktometer menunjukkan penambahan dopan Cu dan N pada TiO2 tidak
mempengaruhi ukuran kristal yaitu dalam kisaran 40,8 s/d 54,5 nm. Sedangkan hasil karakterisasi SEM-EDS terlihat bahwa penambahan dopan Cu dan N tertinggi diperoleh pada penambahan Cu 10% yaitu Cu sebesar 2,32% dan N sebesar 3,97%. Hasil pengujian menunjukkan penambahan Cu dan N pada TiO2 menurunkan
aktivitas fotokatalis TiO2 dalam mendegradasi methylen blue dari konstanta laju reaksi TiO2 0,091 jam-1
menjadi 0,017 jam-1 untuk Cu/TiO2-N 3% dan 0,005 jam-1 untuk Cu/TiO2-N 10%. Penurunan tersebut terjadi
disebabkan terjadi pergeseran daerah aktif fotokatalis TiO2 dari spektrum UV menjadi spektrum cahaya
tampak akibat doping Cu dan N. Penurunan yang cukup besar terjadi pada Cu/TiO2-N 10%, hal ini
disebabkan penambahan Cu dengan konsentrasi di atas 3% akan menutupi permukaan aktif dari katalis TiO2
sehingga penambahan dopan Cu yang semula dapat mencegah terjadinya rekombinasi elektron-hole tidak berperan secara optimal, melainkan berfungsi sebagai penghalang terjadinya reaksi degradasi methylen blue.
Kata Kunci: Fotokatalis; methylen blue; TiO2 , Cu/TiO2-N
ABSTRACT
METHYLEN BLUE WASTE TREATMENT WITH TiO2 MODIFIED BY Cu AND N. In a previous study
data showed that TiO2 is good enough to degrade the waste methylene blue, but the influence of dopants on TiO2 addition on the activity of TiO2 has not been done. The purpose of this study was to determine the effect of Cu and N to the activity of TiO2 photocatalyst in wastewater treatment methylene blue. Precursors used were 99.9 % rutile TiO2 . The addition of Cu dopant done by impregnation . Cu in the catalyst composition was varied from 3 % and 10 wt% TiO2 . The addition of dopants N carried by the method of soaking the NH3 concentration of 0.3 M. The results of the characterization of X - Ray Diffractometer shows the addition of Cu and N dopants in TiO2 does not affect the crystal size in the range of 40.8 s / d of 54.5 nm . While the results of SEM - EDS characterization shows that the addition of Cu and N dopants highest Cu was obtained on addition of 10 % ie by 2.32 % Cu and 3.97% N. The test results showed the addition of Cu and N in the TiO2 photocatalytic activity of TiO2 decrease in degrading methylene blue of the reaction rate constants of TiO2 0.091 hour - 1 hour - 1 into 0,017 to Cu/TiO2-N 3 % and 0.005 hr- 1 for Cu/TiO2-N 10 % . The decline is due to a shift in the active region of the UV spectrum of TiO2 photocatalyst into the visible light spectrum due to doping Cu and N. sizable decline occurred in Cu/TiO2-N 10 % , this is due to the addition of Cu with concentrations above 3 % will cover active surface of the catalyst TiO2 so that the addition of Cu dopant can initially prevent electron-hole recombination does not play an optimal role , but rather serves as a barrier degradation of methylene blue reaction .
I. PENDAHULUAN
Fotokatalisis heterogen titanium dioksida merupakan metode yang efisien untuk mendegradasi secara lengkap senyawa organik dalam fase cair dan gas. Pencemar yang mengandung karbon, hidrogen, nitrogen, sulfur dan atom halogen akan terdegradasi menjadi CO2, H2O, anion NO3-,
SO4
2-, dan halida [1]. Metode ini bisa digunakan untuk mendegradasi limbah methylen blue.
Methylen blue merupakan bahan yang banyak digunakan dalam industri tekstil namun merupakan limbah yang cukup berbahaya bagi lingkungan [2]. Disamping menimbulkan bau tak sedap, perombakan zat warna secara anaerob pada dasar perairan menghasilkan senyawa amina aromatik yang lebih toksik dibandingkan dengan zat warna semula [3]. Oleh karena itu, usaha untuk mengatasi masalah tersebut harus dilakukan sedini mungkin. Menghilangkan pewarna dari air akan memperbaiki kualitas air, sehingga diperlukan metode yang efektif untuk menghilangkan warna dari limbah cair tekstil. Metode fotokatalisis dengan menggunakan TiO2 memiliki banyak kelebihan diantaranya
adalah mudah didapat, harga relatif murah, tidak berbahaya, dan stabil secara kimia [4].
Keterbatasan TiO2 sebagai fotokatalis
terletak pada band gap-nya yang sebesar 3,2 eV, dimana band gap sebesar itu memerlukan penyinaran sinar ultraviolet untuk menginisiasi proses fotokatalitik. Asahi
menemukan bahwa pencampuran p states dari N dengan 2p dari O dapat menaikkan pita valensi untuk dapat memperkecil band gap dari TiO2, sementara posisi dari pita konduksi
tetap. Hal ini menyebabkan fotokatalis TiO2
lebih aktif terhadap sinar tampak. Kajian-kajian yang telah dilakukan menunjukkan bahwa nanopartikel TiO2-N dapat
meningkatkan daya absorbsi foton pada rentang panjang gelombang 400 nm sampai 600 nm [5].
Dilaporkan bahwa penambahan dopan N ke dalam sistem fotokatalis TiO2
menjadi komposit TiO2-N masih memiliki
berbagai kendala seperti sulitnya menghasilkan katalis komposit dengan konsentrasi N yang tinggi, rendahnya aktivitas fotokatalitik pada rentang panjang gelombang UV, ketidakstabilan spesi N dalam sistem katalis setelah proses fotokatalisis, lemahnya daya oksidasi hole yang dihasilkan, dan tingginya laju rekombinasi sebagai akibat menyempitnya band gap dan faktor impuritas katalis.[6]
Penambahan dopan logam
digunakan untuk meningkatkan aktivitas fotokatalik. Dopan logam yang paling banyak digunakan adalah logam Pt, Ni dan Cu [7]. Penambahan Cu pada TiO2, baik dalam
bentuk logam maupun oksida logam CuOx,
telah banyak digunakan sebagai electron-trapper untuk menghambat rekombinasi elektron-hole dalam berbagai aplikasi. Perannya sebagai electron-trapper ini disebabkan oleh tingginya potensial reduksi
dari Cu (0.34 V). Selain sebagai electron-trapper, penambahan dopan CuOx juga dapat
meningkatkan absorbansi bagi fotokatalis melalui mekanisme penyempitan band-gap [8].
Tujuan penelitian ini adalah untuk mengetahui pengaruh penambahan dopan terhadap aktivitas fotokatalis TiO2 dalam
pengolahan limbah methylen blue. Aktivitas tersebut ditunjukkan oleh besaran konstanta laju reaksi dari proses degradasi limbah methylen blue. Dalam penelitian sebelumnya diperoleh data bahwa TiO2 cukup baik dalam
mendegradasi limbah methylen blue, namun pengaruh penambahan Cu dan N pada TiO2
terhadap aktivitas TiO2 dalam mendegradasi
limbah methylen blue belum pernah dilakukan, sehingga dalam penelitian ini akan dipelajari pengaruh penambahan Cu dan N terhadap aktivitas fotokatalis TiO2. Penelitian
ini dilakukan di Lab Limbah PSTBM - BATAN pada bulan Mei 2013 sampai bulan September 2013.
II. TATA KERJA
Bahan dan Peralatan
Bahan yang digunakan dalam penelitian ini yaitu TiO2 99,9% rutile
Sigma-Aldrich sebagai prekursor, aquades, NH3
Merck, Cu(NO3)2.3H2O Merck,
serbuk
methylen blue.
Alat yang digunakan dalam penelitian
ini yaitu gelas beker, labu ukur, pipet
ukur, batang pengaduk, cawan porselen,
pH
indikator,
furnace,
X-Ray
Diffractometer (XRD) merek Shimadzu
untuk menganalisis struktur dan ukuran
kristal
serta
fraksi
rutile-anatase,
Scanning Electron Microscope/Energy
Dispersive
Spectroscope
(SEM/EDS)
merek JEOL type JSM 6510 L untuk
menganalisis foto permukaan (butir) dan
konsentrasi
N
dalam
TiO
2,
Spektrofotometri UV-Vis merek PERKIN
ELMER
type
Lambda
25
untuk
menganalisa konsentrasi methylen blue
dalam limbah.
Sintesis fotokatalis
Cu didoping dengan cara impregnasi pada TiO2 antara Cu(NO3)2.3H2O dengan
perbandingan berat Cu(NO3)2.3H2O divariasi
3% dan 10% berat TiO2. Campuran
Cu(NO3)2.3H2O dan TiO2 diaduk dengan
stirrer selama 30 menit pada temperatur ruang. Larutan diaduk dengan stirrer sambil dipanaskan pada suhu 80ºC – 90ºC untuk menguapkan airnya selama 3 jam. Nitrogen didoping ke dalam Cu-TiO2 dengan cara
perendaman 10 g serbuk Cu-TiO2 dalam 400
ml larutan NH3 dengan konsentrasi 0,3M
diaduk dengan magnetic stirrer selama 10 menit dan direndam selama 24 jam. Selanjutnya dilakukan pengeringan pada suhu 120 ºC dan kalsinasi pada suhu 500 ºC selama 1 jam. Hasil yang diperoleh kemudian digerus sampai halus.
Pengaruh penambahan Cu
dan N pada fotokatalis TiO
2dianalisis
menggunakan XRD, SEM dan EDS.
Limbah Simulasi
Larutan limbah simulasi dibuat dengan kandungan methylen blue 10 ppm, dengan cara serbuk methylen blue sebanyak 0,3 g ditambahkan ke dalam 300 ml aquades kemudian
diaduk dengan magnetic stirrer
selama 10 menit.
Aktivitas Fotokatalitik
Lampu Phillips UV-A 10 W
sebanyak 3 buah digunakan sebagai
sumber
foton.
Reaksi
fotokatalitik
dilakukan dalam gelas reaksi dengan
kapasitas 650 ml. Sejumlah 0,3 gram
katalis ditambahkan ke dalam 300 ml
larutan methylen blue 10 ppm, diaduk
dengan stirrer sambil disinari dengan UV
selama 5 jam. Setiap 1 jam dilakukan
pencuplikan sampel untuk mengukur
kadar methylen blue yang terurai dalam
larutan dengan menggunakan peralatan
spektrometri UV-Vis.
III. HASIL DAN PEMBAHASAN
Karakterisasi Fotokatalis
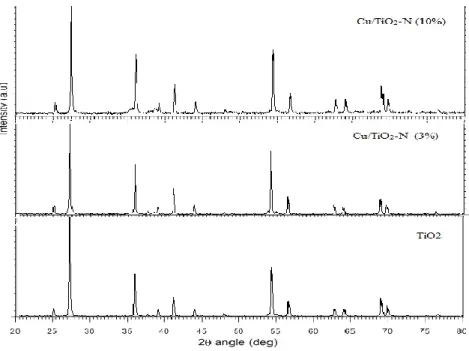
Dari pola difraksi Gambar 1 terlihat struktur kristal rutile relatif tidak mengalami pergeseran antara TiO2 dan Cu/TiO2-N
dengan berbagai variasi konsentrasi Cu. Puncak Cu terlihat pada seluruh konsentrasi penambahan Cu yaitu pada 2θ = 39,10º. Begitu pula struktur kristal anatase juga relatif tidak mengalami pergeseran.
Dari Gambar 1 terlihat untuk Cu/TiO2-N (3%) struktur kristal rutile terlihat
pada 2θ = 27,30º
; 35,90º; 41,10º; 43,90º; 54,10º; 56,50º; 62,60º; 63,90º; 68,80º; 69,90º dan struktur kristal anatase terlihat pada 2θ = 25,10º. Fraksi rutile yang terbentuk sebesar 94,20% sedangkan struktur anatase hanya 5,80% sedangkan Cu terlihat pada 2θ = 38,80º.
Untuk Cu/TiO2-N (10%) struktur
kristal rutile terlihat pada 2θ = 27,40º
; 36,10º ; 41,20º ; 44,00º; 54,30º; 56,70º; 62,80º; 64,00º; 69,00º dan struktur kristal anatase terlihat pada 2θ = 25,30º
. Fraksi rutile yang terbentuk sebesar 94,20% sedangkan strutur anatase hanya 5,80%. Cu juga sudah terlihat pada 2θ = 39,20º
.
Dari hasil XRD di atas diperoleh besar ukuran kristal dan fraksi anatase serta rutile sebagai berikut (Tabel 1).
Tabel 1. Ukuran kristal, fraksi rutile dan
anatase dari katalis N-TiO2 hasil
analisa XRD
No Sampel 2θ (0) L (nm) Fraksi Rutile (%) 1. TiO2 27,50 40,90 94,30 2. Cu/TiO2 -N (3%) 27,30 54,50 94,60 3. Cu/TiO2 -N (10%) 27,50 48,10 92,50
Terlihat bahwa ukuran kristal dari TiO2 dan
Cu/TiO2–N tidak jauh berbeda yaitu berkisar
dalam range 40,80 – 54,50 nm.
Hasil karakterisasi SEM-EDS dapat dilihat pada Gambar 2.
Gambar 2. Hasil SEM: (a)TiO2, Perbesaran 2000 x; (b) Cu/TiO2N ( 3%),
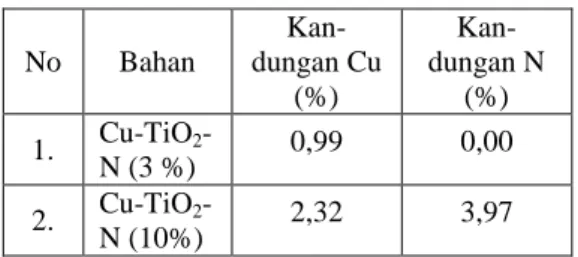
Hasil karakterisasi SEM EDS diperoleh kandungan Cu dan N dalam Cu/TiO2-N
diperlihatkan sebagai berikut (Tabel 2). Tabel 2. Kandungan Cu dan N dalam
Cu/TiO2-N hasil karakterisasi
SEM EDS
Terlihat dari Tabel 2 bahwa kandungan Cu dan N dalam Cu/TiO2-N
mengalami kenaikan dengan kenaikan prosentase Cu(NO3)2.3H2O yang
ditambahkan. Pada penambahan 3% Cu(NO3)2.3H2O tidak terlihat kandungan N.
Hal ini diduga disebabkan atom N terlepas
kembali pada saat penambahan
Cu(NO3)2.3H2O.
Uji Aktivitas
Limbah methylen blue awal mengandung konsentrasi sebesar 10 ppm. Uji reduksi katalis terhadap methylen blue dilakukan selama 5 jam dengan kondisi distirer dan disinari UV.
Reaksi degradasi methylen blue yang terjadi dilukiskan dalam persamaan (1).
C16H18N3SCl + 22,5O2 HCl +
H2SO4 + 3HNO3 + 16CO2 + 6H2 (1)
Reaksi fotokatalis terhadap methylen blue dapat terjadi karena lubang positif yang terbentuk selama aktivasi fotokatalis akan
mengoksidasi ion hidroksi atau air pada permukaan katalis menghasilkan radikal hidroksil HO•. Fotooksidasi maupun fotoreduksi dapat terjadi karena TiO2
merupakan semikonduktor dengan struktur elektronik yang khas yaitu memiliki pita valensi dan pita konduksi yang kosong sehingga ketika dikenai sinar matahari maka akan mengalami eksitasi e- dari pita valensi ke pita konduksi (menghasilkan e-cb) yang menyebabkan adanya kekosongan atau hole (h+vb) pada pita valensi yang dapat berperan sebagai muatan positif. Selanjutnya hole akan bereaksi dengan H2O yang terdapat dalam
larutan membentuk radikal hidroksil (•OH), radikal hidroksil ini merupakan oksidator kuat yang dapat mendegradasi senyawa organik menjadi CO2 dan air. Elektron pada
permukaan semikonduktor dapat bereaksi dengan penangkap e- yang ada dalam larutan yaitu O2 membentuk radikal superoksida
(•O
2-) yang juga dapat mendegradasi senyawa organik dalam larutan. [8]. Radikal hidroksil •OH yang dihasilkan memiliki peranan penting dalam mengoksidasi senyawa organik. Semakin banyak pembentukan hidroksil radikal maka akan semakin besar pula kemampuan fotokatalis untuk mengoksidasi senyawaan organik [10].
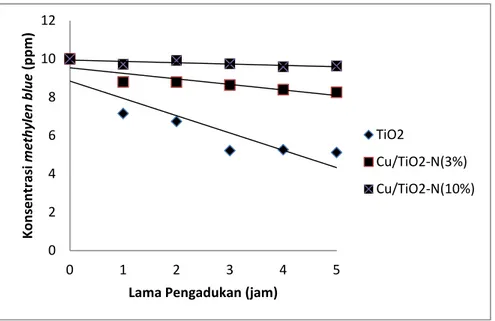
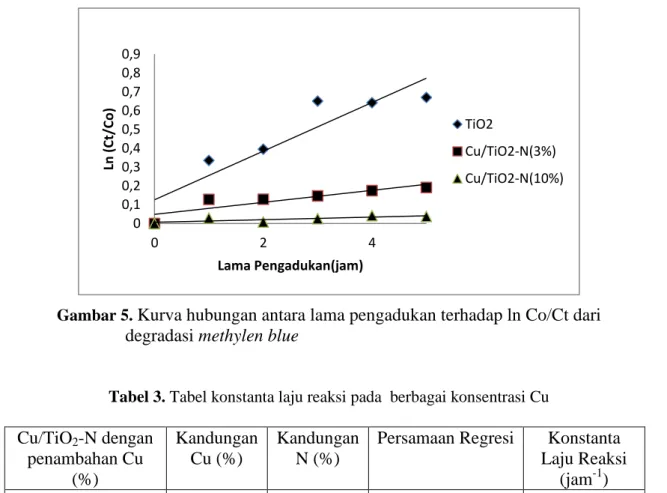
Hasil penurunan konsentrasi methylen blue dalam limbah ditunjukkan oleh Gambar 3 dan Gambar 4 sebagai berikut. Sedangkan kurva hubungan antara lama pengadukan terhadap ln Co/Ct dari degradasi methylen blue diperlihatkan oleh Gambar 5.
No Bahan Kan-dungan Cu (%) Kan-dungan N (%) 1. Cu-TiO2 -N (3 %) 0,99 0,00 2. Cu-TiO2 -N (10%) 2,32 3,97 hv, TiO2
Gambar 3. Pengaruh waktu pengadukan terhadap konsentrasi methylen blue
Gambar 4. Pengaruh waktu pengadukan terhadap prosentase reduksi methylen blue
0 2 4 6 8 10 12 0 1 2 3 4 5 K o n sen tr asi m et h yl en b lu e (p p m )
Lama Pengadukan (jam)
TiO2 Cu/TiO2-N(3%) Cu/TiO2-N(10%) 0 10 20 30 40 50 60 0 1 2 3 4 5 % r e d u ksi m et h yl en b lu e Lama Pengadukan(jam) TiO2 Cu/TiO2-N(3%) Cu/TiO2-N(10%)
Gambar 5.
Kurva hubungan antara lama pengadukan terhadap ln Co/Ct dari
degradasi methylen blue
Tabel 3. Tabel konstanta laju reaksi pada berbagai konsentrasi Cu
Cu/TiO
2-N dengan
penambahan Cu
(%)
Kandungan
Cu (%)
Kandungan
N (%)
Persamaan Regresi
Konstanta
Laju Reaksi
(jam
-1)
0
0,00
0,00
y = 0,091x + 0,263
0,091
3
0,99
0,00
y = 0,017x + 0,102
0,017
10
2,32
3,90
y = 0,005x + 0,013
0,005
. Dari Gambar 5 diperoleh konstanta laju reaksi (jam-1) untuk berbagai konsentrasi Cu seperti dalam Tabel 3Terlihat dari Tabel 3 bahwa aktivitas fotokatalis dalam mereduksi methylen blue paling tinggi diperoleh pada TiO2 yang tidak ditambahkan Cu dan N.
Nilai konstanta laju reaksi TiO2 dengan
penambahan N dan Cu ini masih jauh lebih kecil dibandingkan nilai konstanta laju reaksi dari TiO2 yang ditambahkan N saja yang
diperoleh dari penelitian sebelumnya yaitu sekitar 0,050 jam-1. Hal ini disebabkan doping Cu dan N bersinergi menurunkan bandgap dari TiO2 sehingga terjadi pergeseran daerah
aktif katalis dari daerah UV ke daerah cahaya tampak. Dilaporkan penambahan Cu pada TiO2 akan menurunkan bandgap TiO2 dari
3,28 eV menjadi sekitar 2,58 eV [9]. Dibuktikan pula terjadi penurunan energi bandgap cukup besar untuk penambahan Cu dan N pada TiO2 yaitu dari 3,28 eV menjadi
2,47 eV [11]. Penurunan energi bandgap ini akan menyebabkan terjadinya pergeseran daerah aktif untuk fotokatalis TiO2 dari
daerah UV menjadi daerah sinar tampak, sehingga kinerja fotokatalis TiO2 dalam
mereduksi methylen blue di daerah UV mengalami penurunan. 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 0 2 4 Ln (Ct /Co ) Lama Pengadukan(jam) TiO2 Cu/TiO2-N(3%) Cu/TiO2-N(10%)
Nilai konstanta laju reaksi diperoleh lebih tinggi pada Cu 3% dan mengalami penurunan pada Cu 10%, hal ini disebabkan pada komposisi Cu 3%, kristal Cu berfungsi sebagai dopan sehingga dapat berperan sebagai penangkap elektron yang mencegah terjadinya rekombinasi elektron-hole sehingga meningkatkan aktivitas katalis. Sedangkan bila penambahan Cu lebih dari 3%, permukaan aktif dari TiO
2 tertutupi oleh
kristal Cu dan menjadi penghalang terjadinya reaksi reduksi methylen blue sehingga menurunkan aktivitas katalis.
IV. KESIMPULAN
Berdasarkan penelitian yang telah dilakukan disimpulkan bahwa TiO2 dan
Cu/TiO2-N mampu mereduksi limbah
methylen blue dengan konstanta laju reaksi 0,091 jam-1 untuk TiO2; 0,017 jam
-1
untuk Cu/TiO2-N 3% Cu dan 0,005 jam
-1
untuk Cu/TiO2-N 10% Cu. Penambahan Cu dan N
pada TiO2 akan menurunkan aktivitas
fotokatalitik dalam mereduksi methylen blue pada daerah kerja UV, yang disebabkan terjadinya penurunan bandgap pada fotokatalis TiO2. Penambahan Cu melebihi
konsentrasi tertentu, justru akan menghambat permukaan aktif dari TiO2 sehingga
menurunkan kinerja katalis dalam mendegradasi methylen blue.
UCAPAN TERIMA KASIH
Ucapan terima kasih kepada Saudara Drs. Bambang Sugeng, MT, Dra. Deswita
serta KPTF di PTBIN-BATAN yang telah banyak membantu dalam pengujian, karakterisasi dan penyusunan makalah ini.
DAFTAR PUSTAKA
1. GUNLAZUARDI J., (2001),
Fotokatalisis pada pemukaan TiO2 :
Aspek Fundamental dan Aplikasinya, Prosiding Seminar Nasional Kimia Fisika II, Jakarta.
2.
IRVAN, RENITA, MANURUNG,
HASIBUAN, ROSDANELLI, (2004),
Perombakan Zat Warna Azo Reaktif
Secara Aerob-Anaerob, USU, Medan.
3. VAN der ZEE, F.P., (2002), Anaerobic Azo Dye Reduction, Wageningen University.
4. M. RADECKA, M., REKAS, A., Trencczek-Zajac, K. Zakrzewsk (2008), Importance of the bandgap energy and flatband potential for application of modified TiO2Photoanodes in water
photolysis, J Power Sources, Vol 181, 46-55.
5.
ASAHI
R.,
MORIKAWA
T.,
OHWAKI T., AOKI K., TAGA Y.,
(2001), Visible-light photocatalysis in
nitrogen-doped
titanium
oxides.
Science, Volume 293, 269–271.
6.
JINLONG ZHANG, YONGMEI WU,
MINGYANG
XING,
LEGHARI,
SAJJAD AHMED KHAN, SAJJAD
SHAMILA., (2010), Development of
modified N doped TiO
2photocatalyst
with metals, nonmetals and metal
oxides. Energy Environ. Sci., Volume
3, 715-726.
7. RYO B., SEIICHIRO N., AKIRA F., (1985), Investigation of the Mechanism of hidrogen evolution during photocatalytic water decompotion on metal loadled semiconductor Powders, J.Physchem., Vol. 89, 1902-1905.
8. SLAMET, HOSNA W., EZZA P., KAPTI R., GUNLAZUARDI J., (2009),
Effect of Copper Species in a Photocatalytic Synthesis of Methanol from Carbon Dioxide over Copper-doped Titania Catalysts, J. World Appl. Sci., Vol. 6, Issue 1, 112-122.
9. SLAMET, ARBIANTI R., MARLIANA E., (2005), Pengolahan Limbah Cr(VI) dan Fenol Dengan Fotokatalis Serbuk TiO2 dan CuO/TiO2, Reaktor, Vol. 11
No.2, Desember 2007, 78-85.
10. HOFFMANN. M.R., S.T. MARTIN, W. CHOI, AND D.W. BAHNEMANN, (1995), Environmental Applications of Semiconductor Photocatalysis, Chemical
Reviews., Vol 95, No. 1.
California:American Chemical society. 11. AGUS S.A., (2011), Sintesis dan
Karakterisasi Katalis Nanokomposit Berbasis Titania Untuk Produksi Hidrogen dari Gliserol dan Air, Tesis, DTK-FT-UI, Depok.