KONVERSI ENZIMATIK
PENGUJIAN AKTIVITAS ENZIM α-AMILASE
Wahyuni
13012112
Program Studi Teknik Kimia
Fakultas Teknologi Industri
Institut Teknologi Bandung
2015
1 Abstrak
Enzim α-amilase merupakan salah satu jenis enzim yang banyak digunakan di industri, terutama kemampuannya dalam menghidrolisis pati pada tahap likuifaksi. Tahap likuifaksi merupakan tahap paling penting dalam proses produksi produk turunan pati berupa gula. Produk antara dari tahap likuifaksi biasanya dihidrolisis lagi pada tahap selanjutnya, yaitu sakarifikasi, untuk menghasilkan produk akhir berupa gula. Oleh sebab itu, pengujian aktivitas enzim α-amilase sangat penting. Pengujian aktivitas enzim α-amilase dilakukan untuk mengetahui kemampuan hidrolisis enzim α-amilase sebelum akhirnya digunakan dalam skala besar di industri. Pengujian akan dilakukan berdasarkan metode Fuwa menggunakan larutan iodin secara stop assay. Substrat berupa larutan pati 20 mg/mL yang dilarutkan dalam buffer fosfat dicampurkan enzim α-amilase Liquozyme Supra untuk diinkubasikan pada temperatur 37oC selama 30 menit. Reagen pemberhenti reaksi yang digunakan adalah HCl 1 N. Analisis data aktivitas enzim dilakukan berdasarkan tiga literatur. Akurasi tertinggi diperoleh dari literatur Yoo, dkk.[1], yaitu sebesar 96% dengan aktivitas enzim α-amilase 800 U/mL.
Pendahuluan
Enzim amilase merupakan enzim yang mampu bertindak sebagai katalis dalam reaksi hidrolisis pati oleh air membentuk gula. Gula merupakan produk konstituen utama dalam industri makanan dan minuman [2]. Kemampuan enzim dalam memproduksi gula dipengaruhi terutama oleh kemampuan enzim sebagai katalis proses produksi, yang dapat dikuantifikasi melalui pengujian aktivtas enzim. Terdapat banyak faktor yang mempengaruhi aktivitas enzim. Oleh sebab itu, pengujian aktivitas enzim sebaiknya dilakukan pada kondisi optimum sehingga hasil kuantifikasi yang didapatkan lebih akurat.
Proses pengolahan pati menjadi gula sebenarnya dapat dilakukan dengan menggunakan dua jenis katalis, yaitu katalis asam dan katalis enzim. Pengolahan pati degan bantuan katalis enzim terdiri dari dua tahap, yaitu likuifaksi dan sakarifikasi. Pada tahap likuifaksi, enzim yang digunakan adalah enzim α-amilase. Enzim α-amilase membantu proses hidrolisis pati (polisakarida) menjadi oligosakarida, berupa limit dekstrin dan senyawa oligosakarida lainnya. Kemudian proses pengolahan dilanjutkan dengan penambahan enzim lainnya selama proses sakarifikasi. Jenis enzim yang ditambahkan selama proses sakarifikasi spesifik tergantung jenis dan karakteristik produk gula yang ingin dihasilkan.
2 Enzim α-Amilase
Enzim α-amilase memiliki nama kimiawi, yaitu endo-1,4-α-D-glucan glucohydrolase, EC 3.2.1.1. Enzim α-amilase merupakan enzim ekstraseluler yang mampu memotong ikatan 1,4-α-D-glikosidik antara monomer glukosa pada rantai linier amilosa. Enzim ini dikategorikan sebagai endoenzim karena pemotongan pati dilakukan secara acak dari dalam [3]. Enzim α-amilase disusun oleh protein. Protein yang tersusun dalam enzim terdiri dari 3 domain, yaitu domain A, B, dan C sesuai Gambar 1. Domain A yang ditandai dengan warna merah merupakan domain terbesar berbentuk seperti super struktur barrel (β/α)g. Domain B yang ditandai dengan
warna kuning. Domain B menempel dengan domain A karena ikatan disulfida serta berada di antara domain A dan C. Domain C yang ditandai dengan warna biru memiliki struktur lembaran β yang terhubung dengan domain A karena adanya rantai polipeptida sederhana. Sisi aktif enzim yang ditandai dengan warna hijau merupakan rantai panjang, terletak di bagian akhir gugus karboksil domain A dan B. Enzim juga dilengkapi dengan ion kalsium yang ditandai dengan bola biru dan ion klorida yang ditandai dengan bola kuning. Ion kalsium berperan sebagai stabilisator dan activator allosteric [4]. Beberapa enzim memiliki lebih dari satu bagian aktif untuk mengikat substrat supaya enzim dapat mengikat substrat lain ketika sudah terikat dengan suatu substrat tertentu. Sifat enzim inilah yang disebut sebagai allosteric [5]. Enzim α-amilase bersifat calsium metalloenzymes sehingga tidak dapat berfungsi tanpa adanya ion kalsium [6].
Gambar 1. Struktur α-amilase [4]
Sebagian besar enzim α-amilase memotong karbohidrat rantai panjang baik secara endoamilase. Akan tetapi, terdapat beberapa enzim α-amilase yang memotong karbohidrat
3 secara eksoamilase, tergantung dari sumber enzim α-amilase dihasilkan. Hasil penguraian oleh α-amilase adalah dekstrin, limit dextrin, oligosakarida, dan turunan siklodextrin [7]. Dextrin adalah campuran oligosakarida kompleks yang memiliki rumus molekul C6H10O3. Dextrin
merupakan produk antara pati dan dekstrosa/glukosa. Limit dextrin adalah campuran oligosakarida dengan rantai lebih pendek. Mekanisme hidrolisis pati menggunakan katalis enzim α-amilase dapat dilihat pada Gambar 2 dan 3.
Gambar 2. Mekanisme SN2 pemutusan ikatan α-1,4-glikosidik oleh enzim α-amilase [8]
Gambar 3. Hidrolisis pati oleh enzim α-amilase [9]
Catatan : (•) residu α-D-glukosa pereduksi; (ᵒ) residu α-D-glukosa nonpereduksi
Enzim α-amilase yang menghasilkan dextrin secara endoamilase berasal dari saliva dan pankreas manusia, pankreas babi, gandum, jamur (Aspergillus oryzae dan Rhizopus niveus), bakteri termostabil (Bacillus subtilis, Bacillus licheniformis, Bacillus acidocaldarius, Clostridium, Dyctio glomus thermophilum, dan Bacilus stearothermophillus), serta bakteri lainnya seperti Streptococcus bovis. Enzim α-amilase yang berasal dari bakteri termostabil cenderung lebih stabil pada temperatur 10oC lebih tinggi dari temperatur kerja enzim α-amilase
4 yang dihasilkan bakteri biasa seperti Bacillus amyloliquefaciens. Keberadaan ion kalsium tidak mempengaruhi sifat termostabil enzim α-amilase yang dihasilkan. [7]
Tabel 1. Karakteristik dan sumber enzim α-amilase yang menghasilkan dextrin [7] Sumber enzim Berat molekular T stabil (oC) pH stabil pH optimum
air ludah manusia 62000 50 4-10 6,8-7,0
pankreas manusia 56000 50 4-10 6,8-7,0 pankreas babi 56000 35 5-11 6,9 gandum 41500 60-66 - 5,5 Rhizopus 51000 < 40 3,6-8,0 4,6-4,8 Bacillus (sakarifikasi) 47300 < 55 4,5-9,2 5,3 Bacillus (likuifaksi) 48900 < 80 5,1-10,4 5,9 Streptococcus 79000 45 5-7 5,6
Tabel 2. Karakteristik dan sumber enzim α-amilase termostabil [7]
Bakteri sumber enzim Berat molekul T optimum (oC) pH optimum pH stabil
B. stearothermophilus 48000 65-73 5-6 6-11 B. licheniformis 62650 90 7-9 7-10 B. subtilis - 95-98 6-8 5-11 Thermophile V-2 50000 70 6-7 9,2 B. acidocaldarius 66000 70 3,5 4-5,5 Clostridium sp. - 80 4,0 2-7 D. thermophilum 70000 85-90 5,0 -
Tabel 3. Karakteristik dan sumber enzim α-amilase yang menghasilkan maltosa dan turunannya [7]
Sumber enzim Berat molekular T stabil (oC) pH stabil T optimum (oC) pH optimum produk Streptomyces griseus 55000 <40 3,5-6,5 45 5,6-6,0 maltotriosa Pseudomonas stutzeri 56000 35 6,0-10,5 45 8 maltotetraosa Bacillus licheniformis 22500 <60 8 76 5,0-8,0 maltopentaosa Aerobacter aerogenes 48000-65000 50 5,0-10,0 52 7,0 maltoheksaosa Bacillus circulans 48000-67000 50 6,0-9,0 60 6,8 maltoheksaosa
Enzim α-amilase juga menghasilkan oligosakarida spesifik. Maltotriosa dihasilkan oleh enzim α-amilase secara eksoamilase dari Streptomyces griseus. Maltotetraosa dihasilkan oleh
5 enzim α-amilase secara eksoamilase dari Pseudomonas stutzeri. Maltopentaosa dihasilkan oleh enzim α-amilase secara endoamilase dari Bacillus licheniformis. Sedangkan, maltoheksaosa dihasilkan oleh enzim α-amilase secara eksoamilase dari Aerobacter aerogenes dan secara endoamilase dari Bacillus circulans. [7]
Pengujian Aktivitas Enzim α-Amilase
Pengujian aktivitas enzim α-amilase pada dasarnya dapat dilakukan melalui tiga pengamatan utama, yaitu peningkatan kekuatan reduksi, penurunan intensitas warna biru, dan perubahan densitas optis. Peningkatan kekuatan reduksi diamati dengan pengukuran produk berupa gula pereduksi dari substrat pati. Penurunan intensitas warna biru senyawa kompleks iodin-pati terjadi akibat jumlah substrat yang semakin berkurang akibat kinerja enzim untuk menghidrolisis pati. Perubahan densitas optis terjadi akibat lepasnya substrat dari gugus kromogenik menuju pelarut. [1]
Pengujian aktivitas enzim α-amilase biasanya dilakukan pada kondisi optimum dengan susbtrat amilosa. Pengujian aktivitas enzim biasanya dinyatakan dalam suatu unit tertentu yang spesifik terhadap deskripsinya. Satu unit enzim internasional dinyatakan sebagai jumlah enzim yang mampu berperan sebagai katalis untuk melakukan konversi 1 µM substrat/menit pada kondisi standar. Kondisi standar yang dimaksud meliputi konsentrasi substrat, pH optimum, tidak adanya inhibitor, dan adanya aktivator. Pemakaian definisi unit enzim internasional sangat jarang ditemukan pada pengujian aktivitas enzim α-amilase. Membandingkan aktivitas enzim dalam unit yang berbeda mustahil dilakukan karena setiap unit aktivitas enzim memiliki metode dan cara perhitungan yang berbeda. [1]
Pengujian aktivitas enzim biasanya dilakukan untuk menentukan aktivitas enzim amilase yang telah disimpan terlalu lama. Selain itu, juga dapat menentukan aktivitas enzim α-amilase hasil recovery. Biasanya recovery enzim dilakukan menggunakan membran dengan teknologi reverse osmosis dan elektrodeionisasi [2]. Elektrodeionisasi juga luas digunakan untuk penghilangan asam [22]. Penentuan aktivitas enzim α-amilase hasil recovery penting untuk diketahui karena proses recovery menggunakan membran terkadang diiringi dengan adanya fenomena fouling. Fenomena fouling dapat dicegah melalui backflushing untuk membran mikrofiltrasi [23] dan penggunaan cleaning agent [24]. Selain recovery enzim, membran juga dapat digunakan untuk menghilangkan turbiditas produk minuman seperti jus apel [25].
6 Tabel 4. Metode-metode pengujian aktivitas enzim α-amilase
Metode Sumber enzim Literatur Unit enzim
Ceralpha plant and microbial [10] ceralpha unit, bisa
dikonversi ke UI Amylase sd / sprout
method
cereal grains [11] Amylase SD unit
Novo assay Bacillus licheniformis dan Bacillus
stearothermophilus
[12] Novo unit (NU)
HPLC dan spektrofotometri
- [13] Somogyi unit/dl
Penggunaan reagen kit dari Genzyme
- [14] Optical density
Maltose concentration measurement (reducing sugar)
Bacillus subtilis [15] 1 µmol (red sgr)
maltose/min Fuwa - [16, 17, 18, 19, 20] Dextrinizing and Saccharifying Power (DP, SP)
Somogyi-Nelson Aspergillus oryzae [7] -
Hidrolisis p-nitrofenil menjadi p-nitrofenol
Aspergillus oryzae [7] -
Starch liquefying method (iodin)
bacterial (b licheniformis) [7] Lj unit/mL Measurement of
reducing group
human urine [21] U/l
UV determination of degradation product maltose and glucose
serum and urine [21] U/l
Determination with Coloured Insoluble Substrates - [21] U/l Measurement of the Starch-Iodine Complex - [21] U/l Measurement by End-point Determination on Paper - [21] U/l Measurement after Electrophoretic Separation urine [21] U/l
7 Tabel 5. Metode pengujian enzim disertai dengan definisi satuan aktivitas enzim α-amilase [1]
Metode Deskripsi Definisi unit Temperatur
(oC) Waktu inkubasi (menit) Wohlgemuth (iodine) Mengukur waktu perubahan warna iodin tertentu Jumlah (mL) pati (1%) yang dihidrolisis 1 mL enzim 40-60 30 Fisher dan Stein (reducing value) Mengukur konsentrasi gula pereduksi menggunakan reagen dinitrosalicyclic acid 1 mg gula pereduksi (maltosa) yang dihasilkan dari pati 1% 65 3 Bird dan Hopkins (iodine) Mengukur penurunan kepudaran warna senyawa kompleks pati-iodin pada panjang gelombang 620 nm
Jumlah enzim yang berhasilkan menghidrolisis pati menjadi 1 mg maltosa 25 10 Insoluble dyed amylose Menentukan konsentrasi oligosakarida yang memiliki ikatan kromogen dari amilosa berwarna yang tidak larut
1 unit absorbansi menyatakan 0,06 IU/mL α-amilase 37 30 Fuwa (iodine) Menggunakan amilosa 0,2% sebagai substrat Jumlah amilosa (mg) yang menyebabkan penurunan intensitas warna biru sebesar 10% pada panjang gelombang 700 nm
37 30
SKB (iodine) - Jumlah enzim yang
mampu mengurai 5,26 mg pati untuk
mencapai nilai iodin tertentu
37 60
Metodologi
Substrat berupa larutan pati dengan variasi konsentrasi 10 mg/mL dan 20 mg/mL sebanyak 5 mL dilarutkan dalam buffer fosfat 5 mL. Kemudian enzim α-amilase Liquozyme supra sebanyak 1 mL ditambahkan ke dalam 7 mL campuran tersebut. Larutan kemudian diinkubasikan dalam inkubator pada temperatur 37oC selama 30 menit. Reaksi dihentikan
dengan penambahan HCl 1 N sebanyak 1 mL. Konsentrasi pati tersisa dalam larutan diukur secara tidak langsung melalui pengukuran nilai absorbansi larutan yang telah dicampur larutan
8 iodin 1 mL. Larutan iodin disiapkan dengan melarutkan 5 gram KI dan 500 mg I dalam air 100 mL untuk diencerkan sebanyak 100 kali. Nilai absorbansi diukur dengan menggunakan spektrofotometer UV-Vis pada panjang gelombang 620 nm. Konsentrasi yang terbaca kemudian ditentukan dari nilai absorbansi yang terbaca pada kurva kalibrasi. Jika nilai absorbansi tidak terbaca pada kurva kalibrasi, maka sampel diencerkan hingga nilai absorbansi terbaca pada kurva kalibrasi. Metodologi diadaptasi dari literatur [1, 16, 17, 18].
HASIL DAN PEMBAHASAN
Kurva Kalibrasi
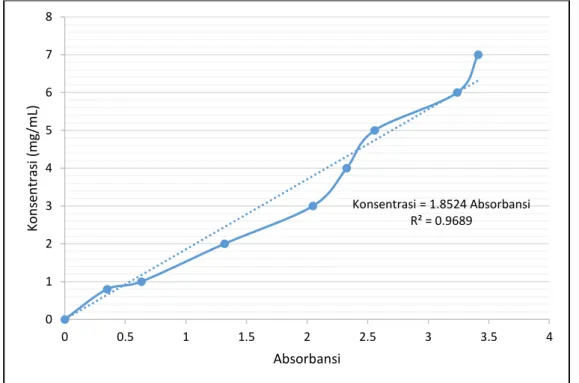
Sebelum pengujian aktivitas enzim dilakukan, kurva kalibrasi dibuat terlebih dulu dengan cara mengalurkan absorbansi dan konsentrasi pati tertentu yang diberi larutan iodin. Konsentrasi yang dipilih memiliki absorbansi di bawah 3,5. Kurva kalibrasi hasil percobaan dapat dilihat pada Gambar 2.
Nilai R2 dari kurva kalibrasi masih melebihi 0,95 yaitu 0,9689 sehingga kurva kalibrasi dianggap layak dan mampu mewakili data dengan baik. Data yang diambil untuk membuat kurva kalibrasi juga sudah mewakili, yaitu 8 data. Kurva kalibrasi ini kemudian akan digunakan untuk menentukan jumlah pati yang tersisa pada bagian pengujian enzim.
Gambar 2. Kurva kalibrasi absorbansi dan konsentrasi pati
Konsentrasi = 1.8524 Absorbansi R² = 0.9689 0 1 2 3 4 5 6 7 8 0 0.5 1 1.5 2 2.5 3 3.5 4 Kon se n tra si (m g/m L) Absorbansi
9 Aktivitas Enzim α-Amilase
Aktivitas enzim α-amilase dilakukan dengan menggunakan larutan iodin melalui metode Fuwa. Larutan iodin pada dasarnya berwarna kuning kecoklatan. Akan tetapi, larutan iodin dapat membentuk senyawa kompleks berwarna biru dengan pati. Oleh sebab itu, absorbansi warna biru yang terukur oleh spektrofotometer di akhir reaksi menunjukkan jumlah pati yang tidak terhidrolisis oleh enzim. Dengan demikian, kemampuan enzim dalam hidrolisis pati dapat diketahui dari jumlah pati tersisa dalam larutan. Enzim yang diuji aktivitasnya pada percobaan ini adalah enzim α-amilase Liquozyme Supra dan Fungamyl® 800L.
Tabel 6. Dokumentasi sampel sebelum pengukuran nilai absorbansi
Sebelum pengenceran Setelah pengenceran* Sampel enzim Liquozyme Supra *Pengenceran dilakukan sebanyak 2 kali Sampel enzim Fungamyl® 800L *Pengenceran dilakukan sebanyak 10 kali
10 Aktivitas enzim memiliki satuan yang berbeda tergantung deskripsi dan metode pengujiannya. Hal ini menyebabkan besarnya aktivitas enzim hasil percobaan tidak dapat dibandingkan dengan aktivitas enzim yang tertera pada data enzim produsen. Data aktivitas enzim produsen untuk enzim α-amilase Liquozyme Supra dan Fungamyl® 800L berturut-turut sebesar 135 KNU/g dan 880 FAU/g. KNU menyatakan jumlah enzim yang dapat menghasilkan 6 mikro mol p-nitrofenol per menit dari ethylidene-G7-p-nitrophenyl-maltoheptaoside sebanyak 1,86 mM pada kondisi standar, yaitu pH=7,0 dan temperatur=37oC. Sedangkan FAU
menyatakan jumlah enzim yang dapat mengonversi 5,26 gram pati per jam pada kondisi standar, yaitu pH=4,7 dan temperatur=37oC selama 7-20 menit. Kondisi standar untuk jenis enzim yang sama mungkin saja berbeda karena kondisi pengujian bersifat spesifik terhadap sumber enzim berasal.
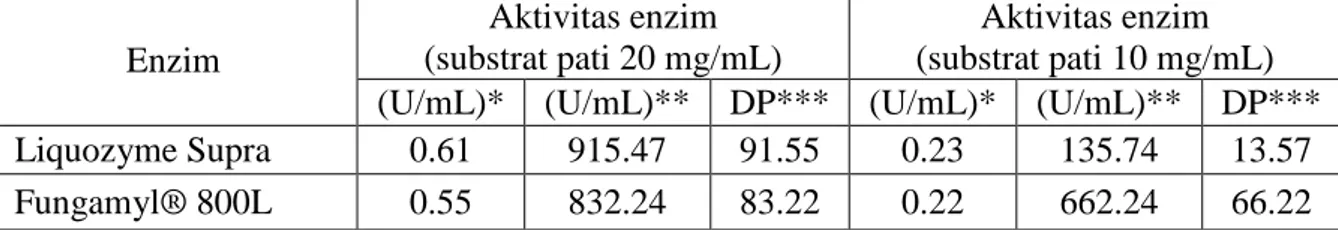
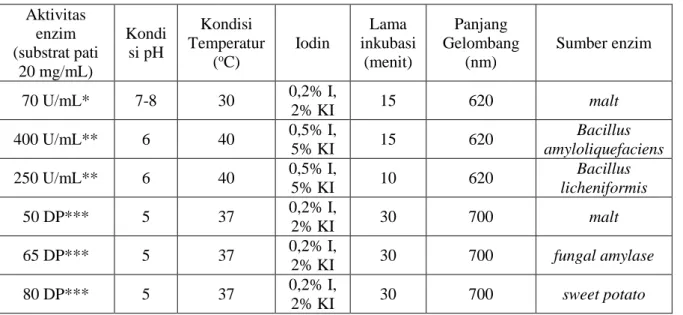
Analisis perhitungan pengujian aktivitas enzim dilakukan mengikuti beberapa literatur untuk dibandingkan sesuai Tabel 9. Metode Fuwa hanya mampu menguji kadar pati tersisa. Data percobaan enzim α-amilase Liquozyme Supra dan Fungamyl® 800L pada Tabel 7 tidak berbeda terlalu jauh dengan data literatur pada Tabel 8. Hal ini dapat ditinjau dari akurasi data pada Tabel 9 sebesar 59-96%.
Selain meninjau keandalan metode Fuwa dalam pengujian aktivitas enzim, data percobaan juga dapat digunakan untuk meninjau kesesuaian kondisi pengujian aktivitas enzim. Dengan melakukan perubahan konsentrasi substrat sebesar 10 mg/mL, terlihat bahwa data percobaan aktivitas enzim pada Tabel 7 menjadi jauh berbeda dengan literatur pada Tabel 8. Hal ini menunjukkan bahwa kondisi dan konsentrasi reagen yang digunakan dalam percobaan sebaiknya dilakukan sesuai dengan literatur.
Tabel 7. Aktivitas enzim melalui metode Fuwa
Enzim
Aktivitas enzim (substrat pati 20 mg/mL)
Aktivitas enzim (substrat pati 10 mg/mL) (U/mL)* (U/mL)** DP*** (U/mL)* (U/mL)** DP*** Liquozyme Supra 0.61 915.47 91.55 0.23 135.74 13.57 Fungamyl® 800L 0.55 832.24 83.22 0.22 662.24 66.22 Keterangan : Percobaan dilakukan pada temperatur 37oC dan pH 7, dengan waktu inkubasi selama 30
menit. Enzim Liquozyme Supra yang digunakan merupakan hasil fermentasi dari Bacillus
licheniformis. Sedangkan Fungamyl® 800L merupakan hasil fermentasi dari jamur Aspergillus oryzae.
11 Tabel 8. Aktivitas enzim melalui metode Fuwa dari literatur
Aktivitas enzim (substrat pati 20 mg/mL) Kondi si pH Kondisi Temperatur (oC) Iodin Lama inkubasi (menit) Panjang Gelombang (nm) Sumber enzim 70 U/mL* 7-8 30 0,2% I, 2% KI 15 620 malt 400 U/mL** 6 40 0,5% I, 5% KI 15 620 Bacillus amyloliquefaciens 250 U/mL** 6 40 0,5% I, 5% KI 10 620 Bacillus licheniformis 50 DP*** 5 37 0,2% I, 2% KI 30 700 malt 65 DP*** 5 37 0,2% I, 2% KI 30 700 fungal amylase 80 DP*** 5 37 0,2% I, 2% KI 30 700 sweet potato Keterangan :
* Satu unit aktivitas enzim dinyatakan sebagai jumlah enzim yang mampu menyebabkan perubahan intensitas warna biru larutan pati berkurang hingga 1%. [17]
𝐴𝑘𝑡𝑖𝑣𝑖𝑡𝑎𝑠 𝑒𝑛𝑧𝑖𝑚 (𝑈/𝑚𝐿) = (𝑂𝐷620𝑐𝑜𝑛𝑡𝑟𝑜𝑙 − 𝑂𝐷620𝑠𝑎𝑚𝑝𝑙𝑒) 𝑂𝐷620𝑚𝑔 𝑠𝑡𝑎𝑟𝑐ℎ 𝑥 𝑡 𝑥 𝑉
** Satu unit aktivitas enzim akan menghasilkan 1 mg maltosa dari pati [1] 𝐴𝑘𝑡𝑖𝑣𝑖𝑡𝑎𝑠 𝑒𝑛𝑧𝑖𝑚 (𝑈/𝑚𝐿) = 𝐷(𝑅0− 𝑅)
𝑅0
𝑥100
*** Satu unit Dextrinizing Power dihitung sebagai jumlah amilase yang mampu menurunkan intensitas warna biru sebanyak 10% pada senyawa kompleks amilosa-iodin pada 37oC dan pH 6 untuk α-amilase
bakterial dan pH 5 untuk amilase lainnya. [16] 𝐷𝑃 =𝐷0− 𝐷
𝐷0
÷ 10%
Tabel 9. Perhitungan akurasi data percobaan dengan literatur (substrat 20 mg/mL pati)
Jenis Enzim
Aktivitas enzim data percobaan
Aktivitas enzim
data literatur modifikasi Akurasi (%) U/mL* U/mL** DP*** U/mL* U/mL** DP***
Liquozyme Supra 0.61 915.47 91.55 187 800 65 0.33 85.57 59.16 Fungamyl ® 800L 0.55 832.24 83.22 187 800 65 0.30 95.97 71.96 Referensi : * [17]; ** [1]; *** [16]. Kesimpulan
Pengujian aktivitas enzim α-amilase dapat dilakukan melalui metode Fuwa. Analisis data aktivitas enzim dengan akurasi tertinggi diperoleh dari literatur Yoo, dkk., [1], yaitu sebesar 96% dengan aktivitas enzim α-amilase 800 U/mL.
12 Daftar Pustaka
1. Yoo, Y.J.; Hong, J.; Hatch, R.T.,
”Comparison of α-amylase activities from different assay methods”, Biotechnology and Bioengineering XXX (1987), 141-151. 2. Widiasa, I.N.; Wenten, I.G.,"Combination of
reverse osmosis and electrodeionization for simultaneous sugar recovery and salts removal from sugar wastewater", Reaktor 11 (2007), 91-97.
3. Pandey, A.; Nigam, P.; Soccol, C.R.; Soccol, V.T.; Singh, D.; Mohan, R., "Review:
advances in microbial amylases",
Biotechnol. Appl. Biochem. 31 (2000), 135– 152.
4. Souza, P.M. de; Magalhaes, P. de O., "Application of microbial alpha-amylase in industry - a review", Brazilian Journal of Microbiology 41 (2010), 850-861.
5. Shuler, M.L.; Kargi, F., "Bioprocess engineering: basic concepts", 2nd Ed., Prentice Hall PTR, 2002.
6. Stein, E.A.; Hsiu, J.; Fischer, E.H, "Alpha-amylases as calcium-metalloenzymes. I. Preparation of calcium-free apoamylases by chelation and electrodialysis", Biochemistry
3 (1964), 56–61.
7. The Amylase Research Society of Japan, “Handbook of amylases and related enzymes”, Pergamon Press, 1988.
8. Bemiller, J.; Whistler, R., "Starch: chemistry and technology", 3rd Ed., Elsevier Inc., 2009.
9. Horvathova, V.; Janecek, S.; Sturdik, E., "Amylolytic enzymes: their specificities, origins and properties", Biologia, Bratislava,
55 (2000), 605-615.
10. Megazyme, "Alpha-amylase assay procedure (ceralpha method)", Megazyme International Ireland, 2012.
11. Megazyme, "Alpha-amylase assay procedure
(amylase sd method)", Megazyme
International Ireland, 2015.
12. Carrol, J.O.; Swanson, T.R.; Trackman,P. C.,
“Alpha-amylase mixtures for starch
liquefaction”, EP 0252730 A2, 1988. 13. Ikenaka, S.T.; Omichi, K., "Modified
oligosaccharides used as substrate for measuring alpha-amylase activity", US Patent 4622295, 1986.
14. Blair, H.E., "An alpha-amylase assay method and reagent kit", Europe Patent 0 171 960 A1, 1985.
15. Bisswanger, H., “Practical enzymology”, 2nd Ed., Wiley-Blackwell, 2011.
16. Fuwa, H., “A new method for
microdetermination of amylase activity by the use of amylose as the substrate”, The Journal of Biochemistry 41 (1954), 584-603. 17. Yaldagard, M.; Mortazavi, S.A.; Tabatabaie, F., “Effect of ultrasonic power on the activity of barley’s alpha-amylase from post-sowing treate of seeds”, World Applied Sciences Journal 3 (2008), 91-95.
18. Xiao, Z.; Storms, R.; Tsang, A., "A
quantitative starch-iodine method for
measuring alpha-amylase and glucoamylase activities", Analytical Biochemistry 351 (2006),146–148.
19. Vishnu, T.S.; Soniyamby, A.R.; Praveesh,
B.V.; Hema, T.A., "Production and
Optimization of Extracellular Amylase from Soil Receiving Kitchen Waste Isolate Bacillus sp. VS 04", World Applied Sciences Journal 29 (2014): 961-967.
20. Nurachman, Z.; Kono, A.; Radjasa, O.K.; Natalia, D., "Identification a Novel
Raw-Starch-Degrading-α-Amylase from a
Tropical Marine Bacterium", American Journal of Biochemistry and Biotechnology
6 (2010), 300-306.
21. Bergmeyer, H.U.; Gawehn, K., “Methods of enzymatic analysis volume 2”, 2nd Ed., Academic Press, Inc., 1974.
22. Khoiruddin; Yunus, I.S.; Sucipto, J.;
Wenten, I.G., "Application of
electrodeionization (EDI) for humic acid removal", The 5th AUN/SED Net Regional Conference on Global Environment (2012), Bandung-Indonesia.
23. Wenten, I.G., "Mechanisms and control of
fouling in crossflow microfiltration",
Elsevier Science Ltd 95 (1995), 252-253. 24. Wenten, I.G.; Taylour, J.; Rasmussen, A.;
Jonsson, G., "Membrane cleaning after beer clarification", EUR (1996), 188-195. 25. Wenten, I.G.; Koenhen D.M.; Roesink,
H.D.W.; Rasmussen, A.; Jonsson, G., "Method for the removal of components causing turbidity. from a fluid, by means of microfiltration", US 5560828, 1996.
![Gambar 1. Struktur α-amilase [4]](https://thumb-ap.123doks.com/thumbv2/123dok/4256495.2880977/3.892.333.565.705.1013/gambar-struktur-α-amilase.webp)
![Gambar 2. Mekanisme SN 2 pemutusan ikatan α-1,4-glikosidik oleh enzim α-amilase [8]](https://thumb-ap.123doks.com/thumbv2/123dok/4256495.2880977/4.892.136.756.329.578/gambar-mekanisme-pemutusan-ikatan-glikosidik-oleh-enzim-amilase.webp)
![Tabel 3. Karakteristik dan sumber enzim α-amilase yang menghasilkan maltosa dan turunannya [7]](https://thumb-ap.123doks.com/thumbv2/123dok/4256495.2880977/5.892.112.790.810.1067/tabel-karakteristik-sumber-enzim-amilase-menghasilkan-maltosa-turunannya.webp)