BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di kandang percobaan unggas Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Pengamatan efek perubahan patologis dilaksanakan di Laboratorium Patologi FKH-IPB. Penghitungan jumlah leukosit dan deferensiasi leukosit dilakukan di Laboratorium Fisiologi FKH-IPB. Pemeriksaan antibodi Marek dengan metode ELISA dilaksanakan di Laboratorium terpadu FKH-IPB. Penelitian dimulai bulan Mei 2004 sampai dengan Agustus 2006.
Bahan dan Alat Hewan percobaan
Penelitian menggunakan 80 ekor ayam ras petelur betina berumur satu hari (DOC). Ayam percobaan adalah ayam ras petelur strain Isa Brown yang diperoleh dari peternakan pembibitan “Manggis Farm” desa Tenjoayu Sukabumi, Jawa Barat. Kandang percobaan yang digunakan adalah sistem multiple cages berukuran 60 x 45 x 30 cm, masing-masing unit terdiri atas 3 ekor sehingga jumlah kandang seluruhnya 20 unit. Setiap kandang dilengkapi tempat makan, minum, dan lampu kandang dipakai secara bersama-sama sebagai alat penerangan, cages ditempatkan dalam satu ruangan kandang. Peralatan lain yang digunakan adalah alat pengukur temperatur ruangan, higrometer, plastik wadah ransum, ember, tirai penutup kandang, timbangan, tabung penampung darah, spuit, rak telur, dan peralatan tulis.
Ekstrak benalu teh
Benalu teh (Scurrula oortiana) diperoleh dari Perkebunan Teh PTP Rancabuli, Cibuni, Bandung dan ekstraksi dilakukan di Laboratorium Bahan Makanan Ternak, Universitas Diponegoro, Telukawur Jepara Jawa Tengah. Ekstrak S. oortiana yang digunakan sebagai bahan uji adalah dari hasil ekstraksi dengan metode reflux menggunakan air sebagai pelarut.
Virus Marek
Virus Marek serotipe 1 yang digunakan dalam penelitian ini diperoleh dari Balai Besar Pengawasan Mutu dan Sertifikasi Obat Hewan (BBPMSOH) Direktorat Jenderal Peternakan, Departemen Pertanian, Gunung Sindur Bogor.
Desain Penelitian
Ayam ras petelur betina umur 3 minggu yang tidak divaksin Marek diberi perlakuan infeksi MDV secara intraperitoneal sehingga dimungkinkan terjadi imunosupresi akibat infeksi produktif, kemudian dilanjutkan infeksi laten atau terjadi tranformasi limfosit T (sel T) sehingga terjadi limfoma. Untuk mengetahui pengaruh pemberian ekstrak benalu teh (S. oortiana) pada peningkatan imunitas, dan hambatan onkogenesitas penyakit Marek dilakukan dua tahapan percobaan.
Tahap pertama uji adalah penentuan dosis infeksi MDV. Pada tahap ini digunakan 20 ekor ayam yang dibagi ke dalam lima kelompok perlakuan, masing-masing empat ekor, yaitu A. kontrol tanpa infeksi, B. diinfeksi intraperitoneal dengan dosis 0,125 x 1000 EID50, C. 0,250 x 1000 EID50, D 0,500 x 1000 EID50, dan E 1 x 1000 EID50. Pada penelitian tahap kedua digunakan 60 ekor ayam yang dibagi ke dalam empat kelompok perlakuan, yaitu perlakuan A. diberi ekstrak S. oortiana dengan, tanpa infeksi MDV, B tanpa pemberian ekstrak S. oortiana dan tanpa infeksi MDV, C diberi ekstrak S. oortiana dan diinfeksi MDV, dan D tanpa diberi ekstrak S.oortiana, diinfeksi MDV. Ekstrak benalu teh diberikan secara oral (dicekok) sejak ayam berumur 15 hari sampai akhir percobaan, dengan dosis 10 mg/kg bobot badan yang dilarutkan dalam air minum. Ayam diinfeksi dengan virus Marek pada umur 20 hari secara intraperitoneal (Cho et al. 1999) dengan dosis 1.000 EID50.
Pengaruh pemberian ekstrak S. oortiana sebagai imunomodulator diukur berdasarkan bobot relatif bursa Fabricius dan timus, ukuran diameter folikel bursa Fabricius, imunoreaktivitas terhadap iNOS, dan titer antibodi terhadap MDV. Kemampuan daya hambat atas keberadaan MDV pada bursa Fabricius diukur dengan metode imunohistokimia. Kemampuan menurunkan risiko kanker diukur dengan pemeriksaan histopatologi berdasarkan jumlah limfosit pada mukosa proventrikulus dan perubahan histopatologi pada organ hati.
Metode Penelitian
Ayam percobaan secara acak ditempatkan dalam kandang yang sudah dilengkapi tempat makan, minum, dan lampu penerangan. Adaptasi ayam percobaan tidak dilakukan karena menggunakan ayam umur satu hari (day old chicken – DOC).
Desain percobaan yang digunakan untuk penentuan titer antibodi pada MDV, jumlah leukosit per ml dan proporsi limfosit, jumlah limfosit submukosa
proventrikulus, diameter folikel bursa Fabricius, dan jumlah iNOS positif pada hati. Metode statistika yang digunakan pada percobaan ini adalah Rancangan Acak Lengkap, dan bila terdapat beda nyata antara perlakuan akan dilanjutkan dengan Uji Kontras Ortogonal (Steel dan Torrie, 1991). Penghitungan analisis statistika dilakukan dengan bantuan Microsoft Exell 2000 dan SPSS 13 for Windows
Model statistika RAL adalah :
Yij = µ + τi + Єij
Yij = Respons percobaan pada perlakuan ke-i dan ulangan ke-j µ = Rataan umum
τi = Pengaruh perlakuan ke-i Єij = Galat percobaan
i = 1,2,3,4 (perlakuan)
j = 1,2,3,4 (ulangan)
Tahap I. Uji penentuan dosis infeksi Marek’s disease virus (MDV)
Infeksi MDV dilakukan secara intraperitoneal terhadap ayam umur 21 hari, pada lima kelompok perlakuan, masing-masing terdiri atas empat ekor ayam, dengan dosis sebagai berikut :
Kelompok A : kontrol, hanya diberi akuades sebagai plasebo Kelompok B : diinfeksi MDV dengan dosis 1.103 EID50 Kelompok C : diinfeksi MDV dengan dosis 0,5.103 EID50 Kelompok D : diinfeksi MDV dengan dosis 0,25.103 EID50 Kelompok E : diinfeksi MDV dengan dosis 0,125.103 EID50
Parameter yang diukur adalah : perubahan histopatologi pada bursa Fabricius, hati, dan proventriculus pada 20 dan 40 hari p.i.
Tahap II. Uji ekstrak S. oortiana sebagai imunomodulator dan menurunkan risiko ksnker .
Pemberian ekstrak S. oortiana dengan dosis 10 mg/kg bobot badan, diberikan secara oral dengan cara dicekok pada umur 15 hari sampai akhir percobaan, yaitu 60 hari, infeksi MDV diberikan pada umur 20 hari secara intraperitoneal dengan dosis 1.103 EID50.
Kelompok A : diberi ekstrak S. oortiana tanpa diinfeksi MDV Kelompok B : tanpa diberi ekstrak S. oortiana tanpa diinfeksi MDV Kelompok C : diberi ekstrak S. oortiana dan diinfeksi MDV
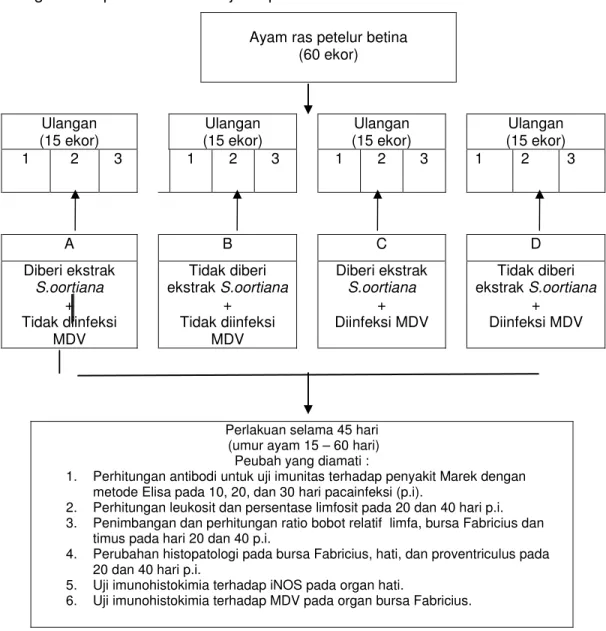
Diagram alir penelitian ini disajikan pada Gambar 6.
Ayam ras petelur betina (60 ekor) Ulangan (15 ekor) Ulangan (15 ekor) Ulangan (15 ekor) Ulangan (15 ekor) 1 2 3 1 2 3 1 2 3 1 2 3 A B C D Diberi ekstrak S.oortiana + Tidak diinfeksi MDV Tidak diberi ekstrak S.oortiana + Tidak diinfeksi MDV Diberi ekstrak S.oortiana + Diinfeksi MDV Tidak diberi ekstrak S.oortiana + Diinfeksi MDV
Perlakuan selama 45 hari (umur ayam 15 – 60 hari) Peubah yang diamati :
1. Perhitungan antibodi untuk uji imunitas terhadap penyakit Marek dengan metode Elisa pada 10, 20, dan 30 hari pacainfeksi (p.i).
2. Perhitungan leukosit dan persentase limfosit pada 20 dan 40 hari p.i. 3. Penimbangan dan perhitungan ratio bobot relatif limfa, bursa Fabricius dan
timus pada hari 20 dan 40 p.i.
4. Perubahan histopatologi pada bursa Fabricius, hati, dan proventriculus pada 20 dan 40 hari p.i.
5. Uji imunohistokimia terhadap iNOS pada organ hati.
6. Uji imunohistokimia terhadap MDV pada organ bursa Fabricius.
Gambar 6 Diagram alir penelitian
Pengukuran titer antibodi terhadap MDV dengan teknik enzyme-linked immuno sorbent assay (ELISA)
Bahan dan alat.
Mikroplat, pipet mikro, antigen MDV, serum ayam, PBS- TW20 0,05%, carbonate bicarbonate buffer pH 9,6, Bovine Serum Albumin (BSA) 1%, conjugate (Rabbit anti Chicken), substrat 2-2’-azino-bis(3-ethylbenzthiazo-line-6-sulphonic acid) (ABTS), Microplate Reader, dan inkubator.
Prosedur kerja.
1. Coating antigen MDV 1/200 dalam carbonate bicarbonate buffer pH 9,6 yaitu antigen 50 µl dilarutkan pada carbonate bicarbonate buffer 9950 µl. Tiap sumur
diisi 100 µl kemudian diinkubasikan 4o C semalam. Antigen terabsorbsi secara pasif ke matriks padat melalui interaksi hidrofobik, interaksi ini dapat meningkatkan pengikatan. Mikroplate dicuci 3 sampai 4 kali dengan PBS-TW20 0,05% 200 µl sampai dengan 250 µl. Pencucian dengan larutan bufer dilakukan untuk menghilangkan materi nonpengikatan dan yang berikatan longgar pada fase padat .
2. Selanjutnya dilakukan blocking dengan Bovine Serum Albumin (BSA) 1% (100 µg BSA dalam 10 ml PBS) tiap sumur diisi 200 µl kemudian diinkubasi selama 45 menit pada suhu 37oC. Perlakuan blocking bertujuan untuk mengisi tempat yang belum tertutup (coated) antigen pada fase padat sehingga menghambat pengikatan non-spesifik reagent berikutnya, BSA mudah mengikat pada fase padat. Kemudian dicuci 3 sampai 4 kali dengan PBS-TW20 0,05%.
3. Sebanyak 100 µl serum ayam dengan konsentrasi 1/100 (10 ul dalam 1 ml larutan PBS) dimasukkan ke dalam tiap sumur, kemudian diinkubasikan selama 1 jam pada suhu 37oC. Mikroplate dicuci 3 sampai 4 kali dengan PBS-TW20 0,05%. 4. Kemudian ditambahkan 100 µl conjugat (Rabbit anti Chicken, Sigma®) dengan
konsentrasi 1/2000 dalam larutan PBS, dan diinkubasi selama 1 jampada suhu 37oC. Mikroplate dicuci kembali 3 sampai 4 kali dengan PBS-TW20 0,05%. Kemudian disiapkan substrat yang terdiri atas 10 µl citrat bufer pH 4,2, H2O2 5 µl., substrat 2-2’-azino-bis(3-ethylbenzthiazo-line-6-sulphonic acid) 200 µl. Sebanyak 100 µl.substrat tersebut dimasukkan ke dalam tiap sumur yang dilanjutkan dengan inkubasi selama 30 menit pada suhu 37oC. Setelah itu, nilai absorbansi segera dibaca pada Microplate Reader (Birad®) pada panjang gelombang 415 nm.
Perhitungan jumlah leukosit Bahan dan alat.
Pipet, kamar hitung, larutan Turk, EDTA, tabung reaksi, alkohol 70%, dan kapas.
Prosedur kerja.
Secara hati-hati bagian badan dan kaki ayam dipegang sehingga tidak meronta. Jarum suntik dimasukkan ke bagian sayap (vena brachialis) yang sebelumnya dibersihkan dengan alkohol. Darah diambil sebanyak 2 ml, kemudian ditampung dalam tabung reaksi yang telah diisi antikoagulan EDTA dengan tujuan mencegah pembekuan darah. Tabung reaksi yang berisi darah ditutup dengan parafin untuk mencegah kontaminasi.
Darah yang dicampur dengan antikoagulans EDTA dihisap dengan pipet hingga tanda 0,5 dan ujung pipet dibersihkan, kemudian pipet diletakkan pada larutan pengencer leukosit (larutan Turk) dan diisi perlahan-lahan hingga tanda angka 11 sehingga didapat konsentrasi menjadi 1 : 20. Pipet yang berisi darah ini dikocok selama 3 menit hingga tercampur homogen, setelah itu sebanyak 2 atau 3 tetes larutan diteteskan dari pipet dibuang sebelum mengisi kamar hitung. Setelah itu, larutan diteteskan ke dalam kamar hitung dan dibiarkan selama 1 menit . Dengan perbesaran rendah jumlah leukosit dihitung dalam 4 kotak sudut kamar hitung darah. Rumus perhitungan yang dipakai adalah :
leukosit/cu.mm atau jumlah sel leukosit = Jumlah sel x 200 (larutan 1 : 20x10) 4
dalam kotak sudut kamar hitung x 50 = leukosit/cu.mm.
Diferensiasi leukosit
Pemeriksaan dilakukan dengan membuat preparat ulas darah dan diwarnai dengan pewarnaan Giemsa 10% selama 30 menit. Sampel darah di campur homogen sebelum diambil dengan pipet kapiler, kemudian satu tetes kecil darah diletakkan dekat ujung gelas obyek posisi permukaan datar. Gelas obyek yang kedua ditempatkan dengan ujung menyentuh permukaan gelas obyek pertama sehingga membentuk sudut 30-45o. Gelas obyek kedua ditarik ke samping dan di biarkan darah mengalir dengan daya kapiler sehingga mencapai luasan 2/3 gelas obyek pertama. Gelas obyek kedua didorong dengan sudut yang sama sehingga membentuk lapisa tipis. Preparat apus dibiarkan mengering di udara terbuka.
Preparat apus darah difiksasi dengan metil alkohol selama 3-5 menit, preparat diambil dan dibiarkan kering di udara. Setelah kering preparat direndam dengan pewarna Giemsa yang baru selama 15-60 menit. Preparat dicuci dengan air berkali-kali dan dibiarkan mengering di rak. Penghitungan persentase limfosit dilakukan perbesaran obyektif 100 x, klasifikasi leukosit pada beberapa lapang pandang dan dihitung per 100 leukosit.
Pembuatan Preparat Histopatologi Bahan dan alat.
10% buffered neutral formalin, parafin, Mayer, hematoxylin, eusin, alkohol konsentrasi 100% (absolut), 96%, 80%, 50%, xylol, perkat neofren, aquades, cover glass, obyect glass, pisau bedah, inkubator suhu 52oC, mikrotom, almari pendingin, mikroskop, dan kaset.
Prosedur kerja.
Pembuatan preparat histologi dilakukan melalui beberapa tahapan antara lain; pemilihan jaringan yang pelu diamati, fiksasi jaringan, pemrosesan jaringan (dehidrasi, clearing, infiltrasi dan embeding dengan parafin), pemotongan jaringan, dan pewarnaan. Kadaver ayam yang difiksasi pada penelitian penyakit Marek diambil organ bursa Fabricius, timus, limpa, hati dan proventrikulus. Kemudian organ difiksasi di dalam larutan buffered neutral formalin (BNF) 10% selama 3 x 24 jam, selanjutnya dilakukan embedding pada parafin.
Sebelum dilakukan pemotongan, blok parafin disimpan terlebih dahulu dalam lemari es agar parafin menjadi lebih keras sehingga memudahkan pemotongan. Jaringan kemudian dipotong menggunakan mikrotom dengan ketebalan 3-5 µm. Sayatan jaringan diapungkan pada air hangat dengan suhu 60oC, dan selanjutnya dilekatkan pada gelas obyek. Untuk memudahkan pengamatan di bawah mikroskop, jaringan yang telah dipotong diwarnai. Proses pewarnaan diawali dengan penghilangan parafin menggunakan xylol. Setelah jaringan bebas parafin direndam dalam alkohol dengan konsentrasi menurun. Dimulai dari alkohol konsentrasi 100% (absolut), 96%, 80%, dan seterusnya sampai alkohol 50%. Kemudian irisan jaringan direndam dalam air, dan jaringan siap diwarnai dengan Hematoksilin dan Eosin (HE).
Untuk membedakan ikatan terhadap warna dilakukan dengan menggunakan zat warna alam dan zat warna sintetis. Zat warna alam yang digunakan adalah hematoksilin dan zat warna sintetis yng digunakan adalah eusin. Hematoksilin mewarnai inti sel menjadi biru sedangkan eosin mewarnai sitoplasma menjadi merah.
Pembuatan preparat imunohistokimia
Bahan dan alat.
Inkubator, xylol, alkohol absolut III, II, I, 95%, 90%, 80%, dan 70%, diionize water (DW), H2O2, metanol, PBS, serum normal, Inducible Nitric Oxyd Synthase (INOS), antibodi primer, antibodi sekunder (biotinilasi), 3,3’-diaminobenzidine (DAB), hematoksilin,
Prosedur kerja.
Jaringan dipotong menggunakan mikrotom dengan ketebalan 3-5 µm. Deparafinisasi dilkukan dengan larutan xylol (III, II, dan I) masing-masing larutan 5 menit. Kemudian dilakukan rehidrasi dengan alkohol bertingkat, dimulai dari alkohol absolut III, II, I, 95%, 90%, 80%, dan 70% pada masing-masing larutan selama 5
menit. Selanjutnya pencucian dilakukan dengan menggunakan diionize water (DW) selama 15 menit. Penghilangan peroksidase endogen menggunakan (0,5 ml H2O2 ditambah 50 ml metanol) selama 15 menit. Pembilasan dilakukan dengan
menggunakan DW selama 7 menit dua kali dan PBS selama 7 menit dua kali. Kemudian preparat ditetesi dengan serum normal pada gelas obyek secara merata, dimasukkan ke dalam kotak preparat (humidity chamber) ditambah kertas tissue dan ditetesi dengan PBS untuk menjaga kelembaban. Selanjutnya preparat dimasukkan kedalam inkubator pada suhu 37ºC selama 45 menit. Pencucian dengan PBS masing-masing 5 menit dilakukan 3 kali, yaitu :
1. Jaringan ditetesi dengan antibodi primer terhadap enzim Inducible Nitric Oxyde Synthase (iNOS), kemudian diinkubasi pada suhu 4ºC selama 1 malam.
Kemudian dilakukan pencucian dengan PBS masing-masing 5 menit sebanyak 3 kali.
2. Selanjutnya preparat ditetesi dengan antibodi sekunder (biotinilasi), diinkubasi pada suhu 37ºC selama 35 menit. Pencucian dengan PBS masing-masing 5 menit sebanyak 3 kali. Ditetesi dengan peroksidase inkubasikan pada suhu 37ºC selama 30 menit. Pencucian dengan PBS masing-masing 5 menit 3 kali.
3. Pemberian chromogen dilakukan dengan cara penetesan larutan 3,3’-diaminobenzidine (DAB), diinkubasikan pada suhu 370C selama 35 menit. Pencucian dengan PBS masing-masing 5 menit sebanyak 3 kali. Counterstain menggunakan hematoksilin dilakukan dengan cara meneteskan sampai rata dan dibiarkan 15 detik lalu dicuci dengan DW. Dehidrasi dilakukan dengan larutan alkohol berseri 70%, 80%, 90%, dan 100% serta alkohol absolut I, II, dan III. Pada masing-masing larutan dibiarkan selama 1 menit. Clearing dilakukan dengan Xylol (I, II, dan III).
Penutupan preparat (mounting) dilaksanakan dengan segera ditutup dengan cover glass. Evaluasi pewarnaan imunohistokimia dilakukan dengan dua metode. Pewarnaan menggunakan antibodi primer terhadap iNOS dilanjutkan dengan penghitungan secara kuantitatif, yaitu dengan menghitung imunoreaktivitas positif menggunakan lensa obyektif 40 x pada 5 lapang pandang, kemudian menghitung rataan. Sedangkan hasil pewarnaan menggunakan antibodi primer MDV