Prosiding Kimia FMIPA
SK-091304
SINTESIS OKSIDA PEROVSKIT La
1-xBa
xCoO
3-δDENGAN METODE
KOPRESIPITASI DAN KARAKTERISASINYA
Anis Thoriyah*, Hamzah Fansuri, M.Si., Ph.D
Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Teknologi Sepuluh Nopember
Abstrak
Oksida perovskit La1-xBaxCoO3-δ dengan variasi komposisi x = 0,0-0,5 dengan interval 0,1 disintesis
menggunakan metode kopresipitasi menggunakan larutan NaOH sebagai bahan pengendap. Kalsinasi dilakukan pada temperatur 850 ˚C sesuai dengan hasil analisis DTA/TGA. Hasil kalsinasi dikarakterisasi mengunakan teknik difraksi sinar-X untuk mengetahui fasa mineral yang ada dalam perovskit dan XRF untuk mengetahui komposisi kimia. Berdasarkan pola difraksi sinar-X yang diperoleh, diketahui bahwa oksida hasil sintesis belum diperoleh fase murni perovskit. Fasa non perovskit yang muncul yakni Co3O4. Munculnya puncak fasa perovskit pada 2θ = 23˚, 32˚ dan 33˚ menunjukkan
perovskit telah berhasil disintesis. Substitusi Ba(II) mempengaruhi oksida perovskit berbasis LaCoO3-δ dilihat dari
pergeseran dan tinggi puncak perovskit pada difraktogram. Komposisi kimia dari hasil sintesis dapat diketahui melalui analisa XRF, misal pada LaCoO3-δ komposisi kimia yang didapat adalah La : Co = 1,03 : 1. Hal ini menunjukkan bahwa
komposisi oksida perovskit LaCoO3-δ telah sesuai.
Kata kunci : Perovskit, La1-xBaxCoO3-δ, kopresipitasi
Abstract
Perovskite oxide La1-xBaxCoO3-δ with various composition (x = 0.0- 0.5) with 0,1 interval was synthesized
using coprecipitation method and NaOH as precipitate agent. Calcination was carried out at 850 ˚C as the result of DTA/TGA. Calcination result was characterized using XRD to find out mineral phase of perovskite and XRF were used to analyze the composition of perovskite. The XRD pattern shows that some of the result was not pure perovskite phase. Presence of impurity detected were Co3O4. The peak of perovskite oxide at 2θ = 23˚, 32˚ and 33˚ showing the success of
perovskite synthesis . Ba(II) substitution influence the shift and peak height of perovskite at diffractogram on LaCoO3-δ
-based perovskite oxides. Chemical composition of the synthesis result can be analyzed using XRF. The chemical composition of LaCoO3-δ in this research was obtained in ratio La : Co = 1,03 : 1. It shows that LaCoO3-δ perovskite
composition is suitable.
Keywords: Perovskite, La1-xBaxCoO3-δ, coprecipitation
1. Pendahuluan
Bahan bakar minyak merupakan sumber energi utama dalam menggerakkan roda kehidupan dunia, termasuk didalamnya roda perekonomian. Tanpa adanya bahan bakar, transportasi akan terhenti, industri akan tutup dan roda perekonomian akan berhenti. Namun dewasa ini pemakaian bahan bakar minyak cenderung meningkat setiap tahunnya seiring pertumbuhan penduduk dan industri, sedangkan cadangan minyak semakin menipis. Berdasarkan data Pertamina, kebutuhan nasional akan bahan bakar minyak tahun 2001/2002 sebanyak 54.248.148 kL (Prasetyo, 2003). Sementara itu, minyak bumi merupakan hasil dari proses evolusi alam yang berlangsung selama ribuan bahkan jutaan tahun lalu dan merupakan sumber energi yang tidak dapat diperbaharui. Tidak salah jika banyak ahli memperkirakan pada 10 tahun mendatang kita yang dikenal sebagai negara pengekspor bahan bakar minyak berubah menjadi negara pengimpor. Untuk mengatasi hal itu, keberadaan bahan bakar alternatif sangat diharapkan guna menghemat pemakaian energi fosil dan demi memenuhi kebutuhan energi di masa depan.
Salah satu bahan bakar alternatif yang sangat menjanjikan sebagai pengganti
bahan bakar minyak adalah gas metana (CH4). Gas metana berpotensi besar untuk dikembangkan dan dijadikan bahan bakar sintetis yang mirip dengan produk-produk turunan minyak bumi, bahkan dengan kualitas yang lebih baik (Witono, 2008). Namun bahan bakar ini meskipun jumlahnya melimpah, sulit didistribusikan kepada konsumen sehingga perlu dikonversikan kedalam wujud cair, diantaranya adalah usaha untuk mengkonversi gas metana menjadi metanol.
Metanol sebagai bahan bakar
mempunyai prospek yang baik, selain dapat diperbaharui (renewable energy) juga memiliki karakteristik pembakaran dengan effisiensi yang besar juga emisi gas buang yang relatif kecil sehingga lebih ramah lingkungan dibandingkan dengan bahan bakar minyak lainnya (Prasetyo, 2003). Disamping itu secara ekonomi metanol mempunyai masa depan yang sangat menjanjikan. Menurut Badan
Tenaga Nuklir Nasional, diperkirakan
peningkatan kebutuhan metanol dunia sampai dengan tahun 2020 sebesar 34,175 milyar gallon atau 3 kali produksi metanol saat ini 12,5 milyar galon. Ini adalah peluang yang
sangat menjanjikan bagi negara-negara
produsen metanol. Indonesia sebagai salah satu Prosiding Skripsi Semester Genap 2009/2010
Prosiding Kimia FMIPA
produsen metanol dengan kapasitas produksi 330 juta galon per tahun, dapat memanfaatkan kesempatan ini untuk menambah kapasitas produksi dan volume penjualan (Media Kita, 2010).
Salah satu cara untuk memproduksi metanol adalah melalui proses oksidasi parsial metana. Namun faktor penyulit utama dalam proses tersebut adalah tingginya stabilitas molekul-molekul gas metana dan reaktivitas produk yang terbentuk terhadap oksigen (O2) yang sangat tinggi (Bramanto, 2003). Sebagai akibatnya, hanya sebagian metanol yang terbentuk yang dapat diisolasi. Oleh karena itu, diperlukan membran dan katalis yang tepat yang berfungsi sebagai pengontrol oksigen dalam upaya mengatasi kendala-kendala tersebut.
Salah satu bahan yang telah banyak digunakan sebagai membran dan katalis pada konversi gas metana menjadi metanol adalah oksida perovskit. Perovskit merupakan oksida campuran dengan rumus umum ABO3, di mana B adalah kation logam transisi dan A adalah kation berukuran besar umumnya kation golongan alkali tanah dan tanah jarang (Rousseau, et.al., 2008). Oksigen kisi pada oksida perovskit dapat disumbangkan kepada
pereaksi lain secara reversibel tanpa
mengakibatkan kerusakan struktur kristalnya. Oksigen kisi ini dapat bereaksi dengan lebih selektif dengan pereaksi lain dibandingkan dengan oksigen dalam fas gas. Sebagai akibatnya, oksida ini memiliki potensi tinggi sebagai sumber oksigen dalam reaksi-reaksi oksidasi reduksi. Karena sifat istimewa inilah oksida perovskit berfungsi sebagai membran keramik rapat atau Mixed Ionic Electronic
Conductor (MIEC) dan sebagai katalis pada
reaksi-reaksi oksidasi.
Oksida perovskit berbasis LaCoO3 merupakan salah satu oksida perovskit yang telah banyak diteliti karena memiliki sifat oksidasi dan reduksi yang baik, dapat menghantarkan ion oksigen, memiliki aktivitas dan selektivitas yang tinggi. Ia dapat mempertahankan integritas strukturnya saat berada dalam keadaan tereduksi dan kembali ke keadaan asalnya setelah direoksidasi. Oksida perovskit berbasis oksida Cobalt telah terbukti memiliki fluks oksigen yang tinggi (Yang et al, 2005).
Khalil, (2002) berhasil mensintesis membran oksida perovskit berbasis LaCoO3 yang disubstitusi dengan barium menggunakan metode sol gel dan solid state pada suhu 900 ˚C selama 2 jam. Ia melaporkan bahwa substitusi barium ke dalam sub kisi lantanum dengan x ≤ 0,5 dari La1-xBaxCoO3-δ dapat meningkatkan konduktivitas ion oksigennya. Substitusi barium ke dalam sub kisi Lantanum ini mempengaruhi kekosongan oksigen pada struktur yang berakibat pada meningkatnya konduktivitas listrik oksida perovskit La1-xBaxCoO3-δ.
Pada penelitian ini akan dilakukan sintesis oksida perovskit berbasis LaCoO3
yang disubtitusi dengan ion Ba2+ dengan
metode kopresipitasi dengan NaOH sebagai agen pengendapnya. Oksida perovskit La1-xBaxCoO3-δ yang disintesis difokuskan pada variasi x=0,1-0,5 dengan interval 0,1. Untuk mendukung hasil penelitian tersebut, produk hasil sintesis dianalisis dengan XRD sehingga didapatkan informasi tentang struktur perovskit yang terbentuk, selain itu juga dilakukan DTA/TGA untuk menentukan suhu kalsinasi. Sedangkan informasi mengenai komposisi dari perovskit yang terbentuk dilakukan analisa dengan XRF.
2. Metode Penelitian 2.1 Pemilihan alat dan Bahan 2.1.1 Alat
Alat-alat yang digunakan dalam percobaan ini adalah gelas beaker, gelas ukur, pipet volum, pipet tetes, corong, labu ukur, kaca arloji, botol semprot, pengaduk magnetik,
evaporating disk, corong Buchner, pompa
vakum, oven (Memmert) di Laboratorium Kimia Anorganik ITS Surabaya, furnace (Naber) di Laboratorium Kimia Anorganik ITS Surabaya dan DTA/TGA (Setaram
Setsys-1750) di Balai Besar Keramik Bandung.
Instrumen karakterisasi yang digunakan adalah alat difraksi sinar-X (XRD) (Philipps X’Pert
PW-3373) di Research Center ITS Surabaya, X-ray Fluoresence (XRF Minipal4 PANalytical) di Laboratorium Studi Energi dan
Rekayasa LPPM ITS Surabaya.
2.1.2 Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah serbuk La2O3 p.a 99,5%
(Merck), serbuk Co(NO3)3.6H2O p.a 99,0%
(Merck), serbuk BaCO3 p.a 99,5% (Merck),
padatan NaOH p.a 99,0% (Mallinckrodt
Chemicals), larutan HNO3 p.a 65%
(Mallinckrodt Chemicals), Metanol p.a 99,8% (Mallinckrodt Chemicals) dan aqua DM.
2.2 Prosedur Kerja
Metode yang digunakan dalam
penelitian ini adalah metode experimental di laboratorium. Langkah-langkah yang akan dilakukan di dalam penelitian ini adalah preparasi dan karakterisasi oksida perovskit La1-xBaxCoO3-δ di mana x antara 0 dan 0,5
dengan interval 0,1.
2.2.1 Preparasi Oksida Perovskit La1-xBaxCoO3-δ
Oksida perovskit yang disintesis pada penelitian ini adalah oksida perovskit berbasis LaCoO3-δ yang disubstitusi dengan Ba2+.
Metode yang digunakan adalah kopresipitasi sebagaimana yang telah dilakukan oleh Junwu, et.al (2007). Bahan baku utama yang digunakan adalah serbuk lanthanum(III) oksida (La2O3), kobalt(II) nitrat heksahidrat
(Co(NO3)2.6H2O) dan barium karbonat
(BaCO3). Preparasi oksida perovskit La
1-xBaxCoO3-δ (x=0-0,5) diawali dengan
Prosiding Kimia FMIPA
yaitu larutan lantanum nitrat (La(NO3)3),
barium nitrat Ba(NO3)2 dan kobalt nitrat
heksahidrat (Co(NO3)2.6H2O).
Larutan lantanum nitrat dibuat dengan melarutkan lanthanum(III) oksida (La2O3)
dalam larutan asam nitrat 1 M. Pelarutan lanthanum(III) oksida (La2O3) ke dalam larutan
asam nitrat dilakukan dengan pengadukan konstan menggunakan pengaduk magnetik pada suhu 60 ˚C dengan kecepatan 400 rpm hingga semua serbuk La2O3 larut dan menjadi
jenuh. Larutan La(NO3)3 yang diperoleh tidak
berwarna.
Selanjutnya, kobalt nitrat heksahidrat dibuat dengan cara melarutkan serbuk Co(NO3)2.6H2O sebanyak 11,6400 gram ke
dalam ± 15 mL aqua DM. Larutan yang diperoleh berwarna merah pekat.
Sementara itu, larutan barium nitrat disiapkan dengan cara melarutkan serbuk BaCO3 dalam larutan asam nitrat 1M.
Kemudian larutan tersebut diaduk pada suhu 60 ˚C dengan kecepatan 400 rpm sampai larut sehingga diperoleh larutan homogen Ba(NO3)2
bening.
Larutan La(NO3)3, Ba(NO3)2 dan
Co(NO3)2.6H2O yang telah disiapkan
selanjutnya dicampurkan. Kemudian pada larutan yang terbentuk ditambahkan larutan NaOH 1M berlebih dan diaduk dengan pengaduk magnetik selama 1 jam. Penambahan larutan NaOH dilakukan hingga pH larutan 10-11. Larutan NaOH 1M dibuat dengan cara menimbang 4 gram pelet NaOH yang dilarutkan ke dalam 100 ml aqua DM.
Endapan yang terbentuk kemudian disaring dengan kertas saring whatman 40 dengan corong buchner. Endapan yang diperoleh berwarna hijau. Endapan tersebut selanjutnya dicuci dengan metanol 99,8% hingga didapat filtrat dengan pH netral. Metanol yang dibutuhkan adalah 150-200 ml. Setelah pH filtrat hasil pencucian menjadi netral, endapan pada kertas saring selanjutnya dikeringkan di dalam oven pada suhu 100 ˚C selama 4 jam sehingga diperoleh endapan kering.
Endapan kering (prekursor) yang terbentuk selanjutnya diubah menjadi oksida perovskit dengan proses kalsinasi pada suhu yang diperoleh dari analisis DTA/TGA.
3.2.2. Penentuan Suhu Kalsinasi dengan Analisis DTA/TGA
Analisis DTA/TGA dilakukan untuk untuk mengetahui perubahan massa endapan setelah dikeringkan dan menentukan suhu yang paling sesuai untuk mengubah prekursor menjadi oksida perovskit. Analisis dilakukan di
Balai Keramik Bandung menggunakan
instrumen DTA-TGA Setaram Setsys-1750. Analisis DTA-TGA dilakukan dalam atmosfir udara dengan kenaikan suhu 10 oC per menit
pada rentang suhu mulai dari suhu kamar hingga 1000 oC. Cuplikan oksida perovskit
yang digunakan dalam bentuk serbuk hasil pengeringan sebanyak 1 gram.
3.2.3 Karakterisasi Oksida Perovskit La1-xBaxCoO3-δ
Karakterisasasi dilakukan terhadap oksida perovskit yang dihasilkan. Karakterisasi yang dilakukan meliputi penentuan fasa menggunakan difraksi sinar-X dan analisis komposisi unsur-unsur pembentuk oksida perovskit menggunakan fluoresensi sinar-X (XRF).
3.2.3.1 Penentuan Fasa Oksida Perovskit Menggunakan XRD
Karakterisasi dengan difraksi sinar-X dilakukan untuk mengetahui struktur dan fasa kristal oksida perovskit yang dihasilkan. Analisis dilakukan di Research Center ITS Surabaya menggunakan instrumen XRD
Philipps X’Pert PW-3373. Radiasi yang digunakan adalah Cu Kα1 dengan panjang
gelombang (λ) 1,54056 Å. Cuplikan yang dianalisis dengan XRD disiapkan dengan cara serbuk oksida perovskit diambil sebanyak 2 gram dan dimasukkan ke dalam sample holder berbentuk lingkaran dengan diameter luar 5,12 cm dan diameter dalam 1,58 cm dengan kedalaman 0,20 cm. Permukaan serbuk kemudian diratakan dengan alat press yang terbuat dari aluminium. Tegangan dan arus yang digunakan adalah 40 kV dan 30 mA. Sudut 2θ yang dipakai adalah 20,02˚ sampai 59,80˚ dengan ukuran step 0,04 dan laju 0,04˚
per detik.
3.2.3.2 Penentuan Komposisi Oksida Perovskit Menggunakan XRF
Analisis XRF digunakan untuk
mengetahui komposisi kimia oksida perovskit yang dihasilkan. Analisis dilakukan di Laboratorium Studi Energi dan Rekayasa LPPM ITS Surabaya menggunakan instrumen XRF Minipal4 PANalytical. Cuplikan yang digunakan untuk analisa adalah serbuk setelah dilakukan kalsinasi.Cuplikan oksida perovskit La1-xBaxCoO3-δ dimasukkan ke dalam sample
cup plastik sebanyak 3 gram. Permukaan
serbuk kemudian diratakan dengan alat press yang terbuat dari tembaga hingga merata dan tidak ada ruang udara pada bagian bawah cup
sample yang nantinya akan dilewati sinar-X.
Pengukuran dilakukan dengan standardless
analysis menggunakan filter Al dan step
pengukuran per 60 detik. Tegangan dan arus listrik yang digunakan adalah sebesar 14 kV dan 643 µA.
3.Hasil dan Diskusi
3.1 Preparasi Oksida Perovskit La1-xBaxCoO3-δ dengan Metode Kopresipitasi
Larutan lantanum nitrat dibuat dengan cara melarutkan serbuk oksida lantanum (La2O3) dalam asam
nitrat 1 M. Larutan lantanum nitrat merupakan sumber ion La3+ untuk oksida perovskit. Pengunaan HNO
Prosiding Kimia FMIPA
sebagai pelarut mengacu pada sifat padatan La2O3 yang
dapat larut dalam larutan asam encer (Windholtz, 1983). Proses pelarutan lantanum nitrat dilakukan dengan pengadukan konstan menggunakan pengaduk magnetik pada suhu 60 ˚C dengan kecepatan 400 rpm hingga semua serbuk La2O3 larut dan didapatkan larutan
La(NO3)3 bening. Penggunaan suhu sebesar 60 ˚C pada
400 rpm bertujuan untuk menghomogenkan larutan dan untuk membuat larutan La(NO3)3 jenuh. Larutan yang
terbentuk tak berwarna karena ion lanthanum tidak bisa menyerap cahaya tampak seperti halnya logam transisi yang memiliki elektron yang tidak berpasangan pada sub kulit d-nya yang bisa menyerap cahaya tampak (Saito, 2004).
Sementara itu, larutan barium nitrat disiapkan dengan cara melarutkan serbuk BaCO3 dalam larutan
asam nitrat 1M. Pengunaan HNO3 sebagai pelarut
mengacu pada sifat barium karbonat yang mempunyai kelarutan yang tinggi dalam pelarut asam (Daintith, 2004). Larutan barium nitrat digunakan sebagai sumber ion Ba2+. Proses pelarutan lantanum nitrat dilakukan
dengan pengadukan konstan dengan pengaaduk magnetik pada suhu 60 ˚C dengan kecepatan 400 rpm. Perlakuan ini bertujuan untuk menghomogenkan larutan dan untuk membuat larutan Ba(NO2)3 jenuh. Serbuk BaCO3 dan
larutan Ba(NO3)2 yang diperoleh diperlihatkan pada
Gambar 4.2. Larutan yang terbentuk tidak berwarna karena ion Ba2+ tidak bisa menyerap cahaya tampak.
Barium merupakan logam blok s karena hanya terdapat dua elektron pada kulit terluarnya, sedangkan warna senyawa dari suatu unsur berkaitan dengan adanya subkulit d yang terisi tidak penuh. (Vogel, 1990).
Reaksi yang terjadi pada proses pelarutan lantanum (III) oksida dan barium karbonat dalam larutan asam nitrat 1 M dapat ditulis sebagai berikut:
La2O3(s) + 6HNO3(aq) → 2La(NO3)3(aq) + 3H2O(l)
BaCO3(s) + 2HNO3(aq) → Ba(NO3)2(aq) + H2CO3(aq)
Selanjutnya, kobalt nitrat heksahidrat dibuat dengan cara melarutkan serbuk Co(NO3)2.6H2O
sebanyak 11,6400 gram ke dalam ± 15 mL aqua DM. Larutan yang diperoleh berwarna merah pekat. Proses pelarutan ini tidak memerlukan air yang banyak karena garam Co(NO3)2.6H2O bersifat higroskropik sehingga
kelarutan dalam airnya relatif tinggi (Windholtz, 1983).
Larutan La(NO3)3, Ba(NO3)2 dan
Co(NO3)2.6H2O yang telah disiapkan selanjutnya
dicampurkan. Kemudian pada larutan yang terbentuk ditambahkan larutan NaOH 1M sebanyak 150 ml dan diaduk dengan pengaduk magnetik selama 1 jam untuk memastikan pengendapan ion logam terjadi secara sempurna dan homogen (Berchmans, et.al. 2008). Larutan NaOH 1M kemudian ditambahkan ke dalam campuran larutan tersebut sampai didapatkan larutan pH 10-11 merujuk pada penelitian yang dilakukan oleh Junwu, et.al. (2007). Penambahan larutan NaOH ini bertujuan sebagai bahan pengendap campuran kation-kation logam oksida perovskit (Jadhav, et.al., 2006).
Larutan kemudian disaring dengan kertas
saring whatman 40 dengan corong buchner
menggunakan vacuum pump. Endapan selanjutnya dicuci dengan metanol hingga pH filtrat menjadi netral. Penambahan metanol bertujuan untuk menghilangkan ion Na+ dan garam-garam yang terlarut. Metanol yang
dibutuhkan 150-200 ml.
Endapan yang telah dicuci dikeringkan di dalam oven 100 ˚C selama 4 jam untuk menghilangkan kandungan air sehingga diperoleh endapan kering. Metanol digunakan sebagai bahan pencuci pada penelitian ini karena kelarutan larutan NaOH yang tinggi dalam metanol, disamping sifat metanol yang mudah menguap (t.d. 64,5 ˚C) sehingga endapan lebih cepat kering. Endapan kering selanjutnya digerus hingga halus menggunakan agate mortar sehingga didapatkan serbuk prekursor oksida perovskit.
Langkah selanjutnya setelah diperoleh serbuk prekursor oksida perovskit adalah dilakukan kalsinasi. Proses kalsinasi adalah pemanasan pada suhu tinggi yang berfungsi untuk menguraikan garam-garam nitrat menjadi oksidanya pada suhu yang sesuai (Idayanti, 2001). Suhu kalsinasi yang digunakan untuk membentuk Oksida Perovskit diperoleh dari data DTA/TGA.
3.2 Penentuan suhu kalsinasi prekursor oksida perovskit
Analisis DTA-TGA pada penelitian ini dilakukan dalam atmosfir udara dengan laju
kenaikan 10°C.men-1 dengan rentang suhu
pengukuran 0 sampai 1000°C. Hasil analisis DTA-TGA dari cuplikan prekursor LaCoO3 ditunjukkan
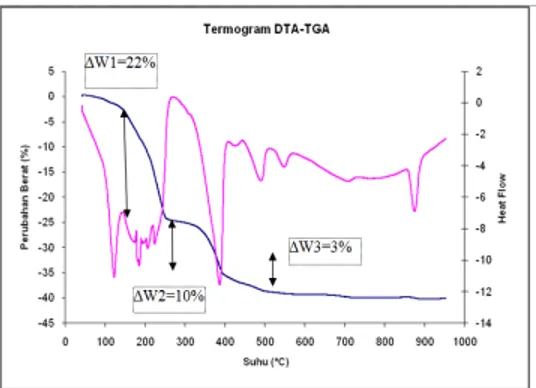
pada Gambar 1.
Termogram hasil analisis DTA-TGA
terhadap prekursor oksida perovskit disajikan pada Gambar 4.6. Pada termogram tersebut
memperlihatkan adanya lembah-lembah
endotermis pada suhu disekitar 100 ˚C, 200 °C, 500 °C, 570 °C, 730 ˚C dan 875 °C. Lembah endotermis pada 100 ˚C merupakan ciri khas dari penguapan air yang yang terikat secara fisis. Proses ini dikaitkan dengan proses hilangnya air selama proses dehidrasi dan terlepasnya air kristal yang terjebak di dalam sampel (Berchmans et al., 2008). Air fisis merupakan suatu kenampakan fisik dimana air berfungsi sebagai pelarut. Air ini memiliki titik didih pada 100˚C sehingga dapat menguap pada suhu di atas titik didihnya. Sedangkan air kristal berada di dalam senyawa kristalin dalam proporsi tertentu. Molekul air ini dapat mengisi kedudukan kisi kristal atau membentuk ikatan dengan anion atau kation yang ada (Daintith, 2004). Hal ini didukung dengan kurva TGA yang memperlihatkan pengurangan berat cuplikan sebanyak 22% (∆W1).
Prosiding Kimia FMIPA
Selanjutnya, lembah endotermis pada suhu di sekitar 200 ˚C yang diikuti dengan penurunan berat (∆W2) sebesar 10% merupakan hasil dari pelepasan air kristal dan air yang teroklusi pada padatan. Reaksi kimia yang terjadi dituliskan sebagai berikut:
La(OH)3.xH2O(s) + Co(OH)3.xH2O(s) + Ba(OH)2.
xH2O(s) → La(OH)3(s) + Co(OH)3(s) + Ba(OH)2(s) +
xH2O(g)
Banyaknya lembah endotermis yang terdeteksi pada difraktogram dalam daerah 200 ˚C ini menunjukkan bahwa terdapat air kristal dan air teroklusi dengan kuat ikat yang beragam. Hal ini menunjukkan heterogenitas kristal serta morfologinya. Heterogenitas kristal merupakan konsekuensi dari terdapatnya bebagai macam ion logam pada prekursor. Kristal-kristal tersebut tentunya juga memiliki morfologi permukaan maupun pori yang berbeda pula. Analisis kristalografi (menggunakan difraksi sinar-X), morfologi dan mikroskopi elektron kemungkinan besar dapat menunjukkan keragaman kristal dan morfologi dari prekursor tersebut.
Kemudian antara suhu 400 ˚C sampai 600 ˚C berat terus berkurang sebesar 3 %. Hal tersebut mengindikasikan adanya proses dekomposisi molekul-molekul nitrat dan pelepasan gas-gas yang lain (Berchmans et al., 2008). Pada suhu diatas 730˚C sampai 800 ˚C dari kurva TGA tidak terjadi lagi pengurangan berat, dapat dianggap reaksi kimia diantara prekursor pembentuk perovskit terjadi pada suhu sekitar suhu tersebut. Hal ini sesuai dengan pernyataan Berchman, et.al, (2008) dimana pada suhu di atas 600 ˚C berlangsung penyusunan ulang struktur kristal dari oksida logam menjadi oksida perovskit serta modifikasi tekstur dan strukturnya.
Reaksi yang terjadi mulai dari pelepasan air kristal prekursor hingga terbentuk oksida perovskit La1-xBaxCoO3-δ kemungkinan adalah sebagai berikut:
La(OH)3(s) + Co(OH)3(s) + Ba(OH)2(s) → La1-xBaxCoO3-δ (s) + xH2O(g)
Puncak endotermik di sekitar suhu 850˚C diperkirakan sebagai akibat dari pembentukan oksida perovskit yang bersifat endothermik sehingga menghasilkan kurva DTA endothermik. Perubahan tersebut terjadi tanpa diikuti perubahan berat. Ini berarti bahwa perubahan yang terjadi hanya merupakan penyusunan ulang struktur kristal dari oksida logam biasa menjadi oksida perovskit.
Berdasarkan ulasan tersebut di atas, maka proses kalsinasi oksida perovskit La1-xBaxCoO3-δ pada
penelitian ini dilakukan pada suhu 850°C dan dilakukan dua tahap. Pada tahap pertama, prekursor dalam bentuk serbuk dikalsinasi selama 2 jam. Setelah itu, prekursor dikeluarkan dari furnace dan digerus sebelum dilanjutkan dengan tahap kedua. Pada tahap kedua, serbuk hasil kalsinasi tahap pertama yang telah digerus ulang dikalsinasi dengan suhu yang sama selama 2 jam sehingga didapatkan waktu kalsinasi total selama 4 jam. Pengerusan di tengah-tengah waktu kalsinasi dilakukan untuk mendapatkan prekursor yang lebih homogen dan membantu mempercepat proses pengubahan prekursor menjadi oksida perovskit (Royer et.al.,2005).
3.3 Karakterisasi oksida perovskit 3.3.1 Karakteristik fasa oksida perovskit
Karakterisasasi dilakukan terhadap oksida perovskit yang dihasilkan. Karakterisasi yang dilakukan meliputi penentuan fasa menggunakan difraksi sinar-X dan analisis komposisi unsur-unsur pembentuk oksida perovskit menggunakan fluoresensi sinar-X (XRF).
4.2.1 Penentuan Fasa Oksida Perovskit Menggunakan XRD
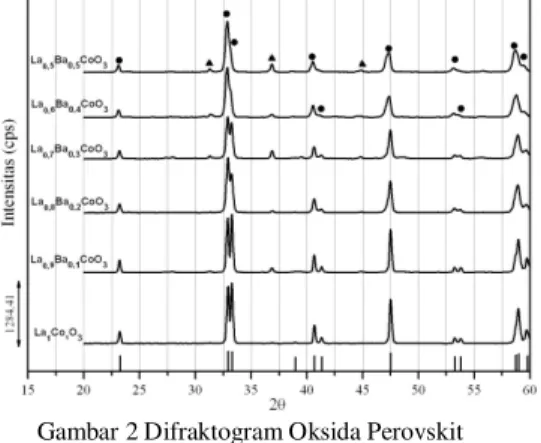
Analisis difraksi sinar X dilakukan dengan panjang gelombang (λ) radiasi CuKα sebesar 1,541 pada rentang sudut 2θ antara 20-60˚. Difraktogram oksida perovskit La1-xBaxCoO3-δ diperlihatkan pada Gambar 2.
Gambar 2 memperlihatkan bahwa oksida perovskit La1-xBaxCoO3-δ (x= 0,0-0,5 dengan interval
0,1) telah menunjukkan keberadaan fasa oksida perovskit yang muncul di daerah puncak khas perovskit, yaitu di sekitar sudut 2θ = 23˚, 32˚, 33˚, 41˚, 47˚, 53˚, 58˚ dan 59˚. Keberadaan puncak khas fasa perovskit tersebut sesuai dengan puncak difraksi oksida perovskit induk LaCoO3 dengan data JCPDS (Joint
Committee on Powder Diffraction Standar) tahun 2001 nomor 25-1060. Selain puncak-puncak khas oksida perovskit, ditemukan pula puncak-puncak difraksi fasa non perovskit . Fasa non perovskit yang teridentifikasi tersebut adalah Co3O4.
Keberadaan fasa non perovsit Co3O4 dapat
disebabkan kemungkinan besar masih ada ion Co3+ yang
belum masuk ke kisi oksida perovskit sehingga mengendap menjadi Co3O4. Selain itu keberadaan
puncak Co3O4 selalu terjadi pada katalis oksida perovskit
berbasis Co, pernyataan ini diperkuat oleh Zhang et.al. (2006). Munculnya fasa non-perovskit Co3O4 dapat
pula disebabkan kurangnya homogenitas cuplikan. Peningkatan homogenitas cuplikan dapat dilakukan dengan teknik penggerusan berulang sampai homogen. Teknik penggerusan yang dilakukan setiap selesai kalsinasi memudahkan ion-ion bermigrasi antara oksida-oksida murni melalui kisi kristal yang saling berkontak sehingga membentuk struktur oksida perovskit seperti penelitian yang dilakukan oleh Royer et.al.,(2005).
Gambar 2 Difraktogram Oksida Perovskit La1-xBaxCoO3-δ (●: perovskit dan ▲: Co3O4)
Difraktogram oksida perovskit La1-xBaxCoO3-δ
pada Gambar 2 menunjukkan puncak-puncak yang tajam dengan intensitas yang berbeda. Dari Gambar 4.8 tersebut terlihatbahwa intensitas tertinggi untuk oksida perovskit La1-xBaxCoO3-δ diperoleh pada komposisi x =
0,0 yaitu oksida perovskit tanpa agen pensubstitusi, LaCoO3-δ. Selanjutnya, intensitas oksida perovskit
Prosiding Kimia FMIPA
La0,9Ba0,1CoO3-δ >La0,8Ba0,2CoO3-δ > La0,7Ba0,3CoO3-δ >
La0,6Ba0,4CoO3-δ > La0,5Ba0,5CoO3-δ.
Berdasarkan difraktogram tersebut, nampak bahwa perubahan intensitas perovskit dipengaruhi oleh banyaknya subtituen x (Ba2+) (x = 0,1 – 0,5), dimana
semakin banyak jumlah ion Ba2+, intensitas oksida
perovskit akan semakin rendah. Pernyataan ini didukung oleh penelitian yang telah dikerjakan oleh Khalil, (2002). Ia melaporkan bahwa intensitas oksida perovskit La
1-xBaxCoO3-δ semakin menurun seiring dengan
bertambahnya jumlah substituen Ba2+ terhadap ion La3+.
Perbedaan intensitas oksida perovskit ini diperkirakan terjadi karena jumlah bidang pemantul sinar-X masing-masing cuplikan oksida perovskit berbeda. Semakin besar jumlah bidang yang memantulkan sinar maka semakin besar pula intensitas dari sinar-X yang dipantulkan. Suatu material dengan kristalinitas yang tinggi akan memiliki jumlah bidang pemantul sinar-X yang lebih tinggi daripada bahan yang sama dengan tingkat kekristalan yang lebih rendah. Dengan sifat seperti ini, maka analisis menggunakan sinar-X dapat digunakan untuk menentukan tingkat kekristalan oksida perovskit. Dari Gambar 2 memperlihatkan bahwa oksida perovskit yang diperoleh dengan kristalinitas paling tinggi adalah LaCoO3-δ dan
kristalinitas paling rendah adalah La0,5Ba0,5CoO3-δ.
Fenomena ini menunjukkan bahwa penambahan substituten Ba2+ mengakibatkan gangguan pada
struktur kristal asal LaCoO3. Walau demikian,
gangguan tersebut tidak sampai mengubah struktur LaCoO3 hingga 50% La3+ disubstitusi oleh Ba2+.
Disamping itu, dapat diamati pula
kecenderungan pergeseran kecil sudut puncak difraksi oksida perovskit La1-xBaxCoO3-δ. Nilai d dan sudut 2θ
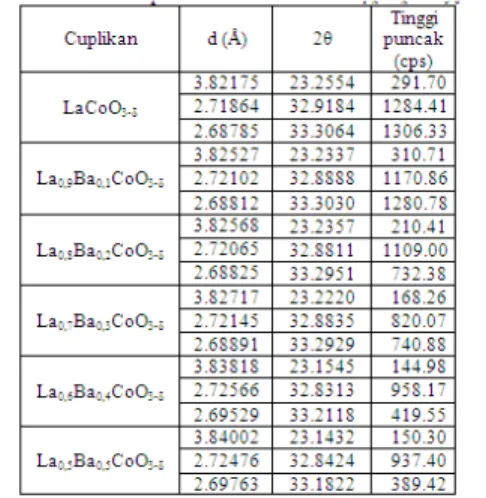
pada puncak karakteristik perovskit dengan tiga intensitas tertinggi yang dimiliki masing-masing oksida La1-xBaxCoO3-δ (x=0,1-0,5) ditunjukkan pada Tabel 1.
Tabel tersebut memperlihatkan bahwa semakin meningkatnya jumlah substituen x (Ba2+), maka puncak
difraksi bergeser ke sudut 2θ yang lebih kecil dan jarak antar bidang kisi kristal (d) oksida perovskit La 1-xBaxCoO3-δ semakin besar. Hal ini dapat terjadi karena
ukuran ion Ba2+ (1,42 Å ) lebih besar dibandingkan
dengan ukuran ion La3+ (1,16 Å), sehingga apabila
kandungan Ba2+ yang mensubstitusi ion La3+ pada kisi
oksida perovskit semakin banyak, maka jarak antar kisi kristal (d) juga menjadi semakin besar. Pergeseran posisi puncak difraksi tersebut dapat diindikasikan sebagai telah masuknya ion Ba2+ ke dalam struktur kisi oksida
perovskit LaCoO3 (Liu, et.al., 2002).
Tabel 4.1 Nilai d pada Oksida Perovskit La1-xBaxCoO3-δ
4.2.2 Penentuan Komposisi Oksida Perovskit Menggunakan XRF
Karakterisasi oksida perovskit La1-xBaxCoO3-δ
dengan XRF (X-Ray Fluorescense) bertujuan untuk mengetahui rasio komposisi kimia oksida perovskit yang terbentuk. Hasil komposisi oksida perovskit La 1-xBaxCoO3-δ dengan metode XRF disajikan dalam Tabel
2 Perhitungan matematis cuplikan oksida perovskit menjadi rasio mol dapat dilihat pada Lampiran, dan hasilnya disajikan dalam Tabel 3.
Tabel 2 Komposisi oksida perovskit La1-xBaxCoO3-δ dengan metode XRF
Tabel 3 Perbandingan mol Komposisi Oksida Perovskit La1-xBaxCoO3-δ
Dari data Tabel 3 terlihat bahwa terdapat perbedaan komposisi kimia cuplikan yang disintesis dengan yang dikehendaki. Hasil menunjukkan bahwa pada semua oksida perovskit La1-xBaxCoO3-δ dengan x=
0,1-0,5, komposisi lantanum bernilai relatif lebih besar dari yang dikehendaki, sedangkan komposisi barium lebih kecil. Komposisi yang paling mendekati komposisi yang sebenarnya yakni pada La1Co1O3
dimana diperoleh La1,03Co1O3.
Keditaksesuaian komposisi logam antara cuplikan target dan cuplikan yang terealisasi terjadi dimungkinkan karena masih ada ion Ba2+ yang belum
mengendap dengan sempurna pada saat proses pengendapan dengan larutan NaOH. Pengendapan yang kurang sempurna dapat disebabkan karena ion Ba2+
mempunyai jarak rentang Ksp yang cukup besar dibandingkan dengan ion La3+ dan Co2+ dalam larutan
Prosiding Kimia FMIPA
hidroksida. Harga Ksp dari Ba(OH)2, Ksp Co(OH)2, dan
La(OH)2 berturut-turut adalah sebagai berikut 3x10-4,
1,3x10-15 dan 2x10-21. Besarnya Ksp Ba(OH) 2 adalah
1017 kali terhadap Ksp La(OH)
3 dan 1011 lebih besar
terhadap Ksp Co(OH)2. Semakin besar harga Ksp, maka
ion mempunyai kelarutan yang besar dalam larutan sehingga semakin sulit untuk mengendap. Oleh karena itu, ion La3+ dan Co2+ akan lebih mudah dan lebih dulu
mengendap daripada ion Ba2+, sehingga didapatkan
endapan Ba2+ yang sedikit Sebagai akibatnya komposisi
kimia logam Ba yang teramati dari analisa dengan XRF menjadi berkurang.
Pada uji XRF oksida perovskit La1-xBaxCoO3-δ,
unsur yang terdeteksi dengan energi sinar-X karakteristik pada unsur komponennya disajikan dalam Tabel 4.
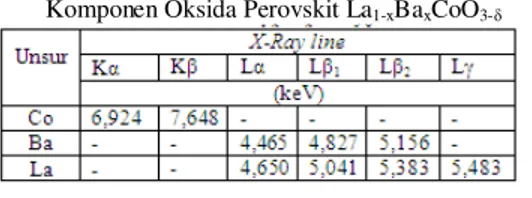
Tabel 4.4 Energi Sinar-X Karakteristik Unsur Komponen Oksida Perovskit La1-xBaxCoO3-δ
Energi sinar-X karakteristik setiap unsur merupakan sinar-X yang dpancarkan oleh atom karena perbedaan energi dari dua kulit akibat eksitasi elektron. Setiap unsur akan menunjukkan peak yang karakteristik yang merupakan landasan dari uji kualitatif untuk unsur-unsur yang ada dalam cuplikan oksida perovskit. Pada uji kualitatif setiap unsur biasanya akan muncul dua peak untuk meyakinkan keberadaan unsur itu dalam cuplikan (Sumantry, 2007).
Keberadaan unsur kobalt dalam cuplikan oksida perovskit dengan Kα = 6,924 keV dan Kβ = 7,648 keV merupakan energi karakteristik sinar-X untuk unsur kobalt, begitu pula dengan barium yang menampakkan energi karakteristik sinar-X pada Lα, Lβ1, Lβ2 dan
lantanum dengan energi sinar-X karakteristik pada Lα, Lβ1, Lβ2 dan Lγ.
Sinar-X karakteristik kobalt Kα artinya sinar-X yang dihasilkan dari transisi elektron kulit L ke kulit K dan Kβ merupakan sinar-X yang dihasilkan dari transisi elektron dari kulit M ke kulit K atom kobalt, sedangkan sinar-X karakteristik barium dan lantanum Lα artinya sinar-X yang dihasilkan dari transisi elektron kulit M ke kulit L dan Lβ merupakan sinar-X yang dihasilkan dari transisi elektron dari kulit N ke kulit L atom barium dan lantanum.
Grafik antara intensitas (cps) dengan energi sinar-X karakteristik (keV) unsur-unsur komponen oksida perovskit La0,7Ba0,3CoO3 ditampilkan pada
Gambar 4.9.
Gambar 3 Grafik intensitas dan energi sinar-X karakteristik unsur-unsur komponen oksida perovskit La0,7Ba0,3CoO3
Dari Gambar spektrum XRF Gambar 3 terlihat peak unsur Co terpisah dan terlihat jelas, sedangkan unsur La dan Ba terjadi overlapping. Hal ini disebabkan energi sinar-X karakteristik yang dihasilkan unsur Co mempunyai jarak rentang yang besar terhadap unsur La dan Ba, sedangkan energi karakteristik unsur La dan Ba mempunyai selisih energi yang kecil. Berlebihnya komposisi lantanum dan berkurangnya komposisi barium juga dapat dimungkinkan terjadi karena perbedaan energi yang sangat kecil diantara keduanya, yaitu dengan perbedaan energi 0,185 keV sehingga terjadi tumpang tindih spektrum seperti yang terlihat pada Gambar 4.9. Hal ini memerlukan kalibrasi untuk peningkatan sensitivitas alat untuk perbedaan energi yang sangat kecil diantara dua unsur atau lebih dengan energi sinar-X karakteristik yang berdekatan. Hal ini juga diperkuat oleh hasil XRD untuk oksida perovskit La1-xBaxCoO3, bahwa
tidak ditemukan fasa kristal yang menunjukkan kelebihan lantanum, seperti fasa La2O3, La(OH)3 ataupun
La2BaOx.
4. Kesimpulan
Oksida perovskit berbasis LaCoO3 yang
disubstitusi Ba(II) (La1-xBaxCoO3-δ, dimana x= 0,0 ; 0,1;
0,2; 0,3; 0,4 dan 0,5) dapat disintesis dengan metode kopresipitasi menggunakan larutan natrium hidroksida sebagai agen pengendap dengan suhu kalsinasi sebesar 850 oC (hasil dari analisis DTA-TGA).
Hasil analisis fasa kristal oksida perovskit menunjukkan bahwa substitusi Ba(II) terhadap La(III) hingga 50% tidak menyebabkan perubahan yang berarti bagi struktur kisi LaCoO3. Akan tetapi, semakin
banyak substitusi Ba(II) tersebut menyebabkan berkurangnya kristalinitas oksida perovskit yang dihasilkan. Oksida perovskit yang diperoleh dengan kristalinitas paling tinggi adalah LaCoO3-δ dan
kristalinitas paling rendah adalah La0,5Ba0,5CoO3-δ.
Pergeseran posisipuncak sebagai akibat bertambahnya jarak antar kisi (d) pada oksida perovskit La1-xBaxCoO3
dapat mengindikasikan telah masuknya ion Ba2+ ke
dalam struktur kisi oksida perovskit LaCoO3. Komposisi
oksida perovskit berdasarkan hasil analisis XRF, oksida perovskit yang paling mendekati komposisi sebenarnya adalah LaCoO3-δ dimana diperoleh perbandingan mol La
: Co sebesar 1,03 : 1.
Ucapan terimakasih
1. Hamzah Fansuri, Ph.D dan atas dukungan, bimbingan dan motivasi yang diberikan 2. Ibu dan Ayahanda atas dukungannnya dan
doanya
3. Semua pihak yang mendukung yang tidak dapat saya sebutkan satu persatu hingga terselesainya penelitian ini
DAFTAR PUSTAKA
Amini, S., 1997. Spektrometri Emisi : Pelatihan dan
Keahlian Analisis Kimia Bahan Nuklirsecara Spektrometri. Serpong :
Prosiding Kimia FMIPA
Azad, A.K., Eriksson , S-G. dan Irvine, J.T.S., 2009.
“Structural, magnetic and
Electrochemical Characterization of
La0,83A0,17Fe0,5Cr0,5O3-δ (A = Ba, Ca)
Perovskites”. Materials Research
Bulletin 44, 1451–1457
Berchmans J. L., Sindhu R., Angappan S., Augustin C.O., 2008. “Effect of Antimony Substituon on Structural and Electrical Properties of LaFeO3“. Journal of material prosessing
technology 207, 301-306
Bramanto, L., 2003. “Karakteristik dan Aktivitas
Aerogel pada Proses Oksidasi Katalitik Metana Menjadi Metanol”. Tesis S2-UI. Universitas Indonesia
Brouwer, P., 2006. Theory of XRF Getting
Acquainted with the Principles. Almelo, Netherland : PANanalytical B
Chen, C. M., 2004. Ceramic Membrane Reactor
Systems for Converting Natural Gas to Hydrogen (ITM Syngas). Air Products and Chemicals, Inc.
Cong, L., He, T., Ji, Y., Guan, P., Huang, Y. dan Su, W., 2003. “Synthesis and Characterization of
IT-Electrolyte with Perovskite Structure
La0,8Sr0,2Ga0,85Mg0,15O3-δ by Glycine-Nitrate
Combustion Method”. Journal of Alloys and
Compounds 348, 325-331
Daintith, J., 2004. Kamus Lengkap Kimia. Jakarta : Erlangga
Dann, S.E., 2002. Reaction and Characterization of
Solids. The Royal Society of
Chemistry
Darminto, 2008. Pengantar Kristalografi dan Difraksi
Kristal. Lecture handout. Surabaya : Fisika
MIPA ITS
Goldwaser, M. R., Rivas, M. E., Lugo, M. L., Pietri, E., Perez- Zurita, J., Cubeiro, M. L.,
Griboval-Constant, A. dan Leclercq G., 2005.
“Combined Methane Reforming in
Presence of CO2 and O2 over LaFe1-xCoxO3
Mixed-oxide Perovskites as Catalysts
Precursors”. Catalysis today
106-113
Harvey, D., 2000. Modern Analytical Chemistry. New York : McGraw-Hills
Idayanti N, dan Dedi, 2001, “Pemanfaatan Limbah Hot
Strip Mill sebagai Bahan Baku Pembuatan Manet Permanen”, Prosiding Seminaar
Nasional X, Yogyakarta
Ismunandar, 2004. Padatan Oksida Logam: Struktur
Sintesis dan Sifat – Sifatnya. FMIPA-Kimia
ITB. Bandung
Janssens, K. Dan Grieken, V., 2004. Comprehensive
Analytical Chemistry XLII. Elsevier
Jadhav, A.D., Gaikwad, A.B., Samuel, V. dan Ravi, V., 2006, “A low temperature route to prepare LaFeO3 and LaCoO3”. Materials Letters 61,
2030–2032
Junwu, Z., Xiaojie, S., Yanping, W., Xin, W., Xujie Y., dan Lude, L., 2007. “Solution-Phase Synthesis and Characterization of Perovskite LaCoO3
Nanocrystals via A Co-Precipitation Route “.
Journal Of Rare Earths 25, 601-604
Khalil, M.S., 2002. “Synthesis, X-ray, Infrared Spectra and Electrical Conductivity of
La/Ba-CoO Systems”. Materials
Science and Engineering A352, 64-70
Levasseur, B. dan Kaliaguine, S., 2008. “Methanol Oxidation on LaBO3 (B = Co, Mn, Fe)
Perovskite-Type Catalysts Prepared by
Reactive Grinding”. Applied Catalysis A:
General 343, 29–38
Lima, S.M., Assaf, J.M., Pena M.A., dan Fierro, J.L.G., 2006. ”Structural Features of La1-xCexNiO3
Mixed Oxides and Performance for The Dry
Reforming of Methane”. Applied
Catalysis A: General 311, 94–104
Liu, Y., Zheng, H., Liu, J., Zhang, T., 2002.
“Preparation of High Surface Area
La1−xAxMnO3 (A = Ba,Sr or Ca) Ultra-fine
Particles Used for CH4 Oxidation”. Chemical
Engineering Journal 89, 213–221
Media Kita, 2010. Peluang Bahan Bakar Dari
Metanol. Alpen Steel-Renewable
Energy.URL:http://www.actionio.com/jimpint o/fbarticl.html
Merck Chemical Database, 2004. Lanthanum (III) Oxide
LAB. 112220
Merck Chemical Database, 2004. Cobalt (II) Nitrate
Hexahydrate GR for Analysis. 102536
Merck Chemical Database, 2004. Nitric Acid 65% GR
for Analysis ISO. 100456
Merck Chemical Database, 2004. Sodium Hydroxide
Pellets GR for Analysis ISO. 106498
Merck Chemical Database, 2004. Methanol GR for
Analysis ACS, ISO, Reag. Ph Eur. 106009
Merino, N. A., Barbero, B. P., Grange, P. dan Cadus, L. E., 2005. “La1-xCaxCoO3 Perovskite-type
Oxides: Preparation, Characterisation,
Stability, and Catalytic Potentiality for The Total Oxidation of Propane”. Journal of
Catalysis 231, 232-244
Muhamed, B.A., 2005. “Synthesis, Characterization
and Activity of Al-MCM-41 Catalyst for Hydroxyalkylation of Epoxides”. Tesis,
Master of Science (Chemitry). Faculty of Science Universiti Teknologi Malaysia Mundschau, M.V., Burk C.G., dan Gribble Jr., D.A.,
2008. ”Diesel Fuel Reforming Using Catalytic Membrane Reactors”. Catalysis Today 136, 190–205
Murwani, I.K. dan Pratapa, S., 2006. Pengenalan
Analisis Material Anorganik dengan Difraksi Sinar-X. Retooling Program Batch
IV. Surabaya:, Jurusan Kimia Fakultas MIPA ITS.
Noble, R. D. and L.Falconer, J., 1995. “Direct Catalytic
Conversion of CH4 to CH3OH in A Non-isothermal Membrane Reactor”. Colorado :
Department of Chemical
Engineering-University of Colorado
Patnaik, P., 2004. Dean's Analytical Chemistry
Handbook. 2nd edition. New York :
McGraw-Hill
Pham, Q. N., Vijayakumar, M., Bohnke, C. dan Bohnke,
O., 2005. “Synthesis and Electrical
Characterization of Li0,30Ca0,35TaO3 Perovskite
Synthesized via a polymerized Complex Route”. Journal of Solid State Chemistry 178, 1915-1924
Prosiding Kimia FMIPA
Prasetyo, T., 2003. “Karakteristik Pembakaran
Metanol”. Makalah Pengantar
Falsafah Sains Program Pasca
Sarjana/S3. Bogor : Institut Pertanian Bogor Predoana, L., Malic, B., Kosec, M., Carata, M.,
Caldararu, M. dan Zaharescu, M., 2007.
“Characterization of LaCoO3
Powders Obtained by Water-based Sol–gel
Method with Citric Acid”. Journal of
the European Ceramic Society 27,
4407–4411
Ramachandran, V.S., Paroli, R.M., Beaudoin, J.J.dan Delgado, A.H., 2002. Handbook of Thermal
Analysis of Construction Materials. New York : William Andrew Publishing
Rousseau, S., Loridant, S., Delichere, P., Boreave, A. dan Deolume, J.P., 2008. “La(1-x)SrxCo(1-y)FeO3
Preovskite Prepared by Sol-gel Methode,
Applied Catalyst B: Environmental 88,
438-447
Royer, S., Alamdari, H., Duprez, D. dan, Kaliaguine, S., 2005. “Oxygen Storage Capacity of La 1-xA'xBO3 Perovskites (with A'= Sr, Ce;
B = Co, Mn)—Relation with Catalytic Activity in The CH4 Oxidation Reaction”.
Applied Catalysis B: Environmental 58, 273–288
Saito,T., 2004, Buku Teks Kimia Anorganik Online. Tokyo : Iwanami Shoten, Publishers
Sibilia, J.P., 1996. Materials Characterization and
Chemical Analysis. 2nd edition, New York :
Wiley-VCH
Song, K., Cui, H.X., Kim, S.D. dan Kang, S., 1999.
“Catalytic Combustion of CH4 And
CO On La1-xMxMnO3 Perovskites”.
Catalysis Today 47, 155-160
Sunarso, J., Baumann, S., Serra, J.M., Meulenberg, W.A., Liu, S., dan Dimiz da Costa, J.C.,
2008. “Mixed Ionic-Electronic
Conducting (MIEC) Ceramic Based
Membranes for Oxygen Separation”.
Journal of Membrane Science 320, 13-41
Sumantry, T., 2007, “Aplikasi Xrf untuk Identifikasi
Lempung pada Kegiatan Penyimpanan Lestari Limbah Radioaktif”,
Prosiding Seminar Nasional Teknologi
Pengelolaan Limbah VII, Pusat
Teknologi Limbah Radioaktif-BATAN Taguchi, H., Yamasaki, S., Itadani, A., Yosinaga M., dan
Hirota, K., 2008. “CO Oxidation on
Perovskite-Type LaCoO3 Synthesized
Using Ethylene Glycol and Citric Acid”.
Catalysis Communications 9, 1913–1915
Tanaka, H. dan Misono, M., 2001. “Advances in
Designing Perovskite Catalysts”.
Current Opinion in Solid State and Materials Science 5, 381–387
Valderrama, G., Kiennemann, A. dan Goldwasser M.R., 2008. “Dry Reforming of CH4 Over Solid
Solutions of LaNi1-XCoxO3” . Catalysis Today
133–135, 142–148
Vogel, 1990, Buku Teks Analisis Anorganik Kualitatif
Makro dan Semimikro. Jakarta: PT.
Kalman Media Pusaka
West, A.R., 1984. Solid State Chemistry and its
Application. Singapore: John Wiley &
Sons, 103-104
Windholz, M., Budhavari, S., Blumetti R.F., and Otterbein, E.S., 1983. The Merck Index an
Encyclopedia of Chemicals, Drugs, and Biologicals, 10th edition. New York : Merck &
Co., Inc.
Witono, J.A., 2008. Teknologi Gas to Liquid, Majari Magazine : UNTIRTA Chemical Engineering Day
Yang, W., Wang, H., Zhu, X dan Lin, L., 2005. “Development and Application of Oxygen Permeable Membrane in Selective Oxidation of Light Alkanes”. Topics in Catalysis 3, 155-167
Zhang, R., Villanueva, A., Alamdari, H. and Kaliaguine, S., 2006. Reduction of NO by CO over Nanoscale LaCo1-xCuxO3 and LaMn1-xCuxO3
Perovskites. Journal of Molecular Catalysis 258, 22-34