BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
Uraian tumbuhan meliputi morfologi tumbuhan, nama asing, sistematika,
manfaat dan kandungan kimia.
2.1.1 Morfologi Tumbuhan
Tumbuhan Leea aequata L. merupakan tumbuhan perdu, tahunan,
tingginya 1,5–3 m. Batang tumbuhan ini berkayu, bercabang, bentuk bulat , masih
muda berambut dan hijau. Daun tumbuhan majemuk, anak daun lanset, bertangkai
pendek, tepi daun bergerigi, ujung daun runcing, pangkal membulat, panjangnya
6-25 cm, lebarnya 3-8 cm, berambut dan berwarna hijau. Bunga tumbuhan
majemuk, bentuk malai, kelopak bulat telur, panjang 2-5 cm, kuning keputih-
putihan. Buahnya berbentuk bulat, diameter ± 12 mm, masih muda hijau dan
setelah tua ungu kehitaman dengan biji kecil, bentuk segitiga, dan berwarna putih
kekuningan. Tumbuhan ini termasuk tumbuhan berakar tunggal dengan warna
coklat muda (Depkes RI, 2001).
2.1.2 Nama Asing
Leea aequata L. memiliki nama lain seperti : ginggiyang (Sunda), girang
(Jawa Tengah), jirang (Madura), kayu ajer perempuan (Melayu), mali-mali
2.1.3 Sistematika Tumbuhan
Klasifikasi tumbuhan titanus adalah sebagai berikut (Depkes RI, 2001: LIPI,
2015) :
Kingdom : Plantae
Divisi : Spermatophyta
Kelas : Dicotyledonae
Bangsa : Rhamnales
Suku : Leeaceae
Marga : Leea
Jenis : Leea aequata L.
2.1.4 Manfaat Tumbuhan
Daun Leea aequata L. berkhasiat sebagai obat luka baru dan pegal linu.
Untuk obat luka baru dipakai ±30 gram daun segar Leea aequata L., dicuci,
ditumbuk sampai lumat, ditempelkan pada luka dan dibalut dengan kain bersih
(Depkes RI, 2001).
2.1.5 Kandungan Kimia
Biji Leea aequata L. mengandung saponin, flavonoid dan polifenol
(Depkes RI, 2001). Malinda (2015) melporkan bahwa daun Leea aequata L.
mengandung alkaloid, flavonoid, glikosida, saponin, tanin dan
steroid/triterpenoid.
2.2 Simplisia
Simplisia adalah bahan alam yang digunakan sebagai obat yang belum
telah dikeringkan. Simplisia terbagi atas simplisia nabati, simplisia hewani dan
simplisia mineral. Simplisia nabati adalah simplisia yang berupa tanaman utuh,
bagian tanaman dan eksudat tanaman (Depkes RI, 1979).
2.3 Ekstraksi
Ekstraksi merupakan istilah umum yang digunakan dalam bidang farmasi,
yang berkaitan dengan pemisahan bahan aktif yang berkhasiat pada tumbuhan
atau jaringan hewan dari komponen yang tidak aktif dengan menggunakan pelarut
selektif menggunakan prosedur standard ekstraksi (Handa, dkk., 2008).
Ekstrak adalah sediaan pekat yang diperoleh dengan mengekstraksi zat
aktif dari simplisia nabati atau simplisia hewani menggunakan pelarut yang
sesuai, kemudian semua atau hampir semua pelarut diuapkan dan massa atau
serbuk yang tersisa diperlakukan sedemikian hingga memenuhi baku yang telah
ditetapkan (Depkes RI, 1995).
Ekstraksi dengan menggunakan pelarut dapat dilakukan dengan berbagai
cara, yaitu :
a) Cara dingin
1. Maserasi
Maserasi adalah cara penarikan simplisia dengan merendam
simplisia tersebut dalam cairan penyari dengan beberapa kali
pengocokkan atau pengadukkan pada temperatur kamar sedangkan
remaserasi merupakan pengulangan penambahan pelarut setelah
dilakukan penyaringan maserat pertama dan seterusnya (Depkes RI,
2. Perkolasi
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai
terjadi penyarian sempurna yang umumnya dilakukan pada temperatur
kamar (Depkes RI, 2000).
b) Cara panas
1. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik
didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif
konstan dengan adanya pendingin balik (Depkes RI, 2000).
2. Sokletasi
Sokletasi adalah ekstraksi kontinu menggunakan alat soklet,
dimana pelarut akan terdestilasi dari labu menuju pendingin, kemudian
jatuh membasahi dan merendam sampel dalam tabung soklet, kemudian
setelah pelarut mencapai tinggi tertentu maka akan turun ke labu destilasi
seterkah melewati pipa sifon, demikian berulang-ulang (Depkes RI,
2000).
3. Digesti
Digesti adalah maserasi dengan pengadukan kontinu pada
temperatur yang lebih tinggi dari temperatur ruangan yaitu secara umum
secara umum dilakukan pada temperature 40-50o C (Depkes RI, 2000).
4. Infudasi
Infus adalah sediaan cair yang dibuat dengan menyari simplisia
5. Dekoktasi
Dekok adalah sediaan cair yang dibuat dengan menyari simplisia
nabati dengan air pada waktu yang lebih lama ±30 menit dengan
temperature sampai titik didih air (Depkes RI, 2000).
2.4 Metode Organ Terisolasi
Organ terisolasi adalah suatu metode percobaan in vitro.Pada prinsipnya
adalah menggunakan organ yang terendam dalam larutan fisiologis yang sesuai,
temperatur diatur atau dikondisikan pada kondisi yang sama dari mana organ
tersebut berasal serta pengaturan aliran oksigen. Percobaan organ terisolasi ini
menggunakan alat organ bath (Perry, 1970).
Metode organ terisolasi merupakan metode klasik dalam percobaan
farmakologi yang dapat digunakan untuk menganalisa hubungan dosis-respon
suatu senyawa obat. Hasil penelitian Anas, dkk., (2010) mengatakan bahwa
dengan metode ini, konsentrasi agonis dan antogonis reseptor pada tingkat
jaringan dapat diketahui secara pasti. Metode ini mempunyai kemampuan dengan
intensitas maksimum. Hal ini tidak sepenuhnya dapat dilakukan ketika
menggunakan organisme utuh (pengujian secara in vivo). Selain itu, metode ini
juga dapat mengukur konsentrasi agonis terkecil yang dapat menginduksi respon
biologis.
Syamsudin dan Darmono (2011) melaporkan bahwa untuk mendapatkan
hasil percobaan yang akurat, maka diperlukan persiapan yang baik dan seluruh
percobaan harus betul-betul terkontrol. Hewan percobaan yang digunakan
yang diambil segera dimasukkan kedalam cairan fisiologis dan dikontrol
oksigenasinya dan dihubungkan ke tranducer dan diteruskan kealat pencatat
misalnya, kymograph atau maclab komputer.
Organ yang umum digunakan dengan metode organ terisolasi
mengunakan alat organ bath adalah uterus, usus halus, otot skeletal, vas deferens,
jantung dan lambung (Kitchen, 1984).
2.5 Otot Polos
Otot polos terdiri dari sel-sel otot polos. Sel otot ini bentuknya seperti
gelendong, dibagian tengah terbesar dan kedua ujungnya meruncing. Otot polos
memiliki serat yang arahnya searah dengan panjang sel disebut myofibril. Serat
myofibril terdiri dari miofilamen dan masing-masing miofilamen terdiri dari
protein otot yaitu aktin dan myosin. Otot polos merupakan otot tak sadar, karena
bekerja diluar kesadaran kita dan dipengaruhi oleh susunan saraf otonom (Irianto,
2004).
Otot polos bergerak secara lambat dan teratur dan tidak cepat lelah.
Walapun kita tidur, otot polos mampu bekerja. Otot polos terdapat pada dinding
alat-alat dalam tubuh, misalnya pada dinding usus, dinding pembuluh darah,
pembuluh limfe, dinding saluran cerna, trakea dan cabang tenggorokan, pada iris
dan muskularis sirliaris mata, otot polos dalam kulit, saluran kelamin dan saluran
2.6 Persyarafan Sistem Percernaan
Ada dua sistem pencernaan yang memegang peranan penting dalam
fungsi saluran pencernaan, yaitu sistem intrinsik yang terdiri atas sistem syaraf
enterik dan sistem syaraf ekstrinsik yang terdiri atas sistem syaraf otonom
parasimpatis dan simpatis.
2.6.1 Sistem Syaraf Intrinsik – Sistem Syaraf Enterik
Sistem syaraf ini terbentang didalam dinding saluran pencernaan mulai
dari esophagus sampai ke anus. Sistem syaraf enterik terbagi atas dua pleksus,
yaitu :
a) Pleksus mientrikus (pleksus Auerbach)
Pleksus ini terbentang diantara lapisan otot longitudinal dari lapisan otot
sirkuler. Fungsinya mengontrol fungsi motorik saluran pencernaan.
b) Pleksus submukosa atau pleksus Meissner
Pleksus ini terbentang didalam lapisan submukosa. Fungsinya terutama
untuk mengontrol kecepatan sekresi saluran pencernaan. Disamping itu,
pleksus submukosa sangat berperan dalam mengendalikan aktivitas otot
polos submukosa yang bila berkontraksi akan menimbulkan lipatan-lipatan
pada mukosa saluran pencernaan serta meningkatkan absorbsi dan aliran
darah disekitarnya (Herman, 2004).
2.6.2 Sistem Syaraf Ekstrinsik – Sistem Syaraf Otonom Sistem syaraf ekstrinsik terbagi menjadi dua, yaitu :
a) Sistem syaraf parasimpatis
Neuron pascaganglion (postganglion neuron) sistem parasimpatis terletak
pleksus submukosa. Ujung serat syaraf parasimpatis menyekresikan
asetilkolin sebagai neurotransmitternya. Stimulasi parasimpatis pada
umumnya menyebabkan peningkatan aktivitas sistem syaraf enterik yang
selanjutnya meningkatkan aktivitas saluran pencernaan.
b) Sistem syaraf simpatis
Ujung serat syaraf simpatis menyekresikan neurotransmitter norepinefrin.
Sistem syaraf ini merangsang sistem pencernaan melalui dua cara, yaitu:
1. Secara langsung pada otot polos saluran pencernaan
2. Secara tidak langsung, yaitu melalui neuron sistem syaraf enterik.
2.7 Usus Halus
Usus halus adalah tempat berlangsungnya sebagian besar pencernaan dan
penyerapan. Usus ini berada dalam keadaan bergelung didalam rongga abdomen
dan terentang dari lambung sampai usus besar. Usus halus dibagi menjadi tiga
segmen, yaitu duodenum, jejunum dan ileum (Sherwood, 2001).
2.7.1 Histologi Usus Halus
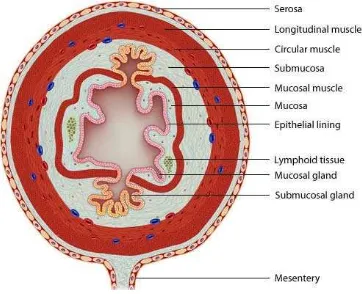
Herman (2004) membagi lapisan dinding usus halus menjadi empat
lapisan (Gambar 2.1), yaitu :
a) Lapisan serosa
Lapisan serosa adalah lapisan terluar dari dinding saluran pencernaan.
Lapisan ini berupa suatu membran yang terdiri atas jaringan penyambung
dan sel-sel epitel. Pada lapisan ini terdapat pembuluh darah dan syaraf
yang berukuran lebih besar yang berjalan diantara jaringan penyambung
serosa yang terletak dibawah diafragma (sekat rongga badan) ikut
membentuk dan merupakan bagian dari peritoneum secara keseluruhan
dan disebut peritoneum viseral.
b) Lapisan muskularis
Lapisan muskularis di dinding saluran pencernaan selain dari telah yang
disebutkan diatas adalah berupa otot polos yang terdiri atas dua lapis.
Lapisan sebelah dalam adalah lapisan sirkuler yang bila berkontraksi
menyebabkan pengecilan diameter lumen saluran pencernaan. Lapisan
sebelah luas adalah lapisan longitudinal yang bila berkontraksi
menyebabkan pemendekan saluran pencernaan.
c) Lapisan submukosa
Lapisan submukosa terdiri atas jaringan penyambung areola yang
mengikatkan lapisan mukosa kelapisan muskularis. Lapisan ini sangat
kaya dengan pembuluh darah dan mengandung jaringan syaraf yang
disebut pleksus submukosa atau disebut juga pleksus Meissner.
d) Lapisan mukosa
Lapisan mukosa merupakan lapisan terdalam dari dinding saluran
pencernaan. Lapisan ini berbentuk membran (selaput) mukosa dan
dibentuk oleh tiga komponen, yaitu lapisan epitel, lamina propiadan
lapisan muskularis mukosa.
2.8 Saraf Kolinergik
Neurotransmitter yang memperantai penghantaran sinaptik saraf
preganglion dan postganglion pada sistem parasimpatik adalah asetilkolin dan
kemudian berinteraksi dengan reseptor asetilkolin nikotinik dan muskarinik pada
sel organ efektor. Sistem parasimpatik dinamakan juga system saraf kolinergik
karena neurotransmitter utamanya adalah asetilkolin (Nugroho, 2012).
Saraf yang mensintesis dan melepaskan asetilkolin disebut saraf
kolinergik, yakni saraf praganglion simpatis dan parasimpatis, saraf pascaganglion
parasimpatis dan saraf somatik yang mempersarafi otot rangka. Perbedaan
mendasar antara saraf parasimpatis dan simpatis adalah saraf parasimpatis
berperan dalam fungsi konservasi dan reservasi sedangkan saraf simpatis
berfungsi mempertahankan diri terhadap tantangan dari luar tubuh yang dikenal
Ada berbagai reseptor kolinergik, yakni reseptor nikotinik dan reseptor
muskarinik dan berbagai subtipenya.
2.8.1 Reseptor Muskarinik
Reseptor muskarinik terdistribusi luas diseluruh tubuh dan mendukung
berbagai fungsi vital, diotak, sistem saraf otonom terutama saraf parasimpatis.
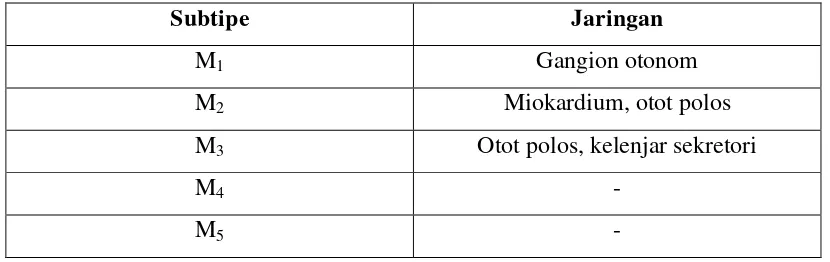
Reseptor muskarinik merupakan reseptor yang terhubung dengan protein G,
terdiri dari 5 subtipe yaitu : M1, M2, M3, M4 dan M5. Respon yang timbul dari
aktivasi reseptor muskarinik oleh asetilkolin dapat berbeda, tergantung pada
subtipe reseptor dan lokasinya (Rahardjo, 2009). Reseptor M1 ditemukan di sel
parietal lambung, reseptor M2 di otot jantung dan otot polos, reseptor M3
dikandung kemih, kelenjar eksokrin dan otot polos sedangkan M4 dan M5 belum
diketahui. Reseptor M3 memainkan peran dalam regulasi kontraksi otot polos
seperti pada usus dan bronkiolus, dimana aktivasinya akan menyebabkan
stimulasi phospolidase C, membrane depolarisasi dan meningkatkan kontraksi
otot polos (Lullmann, 2000; Nugroho, 2012).
Tabel 2.1 Tipe reseptor muskarinik ( Harahap, dkk., 2015).
Subtipe Jaringan
M1 Gangion otonom
M2 Miokardium, otot polos
M3 Otot polos, kelenjar sekretori
M4 -
2.8.2 Reseptor Nikotinik
Reseptor nikotinik merupakan reseptor yang terhubung dengan kanal ion
dan terdiri dari empat subunit yaitu α1, α2, β dan δ yang masing masing
berkontribusi membentuk kanal ion dan memiliki tempat ikatan untuk molekul
asetilkolin. Reseptor ini terdapat di neuromuscular junction, ganglion otonom,
medula adrenal dan susunan saraf pusat (Rahardjo, 2009).
2.9 Agonis Muskarinik
Umumnya obat akan menghasilkan efeknya ketika berikatan dengan
protein spesifik yang disebut dengan reseptor. Reseptor akan merespon senyawa
kimia endogen pada tubuh seperti transmitter sinaps (contohnya asetilkolin,
noradrenaline) atau hormon (contohnya endokrin, insulin). Adanya obat atau
transmitter berikatan dengan reseptor dan menghasilkan respon berupa efek
farmakologik disebut dengan agonis (Zunilda, 2007).
Agonis muskarinik dibedakan atas :
1. Asetilkolin dan ester kolin sintesis yaitu metakolin, karbakol dan
dan betanekol.
2. Alkaloid kolinergik yang terdapat dialam yaitu muskarin,
pilokarpin dan arekolin beserta senyawa sintesisnya (Zunilda,
2007).
Asetilkolin hanya bermanfaat dalam penelitian dan tidak berguna secara
klinis karna efeknya sangat luas di berbagai organ. Selain itu, kerjanya terlalu
singkat karena segera dihancurkan oleh asetilkolinesterase atau
dihidrolisis oleh asam lambung. Asetilkolin eksogen memperlihatkan efek yang
sama dengan efek asetilkolin endogen. Secara umum efek farmakodinamik
asetilkolin dibedakan atas dua golongan, yaitu efek terhadap kelenjar eksokrin dan
otot polos yang disebut dengan efek muskarinik dan efek terhadap ganglion
(simpatis dan parasimpatis), kelenjar adrenal dan otot rangka yang disebut efek
nikotinik (Zunilda, 2007).
2.10 Antagonis Muskarinik
Antagonisme adalah suatu keadaan ketika efek dari satu obat menjadi
berkurang atau hilang sama sekali yang disebabkan oleh keberadaan satu obat
lainnya (Setiawati dan Gan, 2007). Zunilda (2007) mengelompokkan penghambat
reseptor muskarinik atau antimuskarinik dalam tiga kelompok, yaitu :
1. Alkaloid antimuskarinik, atropin dan skopolamin
2. Derivat semisintesisnya
3. Derivat sintesis.
Atropin selektif menghambat reseptor muskarinik, tetapi pada dosis
sangat besar atropin memperlihatkan efek penghambatan juga diganglion otonom
dan otot rangka yang reseptornya nikotinik. Hambatan oleh atropin bersifat
reversible dan dapat diatasi dengan pemberian asetilkolin dalam jumlah berlebih
atau pemberian asetilkolinesterase. Atropin memblok asetilkolin endogen maupun
eksogen, tetapi hambatannya jauh lebih kuat terhadap eksogen. Kepekaan reseptor
muskarinik terhadap antimuskarinik juga berbeda antarorgan, atropin sendiri
memiliki efek yang lebih kuat diperifer yaitu terhadap jantung, usus dan otot