PEMBERIAN PROBIOTIK Bacillus sp BERASAL DARI UDANG GALAH (Macrobranchium rosenbergii DE MAN) DAN UDANG WINDU (Penaeus monodon)
TERHADAP STATUS KESEHATAN IKAN NILA(Oreochormis niloticus)
By
Alfian 1, Iesje Lukistyowati 2, Henni Syawal 2
Aquaculture, Faculty of Fisheries and Marine Science University of Riau Pekanbaru, Riau Province
ABSTRACT
This research was conducted on October 2015 - June 2016, at the Laboratory of Microbiology and the Laboratory of Parasites and Fish Diseases, Faculty of Fisheries and Marine Sciences, University of Riau. The purpose of this study is to comprehend the probiotic Bacillus sp. from the digestive tract of the giant prawns (Macrobranchium
rosenbergii DE MAN) and the black tiger shrimp (Panaeus monodon) for the health status of
tilapia (Oreochormis niloticus). This study uses a Completely Randomized Design (CRD), which consists of three treatments and each of them uses three replications for the probiotic
Bacillus sp. treatment of the digestive tract either from the giant prawns or the tiger shrimp.
The Bacillus sp. treatment from the giant prawns are P1G (UG4 isolates), P2G isolates combined (UG1, UG2, UG3, UG4, and UG5) and as a control (P0).While the tiger shrimp are using P1W (UWH9 isolates), P2W isolates that combined (UWH1, UWH2, UWH8, UWH9 and UWH 10) and as a control (P0). Probiotics from each treatment were put into the medium water about 3 mL / container with a density of 104 CFU/ml. The results showed that the P1W
treatment is the best treatment after infected by Streptococcus iniae for the health statusof tilapia, it is showed by the number of Erythrocytes 246.67x104 sel / mm, Haemoglobin level
of 6633 g/dl, Hematocrytes 30.33%, and total Leukocytes 79,33x103 sel/mm3. Given by
probiotics of Bacillus sp that originatit from the digestive tract of giant prawns and tiger shrimp through the water were able to maintain the health of tilapia (Oreochormis niloticus). Key Words: Bacillus sp, giant prawns, black tiger shrimp, health status, tilapia
1. College student from Faculty of Fisheries and Marine Sciences, University of Riau 2. Lecturers from Faculty of Fisheries and Marine Sciences, University of Riau PENDAHULUAN
Probiotik umumnya didefinisikan sebagai mikroorganisme yang memiliki kemampuan untuk memodifikasi komposisi bakteri dalam saluran pencernaan hewan akuatik, air, dan sedimen serta dapat digunakan untuk suplemen pakan yang dapat meningkatkan kesehatan inang dan berperan sebagai agen biokontrol (Flores, 2011). Pada umumnya probiotik yang biasa digunakan untuk meningkatkan pertumbuhan tubuh adalah golongan bakteri asam laktat. Verschuere et al. dalam Widanarni et al. (2012) menyatakan , probiotik adalah agen mikroba hidup yang mampu mem-
berikan keuntungan bagi inang dengan memodifikasi komunitas mikroba atau berasosiasi dengan inang, memperbaiki nilai nutrisi, dan pemanfaatan pakan, meningkatkan respons inang terhadap penyakit, dan memperbaiki kualitas lingkungan. Salah satu jenis bakteri yangbanyak dimanfaatkan sebagai probiotik dalam akuakultur adalah genus
Basillus (Hong et al., 2004).
Probiotik dalam akuakultur telah diketahui berperan dalam berbagai hal, yaitu menyingkirkan bakteri patogen melalui produksi senyawa-senyawa
penghambat; perbaikan kualitas air; peningkatan respon imun inang; dan peningkatan nutrisi inang melalui produksi enzin pencernaan bakteri asam laktat (probiotik) dalam kapang mempunyai berbagai manfaat untuk kesehatan diantaranya dapat menekan pertumbuhan bakteri penyebab penyakit di saluran pencernaan, karena bakteri asam laktat memproduksi senyawa anti mikroba, antara lain bakteriosin, hidrogen peroksida dan berbagai antibiotik (Verschuere et al.,
dalam Mayasari, 2013).
Tujuan dilakukannya penelitian ini adalah untuk mengetahui pemberian probiotik dari saluran pencernaan udang Windu yang diberikan dalam wadah budidaya terhadap kesehatan ikan nila (O.
niloticus)
METODE PENELITIAN
Metode yang digunakan adalah metode eksperimen. Pemberian probiotik pada wadah budidaya dilakukan setiap 10 hari sekali sebanyak tiga kali (selama penelitian) yaitu 3 mL/wadah dengan kepadatan bakteri 104 CFU/mL, pemberian
probiotik Basillis sp dari udang galah dengan taraf perlakuan yaitu:
P0 Kontrol
P1G Penebaran isolat terbaik (UG4) P2 G Penebaran isolat gabungan (UG1,
UG2, UG3, UG4, dan UG5) Pemberian probiotik Basillis sp dari udang windu dengan taraf perlakuan yaitu:
P0 Kontrol
P1W Penebaran isolat terbaik (UWH9) P2 W Penebaran isolat gabungan (UWH1, UWH2, UWH8, UWH9 dan UWH 10)
Persiapan Wadah
Wadah pemeliharaan yang di-gunakan adalah akuarium yang berukuran 40x30x30 cm. Sebelum akuarium digunakan, terlebih dahulu di-bersihkan agar terbebas dari mikro organisme patogen. Setelah akuarium dibersihkan kemudian dikeringkan dan diisi air dengan ketinggian 25 cm dan kemudian diberi aerasi.
Persiapan Probiotik
Probiotik didapat dari hasil isolasi udang Galah (Macrobranchium
rossenbergii De Man) dan Udang Windu
(Penaeus monodon) Probiotik hasil isolat dari udang Galah terdiri dari 5 jenis bakteri
Bacillus sp dengan kode isolat yaitu UG1,
UG2, UG3, UG4 dan UG5. Sedangkan probiotik hasil isolat dari udang windu terdiri dari 5 jenis bakteri Bacillus sp dengan kode isolat yaitu UWH1, UWH2, UWH8, UWH9, dan UWH10.
Pemeliharaan Ikan
Benih ikan yang sudah diakli-matisasi dan dipuasakan selama 24 jam kemudian ditimbang bobotnya sebagai data awal. Pemeliharaan hewan uji dilakukan selama 30 hari dan selama pemeliharaan, ikan diberi pakan komersial secara ad satiations sebanyak tiga kali sehari yaitu pada pukul 09.00, 13.00, dan 17.00 WIB. Selama penelitian (30 hari), pemberian probiotik dilakukan sebanyak tiga kali yaitu setiap 10 hari sekali yang dilakukan pada awal, pertengahan dan akhir penelitian dan ikan diukur pertumbuhannya, jumlah ikan yang di sampling sebanyak 50% atau 5 ekor per wadah . Selama pemeliharaan dilakukan penyiponan air dari feses pada saat air mengalami kekeruhan dan dilakukan penambahan air sesuai dengan volume air yang terbuang.
Uji Tantang
Biakan Streptococcus iniae
diperoleh dari Stasiun Karantina Ikan dan Penjaminan Mutu (SKIPM) Kelas 1 Pekanbaru. Ikan diuji tantang selama kurun waktu 10 hari dengan menyuntikkan biakan Streptococcus iniae dengan kepadatan 105 CFU/mL. Ikan disuntik
secara intramuscular dengan dosis suntikan 0,1 mL/ikan.
Pengamatan Gejala Klinis
Pengamatan gejala klinis ikan meliputi pergerakan tubuh, nafsu makan ikan, morfologi atau kondisi fisik. Pengamatan nafsu makan dilakukan dengan melihat respons dan aktifitas makan terhadap pakan yang diberikan dibandingkan dengan respon dan aktifitas
makan ikan kontrol. Pengamatan dilakukan selama uji tantang dengan bakteri S. iniae.
Pengambilan Sampel Darah Ikan. Sebelum pengambilan darah, ikan terlebih dahulu dibius dengan minyak cengkeh secukupnya, setelah ikan dimasukkan ke dalam nampan dengan kepala disebelah kiri, sebelumnya alat suntik sudah dibilas dengan Na-sitrat 3,8% sedikit, kemudian darah diambil pada bagian vena caudalis yaitu pembuluh darah yang terletak tepat dibagian ventral tulang vertebrae (tulang punggung). Jarum ditusukan di bawah garis linea latelaris antara anus dan sirip anal. Lalu jarum ditarik sedikit kemudian darah dihisap sampai batas yang diinginkan. Setelah itu alat suntik dicabut kemudian darah ditempatkan ke dalam eppendorf.
Kadar Hemoglobin
Menurut Wedemeyer dan Yasutake
dalam Dosin et al (2013), menyatakan
kadar hemoglobin diukur dengan cara; tabung sahlinometer diisi dengan larutan HCl 0,1 N sampai angka 10 (garis skala paling bawah pada tabung sahlinometer), kemudian tabung tersebut ditempatkan di antara 2 tabung dengan warna standar, lalu darah ikan diambil dari tabung microtube dengan pipet sahli sebanyak 0,02 ml dan dimasukkan ke tabung sahli dan didiamkan 3 menit, sebelumnnya ujung pipet dibersihkan terlebih dahulu. Kemudian ditambahkan akuades dengan pipet tetes sedikit demi sedikit sambil diaduk dengan gelas pengaduk sampai warnanya tepat sama dengan warna standar. Kadar hemaglobin dinyatakan dalam g%
Kadar Hematokrit
Sampel darah dimasukkan dalam tabung mikro hematokrit sampai kira-kira 4/5 bagian tabung, sumbat ujungnya (bertanda merah) dengan kretoseal kemudian sentrifuse selama 15 menit dengan kecepatan 3500 rpm. Setelah itu diukur presentase dari nilai hematokrit. Kadar hematokrit dinyatakan sebagai % volume padatan sel darah (Anderson dan Siwicki dalam Dosin et al.,2013).
Total Eritrosit
Menurut Blaxhall dan Daisley
dalam Dosin et al.,(2013), metode
pengukuran total eritrosit yaitu sampel darah dihisap dengan pipet skala 0,5 dilanjutkan dengan menghisap larutan Hayem sampai skala 101, kemudian dihomogenkan dengan cara menggoyang-goyangkan membentuk angka delapan. Tetesan pertama dibuang dan tetesan berikutnya dimasukkan ke dalam hemasitometer dan ditutup dengan cover glass. Penghitungan dilakukan pada 5 kotak kecil hemasitometer dan jumlahnya dihitung dengan rumus:
Jumlah eritrosit = Jumlah sel eritrosit terhitung × 104 sel/mm3 Total Leukosit
Menurut Blaxhall dan Daisley dalam
Dosin et al.,(2013), metode pengukuran
total leukosit yaitu sampel darah dihisap dengan pipet skala 0,5 (pipet yang digunakan adalah pipet khusus pengukuran leukosit), dilanjutkan dengan menghisap larutan Turk’s sampai skala 11, kemudian dihomogenkan dengan cara menggoyang-goyangkan membentuk angka 8. Tetesan pertama dibuang dan tetesan berikutnya dimasukkan ke dalam hemasitometer dan ditutup dengaan cover glass. Penghitungan dilakukan pada 4 kotak besar hemasitometer dan jumlahnya dihitung:
Jumlah leukosit = Jumlah sel leukosit terhitung × 50 sel/mm3. PertumbuhanBobotMutlak
Pengukuran pertumbuhan bobot mutlak individu ikan diukur dengan menggunakan rumus Effendie (1979) yaitu:
Wm = Wt-Wo
Dimana :Wm =Pertumbuhanberatmutlak ikan uji (g)
Wt =Bobot ikan uji pada akhir penelitian (g)
Wo = Bobot ikan uji pada awal penelitian (g)
Tingkat Kelulushidupan
Untuk mengukur kelangsungan hidup digunakan rumus dari Zonneveld et
al (1991) sebagaiberikut:
SR = No
Nt
Dimana : SR = Tingkat kelulushidupan (%)
Nt =
Populasiikanpadaakhirmas apemeliharaan (ekor) No = Populasi ikan pada awal
pemeliharan (ekor). Kualitas Air
Parameter kualitas air yang diukur adalah suhu, pH dan oksigen terlarut (DO). Pengukuran kualitas air ini dilakukan sebanyak 2 (dua) kali yaitu pada awal penelitian dan akhir penelitian. Analisa Data
Data yang diperoleh selama penelitian disajikan dalam bentuk tabel kemudian dihitung kadar hemoglobin, kadar hematokrit, total eritrosit, total leukosit, pertumbuhan bobot mutlak dan tingkat kelulushidupan. Untuk mengetahui pengaruh perlakuan terhadap parameter yang diuji dengan menggunakan model
RAL (Sudjana, 1992), dianalisa dengan uji statistik dengan menghitung Anava, tetapi sebelumnya diuji normalitas dan homogenitas. Apabila nilai probabilitas (P <0,05) maka ada pengaruh penambahan probiotik dalam media terhadap parameter yang diukur. Untuk mengetahui perbedaan antara tiap perlakuan, maka dilakukan uji lanjut yaitu uji Newman-Keuls. Sedangkan data kualitas air dianalisa secara deskriptif. HASIL DAN PEMBAHASAN
Gejala Klinis
Gejala klinis ikan nila yang dipelihara selama 30 hari yang diberi probiotik Bacillus sp yang berasal dari saluran pencernaan Udang Galah (Macrobrachium rosenbergii de MAN) dan udang windu (Panaeus monodon) kemudian di infeksi dengan bakteri S.
Iniae dengan kepadatan 105 CFU/mL
mengalami perubahan morfologi, untuk lebih jelasnya dapay dilihat pada Tabel1. Tabel 1. Gejala klinis ikan nila (O. niloticus) yang diberi perlakuan Bacillus sp dari saluran
pencernaan udang galah dan udang windu setelah diinfeksi bakteri S. iniae Perla
kuan
Gejala Klinis Pergerakan ikan Produksi
lender Nafsu makan Warna tubuh Mata Sirip/sisik
P0 Lambat, mudah
terkejut, dan diam di dasar Produksi lendir banyak setelah 12 jam
Ikan tidak mau makan Pucat Menonjol
(Eksopthalmia) sirip geripis dan sisik lepas
P1G Ikan lebih sering
bergerombol mendekati aerasi Produksi lendir banyak setelah 12 jam
Nafsu makan menurun
kembali meningkat
pada hari ke-6 setelah infeksi Warna tubuh menjadi kehitaman Kornea mata berwarna putih Sirip ekor geripis P2G Berenang lemah didasar, mudah
terkejut, dan ikan
lebih sering bergerombol mendekati aersi Produksi lendir banyak setelah 12 jam
Nafsu makan menurun, dan kembali normal pada hari ke-6 setelah infeksi Pucat, terdapat bercak kemerahan di permukaan kulit Menonjol (Eksopthalmia) Sirip ekor dan sirip punggung geripis
P0 Mudah terkejut, dan
diam di dasar
Produksi lendir banyak
Ikan tidak mau makan Pucat Menonjol
(Eksopthalmia) Sirip geripis dan sisik lepas P1W P2W Ikan sering bergerombol mendekati aerasi Berdiam didasar, mudah terkejut, dan ikan lebih sering bergerombol mendekati aersi Produksi lendir banyak setelah 12 jam Produksi lendir banyak setelah 12 jam Nafsu makan
menurun, dan kembali normal pada hari ke-5 setelah infeksi
Nafsu makan menurun dan kembali normal pada hari ke-6 setelah infeksi Pucat Pucat Kornea mata berwarna putih Kornea mata memutih Sirip dan sisik utuh Sirip ekor geripis
Keterangan: P0 = kontrol (tanpa probiotik dan diinfeksi S. iniae); P1 = pemberian probiotik Bacillussp isolat UG4 dan diinfeksi S. iniae; P2 = pemberian probiotik Bacillussp Gabungan isolat (UG1+UG2+ UG3+UG4+UG5) dan diinfeksi S. IniaeP1W = pemberian probiotik Bacillussp isolat UWH9 dan diinfeksi S. iniae; P2W = pemberian dengan probiotik Bacillussp Gabungan isolat (UWH1+UWH2+ UWH8+UWH9+UWH10) dan diinfeksi S. Iniae
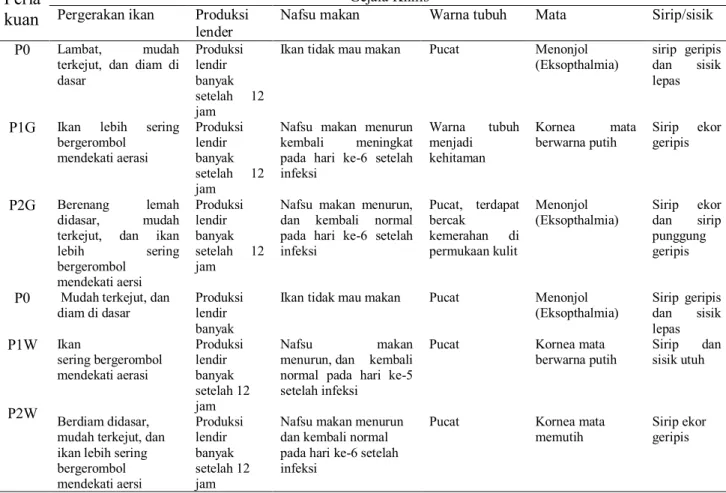
Gambar 2 : Gejala klinis ikan nila setelah diinfeksi dengan bakteri S. Iniae pada perlakuan
yang diberikan melalui media
pemeliharaan dengan probiotik yang diisolasi dari saluran pencernaan udang galah (dokumentasi pribadi)
Keterangan : a.Ikan normal (tidak diinfeksi S. Iniae) b. P0 mata ikan eksophtalmia, warna
perut menjadi pucat, sirip ekor , geripis.
c. P1G sisik terlepas, sirip ekor geripis.
d. P2G mata keruh keadaan perut menjadi cekung, sirip ekor geripis.
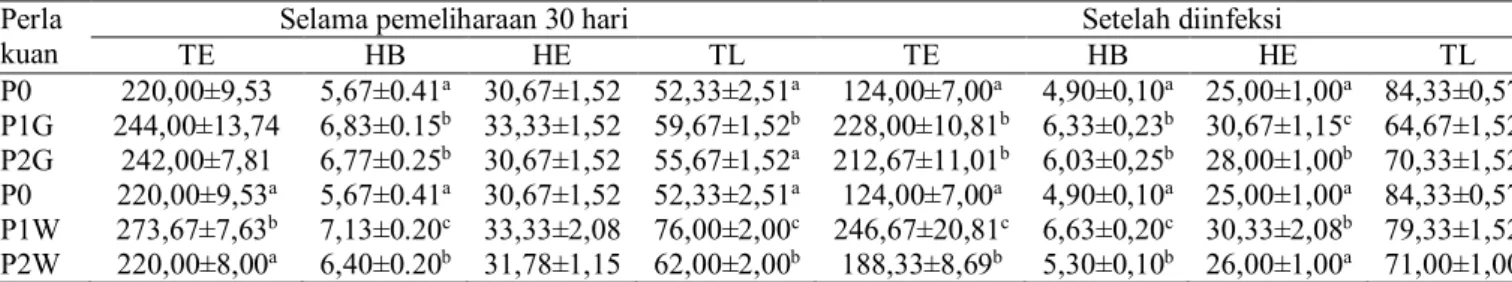
Gambar 2: Gejala klinis ikan nila setelah diinfeksi dengan bakteri S. iniae pada perlakuan dengan probiotik yang diisolasi dari
saluran pencernaan udang windu
(dokumentasi pribadi) Keterangan : a. Ikan dalam keadaan normal
b.P0 Mata ikan putih pucat, keadaan warna tubuh pucat, sirip ekor geripis c. P1W Keadaan warna tubuh ikan
menjadi pucat, kornea mulai memutih d. P2W mata putih pucat sirip ekor
geripis
Tabel 2. Status kesehatan ikan uji selama penelitian
Perla
kuan TE Selama pemeliharaan 30 hari HB HE TL TE Setelah diinfeksi HB HE TL
P0 220,00±9,53 5,67±0.41a 30,67±1,52 52,33±2,51a 124,00±7,00a 4,90±0,10a 25,00±1,00a 84,33±0,57c P1G 244,00±13,74 6,83±0.15b 33,33±1,52 59,67±1,52b 228,00±10,81b 6,33±0,23b 30,67±1,15c 64,67±1,52a P2G 242,00±7,81 6,77±0.25b 30,67±1,52 55,67±1,52a 212,67±11,01b 6,03±0,25b 28,00±1,00b 70,33±1,52b P0 220,00±9,53a 5,67±0.41a 30,67±1,52 52,33±2,51a 124,00±7,00a 4,90±0,10a 25,00±1,00a 84,33±0,57c P1W 273,67±7,63b 7,13±0.20c 33,33±2,08 76,00±2,00c 246,67±20,81c 6,63±0,20c 30,33±2,08b 79,33±1,52b P2W 220,00±8,00a 6,40±0.20b 31,78±1,15 62,00±2,00b 188,33±8,69b 5,30±0,10b 26,00±1,00a 71,00±1,00a
Keterangan: TE: Total Eritrosit, HB: Kadar Hemoglobin, HE: Kadar Hematokrit, TL: Total Leukosit, Superskrip yang berbeda padakolam yang sama menunjukkan perbedaan nyata (p<0,05)
Status Kesehatan ikan Total Eritrosit
Hasil pengamatan terhadap total eritrosit ikan nila yang diberi probiotik
Bacillus sp dipelihara 30 hari masih dalam
kisaran normal yaitu antara
220,00±8,00
x
104 sel/mm3 sampai 273,67±7,637 x104sel/mm3. Hal ini tidak berbeda dengan
hasil penelitian Maryadi (2009) menunjukkan jumlah eritrosit darah ikan nila berkisar antara total eritrosit dengan kisaran 105-300x104 sel/mm3.
Setelah setelah infeksi dengan S.
iniae, terjadi penurunan jumlah total
eritrosit dalam darah ikan nila. Hal ini diduga karena terjadi fogositosis bakteri yangmasuk. Proses tersebut membutuhkan oksigen sehingga terjadi penurunan eritrositMatofani et al., (2013). Hardi
(2012) Penurunan nilai eritrosit diduga karena adanya produk ekstraseluler yang dihasilkan oleh S. iniae yaitu hemolisin, enzim ekstrasellular yang memiliki kemampuan untuk melisiskan eritrosit dengan cara menghasilkan toksin berupa hemolisin.
Berdasarkan uji statistik (ANAVA) menunjukkan bahwa nilai eritrosit ikan nila yang diberi perlakuan dengan probiotik Bacillus yang diisolasi dari saluran pencernaan udang windu berpengaruh sangat nyata (P<0.05) terhadap nilai total eritrosit ikan nila setelah infeksi dengan bakteri S.iniae. Hal ini menunjukkan bahwa perlakuan pemberian probiotik Bacillus memiliki pengaruh dalam mempertahankan total eritrosit ikan nila. Hasil pengamatan nilai
total eritrosit terlihat bahwa nilai eritrosit masih berada dalam jumlah normal,hal ini sesuai dengan Irianto (2005), jumlah eritrosit pada ikan teleostei antara 1,05– 3,0x106/mm3. dengan demikian, dapat
dikatakan bahwa probiotik Bacillus mampu menjaga status kesehatan ikan nila. Kadar Hemoglobin
Hasil pengamatan terhadap kadar hemoglobin ikan nila selama penelitian yang dipelihara 30 hari dengan probiotik menunjukkan kadar hemoglobin dalam kisaran normal yaitu 6,40±0,20g/dL sampai 7,13±0,20g/dL, ini sesuai dengan Penelitian Salasia et al., (2001), pemeriksaan terhadap nila yang telah dipastikan sehat mendapatkan kadar hemoglobin sebesar 5,05–8,33 g/dL
Setelah infeksi dengan bakteri S. iniae terjadi penurunan kadar hemoglobin dalam darah ikan nila.Saat terjadi infeksi bakteri patogen, darah akan melakukan mekanisme fagositosis sebagai bentuk perlawanan terhada bakteri patogen. Aktifitas ini membutuhkan jumlah oksigen untuk mampu bekerja secara optimal. Akibatnya, jumlah oksigen didalam darah akan berkurang dan berdampak pada penurunan jumlah hemoglobin dalam darah (Fauziah et al., 2013).
Berdasarkan uji statistik (ANAVA) menunjukkan bahwa kadar hemoglobin ikan nila yang diberi perlakuan probiotik dari saluran pencernaan udang galah setelah diinfeksi dengan S. iniae
berpengaruh nyata antara P0 dengan P1G, P2G (P<0.05), sedangkan perlakuan probiotik dari saluran pencernaaan udang windu setelah uji statistik (ANAVA) kadar hemoglobin ikan nila setelah infeksi memliki pengaruh dan berbeda sangat nyata (P<0.05) antara perlakuan P1W dan kontrol, sedangkan perlakuan P1W dan P2W berbeda nyata.
Kadar Hematokrit
Hasil pengamatan terhadap kadar hematokrit ikan nila selama penelitian yang dipelihara 30 hari dengan probiotik menunjukkan kadar hematokrit normal yaitu 30.67% sampai 33.33%. jumlah ini
tidak berbeda dengan hasil penelitian Hardi et al., (2011) yang menyebutkan jumlah normal kadar hematokrit ikan nila berkisar antara 27,3 sampai 37,8%. Keadaan ini menunjukkan bahwa pem-berian probiotik mampu meningkatkan kadar hematokrit dalam darah ikan nila jika dibandingkan dengan perlakuan kontrol tanpa pemberian probiotik. Saat setelah infeksi dengan bakteri S. iniae, terjadi penurunan kadar hematokrit da- lam darah ikan nila. Penurunan ka- dar hematokrit menunjukkan adanya kerusakan pada sel darah merah akibat infeksi bakteri (Martins et al., 2008). Dellman dan Brown dalam putra (2015) menyatakan bahwa, apabila ikan terkena infeksi maka nafsu makan ikan akan menurun dan nilai hematokrit darah akan menurun.
Probiotik Bacillus sp P1G memiliki pengaruh nyata terhadap kadar hematokrit ikan nila setelah diinfeksi dengan bakteri S.iniae (P<0.05). Begitu juga pada perlakuan probiotik dari saluran pencernaan udang windu, berdasarkan uji statistik (ANAVA) berpengaruh nyata (P<0.05) terhadap kadar hematokrit ikan nila P0 dan P1W sedangkan P0 dan P2W tidak berbeda nyata. Hal ini diduga karena pada isolat gabunga pada P2W terdapat isolat lain yang bersifat resisten sehingga tidak mampu mencegah tekanan terhadap infeksi bakteri S.iniae. Dellman dan Brown dalam Putra (2015) menyatakan bahwa, apabila ikan terkena infeksi maka nafsu makan ikan akan menurun dan nilai hematokrit darah akan menurun.
Total Leukosit
Hasil pengamatan terhadap total leukosit ikan nila selama penelitian yang dipelihara 30 hari dengan probiotik dalam keadaaan normal yaitu sebesar 52.33x103
sel/mm3 sampai 76.00x103 sel/mm3..
Leukosit berfungsi membantu melindungi tubuh dari benda asing, termasuk invasi patogen melalui sistem imun, jumlah leukosit normal berkisar 20.000 - 150.000 sel/mm3 (Moyle and Cech dalam Riantono et al., 2016). Keadaan ini
menunjukkan bahwa pemberian probiotik mampu meningkatkan total leukosit dalam darah ikan nila jika dibandingkan dengan perlakuan kontrol tanpa pemberian probiotik. Ini membuktikan bahwa pemberian Bacillus secara penebaran secara langsung ke media dapat menstimulasi imunitas ikan nila (O.
niloticus).
Saat setelah infeksi, terjadi peningkatan total leukosit dalam darah ikan nila. Peningkatan total leukosit ini terkait dengan kinerja sistem imun ikan dalam mereduksi serangan patogen. Semakin meningkatnya serangan patogen maka akan semakin meningkat pula produksi leukosit dalam darah (Farouq 2011).
Berdasarkan uji statistik (ANAVA) setelah infeksi menunjukkan berpengaruh nyata (P<0.05) terhadap perubahan total leukosit dalam darah ikan nila. Perlakuan P0 berbeda sangat nyata terhadap perlakuan P1G dan berbeda nyata terhadap perlakuan P2G. Berdasarkan uji statistik (ANAVA) setelah infeksi menunjukkan berpengaruh sangat nyata (P<0.05) terhadap perubahan total leukosit dalam darah ikan nila. Perlakuan P0 berbeda sangat nyata terhadap perlakuan P1W dan berbeda nyata terhadap perlakuan P2W. Hal ini diduga Bacillus yang diisolasi dari saluran pencernaan udang galah memiliki zat aktif bakteriosin yang mampu menghambat pertumbuhan dan perkembangan bakteri patogen. Sel darah putih merupakan unit sistem pertahanan tubuh paling aktif, dan beredar di dalam sirkulasi darah dalam berbagai tipe. Fungsi utama dari leukosit sebagai pertahanan non spesifik yang akan melokalisasi dan mengeliminir agen patogen melalui proses fagositosis (Affandi dan Tang dalam Putra 2013).
Pertumbuhan Bobot Mutlak
Hasil pengamatan terhadap pertumbuhan bobot mutlak ikan nila selama penelitian yang dipelihara 30 hari dengan probiotik ikan nila dapat tumbuh lebih 2 kali bobot awal tubuh ikan,
pertumbuhan bobot mutlak ikan nila pada perlakuan P0 sebesar 14.26g, perlakuan P1W sebesar 22. 64g, perlakuan P2W sebesar 17.99 g Hal ini sesuai dengan penelitian Jusadi et al.,( 2004) Setelah dipelihara selama 60 hari dengan penambahan probiotik Bacillus sp. pada pakan komersil, ikan patin dapat tumbuh lebih dari 2,8 kali bobot awal. Untuk lebih jelasnya dapat dilihat pada Tabel 3.
Tabel 3. Pertumbuhan bobot mutlak
Perlakuan probiotik udang galah
Bobot awal
(g) Bobot akhir (g) Bobot Mutlak (g) ± SD
P0 10,32 24,58 14,26 ± 0,28a P1G 13,95 33,19 19,24 ± 1,02b P2G 11,24 26,74 15,50 ± 0,92a Perlakuan probiotik udang windu P0 10,32 24,58 14,26 ± 0,28a P1W 17,22 39,86 22, 64 ± 2,6 b P2W 13,62 30,72 17,99 ± 3,92a
Keterangan : superskrip yang berbeda pada kolam yang sama menunjukkan perbedaan nyata (p<0,05)
Berdasarkan uji statistik (ANAVA) pertumbuhan bobot mutlak ikan nila yang diberi perlakuan probiotik dari udang galah memiliki pengaruh nyata (P<0.05). Perlakuan P0 dengan perlakuan P2G tidak berbeda nyata, sedangkan perlakuan kontrol (P1G) memiliki pengaruh yang berbeda nyata terhadap perlakuan P0 dan P2G, dan berdasarkan uji statistik (ANAVA) pertumbuhan bobot mutlak yang diberi perlakuan dengan probiotik dari udang Windu memiliki pengaruh dan berbeda nyata (P<0.05). Perlakuan P1W berbeda nyata terhadap perlakuan kontrol (P0) dan perlakuan P2W. Kemudian, perlakuan P0 dan perlakuan P2W tidak memiliki pengaruh yang berbeda nyata. Nilai pertambahan bobot ikan pada masing masing perlakuan yang lebih tinggi dibandingkan perlakuan kontrol diduga karena probiotik Bacillus yang diberikan masuk kedalam saluran pencernaan dan mampu meningkatkan nafsu makan ikan. Selanjutnya bakteri tersebut di dalam saluran pencernaan ikan akan mensekresikan enzim-enzim pencernaan
seperti protease dan amilase (Irianto, 2003).Narges et al. (2012) menyatakan bahwa dengan adanya enzim yang dihasilkan oleh probiotik Bacillus seperti amilase, lipase dan protease yang mampu memicu pertumbuhan ikan.
Tingkat Kelulushidupan
Hasil pengamatan terhadap tingkat kelulushidupan ikan nila selama penelitian yang dipelihara 30 hari dengan probiotik dan setelah diinfeksi dapat dilihat pada Tabel 4.
Tabel 4. Tingkat kelulushidupan
Kelulushidupan Selama Penelitian Perlakuan probiotik udang galah Selama pemeliharaan 30 hari(%) Setelah infeksi (%) P0 86,67 ± 5,77a 40,00 ± 0,00 a P1G 80,00 ± 0,00 a 76,67 ± 5,77 c P2G 76,67 ± 5,77 a 63,34 ± 5,77 b Perlakuan probiotik udang windu P0 86,67 ± 5,77a 40,00 ± 0,00a P1W 80,00 ± 0,00a 76,67 ± 5,77b P2W 80,00 ± 5,00a 73,33 ± 5,77b
Berdasarkan uji statistik (ANAVA) setelah infeksi diketahui bahwa tingkat kelulushidupan ikan nila yang diberi perlakuan probiotik yang diisolasi dari saluran pencernaan udang galah berpengaruh sangat nyata (P<0.05). Perlakuan P1G berbeda sangat nyata terhadap perlakuan P0 sedangkan perlakuan P1G dan perlakuan P2G memiliki pengaruh nyata. Berdasarkan uji statistik (ANAVA) setelah infeksi diketahui bahwa tingkat kelulushidupan ikan nila yang diberi perlakuan dengan probiotik dari udang windu memiliki pengaruh berbeda nyata (P<0.05). Perlakuan P1W dan perlakuan P2W berbeda nyata terhadap perlakuan P0 sedangkan perlakuan P1W dan perlakuan P2W tidak memiliki pengaruh nyata. Hal ini menunjukkan bahwa pemberian probiotik mampu memberikan persentase tingkat kelulushidupan yang baik bagi ikan nila.
Kualitas Air
Pengamatan paarameter kualitas air selama penelitian dilakukan sebanyak dua kali, pertama pada awal penelitian dan akhir penelitian. Parameter yang diamati selama penelitian adalah DO,pH dan Suhu. Hasil pengukuran kualitas air selama penelitian disajikan dalam Tabel 5
Tabel 5. Kualitas air
Perlakuan probiotik
udang galah Suhu(0C) Parameter DO (mg/L) pH
P0 27,3-27,7 3,9-4,3 6,7-7,0 P1G 28,3-28,7 3,9-4,1 6,7-6,9 P2G 27,7-28,3 3,9-4,0 6,6-7,0 Perlakuan probiotik udang windu P0 27,3-27,7 3,9-4,3 6,7-7,0 P1W 27,3-28,3 3,9-4,2 6,8-7,1 P2W 27,3-27,7 3,8-4,0 6,8-7,0 Kordi 2010 25 – 33 > 3 6,0 -8,5
Hasil pengukuran kualitas air selama penelitian menunjukkan bahwa nilai suhu yang dianggap masih berada dalam nilai yang baik untuk lingkungan hidup ikan nila. Hal ini sesuai dengan pendapat Susanto (2010) suhu optimum untuk pertumbuhan ikan nila ini adalah 25-300C.
Kadar oksigen terlarut (DO) dalam perairan sangat penting bagi ikan. Ikan nila merupakan ikan yang cendrung lebih tahan terhadap kekurangan oksigen terlarut dalam air, namun pertumbuhan ikan nila akan optimal jika kandungan oksigen terlarut dalam air lebih dari 3 ppm. Kandungan oksigen terlarut dalam air kurang dari 3 ppm dapat menyebabkan pertumbuhan ikan menjadi lambat atau bahkan tidak dapat tumbuh dan akhirnya mati. (Susanto 2010). Dengan demikian pengukuran DO selama masa pemeliharaan menunjukkan jumlah yang bagus untuk kehidupan dan pertumbuhan ikan nila.
Pertumbuhan ikan nila mengalami penurunan pada lingkunagn dengan pH yang rendah. Namun demikian nila masih dapat tum-buh pada kisaran pH 5-10. Batas pH mematikan adalah 11 atau lebih. Sebaiknya nilai pH air dipertahankan pada nilai netral atau pada kisaran 6,5-8,0
(cerman dan sucipto, 2011). Dengan demikian kisaran pH selama masa pemeliharaan masih termasuk dalam kisaran yang baik bagi kelangsungan hidup ikan nila.
KESIMPULAN DAN SARAN
Probiotik Bacillus sp dari udang Galah (macrobranchium rosenbergii De Man) dan udang Windu (Panaeus
monodon) yang terbaik adalah P1W dilihat
dari parameter darah dimana jumlah total eritrosit 246.67x104 sel/mm3, kadar
hemoglobin yaitu 6.633g/dL, kadar hematokrit 30.33% , total leukosit 79.33x103 sel/mm3 serta kelulushidupan
ikan nila (O. niloticus) setelah diinfeksi S.
iniae sebesar 76. 67%. Pertumbuhan bobot
mutlak yang terbaik terdapat pada perlakuan P1W sebesar 22. 64g.
DAFTAR PUSTAKA
Cerman, O dan Sucipto, A. 2011. Panen
Nila 2,5 Bulan. Penebar
Swadaya. Jakarta. 83 hlm.
Dosin. Hardi,E,H dan Agustina. 2013. Efek Penginjeksian Produk Intraseluler (icp) dan Ekstraseluler (ecp) Bakteri
pseudomonas sp. Terhadap
Gambaran Darah Ikan Nila (Oreochromis niloticus). Jurnal
Ilmu Perikanan Tropis Vol. 19. No. 1.
E, D, Jusadi. Gandara. I, Mokoginta. 2004. Effects of Probiotic Bacillus sp. on Food Convertion and Growth of Catfish Pangasius
hypophthalmus. Jurnal
Akuakultur Indonesia, 3(1):
15-18 hlm
Fauziah, P. N. Nurhajati,J.,& Charysanti. 2013. Daya Anti Bakteri Filtrat Asam Laktat Dan Bakteriosin Laktobacillus Bulgaricus Dalam Soygurt Terhadap Pertumbuhan Klebsiella Pneumonia.
Bionatura Jurnal Ilmu-Ilmu Hayati Dan Fisik. Vol. 15, No.
2. 132-138.
Farouq Achmad. 2011. Aplikasi Probiotik, Prebiotik Dan Sinbiotik Dalam Pakan Untuk Meningkatkan Respon Imun Dan Kelangsungan Hidup Ikan Nila
Oreochromis niloticus Yang
Diinfeksi Streptococcus agalactiae. [Skripsi]. Fakultas
Perikanan Dan Ilmu Kelautan Institut Pertanian Bogor Bogor. 78 hlm.
Flores ML. 2011. The Use Of Probiotic In Aquaculture: an overview.
International Research Journal of Microbiology 2: 471–478.
Hardi, E, H. 2011. Kandidat Vaksin Potensial Streptococcus agalactiae Untuk Pencegahan
Penyakit Streptocosis Paada Ikan Nila (Oreochormis
niloticus). [disertasi]. Bogor
(ID): Institut pertanian bogor. Hong HA, Duc LH, Cutting SM. 2004.
The use of bacterial spore formers as probiotics. FEMS
Microbiology Reviews 29: 813–
835.
Irianto Agus. 2003. Probiotik Akuakultur. Gadjah Mada University Press. Yogyakarta. 125 hlm.
. 2005. Patologi Ikan Teleostei. Gadjah Mada University Press. Yogyakarta.
Matofani, A, S. Hastuti, S. Basuki, F. 2013. Profil Darah Ikan nila Kunti (oreochromis niloticus) yangDiinjeksi Streptococcus agalactiae Dengan Kepadatan
Berbeda.Journal of Aquaculture
Management and Technology
Volume 2, Nomor 2. Halaman 64-72.
Mayasari, E. 2013. Pengaruh pemberian bakteri asam laktat terhadap kelangsungan hidup ikan kerapu macan (Epinephelus fuscoguttatus). [Skripsi].
Fakultas Perikanan Dan Ilmu Kelautan. Universitas Riau. Maryadi, H. 2009. Studi Perkembangan
Gejala Klinis dan Patologi Pada Ikan Kerapu Macan (Epinephelus fuscoguttatus ) Yang Diinfeksi Dengan
Streptococcus iniae. [Skripsi].
Sekolah Pasca Sarjana Institut Pertanian Bogor Bogor. 99 hlm. Narges S, Hoseinifar SH, Merrifield DL,
Barati M. 2012. Dietary Supplementation Of Fructooligosaccharide (FOS) Imfroves The Innate Imunne Response, Stres Resistence, Digestive Enzyme Activitis And Growt Peformance Of Caspian Roach (Rutilus rutilus) Fry. Fish
And Shellfish Immunology 32:
316-321 hlm.
Puta Achmad Noerkhaerin. 2015. Gambaran Darah Ikan Patin (Pangasius sp.) Dengan Penambahan Prebiotik Pada Pakan. Jurnal Ilmu Pertanian
dan Perikanan Vol. 4 No.1 :
63-69 hlm.
Riantono Fatih, Kismiyati dan Laksmi, S. 2016. Perubahan Hematologi Ikan Mas Komet (Carassius
auratus auratus) Akibat
Infestasi Argulus japonicus
Jantan dan Argulus japonicus Betina. Journal of Aquaculture
and Fish Health Vol 5 No.2.
28-35 hlm
Salasia, Sitii.o., D. Sulanjari, dan A. Ratnawati. 2011. Studi hematologi ikan air tawar.
Jurnal Biologi. Vol 2. No 12:
710-723 .
Susanto, D. 2010. Budidaya Nila. Pustaka Baru Press. Yogyakarta. 127 hlm.
Widanarni. Wahjuningrum, D. Puspita, F. 2012. Aplikasi Bakteri Probiotik Melalui Pakan Buatan untuk Meningkatkan Kinerja
Pertumbuhan Udang Windu
Penaeus monodon. Jurnal Sains Terapan Edisi II. 2 (1) : 32 – 49.