5 BAB II
TINJAUAN PUSTAKA
2.1 Dasar Teori
Hepatitis merupakan penyakit sistemik yang menyerang hati. Penyakit ini dapat menyebabkan peradangan akut di hati dan kelainan klinis seperti demam, gejala gastrointestinal, misalnya mual dan muntah, serta ikterus. Hepatitis dapat disebabkan oleh berbagai faktor seperti Virus Hepatitis, alkohol, obat-obatan tertentu, dan penyakit autoimun. Namun sebagian besar kasus Hepatitis disebabkan oleh salah satu dari lima jenis Virus Hepatitis, yakni Virus Hepatits A, Virus Hepatitis B, Virus Hepatitis C, Virus Hepatitis D, dan Virus Hepatitis E. Jenis Hepatitis yang banyak menginfeksi penduduk Indonesia adalah Hepatitis B (21,8%), Hepatitis A (19,3%) dan Hepatitis C (2,5%) (Brooks et al., 2012; Infodatin, 2018).
2.1.1 Hepatitis B
Penyakit Hepatitis B disebabkan oleh Virus Hepatitis B (VHB). VHB menyebabkan kerusakan hepar tidak dengan cara sitopatik langsung, tetapi dengan terdapatnya antigen VHB pada permukaan sel hati kemudian akan dikenal oleh sistem imun tubuh dan kemudian sel hati yang terinfeksi ini dihancurkan (Price and Wilson, 2005). Penyakit ini dapat ditularkan secara vertikal maupun horizontal. Penularan secara vertikal 95% terjadi saat masa perinatal (dari ibu ke bayi saat lahir) dan 5% intrauterin. Sedangkan penularan horizontal melalui
kontak dengan darah orang yang terinfeksi, infeksi nosokomial, kontak seksual, transplantasi organ, jarum suntik, peralatan injeksi lain, atau melalui transfusi darah dengan DNA VHB positif (Trépo, Chan, & Lok, 2014; CDC, 2019).
2.1.1.1 Klasifikasi Hepatitis B 1) Hepatitis B Akut
Kebanyakan orang tidak mengalami gejala apapun ketika baru terinfeksi. Namun, beberapa orang ada yang memiliki gejala akut, seperti timbulnya warna kuning pada kulit dan mata (jaundice), urin gelap, kelelahan ekstrem, mual, muntah dan sakit perut. Masa inkubasi biasanya bervariasi antara 45 hingga 120 hari, dengan rata-rata 60 hingga 90 hari. Variasi tersebut bergantung pada jumlah virus yang masuk, cara penularan dan faktor host. Sebagian kecil orang dengan hepatitis akut dapat berkembang menjadi gagal hati akut yang dapat menyebabkan kematian (WHO, 2002, 2019).
2) Hepatitis B Kronik
Hepatitis B kronik merupakan perkembangan dari Hepatitis B akut. Infeksi kronik biasanya tergantung pada usia seseorang terinfeksi. Pada bayi yang terinfeksi VHB selama tahun pertama kehidupannya, maka 80–90% dapat mengalami infeksi kronik. Pada anak-anak yang terinfeksi sebelum usia 6 tahun maka 30-50% dapat mengalami infeksi kronik dan bila penularan terjadi pada orang dewasa maka kurang dari 5% bisa menjadi penderita infeksi kronik. Sekitar 15%-25% orang dengan Hepatitis B kronik dapat berkembang menjadi penyakit
hati yang serius, seperti kerusakan hati, sirosis, gagal hati, dan bahkan kanker hati (CDC, 2010; WHO, 2002, 2019).
2.1.1.2 Morfologi Virus Hepatitis B
Sumber : Parija, 2012
Gambar 2.1 Morfologi Virus Hepatitis B
Virus Hepatitis B (VHB) diklasifikasikan dalam famili Hepadnaviridae dan genus Orthohepadnavirus (Riaz et al., 2016; EASL, 2017). VHB mempunyai materi genetik DNA genom untai ganda parsial rileks sirkuler (relaxed circular) yang terdiri dari untai positif dan negatif serta berukuran 3200 bp (Jayalakshmi, Kalyanaraman and Pitchappan, 2013; Li et al., 2017). VHB memiliki selubung ganda dan berukuran 42 nm, terdiri dari inti yang mengandung antigen inti (core) hepatitis B (HBcAg) dan dikelilingi oleh mantel lipoprotein luar (amplop) yang mengandung antigen permukaan (HBsAg) (WHO, 2002; Brooks et al., 2012).
VHB merupakan virus yang mempunyai selubung amplop dan bereplikasi melalui RNA (Q. and G., 2011; Torres et al., 2013). Terdapat tiga jenis partikel
yang dapat dilihat dalam serum pasien penderita Hepatitis B, seperti pada Gambar 2.1, yakni partikel bola yang berdiameter 22 nm, partikel filamen atau tubular memanjang dengan diameter 22 nm, serta partikel berdinding ganda dan struktur bola dengan diameter 42 nm. Kedua partikel sebelumnya identik secara antigen dan dikenal sebagai antigen permukaan hepatitis B atau HBsAg. Partikel terakhir adalah partikel virus hepatitis lengkap yang dikenal sebagai partikel Dane (Parija, 2012).
2.1.1.3 Karakteristik Virus Hepatitis B
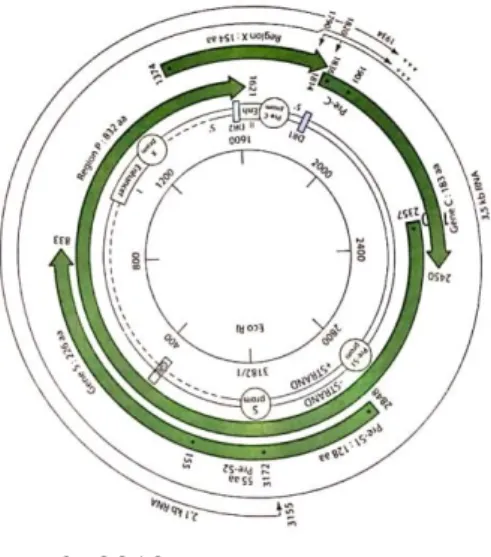
Genom VHB memiliki empat kerangka baca terbuka yang tumpang tindih yang dapat dilihat pada Gambar 2.2, yaitu s, p, c dan x. Kerangka baca terbuka s (surface) mengkode protein amplop, yang terdiri dari tiga protein permukaan yang terpisah, yaitu protein besar (L), sedang (M), dan kecil (S). Kerangka baca terbuka p (polimerase) mengkode protein multifungsi yang terlibat dalam enkapsulasi, inisiasi sintesis DNA untai negatif, domain transkripsi balik, dan degradasi RNA pre-genomik (pgRNA). Kerangka baca terbuka c (core) mengkode Hepatitis B core Antige (HBcAg) dan mengkode Hepatitis B envelope Antigen (HBeAg). Kerangka baca terbuka x mengkode protein Hepatitis B x (HBx), yang memainkan peran dalam transduksi sinyal, aktivasi transkripsi, perbaikan DNA, dan penghambatan degradasi protein (Neuveut, Wei and Buendia, 2010; Ezzikouri et al., 2014).
Sumber : Brooks et al., 2012
Gambar 2.2 Genom untai ganda parsial VHB
Urutan nukleotida genom VHB diklasifikasikan menjadi 10 genotipe (A-J) dan subgenotipe berdasarkan perbedaan urutan nukleotida diseluruh genomnya. Masing-masing genotipe tersebar hampir diseluruh dunia. Salah satunya adalah Genotipe B dan C yang dominan di wilayah Asia Timur dan Tenggara. Keragaman genetik genom VHB berfungsi sebagai alat untuk memberikan petunjuk dalam epidemiologi penyakit, menyelidiki adanya mutasi, pengembangan klinis, prognosis dan untuk melihat respon terhadap pengobatan antivirus (Q. & G., 2011; Chook et al., 2015).
2.1.1.4 Siklus Hidup Virus Hepatitis B
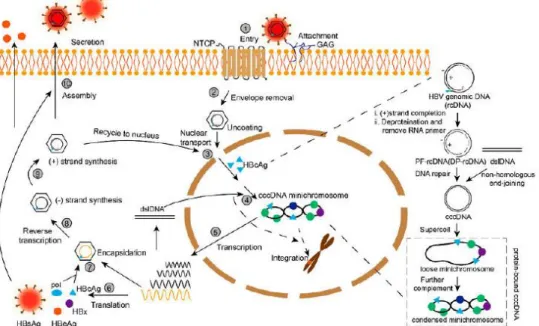
Siklus hidup VHB dimulai dari penempelan protein selubung virus yaitu Glikosaminoglikan (GAG) pada reseptor sel inang (hepatosit) yaitu Natrium Taurocholate Cotransporting Polypeptide (NTCP). Setelah reseptor mengenali virus, kemudian virus masuk ke dalam sel dan terjadi pelepasan amplop dan
nukleokapsid virus dilepaskan ke sitoplasma. Nukleokapsid virus masuk ke dalam inti sel dan terjadi pelepasan relaxed circular DNA (rcDNA). Kemudian rcDNA dikonversi menjadi covalently closed circular DNA (cccDNA). Awalnya, rcDNA yang masuk ke dalam inti sel mengisi celah dalam untai positif dan menghilangkan pol dan RNA primer dari 5′-terminal dari untai negatif dan positif untuk membentuk protein-free (PF)-rcDNA, yang juga disebut deproteinized-rcDNA (DP-rcDNA). Ujung dari kedua untai PF-rcDNA selanjutnya diikat untuk membentuk cccDNA. Selain itu, sebagian kecil cccDNA disintesis dari double-stranded linear DNA (dslDNA) oleh Non-Homologous End Join (NHEJ). Untuk lebih jelasnya, dapat dilihat Gambar 2.3 di bawah ini.
Sumber : Li et al., 2017
Gambar 2.3 Siklus Replikasi VHB dimulai dengan penempelan virus pada sel hepatosit, kemudian masuk ke dalam sel melalui endositosis, selubung amplop terlepas, genom virus masuk ke inti sel, terjadi perubahan DNA untai ganda, pembentukan DNA untai negatif dan positif, nukleokapsid bermigrasi ke retikulum endoplasma, virus keluar dan menginfeksi sel hepatosit lain
Kemudian cccDNA yang terbentuk dibungkus oleh histon membentuk struktur kromatiniasi episom. Episomal cccDNA dibentuk menjadi minikromosom yang berfungsi sebagai templat transkripsi untuk selanjutnya diterjemahkan ke dalam protein virus yang berbeda (EASL, 2017). Tahap selanjutnya adalah transkripsi virus menjadi mRNA. cccDNA digunakan sebagai cetakan untuk proses transkripsi virus. Ada tiga jenis mRNA hasil transkripsi, yaitu RNA pre-genomik (pgRNA), pre-core mRNA, dan komponen mRNA virus. Kemudian dilakukan translasi protein VHB menjadi Hepatitis B surface Antigen (HBsAg), Hepatitis B envelope Antigen (HBeAg), Hepatitis B core Antigen (HBcAg), protein VHB X (HBx) dan polimerase (pol).
Tahap selanjutnya adalah terjadi proses enkapsulasi yang melibatkan pgRNA, pol dan HBcAg. pgRNA dilingkupi oleh protein inti virus (HBcAg) dan ditranskripsi balik oleh enzim reverse transcriptase virus membentuk untai tunggal DNA untai negatif. Kemudian pgDNA didegradasi dan untai DNA negatif tersebut digunakan untuk cetakan DNA untai positif. Pada akhirnya rangkaian yang mengandung rcDNA dengan HBsAg membentuk virion kemudian keluar dari sel dan menginfeksi sel hepatosit lain (Neuveut, Wei and Buendia, 2010; Jayalakshmi, Kalyanaraman and Pitchappan, 2013; Li et al., 2017).
2.1.1.5 Hepatitis B core Antigen
Hepatitis B core Antigen (HBcAg) adalah salah satu marker untuk identifikasi infeksi VHB. HBcAg dapat ditemukan di dalam darah, serum, dan inti dari sel Hepatosit. HBcAg dapat dideteksi di dalam serum karena Partikel Dane
yang mengandung nukleokapsid virus dilepaskan dalam sirkulasi darah pasien. Dengan demikian, jumlah HBcAg akan mencerminkan viral load dan berkorelasi dengan jumlah DNA VHB.
Antigen inti (HBcAg) VHB adalah konstituen utama dari nukleokapsid yang berbentuk simetri ikosahedral. HBcAg ini penting untuk replikasi virus, terdiri dari 183-185 asam amino tergantung pada genotipe virus (Jayalakshmi, Kalyanaraman and Pitchappan, 2013). Protein HBcAg terdiri dari tiga bagian yaitu domain ujung amino, yang digunakan untuk membangun sebagian besar kapsid (1-140 residu), domain ujung karboksi, untuk pengikatan RNA/DNA (150-183 residu), dan 10 residu linkler di antara keduanya (141-149 residu) (Liu et al., 2011). Metode deteksi yang paling berguna adalah ELISA untuk antigen dan antibodi HBC, serta PCR untuk deteksi DNA virus.
Sumber : Wynne, Crowther, & Leslie, 1999
Gambar 2.4 Nukleokapsid HBcAg
2.1.2 Isolasi DNA Virus Hepatitis B
Isolasi DNA adalah proses ekstraksi DNA dari berbagai sumber. DNA VHB dapat berasal dari darah, serum, dan sel Hepatosit. Pada penelitian ini, DNA yang
diisolasi berasal dari serum penderita Hepatitis B. Metode yang digunakan untuk mengisolasi DNA tergantung pada sumber, usia, dan ukuran sampel. Meskipun beragam metode yang digunakan, pada dasarnya langkah isolasi yang dilakukannya sama. Langkah-langkah dasar isolasi DNA terbagi menjadi tiga fase utama. Fase pertama adalah destruksi struktur sel untuk membuat lisat. Fase kedua adalah dilakukan pemisahan DNA yang larut dari sel debris dan bahan tidak larut lainnya. Fase ketiga adalah pemurnian DNA target dari protein dan asam nukleat lainnya. Tujuan isolasi DNA ini adalah memurnikan DNA sampel dengan meminimalkan gangguan dari DNA non-target dan kontaminan lainnya sehingga tidak mengganggu metode analisis DNA terutama menggunakan PCR serta meningkatkan stabilitas sampel dalam penyimpanan jangka panjang (Kizirian, Phillips, Prendini, & Wyner, 2002; Promega, 2014a; Cengage, 2019).
2.1.3 Polymerase Chain Reaction (PCR)
Polymerase Chain Reaction (PCR) adalah teknik dasar untuk biologi molekuler dan merupakan teknik genetik secara in vitro yang digunakan untuk amplifikasi spesifik fragmen DNA target dari sumber DNA yang rendah atau RNA (setelah ditranskripsi balik menjadi cDNA) secara eksponensial. DNA disintesis dengan cara yang sama seperti in vivo menggunakan DNA polimerase, yaitu enzim yang digunakan sel untuk mereplikasi DNA. Salah satu keunggulan PCR adalah urutan target bisa diamplifikasi dari satu salinan materi awal, bahkan ketika templat terdegradasi dan terkontaminasi dengan inhibitor (Stephenson &
Abilock, 2012; Kalendar, Lee and Schulman, 2014; Ehtisham, Wani, Wani, Kaur, & Nissar, 2016).
Terdapat beberapa tipe dan modifikasi dari PCR diantaranya yaitu Nested PCR, Multiplex PCR, Reverse Transcription PCR (RT-PCR), Hot-Start PCR, Touchdown PCR, dan Real-Time PCR (qPCR) (Rahman et al., 2013). Nested PCR adalah modifikasi PCR yang dirancang untuk meningkatkan sensitivitas dan spesifisitas dengan melibatkan penggunaan dua set primer dan dua reaksi PCR berturut-turut. Set primer pertama digunakan dalam reaksi PCR awal. Amplikon yang dihasilkan dari reaksi PCR pertama digunakan sebagai templat untuk set primer kedua dan langkah amplifikasi kedua. Multiplex PCR adalah amplifikasi simultan lebih dari satu urutan target dalam tabung reaksi tunggal menggunakan lebih dari satu pasangan primer. Ko-amplifikasi dua target atau lebih dalam satu reaksi bergantung pada kompatibilitas primer PCR yang digunakan dalam reaksi. Semua primer dalam reaksi harus memiliki suhu leleh yang sama (Tm). (Carr, Williams and Hayden, 2010). Reverse Transcription PCR (RT-PCR) adalah variasi PCR standar yang melibatkan amplifikasi mRNA spesifik yang diperoleh dari sampel kecil. Enzim reverse transcriptase dan sampel RNA ditambahkan ke dalam RT-PCR di samping reagen PCR standar. Hot-Start PCR ini membuat modifikasi pada DNA polimerase untuk memblokir amplifikasi dan tetap tidak aktif sampai suhu yang lebih tinggi tercapai. Hot-Start DNA polimerase akan tetap tidak aktif pada suhu kamar karena enzim hot-start telah ditambahkan (Merck, 2020). Touchdown PCR menggunakan program siklus dengan suhu annealing yang bervariasi. Ini adalah metode yang berguna untuk meningkatkan
spesifisitas PCR. Suhu annealing pada siklus awal harus 5-10°C di atas Tm dari primer. Dalam siklus berikutnya, suhu annealing menurun dalam langkah 1-2°C per siklus sampai mencapai suhu yang sama dengan Tm atau 2-5°C di bawah Tm dari primer (Qiagen, 2013). Untuk Real-Time PCR akan dijelaskan lebih lanjut pada subab berikutnya.
PCR terdiri dari siklus reaksi pemanasan dan pendinginan. Suhu digunakan untuk mengontrol setiap tahap reaksi yang dilakukan dan waktu inkubasinya tergantung pada alat (Thermal cycler) dan reagen. Hal tersebut harus dioptimalkan untuk setiap percobaan, terutama untuk peningkatan sensitivitas deteksi (Bergkvist et al., 2012).
Tahapan penting dalam proses PCR adalah sebagai berikut. 1) Tahap Denaturasi
Tahap pertama pada proses PCR adalah denaturasi DNA sampel dengan menaikkan suhu dalam thermal cycler 94-98°C tergantung pada aktivitas DNA polimerase dan jumlah basa G+C dari DNA templat. Reaksi diinkubasi selama 2-5 menit untuk memastikan bahwa DNA untai ganda terpisah menjadi dua untai tunggal. Suhu tinggi menyebabkan ikatan hidrogen antar basa lemah dan akhirnya terpisah, sedangkan ikatan antara deoksiribosa dan fosfat, yang merupakan ikatan kovalen lebih kuat dan tetap utuh. Waktu inkubasi yang terlalu lama dapat menonaktifkan DNA polimerase dan menghancurkan aktivitas enzimatiknya (Lorenz, 2012; Bergkvist et al., 2012).
Sumber : Roche, 2006
Gambar 2.5 Tahap Denaturasi
2) Tahap Penempelan (Annealing)
Tahap kedua pada sistem amplifikasi PCR adalah annealing, merupakan penempelan suatu primer terhadap urutan komplementer pada DNA target. Tujuannya bukan untuk mereplikasi seluruh untai DNA tetapi untuk mereplikasi urutan nukleotida yang khas untuk organisme. Primer menentukan ujung urutan target tersebut. Tahapan ini bergantung pada panjang untai DNA, banyaknya kandungan G+C, dan konsentrasi primer itu sendiri. Reaksi diinkubasi selama 30 detik hingga 1 menit, pada suhu 45-60°C. Semakin panjang ukuran primer, semakin tinggi suhunya (Roche, 2006; Nurhayati and Darmawati, 2017).
Amplifikasi lebih efisien jika suhu annealing tidak kurang dari 37ºC agar tidak terjadi penempelan primer pada tempat yang salah (mispriming). Suhu Annealing yang biasanya digunakan adalah 55ºC. Optimalisasi suhu annealing penting dilakukan untuk menghasilkan produk PCR yang mempunyai spesifisitas tinggi. Primer akan menempel pada urutan nukleotida yang sesuai dengan urutan primer tersebut serta menempel pada posisi ujung-5’dari untai DNA target yang telah terurai pada tahap denaturasi (Blirt, 2016; Nurhayati and Darmawati, 2017).
Sumber : Roche, 2006
Gambar 2.6 Tahap Annealing
3) Tahap Ekstensi/Elongasi
Setelah primer menempel pada urutan DNA komplementer, suhu dinaikkan sekitar 72-78°C dan Taq DNA polymerase mulai mensintesis molekul DNA untai ganda baru yang identik dengan DNA target asli. Suhu optimal untuk sintesis DNA dapat sedikit berbeda tergantung pada DNA polimerase yang digunakan. Proses pemanjangan untai baru DNA dimulai dari posisi primer yang telah menempel di urutan nukleotida DNA target yang akan bergerak dari ujung 5’ menuju ujung 3’ dari untai tunggal DNA. Proses elongasi DNA sesuai dengan panjang urutan basa nukleotida yang ditargetkan (Joshi and Deshpande, 2011).
Sumber : Roche, 2006
Gambar 2.7 Tahap Ekstensi
Pada akhir siklus PCR pertama, dihasilkan dua untai DNA baru identik dengan DNA target asli. Selanjutnya tahap denaturasi sampai tahap ekstensi dilakukan dengan siklus proses PCR yang tepat, biasanya antara 30 sampai 40
Primer
siklus yang menghasilkan amplifikasi eksponensial dari amplikon hingga satu miliar salinan target hanya dalam beberapa jam. Semua tahapan berlangsung dalam thermal cycler, sebuah instrumen yang secara otomatis mengontrol siklus pemanasan dan pendinginan yang diperlukan untuk PCR (Roche, 2006).
Sumber : Roche, 2006
Gambar 2.8 Akhir dari Siklus Pertama PCR : dua salinan urutan DNA Target
2.1.4 Real-Time PCR
Real-Time PCR (qPCR) bisa menjadi alat dalam menilai viral load dan memantau terapi untuk Virus Hepatitis B (VHB) (McPherson and Pincus, 2017). Real-Time PCR memiliki tahapan yang sama seperti PCR pada umumnya, yakni denaturasi, annealing, dan ekstensi/elongasi. Perbedaanya terdapat pada saat pembacaan hasil amplifikasi PCR. Pada qPCR, setiap reaksi ditambahkan senyawa yang dapat memancarkan fluoresen. Peningkatan sinyal fluoresen berbanding lurus dengan produk PCR (amplikon) yang dihasilkan. Sinyal fluoresen dari setiap reaksi dengan menggunakan qPCR kemudian dikonversi menjadi nilai numerik (Thermofisher Scientific, 2016; Primer Digital, 2017).
2.1.4.1 Real-Time PCR dengan Metode DNA-binding Dyes
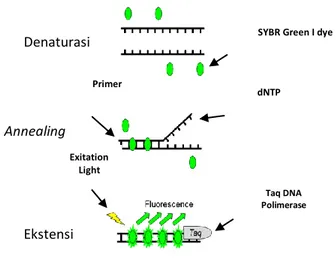
Terdapat berbagai jenis pewarna (dye) dengan metode DNA-binding Dyes, yang paling umum digunakan adalah SYBR® Green I. Metode ini masih banyak
digunakan karena biaya yang rendah, sederhana, dan pengaplikasiannya yang fleksibel dibandingkan dengan opsi lain. Prinsip dari metode ini adalah pewarna berinterkalasi secara non-spesifik dengan DNA untai ganda, sehingga dapat menghasilkan fluoresensi. Sinyal fluoresensi semakin meningkat seiring dengan semakin banyak amplikon yang terbentuk selama proses PCR yang dapat dipantau secara Real-Time. Pewarna yang tidak berikatan dengan untai ganda DNA maka tidak akan berfluoresensi sehingga tidak ada sinyal yang ditangkap oleh detektor alat (Qiagen, 2010; Kim, Lim, & Lee, 2013). Untuk lebih jelasnya perhatikan Gambar 2.9 berikut.
Sumber : Kim, Lim, & Lee, 2013
Gambar 2.9 Metode Deteksi SYBR Green I Dyeuntuk qPCR
2.1.4.2 Real-Time PCR dengan Metode Probe Fluoresensi
Real-Time PCR dengan Metode Probe Fluoresensi terdiri dari beberapa jenis, yakni probe primer (Amplifluor, LUX, Cyclicons), probe hidrolisis (TaqMan, MGB-TaqMan, Snake Assay) dan hibridisasi (FRET, HyBeacon, ResonSense) dan analog asam nukleat (PNA, LNA, basa tidak alami: Tiny-Molecular Beacon). Tidak seperti pewarna DNA-Binding Dyes yang mendeteksi
Primer
SYBR Green I dye
Taq DNA Polimerase dNTP Exitation Light Denaturasi Annealing Ekstensi
semua DNA untai ganda, metode probe ini menggunakan probe target spesifik berlabel fluoresen yang menghasilkan peningkatan spesifitas dan sensitivitas. Untuk lebih jelasnya perhatikan Gambar 2.10 berikut.
Sumber : Kim, Lim, & Lee, 2013
Gambar 2.10 Metode Deteksi TaqMan Probeuntuk qPCR
Keuntungan probe fluorogenik dibandingkan pewarna DNA-Binding Dyes adalah hibridisasi spesifik antara probe dan DNA target diperlukan untuk menghasilkan sinyal fluoresens, maka amplifikasi non-spesifik seperti mispriming atau dimer primer tidak akan terdeteksi karena tidak menghasilkan sinyal. Selain itu, probe dapat diberi label dengan pewarna reporter berbeda, sehingga amplifikasi dua sekuens berbeda dapat dilakukan dalam satu reaksi PCR. Adapun kerugian dari probe fluorogenik ini adalah probe harus disintesis untuk mendeteksi urutan yang berbeda (Kim, Lim, & Lee, 2013).
Ekstensi
Sinyal Reporter Sinyal Quencher
Denaturasi
2.1.5 Komponen Real-Time PCR 2.1.5.1 Templat DNA
Templat DNA berisi sampel DNA genomik dari pasien yang dapat digunakan dalam bentuk untai tunggal atau untai ganda untuk dilipatgandakan. Real-Time PCR hanya membutuhkan satu salinan dari urutan target sebagai templat DNA (Ehtisham et al., 2016).
2.1.5.2 Primer
Primer adalah bagian pendek, untai tunggal dari DNA yang melekat dengan urutan komplementer pada templat DNA target. Sepasang primer akan mengikat kedua sisi fragmen DNA target yang menyediakan situs inisiasi untuk sintesis DNA. Dua primer yang digunakan dalam PCR dikenal dengan istilah forward dan reverse primer (Stephenson and Abilock, 2012).
Primer dirancang sedemikian rupa sehingga mampu mengikat target yang diperlukan. Kriteria umum merancang primer yang baik adalah berukuran 18 – 30 basa, mengandung 40 - 60% G+C dan untuk kedua primer tersebut sebaiknya sama. Sekuens DNA dalam masing-masing primer juga sebaiknya tidak saling berkomplemen, karena hal ini akan mengakibatkan terbentuknya struktur sekunder dan mengurangi efisiensi PCR. Selain itu, pemilihan Temperature melting (Tm) suatu primer sangat penting karena Tm akan berpengaruh sekali dalam pemilihan suhu annealing proses PCR. Sebaiknya Tm primer berkisar antara 50–65°C tergantung dari komposisi primer dan panjang primer. Secara teoritis, Tm primer dapat dihitung dengan menggunakan rumus
[2(A+T)+4(C+G)]. Namun hasil perhitungan biasanya kurang akurat, tetap harus melakukan optimasi. Urutan primer yang optimal dan konsentrasi primer yang tepat sangat penting untuk spesifisitas maksimal dan efisiensi dalam proses PCR (Promega, 2019; Qiagen, 2019).
2.1.5.3 Deoksinukleotida trifosfat (dNTP)
Deoksinukleotida trifosfat (dNTP) adalah basa nukleotida yang ditambahkan ke untai DNA dengan bantuan DNA polimerase. Konsentrasi setiap dNTP dalam campuran reaksi biasanya 200 μM. Sangat penting untuk memiliki konsentrasi yang sama dari setiap dNTP (dATP (deoksiadenosin trifosfat), dTTP (deoksitimidin trifosfat), dCTP (deoksisitidin trifosfat) dan dGTP (deoksiguanosin trifosfat)) karena ketidakakuratan dalam konsentrasi bahkan satu dNTP saja akan meningkatkan tingkat penggabungan yang salah (Ruddock, 2016).
2.1.5.4 DNA Polimerase
DNA polimerase yaitu enzim yang bersifat termostabil sehingga dapat bertahan pada suhu denaturasi dan sangat penting untuk mengkatalisis reaksi sintesis rantai DNA. Awalnya, DNA polimerase yang digunakan adalah fragmen Klenow dari Escherichia coli pol I. Enzim ini menjadi tidak aktif pada suhu tinggi, yaitu pada tahap denaturasi dan harus ditambahkan zat baru dalam setiap langkah denaturasi. Oleh karena itu, enzim diganti dengan DNA polimerase yang termostabil, yaitu Taq DNA polimerase yang diisolasi dari bakteri termofilik, yaitu Thermus aquaticus (Ehtisham et al., 2016).
2.1.5.5 Buffer PCR dan Magnesium klorida (MgCl2)
Buffer adalah larutan yang tahan terhadap perubahan pH. Ini digunakan untuk memastikan bahwa DNA polimerase berada dalam lingkungan yang tepat sehingga memiliki aktivitas maksimum serta membantu juga dalam proses annealing (Stephenson and Abilock, 2012). Buffer ini terdiri atas 50 mM KCl, 10 - 50 mM Tris-Cl (pH 8,3 - 8,8), dan 1,5 - 5,5 mM MgCl2. MgCl2 diperlukan
sebagai kofaktor untuk aktivitas DNA Polimerase. Dengan adanya MgCl2 ini akan
meningkatkan interaksi primer, templat DNA dan dNTP (Viljoen et al., 2015). MgCl2 akan bekerja optimal jika konsentrasi yang digunakan telah sesuai.
Konsentrasi MgCl2 yang rendah dapat membantu menghilangkan produk PCR
non-spesifik yang tidak diinginkan, tetapi produk PCR yang dihasilkan rendah. Konsentrasi MgCl2 yang tinggi dapat membantu menstabilkan interaksi primer
dengan templat DNA target, tetapi dapat mengakibatkan pembentukan produk PCR yang tidak spesifik dan mispriming (Ruddock, 2016).
2.1.5.6 Reagen Master Mix Kit Komersial
Master Mix adalah reagen untuk PCR kuantitatif (qPCR). Reagen ini dapat mudah didapatkan karena telah tersedia dalam Kit Komersial. Sistem ini mengandung pewarna DNA fluoresen dan BRYT Green Dye. Selain itu, reagen ini mudah digunakan dan distabilkan karena mencakup semua komponen untuk qPCR, yaitu Taq DNA polymerase, dNTP, MgCl2 dan buffer reaksi pada
konsentrasi optimal untuk amplifikasi efisien templat DNA oleh PCR, primer dan Nuclease Free Water (NFW) (Promega, 2014b).
2.1.5.7 Instrumen Thermal Cycler
Untuk pengujian PCR diperlukan alat yang disebut Thermal Cycler, ada yang Konvensional dan ada yang Real-Time. Dalam studi literatur ini, Thermal Cycler yang digunakan bersifat Real-Time. Alat ini mengukur sampel selama fase Eksponensial dari reaksi PCR. Label fluoresen ditambahkan ke dalam reaksi PCR. Kemudian alat tersebut akan memonitor campuran reaksi dan mengukur fluoresensi pada setiap siklus amplifikasi tidak hanya pada titik akhir. Hasil akhir dalam protokol PCR ini adalah visualisasi dan kuantifikasi amplifikasi DNA. Tanpa alat ini, proses PCR akan memakan waktu yang lama dan membutuhkan instrumentasi tambahan serta kapasitas untuk deteksi pun terbatas. Selain itu, konsentrasi DNA yang sangat rendah kadang-kadang sulit untuk divisualisasikan (Healthcare, 2010; Yilmaz et al., 2012).
2.1.6 Optimasi Real-Time PCR
Optimalisasi kondisi Real-Time PCR penting untuk pengembangan pengujian yang baik. Indikasi optimasi yang buruk adalah kurangnya reproduksibilitas antar ulangan serta tes yang tidak efisien dan tidak sensitif. Dalam berbagai metode pemeriksaan, optimasi penting dilakukan bahkan ketika menggunakan tes komersial atau tes yang telah dirancang sebelumnya. Optimasi bertujuan untuk menentukan berapa konsentrasi optimal dari setiap komponen campuran reaksi untuk menjamin amplifikasi spesifik dan efisien dari proses PCR. Dua pendekatan utama adalah optimasi suhu annealing dan konsentrasi primer (Handoyo and Rudiretna, 2001; Bergkvist et al., 2012; Blirt, 2016).
2.1.6.1 Optimasi Suhu Annealing
Salah satu pendekatan optimasi pengujian adalah menentukan suhu annealing optimal (Ta) dari proses PCR (Bergkvist et al., 2012). Ta dapat ditentukan dengan menghitung Temperature melting (Tm). Ta biasanya 3-5°C lebih rendah dari Tm primer tersebut dan waktu inkubasi yang diperlukan sekitar 0,5-2 menit (Thermofisher Scientific, 2016). Tajuga dapat dihitung dengan rumus lainnya sesuai dengan desain primer yang digunakan. Akan tetapi, suhu yang dihasilkan dari perhitungan-perhitungan tersebut tidak selalu tepat untuk mencapai performa pengujian terbaik.
Suhu annealing dapat mempengaruhi efektivitas dan spesifisitas PCR. Jika suhu annealing tidak sesuai, amplifikasi PCR akan gagal sepenuhnya. Untuk menghindari terjadinya ikatan yang tidak spesifik antara primer dengan Templat DNA, perlu dilakukan optimasi terhadap proses PCR (Blirt, 2016; Thermofisher Scientific, 2016). Optimasi dilakukan dengan memulai reaksi suhu anneling terendah dari rentang suhu yang diujikan. Kemudian, reaksi dilanjutkan secara bertahap pada suhu yang lebih tinggi. Hasil optimasi dapat dilihat dengan analisis kurva Cycle threshold (Ct)untuk melihat efisiensi pengujian.
2.1.6.2 Optimasi Konsentrasi Primer
Optimasi konsentrasi primer juga penting dilakukan karena konsentrasi yang tidak tepat mengarah pada pengikatan primer non-spesifik yang dapat mengakibatkan hasil negatif palsu dan mengurangi sensitivitas reaksi PCR (Gunson, Gillespie and Carman, 2003; Bergkvist et al., 2012). Penilaian
keberhasilan pengujian Real-Time PCR salah satunya dapat dilakukan dengan analisis Cycle threshold (Ct). Keberhasilan pengujian ditunjukan dengan penurunan nilai Ct pada saat penambahan konsentrasi yang tepat. Analisis tersebut dapat digunakan untuk menilai spesifisitas reaksi (Gunson, Gillespie and Carman, 2003; Xiaowei and Seed, 2006).
2.1.7 Analisis hasil Optimasi berdasarkan Kurva Cycle threshold (Ct)
Analisis data yang tepat sangat penting agar hasil yang didapatkan valid dan relevan pada eksperimen yang dilakukan, termasuk dalam pengujian dengan metode Real-Time PCR (qPCR). Salah satu metode yang digunakan untuk analisis hasil adalah Kurva Cycle threshold (Ct). Ct didefinisikan sebagai siklus ketika sinyal fluoresen dari reaksi PCR berpotongan dengan garis threshold yang ditentukan.
Sumber : Rodríguez-Lázaro, Cook, & Hernández, 2013 Gambar 2.11 Fase kurva amplifikasi PCR. Garis Merah: kurva amplifikasi sampel positif.
Garis Biru: Threshold. Hitam: siklus baseline
Nilai Ct dipengaruhi oleh pengaturan threshold dan baseline yang digunakan. Baseline dalam qPCR menunjukkan tingkat sinyal yang muncul pada
saat siklus awal PCR. Sedangkan threshold adalah batas level sinyal fluoresen dari reaksi yang meningkat secara signifikan diatas sinyal baseline yang terhitung (Bio-Rad laboratories, 2006; Thermofisher Scientific, 2016). Pengujian yang optimal dapat dilihat dengan pembuatan kurva standar dengan menganalisis kurva amplifikasi. Dalam Gambar 2.11, jumlah siklus PCR ditunjukan dengan sumbu x, dan fluoresensi dari reaksi amplifikasi (sebanding dengan jumlah produk dalam tabung) ditunjukkan pada sumbu y. Kurva amplifikasi menunjukkan tiga fase, yaitu fase inisiasi, fase eksponensial diikuti oleh fase dataran tinggi non-eksponensial atau fase plateau. Selama fase eksponensial, jumlah produk PCR sekitar dua kali lipat dalam setiap siklus. Nilai Ct berbanding terbalik dengan jumlah awal target. Jika jumlah templat pada awal reaksi banyak maka siklus yang dibutuhkan menjadi sedikit ditandai dengan pemberian sinyal fluoresensi yang rendah sehingga didapatkan nilai Ct yang rendah, begitupun sebaliknya.
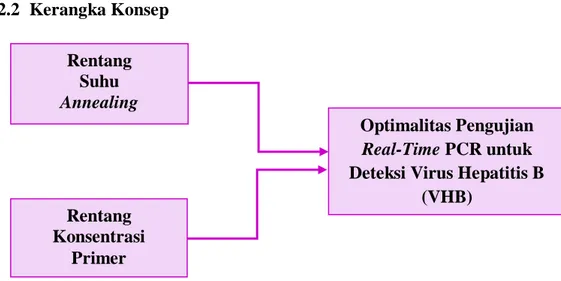
2.2 Kerangka Konsep
Gambar 2.12 Kerangka Konsep
Optimalitas Pengujian
Real-Time PCR untuk
Deteksi Virus Hepatitis B (VHB) Rentang Suhu Annealing Rentang Konsentrasi Primer