BAB II. TINJAUAN PUSTAKA
2.1 Industri Pertambangan
Air asam tambang adalah salah satu permasalahan lingkungan yang
dihasilkan oleh industri pertambangan. Air asam tambang merupakan hasil dari
oksidasi batuan yang mengandung pirit (FeS2) dan mineral sulfida dari sisa batuan
yang terpapar oleh oksigen yang berada dalam air (Elberling.et.al, 2008).
Permasalahan air asam tambang adalah salah satu dampak potensial yang dihadapi
industri pertambangan. Air asam tambang juga mengandung logam berat seperti
besi (Fe), alumunium (Al), mangan (Mn). Kesalahan dalam pemantauan,
pengumpulan dan pengolahan air asam tambang dapat menyebabkan kontaminasi
terhadap air tanah dan air permukaan yang berdampak kepada ekosistem, manusia
dan struktur bangunan (MEND Program, 1997).
Seperti diketahui beberapa komponen atau kegiatan pertambangan
menghasilkan dampak yang serius terhadap lingkungan. Kolam tailing (tailing
impoundment) dan penempatan batuan sisa (waste rock piles) merupakan bagian
yang harus benar-benar diperhatikan karena menghasilkan dampak negatif
terhadap saluran air, tanah dan air permukaan (Bussiere, 2009).
Langkah pertama yang digunakan untuk mengelola air asam tambang
adalah dengan mengetahui sumber produksi pembentuk potensial asam. Produksi
potensial asam umumnya berasal dari penilaian melalui sisa batuan (waste rock)
yang dianalisis, dimana dapat dibagi atas 2 kategori analisis, yaitu analisis statis
atau analisis dinamis atau kinetik. Dalam tes statis, seluruh analisis batuan
mineral – mineral spesifik yang terdiri dari batuan sisa akan bereaksi dengan air
akan menghasilkan tingkat asam atau basa yang bervariasi. Alternatif lain adalah
test dinamis yang secara empiris menentukan kualitas lindi berdasarkan subjek
batuan sampel yang disimulasikan dengan proses pelapukan dan pemantauan
kualitas efluen yang dihasilkan. Masing – masing teknik mempunyai kelebihan
dan kekurangan satu dengan yang lainnya (Bradham dan Carrucio, 1990).
2.2 Air Asam Tambang (AAT)
Air asam tambang (AAT) dihasilkan di atau dalam sisa batuan, tailing,
dinding pit tambang terbuka dan tambang bawah tanah. Mineral sulfida seperti
pirit teroksidasi dan hadir di air dan udara melalui oksigen yang menghasilkan air
asam tambang melalui proses kimia dan biokimia. Oksidasi mineral sulfida dapat
dideskripsikan dengan persamaan (Morin and Hutt, 1997 dalam Bussiere, 2009)
dengan langkah pertama terjadinya oksidasi langsung dari pirit (FeS2) oleh
oksigen yang menghasilkan sulfat (SO42-), ferrous iron (Fe2+) dan keasaman (H+) :
2FeS2 + 7O2 + 2H2O = 2Fe2+ + 4SO42- + 4H+ (1)
Reaksi selanjutnya ferrous iron teroksidasi menjadi ferric iron (Fe3+).
2Fe2+ + 1/2O2 + 2H+ = 2Fe3+ + H2O (2)
Ferrous iron juga dapat teroksidasi menghasilkan iron hidroksida
(FeOOH) dan keasaman.
Fe2+ + 1/4O2 + 3/2H2O = FeOOH + 2H+ (3)
Pada saat pH > 4, Fe3+ akan terendapkan sebagai ferric hidroksida
(Fe(OH)3), lepas ke lingkungan dengan sangat asam.
Pada saat pH < 4, Ferric iron akan larut dan mengoksidasi pirit secara
langsung dan melepas asam kesekelilingnya dengan bebas.
FeS2 + 14Fe3+ + 8H2O = 15Fe2+ + 2SO42- + 16H+ (5)
Secara keseluruhan reaksi oksidasi pirit dapat diperlihatkan sebagai
berikut :
FeS2 + 15/4O2 + 7/2H2O = Fe(OH)3 + 2H2SO4 (6)
Oksidasi 1 mol pirit akan menghasilkan 2 mol asam sulfur. Secara umum
pertimbangan literatur (Aubertin et al, 2002 dalam Bussiere 2009) bahwa oksidasi
oleh oksigen (persamaan 1) berlangsung pada pH netral (5 < pH > 7), sementara
itu oksidasi tidak langsung (Persamaan 5) lebih dominan pada pH rendah (pH <
3). Persamaan diatas berdasarkan pada persamaan stoikiometri tanpa
mempertimbangkan kondisi kinetik setiap reaksi. Seperti nilai rata-rata oksidasi
sebagai fungsi faktor penambah (Jerz dan Rimstidt, 2004 dalam Bussiere, 2009),
supply oksigen, temperatur, pH, aktivitas bakteri, luas paparan. Pertimbangan
secara umum rata-rata reaksi dikontrol oleh (persamaan 2). Rata-rata reaksi
berjalan lambat pada pH rendah, tetapi meningkat dengan cepat dan menurunkan
pH karena adanya bakteri. Contohnya Acidithiobaccilus ferrooxidans sebagai
katalisator reaksi oksidasi ferrous iron menjadi ferric iron.
Kualitas kimia dari drainase juga tergantung dari mineral lain yang ada di
batuan sisa. Asam dapat bereaksi dengan penetral oleh karbonat dan mineral
sillicate, yang dapat dipertimbangkan sebagai penetral utama adalah calcite
(CaCO3) dan dolomite (CaMg(CO3)2) (Lapakko,1992).
2CaCO3 + H2SO4 = 2Ca2+ + 2HCO3- + SO42- (7)
Persamaan diatas memperlihatkan bahwa 2 mol calcite dan 1 mol dolomit
dibutuhkan untuk menetralkan 1 mol asam sulfur. Kapasitas mineral penetral
untuk membatasi pembentukan air asam tambang juga tergantung kepada faktor
yang berbeda beda untuk mempengaruhi proses reaksi seperti : temperatur, pH,
tekanan, permukaan mineral.
Ketika potensi penetral kurang dari potensial pembentukan asam, air asam
tambang akan terjadi dan diperlukan pengukuran yang akurat dan tindakan
mitigasi. Beberapa tahun terakhir, beberapa teknik telah diajukan untuk
membatasi dampak air asam tambang terhadap lingkungan. Salah satu pendekatan
yang dikembangkan untuk mengontrol produksi air asam tambang dari tailing
dan batuan sisa adalah dengan mengeliminasi atau menghilangkan satu atau lebih
dari 3 komponen utama reaksi oksidasi yaitu : oksigen, air dan mineral sulfida.
Beberapa metode yang dikembangkan adalah :
a. Ekstraksi sulfida
Kehadiran mineral sulfida adalah esensi utama pembentukan air asam
tambang. Air asam tambang dapat dikontrol dengan melakukan ekstraksi mineral
sulfida sehingga membatasi pembentukan air asam tambang di lingkungan.
Recovery atau penyimpanan mineral sulfida yang diperlukan tergantung kepada
jumlah mineral penetral. Teknik yang berbeda dapat digunakan seperti flotasi dan
pemisahan dengan gravimetri dapat digunakan untuk memisahkan sulfida dari
tailing (Bussiere, 1998). Metode kontrol seperti ini secara umum sangat aplikatif
b. Hambatan oksigen / oxygen barriers
Oksigen merupakan salah satu komponen kunci terhadap pembentukan air
asam tambang. Membatasi kemampuan oksigen bereaksi pada batuan sisa adalah
salah satu teknik yang paling sering digunakan untuk mengontrol air asam
tambang, terutama pada daerah lembab (MEND, 2008). Pendekatan yang berbeda
dapat digunakan untuk menghambat oksigen dengan cara menempatkan pelindung
air dan megatur elevasi air tanah.
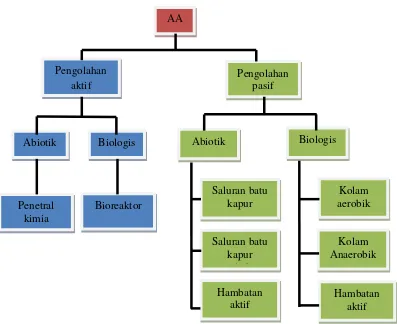
2.3 Pengolahan Air Asam Tambang
Pemilihan pengolahan air asam tambang dikategorikan atas 2 yaitu
pengolahan pasif dan pengolahan aktif. Pengolahan yang paling umum digunakan
adalah dengan metode mengolah debit air asam tambang dengan pengolahan aktif
dimana pengolahan menggunakan kimia penetral yang ditambahkan terus
menerus ke air asam tambang. (Johnson and Hallberg, 2005 dalam Newcombe,
2009). Proses penetralan air asam tambang ini akan mengendapkan logam-logam
terlarut dan akan membentuk selimut lumpur (sludge blanket). Kelemahan dari
pengolahan aktif ini adalah memerlukan biaya yang besar dan memindahkan atau
membuang selimut lumpur yang mengandung logam.
Pemilihan metode pasif dalam pengolahan air asam tambang dibandingkan
dengan pengolahan secara aktif mempunyai kelebihan terutama dari segi
perawatan dan biaya yang lebih rendah. Sistem pengolahan pasif hanya
memerlukan perawatan dan penggantian secara periodik.
Gambar 2.1 dibawah ini memperlihatkan beberapa alternatif pemilihan
Gambar 2.1 Pemilihan pengolahan air asam tambang (amd), Johnson and Hallberg, 2005a Dalam Newcombe (2009)
2.4 Metoda Successive Alkalinity Producing System (SAPS)
Successive Alkalinity Producing System (SAPS) merupakan salah satu
metode pengolahan pasif air asam tambang yang terdiri atas lapisan bahan organik
dan batu kapur. Keduanya disusun secara vertikal dengan ketebalan tertentu. Air
asam tambang yang diolah akan mengalir secara vertilal ke dalam sistem
berdasarkan tekanan gravitasi hidrolik.
Pada sistem SAPS terdapat dua proses utama yang menyebabkan
terjadinya Peningkatan pH dan reduksi logam, yakni larutnya batu kapur dan
reduksi sulfat secara biologis. Kedua proses ini menghasilkan alkalinitas dalam
Lapisan bahan organik yang umum digunakan adalah komposisi produk
organik sisa yang biasanya dari industri perkembangbiakan jamur yang disebut
dengan Spent Mushroom Substrat (SMS). SMS merupakan material organik yang
bersifat heterogen yang mengandung serbuk gergaji, kotoran hewan, dedak dan
gypsum. SMS ini mengandung nutrient dan penyedia sumber Karbon
(Newcombe, 2009). Media SMS ini sangat kaya jenis mikrobiologi di dalamnya,
tinggi kandungan organiknya tetapi rendah konsentrasi material esensi nutrient
untuk tumbuhan.
Serbuk gergaji yang terdapat dalam komposisi SMS berfungsi sebagai
penyedia nutrisi bagi jamur. Sebelum digunakan sebagai media, biasanya serbuk
kayu harus dikompos terlebih dahulu agar bisa terurai menjadi senyawa yang
lebih sederhana agar mudah dicerna oleh jamur. Proses pengomposan berlangsung
1 – 2 hari menggunakan plastik atau terpal. Alternatif bahan yang digunakan
untuk mengganti serbuk kayu adalah berbagai macam ampas, misalnya ampas
kopi, ampas kertas, ampas tebu dan ampas teh. Dedak atau bekatul berfungsi
sebagai substrat dan penghasil kalori untuk pertumbuhan jamur (Chazali dan
Pratiwi, 2010).
Aspek desain SAPS yang harus diperhatikan adalah temperatur antara 40o
C dan terendah 1o C, dengan reduksi sulfat sebesar 20% (Gusek et al, 2002 dalam
Bhattacharya et al 2008), tipikal reduksi sulfat antara 200 – 600 mmol/m3/hari,
rekomendasi adalah 300 mmol/m3/hari untuk desain SAPS (Wildeman et al, 1994
dalam Bhattacharya et al, 2008). Studi yang dilakukan oleh Thomas et al, 2006
dalam Bhattacharya et al, 2008 menyatakan bahwa logam terlarut seperti Fe, Al,
akumulasi berubah terhadap loading rate dan waktu. Dengan ketebalan batu kapur
1 m dan diameter 1,3 – 1,9 cm dapat menghasilkan paling sedikit 100 mg/L
alkalinitas untuk periode 10 tahun.
Menurut Neculita (2009), efisiensi pengolahan secara pasif air asam
tambang dengan bioreaktor, dalam hal ini SMS dan batu kapur dapat menaikkan
pH dari 2,9-5,7 menjadi pH 6 dan mereduksi logam 60-82% untuk logam Fe, dan
99,9% untuk logam Cd, Ni dan Zn dengan hidraulic retention times (HRTs) atau
waktu kontak 7,3 dan 10 hari.
2.5 Adsorpsi dan Jenis Adsorpsi
Adsorpsi adalah proses dimana satu atau lebih unsur-unsur pokok dari
suatu larutan fluida akan lebih terkonsentrasi pada permukaan suatu padatan
tertentu (adsorben). Dengan cara ini, komponen-komponen dari suatu larutan,
baik dari larutan gas ataupun cairan, bisa dipisahkan satu sama lain (Treybal,
1980). Adsorpsi melibatkan proses perpindahan massa dan menghasilkan
kesetimbangan distribusi dari satu atau lebih larutan antara fasa cair dan partikel.
Pemisahan dari suatu larutan tunggal antara cairan dan fasa yang diserap membuat
pemisahan larutan dari fasa curah cair dapat dilangsungkan. Berdasarkan interaksi
molekular antara permukaan adsorben dengan adsorbat, adsorpsi dibagi menjadi 2
(dua) jenis :
1. Adsorpsi fisik adalah adsorpsi yang terjadi akibat gaya interaksi tarik-menarik
antara molekul adsorben dengan molekul adsorbat. Adsorpsi ini melibatkan
gaya-gayaVan der Wals (sebagai kondensasi uap). Jenis ini cocok untuk
teradsorpsi tidak larut dalam adsorben tapi hanya sampai permukaan saja.
Pada adsorpsi fisik, adosrbat tidak terikat kuat pada permukaan adsorben
sehingga adsorbat dapat bergerak dari satu bagian permukaan ke bagian
permukaan lainnya. Permukaan yang ditinggalkan oleh adsorbat dapat
digantikan oleh adsorbat lainnya (multilayer).
2. Adsorpsi Kimia Adsorpsi kimia adalah adsorpsi yang terjadi akibat interaksi
kimia antara molekul adsorben dengan molekul adsorbat. Proses ini pada
umumnya menurunkan kapasitas dari adsorben karena gaya adhesinya yang
kuat sehingga proses ini tidak reversibel. Ikatan yang terbentuk merupakan
ikatan yang kuat sehingga lapisan yang terbentuk adalah lapisan monolayer.
2.6 Jenis Adsorben
Adsorben merupakan material berpori dan proses adsorpsi berlangsung di
dinding pori. Adsorben dapat digolongkan menjadi 2 (dua) jenis yaitu adsorben
tidak berpori (non-porous sorbents) dan adsorben berpori (porous sorbents).
1. Adsorben tidak berpori (non-porous sorbents)
Adsorben tidak berpori dapat diperoleh dengan cara presipitasi deposit
kristalin seperti BaSO4 atau penghalusan padatan kristal. Luas permukaan
spesifiknya kecil, tidak lebih dari 10 m2/g dan umumnya antara 0,1 – 1 m2/g.
adsorben tidak berpori seperti filter karet (rubber filters) dan karbon bergrafit
(graphitized carbon blacks) adalah jenis adsorben tidak berpori yang telah
mengalami perlakuan khusus sehingga luas permukaannya dapat mencapai
2. Adsorben berpori
Luas permukaan spesifik adsorben berpori berkisar antara 100 – 1000
m2/g. Beberapa jenis adsorben berpori yang telah digunakan secara komersial
antara lain adalah karbon aktif, zeolit, silica gel, activated alumina.
2.7 Kulit Bagian Dalam Ubi Kayu Sebagai Adsorben Karbon Aktif
Karbon aktif merupakan arang yang telah diproses sedemikian rupa
dengan cara diaktifasi oleh suatu zat sehingga mempunyai daya serap yang tinggi.
Karbon atau arang merupakan padatan berpori yang mengandung 85-95% karbon,
dihasilkan dari pemanasan pada suhu tinggi. Luas permukaan karbon aktif 300 –
3500 m2/g yang berhubungan dengan struktur pori internal yang berhubungan
dengan struktur pori internal yang menyebabkan karbon aktif mempunyai sifat
sebagai adsorber (Darmawan, 2010).
Kulit ubi kayu termasuk jenis sampah organik. Kulit ubi kayu mempunyai
kandungan selulosa yang cukup tinggi. Kulit ubi kayu dapat dimanfaatkan sebagai
bahan karbon aktif. (Darmawan, 2011). Karakteristik ubi kayu (manihot esculenta
crantz) yang efektif dalam menyerap logam berat (Obiri et al, 2006). Dalam
pemanfaatan ubi kayu sebagai bahan makanan dalam pengolahannya, ubi kayu
harus dikupas terlebih dahulu. Dengan kata lain kulit ubi kayu merupakan limbah
dari pengolahan ubi kayu yang cukup besar. Pemanfaatan kulit ubi kayu secara
komersil masih sedikit. Hal ini disebabkan karena kulit ubi kayu mengandung 3-5
kali lebih banyak kadar asam sianida (HCN) dari ubinya yang sangat berbahaya
Menurut Darmawan (2010), salah satu cara untuk mengatasi limbah kulit
ubi kayu adalah dengan membuatnya menjadi lebih berguna dan mempunyai nilai
ekonomi yang lebih tinggi, yaitu sebagai bahan baku pembuatan karbon aktif.
Dalam penelitian Koeswardhani (1995) yang melakukan analisis adsorpsi
logam Fe dan Zn pada limbah cair industri tekstil dengan karbon aktif bubuk
menyatakan bahwa efektivitas adsorpsi karbon aktif dipengaruhi waktu kontak.
Waktu kontak terbaik adalah 10 menit/liter dan kadar terendah yaitu 7,5% (75
gram karbon aktif/liter limbah cair). Dari penelitian ini juga disebutkan bahwa
karbon aktif masih efektif digunakan sebanyak 20 kali tanpa regenerasi.
Menurut Wasay, et.al, 1997 menyatakan bahwa karbon aktif berbentuk
granular mempunyai efektivitas mengadsorpsi logam (Cd, Cu, Cr, Hg, Mn, Pb dan
Zn) dari air lindi remediasi tanah yang terkontaminasi logam berat dengan
efektivitas 96 – 97% dengan pH antara 5,4-6,9 dan waktu kontak 5 – 7 jam.
Remediasi harian tanah 20 ton atau 10 m3 yang terkontaminasi logam berat yang
menghasilkan volume 62,5 m3 lindi dengan kadar 148 mg/L logam berat
memerlukan 575 kg granular karbon aktif. Regenerasi karbon aktif dilakukan
dengan cairan HCl.
Faktor – faktor yang mempengaruhi performa karbon aktif sebagai
adsorber adalah (Desilva, 2010) :
1. Berat molekul
Dengan meningkatnya berat molekul maka daya serap akan semakin
meningkat karena molekul terlarut di dalam air. Struktur pori dari karbon harus
2. pH
Penyerapan biasanya dipengaruhi oleh konsentrasi ion hidrogen dalam
larutan. Untuk asam – asam organik adsorpsi akan meningkat bila pH diturunkan
atau pH rendah. Bila pH asam dinaikkan dengan penambahan alkali, adsorpsi
akan berkurang sebagai akibat terbentuknya garam.
3. Ukuran partikel
Ukuran partikel karbon aktif berpengaruh terhadap penyerapan logam.
Ukuran partikel yang tersedia 8-50 mesh. Ukuran yang terbaik 20-50 mesh.
4. Laju Aliran
Secara umum, laju aliran yang rendah mengakibatkan waktu kontak yang
lebih lama. Ukuran partikel 20 – 50 mesh mengalirkan dua kali lebih cepat dari 12 – 40 mesh, dan 12 – 40 mesh mengalirkan dua kali lebih cepat dari ukuran 8 - 30
mesh.
Kapasitas adsorpsi dapat dihitung dengan menggunakan rumus :
qt = (Co – Ct).V (9)
m
dimana : qt : kapasitas adsorpsi dalam waktu t (mg adsorbate/g adsorbent)
Co : konsentrasi logam (mg/L)
Ct : konsentrasi residual setelah adsorpsi (mg/L)
V : volume sampel (l)
m : massa adsorbent (g)
Untuk menghitung persentase (%) penyisihan logam dapat dihitung
dengan menggunakan rumus :
2.8 Percobaan Batch
Sistem batch merupakan pengoperasian yang sederhana. Tujuan dari
sistem ini adalah untuk mengetahui karakteristik adsorbat dan adsorbant yang
dinyatakan dalam hubungan antara penurunan adsorbate dan berat adsorbent
dalam suatu koefisien dari persamaan yang ada (Reynold,1982).
Partikel adsorben ditempatkan di dalam sebuah larutan adsorbat dan
diaduk untuk mendapatkan kontak yang merata sehingga terjadi proses adsorpsi.
Konsentrasi larutan awal (Co) akan berkurang dan bergerak ke konsentrasi
kesetimbangan (Ce) setelah waktu tertentu. Makin lama waktu kontak maka
makin setimbang larutan tersebut (Eckenfelder, 2000).
Kuantitas adsorbat yang dapat diadsorpsi oleh adsorben merupakan fungsi
dari dua hal yaitu karakteristik dan konsentrasi adsorbat. Umumnya jumlah
adsorbat ditentukan dari fungsi konsentrasi pada suhu konstan, dan menghasilkan
fungsi yang disebut isoterm adsorpsi. Pendekatan dengan model isoterm dapat
membantu menganalisis karakteristik isoterm berupa kapasitas, afinitas,
selektifitas serta mekanisme interaksi adsorpsi. Persamaan yang sering digunakan
untuk menggambarkan data isoterm adsorpsi secara eksperimental dilakukan oleh
Freundlich, Langmuir, Brunauer Emmet Teller (BET isoterm).
2.9 Isoterm Freundlich
Menurut Metcalf and Eddy (2003), secara empiris penurunan rumus
isoterm Freundlich adalah sebagai berikut :
Dimana : x/m : jumlah adsorbat yang terserap per unit berat adsorben
Ce : konsentrasi kesetimbangan adsorbat dalam larutan setelah
proses adsorpsi
Kf,n : konstanta empiris
Model isoterm Freundlich menggunakan asumsi bahwa adsorpsi berjalan
secara fisika. Konstanta dalam isoterm Freundlich dapat ditentukan dengan
membuat grafik antara q (x/m) versus C, dan menggunakan kembali persamaan di
atas yang sudah dilogkan menjadi :
(12)
Dari persamaan linier dapat dibuat kurva linear adsorpsi isoterm
Freundlich yang dapat diketahui nilai konstanta Freundlich dengan pendekatan
dan plot nilai log q dengan nilai log C sehingga akan didapatkan slope (m) = 1/n
dan intercept (b) = log k.
Jika konsentrasi zat terlarut relatif tinggi, penggunaan persamaan diatas
menjadi tidak sesuai karena akan menyebabkan terjadinya penyimpangan. Selain
itu isoterm Freundlich juga digunakan untuk identitas zat terlarut tidak diketahui
misalnya adsorpsi mineral, minyak nabati dan warna (Sawyer, 2003).
2.10 Isoterm Langmuir
Menurut Metcalf and Eddy (2003), isoterm adsorpsi Langmuir
didefinisikan sebagai berikut :
Dimana : x/m : jumlah adsorbat yang terserap per unit massa adsorban
a,b : konstanta empiris
Ce : konsentrasi kesetimbangan adsorbat dalam larutan setelah
adsorpsi
Isoterm adsorpsi Langmuir dikembangkan dengan mengasumsikan bahwa
(1) sejumlah bagian adsorbat tetap tersedia pada permukaan adsorban, dimana
bagian permukaan tersebut memiliki energi yang sama, (2) adsorpsi yang terjadi
reversible (dua arah). Kesetimbangan terjadi apabila kecepatan adsorpsi molekul
ke dalam permukaan sama dengan kecepatan desorpsi dari permukaan. Konstanta
isoterm Langmuir dapat ditentukan dengan membuat grafik antara C/(x/m) versus
C dan mengubah persamaan diatas menjadi :
(14)
Dari persamaan linear diatas dapat dibuat kurva linear adsorpsi isoterm
Langmuir dan dapat diketahui nilai konstanta Langmuir dengan pendekatan plot
nilai Ce/(x/m) dan nilai Ce sehingga akan didapatkan slope (m) = 1/ab dan
intercept (b) = 1/a.
2.11 Isoterm Brunauer – Emmet – Teller (BET)
Selain dua persamaan isoterm diatas, pada adsorpsi juga berlaku
persamaan isoterm Brunauer – Emmet – Teller (BET). Persamaan ini digunakan
dengan asumsi untuk mendiskripsikan adsorpsi multilayer (Metcalf, 2003). Selain
itu asumsi pada model persamaan BET adalah :
1. Molekul terserap tidak berpindah ke permukaan
3. Semua molekul di luar lapisan pertama memiliki energi yang sama untuk
adsorpsi
4. Untuk memulai pada lapisan yang lain lapisan sebelumnya tidak harus
penuh
Berdasarkan atas asumsi di atas, bentuk persamaan BET adalah :
(15)
Dimana :
q : x/m : jumlah adsorbat yang terserap per unit massa adsorban
qm : maksimum adsorbat teradsorpsi
Cs : konstanta awal larutan
Kb : konstanta (tergantung pada energi adsorpsi)
Persamaan tersebut dapat diubah menjaadi persamaan linear menjadi
persamaan seperti dibawah ini (Metcalf, 2003)
(16)
2.12 Analisis Regresi
Analisis regresi merupakan salah satu alat statistika yang digunakan untuk
menggambarkan hubungan antara dua variabel, sehingga suatu variabel dapat
diprediksi dari variabel yang lain. Analisis regresi juga dapat dilakukan untuk
mengetahui linearitas variabel terikat dengan variabel bebasnya. Analisis regresi
sebagai kajian terhadap hubungan satu variabel sebagai variabel yang diterangkan
(the explained variable) dengan satu atau dua variabel yang menerangkan (the
kedua disebut juga variabel bebas. Jika variabel bebas lebih dari satu maka
analisis regresi disebut regresi linear berganda.
Regresi sederhana adalah bentuk regresi dengan model yang bertujuan
untuk mempelajari hubungan antara dua variabel yakni variabel independen
(bebas) dan variabel dependen (terikat). Jika ditulis dalam bentuk persamaan
model regresi sederhana adalah :
y = a + bx (17)
Dimana : y = variabel dependen (terikat)
x = variabel independen (bebas)
a = penduga bagi intercept ()
b = penduga bagi koefisien regresi ()
2.13 Analisis Korelasi
Dalam ilmu statistika ada dua macam hubungan antara dua variabel yang
relatif sering digunakan yaitu bentuk hubungan dan keeratan hubungan. Bentuk
hubungan bisa diketahui melalui analisis regresi, sedangkan keeratan hubungan
dapat diketahui melalui analisis korelasi.
Koefisien determinasi (R2) adalah satu ukuran yang digunakan untuk
mengukur pengaruh variabel independen terhadap variasi variabel dependen
dengan nilai 0 < R2 < 1. Bagian dari keragaman total variabel dependen (terikat)
yang dapat diterangkan atau diperhitungkan oleh keragaman variabel independen
(bebas). Koefisien determinasi pada regresi linear sering diartikan sebagai
seberapa besar kemampuan semua variabel bebas dalam menjelaskan varians dari
Analisis korelasi digunakan untuk mengetahui derajat linear antara dua
variabel atau lebih. Hubungan antara satu variabel dengan variabel yang lain dapat
merupakan hubungan yang terjadi dengan ketidaksengajaan, tetapi dapat juga
merupakan hubungan sebab akibat.
Besarnya hubungan antara variabel yang satu dengan yang lain dinyatakan dengan koefisien korelasi yang disimbolkan dengan huruf “r”. Besarnya koefisien
korelasi akan berkisar antara -1 (negatif 1) sampai dengan +1 (positif satu).
-1 < r < +1
Keterangan : + menunjukkan korelasi positif
- menunjukkan korelasi negatif
0 menunjukkan tidak adanya korelasi
a. Korelasi positif
Terjadi korelasi positif apabila perubahan pada variabel yang satu diikuti dengan
perubahan variabel yang lain dengan arah yang sama (berbanding lurus). Artinya
apabila variabel yang satu meningkat maka akan diikuti dengan peningkatan
variabel yang lain. Apabila variabel yang satu turun, maka akan diikuti dengan
penurunan variabel yang lain.
b. Korelasi negatif
Korelasi negatif terjadi apabila perubahan pada variabel yang satu diikuti dengan
perubahan pada variabel yang lain dengan arah yang berlawanan (berbanding
terbalik). Artinya apabila variabel yang satu meningkat maka akan diikuti dengan
penurunan variabel yang lain. Apabila yang satu turun maka akan diikuti dengan
c. Korelasi nihil
Korelasi nihil terjadi apabila perubahan pada variabel yang satu diikuti dengan
perubahan pada variabel yang lain dengan arah yang tidak teratur (acak). Artinya
apabila variabel yang satu meningkat diikuti dengan peningkatan variabel yang