LARUTAN
KULIAH KE 6
•
Bahan2 dpt dicampurkan menjadi : lar sejati, lar/dispersi koloid, lar/dispersi kasar•
Larutan sejati : campuran dr 2 / lebih komponen yg membentuk suatu dispersi molekul yg homogen, merupakan sistem 1 fase.•
Sistem adalah suatu ruangan yg diberi batas/sejumlah zat yg berada dlm pengamatan & percobaan•
Fase adalah suatu bagian homogen tertentu dr sistem yg dipisahkan dr bag lain sistem oleh suatu batas•
Larutan yg tdd dr 2 macam zat sj disebut larutan biner, yaitu : zat yg dilarutkan (solute) & pelarut (solvent)Dispersi kasar : suatu fase diantara sistem yg tdk
tercampurkan, dgn diameter partikel lebih besar dr 0,1 µm (1000A atau 10 -5 cm). Contoh tetes minyak dlm emulsi / partikel padat dlm suspensi
Dispersi koloid : suatu fase didalam sistem dengan ukuran
partikel 10-5000A, berada diantara lar sejati dan dispersi kasar, dpt berupa 1 fase (exp:CMC/PGA dlm air) atau 2 fase
(exp:protargol dlm air).
Bahan-bahan dapat dicampurkan menjadi:
Larutan Sejati
• campuran dr 2 / lebih komponen yg membentuk suatu dispersi molekul yg homogen, merupakan sistem 1 fase
Larutan/Dispersi koloid
• suatu fase didalam sistem dengan ukuran partikel 10-5000A, berada diantara lar sejati dan dispersi kasar, dpt berupa 1 fase (exp:CMC/PGA dlm air) atau 2 fase (exp:protargol dlm air).
Larutan/dispersi kasar
• suatu fase diantara sistem yg tdk tercampurkan, dgn diameter partikel lebih besar dr 0,1 µm (1000A atau 10-5cm). Contoh tetes minyak dlm emulsi / partikel padat dlm suspensi
Sistem suatu ruangan yg diberi batas/sejumlah zat yg berada dlm pengamatan &
percobaan
Fase suatu bagian homogen tertentu dr
sistem yg dipisahkan dr bag lain sistem oleh suatu batas
Larutan
Biner Larutan yg tdd dr 2 macam zat sj, yaitu
: zat yg dilarutkan (solute) & pelarut
(solvent)
Sifat Larutan
Sifat koligatif
bergantung pd jml partikel dlm larutan, exp:tekanan osmosis, penurunan tekanan
uap, penurunan titik beku &
kenaikan titik didih
Sifat aditif
bergantung pd andil atom total dlm molekul / jml sifat
konstituen dlm larutan, exp:berat molekul, vol molar,
refraksi molar
Sifat
konstitutif
bergantung pd penyusun, jenis & jml atom dlm molekul,
exp:pembiasan cahaya, sifat permukaan & antar permukaan, kelarutan obat
Tipe larutan
LARUTAN NON ELEKTROLIT
• tdk menghasilkan ion
apabila dilarutkan dlm air sehingga tdk membawa aliran listrik melalui lar tersebut.
• Sifat koligatif kurang teratur
• Contoh sukrosa, gliserin, naftalen, urea
LARUTAN ELEKTROLIT
• zat yg membentuk ion dlm larutan, menghantarkan muatan listrik.
• Menghasilkan titik beku &
titik didih lbh besar drpd zat nonelektrolit dgn
konsentrasi sama
• Contoh HCl, NaSO4, efedrin, fenobarbital.
Sifat Larutan
1. Sifat koligatif : bergantung pd jml partikel dlm larutan,
exp:tekanan osmosis, penurunan tekanan uap, penurunan titik beku & kenaikan titik didih
2. Sifat aditif : bergantung pd andil atom total dlm molekul / jml sifat konstituen dlm larutan, exp:berat molekul, vol molar, refraksi
molar
3. Sifat konstitutif : bergantung pd penyusun, jenis & jml atom dlm molekul, exp:pembiasan cahaya, sifat permukaan & antar
permukaan, kelarutan obat
Tipe larutan
1. Larutan non elektrolit
: zat yg tdk menghasilkan ion
apabila dilarutkan dlm air sehingga tdk membawa aliran listrik melalui lar tersebut. Sifat koligatif kurang teratur.
Contoh sukrosa, gliserin, naftalen, urea
2. Larutan elektrolit
: zat yg membentuk ion dlm larutan, menghantarkan muatan listrik. Menghasilkan
titik
beku &
titik didih lbh besar drpd zat nonelektrolit dgn konsentrasi sama ⇒ memperlihatkan kelainan yg nyata dr sifat koligatif. Contoh HCl, NaSO4, efedrin,
fenobarbital.
Larutan Non Elektrolit
• Larutan ideal
: larutan dimana tidak ada perubahan sifat komponen, selain dari pengenceran, ketika zat-zat bercampur membentuk larutan.
Lar yg gaya tarik menarik antara molekul2ny sama
Tidak ada panas yang dilepas atau diabsorpsi selama proses pencampuran (tdk terjadi perubahan panas)
Vol total adalah jml vol komponenny
Mengikuti hk Raoult (tek parsial uap komponen yg mudah menguap dr lar = tek uap murni kali fraksi molny dlm lar)
Contoh campuran 100 mL metanol dengan 100 mL etanol (200 mL).
• Larutan nyata
: larutan yang akan mengalami perubahansifat komponen karena adanya panas yang dilepas atau diabsorpsi,
tdk mengikuti hk Raoult meliputi seluruh komposisi, tdpt penyimpangan negatif & penyimpangan positif
Penyimpangan negatif : apabila atraksi adhesi > atraksi
kohesi⇒tek uap lar < tek uap yg diharapkan (exp:kloroform dgn aseton)
Penyimpangan positif : apabila atraksi adhesi < atraksi
kohesi⇒tek uap parsial > dr yg diharapkan (exp:benzen dgn etil alkohol, kloroform dgn etil alkohol)
contoh campuran 100 mL asam sulfat dengan 100 mL air (<200 mL)
Besaran Konsentrasi
• Molaritas (M) : Mol zat terlarut dlm 1 L larutan
• Normalita (N) : Berat gram ekivalen zat terlarut dlm 1 L larutan
• Molalitas (m) : mol zat terlarut dalam 1000 g pelarut
• Fraksi mol (X /N) : perbandingan mol satu konstituen (zat terlarut) dari larutan terhadap mol total dari keseluruhan konstituen (zat terlarut dan pelarut) X1 =n1/
n1+n2
• Persen berat (% b/b) : gram zat terlarut dalam 100 g larutan
• Persen berat dlm vol (% b/v) : gram zat terlarut dalam 100 ml larutan
• Persen volume (% v/v) : mililiter zat terlarut dalam 100 ml larutan
• Berat ekuivalen (u atom) : berat atom per jumlah valensi
• Berat ekuivalen (u molekul) : berat molekul per jumlah
ekivalen
Kemolalan atau molalitas merupakan pernyataan
konsentrasi larutan yang menyatakan jumlah mol zat terlarut dalam 1 kg atau 1.000 g zat pelarut.
Kemolalan = m = Jumlah mol zat terlarut 1 kg zat pelarut
m = n × 1.000
p atau m = 1.000
p g
Mr ×
mol
Massa zat (g)
Massa pelarut (g)
Kemolaran dapat dikonversi menjadi kemolalan dengan mengubah lebih dahulu volume larutan menjadi massa larutan.
Massa jenis (ρ) = Massa larutan Volume larutan
Hubungan Kemolalan dan Kemolaran
M = 1.000
V g
Mr .
Kemolaran (M) Kemolalan (m)
m = 1.000
pel g
Mr .
Massa jenis (ρ) . Volume larutan Massa larutan =
Berapakah kemolalan larutan glukosa yang mengandung 12% masa glukosa (Mr = 180)?
Glukosa 12% = 12/100 x 100 gram = 12 gram.
Dan air (pelarut) = (100 – 12) = 88 gram.
1
kg
-mol 79
, 15840 0
12000
88 x 1000 180
12
m
Jawab :
Fraksi mol merupakan pernyataan konsentrasi suatu larutan yang menyatakan perbandingan jumlah mol zat terlarut terhadap jumlah mol total komponen
larutan (jumlah mol pelarut + jumlah mol zat terlarut).
Fraksi mol zat pelarut (xp) xP = nP
nP + nt
Fraksi mol zat terlarut (xt) xt = nt
nP + nt
Total fraksi mol = x
p+ x
t= 1
Sebanyak 90 gram glukosa dilarutkan dalam 360 gram air ( Ar C=12, H=1, O=16 ). Tentukan fraksi mol masing-masing zat !
Jawab :
mol n
H O20
18 360
2
41 1 5
, 20
5 , 0 5
, 0 20
5 , 0
6 12
6
O H
x
C41 40 41
1 1
2O
x
Hmol n
C H O0 , 5
180 90
6 1 2
6
Mr zat tersebut
Kesetimbangan tekanan
uap pelarut murni Kesetimbangan
tekanan uap larutan
P = P° . xPelarut
Tekanan uap jenuh adalah Tekanan uap jenuh adalah tekanan uap yang ditimbulkan pada saat tercapai kondisi kesetimbangan
Diagram Penurunan
Tekanan Uap
Penurunan tekanan dari P° ke P disebut penurunan tekanan uap, yang diberinotasi ΔP.
Pelarut murni
Larutan
Tekanan (mmHg)
Suhu (°C) P°
P
P = P° – P
P
Dari kedua persamaan diatas, dapat kita turunkan suatu rumus untuk menghitung penurunan tekanan uap jenuh, yaitu:
ΔP= P° – P
Keterangan:
ΔP = penurunan tekanan uap jenuh
Po = tekanan uap jenuh pelarut air murni xterlarut = fraksi mol zat terlarut
xpelarut = fraksi mol zat pelarut
ΔP = P°·xterlarut
= P° – (xpelarut·P°)
= P° (1– xpelarut)
Sebanyak 60 gram urea (Mr = 60) dilarutkan dalam 72 gram air (Mr = 18). Jika tekanan uap air murni pada 20°C adalah 22,5 mmHg, tentukan penurunan tekanan uap larutan pada suhu tersebut!
Jawab:
Δ
P = P° . Xterlarutxurea = nurea
nair + nurea = 60 g.Mol–1 = 0,2 60 g
60 g
60 g.mol–1
72 g
18 g.mol–1 +
ΔP = 22,5 mmHg × 0,2 = 4,5 mmHg
Suhu
Tekanan
Perhatikan diagram fasa berikut.
A B
A’ B’
0,06 atm
Padat
Cair
Gas T
T’
0,1°C 1 atm
Tb° Td°
Tb Td
Pelarut murni H2O Larutan
Perubahan titik didih Td
Titik didih pelarut murni Td°
Perubahan titik beku Tb
Titik beku pelarut murni Tb°
Titik beku larutan Tb
Titik didih larutan Td
Perubahan tekanan uap P
Td Tb
P Perhatikan LKPD
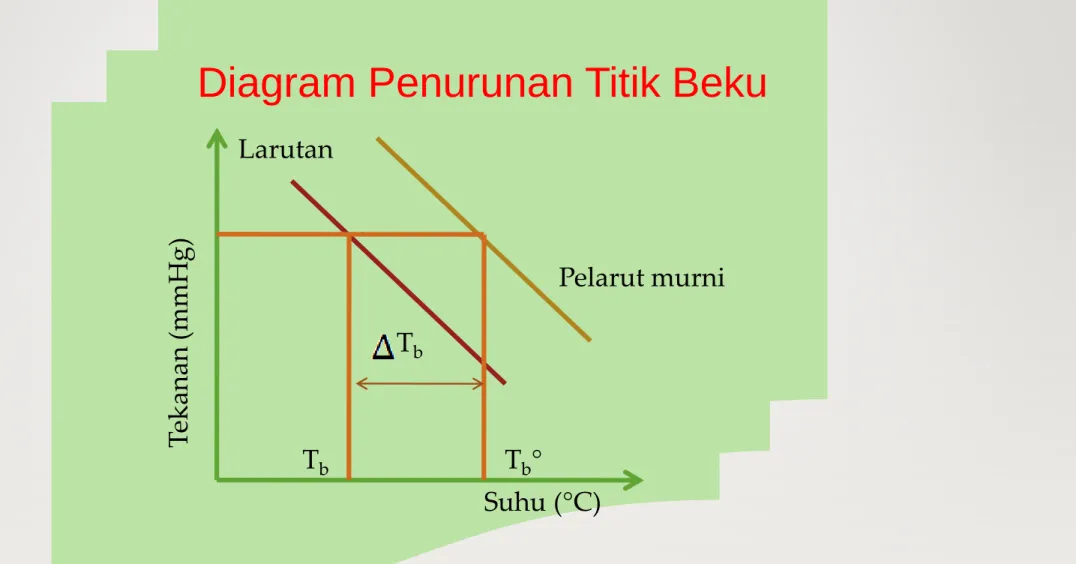
Titik beku adalah suhu pada nilai tekanan tertentu, saat terjadi perubahan wujud zat dari cair menjadi padat.
Δ
Tf = Kf × mPenurunan titik beku larutan diberi notasi Tf.
ΔTf = Mrg . 1000
p . Kf
Diagram Penurunan Titik Beku
Larutan
Pelarut murni
Tekanan (mmHg)
Suhu (°C)
Tb Tb°
Tb
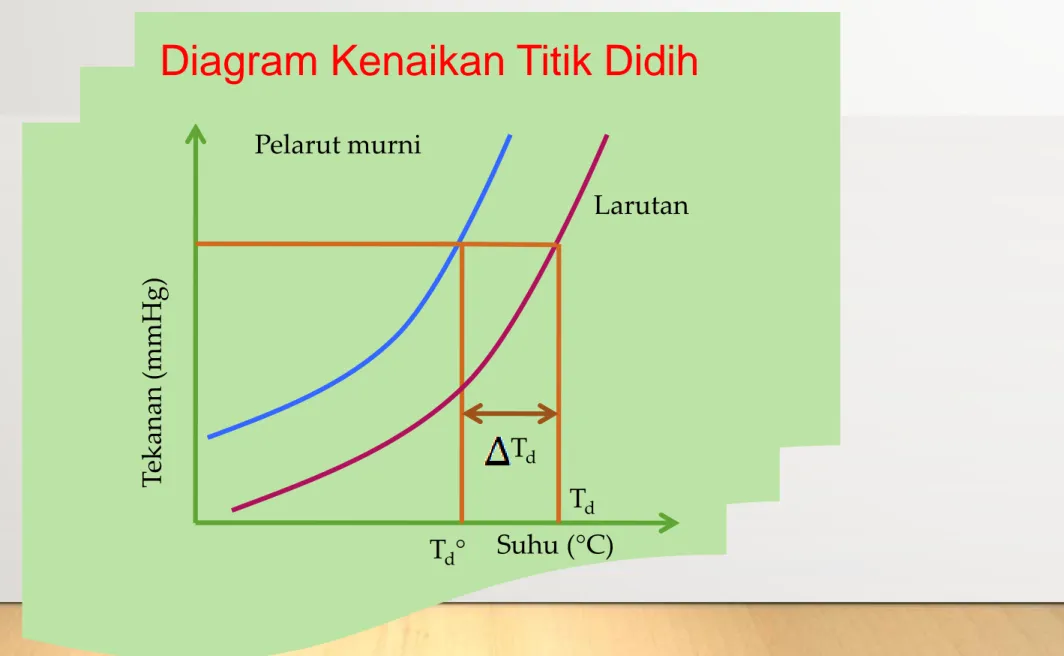
Titik didih adalah suhu pada saat tekanan uap jenuh suatu cairan sama dengan tekanan atmosfer di sekitarnya.
Kenaikan titik didih larutan yang diberi notasi Tb.
Δ
Tb = Kb × m ΔTb = gMr . 1000
p . Kb
Diagram Kenaikan Titik Didih
Tekanan (mmHg)
Suhu (°C) Td°
Pelarut murni
Larutan
Td Td
Dari rumusan penuruan titik beku larutan dan kenaikan titik didih larutan, dapat ditentukan:
Massa molekul relatif
(Mr) zat terlarut Jumlah Zat Terlarut
Mr = Kb × g
Tb × 1.000 P
m = Tb
Kb × Td K
d
g = Mr× Tb
Kb × P 1.000
Mr = Kd× g
Td × 1.000
P g = Mr× Td
Kd × P 1.000
Pelarut Tb (oC) Kb (oC.m-1) Tf (oC) Kf (oC.m-1)
Air 100 0,52 0 1,86
Benzena 80,10 2,53 5,53 5,12
Kamper 207,42 5,61 179,8 39,7
Fenol 181,75 3,56 40,90 7,40
Nitro Benzena 210,80 5,24 5,7 7,00
Tabel :
Ketetapan kenaikan titik didih molal (Kb) dan tetapan penurunan titik beku molal (Kf) dari beberapa pelarut.
Tentukan titik beku dan titik didih 0,54 molal glukosa dalam air. (Kb = 1,86°C.m–1, Kd = 0,52°C.m–1)
Penyelesaian
Tf = T° – Tf Tf = kf × m
= 1,86°C.m–1 × 0,54 m
= 1°C
Tf = 0°C – 1°C
= –1°C Titik beku
Tb = T° – Tb Tb= kb × m
= 0,52°C.m–1× 0,54 m
= 0,28°C
Tb = 100°C + 0,28°C
= 100,28°C Titik didih
Berapa gram glukosa yang harus dilarutkan dalam 100 g air (Mr = 180) agar larutannya membeku pada –1,5°C (kb = 1,86°C.m–1)
Penyelesaian
g = Mr × Tf × kb
P 1.000
= 180 g . Mol–1 × 1,5°C × 1,86°C.m–1
100 g 1.000
= 14,5 g Tf= T° – Tf
= 0°– ( –1,5°C)
= 1,5°C
Perhatikan Video Berikut
Osmosis adalah
Tekanan Osmotik adalah Osmosis adalah proses berpindahnya pelarut
dari larutan yg lebih encer ke larutan pekat melalui membran semipermeabel (hanya dpt dilalui oleh pelarut)
Tekanan Osmotik adalah tekanan yg diperlukan utk menghentikan aliran dari pelarut murni ke dlm larutan
Perhatikan LKPD
Alat yg digunakan utk mengukur besarnya tekanan osmotik adalah
osmometer
= M× R × T
Keterangan: = tekanan osmotik M = Konsentrasi (mol/L)
R = tetapan gas = 0,082L.atm/mol.K T = Suhu mutlak (K)
Sebanyak 7,2 g glukosa (Mr = 180) dilarutkan dalam air sampai volumenya 400 mL. Tentukan tekanan osmotik larutan pada temperatur 27°C. (R = 0,0821 L.atm/K.mol)
Penyelesaian
T = 27°C = 300 K
= M R T
= g ×
Mr
1.000
V × R × T
= 7,2 g ×
180 g . m–1
1.000
400 mL × 0,082 L.atm/K.mol × 300 K
= 2,46 atm