Prosiding Skripsi Semester Gasal 2009/2010
ADSORPSI METHYLEN BLUE DENGAN ABU DASAR PT.IPMOMI
PROBOLINGGO JAWA TIMUR DAN ZEOLIT BERKARBON
Intan Permata Sari*, Nurul Widiastuti1
Jurusan Kimia, Fak ultas Matematik a dan Ilmu Pengetahuan Alam Institut Tek nologi Sepuluh Nopember S urabaya
Abstrak
.
Penelitian ini mempelajari tentang kapasitas adsorpsi dari abu dasar dan zeolit berkarbon. Uji adsorpsi dilakukan dengan cara penentuan waktu setimbang, penentuan konsentrasi awal, dan pH optimum. Dari data hasil penelitian didapatkan pada abu dasar memiliki waktu setimbang 720 menit sedangkan zeolit berkarbon 180 menit. Data hasil penentuan konsentrasi awal diketahui bahwa semakin menigkat konsentrasi methylen blue maka semakin meningkat kapasitas adsorpsinya. pH efektif untuk adsworpsi methylen blue pada pH2. Uji kinetik abu dasr dan zeolit berkarbon mengikuti model orde dua semu, sedangkan uji isoterm mengikuti model langmuir dan tempkin.Kata kunci: abu dasar, zeolit berkarbon, adsorpsi, metode batch, zat warna, kinetic adsorpsi,
adsorpsi isoterm
Abstract
This reserch study about capacity adsorption from bottom ash and carbonized zeolit. Adsorption test by determinate equilibrium time, initial concentration, and pH optimum. In this researsh, result that bottom ash have equilibrium time 720 minute in other wise carbonized zeolit 180 minute. The data show that determinate initial concentration methylen blue is known that increasing concentration methylen blue make increase capacity adsorption. The effective pH adsorption methylen blue is 2. Kinetic test bottom ash and carbonized zeolit following pseudo-second-order. The isotem test folowing langmuir model and tempkin model to carbonized zeolit.
Keywords: bottom ash, carbonized zeolit, adsorpstion, batch method, dyes, adsorption kinetic,
isotherm adsorption
*Corresponding author Phone : 087852776762 e-mail : [email protected]
1
Alamat sekarang : Jur Kimia, Fak MIPA, Institut Teknologi Sepuluh Nopember, Surabaya
1. PENDAHULUAN
Zat warna (dyes) adalah bahan yang tidak lepas dari proses industri. Hampir 9000 zat warna yang telah ada didaftar indeks dan banyaknya permintaan terhadap zat warna tersebut berasal dari industri tekstil, kertas, kosmetik, plastik, makanan dan rokok. Selama ini industri tekstil memiliki rangking tertinggi untuk penggunaan zat warna (Garg,dkk, 2003). Setiap tahunnya total zat warna yang digunakan dari industri tekstil didunia telah melampui batas yang telah ditentukan yaitu sampai 107 kg pertahun dan, diperkirakan 90% dari hasil pabrik bahannya menggunakan zat warna sebagai bahan bakunya. Sebagai akibatnya 1000 ton pertahun limbah zat warna dibuang kealiran air (March, 1996). Limbah zat warna ini memiki sifat non biodegradable karena mengandung senyawa kompleks aromatik dan senyawa organik yang sukar diuraikan oleh mikroba sekalipun (Irvan, 2004). Selain itu zat warna bersifat karsinogenik dan dapat menyebabkan kanker (Arifin, 2009). Berdasarkan data dari lingkungan hidup didapatkan bahwa disekitar limbah tekstil banyak terjangkit penyakit kulit dan timbul nanah selain itu juga dapat menghambat pertumbuhan tanaman (Irvan, 2004).
Berberapa metode telah dilakukan untuk mernghilangkan zat warna tersebut dengan menggunakan pengaktifan sludge, koagulasi kimia, elektrokimia, osmosis, katalis hidrogen peroksida, pengaktifan karbon. Metode pengaktifan sludge memiliki banyak kekurangan terutama pada faktor biaya karena memerlukan biaya yang sangat besar untuk pemanfaatan dalam skala industri. Pengaktifan sludge memerlukan alat yang khusus dan alat yang digunakan juga sangat mahal karena sludge adalah limbah yang sukar untuk dimanfaatkan kembali. Sedangkan pada teknik koagulasi menggunakan batuan koagulan kimia seperti polielektrolit (misalnya : PAC, PAS, dll), garam Aluminat (misalnya : Alum, Tawas, dll.), garam Fe, khitin, dsb (Rastogi,dkk, 2008). Untuk metode Flokulasi dapat digunakan polimer kationik, anionik, atau nonionik (misalnya : poliakrilik, poliakrilamide, dll). Untuk pengendapan dapat digunakan teknologi baffle, settler, lumpur aktif, aerasi, dll. Untuk memperoleh
hasil yang optimal teknik tersebut dapat digabung. Kerugian dari teknik ini yaitu menggunakan banyak bahan sehingga tidak efisien dan lebih mahal. Pada metode osmosis larutan akan diserap dengan cara osmosis. Osmosis adalah perpindahan air melalui membran permeabel selektif dari bagian yang lebih encer ke bagian yang lebih pekat. Teknik ini memiliki keuntungan dalam hal kesederhanaan akan tetapi dalam proses osmosis bahan yang akan digunakan hanya bisa dalam skala kecil. Metoda laju yaitu menggunakan hidrogen peroksida digunakan sebagai katalis untuk penghilangan zat warna. Metode ini tidak efisien karena harga katalis hidrogen peroksida sangat mahal dan hidrogen peroksida juga bersifat karsinogenik. Selain metoda yang disebutkan diatas, metode adsorpsi adalah metode yang relatif lebih murah. Pada penelitian ini digunakan metode adsorpsi untuk menghilangkan methylen blue. Adsorben yang digunakan adalah abu dasar dan zeolit berkarbon yang dibuat dari abu dasar.
Abu dasar adalah bahan buangan dari proses pembakaran batu bara pada tungku (boiler). Selain abu dasar, abu buangan dari proses pembakaran batu bara adalah abu layang. Abu layang adalah abu hasil transformasi, pelelehan atau gasifikasi dari material anorganik yang terkandung dalam batu bara (Malina & Poole, 2001). Dibanding dengan abu layang, abu dasar ini relatif sedikit dimanfaatkan. Hal ini karena jumlah abu layang yang dihasilkan jauh lebih banyak dari abu dasar. Abu layang dihasilkan sekitar 80%, sedangkan abu dasar 20% pada satu proses pembakaran (Supiatni, 2003). Meskipun hanya 20%, tetapi jumlah abu dasar yang dihasilkan dapat mencapai 5.8 ton/hari berdasarkan data kematian lingkungan hidup tahun 2006. Hal ini juga perlu dipikirkan cara penanganannya. Limbah ini dikategorikan dalam limbah B3)
Komponen utama dari abu layang dan abu dasar adalah SiO2, Al2O3, Fe2O3, CaO, Na2O, dll serta sisa karbon sisa hasil pembakaran batu bara. Kandungan sisa karbon dalam abu dasar jauh lebih besar daripada abu layang. Oleh karena itu, abu dasar ini lebih berpotensi dimanfaatkan sebagai adsorben untuk menyerap zat warna bila dibandingkan dengan abu layang.
Pemanfaatan abu layang sebagai adsorben zat warna termasuk methylen blue telah dilaporkan oleh peneliti sebelumnya. Salah satunya yaitu Rastogi, dkk yang telah melaporkan penggunaan abu limbah air industri dalam hidroksi klor. Hasilnya menunjukkan maksimum penyerapan sebesar 58.42% pada adsorben dari 900 mg/l dan pH 6.75 dengan konsentrasi awal adsorben 65 mg/l. Penelitian lain telah dilakukan untuk memanfaatkan abu dasarna relatif (Dincer, dkk, 2007). Hasilnya menunjukkan bahwa abu dasar dapat mengadsorp zat warna Vertigo navy marine (VNM) dengan kapasitas adsorpsi 3.82% mg/g dengan konsentrasi UNM 300 mg/l. Meskipun kapasitas adsorpsi abu dasar ini relatif lebih kecil dibanding dengan granular karbon aktif, yaitu 6.35 mg/g (Dincer, dkk, 2007), abu dasar ini dapat digunakan sebagai alternatif adsorben untuk zat warna karena jauh lebih ekonomis.
Berdasarkan paparan diatas, pada penelitian ini abu dasar digunakan sebagai adsorben untuk menyerap methylen blue. Selain menggunakan abu dasar, pada penelitian ini juga menggunakan adsorben zeolit berkarbon. Bahan zeolit berkarbon ini telah disintesa oleh londar dan fahri, 2008 dengan metode hidrotermal langsung. Zeolit berkarbon ini dibuat dengan penambahan molar 3.165 Na2O: Al2O3: 1.926 SiO2 dengan penambahan karbon aktif sebesar 11.5%. Karbon aktif ini ditambahkan setelah dilakukan penghilangan karbon dalam abu dasar. Zeolit berkarbon ini diharapkan dapat digunakan sebagai adsorben multifungsi. Hal ini merupakan penelitian awal untuk menguji kapasitas adsorpsi zeolit berkarbon untuk mengadsorp methylen blue.
2. METODOLOGI 2.1 Alat dan Bahan 2.1.1 Alat
Peralatan yang digunakan pada penelitian ini meliputi peralatan yang digunakan untuk proses adsorpsi. Peralatan untuk pengujian kapasitas adsorpsi meliputi peralatan gelas, alat shaker, termometer, pH meter, stopwatch, kertas saring Whatman No. 40, spektrofotometer UV-VIS,dan SEM..
2.1.2 Bahan
Bahan-bahan yang digunakan dalam penelitian ini meliputi bahan yang digunakan untuk proses adsorspsi yaitu abu dasar dari PT. IPMOMI di Probolinggo Jawa Timur dan zeolit berkarbon yang telah dibuat oleh peneliti sebelumnya (Londar dan fasuri, 2008) dari abu dasar berfungsi sebagai adsorben , air demineralisasi, zat warna sintetik yaitu methylen blue sebagai adsorbat, HCl dan NaOH 1 M untuk proses adsorpsi pada variasi pH.
2.2 Prosedur Kerja
2.2.1 Karakterisasi Abu Dasar
Abu dasar PT.IPMOMI Probolinggo Jawa-Timur dilakukan proses pratreatment dengan dipanaskan menggunakan oven pada suhu 105oC untuk proses penghilangan kadar air dan diayak sampai ukuran 20 mesh. Analisa kadar karbon secara gravimetri dilakukan dilaboratorium teknik kimia ITS.
2.2.2 Persiapan pembuatan bahan
2.2.1 Pembuatan Larutan zat warna tekstil secara sintetis
Pembuatan larutan standar dilakukan dengan cara, pertama-tama disiapkan gelas kimia dan labu ukur.Methylen blue 1000 mg dimasukkan kedalam gelas kimia dan dilarutkan dengan aqua DM sebanyak 10 ml.Larutan tersebut dimasukkan kedalam labu ukur 1 liter, dan ditambahkan aqua DM sampai ambang batas.
2.2.3 Studi Adsorpsi
Studi adsorpsi yang dilakukan pada penelitian ini meliputi (i) penentuan waktu setimbang, (ii) mempelajari beberapa variabel yang mempengaruhi kinerja adsorpsi yaitu konsentrasi awal adsorbat dan pH adsorbat, (iii) penentuan kinetika adsorpsi dan (iv) penentuan isoterm adsorpsi. Adapun adsorben yang digunakan terdiri atas abu dasar dan zeolit berkarbon.
2.2.3.1 Penentuan waktu setimbang
Untuk menentukan waktu setimbang dilakukan prosedur percobaan sebagai berikut. Pertama gelas kimia disiapkan beberapa buah dan dimasukkan methylen blue 25 ppm sebanyak 50 mL.Kedalam masing-masing beaker gelas yang sudah berisi larutan methylen blue dimasukkan abu dasar sebanyak 0.5 gram kemudian larutan
tersebut diaduk dengan kecepatan 400 rpm selama 5 menit sampai terjadi waktu setimbang dan dilakukan pada suhu ruang.Setelah itu larutan yang tidak teradsorp diendapkan sampai semua adsorben mengendap kemudian dipisahkan dengan metoda dekantasi. Hasil filtrat kemudian di analisa dengan UV-VIS dengan panjang gelombang 665 nm.Percobaan ini juga dilakukan untuk adsorben zeolit berkarbon dengan hasil sintesis dari abu dasar, konsentrasi methylen blue 140 ppm.
2.2.3.2 Variasi Konsentrasi Awal methylen blue
Methylen blue dengan variasi konsentrasi 25 ppm, 30 ppm, 35 ppm, 40 ppm, 45 ppm, 50 ppm, 55 ppm, 60 ppm, 80 ppm, 100 ppm, 120 ppm, dan 140 ppm diambil sebanyak 50 mL dan dimasukkan kedalam gelas kimia 250 mL. Kemudian abu dasar 0.5 gram dimasukkan kedalam larutan tersebut dan diaduk dengan kecepatan 400 rpm selama 12 jam. Waktu kontak 12 jam didapatkan dari hasil waktu setimbang. Kemudian larutan yang tidak teradorps diendapkan dan filtratnya danalisa dengan UV-VIS menggunakan panjang gelombang 665 nm. Hasil analisa tersebut dicatat absorbansinya kemudian dibuat grafik antara kapasitas teradsorp dan variasi konsentrasi. Hasil perhitungan diatas digunakan untuk menentukan model adsorpsi yang terjadi. Setelah itu, adsorben dari proses adsorpsi methylen blue 50 ppm dianalisa menggunakan SEM JEOL JSM-6360LA di badan geologi Bandung. Percobaan ini juga dilakukan untuk adsorben zeolit berkarbon dengan lama pengadukkan selama 3 jam dengan hasil sintesis dari abu dasar, konsentrasi methylen blue 150 ppm, 160 ppm, 170 ppm, 180 ppm, 190 ppm, dan 200 ppm.
2.2.3.3 Penentuan pH optimum
Percobaan ini bertujuan untuk menentukan pH optimum larutan pada proses adsorpsi methylen blue. Pertama-tama adsorben sebanyak 0.5 gram ditambahkan kedalam larutan methylen blue dengan konsentrasi 50 ppm.pH awal larutan divariasikan dengan range pH 2-10 dan dilakukan pengadukan. Pengaturan pH ini dengan penambahan HCl 0,1 M dan NaOH
0,1 M. Larutan kemudian diaduk selama 12 jam dengan kecepatan 400 rpm. Setelah itu larutan yang telah di adsorpsi diendapkan sama dengan metoda yang digunakan pada 3.2.3.2 dan dilakukan analisa seperti pada sub bab 3.2.3.2. Percobaan ini juga dilakukan pada adsorben zeolit berkarbon dengan lama pengadukkan selama 3 jam dengan hasil sintesis dari abu dasar, konsentrasi methylen blue 140 ppm.
2.2.3.4 SEM
Sampel abu dasar dan zeolit berkarbon setelah adsorpsi methylen blue dianalisa dengan SEM. Sampel tersebut dilapisi dengan lapisan tipis emas paladium menggunakan mesin in spuffer.
2.2.4 Pengolahan data
2.2.4.1 Kapasitas dan efisiensi penghilangan
Banyaknya kontaminan yang diserap dari larutan dinyatakan sebagai kapasitas penghilangan methylen blue tiap unit berat dari zeolit berkarbon atau abu dasar yaitu
m V C C q ( o e) (3.1)
Dimana, Co adalah konsentrasi awal
methylen blue (mg/L), Ce konsentrasi
kesetimbangan methylen blue (mg/L), V adalah jumlah volume (L) dan m adalah massa zeolit berkarbon atau abu dasar (g). Efisiensi penghilangan methylen blue dari larutan secara berturut-turut kemudian dihitung dari: % 100 % x C C C n enghilanga EfisiensiP o e o (3.2)
2.2.4.2 Analisa data kinetik
Lima model kinetik digunakan dalam mengamati proses adsorpsi kontaminan kedalam adsorben yaitu orde 1 semu, orde dua semu, Bangham, model difusi intra-partikel dan Elovich. Data diproses dan dicocokkan dengan persamaan kinetik. Pertama, orde satu semu adalah persamaan yang biasa digunakan untuk menggambarkan adsorpsi dan ditentukan dengan persamaan berikut:
)
(
e t f tq
q
k
dt
dq
(3.3)qt (mg/g) adalah jumlah adsorbat yang
diserap pada waktu t (min), qe (mg/g) adalah
kapasitas adsorpsi kesetimbangan (mg/g), dan kf (min
-1
) adalah konstanta laju model orde satu semu(min-1). Persamaan dapat diintegrasi dengan memakai kondisi-kondisi batas qt = 0 pada t = 0 dan qt=qt pada t=t,
persamaan menjadi:
t
k
q
q
q
e t)
ln
e 1ln(
(3.4)Model orde dua semu dapat dinyatakan dalam bentuk 2 ) ( e t s t q q k dt dq (3.5)
dimana ks adalah konstanta laju model orde
dua semu (dalam g/(mg min)). Setelah integrasi dan penggunaan kondisi-kondisi batas qt=0 pada t =0 dan qt=qt pada t=t,
persamaan linier dapat diperoleh sebagai berikut t q q k q t e e s t 1 1 2 (3.6)
Laju penyerapan awal, h (mg/g min) sedangkan t t 0 dapat didefinisikan sebagai berikut 2 e s
q
k
h
(3.7)Laju adsorpsi awal (h), kapasitas adsorpsi kesetimbangan (qe) dan konstanta orde dua
semu ks dapat ditentukan secara eksperimen
dari slope dan intersep plot dari t/qt versus t.
Persamaan Bangham digunakan untuk mempelajari tahap waktu terjadinya sistem adsorpsi dan persamaannya digambarkan sebagai berikut t V m k m q C C o t o o log 303 . 2 log log log (3.8)
Co adalah konsentrasi awal adsorbat dalam
larutan (mg/L), V adalah volume larutan (mL), m adalah berat adsorben per liter larutan (g/L), qt (mg/g) adalah jumlah
adsorbat yang tertinggal pada waktu t, dan (<1) dan ko adalah tetap/konstan.
Studi difusi intra partikel juga digunakan dalam studi kinetik ini. Rumus model intra-partikel dinyatakan sebagai berikut
C
t
k
q
t id 1/2 (3.9)dimana kid adalah konstanta laju difusi
intra-partikel. Sebuah plot qt versus t 1/2
akan didapatkan garis lurus dengan slope kid dan
intersep C ketika mekanisme adsorpsi mengikuti proses difusi intra-partikel. Nilai intersep menandakan tentang ketebalan dari batas lapisan, yaitu luas intersep terbesar adalah efek batas lapisan. Persamaan Elovich berasumsi bahwa permukaan padat sesungguhnya adalah sepenuhnya heterogen. Persamaan Elovich dapat dinyatakan sebagai
t q t
e
dt
dq
(3.10)Integrasi persamaan diatas dan penggunaan kondisi awal qt = 0 pada t = 0 dan qt=qt, akan
kita peroleh model Elovich
t
q
t(
1
/
)
ln(
)
(
1
/
)
ln
(3.11)
adalah laju adsorpsi awal (mg/(g min)) dan parameter berhubungan dengan luas perrmukaan yang tertutup dan energi aktivasi(g/mg).
2.2.4.3 Analisa data isotherm
Isotherm adsorpsi terkarakterisasi oleh nilai konstanta tertentu yang menggambarkan karakteristik permukaan, afinitas dari adsorben dan kapasitas adsorpsi dari adsorben. Untuk menggambarkan kesetimbangan adsorpsi, persamaan isotherm yang bermacam-macam telah digunakan seperti Langmuir, Freundlich dan model Tempkin.
Model isotherm adsorpsi Langmuir mengasumsikan bahwa penyerapan mengambil pada tempat spesifik yang homogen dalam adsorben dan distribusi yang seragam dari tempat adsorpsi energetik. Akibatnya, sekali molekul adsorbat menempati tempat, tidak ada lagi penyerapan yang dapat terjadi pada tempat tersebut.
Oleh karena itu, model Langmuir valid untuk adsorpsi monolayer pada permukaan dengan jumlah terbatas pada tempat yang sama. Parameter Langmuir ditentukan dengan rumus berikut e e
KC
KC
q
q
1
max (3.12)qmax (mg/L) dan K (L/mg) adalah kapasitas
monolayer yang dicapai pada konsentrasi tinggi dan konstanta kesetimbangan, berturut-turut. Ce adalah konsentrasi
kesetimbangan dalam larutan (mg/L) dan q menunjukkan jumlah yang diserap pada kesetimbangan (mg/g). e e C q Kq q C max max 1 1 (3.13)
Selanjutnya model Freundlich menganggap permukaan heterogen dengan distribusi panas adsorpsi yang tidak seragam pada permukaan. Parameter Freundlich ditentukan dengan rumus n e F
C
K
q
1 (3.14)KF dan 1/n menunjukkan faktor kapasitas Freundlich dan parameter intensitas Freundlich, berturut-turut. Ce adalah
konsentrasi kesetimbangan dalam larutan (mg/L) dan q menunjukkan jumlah yang diserap pada kesetimbangan (mg/g).
e F
C
n
K
q
log
1
log
log
(3.15)Model isotherm Tempkin menjelaskan tentang interaksi antara adsorben dengan adsorbatnya. Model ini menganggap adsorpsi pada semua molekul pada permukaan akan menurun linier dengan jumlah interaksi antara adsorbat dan adsorben dan adsorpsinya dikarakterisasi dengan energi sampai energinya maksimun. Parameter Tempkin ditentukan dengan rumus
) ln( t e e K C b RT q (3.16) Model liniernya yaitu
e t e B K B C q 1ln 1ln (3.17) dimana b RT B1 (3.18)
A adalah plot dari qe versus ln Ce yang
digunakan untuk menentukan konstanta isotherm Kt dan B1. Ce adalah konsentrasi
kesetimbangan dalam larutan (mg/L) dan q mewakili jumlah kesetimbangan adsorpsi (mg/g). Kt adalah konstanta kesetimbangan
(L/mol) yang cocok digunakan untuk energi ikatan maksimum dan konstanta B1
berhubungan dengan bagian adsorpsi (Widiastuti,2009).
3. HASIL DAN PEMBAHASAN 3.1 Studi Adsorpsi
Salah satu faktor penting dalam proses adsorpsi adalah adsorben. Menurut Do (1998) adsorben yang baik harus memiliki sifat sebagai berikut:
1. Adsorben harus memiliki luas permukaan efektif yang besar
2. Adsorben harus memiliki sejumlah besar jaringan pori-pori sebagai jalan bagi molekul menuju kedalam adsorben.
Abu dasar dan zeolit berkarbon dapat digunakan sebagai adsorben karena memenuhi 2 kriteria tersebut. Abu dasar hasil pembakaran mempunyai surface area 3000 m2 g-1 (Franqoise, 1999). Proses adsorpsi terjadi pada rongga permukaan adsorben dan adsorbat menempel dalam permukaan tersebut sehingga terjadi proses difusi dari larutan ke dalam adsorben.
3.1.1 Penentuan waktu setimbang
Variasi waktu kontak antara adsorben dan adsorbat dilakukan untuk menentukan waktu setimbang dari adsorpsi. Hasil variasi waktu kontak antara methylen blue dan adsorben, yaitu abu dasar dan zeolit karbon ditunjukkan pada Gambar 4.5. dan gambar 4.6.
Gambar 3.1 Hubungan waktu kontak (menit) dengan kapasitas adsorpsi (qt) (mg/g) dengan ju mlah abu dasar 0,5 gra m, volu me 50 ml, konsentrasi awal 25 mg/ l
Gambar 3.2 Hubungan waktu kontak (men it) dengan kapasitas adsorpsi (qt) (mg/g) dengan ju mlah abu zeolit berkarbon 0,5 gra m, volu me 50 ml, konsentrasi awal 140 mg/l.
Gambar 3.1 dan 3.2 menunjukkan pada menit-menit awal dan sampai 60 menit pertama terjadi peningkatan tajam dan kesetimbangan terjadi pada 720 menit sampai 1440 menit dengan jumlah methylen blue yang terserap 0.9376 mg/gram. Hal ini dapat dikarenakan pada awalnya banyak sisi adsorben yang kosong, sehingga kecendrungan larutan untuk terserap ke adsorben semakin tinggi. Dengan bertambahnya waktu kontak, jumlah adsorbat yang terserap pada permukaan adsorben semakin meningkat hingga tercapai titik setimbang. Pada saat mencapai titik kesetimbangan, permukaan adsorben telah penuh tertutupi oleh methylen blue yang diserap dan adsorben mengalami titik jenuh sehingga adsorben tidak dapat menyerap zat warna lagi. Sedangkan untuk zeolit berkarbon, peningkatan penyerapan terjadi pada 160 menit pertama dan setelah itu penyerapan zat warna mengalami kesetimbangan setelah 180 menit hingga
mencapai konstan. Waktu kesetimbangan tercapai pada saat methylen blue yang teradsorp sebanyak 5,44 mg/gram.
Dari gambar 3.1 dan 3.2 hasil penyerapan methylen blue dengan adsorben abu dasar dan zeolit berkarbon sangat jauh berbeda. Hasil dari penyerapan oleh zeolit karbon lebih tinggi daripada abu dasar hal ini dikarenakan pada zeolit berkarbon memiliki jumlah karbon yang lebih banyak karena tejadi proses penambahan karbon aktif. Pada abu dasar memilki kadar karbon sebesar 67,62% sedangkan pada zeolit berkarbon terjadi penambahan karbon aktif sebanyak 79.22%. Kadar karbon sangat penting untuk proses adsorpsi, karena semakin banyak kadar karbon maka semakin cepat proses adsorpsi berlangsung.Adsorpsi yang terjadi pada penilitian ini merupakan adsorpsi fisik dimana tidak terjadi transfer elektron. Adsorpsi fisika terjadi bila gaya intermolekular lebih besar dari gaya tarik antar molekul atau gaya tarik menarik yang relatif lemah antara adsorbat dengan permukaan adsorben, gaya ini disebut gaya Van der Waals sehingga adsorbat dapat bergerak dari satu bagian permukaan ke bagian permukaan lain dari adsorben.
3.1.2 Penentuan Konsentrasi awal methylen blue
Penentuan konsentrasi ini dilakukan untuk mengetahui pola penyerapan methylen blue menggunakan abu dasar dan zeolit karbon. Hasil variasi konsentrasi awal ini dapat dilihat pada Gambar 4.7 dan 4.8.
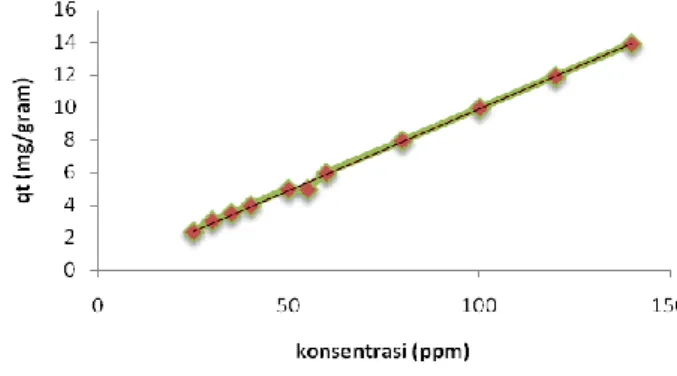
Gambar 3.3 Hubungan konsentrasi (ppm) dengan kapasitas adsorpsi (qt) (mg/g) dengan ju mlah abu dasar 0,5 g ra m, volu me 50 ml, wa ktu 720 menit.
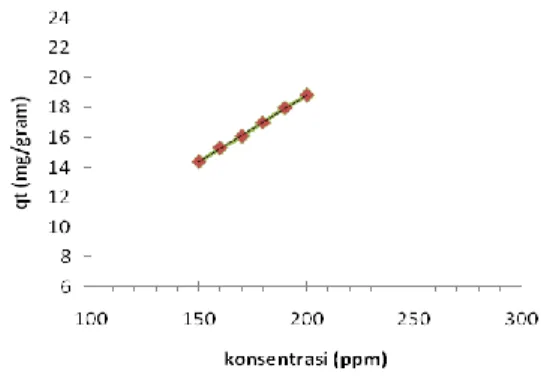
Gambar 3.4 Hubungan konsentrasi (ppm) dengan kapasitas adsorpsi (qt) (mg/g) dengan ju mlah zeo lit berkarbon 0,5 gra m, volu me 50 ml, waktu 180 menit.
Gambar 3.3 dan 3.4 menunjukkan kemampuan penyerapan methylen blue meningkat seiring dengan meningkatnya konsentrasi methylen blue. Kemampuan penyerapan methylen blue dapat dilihat dari nilai kapasitas adsorpsi (q). Peningkatan kapasitas adsorpsi terjadi karena adanya penyerapan methylen blue yang semakin banyak dari larutan menempel pada permukaan adsorben. Variabel yang mempengaruhi pada penelitian ini adalah faktor konsentrasi larutan bahwa semakin meningkatnya konsentrasi methylen blue maka akan memberikan daya dorong terhadap methylen blue untuk teradsorp.
Alok mittal,V.K Gupta, Arti malviya,dan Jyotimittal juga meneliti pengaruh konsentrasi awal terhadap penyerapan zat warna menggunakan abu dasar. Hasil yang diperoleh menunjukkan bahwa penyerapan zat warna meningkat dengan meningkatnya konsentrasi awal zat warna.
Hal yang menarik dalam penelitian ini yaitu dapat diketahui bahwa adsorben abu dasar dan zeolit berkarbon adalah adsorben yang baik untuk zat warna karena dapat menyerap zat warna dengan baik (dapat dilihat pada gambar 3.3 & 3.4).Pada kondisi konsentrasi 140 ppm methylen blue teradsorp sebanyak 13.8796 sedangkan pada zeolit berkarbon pada kondisi larutan 150 ppm methylen blue teradsorp sebanyak 14.3781 dan juga pernah di teliti sebelumnya bahwa pada methylen blue 25 ppm untuk zeolit berkarbon didapatkan hasil kapasitas adsorpsi 100%.
3.1.3 Penentuan pH optimum
Variasi pH ini dilakukan untuk mengetahui kondisi pH yang optimum untuk penyerapan methylen blue Hasil variasi pH ini dapat dilihat pada Gambar 4.10. dan 4.11
Gambar 3.5 Hubungan pH dengan kapasitas adsorpsi (qt) (mg/g) dengan ju mlah abu dasar 0,5 gram, volu me 50 ml, wa ktu 720 men it, konsntrasi 25 ppm.
Gambar 3.6 Hubungan pH dengan kapasitas adsorpsi (qt) (mg/g) dengan ju mlah zeo lit berkarbon 0,5 g ra m, vo lu me 50 ml, waktu 180 men it, konsentrasi 140 pp m.
Pada gambar tersebut diketahui bahwa kapasitas adsorpsi pada pH asam lebih besar dari pada pH basa hal ini juga diperkuat oleh jurnal sebelumnya dapat dilihat pada bab II, tingginya adsorpsi pada pH asam hal ini dikarenakan meningkatnya protonasi oleh penetralan muatan negatif dari permukaan adsorbent. Hal ini memudahkan proses difusi dan mengaktifkan didaerah adsorbent(alok dan gupta,dkk,2007).
Sistem reaksi-difusi
adalah
model
matematika
yang
mendiskripsikan bagaimana konsentrasi
dari satu atau lebih substansi terdistribusi
dalam ruang berubah karena pengaruh
dua proses: reaksi kimia lokal dimana
substansi diubah menjadi yang lain, dan
difusi
yang
menyebabkan
substansi
menyebar dalam
ruang (pergerakan
partikel dapat dilihat pada gambar 4.11).
Adsorpsi maksimum methylen blue terjadi pada pH 2,sama dengan halnya jurnal sebelumnya pH maksimum pada RB(reactiv blue) terjadi pada pH 1.5.3.2 Kinetika Adsorpsi
Hasil penentuan waktu setimbang digunakan untuk mengetahui model kinetika adsorpsi. Model kinetika adsorpsi yang digunakan dalam penelitian ini ada 5 model, yaitu: orde satu semu, orde dua semu, bangham, elovich, dan difusi intra partikel. Penentuan model adsorpsi ini didasarkan pada koefisien regresi dan kapasitas adsorpsi qe. Beberapa model kinetika adsorpsi digunakan pada penelitian ini dan hasilnya dapat dilihat pada Gambar 3.7 dan 3.8 dan Tabel 3.1.
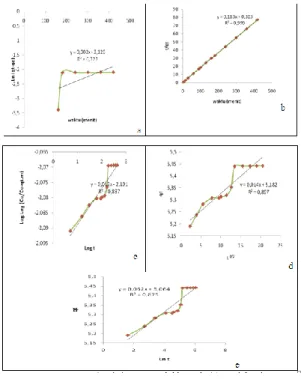
Gambar 3.7. Analisa beberapa model
kinetik, (a) Model orde satu semu, (b) Model orde dua semu, (c) Model Bangham, (d) difusi intra partikel dan (e) Model Elovich.
Gambar 3.8. Analisa beberapa model
kinetik, (a) Model orde satu semu, (b) Model orde dua semu, (c) Model Bangham, (d) difusi intra partikel dan (e) Model Elovich.Kondisi : jumlah adsorben zeolit berkarbon 0,5 gram, konsentrasi awal 140mg/L, volume 50 ml, suhu 25°C , waktu 3 jam dan pH 2
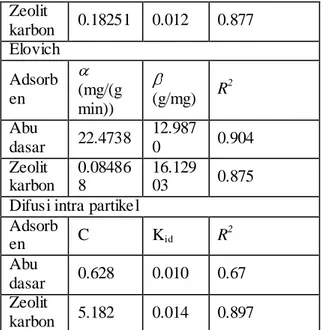
Tabel 4.2 Ringkasan dari perhitungan
kinetika adsorpsi Orde satu semu Adsorb en kf (min -1 ) qe (mg/g) R 2 Abu dasar 0.034 0,4086 0,971 Zeolit karbon 0.002 0,0439 0,323 Orde dua semu
Adsorb en h (mg/g min) qe (mg/g) R 2 Ks(g/( mg min) Abu dasar 0.1136 0,944 0.99 9 0.1275 Zeolit karbon 0.303 5.464 0.99 9 0.1105 Bangham Adsorb en ko (mL/(g/ L)) R2 Abu dasar 0.00954 9 0.106 0.871
Zeolit karbon 0.18251 0.012 0.877 Elovich Adsorb en (mg/(g min)) (g/mg) R2 Abu dasar 22.4738 12.987 0 0.904 Zeolit karbon 0.08486 8 16.129 03 0.875 Difusi intra partikel
Adsorb en C Kid R 2 Abu dasar 0.628 0.010 0.67 Zeolit karbon 5.182 0.014 0.897
Dari Gambar3.7 & 3.8 dan Tabel 3.1 dapat diketahui bahwa adsorpsi methylen blue menggunakan abu dasar dan zeolit berkarbon mengikuti model orde dua semu. Hal ini dapat disimpulkan jenis modelnya sesuai dengan nilai R2 yang mendekati satu, dimana nilai R ini merupakan nilai koefisien korelasi dari grafik. Nilai R semakin mendekati satu memiliki data yang linier.
Adsorpsi methylen blue menggunakan abu dasar dan zeolit berkarbon mengikuti model kinetik orde dua semu. Hal ini sesuai dengan hasil penelitian adnan (2006) dan lara (2000) yaitu meneliti adsorpsi reactiv blue dan azo dye orange menggunakantitania aerogel dan bentonit. Adnan dan lara menyimpulkan bahwa zat warna mengikuti model orde dua semu karena data nilai R2 orde dua semu lebih baik dari nilai R2 pada orde satu semu.
3.3 Adsorpsi Isoterm
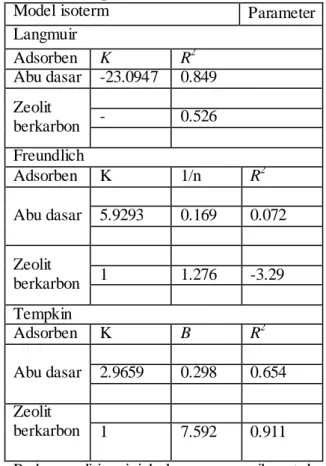
Dari data hasil variasi konsentrasi maka dapat ditentukan data model isoterm adsorpsinya. Hal ini untuk mengetahui jenis adsorpsi yang terjadi. Setelah mengetahui jenis adsorpsi yang terjadi maka dapat diketahui ikatan yang terjadi. Data ini sangat bermanfaat untuk mengetahui apakah adsorben yang digunakan dapat diregenerasi ulang atau tidak. Data isoterm dalam penelitian ini dianalisa dengan beberapa model. Hasil dapat dilihat di Gambar 3.9, dan 3.10. Nilai parameter adsorpsi isoterm dari tiga model dirangkum dalam Tabel 3.2.
Gambar3.9 adalah kurva isotherm model Langmuir. Jika dilihat dari data koefisien korelasi maka dari grafik tersebut nilai R2 jauh dari angka satu sehingga dapat disimpulkan bahwa adsorpsi methylen blue menggunakan abu dasar mengikuti model langmuir dan zeolit berkarbon mengikuti mode l tempkin.
Gambar 3.9 adalah kurva isoterm model langmuir, Freundlich,dan tempkin dari abu dasar .
Jika dilihat dari data koefisien korelasi maka dari semua grafik tersebut nilai R2 mendekati angka satu sehingga dapat disimpulkan bahwa adsorpsi methylen blue menggunakan abu dasar mengikuti model langmuir. Adsorpsi langmuir merupakan adsorpsi yang terjadi karena adanya ikatan fisika yang terjadi antara adsorbat ( zat yang diserap ) dengan permukaan adsorben (zat yang menyerap ). Model adsorpsi langmuir di dasarkan hipotesis fisika ,disana tidak terjadi interaksi disamping itu molekul adsorben dan energi adsorpsi terdistribusi secara homogen dengan membentuk lapisan monolayer diatas permukaan adsorben dengan diperkuat data SEM.dan disini tidak terjadi perpindahan zat dari adsorbat ke adsorben(Adnan ,2006). Hal ini menunjukkan bahwa adsorpsi methylen blue menggunakan abu dasar termasuk jenis adsorpsi fisika. Adsorpsi fisika terjadi bila gaya intermolekular lebih besar dari gaya tarik antar molekul atau gaya tarik menarik yang relatif lemah antara adsorbat dengan permukaan adsorben, gaya ini disebut gaya Van der Waals sehingga adsorbat dapat bergerak dari satu bagian permukaan ke bagian permukaan lain dari adsorben (Khartikeyan, 2004). . Gaya antar molekul adalah gaya tarik antara
molekul-molekul fluida (cairan maupun gas) dengan permukaan padat, sedangkan gaya intermolekular adalah gaya tarik antar molekul-molekul fluida itu sendiri. Adsorpsi ini berlangsung cepat, dapat membentuk lapisan jamak (multilayer), dan dapat bereaksi balik (reversible), karena energi yang dibutuhkan relatif rendah. Energi aktivasi untuk terjadinya adsorpsi fisika biasanya adalah tidak lebih dari 1 kkal/gr-mol, sehingga gaya yang terjadi pada adsorpsi fisika termasuk lemah. Adsorpsi fisika dapat berlangsung di bawah temperatur kritis adsorbat yang relatif rendah sehingga panas adsorpsi yang dilepaskan juga rendah yaitu sekitar 5 – 10 kkal/gr-mol gas, lebih rendah dari panas adsorpsi kimia. Sedangkan adsorpsi kimia terjadi karena adanya reaksi antara molekul-molekul adsorbat dengan adsorben dimana terbentuk ikatan kovalen dengan ion. Gaya ikat adsorpsi ini bervariasi tergantung pada zat yang bereaksi. Adsorpsi jenis ini bersifat tidak reversible dan hanya dapat membentuk lapisan tunggal (monolayer). Umumnya terjadi pada temperatur tinggi di atas temperatur kritis adsorbat, sehingga panas adsorpsi yang dilepaskan juga tinggi, yaitu sekitar 10-100 kkal/gr-mol. Untuk dapat terjadinya peristiwa desorpsi dibutuhkan energi lebih tinggi untuk memutuskan ikatan yang terjadi antara adsorbat dengan adsorben. Energi aktivasi pada adsorpsi kimia berkisar antara 10 – 60 kkal/gr-mol.
Gambar 3.10 adalah kurva isoterm model langmuir, Freundlich,dan tempkin dari zeolit berkarbon .
Jika dilihat dari data koefisien korelasi maka dari semua grafik tersebut nilai R2 mendekati angka satu sehingga dapat disimpulkan
bahwa adsorpsi methylen blue menggunakanzeolit karbon mengikuti model tempkin. Model adsorpsi tempkin menjelaskan tentang interaksi antara adsorben dengan adsorbatnya. Model ini menganggap adsorpsi pada semua molekul pada permukaan akan menurun linier dengan jumlah interaksi antara adsorbat dan adsorbennya.Pada abu dasar dan zeolit berkarbon memiliki model adsorpsi yang berbeda hal ini dikarenakan pada abu dasar hanya terjadi adsorpsi secara fisik yang mana hanya melapisi satu lapis pada adsorbennya sedangkan pada zeolit berkarbon karena memilki kadar karbon yang tinggi dan luas permukaan yang lebih besar maka adsorbat lebih teradorps secara menyeluruh sehingga mengikuti model adsorpsi tempkin.
Tabel 323. Ringkasan dari perhitungan
isoterm adsorpsi
Model isoterm Parameter
Langmuir Adsorben K R2 Abu dasar -23.0947 0.849 Zeolit berkarbon - 0.526 Freundlich Adsorben K 1/n R2 Abu dasar 5.9293 0.169 0.072 Zeolit berkarbon 1 1.276 -3.29 Tempkin Adsorben K B R2 Abu dasar 2.9659 0.298 0.654 Zeolit berkarbon 1 7.592 0.911 Pada penelitian ini hal yang menarik untuk dibahas zeolit berkarbon adalah adsorben yang paling bagus untuk zat warna karena memilki kapasitas adsoprsi lebih besar dari abu dasar, akan tetapi dilihat dari segi ekonomi pembuatan sintesis zeolit berkarbon membutuhkan harga yang lebih besar daripada penggunaan abu dasar. Beberapa metode yang telah dilakukan sebelumnya untuk mernghilangkan zat warna tersebut
dengan menggunakan pengaktifan sludge, koagulasi kimia, elektrokimia, osmosis, katalis hidrogen peroksida, pengaktifan karbon. Pada metode pengaktifan sludge memiliki banyak kekurangan terutama pada faktor biaya karena memerlukan biaya yang sangat besar untuk pemanfaatan dalam skala industri. Pengaktifan sludge memerlukan alat yang khusus dan alat yang digunakan juga sangat mahal karena sludge adalah limbah yang tergolong sukar untuk dimanfaatkan kembali.Sedangkan pada teknik koagulasi menggunakan bantuan koagulan kimia seperti Polyelektrolit (misalnya : PAC,PAS, dll.), garam Aluminat (misalnya : Alum, Tawas, dll.), garam Fe, khitin, dsb (Rastogi dan Sahu,dkk,2008). Untuk Flokulasi dapat digunakan polimer kationik, anionik, atau nonionik (misalnya : poliakrilik, poliakrilamide, dll). Untuk pengendapan dapat digunakan teknologi baffle, settler, lumpur aktif, aerasi, dll. Untuk menghasilkan hasil yang optimal teknik tersebut dapat digabung. Kerugian dari teknik ini yaitu menggunakan banyak bahan sehingga tidak efisien dan lebih mahal. Pada metode osmosis larutan akan diserap dengan cara osmosis. Teknik ini memilki keuntungan dalam hal kesederhanaan akan tetapi dalam proses osmosis bahan yang akan digunakan hanya bisa dalam skala kecil. Metoda laju yaitu menggunakan hidrogen peroksida digunakan sebagai katalis untuk penghilangan zat warna. Metode ini tidak efisien karena harga katalis hidrogen peroksida sangat mahal dan hidrogen peroksida juga bersifat karsinogenik. Maka dari itu apabila dilihat dari segi ekonomi dan faktor lingkungan lebih baik menggunakan adsorben abu dasar karena lebih praktis dan ekonomis.
3.4 SEM
SEM adalah alat yang digunakan untuk mendiagnosa permukaan. Photo SEM ditunjukkan pada gambar 3.11.
Gambar 3.11 SEM (a) abu dasar (b) zeolit berkarbon (c) abu dasar setelah proses adsorpsi (d) zeolit berkarbon setelah proses adsorpsi.
Pada Gambar 3.11 (a) terlihat bahan awal (abu dasar) memiliki morfologi struktur mikro berbentuk bola (spherical) dengan tekstur permukaan yang relatif lembut dan butiran berbentuk tak beraturan. Ukuran dan bentuk partikel abu dasar mempengaruhi keaktifan abu dasar. Semakin kecil dan tidak beraturan bentuk partikel abu dasar, semakin reaktif karena luas permukaan bidang sentuh semakin luas. Setelah methylen blue teradsorps permukaan dan pori adsorben terlapisi sehingga permukaan dan pori semakin mengecil. Lapisan yang terlihat pada gambar tersebut adalah satu lapis dengan tidak menyeluruh pada semua permukaan. Sedangkan pada zeolit berkarbon membentuk empat persegi, bentuk sel ini disebut orthorombik. Pada gambar 3.11 ditunjukkan adanya bulatan kecil yang menyelimuti orthorombik, bulatan-bulatan tersebut adalah karbon. Sehingga dapat diketahui bahwa karbon sudah menutupi struktur dari zeolit. Ketika proses adsorpsi terjadi semua bentuk orthorombik tertutupi sehingga membentuk bulatan-bulatan kecil yang memiliki pori halus dan merata. Hal ini dapat diketahui bahwa methylen blue terserap secara merata pada semua bagian zeolit berkarbon sehingga membentuk permukan yang halus.
4. KESIMP ULAN
Berdasarkan hasil penelitian, diperoleh kesimpulan bahwa kapasitas adosrpsi oleh zeolit berkarbon lebih besar daripada abu dasar. Hal ini ditunjukkan oleh data waktu setimbang, penentuan konsentrasi awal, penentuan optimum pH. Pada waktu setimbang oleh abu dasar didapatkan hasil selama 720 menit sedangkan zeolit berkarbon 180 menit. Hasil penentuan konsentrasi awal didapatkan trend grafik semakin meningkat konsentrasi maka semakin meningkat pula
kapasitas adsorpsinya. pH optimum pada zeolit berkarbon dan abu dasar terjadipada pH 2. Uji kinetik dan isoterm didapatkan hasil model adsorpsi langmuir dan mengikuti model orde dua semu untuk abu dasar sedangkan pada zeolit berkarbon mengikuti model tempkin dan orde dua semu.
UCAPAN TERIMA KASIH
Penulis mengucapkan terima kasih kepada
1. Nurul widiastuti, Ph.D, selaku dosen pembimbing atas segala bimbingan yang telah diberikan.
2. Kelurga tercinta atas duk ungannya. 3. Dra. Y ulfi Zetra, MS, selaku koordinator
tugas akhir.
4. Mahasiswa Jurusan Kimia FMIPA -ITS angkatan 2005 dan semua pihak yang telah membantu dalam penyelesain tugas akhir ini.
DAFT AR PUSTAKA